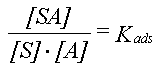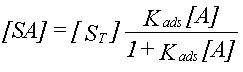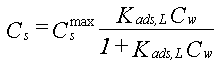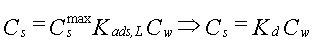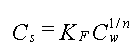Udvikling af metode til testning af udvaskning af organiske stoffer fra jord og restprodukter
Bilag A Sorptionsligevægte
Sorptionsligevægte
Isotermer
Sorption beskrives ofte ved en isoterm, som viser sammenhængen mellem koncentrationen af stoffet (sorbatet) i vandet og mængden af stof sorberet til partiklerne (sorbenten) ved ligevægt, dvs efter at sorptionsprocessen er løbet til ende. Betragtes i første omgang det simple tilfælde, hvor sorptionen alene er en adsorptionsproces, og hvor sorptionspladserne på overfladen, S, adsorberer sorbatet, A, fra opløsningen:
| 1. |
| hvor | S er adsorptionspladser |
| A er stof i opløsning | |
| SA er sorberet stof |
Koncentrationen af S og SA regnes i mol/l (kunne også regnes i mol/m2 eller mol/g). Ved brug af massevirkningsloven på ligning 1 fås:
| 2. |
Den maksimale koncentration af sorptionspladser, ST, er:
| 3. |
Fra ligning 2 og 3 fås:
| 4. |
Hvis den sorberede koncentration i stedet opgives i mg/g sorbent og den opløste koncentration i mg/l fås følgende ligning, som kaldes Langmuir adsorptionsisotermen:
| 5. |
| hvor | Cs er stofkoncentrationen i den faste fase (mg/g) |
| Csmax er den maksimale stofkoncentration i den faste fase (mg/g) | |
| Cw er koncentrationen i vandet (mg/l) | |
| Kads,L er Langmuir adsorptionskonstanten (l/mg) |
I figur 2 er Langmuir isotermen vist. Det ses at den sorberede koncentration stiger asymptotisk til den maksimale værdi med stigende koncentrationer i vandet. Hvis Cw er tilstrækkelig lille er nævneren i ligning 5 approksimativt lig 1, hvilket giver følgende sammenhæng:
| 6. |
hvor Kd er fordelingskoefficienten (l/kg)

Figur 1
Langmuir adsorptions isotermen. For lave ligevægtskoncentrationer i vandet er Langmuir
adsorptionsisotermen sammenfaldende med den lineære sorptionsisoterm, hvis hældning er
konstant og lig med fordelingskoefficienten, Kd.
Ved lave koncentrationer fås altså en simpel lineær isoterm, hvis hældning er lig fordelingskoefficienten, Kd (se figur 1).
Langmuir adsorptionsisotermen er udviklet under den forudsætning at alle sorptionspladser har den samme aktivitet. (har samme adsorptionskonstant). For bl.a. jorde vil dette sjældent være tilfældet, idet naturlige jorde er sammensat af lermineraler, hydroxider og organiske overflader som vil reagere forskelligt overfor et givent stof. På grund af denne sammensathed benyttes en mere empirisk isoterm, Freundlich isotermen, til beskrivelse af egentlige forsøgsresultater:
| 7. |
| hvor | KF er Freundlich konstanten |
| 1/n er potensen som Cw opløftes til. |
I figur 2 er vist tre eksempler på Freundlich isotermer. Tilfælde I hvor 1/n<1 opnås en mindre fordelingskoefficient (=hældning på kurven) med stigende koncentration, et forhold tilsvarende til det af Langmuir isotermen beskrevne, hvor de tilrådighed værende sorptionspladser fyldes op. Tilfælde III hvor 1/n>1 beskriver den modsatte situation, hvor der via de allerede sorberede molekyler sker en modifikation af partiklerne, som favoriserer yderligere sorption. I tilfælde II er 1/n=1, hvorved man opnår den lineære isoterm som allerede beskrevet. Som det ses på figur 2 er de tre isotermer tilnærmelsesvis sammenfaldende ved lave værdier af Cw, hvilket indikere at for tilfælde, hvor man kun interesserer sig i lave koncentrationer kan sorptionen beskrives tilstrækkeligt nøjagtigt med den lineære isoterm.

Figur 2
Tre eksempler på Freundlich isotermer, nemlig hvor 1/n<1, 1/n=1 og 1/n>1 i
Freundlich isotermudtrykket (formel 7) (efter Schwarzenbach et al. 1993).
Referencer
Schwarzenbach, R.P., Gschwend, P.M., Imboden, D.M. (1993). Environmental organic chemistry. John Wiley & Sons, New York.