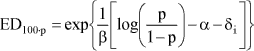|
Miljøprojekt nr. 1011, 2005 Systemisk kontakteksem over for nikkel ved oral eksponeringIndhold
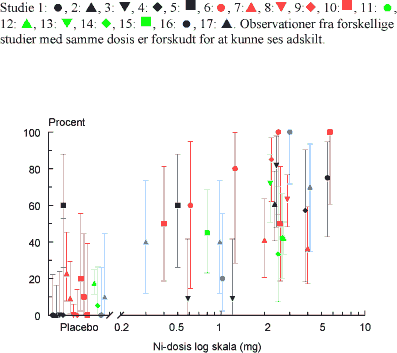
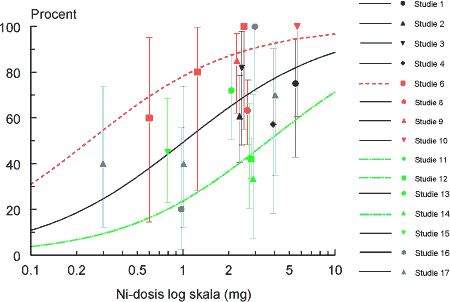
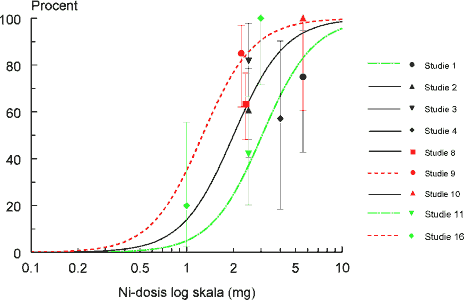
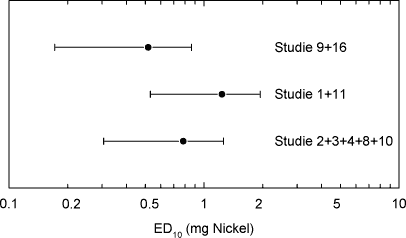
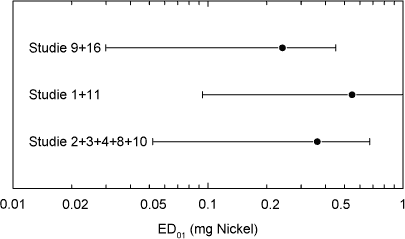
ForordNikkel er den hyppigste årsag til kontaktallergi i befolkningen, hvor cirka hver 5. kvinde er afficeret. Nikkelallergi viser sig ved eksem på huden og opstår ved tæt hudkontakt med blankt metal, der frigiver nikkel. En række eksperimenter har vist, at personer, som har fået nikkelallergi, efterfølgende kan reagere med eksem ved indtagelse af nikkel, såkaldt systemisk kontakteksem. Nikkel findes naturligt i føden og i drikkevand. Der er derfor stor interesse for at belyse, hvilke mængder af nikkel f.eks. i drikkevand, som kan fremkalde systemisk kontakteksem. Imidlertid er der ingen af de publicerede studier, som i sig selv er konklusive på dette punkt. Rapporten er udarbejdet på Miljøstyrelsens foranledning af en projektgruppe med mangeårig erfaring i forskning i nikkelallergi på internationalt niveau. Projektgruppen har relation til Videncenter for Allergi, der er en uafhængig institution finansieret af offentlige midler, og med den opgave at forebygge allergi gennem blandt andet forskning. Formålet med rapporten har været at foretage en samlet fremstilling og analyse af alle de publicerede studier vedrørende systemisk kontakteksem og nikkel med henblik på at tilvejebringe det bedst mulige grundlag for vurdering af f.eks. grænseværdier for nikkelindtagelse. Videncenter for Allergi, marts 2005 Sammenfatning og konklusioner1.1 Baggrund og formål 1.1 Baggrund og formålEn systemisk påvirkning som følge af oral indtagelse af nikkel kan hos nogle nikkelsensibiliserede føre til et nikkelspecifikt systemisk kontakteksem. Det viser sig oftest som en eksematøs ”flare-up” reaktion på hudområder, hvor der tidligere har været eksemudbrud forårsaget af nikkel. Endvidere er der indicier for, at oral nikkelindtagelse kan inducere kroniske håndeksem hos nikkelsensibiliserede individer. Resultater fra tidligere studier af forekomsten af nikkelforårsaget systemisk kontakteksem tyder på, at reaktionsgraden er dosisafhængig. En sammenfatning af disse resultater foreligger dog ikke. Hvorvidt nikkel indtaget gennem drikkevandet og den daglige kost kan inducere systemiske reaktioner er stadig kontroversielt, da de eksponeringsdoser, som har været brugt i de tidligere studier er højere, end hvad man normalt vil indtage gennem føden. Enkelte studier har dog vist, at nikkeldoser, som svarer til nikkelmængden, man får gennem kosten (0,3 mg nikkel pr. dag), og den maksimale nikkelmængde man kan opnå (0,9 mg nikkel pr. dag), kan inducere systemiske reaktioner hos nikkel-sensibiliserede individer. Formålet med denne undersøgelse var at bestemme teoretiske grænseværdier for nikkelindtagelse, som medfører udvikling af kontakteksem hos nikkelsensibiliserede individer, ved at sammenfatte resultater fra tidligere nikkeleksponeringsstudier i tillempede statistiske meta-analyser. Herved fås mere operationelle talværdier, som vil kunne få betydning for vurderingen og fastlæggelsen af grænseværdier for nikkel i f.eks. drikkevand. 1.2 UndersøgelsenUndersøgelsen er et tillempet statistisk meta-analysestudie på perorale nikkeleksponeringsforsøg udført på nikkelsensibiliserede individer. Nikkeleksponeringsundersøgelserne blev identificeret ved litteratursøgning på MEDLINE, EMBASE og BIOSIS med søgeordene: ”nickel”, ”oral”, ”challenge”, ”exposure”, ”hypersensitivity”, ”sensitivity”, ”allergy”, ”systemic”, ”provocation” og ”contact dermatitis” i forskellige kombinationer. Da de fundne studier ikke er umiddelbart sammenlignelige ud fra strikte meta-analytiske kriterier, blev der foretaget fire tillempede statistiske meta-analyser med forskellige inklusionskriterier: 1) Samtlige fundne studier, 2) studier med én enkelt oral nikkeleksponering, 3) studier med én enkelt oral nikkeleksponering, som inkluderede placebokontrol-eksponering og 4) en tillempet analyse hvor data fra studier med én enkelt oral nikkel- og placeboeksponering blev sammenfattet i kategorier efter eksponeringsdosis. 1.3 HovedkonklusionerStatistiske analyser udført på 9 nikkeleksponeringsstudier identificerede tre grupper af studier som kunne beskrives ved hjælp af parallelforskudte dosis-responskurver. På basis af disse kurver blev der beregnet eksponeringsdoser, som svarede til forskellige responsfrekvenser. Samtlige studier er udført ved at tilføre en ekstra mængde vandopløselig nikkel udover den normale kost. Det vil sige studierne i særlig grad er egnede til at vurdere effekten af en ekstra tilført mængde nikkel f.eks. via drikkevand. De udførte beregninger indikerede at peroral nikkeleksponering med hhv. 0,22, 0,35 eller 0,53 mg kan give positive respons hos ca. 1 % af nikkelsensibiliserede eksempatienter set af hudlæger. Tilsvarende vil en eksponering for hhv. 0,55, 0,87 eller 1,33 mg nikkel få 10 % i den ovennævnte gruppe til at reagere med symptomer på et systemisk kontakteksem. Beregningerne fra to statistiske modeller viste, at 1 % af de mest følsomme nikkelsensibiliserede individer vil kunne reagere systemisk ved indtagelse af mellem 0,22 og 0,35 mg nikkel. Såfremt grænseværdien for vand på 20 g nikkel per liter overholdes, vil en persons gennemsnitlige indtagelse af 40-60 g per dag via vand udgøre op mod ¼ af den dosis, som medfører risiko for systemiske reaktioner hos 1 % af de mest følsomme nikkelallergikere. Ud fra en grov beregning vil disse 1 % kunne estimeres at svare til ca. 20 nye tilfælde af eksem-patienter med nikkelallergi i Danmark årligt. Det reelle tal kan være større, da ikke alle med et problem forventes at opsøge læge og de generelle usikkerheder, som i øvrigt ligger bag tallene. På den anden side må estimatet forventes at omfatte hovedparten af de personer, som vil have betydelige gener. Såfremt en relativ stor del af det daglige vandindtag sker fastende, vil bidraget af nikkel fra drikkevandet til den daglige nikkeloptagelse være af større betydning og kunne udgøre mere end ¼ af den dosis, som kan udløse systemiske reaktioner. Beregningerne indikerer, at et nikkelindtag svarende til 0,5-0,9 mg per dag, hvilket kan forekomme ved indtagelse af udvalgte høj-nikkelholdige fødemidler eller hvis man drikker vand fra armaturer, der frigiver meget nikkel, kan medfører udvikling af systemiske reaktioner hos op mod 10 % af nikkelallergiske patienter. Det skal fremhæves, at de udførte statistiske analyser var af eksplorativ art, primært fordi de forskellige studier er udført under varierende betingelser på patientgrupper, som næppe kan antages at repræsentere en fælles population. Der er derfor en naturlig usikkerhed forbundet med resultaterne af de udførte analyser, men disse er imidlertid den bedst mulige evidens på nuværende tidspunkt. Det vil ikke være meningsfyldt ud fra de foreliggende data at fastlægge et absolut ingen-effekt niveau, i det der forekommer placebo-effekter og sygdomsaktivitet af andre årsager end nikkelindtagelse, som det ikke er muligt at kontrollere for. 1.4 ProjektresultaterStatistiske analyser udført på data fra de 17 publicerede nikkeleksponerings- studier, der indgik i undersøgelsen, viste, at det ikke var muligt at udføre en klassisk meta-analyse af data. Man så dog en tydelig tendens til en voksende frekvens af systemiske reaktioner med voksende nikkeldosis ved en samlet vurdering. Der er dog stor variation, og en del studier udviste også positiv respons på placebo. I 9 studier var det muligt at sammenligne responsfrekvenser ved forskellige doser, og iblandt disse kunne der i 7 studier påvises statistisk signifikant dosis-responseffekt. For de øvrige studiers vedkommende var datas beskaffenhed således, at det (i visse tilfælde) ikke var muligt at teste for forskelle mellem de anvendte doser, inkl. placebo. Analyser viste også, at placeboeffekten i de enkelte studier var signifikant forskellige. Udfra et statistisk synspunkt var det således ikke muligt, at inddrage denne gruppe studier samlet i en analyse eller uddrage en entydig lære om et placebo-niveau, der ville kunne korrigeres for i de øvrige analyser. Det blev fundet nødvendigt at tillempe analyserne og fokusere på data fra studier som gav statistik identiske resultater. 1.5 Endelige estimater af dosis-responseffekt.Efter udeladelse af dobbelteksponerings studier og studier med positiv respons på placebo identificeredes tre grupper af studier, en homogen midtergruppe omfattende 5 studier, samt to grupper á to studier med hhv. højere og lavere responshyppighed, som kunne beskrives ved hjælp af parallelforskudte dosis-responskurver. Bestemmelse af eksponeringsdoser som medførte respons. På basis af disse kurver blev der beregnet eksponeringsdoser, som ville svare til teoretiske responsfrekvenser på hhv. 50 % (ED50), 25 % (ED25), 10 % (ED10), 5 % (ED5), 2 % (ED2) og 1 % (ED1) hos eksponerede nikkelsensibiliserede eksempatienter. Oversigt over estimerede værdier for ED50 og lavere responser:
Summary and conclusionsSystemic contact dermatitis can be elicited in nickel-sensitized individuals by oral intake of nickel under experimental conditions. The crucial point in the interpretation of such experiments has been the relevance of the experimental results to normal oral intake of nickel from drinking water and diet. In the current investigation an adjusted dose-response meta-analysis of the experimental results in the available published literature was performed. The aim was to provide the best possible estimation of doses of nickel that may cause systemic reactions, as a basis for decision making e.g. in relation to the establishment of limit values for drinking water. An extensive literature search was made in MEDLINE, EMBASE and BIOSIS, and 17 scientific papers concerning experimental oral nickel exposure and systemic contact dermatitis were identified. The studies were not directly comparable, and for this reason the statistical analysis was performed in a step-wise procedure. In the resulting analysis nine studies were included, which from a statistical point of view were comparable, concerned a single oral exposure dose and included a negative placebo control. These nine studies included 171 patients and could be divided into further three groups: A homogenous middle group of five studies, and two groups of two studies each with a higher and lower response frequency, which could be described by dose-response curves shifted in parallel. Based on these dose-response curves, an estimation was made concerning the doses, which theoretically would give response in 50% of the exposed (ED50), 25% (ED25), 10% (ED10), 5% (ED5) and 1% (ED1) of the exposed nickel sensitized eczema patients. Overview of estimated doses for (ED50) and lower responses
The results from the two most sensitive groups of nickel-allergic eczema patients show that 1% of these sensitive individuals may react with a systemic contact eczema at exposures to 0.22 to 0.35 mg nickel in addition to their normal diet. It is roughly estimated that this will concern about 20 new cases of nickel-sensitive eczema patients per year seen by dermatologists in Denmark. The real frequency may be higher, as not everybody with a problem will see a dermatologist. On the other hand, it is expected that this estimate will cover most of the severe cases. 2 Baggrund2.1 Introduktion 2.1 IntroduktionAllergisk kontakteksem over for nikkel ses oftest som en eksemreaktion efter en direkte, længerevarende hudkontakt med nikkel hos en tidligere nikkelsensibiliseret person. Når nikkelholdige metallegeringer kommer i direkte kontakt med huden i længere tid, vil svedafsondring medføre korrodering og frigivelse af nikkel. De frie nikkelioner medfører en risiko for, at personen bliver sensibiliseret og ved en senere re-eksponering udvikler allergisk kontakteksem over for nikkel. Denne risiko for sensibilisering og udvikling af allergisk kontakteksem har vist sig at afhænge af den mængde nikkel, som frigives. Flere undersøgelser har vist, at nikkelsensibilisering er stærkt korreleret til det at blive øre-piercet (1-7), idet frigivelse af nikkel fra øre-piercings-remedier og smykker kan forårsage nikkelsensibilisering (8-9). Flere studier har vist, at udsættes nikkelsensibiliserede individer for en systemisk nikkeleksponering ved peroral indtagelse, vil en del individer udvikle kontaktallergiske hudreaktioner (oversigt i 10,11). Det systemiske kontakteksem ses oftest som flare-up af tidligere eksem eller som de novo kontakteksem, der ligner almindeligt allergisk kontakteksem. Mens systemisk kontakteksem forårsaget af medikamenter er alment accepteret, har systemiske hudreaktioner over for metaller indtaget gennem føden været mere kontroversielle (12,13). Baggrunden for nikkels vedkommende har været, at det er meget svært at beregne et individs daglige nikkeleksponering, fordi nikkel findes udbredt i de fleste metallegeringer, som vi omgås, og i vores mad og drikkevand. Der er dog i tiltagende grad evidens for, at oral nikkelindtagelse kan inducere systemisk kontakteksem hos nikkelsensibiliserede individer. Det er vist, at peroral eksponering giver flare-up reaktioner, som er allergenspecifikke i hudområder, hvor der tidligere har været en positiv lappetest for det pågældende allergen. (14). Sammenholdes resultater fra flere perorale eksponeringsundersøgelser, ses en tendens til, at de enkelte eksponerede personers reaktionsgrad og antallet af nikkelsensibiliserede individer, som vil få hudreaktioner, stiger ved øgning af eksponeringsdosen (tabel 1 og figur 1.1) (15-31). Endnu har man ikke forsøgt at sammenfatte resultaterne af disse studier for at kunne fastlægge en grænseværdi for den perorale nikkeldosis, som forårsager det systemiske kontakteksem, da de tidligere studier ikke har været umiddelbart sammenlignelige. Hvorvidt nikkel indtaget gennem drikkevandet og den daglige kost kan inducere systemiske reaktioner er stadig kontroversielt, da de eksponeringsdoser, som har været brugt i de tidligere studier, har været generelt højere, end hvad man normalt vil indtage gennem føden og drikkevandet. Enkelte studier har dog vist, at nikkeldoser, som svarer til den maksimale nikkelmængde, man kan få gennem kosten (0,9 mg nikkel pr. dag) (32), kan inducere systemiske reaktioner hos nogle nikkelsensibiliserede individer (17,19,20,24,31). Formålet med dette studie har været at bestemme teoretiske grænseværdier for nikkelindtagelse, som kan medføre udvikling af kontakteksem hos nikkelsensibiliserede individer, ved at sammenfatte resultater fra tidligere nikkeleksponeringsstudier i tillempede statistiske meta-analyser. Herved vil man kunne få mere operationelle talværdier, som eventuelt vil kunne få betydning for vurderingen og fastlæggelsen af grænseværdier for nikkel i f.eks. vores drikkevand. 2.2 Allergisk kontakteksem og systemisk kontakteksemUdviklingen af allergisk kontakteksem inddeles i to faser: Induktionsfasen (sensibiliseringsfasen) og effektorfasen (elicitationsfasen). Induktionsfasen starter efter den første hudkontakt med nikkel og strækker sig over et tidsrum fra 3 dage til adskillige uger, hvorefter individet vil være blevet sensibiliseret over for nikkel og derfor kunne udvikle et allergisk kontakteksem ved fornyet hudkontakt med nikkel. I induktionsfasen ses ingen kliniske hudreaktioner. Effektorfasen begynder ved fornyet nikkelkontakt, som oftest sker efter direkte, længerevarende hudkontakt med en nikkelfrigivende metallegering. I hudområdet udvikles et allergisk kontakteksem, som karakteristisk vil give kløe og rødme, der skyldes infiltration og aktivering af reaktive immunologiske celler. Der dannes ødem i huden, hvilket kan ses som vesikler eller bullae forårsaget af frigivelse af immunologiske signalstoffer såsom lymfokiner og kemokiner, som udvider blodkarrene og derved gør dem utætte, så væske trænger fra blodet ud i vævet. Ved det systemiske kontakteksem er de mest specifikke hudreaktioner eksematøs flare-up reaktion på hudområder, hvor der tidligere har været en positiv lappetest for nikkel, eller hvor der tidligere har været nikkelforårsaget eksemudbrud. Andre klinisk karakteristiske reaktioner er vesikulært håndeksem, eksem i albuebøjningen, udbredte uspecifikke eksemreaktioner på store dele af kroppen og/eller det såkaldte ”baboon syndrom” (33). Generelle symptomer så som hovedpine, kvalme og alment ubehag er også set efter peroral nikkeleksponering af nikkelsensibiliserede individer. Endvidere er der indicier for, at peroral nikkelindtagelse kan inducere eller vedligeholde kronisk håndeksem hos nikkelsensibiliserede individer. 2.3 EpidemiologiI det sidste århundrede har sensibilisering over for nikkel været den primære enkeltårsag til allergisk kontakteksem blandt kvinder i de industrialiserede lande (5,34-39). Man har i epidemiologiske studier i Skandinavien fundet, at prævalensen af nikkelallergi i den generelle kvindelige befolkning ligger et sted mellem 2.7 % og 30.8 % afhængig af hvilken aldersgruppe, man har undersøgt (2,6,7,34,40). I Nordamerika har man estimeret, at forekomsten af nikkelinduceret kontakteksem blandt kvinder er 14.3 % (41), mens man i et nyligt skotsk studie fandt, at forekomsten var steget fra 16 til 22 % fra 1982 til 1997 (42). I en tværsnitsbefolkningsbaseret undersøgelse udført i Danmark i 1990 og igen i 1998 fandt Nielsen et al. (39), at forekomsten af nikkelsensibiliserede kvinder var 16.9 % i 1990 og 17.2 % i 1998. I 1991 udstedte det danske miljøministerium et nikkeldirektiv, som implementeredes i 1992, hvis formål var at begrænse nikkeleksponering i Danmark (43). Senere er der kommet en yderligere stramning af reglerne for nikkeleksponering ved implementeringen af et EU-direktiv i 2000 (44), og i den nærmeste fremtid vil man skulle implementere endnu et nyt EU-direktiv på området. Nielsen et al. (40), og yderligere tre andre undersøgelser (38,45,46) også udført i Danmark har vist, at der er sket en reduktion i antallet af nikkelsensibiliserede piger og unge kvinder efter indførelsen af nikkeldirektivet i 1992. I tidligere studier (47,48) har allergisk kontakteksem og systemisk kontakteksem været associeret med tilbagevendende eller kronisk håndeksem. I den føromtalte tværsnitsundersøgelse undersøgte Nielsen et al. (39) også ændringen i forekomsten af selvrapporteret håndeksem og undersøgte associationen mellem nikkelforårsaget kontakteksem og håndeksem hos danskere før og efter indførelsen af det første nikkeldirektiv i Danmark. I 1990 var allergisk kontakteksem over for nikkel signifikant associeret med forekomsten af håndeksem blandt kvinder. I 1998 efter implementeringen af nikkeldirektivet fandt Nielsen et al. (49) ikke længere en korrelation, selvom der sås en general stigning i antallet af nikkelsensibiliserede kvinder. Forfatterne konkluderede, at den manglende association mellem kontakteksem og håndeksem formentligt skyldes nikkeldirektivet, hvilket indicerer at forekomsten af nikkelallergisk relateret håndeksem kan begrænses ved hjælp af nikkeleksponerende reguleringer. 2.4 MekanismerSelvom det er muligt, at antistof-medierede reaktioner kan spille en rolle (50-53), er den almindelige opfattelse, at aktiveringen af allergenspecifikke T-celler er den primære igangsætter ved allergisk kontakteksem (54,55). 2.4.1 InduktionsfasenAllergisk kontakteksem forårsaget af nikkel opstår som følge af en aktivering af immunsystemet efter, at nikkelioner (Ni2+) frigives fra en nikkelholdig metallegering, som er i direkte, længerevarende hudkontakt og trænger gennem huden. Nikkelionerne kan bindes til kroppens egne proteiner og nikkel-protein-komplekset, men formentligt bliver også de enkelte nikkelioner optaget af antigenpræsenterende celler, de såkaldte Langerhanske celler. Disse udvandrer fra huden via lymfesystemet til de regionale lymfeknuder, hvor nikkel vha. specifikke overflademolekyler (MHC-molekyler) på de Langerhanske celler præsenteres for ”naive” T-lymfocytter, som bærer relevante T-cellereceptorer (TCR) (56,57). Dette resulterer i, at T-cellerne aktiveres. De bliver ”primet”, og ved deres deling sker der en klonal ekspansion af de nu nikkelspecifikke T-lymfocytter. Det er tidligere vist, at nikkel kan ændre på såkaldte ”self”-antigener (kroppens egne overflademolekyler), hvorved T-celler kan aktiveres (58) og et nyligt studie af Gamerdinger et al. (59) indikerer, at nikkel også er i stand til at binde sig direkte til MHC-molekyler, hvorved de danner og stabiliserer intermolekylære broer mellem MHC og TCR på en lignende, men ikke eksakt samme, måde som superantigener og derved aktiverer T-cellerne. En undersøgelse af Lu et al. (60) foreslår, at nikkel vha. et histidin-molekyle og to aminosyrer på et MHC-bundet peptid præsenteres for TCR som et kompleks, hvorved T-cellen aktiveres. Det tyder derfor på, at nikkel kan benytte sig af flere mekanismer, som resulterer i T-celle ”priming”, hvorved de bliver til antigenspecifikke T-celler med en ”hukommelse” for nikkel. T-cellernes deling og ekspansion er delvis selvforstærket (autokrin), ved at de selv udskiller signalstoffet interleukin (IL)-2, som øger T-celledelingen. De nyligt dannede nikkelspecifikke T-celler recirkuleres herefter via lymfesystemet og blodbanen til hele kroppen. De fleste nikkelspecifikke T-celler har opreguleret specifikke overflademolekyler, såkaldte ”homing” receptorer (CLA – ”Cutaneous Lymphocyte associated Antigen”) som medfører at T-cellerne vil udvandre fra blodbanen til huden, hvorved de nikkelspecifikke T-celler opkoncentreres i huden. Personen er nu blevet sensibiliseret over for nikkel. Hos disse sensibiliserede individer vil en re-eksponering af huden for nikkel medføre igangsættelsen af effektorfasen. 2.4.2 EffektorfasenHer sker antigenpræsentation af nikkel til de nikkelspecifikke T-celler i det nikkeleksponerede hudområde, hvilket igangsætter en immunologisk kaskadereaktion, hvor både hudcellerne (keratinocytter), de antigenpræsenterende Langerhanske celler og de nikkelspecifikke T-celler lokalt frigiver immunologiske signalstoffer (cytokiner og kemokiner). Frigivelsen af disse signalstoffer tiltrækker flere T-celler og andre reaktive immunologiske celler fra det perifere blod, hvilket i sidste ende resulterer i udviklingen af det kliniske kontakteksem. T-celler kan ud fra deres cytokinprofil underinddeles i fire suptyper: (type-0, type-1, type-2 og type-3). Type-0 T-celler regnes for at være en intermediær form, som kan uddifferentieres til de andre tre T-celle subtyper. De producerer og secernerer en bred vifte af cytokiner såsom IL-2, IL-4, IL-10, interferon (IFN)- og ”tumor necrosis factor” (TNF)-. De andre tre subtyper regnes for at være mere uddifferentierede. Type-1 T-celler, som primært udskiller IL-2, IL-17 og IFN-, blev i tidligere studier betragtet som den primære reaktive effektorcelle i udviklingen af kontakteksem, og de er i stand til at nedregulere aktivering af type-2 celler ved deres frigivelse af IFN-. Type-2 celler, som primært frigiver IL-4, IL-5, IL-6 og IL-10, fungerer som hjælper celler for B-cellers produktion af immunglobulin (Ig) og er i stand til at nedregulere aktiveringen af type-1 celler ved frigivelse af IL-10 og i mindre grad IL-4. Type-3 celler bliver betragtet som regulatoriske celler ved deres frigivelse af ”transforming growth factor” (TGF)-ß som både kan hæmme type-1 og type-2 celleaktivering (61). Fra undersøgelser af de immunologiske mekanismer bag andre kontaktallergener end nikkel er det fundet, at polariseringen af T-cellernes cytokinproduktion og derved uddifferentieringen af T-cellerne formentligt også er afhængig af andre faktorer. Det være sig, hvor i kroppen de immunreaktive celler første gang kommer i allergenkontakt og det lokale cytokinmiljø ved førstegangskontakten. Den molekylære struktur og koncentrationen af allergenet samt neuroendokrine faktorer menes også at kunne være afgørende faktorer (oversigt i 62). Der har været en del kontroverser gennem de sidste årtier om, hvorvidt udviklingen af allergisk kontakteksem primært skyldes CD4+ og/eller CD8+ T-celler, som har en type-1, type-2 eller type-3 cytokinprofil. Tidligere var opfattelsen, at den vigtigste effektorcelle i effektorfasen var CD4+ T-celler (57,63-67), som havde en type-1 cytokinprofil (højt niveau af IFN-, IL-2 og TNF-, men kun lidt eller ingen IL-4, IL-5 og IL-10) (63,64,68). Der er dog nu flere musemodelstudier (69-72) og undersøgelser af nikkel induceret allergisk kontakteksem på mennesker (73-77), som viser, at CD8+ T-celler formentligt spiller den primære effektorrolle, mens CD4+ T-celler enten kan være effektor eller mod-regulatoriske celler. Efter at allergen-specifikke CD4+ og CD8+ T-celler er trængt ud i huden, sker udviklingen af kontakteksemet direkte ved cytotoksicitet og ved frigivelsen af pro-inflammatoriske type-1 cytokiner (76,78-80). Man mener nu, at CD4+ type-2 T-celler udfører en efterfølgende mod-regulatorisk funktion ved at hindre og/eller hæmme de dendritiske cellers funktion (74-77). Andre studier har fastslået, at de nikkelreaktive T-celler er såkaldte ”hukommelse” (”memory”) CD45RO+ T-celler (75,81). Disse T-celler udtrykker desuden i højere grad specifikke ”homing receptorer” til huden (CLA). CLA-molekylerne binder T-cellerne til E-selectin molekyler, som udtrykkes på aktiveret endothel i blodkarrene, og derved bevirker de, at de specifikke T-celler netop trænger ud i det nikkelaktiverede hudområde (82-84). 2.4.3 Mekanismer ved systemisk kontakteksemKun få har prøvet at beskrive de immunologiske mekanismer ved det sekundære systemiske kontakteksem. Christensen et al. (85) fandt, at histologisk ligner flare-up reaktionen ved det systemiske kontakteksem reaktionen ved det allergiske kontakteksem. Imidlertid er det set, at reaktionerne ved det systemiske kontakteksem kan forekomme allerede efter få timer, men også først kan begynde 1-2 dage efter eksperimentel eksponering. Hermed indikerer det, at der måske er flere typer immunologiske reaktioner involveret. Gawkrodger et al. (86) fandt i en eksematøs flare-up reaktion forårsaget af en oral nikkelprovokation, at det cellulære infiltrat i dermis og epidemis var domineret af Leu 3a (CD4+) T-celler og kun få Leu 2a (CD8+) T-celler. Boscolo et al. (87) og Di Gioacchino et al. (88) undersøgte i begrænset omfang subtyper af lymfocytter i perifert blod hos kvinder med systemisk kontakteksem og kontrolpersoner efter peroral nikkeleksponering. Hos kontrolpersonerne sås, at andelen af CD4+, CD45RO+ (”naive”) T-celler var reduceret, og andelen af CD4+, CD45RO+ (”hukommelse”) T-celler var øget 24 timer efter nikkeleksponeringen. Hos tidligere nikkelsensibiliserede kvinder, som ikke reagerede på den orale nikkeleksponering, sås en øgning i antallet af blodets B-celler efter testen, men ingen ændring i sammensætningen af T-celler. Hos tidligere nikkelsensibiliserede kvinder, som reagerede på den perorale nikkeleksponering, sås derimod 4 timer efter nikkeleksponeringen en reduktion i det samlede antal monocytter, og efter 24 timer sås en 20-50 % reduktion i antallet T- og B-celler. Derudover fandt man, at de flare-up reagerende kvinder havde et højere IL-2 niveau og et lavere IL-5 niveau i serum før nikkeleksponeringen end de ikke-reagerende kvinder og kontrolpersonerne. I et andet studie af cytokinniveauer hos nikkelsensibiliserede individer, som reagerede med systemisk kontakteksem på peroral nikkeleksponering, undersøgtes niveauer af IL-4, TNF-, IFN-, IL-1 receptor antagonist og ”frit opløst (soluble)” TNF-receptor type 1 (sTNF-R1). Möller et al. (28) fandt i dette studie kun et forhøjet niveau af sTNF-R1 i plasma fra de nikkelsensibiliserede individer, som reagerede på den perorale nikkeleksponering. Jensen et al. (89) fandt i et dosis-responsstudie, at nikkel-sensibiliserede individer med hudreaktioner på peroral nikkeleksponering havde et signifikant fald i andelen af CD3+, CD45RO+, CLA+ og CD8+, CD45RO+, CLA+ blodlymfocytter, hvilket kunne skyldes en udvandring af CD8+, ”hukommelse”, CLA+ T-celler fra blodet ud i perifert væv. Nikkel-sensibiliserede individer, som reagerede på en høj nikkeldosis (4,0 mg), havde desuden et signifikant forhøjet niveau af IL-5 efter peroral eksponering, hvilket kunne indikere en aktivering af type-2 lymfocytter i det perifere blod. 2.5 Den naturlige systemiske nikkeleksponeringNikkel findes naturligt som metal i forskellige mineralske former og findes vidt udbredt i miljøet i floder, søer, havet, jorden, luften drikkevandet, planter og dyr. Nikkel er det 24. mest udbredte stof i jordskorpen med en gennemsnitlig koncentration på 0,0086 % (fra <0,0001 til >0,3 %) (90). Nikkel frigives til atmosfæren ved minedrift og ved industri, som fabrikerer nikkelholdige legeringer eller på anden måde bruger nikkel i deres produktion. Denne industri kan også frigive nikkel i sit spildevand. Nikkel frigives endvidere til atmosfæren ved afbrænding af olie, kul og skrald. Rusland, Japan, Canada og Ny Caledonien er de største producenter ud fra det meste af jordens nikkelforekomst. Der findes generelt to typer nikkelårer, som hhv. udvindes over eller under jorden (91,92). Verdens produktion af nikkel er steget fra 280.000 tons i 1960 (93) til omkring 1 million tons i dag (94). Da nikkel specielt gennem minedrift er kommet i kontakt med vores miljø, er det blevet ophobet og recirkuleret fra jorden via grøntsager, frugt og drikkevandet til mennesket (90). 2.5.1 Nikkelforekomsten i den daglige kostDe fleste undersøgelser har estimeret nikkelniveauet i en normal daglig kost til at ligge mellem 100 og 300 g (95). Det totale nikkelindtag og absorptionen af nikkel har dog vist sig at være meget variabelt og svært at estimere præcist. For det første afhænger det af kosten, og for det andet afhænger det af, hvordan maden er præpareret, og hvorvidt den er kontamineret fra køkkenremedier ved madlavningen. En vis geografisk og regional forskel i nikkelindholdet af de forskellige fødevarer kan også forekomme afhængigt af, hvor de kommer fra (tabel 2) (32,96-108). Det er endvidere blevet påpeget, at data fra de nyere undersøgelser er mere pålidelige, idet nikkelmålemetoderne og forebyggelsen af nikkelkontaminering i målelaboratoriet er blevet forbedret (102). Nikkel i mel, korn, brød, visse grøntsager og frugt og nødder bidrager mest til nikkelindtaget fra den daglige kost (100). Veien and Andersen (98) fandt de højeste koncentrationer af nikkel (1-10 mg nikkel per kg) i kakao, ris, lucerne spirer, tørrede bønner, peanuts, hasselnødder, solsikkefrø, havregryn og hvedekerner. Andre fødevarer så som linser, , , svampe, chokolade, sojabønner, soja produkter og mandler indeholder også relativt høje koncentrationer af nikkel. Nielsen and Flyvholm (32) estimerede, at indtagelsen af en stor mængde fødeemner med højt nikkelindhold vil kunne øge den daglige nikkelindtagelse til 900 g per dag eller mere. Ved hjælp af diætinstruktioner og ved bevist at undgå specifikke fødeemner kunne ikke-nikkelsensibiliserede forsøgspersoner reducere deres daglige nikkelindtagelse fra ca. 130 g til 70 g (98). Tilsvarende kunne forsøgsdeltagerne øge nikkelindtagelsen til 250 G, når de indtog nikkelrige fødeemner. I pjecen om ”Nikkelallergi og mad” fra Fødevaredirektoratet (100) har man udregnet at en dagskost med meget nikkelindhold i alt vil give et nikkelindtag på 450 G, mens en dagskost med et lavt nikkelindhold i alt vil give 68 g pr. døgn. I pjecen findes desuden en oversigt over nikkelindholdet i diverse fødeemner. 2.5.2 Nikkelforekomsten i drikkevandetNikkeleksponering fra drikkevandet og andre drikkevarer er normalt minimal, men der findes dog undtagelser. I de fleste studier (tabel 3) (109-115) har man fundet at nikkelniveauet i grund- og drikkevandet ligger mellem 1 og 10 g per liter. Enkelte undersøgelser har dog fundet vandprøver, som indeholdt meget højere koncentrationer. Det gennemsnitlige niveau i en canadisk undersøgelse var mindre end 2 g per liter, men man fandt niveauer på op til 69 g per liter i Ontario (113). Postevand fra grundvand, som ligger tæt på åbne nikkelminer, indeholdt 200 g nikkel per liter (109). Andersen et al. (114) tog postevandsprøver fra Københavnsområdet, hvor de fandt nikkelniveauer i de fleste prøver på under 35 g per liter, men der var store variationer som afhang af, hvor prøven var taget, hvilket tidspunktet på dagen prøven blev taget, og mellem varmt og koldt vand. På det tidspunkt, hvor man udførte undersøgelsen var det maksimale tilladte nikkelniveau i drikkevandet i Danmark 50 g per liter, og nikkelindholdet i vandet fra 2 prøvetagningssteder lå over dette niveau. Senere har man indført nye regler om vandkvalitet. I Miljøministeriets nye bekendtgørelse om vandkvalitet og tilsyn med vandforsyningsanlæg fra 2001 (116) sættes den højst tilladelige værdi i vandet hos forbrugeren til 20 g nikkel per liter. I en nyligere undersøgelse foretaget for Miljøstyrelsen (117) fandt man, at nikkelindholdet i drikkevandet i 2 ud af 20 vandværker og i 2 ud af 37 kildepladser var over 20 µg per liter og derfor overskred drikkevandskvalitetskravene. Korttidstest har vist, at for nogle metaller (fx kobber og zink) vil metalkoncentrationen i løbet af 12 timer nå et niveau, som ikke stiger yderligere. For andre metaller (fx bly og nikkel) er tendensen, at jo længere tid vandet står i installationerne, jo større er afgivelsen af metaller. I den tidligere nævnte undersøgelse af Andersen et al. (114) fandt man, at nikkelkoncentrationen var op mod 490 g per liter i de første 250 ml postevand. Efter at have ladet vandet løbe i 5 minutter fandt de meget lavere nikkelniveauer, hvilket kunne indikere, at nikkel frigives fra rør og vandhanen og opkoncentreres i ikke-løbende vand. Forfatterne konkluderede, at indtagelsen af kun det første vand, som blev tappet om morgenen, kunne have indflydelse på udviklingen af håndeksem som følge af nikkeleksponeringen. I den nylige undersøgelse foretaget af Force Instituttet for Miljøstyrelsen (117) fandt man, at forkromet messing, forniklede dele og specielt nikkelholdigt rødgods afgav meget høje mængder nikkel, der i nogle tilfælde overskrider den foreslåede maksimumgrænse mere end 50 gange. Afgivelsen skete i alle vandtyper og syntes ikke at være særligt påvirket af vandets hårdhedsgrad. I en bebyggelse blev der fra blandingsbatterier efter syv års brug stadig målt nikkelafgivelse, som var væsentligt højere end de nye krav. De højeste afgivelser af nikkel var knyttet til de forkromede belægninger som kun burde være på ydersiderne af fittings/vandhaner, hvilket man imidlertid fandt, var i væsentlige mængder på indersiden af mange installationer. Nikkelafgivelsen fra rent messing var tolerabel, når messing kun udgjorde en mindre del af installationen. Man fandt, at rustfrit stål samlet med rustfri fittings næsten ikke afgav metal på grund af sin fortræffelige evne til at danne beskyttelseslag. Dog fandt man, at rustfrit stål samlet med fortinnede kobberlegeringer afgav kobber, nikkel, bly og zink. 2.5.3 Nikkeleksponering fra køkkenremedier og andre kilderTidligere studier indikerede, at frigivelse af nikkel fra køkkenremedier kunne bidrage til den daglige totale nikkeleksponering (118-121). Smart & Sherlock (121) fandt de højeste nikkel koncentrationer i dåsegrøntsager sammenlignet med friske grøntsager, hvilket kunne skyldes selve opbevaringen i dåsen eller forarbejdningsprocessen, inden grøntsagerne kom på dåse. Kuligowski & Halperin (122) undersøgte nikkelfrigivelsen fra forskellige kogeremedier lavet af hhv. rustfrit stål, jern, aluminium og emaljeret stål udsat for væske med lavere pH-værdier og kogepunktet. De fandt at specielt rustfrit stål remedier frigav nikkel, hvorfor de foreslog, at nikkelsensibiliserede individer ikke skulle benytte kogeremedier, som var lavet af rustfrit stål. Mange senere undersøgelser har dog sat spørgsmålstegn ved disse fund, idet man mener, at den fundne nikkelfrigivelse fra rustfrit stål ligger inden for det naturlige niveau, som man finder i almindelige fødeemner (123-125). Accominotti et al. (126) bestemte nikkelniveauer i almindelige madretter som blev fremstillet i forskellige rustfrit stålremedier. De fandt store forskelle i nikkelindtagelsen afhængig af madretten, og de fandt ligeledes en forskel afhængig af, om maden var præpareret i en glas- eller rustfrit stålgryde. Bidraget fra nikkelfrigivelsen fra rustfrit stål var dog meget lavt i forhold til nikkelindholdet i de forskellige madretter. Derfor mente forfatterne ikke, at nikkelsensibiliserede individer skulle afskaffe brugen af køkkenremedier af rustfrit stål, så længe remedierne var af god kvalitet. I en undersøgelse af nikkelfrigivelsen fra el-kedler fandt Berg et al. (127), at 10 ud af 26 kedler på det danske marked frigav mere end 50 g nikkel per liter, og i et opfølgende studie fandt de, at der stadig fandtes to kedler på marked som frigav mere end de 50 g nikkel per liter. Disse to typer kedler blev efterfølgende trukket tilbage. I en tilsvarende test af kaffemaskiner fandt man ingen, som frigav signifikante nikkelmængder. 2.5.4 Nikkeloptagelse og udskillelse efter peroral eksponeringNikkel optages i tarmsystemet efter peroralindtagelse af nikkelholdige kost, drikkevarer og vand. Mængden af nikkel som optages er afhængig af dens kemiske form, binding og opløselighed, samt tilstedeværelse af andre stoffer som kemisk måtte binde eller chelere nikkel eller hæmme optagelsen af nikkel ved at benytte samme optagelsesmekanisme i tarmen. Nikkeloptagelsen øges oftest ved tilstedeværelse af stoffer som øger pH, opløselighed eller oxidation, eller ved chelerende stoffer som aktivt optages i tarmsystemet. Undersøgelser har vist, at nikkeloptagelsen kan variere fra 0,7 til 6 % af den perorale indtagene mængde, hvis nikkel tilsættes som nikkelsulfat opløst i mad eller i vand eller en kapsel indtaget sammen med et måltid. Indtages nikkel derimod når man er fastende har studier vist at man kan optage op mod 12-33 % (29,128-130). Hos mennesket vil hovedparten af peroralt indtaget nikkel, som nævnt ikke optages og derfor udskilles med fæces, mens den i tarmen optagede nikkel efterfølgende udskilles via urinen. Nikkelniveauet i serum er højest efter 1-3 timer efter peroral indtagelse (29,128,131) og Nielsen et al. (29) fandt halveringstid for nikkelkoncentrationen i serum på 19,9-26,7 timer. Hos galvaniseringsarbejdere, som ved et uheld indtog store mængder nikkel som nikkelsulfat og nikkelklorid i vand, fandt Sunderman et al. (132) en gennemsnitlig halveringstid for nikkelkoncentrationen i serum på 60 timer. Efter at arbejderne fik tilført væske intravenøst, faldt halveringstiden til 27 timer. Fækal- og urinnikkeludskillelse har været brugt som et mål for systemisk nikkeleksponering. I en dansk undersøgelse, af personer som havde en vakuum toilet opsamlingstank, fandt man en gennemsnitlig fækal- og urinnikkeludskillelse på 200 g pr. person pr. dag (133). Et Amerikansk studie fandt en gennemsnitlig nikkeludskillelse på 260 g pr. person pr. dag (134). Den totale mængde nikkel i den menneskelige krop er estimeret til at udgøre ca. 6 mg eller 86 g pr. kg i en 70-kg person (135). 2.6 Studier af nikkelforårsaget systemisk kontakteksemSom det fremgår, kan det være næsten umuligt at beregne det totale nikkelindtag og absorptionen i kroppen. Mængden af nikkel afhænger af fødeemnerne i kosten og af ydre faktorer, såsom hvordan føden er tilberedt, hvorledes den har været emballeret, og om den er blevet kontamineret fra nikkelfrigivende køkkenredskaber i forbindelse med den forudgående bearbejdning af maden. Der er fundet en vis regional forskel i nikkelindholdet i de forskellige fødeemner, og selvom bidraget til nikkelindtagelsen fra drikkevarer og vand for det meste er minimalt, har man fundet eksempler på nikkelforurening af drikkevandet. Endvidere vil bidraget af nikkel fra drikkevandet til den daglige nikkeloptagelse være af relativ større betydning, hvis man indtager vand fastende, som f.eks. hvis man starter dagen med at drikke vand, te eller kaffe inden man spiste morgenmad. Spørgsmålet er derfor, om den mængde nikkel, som man kan indtage gennem føden og drikkevandet, er tilstrækkelig til at inducere en opblussen af håndeksem eller andre systemiske reaktioner hos nikkelsensibiliserede individer. Dette spørgsmål har man prøvet at besvare på forskellig vis i både diætinterventionsstudier og perorale eksponeringsstudier. Desuden har man forsøgt at behandle nikkelforårsaget kontakteksem ved hjælp af lav-nikkelholdig diæt. 2.6.1 DiætinterventionsstudierUd over selve nikkelindholdet i føden er der andre faktorer, som har betydning for den faktiske mængde, der bliver optaget i kroppen. I føden findes forskellige bestanddele såsom fosfatforbindelser, fytinsyre, fibre og metalionbindende komponenter, som kan binde nikkel i føden, hvorfor absorptionen af en given mængde nikkel i fødeemner må forventes at være mindre, end hvis den samme mængde indtages som nikkelsulfat i kapsler eller opløst i vand indtaget på fastende mave. I de perorale eksponerings-forsøg er nikkeleksponeringen blevet givet som en bolusdosis, hvorfor nikkelabsorptionen i disse forsøg ikke kan sammenlignes med nikkeleksponeringen fra den normale kost. Forskellige forskere har udført diætinterventionsundersøgelser for at belyse den systemiske effekt af nikkel i føden hos nikkelsensibiliserede individer. Man har endvidere forsøgt at behandle kronisk håndeksem og andre systemiske reaktioner på nikkel ved hjælp af diætintervention. Generelle diætinterventionsstudier (16,136-138) og individuel kasuistik (139,140) indikerer at det er muligt at reducere kontakteksemet hos nikkelallergiske patienter, hvis de vedbliver med at holde en streng diæt med lavt nikkelindhold. I et andet studie så man, at indtagelsen af en diæt, som indeholdt et højt nikkelindhold, kunne forværre håndeksem hos nikkelallergiske personer (141). Christensen et al. (142) fandt, at nikkelallergiske individer havde et signifikant lavere indtag af fødeemner med et højt nikkelindhold i forhold til raske kontrolpersoner, hvilket kunne indikere, at nikkelallergiske patienter mere eller mindre bevidst undgik eller begrænsede deres indtag af fødeemner med et højt nikkelindhold. Et grundlæggende problem ved samtlige de ovennævnte undersøgelser er, at de alle er åbne kliniske studier, og at der ikke er udført dobbelt-blindede forsøg. Dette begrænser de konklusioner, der kan drages på baggrund af studierne. 2.6.2 Perorale eksponeringsstudierSiden 1975 har flere undersøgelser indikeret, at peroral nikkeleksponering kan inducere systemisk kontakteksem hos nikkelsensibiliserede individer (tabel 1 og figur 1). Der er dog flere faktorer, som gør det svært at drage endelige konklusioner ud fra de udførte studier. Et af hovedproblemerne er, at nikkeleksponeringen i studierne ikke efterligner det virkelige livs forhold, hvad angår nikkeleksponering. Der er desuden blevet brugt forskellige forsøgsprotokoller og nogle af forsøgene var ikke dobbelt-blindede. En del af undersøgelserne har kun benyttet et begrænset antal forsøgspersoner, og udvælgelseskriterierne for de indrullerede forsøgspersoner er ikke standardiseret forsøgene imellem. I nogle forsøg har det kun været en positiv lappetest for nikkel, som har været inklusions-kriterium, mens det i andre også har indbefattet håndeksem og/eller en sygehistorie, som indikerede nikkelforårsaget kontakteksem. Kriterierne for en positiv reaktion på den perorale eksponering er ikke standardiseret. Tiden mellem eksponering og evaluering er forskellig i mange af studierne, varierende fra 0 til 72 timer eller mere. Studier, hvor man evaluerede reaktionen på den perorale eksponering tidligt, kunne tænkes at have underrapportering af antallet af reaktioner på eksponeringen. Ikke alle undersøgelser har specificeret, om forsøgsdeltagerne var fastende eller om der var andre diætinterventioner. Nogle studier har benyttet sig af enkeltbolus eksponering, mens andre har brugt dobbeltbolus eksponering. Absorption og biokinetik efter nikkeleksponeringen i de forskellige studier er formentligt forskellig fra nikkelabsorption og biokinetik ved naturlig nikkeleksponering gennem kosten, hvor nikkel bliver absorberet løbende gennem hele dagen. Som tidligere nævnt kan den naturlige nikkeleksponering og absorption fra kosten være meget varierende og svær at estimere, og i de fleste perorale eksponeringsundersøgelser har man ikke taget højde for dens eventuelle betydning for forsøgsresultatet. Ser man bort fra disse variable ved de forskellige undersøgelser, er det samlede generelle billede ved de systemiske eksponeringsforsøg, at peroral nikkelindtagelse kan inducere systemisk kontakteksem hos nikkelsensibiliserede individer. Flare-up reaktioner af tidligere lappetestområder efter systemisk peroral eksponering ser ud til at være allergenspecifikke, og der ser ud til at være en dosis-respons sammenhæng, idet eksponering med højere doser får flere individer til at reagere (15-31). Hvorvidt nikkel indtaget gennem drikkevandet og den daglige kost kan inducere systemiske reaktioner er stadig kontroversielt, da de eksponeringsdoser, som har været brugt i de tidligere studier generelt har været højere (fra 0,3 mg til 5,6 mg nikkel) (tabel 1 og figur 1.1), end hvad man normalt vil indtage gennem føden (0,1 mg til 0,5 mg nikkel) (tabel 2). Enkelte studier har dog vist, at nikkeldoser, som svarer til nikkelmængden, man får gennem diæten, og den maksimale nikkelmængde, man kan opnå (0,9 mg nikkel pr. dag) (24), kan inducere systemiske reaktioner hos nikkelsensibiliserede individer (17,19,20,24,31). Formålet med undersøgelsen var at bestemme teoretiske grænseværdier for nikkelindtagelse, som medfører udvikling af kontakteksem hos nikkelsensibiliserede individer, ved at sammenfatte resultaterne fra de tidligere nikkeleksponeringsstudier i tillempede statistiske meta-analyser. Herved fås mere operationelle talværdier, som vil kunne få betydning for vurderingen og fastlæggelsen af grænseværdier for nikkel i f.eks. drikkevand. 3 Metode3.1 Identifikation af nikkeleksponeringsstudier 3.1 Identifikation af nikkeleksponeringsstudierRelevante undersøgelser publiceret fra januar 1966 til november 2004 blev identificeret ved litteratursøgning på MEDLINE, EMBASE og BIOSIS med søgeordene: ”nickel”, ”oral”, ”challenge”, ”exposure”, ”hypersensitivity”, ”sensitivity”, ”allergy”, ”systemic” ”provocation” og ”contact dermatitis” i forskellige kombinationer. Der blev desuden søgt ved hjælp af søgefunktionen ”Related Articles” og på specifikke forfattere inden for det videnskabelige område. Endeligt blev relevante referencer lokaliseret ved hjælp af referencer i oversigtsartikler. Selvom de fleste relevante publikationer formentligt er blevet lokaliseret ved hjælp af disse benyttede metoder, udgør denne rapport ikke en formel meta-analyse (eller serie af meta-analyser), der omfatter alle publikationer, som måtte være inden for området. 3.2 Statistisk analyseplan og benyttede metoderFormålet med den statistiske analyse er at udføre sammenlignende kvantitative dosis-responsanalyser, hvilket vanskeliggøres pga. heterogeniteten imellem de identificerede studier. Det vil sige at de observerede forskelle mellem studierne kan skyldes såvel forskelle i testnings- og bedømmelsesmetode som forskelle imellem de undersøgte patientpopulationer. Tre studier anvendte en dobbelt dosering med oralt nikkel, mens de øvrige anvendte en enkel dosis. En fra et statistisk synspunkt vigtig forskel er, at det i nogle af studierne er de samme patienter, som testes med forskellige nikkeldoser inkl. placebo, mens det i de øvrige er forskellige grupper, som hver testes med én dosis. Primært beregnes for hvert studie og dosisgruppe responsrater (procent positive patienter) med 95 % konfidensgrænser baseret på binomialfordelingen (6.2). Bortset fra to studier med kun én nikkeldosis og ingen placebo udføres der for de øvrige studier test af signifikant dosis-responseffekt (6.3). Dette udføres vha. McNemars test eller Fishers test for sammenligning af hhv. parrede eller uparrede responsdata. Det er imidlertid ikke muligt at anvende McNemars test i de studier, hvor der er positive patienter ved begge doser, idet de individuelle parrede responsdata ikke er rapporteret. I tre studier muliggjorde data en bestemmelse af en logistisk dosis-responsrelation. Endelig blev hyppighed af positivt respons ved placebo sammenlignet separat for studierne med dobbelt og enkelt dosering vha. Fishers test. Efter disse analyser omfattende alle studier udføres supplerende sammenlignende analyser af de 14 studier med en enkel oral nikkel dosis for at identificere evt. homogene grupper, som kan antages at have en fælles dosis-responsrelation (6.4). Dette udføres vha. trinvis multipel logistisk dosis-respons regressionsanalyse, idet det først undersøges hvilke studier, som udviser signifikante afvigelser fra middelværdien af de øvrige, efterfulgt af en analyse af hvilke af disse, som kan antages at have en fælles dosis-responsrelation. Denne analyse bygger på en simplificerende forudsætning om, at dosis-responskurverne fra de forskellige studier kan antages at være parallellelforskudt langs den logaritmiske dosisakse. Hvorvidt dette er opfyldt eller ej vurderes ud fra plots af data og de tilpassede dosis-responskurver. Der er imidlertid to problemer med udvælgelse af data til denne analyse. For at sikre, at forudsætningen om uafhængige responser er opfyldt, må der kun indgå responsdata ved én dosis fra de studier, hvor det er de samme patienter, som testes. Dette problem løses ved at vælge data ved den dosis, som giver en responshyppighed nærmest 50 %, idet det ud fra en statistisk betragtning er de data, som indeholder mest præcis information om dosis-responsrelationen. Det andet problem er, at nogle af disse studier udviser positiv responsfrekvens på placebo, dvs. nikkel dosis = 0, mens den logistiske model har responsfrekvens på 0 ved dosis 0. Endelig udføres der en tilsvarende analyse efter udeladelse af 2 studier, hvor der ikke var placebogrupper, og tilsvarende analyser efter udladelse af de 3 studier, hvor der var positivt respons på placebo (6.5). På basis af analysen af disse data er der beregnet eksponeringsdoser svarende til responsfrekvenser på hhv. 50 % (ED50), 25 % (ED25), 10 % (ED10), 5 % (ED5), 2 % (ED2) og 1 % (ED1) (6.6). Det er imidlertid stadig et problem at karakterisere den patientpopulation og testningsprocedure, som disse beregninger vil gælde for. Beregningen af de forskellige responsfrekvenser samt de tilhørende konfidensgrænser udføres vha. Fiellers metode baseret på resultatet af den logistiske regressionsanalyse. Baggrunden for de benyttede statistiske metoder er yderligere beskrevet i Appendiks 1 (Bilag C) 4 Resultater4.1 Beskrivelse af datamaterialet 4.1 Beskrivelse af datamaterialetDer foreligger dosis-responsdata fra 17 publicerede studier af patienter med nikkelallergi (se tabel 4.1). Disse studier varierer mht. til inklusionskriterier, eksponering ved testning, antal og størrelse af oral nikkeldosis, blindet eller ikke-blindet bedømmelse, kriterier for systemiske reaktion samt tidspunkt for bedømmelsen. De 17 studier omfattede i alt 496 patienter. Størrelsen af de enkelte studier varierede fra 11 til 131. 4.2 Responsrater og 95 % konfidensgrænserI tabel 4.1 ses fordelingen af positive reaktioner i forhold til de indtagne nikkeleksponeringsdoser i de 17 studier. Figur 1.1 viser responsraten med 95 % konfidensgrænser plottet mod nikkel dosis i logaritmisk skala. Konfidensgrænserne er i de fleste tilfælde store, hvilket skyldes det relativt lille antal deltagere i de forskellige studier. Ved den samlede vurdering af responshyppighederne med konfidensgrænser i forhold til dosis ses en tydelig tendens til voksende responsrate med voksende dosis, men der er behov for en mere detaljeret analyse for at evaluere, hvordan dosis-responsrelationerne eventuelt varierer mellem de forskellige studier. Der er dog stor variation, og en del studier udviste positivt respons ved placebo (studie 5, 7, dele af 10 (studiet består både af enkelt- og dobbelteksponering), 12, 14 og 17). 4.3 Dosis-responsanalyser af de forskellige eksponeringsstudierFørst analyseredes for om der var en statistisk signifikant dosis-responseffekt i hvert studie (tabel 4.2 og 4.3). Dette var ikke muligt for studie 13 og 15, som kun havde én dosis gruppe og ingen placebo gruppe. Hvis studierne kun havde en Ni-dosisgruppe ud over en placebogruppe, blev dosis-responseffekten testet vha. Fishers test (studie 4 og 16). I det tilfælde, hvor der ikke var respons på placebo (der var ingen placebo gruppe) og 2 eller flere højere dosisgrupper, blev der udført en standard logistisk regressionsanalyse (studie 6). I det tilfælde, hvor der var positivt responser på placebo og 2 eller flere højere dosisgrupper, blev der udført en modificeret logistisk regressions analyse (studie 17). Endeligt blev der i de tilfælde, hvor en enkelt gruppe individer testes med forskellige doser, inkl. placebo, estimeret en logistisk tolerance fordeling svarende til dosis-responsrelationen (studie 3). Hvis der i denne slags studier kun var én placebo- og én Ni-dosisgruppe, blev der anvendt McNemars test for parrede responsdata (studie 1, 2, 5, 8, 9, 10 og 11). Tabel 4.2 opsummerer resultaterne af de testede dosis-responseffekter ved parvis sammenligning af responsraterne mellem placebo- og Ni-dosisgrupperne. Det var ikke muligt at teste for dosis-responseffekter i studie 7, dele af 10, 12 og 14, da det ikke fremgår af artiklerne, hvordan de individuelle parrede responser på placebo og Ni-eksponeringen var fordelt. Dette gør sig ikke gældende i studie 1, 2, 5, 8, 9, dele af 10 (studiet består både af enkelt- og dobbelteksponering) og 11 hvor der ikke var respons på placebo. Blandt disse studier var der statistisk signifikante dosis-responseffekter i 7 af de 9 studier (tabel 4.2). Tabel 4.3 viser resultater af estimeringen af de logistiske dosis-responsrelationer, som kun var mulig for studie 3, 6 og 17. Studie 6 viste imidlertid ingen statistisk signifikant logistisk dosis-responseffekt, formentligt pga. det lille datamateriale (3 grupper af 5 individer). Selv om konstanterne og hældningsparametrene er forskellige i studie 3 og 17, er den udregnede ED50-værdi ens. Sammenfattende blev det fundet, at der kunne estimeres kvantitative logistiske dosis-respons relationer i tre studier, som i to af studierne svarede til en statistisk signifikant dosis-responseffekt. Blandt de øvrige studier gjorde datas beskaffenhed i visse tilfælde, at det ikke var muligt at teste forskelle mellem de anvendte doser, inkl. placebo (studie 7, 10, 12, 13 og 14). I de resterende 9 studier var det imidlertid muligt at sammenligne responsfrekvenser ved forskellige doser, og iblandt disse kunne der i 7 studier påvises statistisk signifikant (P < 0,05) dosis-responseffekt. Ved analyse af responsraten på placebo (baggrundsresponsraterne) påvistes forskelle mellem enkeltstudier og/eller grupper af studier såvel blandt dem med dobbelt dosering som dem med en enkel eksponering (data ikke vist). 4.4 Dosis-responsanalyser af de forskellige enkelteksponeringsstudierDe efterfølgende analyser er baseret på de 14 studier med en enkel dosering og omfattede relevante data fra 401 patienter (tabel 4.4). Analyserne udførtes vha. trinvis multipel logistisk dosis-respons regressionsanalyse, idet man først undersøgte hvilke studier, som udviser signifikante afvigelse fra middelværdien af de øvrige, efterfulgt af en analyse af hvilke af disse, som kan antages at have en fælles dosis-responsrelation. Denne analyse bygger på en simplificerende forudsætning om, at dosis-responskurverne fra de forskellige studier kan antages at være parallellelforskudt langs den logaritmiske dosisakse. Analyser blev udført vha. en baglæns reduktionsprocedure og en forlæns selektionsprocedure. Ved reduktionsproceduren blev det studie (eller Ni-dosis-responseffekt), som adskilte sig mindst og ikke signifikant (P > 0,05) fra gennemsnittet i de andre studier, betragtet som hørende til gennemsnittetsgruppen, og i det næste trin blev det mindst ikke-signifikant afvigende studie blandt de resterende studier overført til gennemsnittetsgruppen og så fremdeles. Reduktionen eller “poolingen” af studier stoppede, når der kun var signifikant afvigende studier tilbage. Disse studier kan også identificeres ved en forlæns selektionsprocedure, hvor det studie (eller Ni-dosis-responseffekten), som adskilte sig mest og signifikant fra gennemsnittet, udvælges først. I det næste trin udvælges det mest signifikante blandt de resterende og så fremdeles. Udvælgelsen stoppes når responsraten i ingen af de tilbageværende studier er statistisk signifikant (P > 0,05) (Bilag C Appendiks 1) for yderligere uddybning af de benyttede metoder). Både den baglæns reduktionsprocedure og den forlæns selektionsprocedure gav same resultat (tabel 4.5). Analyserne viste, at der var en statistisk signifikant dosis-responseffekt, og at resultaterne fra fire af studierne (studie 6, 11, 12 og 14) skilte sig signifikant ud fra de øvrige 10 studier, som udviste en acceptabel overensstemmelse med den samme dosis-responsmodel defineret af parametrene og . Den positive 1 parameter betyder, at responskurven for studie 6 er højere end den for gruppen af de 10 homogene studier, mens de negative 2, 3 og 4 parametre betyder, at responskurverne for studie 11, 12 og 14 var lavere. Da værdierne af 2, 3 og 4 ikke afviger signifikant, er det acceptabelt at betragte studie 11, 12 og 14 som en homogen gruppe med samme dosis-responskurve. Tabel 4.6 viser resultaterne af de logistiske regressionsanalyser, hvor studie 11, 12 og 14 er kombineret, studie 6 er separat og de øvrige 10 studier er kombineret. Figur 1.2 viser de observerede responsrater med 95 % konfidensgrænser og de tilpassede dosis-responskurver. Det bemærkes, at dosis-responskurverne for hhv. studie 6 og studie 11, 12 og 14 er parallelle med kurven for de resterende 10 studier. Dette skyldes strukturen af de logistiske dosis-responsmodeller, som beskriver forskelle mellem studier ved parallelforskydning af dosis-responskurverne langs log-dosisaksen. Resultaterne i tabel 4.6 og figur 1.2 skal tages med visse forbehold, idet enkelte af studierne, som blev inkluderet i gruppen af de 10 homogene studier, var tæt på at afvige signifikant (0,05 < P < 0,10), mens studie 6 kun var svagt signifikant afvigende (P = 0,038). Den opnåede sammenfatning af studierne kan derfor i et vist omfang være et tilfældigt udfald. Man kan også sætte spørgsmålstegn ved antagelsen af de parallelforskudte dosis-responskurver, og det er desværre ikke muligt at teste denne hypotese generelt, idet kun data fra studie 3, 6 og 17 muliggør testning af parallelitet. Sammenfattende viste analyserne derfor, at man kunne sammenfatte studierne i tre grupper. En stor gruppe på 10 studier, som udviste en intermediær dosis-responskurve flankeret af en mindre gruppe på 3 studier (studie 11, 12 og 14), som udviste lavere respons, mens et særskilt studie udgjorde sig egen gruppe, som havde en højere responsfrekvens (studie 6). Ved visuel bedømmelse af data i de grafiske afbildninger synes antagelsen om parallelle dosis-responskurver at være opfyldt med god tilnærmelse. Analysen har imidlertid to svagheder. Dels er der inkluderet data fra to studier uden placebo testning (studie 13 og 15), og dels er der inkluderet studier med positivt respons på placebo (studie 12, 14 og 17). Det er et åbent spørgsmål, om det ud fra et biologisk og statistisk standpunkt er meningsfuldt at sammenligne dosis-responsanalyser fra alle studierne med enkelteksponering, når responsraten på placebo er klart større i visse studier (data ikke vist). Desuden havde studie 13 og 15 ingen placebogruppe inkluderet i forsøgsdesignet. Derfor er der foretaget nogle alternative analyser, dels hvor studiet med ukendte responsrater på placebo blev ekskluderet (studie 13 og 15), hvilket som forventet ikke gav nogen nævneværdig ændring af resultaterne, da de pågældende ekskluderede studier tilhørte midtergruppen og kun omfattede 45 patienter (data ikke vist), og dels alene af de studier (studie 1, 2, 3, 4, 8, 9, dele af 10, 11 og 16), hvor man ikke observerede respons på placebo (6.5). 4.5 Dosis-responsanalyser af enkelteksponeringsstudier uden respons på placeboI studier med et positivt respons på placebo eller en Ni-dosis = 0 (baggrundsrespons) er det principielt ikke korrekt at beskrive dosis-responsrelationer vha. en logistisk model, som forudsætter, at en responsrate er 0 når eksponeringsdosis er 0. Dette invaliderer dog ikke de foranstående analyser bortset fra, at de ikke kan benyttes til ekstrapolation af dosis-responsrelationerne til lavere doser end de lavest forekommende større end 0. Standardløsningen på dette problem ville være at modificere den logistiske model ved tilpasning til en positiv responsrate ved en dosis på 0 (se Appendiks 1 (Bilag C) for yderligere uddybning af de benyttede metoder), som udført tidligere i analyserne med studie 17 som vist i tabel 4.3. Dette forudsætter dog, at der er mindst 2 Ni-doseringer i de pågældende studier med responsrater, som overstiger baggrundsresponsraten. Ved gennemgang af data i tabel 4.1 for de relevante studier (studie 7, 10, 12, 14 og 17) ses, at kun studie 17 muliggør estimering af en modificeret dosis-responsmodel med en baggrundsresponsrate (se tabel 4.3). Da formålet var at bestemme fælles dosis-responsmodeller for grupper af homogene studier, vil det næppe være meningsfuldt at sammenligne og evaluere modeller med forskellige baggrundsresponsrater. Det blev derfor valgt kun at foretage analyser på den del at studierne, som ikke havde respons på placebo. Disse studier kunne tænkes kun at have inkluderet individer med en lav sensitivitet over for nikkel eller have et forsøgsdesign, som medførte, at man ikke observerede eller registrerede sådanne ikke-specifikke responser. I tabel 4.7 ses en oversigt over de inkluderede studier. Efter denne udeladelse af studier med positivt respons på placebo var antallet af individer 171 fordelt på 9 studier. Igen blev der foretaget en trinvis logistisk regressionsanalyse og både den baglæns reduktionsprocedure og den forlæns selektionsprocedure gav samme resultat som ses i tabel 4.8. Studie 1, 9, 11 og 16 adskilte sig fra de resterende studier (studie 2, 3, 8, 10 og 14) ifølge den logistiske regressionsanalyse (P = 0,0069). Det ses, at δ1 og δ3 er negative, mens δ2 og δ4 er positive. Det er derfor rimeligt at fortsætte den statistiske analyse som i de foregående afsnit ved at teste, hvorvidt studie 1 og 11 på den ene side og studie 9 og 16 på den anden side kan beskrives vha. de samme dosis-responsmodeller. Testen for kombination af disse studier gav en P-værdi > 0,50, hvorfor hypotesen om en fælles dosis-responskurve for studie 1 og 11 og en fælles for studie 9 og 16 accepteres. Resultatet for den endelige model ses i tabel 4.9. Figur 1.3 viser de observerede og de tilpassede dosis-responskurver i studier med enkelteksponering og ingen positive respons på placebo. Sammenlignet med de tidligere fundne dosis-responskurver (figur 1.1 og 1.2) ses, at kurven i figur 1.3 er meget stejlere. Hældningen er dog ikke bestemt helt så præcist, da analysen omfatter færre individer. Sammenfattende medførte den endelige analyse, at der skete en markant ændring i resultatet ved ekskludering af studierne, hvor der observeredes en placeboeffekt. Der opnåedes nu en homogen midtergruppe omfattende 5 studier samt to grupper á to studier med hhv. højere og lavere responshyppighed. Disse to ydergrupper omfattede kun ét af de afvigende studier fra de forudgående analyser, idet de øvrige tre var blandt de udeladte pga. positivt respons på placebo. 4.6 Bestemmelse af teoretiske grænseværdier for udvikling af responsDe estimerede dosis-responskurver for de 3 grupper af studier (figur 1.3) kan bruges til beregning af teoretiske ED50-værdier, dvs. den eksponeringsdosis som i teorien vil medføre et positivt respons hos 50 % af nikkelsensibiliserede eksempatienter, eller til udregning af eksponeringsdoser, som vil medføre teoretiske responsrater f.eks. 25 %, 10 %, 5 %, 2 % eller 1 %. Det skal dog pointeres, at værdien af sådanne beregninger er afhængig af, hvorvidt den logistiske dosis-responsmodel vitterligt beskriver de observerede data korrekt. Denne antagelse er utvivlsomt en god tilnærmelse, så længe den estimerede dosis ligger indenfor det dosisinterval, som benyttes i studierne, hvilket vil være tilfældet for ED50-værdien. Man kan argumentere mod, hvorvidt en ekstrapolering af dosis-responskurven under den mindste nikkeleksponeringsdosis vil være korrekt, idet det ikke vides, hvor hurtigt den ”sande” dosis-responskurve vil nærme sig 0. Den logistiske model forudsiger et bestemt lav-dosisrespons, som i det lave område kan være forskellig fra andre plausible dosis-responsmodeller, der i princippet også kan være i god overensstemmelse med de foreliggende data. Tabel 4.10 viser de estimerede værdier for hhv. ED50, ED25, ED10, ED5, ED2 og ED1 med 95 % konfidensgrænser. Figur 1.4-1.6 viser grafiske afbildninger af hhv. ED50, ED10 og ED1 med 95 % konfidensgrænser. Det fremgår af tabel 4.10 og figur 1.4-1.6, at konfidensgrænserne bliver gradvist større og mere ”skæve” ved faldende responsrater, hvilket er en konsekvens af formen på dosis-responskurverne i figur 1.3, som bliver gradvist mere flad ved lavere doser. Ved ED50 (figur 1.4) er der kun et moderat overlap i konfidensgrænserne for de 3 grupper af studier, hvilket svare til de fundne statistiske signifikante forskelle mellem dosis-responskurverne (tabel 4.10). 5 Diskussion og konklusionDer blev ved en omfattende litteratursøgning identificeret dosis-responsdata fra 17 publicerede nikkeleksponeringsstudier udført på patienter med nikkelallergi. Disse studier varierede mht. til inklusionskriterier, eksponering ved testning, antal og størrelse af peroral nikkeldosis, blindet eller ikke-blindet bedømmelse, kriterier for positiv systemisk reaktion samt tidspunkt for bedømmelsen, hvilket gjorde en fælles statistisk meta-analyse af data vanskelig. Det blev derfor fundet nødvendigt at tillempe analyserne og fravælge data fra studier, som adskilte sig fra flertallet, for at bestemme teoretiske grænseværdier for nikkelindtagelse, som medfører udvikling af kontakteksem hos nikkelsensibiliserede individer. Ved den samlede vurdering af responshyppighederne i forhold til eksponeringsdosis i samtlige studier, så man en tydelig tendens til voksende responsfrekvens ved voksende dosis, men der var behov for en mere detaljeret analyse for at evaluere, hvordan dosis-responsrelationerne eventuelt varierede mellem de forskellige studier. Der var stor variation, og en del studier udviste positiv respons ved placebo. Ved nærmere sammenligning af disse baggrundsresponsrater kunne der påvises forskelle mellem enkeltstudier og/eller grupper af studier såvel blandt dem med dobbelt dosering som dem med en enkeleksponering. Da der var betydelig flere studier med enkelteksponering, var det ud fra et statistisk synspunkt mest rationelt at analysere videre på disse studier. Efterfølgende blev der foretaget trinvise logistiske regressionsanalyse på basis af de relevante data fra 381 patienter i de 13 studier med en enkel dosering. Her viste det sig, at resultaterne fra af fire studierne skilte sig signifikant ud fra resultaterne fra en større gruppe på 9 studier. De 4 studier kunne sammenfattes til en gruppe på tre og et særskilt studie. Den store gruppe på 9 studier udviste en intermediær dosis-respons kurve flankeret af den mindre gruppe, som udviste lavere respons, mens det særskilte studie havde højere responsfrekvens. Ved visuel bedømmelse af data i de grafiske afbildninger syntes antagelsen om parallelle dosis-responskurver at være opfyldt med god tilnærmelse. Analysen havde imidlertid to svagheder. Dels var der inkluderet data fra et studie uden placebo testning, og dels var der inkluderet studier med positivt respons på placebo. Udeladelse af studiet uden placebotest gav ingen signifikante ændring i resultaterne. Yderligere udeladelse af de tre studier med positivt respons på placebo bragte antallet af patienter ned på 171 og ændrede resultatet markant. Der identificeredes nu en homogen midtergruppe omfattende 5 studier samt to grupper á to studier med hhv. højere og lavere responshyppighed. Disse to ydergrupper omfattede kun et af de afvigende studier fra de forudgående analyser, idet de øvrige tre var blandt de udeladte pga. positivt respons på placebo. På basis af dette resultat blev der for hver af de tre grupper beregnet teoretiske eksponeringsdoser, som i teorien ville forårsage responsfrekvenser på hhv. 50 %, 25 %, 10 %, 5 %, 2 % og 1 % af nikkelsensibiliserede eksempatienter. Mens selve doserne udviste konstante forhold mellem de tre grupper på grund af de parallelforskudte dosis-responskurver, så voksede de beregnede konfidensgrænser kraftigt med aftagende responsfrekvens, hvilket skyldtes at dosis-responskurverne flader ud. De udførte beregninger kan benyttes til at forudsige, at en peroral nikkel-eksponering med en dosis på hhv. 0,22 mg, 0,35 mg eller 0,53 mg nikkel kan forventes at give et positivt respons hos 1 % af de nikkel-sensibiliserede patienter med muligt systemisk eksem, som ses hos hudlæger (jf. tabel 4.10), afhængig af hvilke dosis-responskurve fra de 3 forskellige grupper af studier, man vælger at benytte. Tilsvarende vil 2 % i denne gruppe af patienter reagere, hvis de eksponeres for en peroral nikkeldosis på hhv. 0,29 mg, 0,45 mg eller 0,70 mg, 5 % vil reagere på hhv. 0,41, 0,65 eller 1,0 mg nikkel, mens en eksponering for hhv. 0,55, 0,87 eller 1,33 mg nikkel, ville få 10 % af patienterne til at reagere med symptomer på et systemisk kontakteksem. Det skal her præciseres at testpersonerne i de inkluderede studier ikke repræsenterer baggrundsbefolkningen, men udgør de nikkelallergiske personer, som har været hos speciallæge og som overvejende har haft symptomer, der kunne tyde på en systemisk komponent i deres eksemsygdom. Mange af patienterne har haft kronisk håndeksem (tabel 1), som vil have blusset op ved den perorale eksponering. Beregningerne viser, at i denne gruppe vil man ud fra de to ”mest følsomme” statistiske modeller kunne forudsige, at 1 % af individerne vil forventes at reagere systemisk ved indtagelse af mellem 0,22 og 0,35 mg nikkel. Såfremt grænseværdien for vand på 20 g nikkel per liter overholdes, vil en person gennemsnitligt via vand indtage 40-60 g per dag. Dette kan derfor udgøre op mod ¼ af den dosis, som forventes at kunne give systemiske reaktioner hos 1 % af de mest følsomme nikkelallergiske patienter set af hudlæger. Hvis en relativ stor del af det daglige vandindtag sker fastende, som hvis man f.eks. starter dagen med at drikke vand, te eller kaffe inden man spiser morgenmad, vil bidraget af nikkel fra drikkevandet til den daglige nikkeloptagelse være af relativ større betydning og derfor formentligt udgøre mere end ¼ af den dosis, som vil kunne udløse systemiske reaktioner. Der lappetestes ca. 25.000 eksempatienter om året i Danmark, hvoraf 15% har nikkelallergi. Dette svarer til 3750 personer. Den nævnte dosis på 0,22 –0,35 mg forventes at kunne fremkalde systemisk kontakteksem hos 1% af de mest følsomme nikkelallergikere. En procent af hele gruppe af nikkelallergiske eksempatienter svarer til ca. 40 personer om året, som vil forventes at kunne få systemisk kontakteksem af nikkel svarende til de nævnte omstændigheder . Beregningerne af doserne 0,22– 0,35mg repræsenterer imidlertid den mest følsomme del af nikkelallergiske eksempatienter og såfremt disse udfra et liberalt skøn antages at udgøre havdelen af gruppen af nikkelallergikere vil det svare til, at ca. 20 nye tilfælde om året. Det reelle tal kan være større, da ikke alle med et problem forventes at opsøge læge og de generelle usikkerheder, som i øvrigt ligger bag tallene. På den anden side må estimatet forventes at omfatte hovedparten af de personer, som vil have betydelige gener. Beregningerne fra de to mest ”følsomme” statistiske modeller indikerer også, at et nikkelindtag svarende til 0,5-0,9 mg per dag, hvilket kan forekomme ved indtagelse af udvalgte høj-nikkelholdige fødemidler, hvis man drikker vand fra armaturer, der frigiver meget nikkel, eller hvis man indtager meget drikkevand fastende, kan medfører en risiko for, at op mod 10 % af de nikkelallergiske patienter vil få en systemisk reaktion. Højere indtag af nikkel må forventes kun at forekomme under særlige eksponeringsforhold. Det skal fremhæves, at de udførte statistiske analyser er af eksplorativ art, primært fordi de forskellige studier er udført under varierende betingelser på patientgrupper, som næppe kan antages at repræsentere en fælles population. Forudsætningen, om at visse studier er homogene, er således alene baseret på de opnåede data, hvor forskelle i patientudvælgelse og testningsomstændigheder kan være konfunderede. Da der således ikke foreligger nogen forudgående hypoteser angående forskelle og ligheder mellem studierne, må de fundne statistisk signifikante forskelle tages med forbehold og kan ikke begrunde nogen konklusioner vedrørende årsagerne til disse forskelle. En mere detailleret diskussion af betydningen af den foreliggende variation i patientudvælgelse og testningsmetoder for forskelle i responsfrekvens mellem studierne anses for at ligge uden for rammerne af den rapport. Det kan dog anføres, at det reducerede datamateriale omfattende 9 studier med i alt 171 patienter ikke vil være tilstrækkeligt til afklaring af, om der måtte være sammenhænge mellem responsfrekvens og testningsbetingelser og/eller forskelle mellem patienterne i de forskellige studier. Det vil desuden ikke være meningsfyldt ud fra de foreliggende data at fastlægge et absolut ingen-effekt niveau, idet der forekommer placebo-effekter og sygdomsaktivitet af andre årsager end nikkelindtagelse, som det ikke er muligt at kontrollere for. 6 Litteraturliste1. Boss A, Menné T. Nickel sensitisation from ear-piercing. Contact Dermatitis, 1982; 8: 211-213. 2. Larsson-Stymne B, Widström L. Ear piercing - a cause of nickel allergy in schoolgirls? Contact Dermatitis, 1985; 13: 289-293. 3. Staerkjaer L, Menné T. Nickel allergy and orthodontic treatment. Eur J Orthod, 1990; 12: 284-289. 4. McDonagh AJG, Wright AL, Cork MJ et al. Nickel sensitivity: the influence of ear-piercing and atopy. Br J Dermatol, 1992; 126: 16-18. 5. Nielsen NH, Menné T. Allergic contact sensitization in an unselected Danish population. Acta Derm Venereol, 1992; 72: 456-460. 6. Dotterud LK, Falk ES. Metal allergy in north Norwegian schoolchildren and its relationship with ear piercing and atopy. Contact Dermatitis, 1994; 31: 308-313. 7. Kerosuo H, Kullaa A, Kerosuo E et al. Nickel allergy in adolescents in relation to orthodontic treatment and piercing of ears. Am J Orthod Dentofac Orthop, 1996; 109: 148-154. 8. Emmett EA, Risby TH, Jiang L et al. Allergic contact dermatitis to nickel: bioavailability from consumer products and provocation threshold. J Am Acad Dermatol, 1988; 19: 314-322. 9. Menné T. Prevention of nickel allergy by regulation of specific exposures. Ann Clin Lab Sci, 1996; 26: 133-138. 10. Menné T, Veien NK. Systemic contact dermatitis. In: Textbook of contact dermatitis. Rycroft RJG, Menné T, Frosch PJ, Lepoittevin J-L, eds. Berlin, Heidelberg, New York: Springer Verlag, 2001; 355-366. 11. Menné T, Veien NK, Sjølin KE et al. Systemic contact dermatitis. Am J Cont Derm, 1994; 5: 1-12. 12. Burrows D. Is systemic nickel important? J Am Acad Dermatol, 1992; 26: 632-635. 13. Möller H. Yes, systemic nickel is probably important! J Am Acad Dermatol, 1993; 28: 511-513. 14. Möller H, Björkner B, Bruze M. Gold allergy and artificial sweat. Contact Dermatitis, 1999; 41: 57-60. 15. Christensen OB, Moller H. External and internal exposure to the antigen in the hand eczema of nickel allergy. Contact Dermatitis 1975; 1:136-41. 16. Kaaber K, Veien NK, Tjell JC et al. Low nickel diet in the treatment of patients with chronic nickel dermatitis. Br J Dermatol, 1978; 98: 197-201. 17. Kaaber K, Menné T, Tjell JC et al. Antabuse® treatment of nickel dermatitis. Chelation – A new principle in the treatment of nickel dermatitis. Contact Dermatitis, 1979; 5: 221-228. 18. Veien NK, Kaaber K. Nickel, cobalt and chromium sensitivity in patients with pompholyx (dyshidrotic eczema). Contact Dermatitis, 1979; 5: 371-374. 19. Jordan Jr. WP, King SE. Nickel feeding in nickel-sensitive patients with hand eczema. J Am Acad Dermatol, 1979; 1: 506-508. 20. Cronin E, Di Michiel AD, Brown SS. Oral challenge in nickel-sensitive women with hand eczema. In: Nickel Toxicology. Brown SS, Sunderman Jr. FW, eds. Academic Press, New York, 1980; 149-152. 21. Burrows D, Creswell S, Merrett JD. Nickel, hands and hip prostheses. Br J Dermatol, 1981; 105: 437-444. 22. Bedello PG, Goitre M, Cane D et al. Nickel: a ubiquitous hapten. G Ital Dermatol Venereol, 1985; 120(4): 293-296. 23. Sertoli A, Lombardi P, Francalanci S et al. Effect of oral administration of haptens in sensitized subjects with contact allergic eczema. I). Up-date. G Ital Dermatol Venereol, 1985; 120(3): 207-212. 24. Gawkrodger DJ, Cook SW, Fell GS et al. Nickel dermatitis: the reaction to oral nickel challenge. Br J Dermatol, 1986; 115: 33-38. 25. Roduner J, Haudenschild-Falb E, Kunz E et al. Perorale Nickelprovokation bei nichtdyshidrosiformem und dyshidrosiformem Nickelekzem. Hautarzt, 1987; 38: 262-266. 26. Veien NK, Hattel T, Justesen O et al. Oral challenge with nickel and cobalt in patients with positive patch tests to nickel and/or cobalt. Acta Derm Venereol, 1987; 67: 321-325. 27. Santucci B, Cristaudo A, Cannistraci C et al. Nickel sensitivity: effects of prolonged oral intake of the element. Contact Dermatitis. 1988; 19(3): 202-205. 28. Möller H, Ohlsson K, Linder C et al. The flare-up reactions after systemic provocation in contact allergy to nickel and gold. Contact Dermatitis, 1999; 40: 200-204. 29. Nielsen GD, Soderberg U, Jorgensen PJ, Templeton DM, Rasmussen SN, Andersen KE, Grandjean P. Absorption and retention of nickel from drinking water in relation to food intake and nickel sensitivity. Toxicol Appl Pharmacol 1999; 154: 67-75. 30. Hindsén M, Bruze M, Christensen OB. Flare-up reactions after oral challenge with nickel in relation to challenge dose and intensity and time of previous patch test reactions. J Am Acad Dermatol, 2001; 44: 616-623. 31. Jensen CS, Menné T, Lisby S et al. Experimental systemic contact dermatitis from nickel: a dose-response study. Contact Dermatitis, 2003; 49(3): 124-132. 32. Nielsen GD, Flyvholm MA. Risks of high nickel intake with diet. IARC Sci Publ, 1984; 53: 333-338. 33. Andersen KE, Hjorth N, Menné T. The baboon syndrome: systemically-induced allergic contact dermatitis. Contact Dermatitis, 1984; 10: 97-100. 34. Menné T, Christophersen J, Green A. Epidemiology of nickel dermatitis. In: Nickel and the skin: Immunology and toxicology. Maibach HI, Menné T, eds. CRC Press Inc., Boca Raton, Florida, 1989; 109-115. 35. Marks Jr. JG, Belsito DV, DeLeo VA et al. North American Contact Dermatitis Group patch test results for the detection of delayed-type hypersensitivity to topical allergens. J Am Acad Dermatol, 1998; 38: 911-918. 36. Uter W, Schnuch A, Geier J et al. Epidemiology of contact dermatitis. The information network of departments of dermatology (IVDK) in Germany. Eur J Dermatol, 1998; 8: 36-40. 37. Sertoli A, Francalanci S, Acciai MC et al. Epidemiological survey of contact dermatitis in Italy (1984-1993) by GIRDCA (Gruppo Italiano Ricerca Dermatiti da Contatto e Ambientali). Am J Contact Dermatitis, 1999; 10: 18-30. 38. Johansen JD, Menné T, Christophersen J et al. Changes in the pattern of sensitization to common contact allergens in Denmark between 1985-86 and 1997-98, with a special view to the effect of preventive strategies. Br J Dermatol, 2000; 142: 490-495. 39. Nielsen NH, Linneberg A, Menné T et al. Allergic contact sensitization in an adult Danish population: two cross-sectional surveys eight years apart (The Copenhagen allergy study). Acta Derm Venereol, 2001; 81: 31-34. 40. Nielsen NH, Menné T. Nickel sensitisation and ear-piercing in an unselected Danish population. Glostrup Allergy Study, Denmark. Contact Dermatitis, 1993; 29: 16-21. 41. Silverberg NB, Licht J, Friedler S et al. Nickel contact hypersensitivity in children. Pediatr Dermatol, 2002; 19: 110-113. 42. Dawn G, Gupta G, Forsyth A. The trend of nickel allergy from a Scottish tertiary referral center. Contact Dermatitis, 2000; 43: 27-30. 43. Miljøministeriet. Bekendtgørelse nr. 854 af 16. december 1991. 44. Miljø- og Energiministeriet. Bekendtgørelse nr. 24 af 14. januar 2000. 45. Veien NK, Hattel T, Laurberg G. Reduced nickel sensitivity in young Danish women following regulation of nickel exposure. Contact Dermatitis, 2001; 45: 104-106. 46. Jensen CS, Lisby S, Baadsgaard O et al. Decrease in nickel sensitization in a Danish schoolgirl population with ears pierced after implementation of a nickel-exposure regulation. Br J Dermatol, 2002; 146(4): 636-642. 47. Edman B. Palmar eczema: a pathogenetic role for acetylsalicylic acid, contraceptives and smoking? Acta Derm Venereol, 1988; 68: 402-407. 48. Christophersen J, Menné T, Tanghøj P et al. Clinical patch test data evaluated by multivariate analysis. Contact Dermatitis, 1989; 21: 291-299. 49. Nielsen NH, Linneberg A, Menné T et al. The association between contact allergy and hand eczema in 2 cross-sectional surveys 8 years apart. Contact Dermatitis, 2002; 46: 71-77. 50. Veien NK, Christiansen AH, Svejgaard E et al. Antibodies against nickel albumin in rabbits and man. Contact Dermatitis, 1979; 5: 378-382. 51. Picardo M, Santucci B, Pastore R et al. Immune complexes in patients with contact dermatitis. Dermatologica, 1986; 172: 52-53. 52. Janecková V, Znojemská S, Korcáková L et al. The immune profile of contact allergy patients. J Hyg Epidemiol Microbiol Immunol, 1989; 33: 121-127. 53. Estlander T, Kanerva L, Tupasela O et al. Immediate and delayed allergy to nickel with contact urticaria, rhinitis, asthma and contact dermatitis. Clin Exp Allergy, 1993; 23: 306-310. 54. Boerigter GH, Bril H, Scheper RJ. Hapten-specific antibodies in allergic contact dermatitis in the guinea pig. Int Arch Allergy Appl Immunol, 1988; 85: 385-391. 55. Bergstresser PR. Sensitization and elicitation of inflammation in contact dermatitis. In: Immune mechanisms in cutaneous diseases. Norris DA, ed. Dekker, New York, 1989; 219-246. 56. Romagnoli P, Labhardt AM, Sinigaglia F. Selective interaction of Ni with a MHC-bound peptide. ENBO J, 1991; 10: 1303-1306. 57. Sinigaglia F, Scheidegger D, Garotta G et al. Isolation and characterization of Ni-specific T cell clones from patients with Ni-contact dermatitis. J Immunol, 1985; 135: 3929-3932. 58. Griem P, von Vultee C, Panthel K et al. T cell cross-reactivity to heavy metals: identical cryptic peptides may be presented from protein exposed to different metals. Eur J Immunol, 1998; 28: 1941-1947. 59. Gamerdinger K, Moulon C, Kark DR. et al. A new type of metal recognition by human T cells: contact residues for peptide-independent bridging of T cell receptor and major histocompatibility complex by nickel. J Exp Med, 2003; 197: 1345-1353. 60. Lu L, Vollmer J, Moulon C, Weltzien HU et al. Components of the ligand for a Ni++ reactive human T cell clone. J Exp Med, 2003; 197: 567-574. 61. Chen Y, Kuchroo VK, Inobe J et al. Regulatory T cell clones induced by oral tolerance: suppression of autoimmune encephalomyelitis. Science, 1994; 265: 1237-1240. 62. Rustemeyer T, van Hoogstraten IM, von Blomberg ME et al. Mechanisms in allergic contact dermatitis. In: Textbook of contact dermatitis 3rd edn. Rycroft RJG, Menné T, Frosch PJ, Lepoittevin J-P, eds. Springer, Berlin, Heidelberg, New York, 2001; 13-58. 63. Kapsenberg ML, Res P, Bos JD et al. Nickel-specific T lymphocyte clones derived from allergic nickel-contact dermatitis lesions in man: heterogeneity based on requirement of dendritic antigen-presenting cell subsets. Eur J Immunol, 1987 17: 861-865. 64. Kapsenberg ML, van der Pouw-Kraan T, Stiekema FE et al. Direct and indirect nickel-specific stimulation of T lymphocytes from patients with allergic contact dermatitis to nickel. Eur J Immunol, 1988; 18: 977-982. 65. Hauser C. Cultured epidermal Langerhans cells activate effector T cells for contact sensitivity. J Invest Dermatol, 1990; 95: 436-440. 66. Silvennoinen-Kassinen S, Poikonen K, Ikaheimo I. Characterization of nickel-specific T cell clones. Scand J Immunol, 1991; 33: 429-434. 67. Kondo S, Beissert S, Wang B et al. Hyporesponsiveness in contact hypersensitivity and irritant contact dermatitis in CD4 gene targeted mouse. J Invest Dermatol, 1996; 106: 993-1000. 68. Kapsenberg ML, Wierenga EA, Stiekema FEM et al. Th1 lymphokine production profiles of nickel-specific CD4+ T-lymphocyte clones from nickel contact allergic and non-allergic individuals. J Invest Dermatol, 1992; 98: 59-63. 69. Gocinski BL, Tigelaar RE. Roles of CD4+ and CD8+ T cells in murine contact sensitivity revealed by in vivo monoclonal antibody depletion. J Immunol, 1990; 144: 4121-4128. 70. Anderson C, Hehr A, Robbins R et al. Metabolic requirements for induction of contact hypersensitivity to immunotoxic polyaromatic hydrocarbons. J Immunol, 1995; 155: 3530-3537. 71. Bour H, Peyron E, Gaucherand M et al. Major histocompatibility complex class I-restricted CD8+ T cells and class II-restricted CD4+ T cells, respectively, mediate and regulate contact sensitivity to dinitrofluorobenzene. Eur J Immunol, 1995; 25: 3006-3010. 72. Xu H, Dilulio NA, Fairchild RL. T cell populations primed by hapten sensitization in contact sensitivity are distinguished by polarized patterns of cytokine production: interferon ?-producing (Tc1) effector CD8+ T cells and interleukin (IL) 4/IL-10-producing (Th2) negative regulatory CD4+ T cells. J Exp Med, 1996; 183: 1001-1012. 73. Probst P, Kuntzlin D, Fleischer B. TH2-type infiltrating T cells in nickel-induced contact dermatitis. Cell Immunol, 1995; 165: 134-140. 74. Moulon C, Wild D, Dormoy A et al. MHC-dependent and -independent activation of human nickel-specific CD8+ cytotoxic T cells from allergic donors. J Invest Dermatol, 1998; 111: 360-366. 75. Cavani A, Mei D, Guerra E et al. Patients with allergic contact dermatitis to nickel and nonallergic individuals display different nickel-specific T cell responses. Evidence for the presence of effector CD8+ and regulatory CD4+ T Cells. J Invest Dermatol, 1998; 111: 621-628. 76. Cavani A, Nasorri F, Prezzi C et al. Human CD4+ T lymphocytes with remarkable regulatory functions on dendritic cells and nickel-specific Th1 immune responses. J Invest Dermatol, 2000; 14: 295-302. 77. Sebastiani S, Albanesi C, Nasorri F et al. Nickel-specific CD4+ and CD8+ T cells display distinct migratory responses to chemokines produced during allergic contact dermatitis. J Invest Dermatol, 2002; 118: 1052-1058. 78. Albanesi C, Cavani A, Girolomoni G. IL-17 is produced by nickel-specific T lymphocytes and regulates I-CAM-1 expression and chemokine production in human keratinocytes: synergistic or antagonist effects with IFN- and TNF-. J Immunol, 1999; 162: 494-502. 79. Kehren J, Desvignes C, Krasteva M et al. Cytotoxicity is mandatory for CD8+ T cell-mediated contact hypersensitivity. J Exp Med, 1999; 189: 779-786. 80. Traidl C, Sebastiani S, Albanesi C et al. Disparate cytotoxic activity of nickel-specific CD8+ and CD4+ T cell subsets against keratinocytes. J Immunol, 2000; 165: 3058-3064. 81. Bos JD, Hagenaars C, Das PK et al. Predominance of “memory” T cells (CD4+, CDw29+) over “naive” T cells (CD4+, CD45R+) in both normal and diseased human skin. Arch Dermatol Res, 1989; 281: 24-30. 82. Picker LJ, Kishimoto TK, Smith CW et al. ELAM-1 is an adhesion molecule for skin-homing T cells. Nature, 1991; 796-799. 83. Santamaria Babi LF, Picker LJ, Perez Soler MT et al. Circulating allergen-reactive T cells from patients with atopic dermatitis and allergic contact dermatitis express the skin-selective homing receptor, the cutaneous lymphocyte-associated antigen. J Exp Med, 1995; 181: 1935-1940. 84. Fuhlbrigge RC, Kieffer JD, Armerding D et al. Cutaneous lymphocyte antigen is a specialized form of PSGL-1 expressed on skin-homing T cells. Nature, 1997; 389: 978-981. 85. Christensen OB, Lindström C, Löfberg H et al. Micromorphology and specificity of orally induced flare-up reactions in nickel-sensitive patients. Acta Derm Venereol, 1981; 61: 505-510. 86. Gawkrodger DJ, McVittie E, Hunter JAA. Immunophenotyping of the eczematous flare-up reaction in a nickel-sensitive subject. Dermatologica, 1987; 175: 171-177. 87. Boscolo P, Andreassi M, Sabbioni E et al. Systemic effects of ingested nickel on the immune system of nickel sensitised women. Life Sci, 1999; 64: 1485-1491. 88. Di Gioacchino M, Boscolo P, Cavallucci E et al. Lymphocyte subset changes in blood and gastrointestinal mucosa after oral nickel challenge in nickel-sensitized women. Contact Dermatitis, 2000; 43: 206-211. 89. Jensen CS, Lisby S, Larsen JK et al. Characterization of lymphocyte subpopulations and cytokine profiles in peripheral blood of nickel-sensitive individuals with systemic contact dermatitis after oral
nickel exposure. Contact Dermatitis, 2004; 50(1): 31-38. 90. Nickel. Medical and biological effects on environmental pollutants. Natl Acad of Sci. Washington D.C. 1975. 91. Duke JM. Nickel in rocks and ores. In: Nickel in the environment. Nriagu JO ed. John Wiley and Sons, Inc., New York, 1980; 51-60. 92. Warner JS. Occupation exposure to airborne nickel in producing and using primary nickel products. In: Nickel in the human environment. IARC scientific publication no 53. Sunderman Jr. FW, Aitio A, Berlin A eds. International Agency for Research on Cancer, Lyon, 1984; 419-437. 93. United Nations. Commodity production data 1960-69. In: The growth of world industry. 1969. Vol. II. New York, 1971. 94. Nickel Institute website, 2005. www.nickelinstitute.org/index.cfm/ci_id/14/la_id/1.htm. 95. World Health Organization. Quality directive of potable water, WHO 2nd edn., Geneva, 1994: 197. 96. Schroeder HA, Balassa JJ, Tipton IH. Abnormal trace metals in man - nickel. J Chron Dis, 1962; 15: 51-65. 97. Tipton IH, Stewart PL, Dickson J. Patterns of elemental excretion in long term balance studies. Health Physics, 1969; 16: 455-462. 98. Veien NK, Andersen MR. Nickel in Danish food. Acta Derm Venereol, 1986; 66: 502-509. 99. Larsen EH, Andersen NL, Møller A, Petersen A, Mortensen GK, Petersen J (2002): Monitoring the content and intake of trace elements from food in Denmark. Food. Addit. Contam., 19: 33-46 100. Fødevaredirektoratet. Nikkelallergi og mad. Ministeriet for Fødevarer, Landbrug og Fiskeri. 2004. 2. udgave. www.foedevareallergi.dk. 101. Smart GA, Sherlock JC. Nickel in foods and the diet. Food Addit Contam, 1987; 4: 61-71. 102. Barberá R, Farré R, Mesado D. Oral intake of cadmium, cobalt, copper, iron, lead, nickel, manganese and zinc in the University students' diet. Nahrung, 1993; 37: 241-245. 103. Dabeka RW, McKenzie AD. Survey of lead, cadmium, fluoride, nickel, and cobalt in food composites and estimation of dietary intakes of these elements by Canadians in 1986-1988. J AOAC Int, 1995; 78: 897-909. 104. Biego GH, Joyeux M, Hartemann P et al. Daily intake of essential minerals and metallic micropollutants from foods in France. Sci Total Environ, 1998; 217: 27-36. 105. Stelz A, Lindemann P, Wojke B et al. Nutritional content in the daily diet from selected nursing homes for the elderly in the German state of Hessen. Second Report-minerals. Z Ernährungswiss/Eur J Nutr, 1998; 37: 269-278. 106. Ysart G, Miller P, Croasdale M et al. 1997 UK Total Diet Study - dietary exposures to aluminium, arsenic, cadmium, chromium, copper, lead, mercury, nickel, selenium, tin and zinc. Food Addit Contam, 2000; 17: 775-786. 107. Gillian, Y., Miller, P., Croasdale, M. et al. 1997 UK Total Diet Study – dietary exposures to aluminium, arsenic, cadmium, chromium, copper, lead, mercury, nickel, selenium, tin and zinc. Food Additives and Contaminants, 1999; 17: 775-786. 108. UK EGVM [Expert group on Vitamins and Minerals]. Intakes of nickel from food in the UK. Revised Review of Nickel. EVM/99/24.REVISEDAUG2002. UK. August, 2002. 109. McNeely MD, Nechay MW, Sunderman Jr. FW. Measurements of nickel in serum and urine as indices of environmental exposure to nickel. Clin Chem, 1972; 18: 992-995. 110. Punsar S, Erämetsä O, Karvonen MJ et al. Coronary heart disease and drinking water. A search in two Finnish male cohorts for epidemiologic evidence of a water factor. J Chron Dis, 1975; 28: 259-287. 111. Clemente GF, Cigna Rossi L, Santaroni GP. Nickel in food and dietary intake of nickel. In: Nickel in environment. Nriagu JO ed. John Wiley & Sons, New York, 1980; 493-498. 112. Schuhmann H. The nickel contamination of surface and potable water and some of its causal factors (Ger.). In: 3. Spurenelement-Symposium Nickel. Anke M, Schneider H-J, Brückner C, eds. Karl-Marx-Universität, Jena, Friedrich-Schiller-Universität, Leipzig, 1980; 155-161. 113. Méranger JC, Subramanian KS, Chalifoux C. Survey for cadmium, cobalt, chromium, copper, nickel, lead, zinc, calcium, and magnesium in Canadian drinking water supplies. J Assoc Off Anal Chem, 1981; 64: 44-53. 114. Andersen KE, Nielsen GD, Flyvholm MA et al. Nickel in tap water. Contact Dermatitis, 1983; 9: 140-143. 115. Andersen JN, Stamer C. Fjernelse af metaller fra grundvand ved traditionel vandbehandling på danske vandværker. Arbejdsrapport fra Miljøstyrelsen nr. 117, 1999. 116. Miljø- og Energiministeriet. Bekendtgørelse om vandkvalitet og tilsyn med vandforsyningsanlæg nr. 871 af 21. september 2001. 117. Kate Nielsen, Asbjørn Andersen. Metalafgivelse til drikkevand (Metal release to drinking water), Environmental Project No. 603, Danish EPA 2001. FORCE Institute. www.mst.dk/udgiv/publikationer/2001/87-7944-526-8/html 118. Katz SA, Samitz MH. Leaching of nickel from stainless steel consumer commodities. Acta Derm Venereol, 1975; 55: 113-115. 119. Christensen OB, Möller H. Release of nickel from cooking utensils. Contact Dermatitis, 1978; 4: 343-346. 120. Brun R. Nickel in food: the role of stainless-steel utensils. Contact Dermatitis, 1979; 5: 43-45. 121. Smart GA, Sherlock JC. Nickel in foods and the diet. Food Addit Contam, 1987; 4: 61-71. 122. Kuligowski J, Halperin KM. Stainless steel cookware as a significant source of nickel, chromium, and iron. Arch Environ Contam Toxicol, 1992; 23: 211-215. 123. Vrochte H, Schatzke M, Dringenberg E et al. Untersuchungen zur Frage der Nickelfreisetzung aus Edelstahlkochtöpfen. Z Ernährungswiss, 1991; 30: 181-191. 124. Flint GN, Packirisamy S. Systemic nickel: the contribution made by stainless-steel cooking utensils. Contact Dermatitis, 1995; 32: 218-224. 125. Flint GN, Packirisamy S. Purity of food cooked in stainless steel utensils. Food Addit Contam, 1997; 14: 115-126. 126. Accominotti M, Bost M, Haudrechy P et al. Contribution to chromium and nickel enrichment during cooking of foods in stainless steel utensils. Contact Dermatitis, 1998; 38: 305-310. 127. Berg T, Petersen A, Pedersen GA et al. The release of nickel and other trace elements from electric kettles and coffee machines. Food Addit Contam, 2000; 17: 189-196. 128. Sunderman Jr. FW, Hopfer SM, Sweeney KR et al. Nickel absorption and kinetics in human volunteers. Proc Soc Exp Biol Med, 1989; 191: 5-11. 129. Patriarca M, Lyon TDB, Fell GS. Nickel metabolism in humans investigated with an oral stable isotope. Am J Clin Nutr, 1997; 66: 616-621. 130. Diamond GL, Goodrum PE, Felter SP et al. Gastrointestinal absorption of metals. Drug Chem Toxicol, 1998; 21: 223-251. 131. Christensen OB, Lagesson V. Nickel concentration of blood and urine after oral administration. Ann Clin Lab Sci, 1981; 11: 119-125. 132. Sunderman Jr. FW, Dingle B, Hopfer SM et al. Acute nickel toxicity in electroplating workers who accidentally ingested a solution of nickel sulfate and nickel chloride. Am J Ind Med, 1988; 14: 257-266. 133. Hansen JA, Tjell JC. Trace metals in human excretes. In: Slammets jordbrugsanvendelse II. Polyteknisk Forlag, Copenhagen, 1981; 121-124. 134. Horak E, Sunderman Jr. FW. Fecal nickel excretion by healthy adults. Clin Chem, 1973; 19: 429-430. 135. Sumino K, Hayakawa K, Shibata T et al. Heavy metals in normal Japanese tissues. Amounts of 15 heavy metals in 30 subjects. Arch Environ Health, 1975; 30: 487-494. 136. Veien NK, Hattel T, Justesen O et al. Dietary treatment of nickel dermatitis. Acta Derm Venereol, 1985; 65: 138-142. 137. Veien NK, Hattel T, Laurberg G. Low nickel diet: an open, prospective trial. J Am Acad Dermatol, 1993; 29: 1002-1007. 138. Antico A, Soana R. Chronic allergic-like dermatopathies in nickel-sensitive patients. Results of dietary restrictions and challenge with nickel salts. Allergy Asthma Proc, 1999; 20: 235-242. 139. Gawkrodger DJ, Shuttler IL, Delvis HT. Nickel dermatitis and diet: clinical improvement and a reduction in blood and urine nickel levels with a low-nickel diet. Acta Derm Venereol, 1988; 68: 453-455. 140. Abeck D, Traeckner I, Steinkraus V et al. Chronic urticaria due to nickel intake. Acta Derm Venereol, 1993; 73: 438-439. 141. Nielsen GD, Jepsen LV, Jørgensen PJ et al. Nickel-sensitive patients with vesicular hand eczema: oral challenge with a diet naturally high in nickel. Br J Dermatol, 1990; 122: 299-308. 142. Christensen JM, Kristiansen J, Nielsen NH et al. Nickel concentrations in serum and urine of patients with nickel eczema. Toxicol Lett, 1999; 108: 185-189. Bilag A
TABELLERTabel 1. Karakteristika for de forskellige studier.
*Gennemsnitlig eksponeringsdosis. Personer blev eksponeret for 12 µg/kg kropsvægt. Tabel 2. Rapporterede niveauer af nikkel i daglig kost (G per dag).
Tabel 3. Rapporterede niveauer af nikkel i drikkevand (G per dag).
Tabel 4.1. Responsrater på Ni-doser (mg) i hvert studie (antal positive/total antal individer).
*Gennemsnitlig eksponeringsdosis. Personer blev eksponeret for 12 µg/kg kropsvægt. Tabel 4.2. Parvis test af dosis-responseffekter.
*Da kun 17 ud af 28 individer i studie 2 blev testet med placebo er antallet i 2,5 mg Ni gruppen proportionelt reduceret. Tabel 4.3. Resulter af logistisk dosis-responsanalyser.
Tabel 4.4. Dosis-responsdata brugt i logistiske regressionsanalyser i tabel 4.5 og 4.6.
*Denne responsrate blev benyttet i analysen i stedet for en rate på 9 % som sås ved Ni-dosis på 0,6 mg. Tabel 4.5. Resultat af trinvis logistisk regressionsanalyse.
Tabel 4.6. Resultat af logistisk regressionsanalyse, som kombinerer studie 11, 12 og 14.
Tabel 4.7. Dosis-responsdata brugt i logistiske regressionsanalyser i tabel 4.8 og 4.9.
*Denne responsrate blev benyttet i analysen i stedet for en rate på 9 % som sås ved Ni-dosis på 0,6 mg. Tabel 4.8. Resultat af trinvis logistisk regressionsanalyse.
Tabel 4.9. Resultat af trinvis logistisk regressionsanalyse, den endelige model.
Tabel 4.10. Estimerede værdier for ED50 og lavere doser baseret på den logistiske model i tabel 4.9.
*Kun data fra enkelteksponeringsdelen af studiet er medtaget. Bilag B
FIGURERFigur 1.1. Observeret frekvens af positivt respons med 95 % konfidensgrænser.
Figur 1.2. Observerede responsrater med 95 % konfidensgrænser og tilpassede dosis-responskurver i studier med enkelteksponering. Studie 1, 2, 3, 4, 8, 9, 10 (kun enkelteksponeringsdata), 13, 15, 16 og 17 danner en homogen gruppe med en fælles dosis-responskurve (sort), studie 11, 12 og 14 danner en anden fælles gruppe (grøn), som er signifikant forskellig, og studie 6 (rød) er forskellig fra begge de kombinerede grupper af studier.
Figur 1.3. Observerede responsrater med 95 % konfidensgrænser og tilpassede dosis-responskurver i studier med enkelteksponering og ingen positive respons på placebo. Studie 2, 3, 4, 8, og 10 (kun enkelteksponeringsdata) danner en homogen gruppe med en fælles dosis-responskurve (sort), studie 1 og 11 danner en anden fælles gruppe (grøn), som er signifikant forskellig, og studie 9 og 16 danner en tredje gruppe (rød), som er signifikant forskellig fra begge de andre kombinerede grupper af studier.
Figur 1.4. ED50 med 95 % konfidensgrænser. 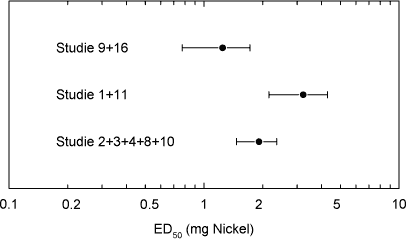
Figur 1.5. ED10 med 95 % konfidensgrænser.
Figur 1.6. ED1 med 95 % konfidensgrænser.
Bilag C
APPENDIKS 1.The logistic dose-response model used in the analyses describes the probability p(x) of a positive response in a single patient exposed to the Ni- dose x as: p(x) =1/[1+exp(-α-βlog(x))] α and β are the parameters of the dose-response model. The parameter β is denoted the slope of the dose-response curve, since it is proportional to the slope of the steepest part of the sigmoid dose-response curve. is denoted the constant or position parameter of the dose-response curve. However, the so-called median effective dose ED50 is normally used to characterize the dose response curve in aδition to β. ED50 is the dose that corresponds to p(x) = 0.5 or the dose that will elicit a positive response in 50 % of the population, and it is calculated as ED50 = exp(α/β). If log(p(x)/(1-p(x)) is plotted against log(x) a straight line is obtained. For this reason the above dose-response model is also denoted the linear logistic model. The number of patients y with positive response in a group of n patients tested with the same dose x is assumed to follow a binomial distribution with parameter p(x). With data from two or more separate (independent) groups of patients tested with different doses of Ni it is possible to estimate α and β, provided not all response rates (y/n) are equal and at least two are different and greater than 0 and smaller than 1. In that case it is also possible to test the significance of the dose-response dependence, i.e. the null hypothesis: β = 0. Furthermore with three or more intermediate response rates > 0 and < 1 it is also possible to test the goodness fit of the logistic dose-response model. The so-called multiple logistic regression analysis extends the logistic dose-response to allow a simultaneous analysis of several dose-response relations. With dose-response data from k studies the multiple logistic model may be defined as: p(x1, ..., xk) = 1/exp(-α-β1log(x1)- ...-βklog(xk)) This model allows different slopes for each dose variable. Another multiple logistic model is: p(x1, ..., xk) = 1/exp(-α1-...-αk-β(log(x1)+...+log(xk))) This one assumes the same slope but different positions, i.e. parallel dose-response curves. The most general multiple linear logistic model is the one with k different α's and k different β's. However, in the present analyses it is not possible to apply the most general model, because it requires that individual models can be estimated with the data from each individual study. The model with a common α and different β's is not very plausible since it assumes that all dose-response curves intersect at some dose. Therefore, the only useful model for studying the properties of the dose-response relations in a number of studies seems to be the one with different α's and the same β, i.e. a series of parallel dose-response curves. By means of the strategy of stepwise-multiple regression analysis it is possible to determine which α's that are significantly different, and which can be assumed equal. The model above is modified to the following: p(x) = 1/exp(-α-δ1...-δk-δlog(x)) The parameter α now denotes the average of the k individual α's, while the δ's represent the deviations between the average and the individual α's. Thus, by testing nil hypotheses for the δ's it is possible to determine which studies differ from the average. Depending of the outcome of the stepwise analysis that eventually provides the (sub)set of significant δ's, the analysis is continued to determine if some of the significant δ's can be assumed equal, and the analysis is stopped, when no more reduction is possible. From the estimated values of the model parameters: α, β, δ1, ..., δk is it possible to calculate the dose that corresponds to a given value of the probability of positive response or the fraction of patients in the population. Inversion of the dose-response model gives the following equation for calculation of the dose associated with a response rate of 100·p %.
Inserting the estimated values of α, β, δ1, ..., δk enables calculation of the doses corresponding to the chosen value for p for any study group. Moreover, it is possible to determine 95 % limits for ED100·p by Fieller's method and the asymptotic covariance matrix of the parameter estimates which is obtained from the logistic regression analysis. The modification of the logistic model in case of a positive background response rate will briefly be outlined. Denoting the probability of a positive response to placebo (or Ni-dose 0) by p0, the simplest dose-response model may be written as: p(x) = p0 + (1p0)/[1+exp(-α-βlog(x))] In order to successfully estimate such a dose-response model it is necessary to have relative precise estimates of the response rate at dose zero and at least at two higher doses where the response rates are higher and increase with the dose. The interpretation of the parameters α and β and ED50 will change and depend on the value of p0. Thus, this model is not very attractive. Table 3.2.2 shows an example of its application in the analysis of the data from study 16. Finally, it will be pointed out that the above-mentioned dose-response modelling analysis does not apply to the experimental situation where the same group of patients is tested with different doses, incl. dose 0. In this case the responses represent non-independent (correlated) binomial data, and special methods are required. One of these would be to regard the increasing response rate as observations of the tolerance of the patients. This requires the implicit assumption that if a patient has shown a positive reaction to a given dose that person will also show a positive reaction to all higher doses. This may be checked by inspection of the individual responses to the doses in question, but the reported response rates do not contain this information except when none or all patients react. Table 3.2.2 shows an example of estimation of the dose-response relation as a tolerance (logistic) distribution curve based on the data from study 3.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||