|
Økologisk byfornyelse og spildevandsrensning Nr. 54 2005 Risikovurdering af anvendelse af lokalt opsamlet fæces i private havebrugIndholdsfortegnelse
3 Risikovurdering af kemiske stoffer
5 Humanpatogene mikroorganismer i lokalt komposteret human fæces
Bilag A: Litteraturstudie for incidens, varighed og udskillelse Bilag B: Litteraturstudie på henfaldsrater i fæces og på/i jord Bilag C: Beregningsmetoder samt fordelinger af input-parametre Bilag D: Beregningsresultater af den mikrobielle risikovurdering ForordNærværende rapport er et resultat af en kvantitativ risikovurdering vedrørende anvendelse af lokal opsamling og håndtering af fæces. Rapporten har som formål at vurdere risici for mennesker ved lokal anvendelse (som kolonihaver, nyttehaver og parcelhaver). For mennesker er risici i denne forbindelse defineret som infektion fra patogener eller påvirkning af kemiske stoffer, herunder medicinrester. Påvirkningerne kvantificeres ud fra en kemisk og en mikrobiel risikovurdering. Resultatet af undersøgelsen kan ikke generaliseres til centraliserede anvendelser, dels fordi man der vil forlange en behandling inden udspredning i naturen og dels fordi der generelt sker en udjævning således at der som udgangspunkt hyppigt vil være smitstoffer og kemiske stoffer, men i lavere koncentrationer end fra husholdninger, hvor der vil være perioder hvor materialet er uskadeligt og andre perioder, hvor der er et højt indhold af patogener og/eller kemiske stoffer. Udgangspunktet for undersøgelsen er, at der vil blive tale om få anlæg i Danmark. Fra udlandet er det kendt, at lokal håndtering af fæces som beskrevet i nærværende rapport vil medføre en øget forekomst af patogener. I nærværende rapport tages udgangspunkt i skøn over den aktuelle sundhedstilstand i Danmark og ikke et fremtidigt scenarium, hvor en sådan anvendelse er blevet udbredt. Analysen fokuserer på påvirkning af mennesker under tømning og udbringning af lokalt håndteret fæces i haven og brug i haven det efterfølgende sommerhalvår. Såfremt der dyrkes spiseklare afgrøder i haven kan der også opstå eksponering i forbindelse med tilberedning og indtagelse af maden i huset, men denne eksponeringsvej er ikke medtaget i beregningerne. Nærværende undersøgelse sker i forlængelse af en række andre risikovurderinger finansieret af Miljøstyrelsen. Hvor det har været muligt er der benyttet samme paradigma som i disse undersøgelser, ligesom data fra disse undersøgelser indgår i beregningerne. Rapporterne er udgivet af Miljøstyrelsen enten som Miljøprojekter (nr. 606, 684) eller som rapporter i serien Økologisk byfornyelse og spildevandsrensning (nr. 1, 6, 10, 14 og 19). Parallelt med nærværende undersøgelse foretages en risikovurdering ved brug af human urin (Hald og Andersen, 2003). Nærværende rapport er udarbejdet af en arbejdsgruppe bestående af: Karsten Arnbjerg-Nielsen, COWI Linda Hansen, COWI Jesper Kjølholt, COWI Frank Stuer-Lauridsen, COWI Arne Bernt Hasling, COWI Niels Jørgen Hansen, COWI Thor Axel Stenström, Smittskyddsinstitutet, Sverige Caroline Schönning, Smittskyddsinstitutet, Sverige Therese Westrell, Smittskyddsinstitutet, Sverige Anders Carlsen, Embedslægeinstitutionen i Viborg Bent Halling-Sørensen, Bent Halling-Sørensen ApS Der har som følgegruppe for projektet været nedsat følgende følgegruppe: Linda Bagge, Miljøstyrelsen (Formand) Line Hollesen, Miljøstyrelsen Karsten Arnbjerg-Nielsen, COWI (Sekretær) Ole Mygind, Sundhedsstyrelsen Efter 1. februar 2003: Lis Keiding Jens Strodl Andersen, Danmarks Veterinærinstitut Jacob Møller, Forskningscenteret for Skov og Landskab Der har i løbet af projektet været afholdt 3 møder, hvor følgegruppen har bidraget positivt til rapportens udformning og indhold. Projektet er finansieret af Miljøstyrelsen som led i Aktionsplan for økologisk byfornyelse og spildevandsrensning. Sammenfattende artikelHuman fæces kan anvendes til gødningsformål i f.eks. parcelhushaver. Nytteværdien bør dog holdes op mod risikoen for at blive syg på grund af denne anvendelse. For en familie med 4 personer er der ca. 11% sandsynlighed for, at mindst et medlem af familien i løbet af et år har været smittet og udskilt sygdomsfremkaldende organismer som vil inficere det opsamlede fæces. Nogle af organismerne overlever længe, især parasitter. Undersøgelsen har vist, at der er en væsentlig risiko for infektion ved anvendelse af det helt eller delvist komposterede fæces, selv hvis komposten lagres i et år inden udbringning. Indholdet af medicinrester og miljøfremmede stoffer i fæces medfører ikke tilsvarende øjeblikkelige sundhedsrisici for mennesker. Baggrund og formål
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stof | PNEC | PEC | RQ |
| Østradiol | 8,5 pg/kg | 350 ng/kg | 41.000 |
| Ibuprofen | 1,8 mg/kg | 2,6 mg/kg | 1,5 |
| Digoxin | 0,06 mg/kg | 0,003 mg/kg | 0,05 |
Mikrobiel risikovurdering
Lokal kompostering sker under forhold, der ikke sikrer en effektiv barriere mod smitte og påvirkning. Eksponeringen vil afhænge såvel af de forhold der er under den lokale kompostering som af de konkrete processer der udføres, såsom håndtering af kompostbeholderen, spredning i haven, ophold i have med udspredt kompost.
I forbindelse med en infektion udskilles typisk milliarder af infektiøse organismer. Som led i projektet er der indsamlet oplysninger om hvilke patogener det er relevant at regne på, hvor mange personer der årligt inficeres i Danmark, hvor mange infektiøse organismer der udskilles under infektionen og hvor hurtigt de henfalder i fæces og efter udbringelsen på jorden.
Mennesker eksponeres ved tømning og udbringning af materialet i haven samt løbende det følgende år under havearbejde samt tilfældigt ophold i haven. Beregningsmæssigt skelnes ikke mellem husstandens medlemmer og gæster. Dette giver formodentlig en overvurdering af risikoen for infektion pr. år, fordi husstandens medlemmer vil være helt eller delvist immune overfor det pågældende patogen, som husstanden har været eksponeret overfor.
Beregning og vurdering af risiko
Der er væsentlig usikkerhed på alle de beskrevne processer. Derfor er resultatet af risikovurderingen også behæftet med en betydelig usikkerhed. Risikovurderingen angiver en "typisk" risiko og en "worst case" risiko. Den "typiske" risiko svarer til en typisk udskillelse fra det inficerede familiemedlem, en typisk eksponering og en typisk person der eksponeres. "Worst case" risiko er de tilfælde hvor en eller flere af ovennævnte faktorer medfører en meget højere risiko end normalt og som sammenlagt forekommer i op til 5% af eksponeringerne.
Efter et års fyldningsperiode med fæces fra fire personer vil gennemsnitligt 11,6% af beholderne være inficeret af en eller to patogener som følge af sygdom/smittebærer i familien, se tabel 0.2. Ved en efterfølgende lagring i 12 måneder vil Salmonella og EHEC beregningsmæssigt typisk være henfaldet til et niveau der er under beregningsprogrammets nøjagtighed mens der stadig vil være en risiko for infektion med de øvrige patogener.
Hvis der er udskilt Ascaris til beholderen er det beregningsmæssigt sikkert, at den person der tømmer beholderen og udspreder den på jorden vil blive inficeret. Til gengæld er udskilning af Ascaris ret sjælden, hvorfor risikoen ved eksponering overfor en tilfældig beholder ikke er meget større end de øvrige patogener.
Table 0.2 Sandsynligheden for, at der er udskilt patogener i beholderen i løbet af året. Beregningerne er foretaget med de typiske værdier for incidenser i en husstand med 4 personer.
| Typisk sandsynlighed for inficeret beholder | |
| 0 patogener | 88,4 % |
| 1 patogen | 11,1 % |
| 2 patogener | 0,5 % |
| Mere end 2 patogener | 0,0 % |
Tabel 0.3 Tømning af beholder og udbringning af materiale opbevaret i 12 måneder. For toksisk E. coli er risikoen for infektion negligibel i beregningen af den typiske risiko.
| Typisk beregning | Worst case beregning | |||
| Risiko, hvis beholderen er inficeret | Risiko, tilfældig beholder | Risiko, hvis beholderen er inficeret | Risiko, tilfældig beholder | |
| Salmonella | meget lav | meget lav | 6 10-11 | 1 10-12 |
| Toksisk E. coli | meget lav | meget lav | meget lav | meget lav |
| Rotavirus | 4 10-5 | 2 10-6 | 7 10-1 | 3 10-2 |
| Hepatitis A | 2 10-9 | 4 10-13 | 2 10-4 | 5 10-8 |
| Giardia | 3 10-15 | 1 10-16 | 8 10-5 | 4 10-6 |
| Cryptosporidium | 4 10-7 | 3 10-9 | 2 10-3 | 2 10-5 |
| Ascaris | 7 10-2 | 6 10-5 | 1 | 9 10-4 |
Summary and conclusions
Introduction
Closing the nutrient cycle in urban areas is a major task for the future. Faeces and urine, as well as mixed sewage products need in this context to be seen as resources rather than as wastes. Hazards associated with recycling of these products include pathogens and pharmaceuticals as well as other organic contaminants/compounds and heavy metals. By treatment it is possible to reduce the number of pathogens, and pharmaceuticals and organic compounds may be degraded to some extent. Heavy metals are, however, not possible to eliminate.
From a hygienic risk perspective faeces should always be considered to contain pathogens. There are a wide range of pathogens, mainly causing gastro-intestinal infections, that may be excreted. When recycling other fractions such as urine or greywater, the potential faecal contamination and related pathogens may constitute the main risk. To evaluate and compare different sanitation systems including reuse of the waste products microbial risk assessment is a valuable tool that allows prospective studies. Epidemiological investigations often require larger study populations, and are mainly applicable when the practises are already in place.
Pharmaceuticals are, by nature, biologically active compounds where some are used and emitted in large quantities from society e.g. antibiotics and compounds for treatment of life-style related diseases. Pharmaceuticals are excreted with faeces and urine after normal therapeutical use and if the faeces or urine is re-cycled, pharmaceutical residues will end up in the environment. It is often anticipated that pharmaceuticals are degradable by microorganisms, since they are transformed by metabolisms in man, but according to the available data biodegradation is actually limited for some groups of compounds. Daily use of a certain type of drug may even lead to very high concentration of the compound in faeces (mg to g/kg faeces). The environmental hazard of pharmaceuticals and exposure assessment of pharmaceuticals to the environment have previously been addressed.
In addition to pharmaceuticals, humans are exposed to numerous other chemical substances, e.g. heavy metals and dioxins, which are present at low levels in food, water and ambient air. These persistent micro-pollutants of high environmental concern are also excreted with faeces but the hazard from the local handling of this material has not previously been assessed.
The case scenarios
The current project was aimed at assessing the risks both to humans and the environment from pathogens and pharmaceutical residues associated with usage of faeces within private households. The faeces were collected from dry urine-diverting toilets in single family households and used in their own gardens as a fertiliser. The faeces were only treated by means of storage prior to the application in the garden and, thus, the material was neither fully stabilized, nor were the pathogens fully inactivated. The following scenarios were evaluated:
1. Application of the material after storage for 0 months
2. Application of the material after storage for 6 months
3. Application of the material after storage for 12 months
4. Application and incorporation of the material after storage for 6 months
5. Application and incorporation of the material after storage for 12 months
In this case application means that the faeces is distributed evenly on top of the soil (i.e. mixed with the upper 1 cm of soil), while incorporation means that the material is actually worked into the upper layer of the soil, resulting in a faeces to soil ratio of around 1:100 compared to a ratio of 1:10 when the faeces is just applied on top of the soil.
Applied risk assessment procedures
Pathogens
Risk identification. For analysing the risks from pathogens, representatives from the various groups of microorganisms were chosen based on the following criteria:
- The organisms should be relatively common in Denmark
- The most persistent microorganisms should be included
- Organisms having low infectious doses should be included
- Some organisms causing infections potentially giving severe symptoms should be included
- There should be reasonable knowledge of the organism
As representatives for the bacterial group Salmonella and EHEC were chosen, and among the viruses, rotavirus and hepatitis A. To model parasites the protozoa Giardia and Cryptosporidium as well as the helminth Ascaris were chosen. All the pathogens included are transmitted through the faecal-oral route. Apart from hepatitis A they all cause gastro-intestinal infections, but further severe symptoms involving other organs may also occur.
Assessment of exposure. Each organism was modelled by means of distributions, i.e. probability density functions (PDFs), for incidence in the population, excretion and duration of infection as well as die-off in the storage container and die-off in the soil after application of the material in the garden.
Incidence data was mainly collected from Danish statistics, where Salmonella, EHEC, hepatitis A and Giardia are officially reported. Surveillance systems are however considered to underestimate the actual number of cases occurring in the population and the reported numbers were therefore corrected based on expert guesses, assuming higher underestimations for infections with less severe symptoms. Estimates of rotavirus and Ascaris infections in the population was made from extrapolation of the number of positive samples registered at Statens Serum Institut, Denmark whereas estimates of Cryptosporidium was based on incidence estimated by Hald and Andersen. The number of excreted pathogens i.e. their concentration in faeces, and the duration of excretion were collected from the literature. A critical step affecting the risks is the inactivation of the various pathogens in the collection and storage container (the container in which the faeces is collected is stored without addition of new material). Since available studies on the survival of pathogens in human faeces are limited, results from studies involving other materials such as animal manure and sewage sludge were also evaluated in order to establish PDFs for the inactivation. The collection and storage was assumed to take place indoors at a temperature around 20°C. The survival of microorganisms in soil is dependent on local conditions, e.g. soil type, moisture, UV-light and the naturally occurring microflora. To describe the inactivation in soil at an average ambient temperature of approx. 11°C, results from studies conducted in various types of soils were consolidated to create the PDFs. The PDFs representing the input data are summarised in table 1.
By combining the data the concentration of pathogens in the faeces after the different storage periods and in the soil after application and incorporation, including continuous inactivation, were calculated.
The actual human exposure was assumed to take place during one of three events, where accidental ingestion of small amounts of faeces or faeces and soil mixture may occur:
- Emptying of the container and distribution of the material
- Recreational activities in the garden
- Gardening
The faeces-soil intake was based on a literature study. Children are estimated to ingest around 200 mg of soil per day on an average with an absolute maximum of 5-10 g per day, occurring once every ten years by exposure each day. It was further assumed that adults ingest 15-50% of this amount , with a maximum of 100 mg per day. The container is emptied once a year, assuming that only adults are exposed. Modelling of the number of exposures through recreation resulted in a median value (50-percentile) of 3.5 times per week (during June-August), whereas 50% of the persons were exposed through gardening once a week (during May-September). An exposed "standard member" of the family was assumed to correspond to 25% child and 75% adult or older child (>6 years). The faeces to soil ratios mentioned above, being approximately equal to the 50-percentile, was used to create distributions for the composition of the faeces and soil mixture. It was further assumed that one exposure corresponded to two hours of gardening, occurring maximum two times per day.
Table 1. Input data used in the QMRA modelling. N (m, s) denotes a normally distributed PDF with mean m and standard deviation s. Some of the input variables are highly skewed to the right, meaning that there are higher probabilities of high numbers than of low numbers. This property of variable Y may be modelled by means of a log-normal distribution, i.e. ln(Y) is a normally distributed PDF.
| Microorganism | Incidence[per 100 000] | Excretion noln [per g wet weight] | Excretion timeln [days] | Survival in faeces, T90 [days] | Survival in soil, T90[days] | Dose-response model |
| Bacteria | ||||||
| Salmonella | N (500; 100) | N (13.8; 2.3) | N (3.6; 0.2) | N (30; 8) | N (35; 6) | Beta-Poisson
ln(N50) ~ N(10; 0.7) =0.3126 |
| EHEC | N (30; 5) | N (5.8; 1.2) | N (2.1; 0.25) | N (20; 4) | N (25; 6) | Exponential
k ~ N(300; 50) |
| Viruses | ||||||
| Rotavirus | N (1200; 200) | N (20.7; 2.3) | N (1.6; 1.25) | N (60; 16) | N (30; 8) | Beta-Poisson
ln(N50) ~ N(1.7; 1.2) =0.265 |
| Hepatitis A | N (6; 1) | N (11.5; 1.2) | N (3.0; 0.25)
median=20 |
N (55; 18) | N (75; 10) | Beta-Poisson
ln(N50) ~ N(3.4; 1.2) =0.2 |
| Parasites | ||||||
| Giardia | N (1100; 100) | N (15.0; 1.7) | N (4.5; 0.7) | N (27.5; 9) | N (30; 4) | Exponential
ln(k) ~ N(3.9; 0.7) |
| Cryptospori-dium | N (200; 25) | N (17.3; 0.6) | N (2.0; 0.85 ) | N (70; 20) | N (495; 182) | Exponential
ln(k) ~ N(5.5; 0.4) |
| Ascaris | N (20; 3) | N (9.2; 0.6) | N (5.5; 0.5) | N (125; 30) | N (625; 150) | Exponential
k=1 |
T90 = time for a 90% reduction
The dose-response relationships. For some pathogens dose-response relationships are relatively well defined and parameters and models can be found in the literature. Information is virtually missing for the susceptible parts of the population, such as children, the elderly or immuno-compromised and are not accounted for in the models. On the contrary, parts of the population are less susceptible, such as previously infected persons. In order to take this inherent variation into consideration the uncertainty of the parameters in the dose-response relationships must be included. As these studies are based on a small sample of individuals the uncertainties of the parameters were enlarged, thus attempting to model the overall variation in the exposed population.
Microbial risk calculation. The risk of infection in the QMRA was calculated applying 5000 iterations in the Monte Carlo simulations. Since many variables are described by means of distributions, calculations of both the realistic impact and also worst-case scenarios were possible, here translated to the 50-percentile and 95-percentile of the resulting distributions, respectively. Calculations were made for two main scenarios i) applying the incidence in the population (unconditional) and ii) assuming that one member of the family actually had an infection during the period of collection (conditional). Results are presented as probability of infection (Pinf) per exposure or per year and compared to an acceptable risk level of 10-4.
Pharmaceuticals and micro-pollutants
Risk identification. Medicine metabolites were evaluated based on the criteria of frequent use in Denmark. The 25 most commonly used pharmaceuticals in the primary health sector in Denmark were assessed. For compounds where data was available a primary environmental hazard assessment for the soil environment and a health hazard assessment of ingesting soil that are polluted with pharmaceuticals were performed. In addition seven heavy metals (Cd, Cr, Cu, Hg, Ni, Pb, Zn) and dioxins (PCDD) were evaluated as representatives for toxic and persistent substances, considered as the micro-pollutants of highest concern in relation to application of faeces in gardens.
Exposure assessment. In the calculations it was assumed that a certain fraction of the drug was excreted with faeces as unchanged compound. Furthermore it was anticipated that compounds were persistent during the storage of faeces. For the exposure assessment of other micro-pollutants it was assumed that no degradation took place neither during storage nor in the soil after application.
Hazard assessment procedure applied in the calculations of risks. The environmental risk assessment was based on the EU draft guideline document for pharmaceuticals, and a risk quotient was calculated between the predicted environmental concentration (based on the scenarios described above) and the predicted no-effect concentration (PNEC) using worst-case assumptions. A default safety factor of 1000 was used to derive the PNECs. The additional safety factors for reduced data sets was not used. If the PEC/PNEC ratio exceed the ratio of 1 it implies that the compound have impact on the environment.
The human health hazard was assessed by an initial calculation of the amount of soil that should be ingested to be exposed for a Daily Defined Dose of the particular drug (DDD). Furthermore a number of cases where a "zero tolerance" perspective should be used were outlined. For the heavy metals and dioxins the environmental hazard assessment was simply based on comparison with existing quality standards for sludge and soil, and the human health assessment upon comparison with TDI-values (Tolerable Daily Intake).
Results and discussion
Calculation of microbial risks. The probability of infections (Pinf) are summarized in tables 2 and 3. The variations in the risk for infection depend on organism and were up to twelve orders of magnitude in a specific scenario. The risk from EHEC can be eliminated if the faeces are stored for one year. Many types of Salmonella are able to regrow in stored, but unstabilized materials, especially if partial wetting occurs. If the risk of regrowth of Salmonella can be ignored the risk of infection from Salmonella may also be ignored. Viruses and parasites generally have longer survival in the environment as well as lower infectious doses which resulted in high risks for rotavirus, the protozoa and Ascaris. It should however be noted that the calculations are based on reported die-off data. An extrapolation is often necessary to cover longer time periods than the actual measured period. Overestimations may occur if the survival curve does not follow first order die-off kinetics in the end of the estimated period. Ascaris, however, have a well documented prolonged survival time. According to table 2 the difference in risk between the conditional and unconditional scenario was 1-4 order of magnitudes and the difference between typical (50%) and worst case (95%) varied from none to 5 orders of magnitude depending on organism.
For viruses and parasites the risk of infection from fresh material is measured in percentages of the infected containers. The risk of infection is thus mainly dependent on the incidences of infections of the pathogen in question. Only after 12 months of storage (scenario 3 and 5) taking incidence into consideration the risks are below 10-4 for all organisms, excluding Ascaris (Pinf 9 x 10-4), when emptying the container and applying the material.
Table 2. Risk for infection when emptying the storage container (is done once per year and household) for scenario 1 (giving the highest risk) and for scenarios 3 and 5 (giving the lowest risk)
| Salmonella | EHEC | Rotavirus | Hepatitis A | Giardia | Crypto-sporidium | Ascaris | ||
| Scenario 1 | conditional 50% | 8 10-7 | 3 10-13 | 8 10-1 | 9 10-3 | 6 10-2 | 6 10-2 | 1 |
| unconditional 50% | 2 10-8 | 4 10-16 | 3 10-2 | 2 10-6 | 2 10-3 | 5 10-4 | 8 10-4 | |
| conditional 95% | 2 10-1 | 9 10-5 | 1 | 6 10-1 | 1 | 1 | 1 | |
| unconditional 95% | 5 10-3 | 1 10-7 | 5 10-2 | 2 10-4 | 5 10-2 | 9 10-3 | 1 10-3 | |
| Scenario 3 & 5 | conditional 50% | n.r. | n.r. | 4 10-5 | 2 10-9 | 3 10-15 | 4 10-7 | 7 10-2 |
| unconditional 50% | n.r. | n.r. | 2 10-6 | 4 10-13 | 1 10-6 | 3 10-9 | 6 10-5 | |
| conditional 95% | 6 10-11 | n.r. | 7 10-1 | 2 10-4 | 8 10-5 | 2 10-3 | 1 | |
| unconditional 95% | 1 10-12 | n.r. | 3 10-2 | 5 10-8 | 4 10-6 | 2 10-5 | 9 10-4 |
nr = negligible risk (<10-14; calculation accuracy of MS Excel)
The typical (50%) yearly risks for gardening and recreation are quite high with a maximum of 4 x 10-2 (0.04) for rotavirus in scenario 1 (0 months of storage; table 3). After storage for 12 months Rotavirus and Ascaris have the highest risk of infection. The risk of being infected by Ascaris is very high if the container was infected. As such it may be concluded that even after 12 months of storage the material must be incorporated properly in the soil in order to make the risks acceptable. These risks were calculated for exposure during May and June, respectively, thus being the highest during the period of activity.
Table 3. Yearly risk for infection (50-percentile representing the typical risk) during gardening and recreational activities in the garden. The numbers indicate the different scenarios for storage and usage of the faeces. Results obtained for the unconditional scenario, i.e. taking incidence into account
| Gardening | Recreational activities in the garden | |||||||||
| Scenario | 1 | 2 | 3 | 4 | 5 | 1 | 2 | 3 | 4 | 5 |
| Salmonella | 2 10-9 | 2 10-15 | n.r. | 2 10-16 | n.r. | 7 10-10 | 6 10-16 | n.r. | 5 10-17 | n.r. |
| EHEC | 2 10-17 | n.r. | n.r. | n.r. | n.r. | n.r. | n.r. | n.r. | n.r. | n.r. |
| Rotavirus | 4 10-2 | 2 10-4 | 2 10-7 | 2 10-5 | 2 10-8 | 3 10-2 | 4 10-5 | 3 10-8 | 4 10-6 | 4 10-9 |
| Hepatitis A | 1 10-6 | 6 10-10 | 3 10-13 | 7 10-11 | 4 10-14 | 1 10-6 | 4 10-10 | 2 10-13 | 5 10-11 | 2 10-14 |
| Giardia | 2 10-4 | 7 10-11 | n.r. | 8 10-12 | n.r. | 5 10-5 | 1 10-11 | n.r. | 2 10-12 | n.r. |
| Cryptosporidium | 1 10-3 | 3 10-6 | 8 10-9 | 3 10-7 | 9 10-10 | 1 10-3 | 3 10-6 | 7 10-9 | 4 10-7 | 9 10-10 |
| Ascaris | 8 10-4 | 7 10-4 | 2 10-4 | 5 10-4 | 2 10-5 | 2 10-3 | 2 10-3 | 2 10-4 | 5 10-4 | 2 10-3 |
The facilities evaluated were based on the idea that the faeces would be composted. This process was however not taking place as indicated by the low temperatures recorded (0-20°C). Thus, the inactivation of pathogens will mainly occur due to time and ambient conditions such as moisture and by competition from other microorganisms. According to the literature the survival of pathogens, especially of protozoa and helminth eggs but also of viruses and some bacteria, can be long during these circumstances. This resulted in high risks for infection, with Ascaris constituting the highest risk. Since this infection is quite uncommon in Denmark, viruses and protozoa infections are of greater concern. A risk of 20%, as was calculated for scenario 1 when not taking incidence into account, may be considered too high for accepting the system with local use of faeces, and far exceeds the risk of 1:10 000 (10-4) per year suggested as an acceptable level. By employing various measures to improve the situation it would however probably be possible to significantly reduce the risks from pathogens. It is difficult to obtain sufficiently high temperatures in small scale composting/dehydrating/storage systems even if other material such as straw or wood chips are added for structure. It is probably easier to add a pH-elevating material such as ash or lime to ensure an inactivation of the pathogens and a stabilization of the material. Exposure to material stored for less than 12 months should be avoided and even after this period exposure should be minimized.
Risks from pharmaceuticals and micro-pollutants
Environmental risk. Predicted environmental concentrations in soil were calculated for the 25 most sold pharmaceuticals in Denmark. For only three of these compounds - Oestradiol, Ibuprofen and Digoxin, effect data on environmental relevant species could be found. The risk quotient RQ defined as, RQ = PEC/PNEC, was calculated for all the scenarios presented above. For the three compounds the following range of RQs applied:
- Oestradiol [41.000- 376.000]
- Ibuprofen [0.3 - 13]
- Digoxin [0.005-0.5]
Results thus clearly show that for two out of the three compounds the PEC/PNEC ratio exceed the ratio of one, and therefore implies that the compound affects the terrestrial environment. It should however be emphasised that the evaluation has been performed on calculations and not using measured concentrations.
Lack of data for toxicity is the primary obstacle for assessing the environmental risk of pharmaceuticals. Nevertheless the results obtained, especially for Oestradiol, imply that this type of compound may affect the environment and suggest that much more effort should be made in order to produce the needed data for a more comprehensive risk analysis.
The levels in faeces of most of the evaluated heavy metals and dioxins were well below existing Danish quality criteria for soil and sludge intended for application on soil with the exception of cadmium and mercury. These metals may be present in faeces at levels about equal to or slightly exceeding the quality standards for use on agricultural soils.
Human health risk. Calculations showed that humans need to consume 200 g to 1 kg soil in order to be exposed to one adult Daily Defined Dose (DDD) of the drug. As stated above Larsen (1998) anticipated that it was not possible to eat more than 10 gram of soil per day. Thus, it is not possible for either children or adults to be exposed to a whole DDD on one day via soil. On the other hand it is difficult to establish a "safe level" for pharmaceuticals such as hormones, antibiotics and cancer drugs. A "zero tolerance" principle might therefore be proposed and applied to protect vulnerable groups of the human population. Some groups (e.g. children) have for different reasons enhanced sensitivity towards drugs.
The evaluation of human health risk for micro-pollutants was based on an exposure scenario where a 10 kg child accidentally ingests 200 mg faeces/day. This dose of faeces will not for any of the micro-pollutants evaluated lead to an exposure level higher than 1/16 of the TDI.
Conclusions. The most important conclusions from this project were:
- There is an unacceptably high risk of infection by pathogens when faeces is used locally without treatment.
- The highest risk was attributable to Ascaris. According to the calculations several secondary infections may be expected from each container with infectious material.
- The risk of infection from bacterial pathogens are low if the material is stored for 12 months unless the pathogens can regrow in the material.
- The risks of infection can be reduced by simple measures such as longer storage, or treatment with a pH elevating compound. This will have to be applied to all containers, as it will be impossible to identify only infected containers.
- For Oestradiol the PEC/PNEC ratio far exceeded the ratio of one, implying that the compound affects the terrestrial environment.
- Calculations showed that humans need to consume 200 g to 1 kg soil in order to be exposed to one adult Daily Defined Dosis (DDD) of a drug. A "zero tolerance" principle may however be applied to protect vulnerable groups in the population.
- Exposure to micro-pollutants during or after local handling of faeces does not appear to be a significant environmental or health problem.
1 Indledning
- 1.1 Ulemper ved central behandling af fæces
- 1.2 Vurdering af risici ved brug af lokalt komposteret fæces
- 1.3 Formål med nærværende undersøgelse
Siden kolera-epidemierne i midten af 1800-tallet har der blandt teknikere og borgere været enighed om, at fæces indebar en uacceptabel risiko for smitte af sygdomme i byområder. Derfor blev byområderne kloakeret, hvorved der blev etableret en effektiv barriere mellem de patogener som inficerede personer udskilte og raske individer i samme by. Dette paradigme er blevet fulgt gennem 150 år og har nedbragt de smitsomme fæcesbårne sygdomme i Danmark i væsentligt omfang.
1.1 Ulemper ved central behandling af fæces
I det konventionelle spildevandssystem blandes urin og fæces med det øvrige husholdningsspildevand såvel som med regnvand, drænvand og spildevand fra industrien. I Danmark ledes dette ofte samlet til et biologisk renseanlæg, hvor der gennemføres forskellige rensningstrin af vandet der muliggør fjernelse af næringsstoffer, patogene mikroorganismer samt organiske el. uorganiske stoffer f.eks. metaller, der ellers ville ledes ud til et modtagende vandområde.
Påvirkningen af omgivelserne ved denne løsning er betydelig og afhjælpes ved en stadig udbygning af afløbssystemerne i form af bassiner, lokale og centrale renseanlæg. Udbygningen medfører betydelige udgifter, ikke kun til etablering, men også til drift. Samtidigt er man opmærksom på den problemstilling, at mens næringssaltene ved renseanlæggene er et problem benytter landbruget industrielt fremstillede næringssalte som supplement til husdyrgødning til produktion af vore afgrøder.
Denne problemstilling har skabt fokus på behovet for at lukke kredsløbet af næringssalte fra jord til bord og tilbage til jorden. Anvendelse af lokalt komposteret fæces er en af mulighederne for at lukke kredsløbet og har et potentiale også fordi den energikrævende transport undgås samtidigt med at næringssaltene i fæces udnyttes.
1.2 Vurdering af risici ved brug af lokalt komposteret fæces
Ud fra en økologisk tankegang er der således et ønske om at få genetableret den cyklus der var af næringssalte i det nære miljø før kloakeringen. Ønsket opstår både i form af at omstrukturere hele vores transport af næringssalte og ved mere lokale tiltag. Denne rapport omhandler lokale tiltag, hvor en enkelt familie etablerer et lokalt system til recirkulering af næringssalte fra fæces. Den lokale håndtering af fæces medfører en øget risiko for at påvirke husstanden og de nærmeste omgivelser, herunder gæster, naboer mv. Påvirkningen af mennesker kan tænkes at foregå i form af infektion fra patogener, forøget indtagelse af medicin eller i form af ekstra kontakt med miljøfremmede stoffer. Endvidere er det relevant at foretage en vurdering af de miljømæssige påvirkninger af kemiske stoffer, herunder medicinrester, ved udbringning i lokale haver.
Principelt kan vurderingen af påvirkningen foretages i form af målinger af de kritiske kemiske stoffer og mikroorganismer ved at identificere en række indikator-stoffer og -organismer. Dette vil dog have en begrænset værdi fordi disse indikatorer ikke kan forventes at afspejle karakteristikken af de patogene organismer endsige de kritiske kemiske stoffer.
Alternativt hertil kan man analysere forekomsten af patogener og kemiske stoffer direkte. Denne forekomst varierer dog særdeles meget afhængigt af sygdomssituationen og levevis i øvrigt i den tilsluttede befolkning og analyserne er endvidere vanskelige og dyre at udføre. Derfor er risikovurderinger et bedre værktøj til at prediktere risici og betydningen af forskellige typer af indgreb og deres betydning for helbredstilstanden i befolkningen.
1.3 Formål med nærværende undersøgelse
Rapporten søger kvalitativt og kvantitativt at beskrive risici ved brug af lokalt komposteret fæces. Metoderne for beregninger af mikrobiel forurening er i overensstemmelse med WHOs principelle metode for risikovurderinger for patogener, hvor Quantitative Microbiological Risk Assessment indgår. Ved vurdering af de kemiske stoffer er de tilsvarende metoder fra OECD og EU benyttet, der baserer sig på en vurdering af forholdet mellem den beregnede koncentration i miljøet og den koncentration hvor der beregningsmæssigt ikke er nogen effekt.
Formålet med risikovurderingerne er at vurdere risici for mennesker. Ved at benytte de internationalt anerkendte metoder opstår der dog væsentlige forskelle. Den mikrobielle risikovurdering er baseret på en vurdering af en akut risiko per eksponering, mens de langvarige effekter ikke medtages i beregningerne. Den kemiske risikovurdering er baseret på en vurdering af alment acceptable koncentrationsniveauer i forskellige (vand-)miljøer ud fra forsøg med dyr. Derved ignoreres eksponeringshyppighed og -måde. Endvidere ses den væsentlige forskel, at der i den formelle kemiske risikovurdering medtages en påvirkning af økosystemer, herunder mennesket, mens den mikrobielle risikovurdering udelukkende fokuserer på mennesker.
Beregningen af risiko er kun en del af den samlede vurdering af, hvorvidt en metode til håndtering af vand- og stofstrømme i byer er hensigtsmæssig. I denne vurdering indgår også hvad konsekvenserne af ikke at foretage et skift mod mere økologiske paradigmer. Vurderingen kan medføre, at man tillader og måske anbefaler lokal håndtering helt eller delvist eller at man opretholder anbefalingen om central håndtering af human fæces.
Denne analyse er baseret på en antagelse om, at lokal håndtering af uprofessionelle ikke vil vinde stor udbredelse. Hvis dette sker, er der mulighed for, at det generelle sygdomsbillede vil ændre sig i Danmark, således at flere bliver syge af fæcesbårne sygdomme.
2 Systembeskrivelse
- 2.1 Principskitse for lokal håndtering af fæces
- 2.2 Definition af påvirkning og uønskede hændelser
- 2.3 Mængde og sammensætning af lokalt komposteret fæces
- 2.4 Arealkrav og udbringningsmetoder
- 2.5 Beregningsscenarier for kemisk risikovurdering af medicinrester
- 2.6 Beregningsscenarier for mikrobiologisk risikovurdering
2.1 Principskitse for lokal håndtering af fæces
Risikovurderingen omhandler fæces opsamles i komposttoiletter, hvor der typisk sker en decentral første kompostering. Denne kompostering indeholder ikke nogen behandling, bortset fra en eventuel tilførsel af flis af æstetiske årsager. Det medfører, at materialet, afhængigt af opbevaringstiden, ikke er fuldt stabiliseret og heller ikke hygiejniseret. Materialet vil derfor ikke blive benævnt "kompost" i rapporten for at tydeliggøre forskellen mellem det materiale der undersøges og kompost i traditionel forstand, hvor materialet er blevet behandlet, f.eks. med varme eller ved at tilsætte kalk. Systemet er anskueliggjort i Figur 2.1

Figur 2.1 Principskitse for lokal håndtering af fæces. Beholderen til opbevaring har flere rum, så materiale med forskellig alder kan holdes separat. Urinbeholderen er ikke angivet på billedet (Foto: Vera Snurredas, reklame downloaded fra www.vera.no)
Der er opstillet en række krav til de toiletter, der skal anvendes, for at sikre et vist minimum af hygiejne. En række tekniske løsninger er undersøgt og en række systemer er udvalgt som værende potentielt egnede til lokal håndtering af fæces. I Tabel 2.1 er vist en oversigt over de toiletter, som undersøges i lignende projekter under Aktionsplanen for økologisk byfornyelse og spildevandsrensning. Ved udvælgelsen er lagt vægt på følgende egenskaber ved toiletsystemerne:
- Systemet separerer fæces og urin
- Opbevaringsbeholderen er opdelt i minimum to kamre så fæces kan komposteres/opbevares inden håndtering
- Toiletpapir og eventuelt tilslagsmateriale tilsættes for at fremme komposteringen.
Det antages, at separationstoiletterne er helt effektive, således at mængden af urin i fæces-beholderen er negligibel. Der er foretaget en særskilt risikovurdering af human urin i Hald og Andersen (2003).
Tabel 2.1 Oversigt over toiletter, der undersøges i andre projekter under Aktionsplanen for økologisk byfornyelse.
| Navn | Forhandler | Type |
| Snurredas | Vera Miljø, Norge | Separationstoilet |
| Toga 2000 | Vera Miljø, Norge | do. |
| Lindén 140 / 180 | Svend Lindén AB, Sverige | do. |
| Økokomperen | Fornyet Energi, Stenlille | do. |
| M195 / MP200 | Mullis AB, Sverige | do. |
| Ekovip/Clever m/ afvanding | Wost-Man-Ecology, Sverige /Kaggen AB | Efterseparation |
| Ecovac/Clevervac m/ afvanding | Wost-Man-Ecology, Sverige /Kaggen AB | do. |
2.2 Definition af påvirkning og uønskede hændelser
Nærværende risikovurdering fokuserer på nogle specifikke, målbare påvirkninger af mennesker samt, for kemiske stoffers vedkommende, tilsvarende specifikke acceptable koncentrationer i det udbragte materiale.
Det er således ikke alle påvirkninger der analyseres. Formålet er at vurdere risikoen for at personer bliver syge eller påvirkede af at fæces behandles og anvendes lokalt. Påvirkning er i nærværende projekt defineret som følgende hændelser:
- Infektion. Det er i den forbindelse ikke nødvendigt, at personen udvikler symptomer på sygdom.
- Påvirkning fra miljøfremmede stoffer, der overskrider anbefalet grænse for dagligt indtag eller tilsvarende værdier
- Indtagelse af en mængde medicin, der overskrider den typiske anbefalede dosis ved behandling
- Udbringning af en mængde medicin, der overskrider de mængder, der anbefales ud fra en miljømæssig vurdering
Ovenstående hændelser omtales samlet i rapporten som uønskede hændelser. Der er også andre påvirkninger af mennesker ved lokal håndtering af fæces, f.eks. en forhøjet risiko for udvikling af allergi ved nogle af arbejdsgangene.
2.3 Mængde og sammensætning af lokalt komposteret fæces
Sammensætningen af frisk fæces afhænger noget af fødeindtaget, men en større del af den fækale masse stammer f.eks. fra nedbrydning af tarmbakterier hvilket medfører relativt små variationer mellem forskellige personer. Hovedkomponenterne i frisk fæces er opsummeret i Tabel 2.2.
Tabel 2.2 Sammensætning af frisk fæces ved indtagelse af gennemsnitlig diæt (Rang og Hale, 1991.
| Komponent | Mængde |
| Tørstof | 25% af total vægt |
| Cellulose og andre fibre | Variabel mængde |
| Bakterier | 30% af fast stof |
| Uorganiske stoffer (primært calcium og fosfat) | 15% af fast stof |
| Fedt og nedbrydningsprodukter af fedt | 5% af fast stof |
Der er udført en række målinger på lokalt komposteret fæces fra danske og sydsvenske toiletter. Karakteristika ved den komposterede fæces er kort sammenfattet i Tabel 2.3.
Tabel 2.3 Sammensætning af lokal komposteret fæces. Data fra Møller (2002)
| Komponent | Variationsområde af måledata |
| Temperatur* | 0 - 20°C |
| Temperatur i forhold til omgivelserne | -4 - +7°C |
| Tørstofindhold | 22 - 39 % |
| Kulstof | 666 - 883 g/kg TS |
| Kvælstof | 24 - 45 g/kg TS |
| C/N-forhold | 20 - 34 |
| Tilslagsmateriale* | 10 - 15 % af totalmængden |
| pH | 6,7 - 8,4 |
* Temperaturintervallet indikerer at der ikke foregår egentlig kompostering
**Tilslagsmateriale består af toiletpapir samt findelt træmateriale: savsmuld, groft savsmuld, spåner
Et menneske udskiller dagligt 50-200 gram fæces afhængigt af alder og livsførelse. Man kan i grove træk regne med følgende gennemsnitlige mængder for forskellige aldersgrupper, angivet som totalvægt (Rang og Hale, 1991):
- Barn, 0-6 år: 50 g/d
- Barn, 7-14 år: 100 g/d
- Voksen, 15-66 år: 200 g/d
- Voksen over 67 år: 100 g/d
Der regnes i forbindelse med vurderingerne i dette projekt med, at en standard husstand omfatter to yngre voksne, et barn under 6 år og et barn mellem 7 og 14 år. Der regnes desuden med, at 75% af husstandens afgivelse af fæces finder sted på bopælen (Wrisberg et al 2001), mens der ikke tages hensyn til bidrag fra evt. gæster o.lign.
Der er i forbindelse med beregningerne regnet med standard mængder og sammensætning af fæces, som angivet i Tabel 2.4. Værdierne er bl.a. baseret på oplysningerne i Wrisberg et al (2001) og Eilersen et al (1998). Der regnes ikke med tørstofreduktion som følge af biologisk omsætning under opbevaringen af fæces før udbringning da opbevaringstemperaturen er lav. Der er heller ikke taget hensyn til sammensætningen af flis eller andet tilslagsmateriale, der måtte blive anvendt, da Møller (2002) angiver, at mængden af tilslagsmaterialer er lille.
Tabel 2.4 Standardmængder og -sammensætning af fæces brugt ved risikovurderingen.
| Parameter | En husstandsperson* | En husstand | En husstand |
| (per dag) | (per dag) | (om året) | |
| Totalmængde, Vtotal | 140 g | 550 g | 160 kg |
| Tørstofmængde | 35 g | 140 g | 40 kg |
| Mængde kvælstof | 1,0 g | 4 g | 1,1 kg |
| Mængde fosfor | 0,5 g | 2 g | 0,55 kg |
ts = tørstof
* Gennemsnit af to voksne, et barn 0-6 år og et barn 7-14 år.
Af standardværdierne i Tabel 2.4 kan der beregnes følgende gennemsnitlige koncentrationer af næringsstofferne kvælstof (N) og fosfor (P) i fæces:
N: ca. 28,5 g/kg tørstof
P: ca. 14,3 g/kg tørstof
2.4 Arealkrav og udbringningsmetoder
Til fastlæggelse af det mængdemæssige grundlag for de forskellige scenarier for anvendelse af fæces er følgende muligheder overvejet:
Mulighed 1: Der udbringes i forhold til indholdet af kvælstof (N). Normen for gødning med N i køkkenhaver er på 150 kg N/ha per år for køkkenhaver. Der regnes med denne mængde uanset om udbringningen af fæces finder sted i køkkenhaven eller på en anden del af husstandens haveareal. 150 kg N/ha per år svarer til 15 g N/m2 eller ca. 0,5 kg fæces tørstof/m2 om året (2 kg fæces totalvægt/m2 per år). Dette indebærer et samlet arealbehov for en husstand på 80 m2 til udbringning af fæces.
Mulighed 2: Der udbringes i forhold til indholdet af fosfor (P). Slambekendtgørelsen foreskriver en maksimal udbringning på 30 kg P/ha per år. Med dette udgangspunkt bliver arealbehovet for en husstand 180 m2. Bekendtgørelsen undtager dog i dag private haver fra P-kravet.
Mulighed 3: Der regnes med, at husstanden har en grund på 800 m2, hvoraf 200 m2 er køkkenhave eller bede, hvor den behandlede fæces kan udbringes (resten udgøres af hus, indkørsel, havegange og græsplæne). Dvs. der i gennemsnit udbringes 0,2 kg fæces tørstof/m2 svarende til 0,8 kg fæces totalvægt/m2 per år.
Det er således sandsynligt, at den højeste dosering ("realistic worst case") ved udbringning af komposteret fæces i private haver vil forekomme ved udbringning i forhold til gødningsnormen for N, dvs. 15 g N/m2 svarende til ca. 0,5 kg fæces tørstof/m2 om året eller 2 kg fæces totalvægt/m2 per år. Det bemærkes, at med typiske værdier for spildevandsslam er den tilsvarende tilladte mængde slam der må udbringes 0,1 kg tørstof/m2 (Miljøstyrelsen, 2001).
Der opereres med to begreber i forbindelse med selve udbringningen af komposteret fæces på jorden; udlægning og indarbejdning. I begge tilfælde regnes der med en mængde på 2 kg fæces totalvægt/m2 svarende til 0,5 kg fæces tørstof/m2.
Ved udlægning anbringes den angivne mængde fæces oven på jorden og fordeles jævnt med en kultivator, rive eller lignende, hvorved der vil ske en begrænset opblanding i det øverste jordlag. Der regnes med opblanding i den øverste 1 cm af jorden, hvis densitet sættes til 1,5 g/cm3. Der tages ikke hensyn til volumenforøgelsen. 2 kg fæces (totalvægt) i 10 dm3 jord (15 kg) svarer til en koncentration på ca. 130 g (totalvægt)/kg jord eller ca. 33 g tørstof/kg jord.
Ved indarbejdning fordeles den udbragte mængde fæces jævnt i de øverste 10 cm af jorden ved hjælp af en skovl eller greb, dvs. 2 kg fæces opblandes i 150 kg jord svarende til en resulterende koncentration på 13 g totalvægt/kg jord eller 3,3 g tørstof/kg jord.
Ved begge former for udbringning, men selvfølgelig især udlægning, vil det jævnligt forekomme, at opblandingen i jorden ikke har været fuldstændig, og dermed vil der stadig være risiko for direkte kontakt med (herunder indtagelse af) ufortyndet fæces.
2.5 Beregningsscenarier for kemisk risikovurdering af medicinrester
I den kemiske risikovurdering vurderes det, hvorvidt en planlagt metode i almindelighed kan forventes at medføre risici for påvirkninger af miljøet. Der er ikke fokus på de enkelte eksponeringer, men hvorvidt de planlagte aktiviteter vil medføre relativt høje koncentrationer i miljøet i forhold til stoffets kendte farlighed. Derfor er det nødvendigt at have forskellige scenarier for den kemiske og den mikrobielle risikovurdering.
Der er opstillet tre scenarier for at vurdere hvorvidt fæces indeholdende lægemiddelrester anvendt som gødning kan have effekt på jordmiljøet. Først skitseres to scenarier, der svarer til hhv. worst-case og best-case med hensyn til indhold af medicinrester i den lokalt komposterede fæces. Dernæst beregnes koncentrationen i den standard-husstand (2 voksne og 2 børn), som er defineret i afsnit 2.3. Husstandsdata er fra Danmarks Statistik (2002).
Scenarium A, worst case
Beregner en lægemiddelkoncentration i fæces ud fra en antagelse om, at husstanden består af 1 person (voksen) der kontinuerligt er medicineret med et medikament som udskilles med fæces. Det betyder at al fæces udskilles med indhold af lægemiddelstof som ikke efterfølgende fortyndes med fæces der ikke indeholder medicin. Hyppigheden for dette scenarium er husstande bestående af enkeltpersoner der bor i eget hus eller hvor alle i husstanden er smittede med samme sygdom. Der er ikke direkte data tilgængelige, men potentiale for dette scenarium kan skønnes ud fra følgende oplysninger: ca. 60% af den danske befolkning bor i hus; der er ca 1,55 mio enlige, det antages at enlige er underrepræsenteret i hussegmentet og kun udgør 40% af husstandene, svarende til 620.000 husstande her svarende til individer.
Scenarium B, best case
Beregner en lægemiddelkoncentration i fæces under antagelse af, at al lægemiddelstof anvendt i Danmark fordeles jævnt i al udskilt fæces. Dette scenarier antages som best-case og er den gennemsnitlige koncentration for hele befolkningen.
Scenarium C: "standard-familie"
Beregner en lægemiddelkoncentration i fæces for stofferne i tabel 5.2 der primært udskilles med fæces fra standard-familien bestående af 2 voksne og 2 børn. Generelt er forudsætningen for alle stofferne i tabel 5.2 at kun en af de voksne er under medicinsk behandling. Desuden regnes der på den mulighed at 1 barn medicineres med gentagne antibiotikakure og bliver behandlet med insulin og smertestillende medicin. Relevansen for dette koncentrationsniveau i fæces relateres dernæst til antallet af danskere der bor som familier (voksne+børn) i eget hus. Der er ca. 650.000 familier med børn, som forventes overrepræsenteret (70%) i segmentet med eget hus, dvs. ca. 450.000 husstande.
2.6 Beregningsscenarier for mikrobiologisk risikovurdering
Beregningsmetoderne for en mikrobiologisk risikovurdering er gennemgået detaljeret i kapitel 4. Det væsentlige i forbindelse med opstilling af scenarierne er, at metoden er hændelsesbaseret, altså at der vurderes en risiko af typen "man vil blive inficeret 1 ud af 10.000 gange man eksponeres". De beregnede risici er opgivet i risikoen for infektion pr. gang, hvorfor en inficeret ud af 10.000 eksponeringer vil blive opgivet som en risiko på 110-4 (= 0,0001) for at blive inficeret pr. gang.
2.6.1 Scenarier for udbringning
De enkelte delprocesser i den overordnede procesbeskrivelse for udbringning og anvendelse af lokalt komposteret fæces kan have meget forskellige parameterværdier (og dermed resulterende risikobidrag) afhængigt af de konkrete omstændigheder. Derfor analyseres flere scenarier, alle baseret på samme overordnede model. Følgende scenarier vil blive belyst:
- Udlægning af materiale, der har været opbevaret i 0 måneder.
- Udlægning af materiale, der har været opbevaret i 6 mdr.
- Udlægning af materiale, der har været opbevaret i 12 mdr.
- Indarbejdning af materiale, der har været opbevaret i 6 mdr.
- Indarbejdning af materiale, der har været opbevaret i 12 mdr.
Den lokalt komposterede fæces benævnes "materiale", for at understrege at den eneste behandling er opbevaring og ikke en traditionel kompostering, som ud over opbevaring omfatter en behandling i form af f.eks. varme eller kalktilsætning.
I alle scenarier antages det, at udbringning sker i april måned. Udbringningen kunne også tænkes at foregå i efteråret. Da der kun påregnes eksponering i haven i sommerhalvåret vil disse scenarier beregningsmæssigt være lidt mindre farlige, idet der vil ske en vis, om end ringe, nedbrydning inden eksponeringen påbegyndes. Udbringning i efteråret ville skulle indarbejdes for at mindske risikoen for overfladeafstrømning fra frossen jord.
Den lokalt komposterede fæces udspredes i en almindelig parcelhushave eller lignende som gødning til afgrøder, nytteplanter og på jorden. Miljøvurderingen af kemiske stoffer, herunder medicinrester, sker i form af vurderinger af lang tids påvirkning af stoffet i haven. For de øvrige påvirkninger er der tale om hændelser, der er begrænset til et kort tidsrum, benævnt en eksponering. Hver gang fæces opbevares eller håndteres giver risiko for en eksponering.
2.6.2 Procesbeskrivelse for typer af eksponering
Den overordnede procesbeskrivelse for hvornår mennesker eksponeres er opdelt i en række delprocesser. De enkelte delprocesser er beskrevet detaljeret i de følgende underafsnit.
Tømning af kompostbeholder og udbringning
Kompostbeholderen tømmes af et voksent medlem af familien i huset. Der bæres ikke åndedrætsværn eller anden beskyttelse ud over gummistøvler og havehandsker. Den komposterede fæces transporteres rundt i haven ved hjælp af trillebør og fordeles herfra med en skovl. Komposten udlægges med rive eller indarbejdes manuelt skovl, greb eller lignende. Kompostbeholderen tømmes en gang årligt i løbet af én arbejdsgang.
Ophold på arealer i haven og nabohaver
Den udbragte kompost kan blive transporteret uden for de behandlede arealer som følge af dyr (f.eks. ræve, katte, egern) og menneskers færdsel. Det har ikke været muligt at få gode målinger til at skønne vigtigheden af denne transport. Det skønnes dog, at den væsentligste transportvej er, når mennesker via fodtøj transporterer klumper af jord og komposteret fæces fra behandlede arealer til de øvrige arealer i eller uden for haven.
Børn og voksne vil, især i sommerhalvåret, lege og på anden måde opholde sig i haven og andre omgivelser, der er gødet eller kontamineret med komposteret fæces, uden at de kan forventes at være opmærksomme på de risici, det indebærer. I forbindelse med fritidsaktiviteter (leg, spisning eller solbadning) i kontaminerede områder udsætter personerne sig dermed for risiko for direkte kontakt med eller indtagelse af komposteret fæces.
Dyrkning af afgrøder
Dyrkning af afgrøder omfatter som begreb en række fysiske aktiviteter, hvoraf såning, lugning og høstning er de mest almindelige og relevante i forhold til eksponering for fæces (ud over selve udbringningen, som er beskrevet ovenfor). Aktiviteterne foregår både med redskaber og med hånden. Lugning antages at foregå både ved afgrøder, og under frugtbuske og prydplanter. Al dyrkning foretages af husstandens egne medlemmer, især de voksne.
Der dyrkes alle typiske former for afgrøder i haven. Afgrøderne kan for eksempel inddeles som følger:
- Afgrøder i jord (kartofler, gulerødder, radiser mv.)
- Afgrøder nær jord (salat, jordbær mv.)
- Afgrøder højt over jord (æbler, pærer, solbær mv.)
Det ses, at der ved afgrøder i og nær jord høstes løbende over en længere periode, mens de afgrøder, der er højt over jorden høstes over en kort periode sent på vækstsæsonen. De første to typer afgrøder medfører en hyppig eksponering fra juni til oktober, mens den sidste type afgrøde høstes ved få eksponeringer i september og oktober måned. Dermed opstår der den situation, at de afgrøder, der har mindst risiko for at komme i kontakt med smitstofferne, også medfører mindre eksponering af mennesker.
I forbindelse med høstningen af grøntsagerne vil der ske kontaminering ved færdsel på arealet samt ved berøring f.eks. i forbindelse med en grovrensning for fastsiddende jord på afgrøden inden denne oplagres eller tages ind i køkkenet med henblik på tilberedning og indtagelse. Den operationelle beskrivelse af eksponering under dyrkning og ophold diskuteres yderligere i kapitlet om eksponering, hvor de tilgængelige data for danskeres ophold og aktiviteter i haven gennemgås.
Den mulige eksponering i forbindelse med de to sidstnævnte aktiviteter, tilberedning og indtagelse af de høstede afgrøder, vurderes ikke i forbindelse med dette projekt. Modelleringen af eksponering via afgrøder vil blive beregnet som et patogentryk pr. have.
3 Risikovurdering af kemiske stoffer
- 3.1 Forekomst og vurdering af miljøfremmede stoffer og metaller i fæces i Danmark
- 3.2 Forekomst af medicinrester i fæces i Danmark
- 3.3 Risikovurdering for medicinrester
- 3.4 Vurdering af risiko for akutte effekter
- 3.5 Diskussion af resultater
- 3.6 Delkonklusion for afsnittet
Mennesker eksponeres for lægemidler primært gennem behandling, mens miljøfremmede stoffer og tungmetaller kommer fra et stort antal kilder, hvoraf fast føde og drikkevarer i de fleste tilfælde er de mest betydningsfulde. Der kan dog også optages stoffer ved indånding eller gennem huden, f.eks. i arbejdsmiljøet, ved brug af kosmetiske produkter eller i forbindelse med rengøring eller andre aktiviteter i hjemmet. Både lægemidler, miljøfremmede stoffer og tungmetaller udskilles gennem urin, fæces og i begrænset omfang udåndingsluft.
Human fæces vil derfor indeholde lægemidler, men også et betydeligt antal miljøfremmede organiske stoffer og tungmetaller, der ikke eller kun delvis er metaboliseret i kroppen og med tiden udskilles med den faste afføring. Dette er imidlertid et emne, der kun er yderst sparsomt undersøgt og beskrevet i litteraturen i modsætning til f.eks. indhold af den slags stoffer i modermælk hos ammende kvinder, herunder ikke mindst dioxiner og polyklorerede biphenyler (PCB).
Det vurderes, at langt de fleste stoffer vil blive transformeret og nedbrudt i den menneskelige organisme, og at interessen derfor må samle sig om de meget persistente miljøgifte, som f.eks. dioxiner, og om egentlige konservative stoffer, dvs. grundstoffer, primært tungmetaller som f.eks. bly og cadmium.
Derudover vil fæces, der opsamles og komposteres, i mindre omfang, men med jævne mellemrum kunne blive "kontamineret" med kemiske stoffer i rengøringsmidler, der anvendes til toiletrengøring. Der er her primært tale om anioniske og nonioniske detergenter, overvejende alkoholethoxylater (AEO) og lineære alkylbenzensulfonater (LAS). Begge disse stoftyper er relativt ugiftige og biologisk letnedbrydelige under aerobe forhold, og de vurderes derfor ikke at udgøre et risikomoment af betydning (den primære eksponering af mennesker vurderes i øvrigt at finde sted ved den tilsigtede anvendelse af stofferne). Der er ikke fundet specifikke oplysninger i litteraturen om disse stoftyper i fæces.
Rester af medicin som spredes i miljøet må betragtes som en forurening med en potentiel effekt ligesom andre af det industrialiserede samfunds kemikalierester. I forhold til de almindelige industrikemikalier, dog med den forskel at medicin ligesom pesticider og biocider i udgangspunktet anvendes netop fordi de har en iboende biologisk effekt. Viden om lægemidlers skæbne og effekt i miljøet er stadig relativ sparsom. Derfor er det nødvendigt at belyse lægemidlernes skæbne og effekter på den gødede jord. En gennemgang af litteraturen viser, at man efterhånden har fundet medicinrester af mere end 100 lægemiddelstoffer i miljøet (Ingerslev, 2000). Det er derfor en sandsynlighed for at nogle af disse også i miljøet kan udvise en effekt, om end effekter på nuværende tidspunkt sjældent kan påvises. Da lægemidler i sagens natur kan have meget specifikke effekter, kan de manglende effekter blandt andet skyldes, at der ikke er udviklet testprogrammer som kan måle de subtile måder effekter kan manifestere sig på.
De mange fund af medicinrester i miljøet viser at stofferne må formodes at have en vis kemisk stabilitet i miljømatricen. For en detaljeret forståelse af lægemidlers eksponeringsvej, tilstedeværelse, skæbne og effekter på miljøet og indirekte effekter på mennesket henvises til f.eks. Stuer-Lauridsen et al. (2002), Halling-Sørensen et al. (2002) samt Halling-Sørensen et al. (1998).
3.1 Forekomst og vurdering af miljøfremmede stoffer og metaller i fæces i Danmark
I Tabel 3.1 sammenfattes oplysninger for et antal tungmetaller og dioxin om grænseværdier i affaldsprodukter til jordbrugsformål, jordkvalitetskriterier, værdier for tolerabel daglig eller ugentlig indtagelse (TDI/TWI) samt koncen-trationsniveauer i human fæces.
Tabel 3.1 Grænseværdier for tungmetaller og dioxiner i miljømatricer og ved indtagelse, samt estimerede niveauer i human fæces på hhv. tørstof- og P-basis. Indhold i fæces på P-basis er baseret på Eilersen et al (1998) og ICON (2001) samt forholdet mellem tørstof of fosfor angivet i afsnit 2.3.
| Stof | Grænseværdi | TDI* | Indhold i fæces | |||
| Slam o.a. affald1 | Jord 1 | |||||
| mg/kg ts | mg/kg P | mg/kg ts | mg/kg lgv | mg/kg ts | mg/kg P | |
| Bly | 120 | 10.000 | 40 | 3,6 E-033 | 0,77; 118 | 50; 770 |
| Cadmium | 0,8 | 100 | 0,5 | 1,0 E-033 | 0,57; 28 | 35; 140 |
| Kobber | 1.000 | - | 40 | 0,23 | 407; 708 | - |
| Krom | 100 | - | 30 | 14 | 0,87 | - |
| Kviksølv | 0,8 | 200 | 0,5 | 7,0E-043 | 1,77 | 120 |
| Nikkel | 30 | 2.500 | 15 | 0,024 | 47; 58 | 280; 350 |
| Zink | 4.000 | - | 100 | 13 | 3207; 2508 | - |
| Dioxiner (som TEQ)** | 0,00012 | - | - | 1-4 E-0952 E-096 | 1,7 E-069 | - |
ts = tørstof; lgv = legemsvægt; P = fosfor (total fosfor)
* TDI = tolerabel daglig indtagelse (over et helt livsforløb)
** Toksicitetsækvivalenter i forhold til "Seveso-dioxin", 2,3,7,8.T4CDD.
1 Miljøministeriet (2003).
2 Miljøstyrelsen (1995). Tysk grænseværdi for spildevandsslam.
3 ANZFA (2001).
4 Friedman (1994).
5 NHMRC (2002), TDI-værdi fra WHO 1998 .
6 NHMRC (2002). Opgivet som TWI-værdi på 14 E-09, altså tolerabel ugentlig indtagelse, fra EC (2001).
7 Eilersen et al. (1998). Beregnet ud fra totale mængder af slam og tungmetaller.
8 ICON (2001).
9 EIP (1997). Beregnet ud fra en mængde dioxin på 60 pg/prs./dag og en gennemsnitlig mængde fæces på 35 g TS/dag/prs. (beregnet ud fra Eilersen (1998)).
Der gøres opmærksom på, at der generelt ikke er fundet oplysninger om omfanget af data, der ligger til grund for de angivne koncentrationsniveauer, som sikkert kan udvise betydelig variation. For eksempel vides det, at rygning har signifikant indflydelse på kroppens belastning med tungmetallet cadmium, som tillige er et ret mobilt metal, hvorfor rygevaner utvivlsomt også vil afspejle sig i koncentrationen af cadmium i fæces.
Specielt hvad dioxiner angår, skal der gøres opmærksom på, at den angivne koncentration er beregnet ud fra oplysninger om en per capita ekskretion af dioxiner på 60 pg-TEQ/dag (EIP 1997) og en fæcesmængde på ca. 35 g tørstof/dag beregnet efter oplysninger i Eilersen et al. (1998). TEQ er mængden af dioxiner (som er en gruppebetegnelse for mere end 200 enkeltstoffer) omregnet til toksicitetsækvivalenter i forhold til den mest kendte og en af de mest giftige dioxiner; 2,3,7,8-T4CDD ("Seveso-dioxin").
Det skal yderligere bemærkes, at originaldata vedr. dioxinindholdet i fæces stammer fra en artikel publiceret i 1990 og bygger altså på målinger, der er foretaget sidst i 1980'erne. Eksponeringen for dioxin vides at være faldet betydeligt siden dengang, og der er således grund til at antage, at den angivne værdi er væsentligt overestimeret.
Det ses af tabellen, at indholdet af tungmetaller i fæces for de fleste metallers vedkommende er betydeligt lavere end den tørstofbaserede grænseværdi, der jf. slambekendtgørelsen (Miljøministeriet 2003) gælder for spildevandsslam mv., der udbringes på dyrkningsjord, og det er også lavere eller på linie med de kriterier for jordkvalitet, der er fastsat i samme bekendtgørelse. Undtagelserne er cadmium, der ligger på linie med grænseværdien og kviksølv, der ser ud til at ligge lidt højere (men formodentlig inden for usikkerheden på estimatet). I forhold til de P-baserede grænseværdier, der alternativt må benyttes som beregningsgrundlag for bly, cadmium, kviksølv og nikkel, er det kun cadmiumindholdet, der ligger på kanten.
De typiske værdier for P i slam medfører, at der må udspredes omtrent 0,1 kg slam tørstof/m2. Som beskrevet i afsnit 2.4 antages det i nærværende undersøgelse, at der udspredes op til 0,5 kg fæces tørstof/m2. De få og sparsomme oplysninger om indhold af tungmetaller i fæces antyder dermed, at for cadmium og kviksølv vil belastningen per arealenhed kunne være op til 10 gange højere end slambekendtgørelsens tørstofbaserede grænseværdier, såfremt komposteret fæces, der udbringes lokalt i private haver, var omfattet af bekendtgørelsens krav for disse stoffer. De 0,5 kg fæces ts/m2 svarer til 7 g tot-P/m2 eller 2,3 gange det tilladte ift. slambekendtgørelsen. Der vil dermed reelt kunne forekomme en (beskeden) overskridelse også af de P-baserede grænseværdier for cadmium og kviksølv ved udbringning af denne mængde fæces per arealenhed.
Dioxiner udskilles på grund af deres lipofile (fedtelskende) karakter meget langsomt fra kroppen og først efter adskillige år (40-50 år) opnås steady-state mellem optagelse og udskillelse (NHMRC, 2002). For børn og yngre mennesker må udskillelsen og dermed indholdet i fæces derfor forventes at være lavere end den angivne værdi (der som tidligere nævnt i øvrigt formodentlig er lavere i dag end for 12 år siden da den blev beregnet). Geyer et al. (2002) angiver i en reviewartikel halveringstiden for udskillelse af 2,3,7,8-TCDD på 5,8-9,7 år og stigende med stigende chloreringsgrad (5-8 chloratomer/molekyle) op til 50-132 år for OCDD, der har 8 chloratomer.
Man bemærker, at det i Tabel 3.1 angivne estimat på dioxinindholdet i fæces er mere end en faktor 50 lavere end den gældende tyske kravværdi for dioxin i slam, der ønskes udbragt på landbrugsjord.
3.2 Forekomst af medicinrester i fæces i Danmark
3.2.1 Udvælgelse af stoffer
I år 2000 var der i alt 4100 lægemidler på det danske marked, der indeholdt ca. 1000 forskellige aktivstoffer (Lægemiddelstyrelsen, 2002). Da der i litteraturen ikke findes data der belyser økotoksikologiske såvel som indirekte effekter af ret mange lægemidler er det valgt at tage udgangspunkt i forbrugsdata og i viden om stoffernes potens hos mennesket. Følgende data er derfor indsamlet:
- Fra Lægemiddelstyrelsens statistik over de 25 mest anvendte lægemidler er udvalgt de 12 stoffer som primært udskilles via fæces.
- I det omfang almindeligt forekommende folkesygdomme som hjertekar-sygdomme, sukkersyge, gigt, allergi, p-piller, depressionsmidler og cancermidler ikke forekommer på listen er udvalgte lægemiddelstoffer også inddraget i undersøgelsen. Derfor er listen udvidet med cancerlægemidlet Ciclosporin, antibiotikummet Erythromycin samt insulin der ikke er på top 25 listen men valgt som modelstoffer ud fra deres egenskaber.
Data for denne bruttoliste er angivet i Tabel 3.2. På grund af datamangel er der i nærværende arbejde anvendt den relativ simpel vurderingsprocedure der anvendes til industrikemikalier, og ikke de foreslåede retningslinier for nye lægemidler (EMEA, 2001). Det er også undladt, at anvende den mere omfattende model for industrikemikalier, EUSES, som er beskrevet i (ECB, 1997). Modellens fundamentale antagelse om, at kemikaliers fordeling i miljøet kan beskrives ved hjælp af oktanol-vand fordelingskoefficienter kan ikke verificeres for lægemidler, der ofte også udviser andre bindingstyper grundet mange funktionelle grupper på molekylet (Loke et al. 2002; Tolls 2001).
Humanlægemidler er udviklet til at virke på mennesket, dvs. hvirveldyr med organer, kredsløb, biokemiske receptormekanismer, der kan virke forskellige fra selv nærbeslægtede arter. Det kan derfor ikke nødvendigvis forventes at lægemidler, der er virksomme i lave doser på mennesket, også er meget potente med hensyn til effekter i miljøet. Lægemidler med en lav potens i mennesker har også omvendt vist sig at være meget potente i miljøtest. Eksempelvis er visse antibiotika ret potente i bakterieassays, men er kun virksomme i høje doser på mennesket.
Det skal dog nævnes, at det er meget muligt at de standard økotoksikologiske test som anvendes, og som der ret beset kun er temmelig begrænsede resultater fra for lægemidler, ikke nødvendigvis identificerer de rette måleparametre for stoffer med specifikke virkninger. Eksempler på stoffer, hvis subtile effekter ikke fanges i standardtest er hormonforstyrrende stoffer.
3.2.2 Kort beskrivelse af de udvalgte stoffer
Nedenfor gives en kort beskrivelse for den terapeutiske anvendelse af de lægemiddelstoffer der er udvalgt til nærmere undersøgelse i projektet med deres tilhørende ATC kode (lægemiddel nr.).
Furosemid (ATC C03CA01). Vanddrivende middel af typen "Loop diuretika" der nedsætter nyrernes koncentrationsevne og øger generelt døgndiuresen og vandindtagelsen. Anvendes ofte til langtidsbehandling hvorfor det regnet i antal doser er det mest anvendte lægemiddel i Danmark (data fra år 2001).
Østrogen (ATC G03CA). Naturligt forkommende kvindeligt hormon som er tilstede i p-piller og eksempelvis klimateriepræparater. Styrer udviklingen af kvinders sekundære kønskarakterer.
Tabel 3.2 De screenede lægemiddelstoffer i den primære sundhedssektor i år 2000, opgjort i mængde som Definerede Døgn Doser (DDD), og som vægt (kg aktivt stof). Derudover er angivet den fraktion af det indtagne lægemiddel der udskilles med fæces og log Kow som mål for stoffernes lipofilicitet.
| Aktiv indholdsstof | ATC* | Middel til behandling/
forebyggelse |
Mio. DDD | Kg aktiv stof | Fraktion af lægemiddel i fæces ** | Log Kow *** | |
| 1 | Furosemid | C03CA01 | forhøjet blodtryk, væske-
ansamling og nyresvigt |
95,3 | 3812 | 33 | 2,03 |
| 2 | Paracetamol | N02BE01 | smerter | 93,0 | 2790000 | 0 | 0,49 |
| 3 | Acetylsalicylsyre | B01AC06 | smerter | 75,6 | 226800 | 0 | 1,19 |
| 4 | Bendroflumethiazid | C03AB01 | forhøjet blodtryk | 71,3 | 178 | 0 | 1,19 |
| 5 | Gestoden og estrogen | G03AA10 | graviditet (p-piller) |
48,3 | 48,3/0.78 | 40 | 3,62 ±0.404,01 |
| 6 | Amlodipin | C08CA01 | forhøjet blodtryk | 39,5 | 198 | 90 | 3,0 |
| 7 | Ibuprofen | M01AE01 | gigt | 28,0 | 33600 | 5 | 3,5 |
| 8 | Budesonid | R03BA02 | astma | 27,9 | 41,85 | 20 | 1,36±0,42 |
| 9 | Acetylsalicylsyre, komb. ekskl. psykoleptika |
N02BA51 | smerter | 27,7 | 83100* | 0 | - |
| 10 | Desogestrel og estrogen | G03AA09 | graviditet (p-piller) |
26,0 | 5.2/0,78 | 40 | 6,59±0,39 |
| 11 | Kaliumchlorid | A12BA01 | kaliummangel | 25,2 | 75600 | 0 | - |
| 12 | Citalopram | N06AB04 | depression | 24,0 | 480 | 88 | 2,86±0,48 |
| 13 | Enalapril | C09AA02 | forhøjet blodtryk og hjertesvigt | 23,1 | 231 | 0 | 4,22±0,58 |
| 14 | Estradiol | G03CA03 | klimakterielle gener | 23,0 | 46 | 0 | 4,01 |
| 15 | Terbutalin | R03AC03 | astma | 22,7 | 454 | 20 | 0,48±0,36 |
| 16 | Mælkesyre- producerende organismer |
A07FA01 | diarré | 21,7 | 0 | - | |
| 17 | Zopiclone | N05CF01 | søvnløshed | 19,8 | 148.5 | 25 | 2,25 |
| 18 | Xylometazolin | R01AA07 | hævede næseslimhinder | 19,4 | 15.5 | 0 | 4,91±0,36 |
| 19 | Nitrazepam | N05CD02 | søvnløshed | 17,7 | 88.5 | 0 | 2,25 |
| 20 | Ketoconazol | D01AC08 | svampe- infektioner (hud) |
17,5 | 7000 | 85 | 4,35 |
| 21 | Diazepam | N05BA01 | angst- og urotilstande | 17,3 | 173 | 0 | 2,82 |
| 22 | Omeprazol | A02BC01 | mavesår | 16,7 | 334 | 20 | 1,80±0,90 |
| 23 | Metoprolol | C07AB02 | forhøjet blodtryk og hjertesygdom | 15,4 | 2310 | 0 | - |
| 24 | Lactulose | A06AD11 | forstoppelse | 15,4 | 103180 | 0 | - |
| 25 | Digoxin | C01AA05 | hjertesygdom | 14,9 | 3.8 | 31 | 1,26 |
| Ciclosporin | L04AA9 | cancer- behandling |
- | - | 65 | - | |
| Erythromycin | J01FA01 | antibiotika | 2,3 | 575 | 60 | 2,49±0,77 | |
| Insulin | A10A | sukkersyge | - | - | 5 | - |
* Lægemiddel nr.
** Lægemiddelkataloget Online WWW.lk-online.dk
*** ACD log P. De opgivne intervaller er 95% konfidensintervaller (Stuer-Lauridsen et al. 2002).
Gestoden (ATC G03D). Hormonalt indholdsstof i p-piller der er artificiel pro-gesteron og som kan indtages oralt da det ikke inaktiveres i leveren.
Desogestrel (ATC G03D). Hormonalt indholdsstof i p-piller der er artificiel progesteron og som kan tages oralt da det ikke inaktiveres i leveren. Er i sig selv inaktiv men omdannes i leveren til det aktive 3-keto-desogetrel.
Amlodipin (ATC C08CA01). Middel mod hjertekramper (Angina pectoris). Virker som kalciumantagonist med overvejende kardilaterende virkning. Indtages som tabletter.
Ibuprofen (ATC M01AE01). Smertestillende gigtmiddel af typen nonsteroidt antiinflammatorisk middel. Indtages som tabletter.
Budesonid (ATC R03BA02) Astmamiddel. Indtages som inhalationsmiddel el. kapsler.
Citalopram (ATC N06AB04) Antidepressivt middel. Indtages som tabletter.
Terbutalin (ATC R03AC03) Astmamiddel. Indtages som tabletter el. inhalationspulver.
Zopiclone (ATC N05CF01). Sovemiddel. Indtages som tabletter.
Ketoconazol (ATC D01AC08) Mod svamp til udvortes brug. Salve.
Omeprazol (ATC A02BC01) Mod for meget mavesyre. Indtages som tabletter eller ved injektion.
Digoxin (ATC C01AA05) Hjerteglykosid mod hjertekramper. Indtages som tabletter eller ved injektion.
Insulin (ATC A10AB01 ) Polypeptid der er nødvendig for opbygning af glykogendepoter, fedtdepoter og protein. Findes som langsom eller hurtigtvirkende. Gives ved injektion.
Erythromycin (ATC J01FA01) Makrolid antibiotika som delvis udskilles med afføringen via galden. Indtages som tabletter og ved injektion.
Ciclosporin (ATC L04AA01). Hyppigt anvendt Cytostatika som primært via galden udskilles med afføringen. Tages som tabletter eller infusionskoncentrat.
3.2.3 Skæbnen af lægemidler
Mange lægemidler metaboliseres helt eller delvist i leveren før ekskretion. Herved forstås at stoffet undergår en kemisk omdannelse, der overordnet set har til hensigt at gøre stoffet mere vandopløseligt og mindre toksisk. Lægemiddelstoffer indeholder ofte mange funktionelle grupper så det kan være svært at forudsige præcist hvordan et stof vil blive metaboliseret. Flere faktorer såsom kroppens pH og evne til at metabolisere (tilstedeværelse af metaboliseringsenzymer), stoffets grad af lipofilicitet, og konkurrence med andre tilstedeværende stoffer har betydning for hvordan stoffet udskilles. Metabolitter udskilles oftest enten via det biliære system med fækalier eller transporteres med plasma til nyrerne for herefter at udskilles med urinen. For nærværende projekt er det derfor primært stoffer der udskilles via det biliære system (også kaldet galden) der har interesse. Det er oftes stoffer med lipofile egenskaber (høj log Kow) der udskilles med fæces. Lægemidler som indtages peroralt, (dvs gennem munden som tablet el. anden doseringsform), og kun delvis absorberes fra tarmen vil også udskilles med afføringen, se Figur 3.1. Mange lægemidler vil derfor, dog ofte i begrænset grad, udskilles med afføringen. Da der her er tale om meget begrænsede koncentrationer i fæces vil dette ikke blive vurderet yderligere her.
Et lægemiddelstof kan ofte gennemgå flere metaboliseringsveje og blive udskilt med både urin og fæces, ligesom der er ofte er en fraktion af det indtagne stof der ikke optages eller ikke undergår metabolisme. Det der findes i fæces vil derfor ofte være en fraktion af den indtagne dose i form af både det indtagne stof og et par hovedmetabolitter. Tabel 3.2 viser for de valgte stoffer den fraktion der normalt regnes for at genfindes i fæces.
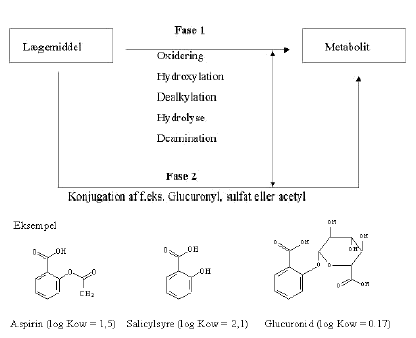
Figur 3.1 Fase I reaktionen kan være en oxidation, reduktion eller hydrolyse af lægemiddel-molekylet. Produktet er oftest et mere reaktivt og polært stof end udgangsstoffet. Den reaktive gruppe i molekylet vil ofte være en hydroxylgruppe, som samtidig vil være det sted en konjugation foregår. Konjugationen udgør fase II, hvor en større gruppe påhæftes, f.eks. en glucuronyl, sulfat eller acetyl gruppe som oftest vil resultere i en vandopløselig og inaktiv metabolit. (Rang og Hale, 1991)
Børn contra voksne.
Børn og unges omdannelse af lægemidler i kroppen adskiller sig ofte fra voksnes grundet biokemiske og fysiologiske forskelle. Der er derfor generelt grund til at være varsom med at give børn unødvendigt medicin og derfor ikke udsætte dem for tilfældig eksponering heraf. Det skyldes bl.a at der i de første leveår foregår en livlig aktivitet i flere organers struktur og størrelse såsom centralnervesystemet, reproduktionsorganer og andre hormonsystemer der er mere sensitive overfor lægemiddelindtagelse end hos voksne. Ser vi på lister over lægemiddelstoffer bør primært hormoner, midler mod hjertesygdomme og cancermidler derfor undgås at blive indtaget utilsigtet af børn.
Normaliseret i forhold til dets vægt, er mindre børns lever og nyrer dog større end ved voksne, og eliminationen af stoffer i leveren foregår derfor relativt hurtigere. Både nedbrydning og udskillelse foregår hurtigere i mindre børn. Den større metaboliseringsrate i børn kan derfor resultere i øget følsomhed over for de stoffer der omdannes til aktive metabolitter der kan have toksiske effekter (f.eks. visse cancermidler). I nogle tilfælde vil den hurtige elimination i og udskillelse fra kroppen dog modvirke de toksiske effekter.
Forekomst af metabolitter i fæces fra nettolisten.
Furosemid (ATC C03CA01). Ca. 60-70 % absorberes fra tarmen således at ca. 33% udskilles via galden med afføringen som konjugeret glucuronidfurosemid.
Østrogen (ATC G03CA). De naturlige østrogener metaboliseres og kunjugeres i tarmen, leveren og nyrerne, og de udskilles gennem nyrerne og fæces (ca. 40%) som glucuronider og sulfater. Konjugerede østrogener er også biologiske aktive fordi de let hydrolyseres til det frie østrogen i mave-tarm kanalen.
Gestoden (ATC G03D). Biotilgængelighden er ca. 85%. Udskilles gennem fæces i højere grad end østrogen som glucuronider og sulfatkonjugater. De konjugerede stoffer er også biologisk aktive - se ovenfor.
Desogestrel (ATC G03D). Biotilgængelighden er ca. 85%. Udskilles gennem fæces i højere grad end østrogen som glucuronider og sulfatkonjugater. De konjugerede stoffer er også biologisk aktive - se ovenfor.
Amlodipin (ATC C08CA01). Biotilgængeligheden er 60-65%. Metaboliseres i leveren til inaktive metabolitter hvorved ca. 50 % udskilles med afføringen som uabsorberes stof eller inaktive metabolitter.
Ibuprofen (ATC M01AE01). Absorberes fuldstændigt fra mave-tarm kanalen og metaboliseres i leveren til inaktive metabolitter. 5% udskilles med afføringen.
Budesonid (ATC R03BA02). Oral biotilgængeligehed er på kun 11% hvorimod det absorberes bedre via luftvejene. Metaboliseres i leveren til inaktive metabolitter såsom 6-?hydroxybudesonide og 16-hydroxyprednisolone. Ca 20% udskilles via afføringen mere ved peoral indtagelse.
Citalopram (ATC N06AB04).Biotilgængeligheden er ca. 80%. Metaboliseres i leveren til delvis aktive metabolitter. 88% udskilles med afføringen.
Terbutalin (ATC R03AC03) Biotilgængeligheden efter peroralt indgift er op til 40%. 20% udskilles med afføringen
Zopiclon (ATC N05CF01). Biotilgængeligheden er ca. 80%. Metaboliseres i leveren via CYP3A4. ca 25 % udskilles via galden med afføringen som inaktive eller delvis aktive metabolitter såsom zopiclone N-oxide og N-desmethylzopiclon.
Ketoconazol (ATC D01AC08) Absorberes i meget varierende grad fra mave-tarmkanalen (20-70%). Absorptionen øges i forbindelse med måltid. Metaboliseres i leveren til inaktive metabolitter og op til 85% kan udskilles med fæces.
Omeprazol (ATC A02BC01) Biotilgængeligheden er ca. 50% og udskilles i begrænset grad med afføringen (20%) som inaktive metabolitter som eksempelvis omeprazol sulfone.
Digoxin (ATC C01AA05) Absorberes ved peroralt indgift 70-85%. Ikke absorberet medicin udskilles med fæces (op til 30%) som aktivt stof.
Insulin (ATC A10AB01 ) Insulin metaboliseres hurtigt til inaktive metaboliter i lever, nyrer og muskelvæv. Da insulin kun kan injiceres vil der ikke findes insulin i fæces. Lidt insulin vil forekomme i urin som uomdannet stof.
Erythromycin (ATC J01FA01) Op til 80% af stoffet udskilles med fæces som både aktive og inaktive metabolitter og ikke-absorberet stof.
Ciclosporin (ATC L04AA01). Ca 90 % af dosen udskilles som metabolitter via galden med fæces.
I de eksponeringsscenarier der evalueres her er der typisk tale om børn som indtager en jordfraktion. Ved sammenligning mellem koncentrationen af lægemiddel i jord/fæces og den terapeutiske dosis for voksne, er der alene gennem indtagelse af jord ikke tegn på at der opnås doser af lægemiddelrester som kan give effekter på børn. I den sammenhæng kan det overvejes om det er ønskeligt at sammenligne følsomme gruppers, i dette tilfælde børns, eksponering til stoffer som de kun i yderst sjældne tilfælde ville blive behandlet med. Det gælder f.eks. digoxin og cancermidler, der kan være lægemidler som raske børn ikke bør udsættes for - en slags "nul tolerance" stoffer, som børn slet ikke bør eksponeres for.
Ved indtagelse af jordrester på grønsager og rodfrugter kan andre følsomme grupper med meget lav eller ingen tolerance overfor visse lægemidler blive eksponeret. Et klassisk eksempel er problemerne ved eventuel forekomst af penicillin, men også f.eks. artificielle gestagener af 19-nortesterontypen som skal undgås i den tidlige graviditet på grund af mulig risiko for virilisering af pigefostre.
Stabilitet under kompostering.
Der er ingen tilgængelige oplysninger i litteraturen om lægemidlers stabilitet i fæces under langtidsopbevaring. Et enkelt studie har dog undersøgt det nærtbeslægtet problemstilling, om antibiotika har effekt på den anaerobe nedbrydning under biogas produktion (Sanz et al., 1996). Dette arbejde viste at, bortset fra makrolidet erythromycin, havde 15 forskellige antibiotika med forskellige virkningsmekanismer en hæmmende effekt på den anaerobe nedbrydning og på methan produktion. Tetracyklinerne og kloramfenikol havde endog stor effekt. Til forskel fra betingelserne for dette projekt var temperaturen i beholderen i det omtalte studie 30°C under hele forsøget.
Indenfor dette projekts rammer vil omsætningen af stofferne derfor kun blive behandlet i overordnede vendinger. Fæces tænkes opbevaret i ca. 1 år og tilsat flis for at hæmme dannelse af anaerobe forhold i en beholder der er afskærmet for lys. Det forudsættes at temperaturen i beholderen under opbevaringen ikke overstiger 20 °C. Under sådanne forhold må det formodes at fæces tørrer mere og mere ud. De generelt højlipofile lægemidler, formodes derfor at sorbere til fæces og med resulterende lav biotilgængelig for evt. bionedbrydning, såvel som mulig fotonedbrydning. Surhedsgraden er ca. neutral (målingsinterval = 6,7 - 8,4) og derfor vil hverken sur eller basisk hydrolyse være udpræget for de fleste af stofferne. Oxidation af lægemiddelstofferene forventes derfor at være den eneste kemiske omdannelsesproces der kan finde sted. Uden at udføre laboratorieforsøg er det ikke muligt at kvantificere en evt. oxidation i beholderen. I nedenstående risikoberegninger er derfor forudsat at lægemiddelstofferne ikke nedbrydes under den 1 årige opbevaring i fæces.
Binding til og optagelse fra jordmatricen efter udbringning.
De undersøgte stoffer og metabolitter i nærværende undersøgelse er overvejende lipofile (se log Kow værdier for stofferne i tabel 5.2) og består ofte af flere funktionelle kemiske grupper med både base eller syre egenskaber. Sådanne stoffer kan tit have en stærk binding til jord (Tolls, 2001; Loke et al. 2002). Fordelingskoefficienten, Kd, imellem jord og vand benyttes ofte til at beskrive denne egenskab. Denne parameter er ikke rapporteret i litteraturen for de undersøgte stoffer, men det må formodes at de opfører sig på samme måde som andre miljøfremmede stoffer med tilsvarende fysisk-kemiske egenskaber. Med de pågældende kemiske strukturer må man antage at de undersøgte stoffer er hårdt bundet til jord med en tilsvarende lav biotilgængelighed.
For tilsvarende lipofile stoffer har man endvidere undersøgt om stofferne ved indtagelse af jord kan frigøres i menneskets tarm og blive biotilgængelige for membrantransport i tarmen. Mange faktorer såsom galdeindholdet i tarmen, ufordøjet fødemængden kan fremme eller hæmme desorptionen af stofferne. En omfattende hollandske undersøgelse (Oomen, 2000) af højlipofile HOC's såsom PCB, og Lindan samt bly, viste at biotilgængeligheden og evt. optagelse gennem menneskets tarm og deraf resulterende toksicitet var afhængig at tilstedeværelse af jord. Hvis stofferne var sorberet på en jordfase så faldt biotilgængeligheden sammenlignet med at stofferne bare blev transporteret med føde eller væske. Dette indikerer at desorptionen af højlipofile stoffer fra jord reduceres i forhold til fra føde og flydende væsker. Konklusionen er at jord hæmmer optagelsen af miljøfremmede stoffer i tarmen. Det blev vurderet at kun op til 50% af den sorberede mængde stof på jorden, blev gjort biotilgængeligt i tarmen afhængig af fødeindhold og galdeinhold i tarmen.
3.3 Risikovurdering for medicinrester
Ved vurderingen af aktivstoffet i lægemidler er anvendt forholdet mellem "predicted environmental concentration" og "predicted no-effect concentration" (PEC/PNEC). Dette er et standard princip som anvendes ved risikovurdering af kemikalier (OECD, 1992; NCM, 1995; EU TGD, 1996). Som applikations- eller sikkerhedsfaktor til beregning af PNEC er brugt værdien 1000. Det er valgt at undlade at benytte den ekstra faktor 10 for små datasæt, som EUs retningslinier for vurdering af lægemidler giver mulighed for (EU, 2002). På en lang række punkter er procedurene fra de nævnte retningslinier ens. Når PEC/PNEC er over en (Risikokvotienten RQ > 1) er der potentiale for miljøeffekter og det anbefales da generelt at undersøge stofferne nærmere. Udfra de fundne PEC og PNEC data udregnes risikokvotienten som:
| Formel (3.1) |
RQ giver en værdi for risikoen på påvirkning af organismer i det miljø hvor PEC og PNEC er bestemt. RQ udtrykker både hvor farligt et stof er og hvor megen viden der er benyttet i evalueringen. Ved fastsættelse af PNEC benyttes en sikkerhedsfaktor, der afhænger af hvor megen viden man har om det pågældende stof. Denne sikkerhedsfaktor har normalt værdien 1000, 100, 50 eller 10, hvor 10 svarer til en meget god viden om stoffets farlighed.
Man kan ikke konkludere, at et stof med RQ = 10 er ti gange så farligt som et stof med RQ = 1. RQ vil for stoffer med få tilgængelige data ofte kunne mindskes ved at tilvejebringe flere økotoksikologiske data fordi sikkerhedsfaktoren der kan sænkes. Det er dog kun under forudsætning af, at der ikke fremkommer data som tyder på større giftighed! Omvendt kan man konkludere, at hvis RQ er større end 100 er det ikke tilstrækkeligt blot at fremskaffe mere viden. Den producerede viden skal samtidig afkræfte hvor farligt man på det nuværende vidensgrundlag mener at stoffet er.
Til vurdering af lægemidler og andre specifikt virkende stoffer kan en tommelfingerregel være at for at kunne udelukke en effekt skal RQ være mindre end 0,1.
Fastlæggelse af eksponering, PEC.
Basisdata for scenarierne A, B og C er beskrevet i afsnit 2.4 og 2.5. Fæces med et indhold af medicinrester som defineret i disse scenarier udbringes derefter ved udlægning. Til beregning af lægemiddelkoncentrationen i jorden efter udspredning (PECjord) anvendes følgende formel:
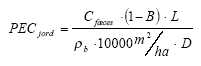 | Formel (3.2) |
Hvor Cfæces er koncentrationen i fæces, B er den fraktion af lægemiddelstoffet der nedbrydes under opbevaring (sættes til 0), L er den mængde fæces der udspredes (kg/ha). ρb er jordens densitet (1500 kg/m3) og D er pløjedybden for den udspredte fæces (1 cm).
Fastlæggelse af økotoksikologi, PNEC.
Predicted no effect concentration (PNEC) er den estimerede koncentration, hvorved der ikke ses effekt på nogen organismer. Den bestemmes i bedste fald ud fra kendskabet til No observed effect concentration (NOEC) data for enkelte organismer, der deles med en sikkerhedsfaktor afhængig af datakendskabet (se nedenstående). Hvis der ikke er NOEC data tilgængeligt anvendes EC50, LC50 eller estimerede data. Når der forefindes data for flere arter anvendes data for den følsomste art.
Størrelsen af sikkerhedsfaktoren afhænger af den tilgængelige datamængde og kvaliteteten af de økotoksikologiske data. For at anvende sikkerhedsfaktoren 10, kræves data opnået ved kroniske test på mindst tre forskellige arter på tre trofiske niveauer. Faktoren 100 kræver EC50 eller LC50 for akut toksicitet for tre forskellige arter og en NOEC, ellers anvendes en faktor 1000 (EU TGD 1996). I nærværende beregninger er anvendt faktoren 1000.
PNEC udregnes således:
PNEC = L(E)C50, LOEC eller NOEC / Sikkerhedsfaktoren
Haves NOEC kun som koncentration i vandigt medium, kan det tillades at oversætte denne værdi til en jordkoncentration som:
NOECjord = NOECvandigtmedium * kd
hvor kd (L/kg) er fordelingskoefficienten imellem vand og jord. Det forudsættes herved at jorden er 50% mættet med vand.
Tabel 3.3 Beregning af PNEC for de 3 lægemiddelstoffer hvor data er tilgængelige.
| Aktivt stof | Test organisme | Test type | Toksisitet | PNEC g/l | kd(jord/vand) | PNEC jord baseret på kd |
| Østradiol(Østrogen) | Fisk, øget vitalogenen konc. Ikke standardtest | LOEC = 0.5 ng/l 1) | 0.5 pg/l! | 17(beregnet) | 0.0085 ng/kg | |
| Ibuprofen | D.magna | akut toksisitet, 48 timer, standard test | EC=9,06 mg/l 2) | 9.06 | 2.3 mg/kg | |
| T. rubrum | bakterietestIkke standard | MIC = 5 mg/l 2) | 5 | 251 (eksperi- mentel) |
1.3 mg/kg | |
| S. costatum | akut toksisitet,96 timer, standard test | EC50 = 7,1 mg/l 2) | 7.1 | 1.8 mg/kg (mest sensitiv på standard test) | ||
| Digoxin | D. magna | Akut toksistet, 24 timer, ikke standard test | EC50 = 21.2 mg/l 2) | 21.2 | 2.6(beregnet) | 0.06 mg/kg |
1) Halling-Sørensen et al (1998)
2) Stuer-Lauridsen et al (2000)
For de fleste stoffer findes der ikke økotoksikologiske data hvorfor PEC/PNEC beregning kun kan foretages på Østrogen, Iboprufen og Digoxin. Usikkerhedsfaktor 1000 anvendt jvf. EU risikovurderingsguideline (EU TGD 1996), når der er begrænsede datasæt uden NOECs. Resultatet af risikovurderingen er vist i Tabel 3.4. Der gøres opmærksom på, at hvis den anvendte LOEC for Østradiol vurderes som en NOEC kan usikkerhedsfaktoren 100 anvendes og risikokvotienterne vil da ligge mellem 4.100 og 37.600.
Tabel 3.4 Beregning af risikokvotienter, RQ, for stoffer hvor fuldt datasæt forefindes. Beregning er mulig for 3 af de 12 stoffer. Resultatet for standard-familie er markeret med fed skrift.
| Stof | PNEC | PEC | RQ |
| Østradiol | |||
| Scenarie A | 8,5 pg/kg | 3200 ng/kg | 376.000 |
| Scenarie B | 8,5 pg/kg | 124 ng/kg | 146.000 |
| Scenarie C | 8,5 pg/kg | 350 ng/kg | 41.000 |
| Ibuprofen | |||
| Scenarie A | 1,8 mg/kg | 24 mg/kg | 13,0 |
| Scenarie B | 1,8 mg/kg | 0,43 mg/kg | 0,3 |
| Scenarie C | 1,8 mg/kg | 2,6 mg/kg | 1,5 |
| Digoxin | |||
| Scenarie A | 0,06 mg/kg | 0,03 mg/kg | 0,5 |
| Scenarie B | 0,06 mg/kg | 0,0003 mg/kg | 0,005 |
| Scenarie C | 0,06 mg/kg | 0,003 mg/kg | 0,05 |
Der er ingen tvivl om, at østradiol med det nuværende datasæt markerer sig som et stof med potentielle miljøeffekter. Selv med et komplet datasæt og en "teoretisk" sikkerhedsfaktor på 1 vil RQ overskride 1. Der skal dog gøres opmærksom på, at det er data for vandmiljø og ikke jordmiljøet som ligger til grund for beregningen.
Ibuprofen ligger også omkring RQ = 1 afhængig af scenariet, hvilket indikerer potentielle effekter. Digoxin synes derimod kun at nå en kritisk RQ (0,1-1) under værst tænkelige forhold, men hører til i gruppen af mulige "nul tolerance stoffer".
3.4 Vurdering af risiko for akutte effekter
Den sundhedsmæssige vurdering tager også udgangspunkt i de tre scenarier for kemisk risikovurdering.
Beregningerne viser at ratioen mellem en voksendosis af det pågældende lægemiddelstoffet og indholdet i en 200 mg klump i alle tilfælde med en faktor 1000, se Tabel 3.5. I de fleste tilfælde er denne faktor på mere end en faktor 10.000, svarende til at man skal indtage mellem 200 g og 2 kg fæces for at indtage en døgndosis, og for flere af stofferne op til 10 kg jord. Det bemærkes, at der i Larsen (1998) er vurderet, at det absolut maksimale indtag af jord beregningsmæssigt kan sættes til 10 g, og at selv ved dette indtag vil TDI ikke være nær. Det er derfor i praksis ikke muligt at man via en enkelt dags eksponering i haven kan indtage hvad der svarer til en dagsdosis medicin.
Tabel 3.5 Antallet af gange en voksendosis af det pågældende lægemiddelstof overtiger indholdet af stoffet i 200 mg fæces.
| Lægemiddelstof | Scenarium A | Scenarium B | Scenarum C |
| Furosemid | 49632 | 3030 | 8333 |
| Gestoden | 80791 | 2500 | 6875 |
| Østrogen | 129266 | 5000 | 13750 |
| Amlodipin | 43907 | 1111 | 3056 |
| Ibuprofen | 1114917 | 20000 | 55000 |
| Budesonid | 279728 | 5000 | 13750 |
| Desogestrol | 150085 | 2500 | 6875 |
| Østrogen | 40022654 | 5000 | 13750 |
| Citalopram | 73905 | 1136 | 3125 |
| Terbutalin | 343807 | 5000 | 13750 |
| Zopiclone | 315330 | 4000 | 11000 |
| Ketoconazol | 104933 | 1176 | 3235 |
| Omeprazol | 467330 | 5000 | 13750 |
| Digoxin | 337927 | 3226 | 8871 |
3.5 Diskussion af resultater
3.5.1 Kemisk risikovurdering
Normalt regnes PNEC systemets sikkerhedsfaktorer (10-1000)for relativt konservative. Imidlertid undtages specifikt virkende stoffer fra EU's retningslinier som omhandler industrikemikalier, idet der findes andre retningslinier for pesticider og biocider der er de typiske specifikt virkende stoffer på markedet. Disse retningslinier indeholder særlig afsnit om stoffernes virkemåde som lægger op til valg af særlige relevante test. Sådanne resultater fra specielt udvalgte følsomme test er ikke til rådighed for lægemidler i dag, og applikationsfaktorerne er derfor ikke nødvendigvis så konservative for lægemidler som for andre kemikalier.
Generelt er der ikke mange data om nedbrydning af lægemidler under miljørelevante forhold. På grund af relativ lav temperatur og sorption til partikler regnes der ikke med nedbrydning under komposteringen, mens der til gengæld regnes med fuldstændig nedbrydning i jordmiljøet i løbet af 12 måneder og derfor ingen akkumulering fra år til år af lægemidler ved tilførsel af komposteret fæces. Validiteten af disse antagelser hviler på et relativt spinkelt grundlag. I virkelighedens verden vil en stor del af lægemidlerne utvivlsomt omsættes ret hurtigt kemisk og biologisk, mens en lille andel vil vise sig at modstå omsætning enten som moderstof eller metabolitter.
3.5.2 Akutte effekter
Det kan konkluderes, at der med hensyn til indholdet af lægemidler ikke er nogen sundhedsmæssig risiko ved at spise i størrelsesorden 200 mg fæces indeholdende lægemiddelrester. Der skal indtages mellem 200 g og 2 kg fæces for at indtage enkelt voksen dosis.
For visse særlige stoffer såsom hormoner, cancermidler, antibiotika kan man ud fra et forsigtighedsprincip ønske at følge et "nul tolerance"-princip for deres forekomst i jord for at beskytte udsatte grupper. Visse mennesker/aldersgrupper kan af forskellige grunde have en stor følsomhed for disse stoffer.
Eksempler på sådanne stoffer, hvor der er vanskeligt at fastsætte "sikre" niveauer, kan være:
- Artificielle gestagener af 19-nortesterontypen pga. mulig risiko i den tidlige graviditet for virilisering af pigefostre.
- hormoner generelt, i dag er der særlig fokus på kønshormoner, men også adfærdspåvirkende stoffer kan være relevante.
- penicillin og andre antibacterielle midler for at beskytte penicillinallergikere,
- digoxin, hvor selv meget små doser er virksomme og tit i et smalt terapeutisk vindue. For sådanne stoffer er det vanskeligt at fastsætte dosis-effekt relation for specielt børn.
- cancermidler, som kan være kraftige cellegifte og celledelingshæmmere.
3.6 Delkonklusion for afsnittet
En vurdering af TDI og den forventede koncentration af tungmetaller og persistente miljøgifte, eksemplificeret ved dioxiner, i komposteret fæces giver ikke anledning til bekymring selv ved 200 mg fæces indtaget dagligt af et barn på 10 kg. Grænseværdien ved udbringning af slam ville være overskredet for cadmium og kviksølv. Indholdet af disse metaller er også nær grænseværdien for indhold i uforurenet jord. Ingen af disse grænseværdier er dog gældende for udbringning af komposteret fæces i private haver.
Aktive lægemiddelstoffer, primært i form af nedbrydningsprodukter og metabolitter, udskilles med fæces og vil havne i miljøet, hvis komposteret fæces anvendes i private haver som gødning selv efter langtidsopbevaring.
Nedbrydningsprodukterne og metabolitterne vil generelt have lavere aktivitet end moderstoffer. Nedbrydningen sker primært i mennesket inden udskillelse og stofferne vurderes ofte til at være meget stabile i fæces under opbevaringen pga af de fysiske forhold i opbevaringstanken.
Antallet af medicinerede personer med bolig på adressen er mest betydningsfuld for de anslåede koncentrationsniveauer. Kontinuerlig medicinering for specielt livsstilssygdomme, såsom hjerte-kar sygdomme, stress- og søvnproblemer og for hormonelle tilstande har indvirkning på koncentrationsniveauet i den oplagrede fæces.
Familiens gæsters og familiens antibiotikabehandlinger i løbet af året bidrager ikke væsentligt i den totale medicinmængde, der udskilles til fæcesbeholderen sammenlignet med kontinuerlig medicinering af enkeltpersoner i familien, især hvis disse har livsstilssygdomme eller kroniske lidelser.
Økotoksikologiske data findes kun for meget få lægemiddelstoffer, således at det kun har været muligt at udføre en begrænset PEC/PNEC beregning i jordmiljøet for 3 lægemiddelstoffer. Kun få økotoksikologiske data på vandorganismer kan anvendes fordi fordelingskonstanten imellem jord og vand ikke kendes. Der er ingen data for relevante arter for jordmiljøet.
Den acceptable risikokvotient er overskredet for 2 ud af de 3 stoffer ved et scenarie, hvor indholdet af fæces fra en standard-familie udbredes i haven. Det kan derfor ikke udelukkes, at der, for visse stoffer, vil være risici i forbindelse med udspredning af fæces i haver.
På det nuværende datagrundlag kan en risiko for effekt på miljøet ikke afvises for stoffer som anvendes i store voluminer eller har lave effektkoncentrationer.
Baseret på sammenligning af anbefalet dagligt indtag og de forventede koncentrationer i fæces, er det generelt usandsynligt at mennesket påvirkes væsentligt selv ved indtagelse af komposteret fæces direkte fra jorden. Stoffer, hvor man ønsker "nul tolerance", vil dog blive indtaget. Det kan være stoffer som påvirker mennesket i dets udviklingsstadier, giver allergi, har celletoksicitet, langtidseffekter og/eller hormonlignende effekter.
4 Mikrobiel risikovurdering
4.1 Brug af resultater fra en risikovurdering
En risikovurdering er en beregning med en model, der giver det bedst mulige svar på det man spørger om. Hvis vigtige processer ikke er med eller er modelleret forkert, bliver svaret tilsvarende upræcist. Dette er ikke mindst væsentligt at bemærke da der er en væsentlig usikkerhed på såvel input parametre som på hvordan processerne forløber. Antagelserne og scenarierne er dermed vigtige for, hvorvidt der beregnes en høj, acceptabel eller lav risiko.
Risikovurderinger har ikke stor værdi isoleret set. Risikovurderingen er et skridt i en iterativ proces som kan beskrives i en cyklus, se Figur 4.1. Alle tilstande i denne cyklus er dynamiske. Risikovurderingen er den kvalitative og/eller kvantitative vurdering af forskellige specifikke risici i samfundet under forskellige forhold. Når resultatet af risikovurderingen foreligger kan det sammenlignes med sundhedsmålene, hvorefter de risici der er påpeget i risikovurderingen må håndteres som led i risikohåndteringen. Den ændrede adfærd medfører en ny sundhedstilstand i befolkningen, hvorefter nye risikovurderinger kan være aktuelle.
Figur 4.1 Cyklus til vurdering og håndtering af sundhedsricisi. Optegnet på baggrund af Fewtrell og Bartram (2001)
4.2 Metode for mikrobiel risikovurdering
En risikovurdering består af fire delelementer:
- Identifikation og beskrivelse af farer
- Vurdering af eksponering
- Analyse af dosis-respons
- Beregning og vurdering af risiko.
I det følgende beskrives de enkelte delelementer kort. Delelementerne beskrives mere udførligt i de følgende kapitler.
4.2.1 Identifikation og beskrivelse af farer
Når fæces behandles lokalt og udbringes i private havebrug kan der være en risiko for human eksponering af bl.a. patogener. Det skyldes bl.a. at komposteringen sker under forhold, der ikke sikrer en effektiv barriere mod smitte og påvirkning. Eksponeringen vil afhænge såvel af de forhold der er under den lokale kompostering som af de konkrete processer der udføres, såsom håndtering af kompostbeholderen, spredning i haven, ophold i have med udspredt kompost.
Påvirkningen vurderes ved, at typiske forekomster af de patogener der udskilles via fæces kort gennemgås med henblik på at identificere de væsentligste risici i forbindelse med den ønskede anvendelse af fæces. De væsentligste patogener beskrives herefter med hensyn til risiko for forekomst, vækst og henfald i kompostbeholderen og de efterfølgende processer.
Beskrivelsen af metoder for udvælgelse og bestemmelse af forekomst af patogenerne i nærværende projekt er beskrevet i kapitel 5.
4.2.2 Vurdering af eksponering
Hele arbejdsgangen i forbindelse med håndtering og brug af fæces og human eksponering vurderes og beskrives. Beskrivelsen udmunder i et beregnet oralt indtag af en mængde patogener. Det er endvidere centralt at udvælge de (grupper af) personer, som har mulighed for at blive påvirket, herunder om der er særlige grupper, der er ekstra følsomme eller immune overfor den pågældende påvirkning.
Beskrivelsen af eksponeringen er foretaget i kapitel 6.
4.2.3 Analyse af dosis-respons
For patogener er brugen af en dosis-respons kurve veldefineret og benyttes som en beskrivelse af, hvor stor indtaget af patogenet skal være før mennesker inficeres. Dosis-respons kurven varierer for forskellige personer og befolkningsgrupper og der er derfor tale om en fordelingsfunktion. Velbestemte dosis-respons kurver forefindes dog kun for raske voksne personer.
Definitionen af dosis-respons for de forskellige typer af farer er beskrevet i kapitel 7.
4.2.4 Beregning og vurdering af risiko
På baggrund af konkrete tal for hver proces udregnes herefter risikoen for at blive påvirket af de forskellige farer. Beregningen kan foretages for flere scenarier med forskellige forudsætninger og vil belyse, hvilke trin i processen, der er de mest kritiske i forhold til smitte-risici.
Beskrivelse af hvordan modellen er opstillet og resultatet af beregningerne er diskuteret i kapitel 8.
4.2.5 Sundhedsmæssig vurdering
På baggrund af risikovurderingerne gives en sundhedsmæssig vurdering hvor de fundne resultater sættes i perspektiv.
Den samlede sundhedsmæssige vurdering er beskrevet i kapitel 9.
5 Humanpatogene mikroorganismer i lokalt komposteret human fæces
I fæces forekommer et stort antal forskellige typer af mikroorganismer, hvoraf de fleste er harmløse. Syge mennesker og symptomfri bærere udskiller i kortere eller længere tid patogener. Mængden af udskilte patogener varierer afhængigt af hvilket patogen der er tale om. Efter udskildelsen kan mængden af patogener vokse eller falde, afhængigt af betingelserne i omgivelserne.
Kapitlet er organiseret, således at der først er en beskrivelse af de organismer, der oftest benyttes som indikatorer for fæcal forurening. Dernæst opstille en bruttoliste over de patogener som vurderes at kunne være relevante i forbindelse med infektion forårsaget af brug af lokalt komposteret fæces. Endelig beskrives de mest relevante patogener operationelt i forhold til risikovurderingen. Denne beskrivelse består i en fordeling for forekomst i en kompostbeholder med kontinuert tilledning fra en husstand samt fordelinger for henholdsvis vækst og henfald af de enkelte patogener i såvel en kompostbeholder som efter udspredning i haven.
5.1 Brug af indikatororganismer
5.1.1 Formål
Indikatorbakterierne er normale tarmbakterier som forekommer hos alle varmblodige dyr inklusive mennesker. Forekomst af disse i eksempelvist et vandløb, på marker, på afgrøder eller lignende viser oftest, dog ikke altid, tegn på en fæcal forurening og under visse forhold, grader af forurening. Udover indikatorbakterier kan bakteriofager anvendes. Bakteriofager er bakterievirus som har specifikke bakterier eller grupper af bakterier som værtsorganisme. Hvis disse bakterier er normale tarmorganismer bliver også deres fager indikatorer på en fæcal forurening.
Årsagen til at man i forskellige sammenhænge supplerer indikatorbakterier med bakteriofager er at de senere kan have en anden overlevelseskarakteristik og herigennem fuldstændiggør risikoen for materialet, specielt i relation til overlevelse af virus. Bakteriofager, som er ufarlige for mennesker og dyr, anvendes bl.a. som indikatororganismer for varmemodstandsdygtige virus.
I dette studie inkluderes de grupper af indikatororganismer, som sædvanligvis anvendes i afløbssammenhæng, dvs. Escherichia coli (normalt analyseres for gruppen af termotolerante coliforme bakterier, som dog også kan indeholde andre arter) og enterokokker (tidligere benævnt fæcale streptokokker).
Coliforme bakterier og enterokokker anvendes eksempelvis i dag som som kontrolparameter i den offentlige kontrol af vand i landets kommuner. Termotolerante coliforme bakterier anvendes til kontrol af badevand og enterokokker benyttes som indikatorbakterie for at påvise mulig forekomst af patogene bakterier og enteriske virus i eksempelvis råslam samt patogene mikroorganismers eventuelle reduktion efter slambehandling i for eksempel biogasanlæg (Bendixen, 1994).
To anvendelsesområder hvor det ifølge Strauch og De Bertoldi (1991) kan være interessant at anvende indikatorbakterier er:
- når man vil kontrollere effektiviteten af desinfektionsprocesser (varme, forhøjelse af pH og langtidsopbevaring kan i denne sammenhæng ses som desinfektionsprocesser) for bakterier. Her er enterokokker den bedste indikator eftersom E. coli blot påviser markant utilstrækkelig behandling, samt
- når man vil undersøge om opformering sker i et hygiejniseret materiale. Her kan E. coli være anvendelig.
Organismer kan også anvendes som validering af processer eller procesparametre, som for eksempel et komposteringsforløb eller påvirkning fra eksempelvis temperatur, tid, fugtighed m.m. I denne sammenhæng kan enten de i materialet normalt forekommende organismer anvendes, eller der kan ske en tilførsel af valgte organismer i velkendte mængder. I det sidste eksempel vælger man sædvanligvis organismer med en forhøjet resistens, eftersom deres henfald med en vis sandsynlighed også gælder for andre organismer, som representerer patogener med mere omfattende symptombilleder.
Bakterielle indikatorer er ikke altid tilstrækkelige indikatorer for tilstedeværelse og henfald af patogener. Derfor er forskellige bakterievirus anvendt som indikator på virusreduktion. Salmonella senftenberg 775w er eksempelvis valgt som den mest temperaturresistente for Salmonella og andre bakterier indenfor Enterobacteriaceae og Ascaris æg (sædvanligvis fra grisens spoleorm Ascaris suum) som repræsentant for de mest levedygtige typer af parasitæg. Blandt de i det foreliggende studie valgte parasitter kan Ascaris (spoleorm) derfor til en vis grad være en procesindikatororganisme for parasitter. I Sverige har man anvendt Ascaris æg som en procesindikator i vådkomposteringsprocesser (Norin et al, 1996). Ascaris forekommer regelmæssigt i svinebesætninger og ofte også i mange andre dyrehold. I Danmark er infektion med Ascaris hos mennesker meget sjælden nu til dags.
5.1.2 Valg af indikatororganismer i denne undersøgelse
I denne undersøgelse er der fokuseret på at beregne forekomst og indtag af følgende indikatororganismer:
- E. coli Benyttes i næsten alle sammenhænge og er velbeskrevet
- Enterokokker Har lidt andre karakteristika end E. coli og benyttes også hyppigt
- Bakteriofager Benyttes som den bedste indikator for tilstedeværelse af fæcalt udskilte vira.
5.2 Patogener i fæces i Danmark
5.2.1 Bakterier
Nedenfor nævnes kort de mest almindelige bakterier hvorfra smitte via fæces er relevant. Beskrivelsen fokuserer på forekomst, smittebærere, vigtigste arter og infektivitet.
Ud over bakterierne nævnt nedenfor kan det nævnes at termofile (eller andre) svampe kan være i vækst i materialet under nedbrydning. Sporerne herfra kan medføre allergiske reaktioner hvis de forekommer som aerosoler og hvor høj eksponering kan forekomme.
Campylobacter. Campylobacter er en almindelig forekommende bakterie over hele verden både hos mennesker og dyr - en zoonose. Blandt smittebærerne er forskellige fuglearter, kvæg, får og geder, hunde, katte, gnavere og andre dyr.
Der findes adskillige arter som kan forårsage diarre og andre symptomer. Blandt disse er Campylobakter jejuni og Campylobacter coli de mest almindelige. Smittedosen er lav - der er opgivet helt ned til 500 bakterier. Periode som smittebærer og for udskillelse er normalt ca. 3 uger. Længere periode som smittebærer kan forekomme. Bakteriernes overlevelse i naturen er ikke fastslået. De formodes at dø indenfor et par uger, men et ikke-dyrkbart men stadig smitsomt stade kan forekomme. Campylobacter medtages ikke i risikovurderingen fordi der er for stor usikkerhed om bakteriens evne til at overleve i naturen og fordi andre arter der overlever længere i miljøet er medtaget i vurderingen.
Toxisk Escherichia coli, EHEC. Bakterien Escherichia coli blev tidligere betragtet som en harmløs bakterie, der forekom som en del af den normale flora hos mennesket. I de seneste årtier er det påvist at adskillelige forskellige typer af E. coli kan fremtræde som sygdomsfremkaldende organismer for mennesker og dyr. For tiden er der fokus på enterohaemorrhagic stammer (EHEC, se nedenfor). Mindst seks forskellige typer af E. coli kan fremkalde sygdom hos mennesker. Disse er enterohaemorrhagic E. coli (EHEC), enteroinvasive E. coli (EIEC), enteropathogenic E coli (EPEC), enterotoxinproducerende E. coli (ETEC), enteroadherant E. coli (EAEC) og enteroaggresive E. coli (EaggEC). Bakterierne forekommer i tarmene hos mennesker og hos visse dyr og udskilles i fæces. De kan alle overføres gennem forurenet vand og ved dårlige hygiejniske forhold, men overføres oftest fra person til person eller gennem kontamineret mad. Bakterierne kan vokse i naturen under favorable vilkår.
Mange forskellige serotyper kan fremkalde sygdommen, men den mest almindelige er E. coli O157. Smittedosen kan være lav - ned til 100-1000 bakterier. Dette modsvarer nogle af de andre typer hvor høje koncentrationer er nødvendige - 104-106 bakterier eller mere. Der er stor bevågenhed omkring specielt serotype O157 på grund af de alvorlige symptomer, hvorfor EHEC medtages i risikovurderingen.
Listeria. Listeria er en ofte forekommende bakterie i naturen. Den findes i jord, vand og i tarmene hos mange dyr og mennesker. Listeriosis fremkaldes af bakterien Listeria monocytogenes, som kan vokse også ved lave temperaturer. Mennesket kan smittes fra dyr og madvarer. Tilfælde af smitte fra vand er også registreret. Bakteriens overlevelse og potentielle opformering i kompostmateriale er ikke veldokumenteret og den typiske transmissionsrute er gennem mad, hvorfor den ikke medtages i risikovurderingen.
Salmonella. Salmonellosis forekommer globalt. Bakterien kan forekomme både hos mennesker og hos en række varm- og koldblodede dyr, som også kan tjene som reservoir. Bakterien kan opformeres i madvarer, men også i dårligt passet kompost og slam. Smittedosen er normalt høj, mere end 100.000 bakterier, men er anlægs-bestemt, således at små børn, ældre og immunokompromiterede er mere modtagelige. Kombineret med fedtholdige fødevarer (eksempelvis ost og chokolade) kan den nødvendige smittedose nedsættes væsentligt, ned til få hundrede bakterier. Smittebære i en periode på 4-6 uger er normalt, men nogle få individer kan bære og udskille organismerne i måneder, endog år. Bakterien medtages i risikovurderingen på grund af den relativt store incidens i befolkningen og fordi bakterien overlever længe.
Shigella. Fire forskellige arter af disse enterobakterier forekommer med mennesker som eneste reservoir. Disse er Shigella dysenteriae; S. boydii; S. flexneri og S. sonnei. Af disse bakterier er S.dysenteriae type 1 den mest alvorlige type, som også producerer shiga toxin. Shigella udskilles i fæces og smitten sker fra person til person ved snavsede hænder og ved kontaminerede fødevarer og vand. Genbrug af ubehandlet latrin affald i landbrug såvel som vask af grønsager i forurenet vand kan overføre bakterien og hermed forårsage sygdom. Sekundærtilfælde er almindeligt forekommende. Infektionsdosen er lav, mellem 100 og 1000 bakterier kan være nok. Udskillelsestiden er normalt under 4 uger, men asymptomatisk smittebæring kan forekomme. Overlevelsestiden i naturen menes at været kort hvorfor bakterien ikke medtages i risikovurderingen da andre arter dermed vurderes at udgøre en væentligt større risiko.
Vibrio cholerae. Kolera forårsages af bakterien Vibrio cholerae. Der findes forskellige arter. Infektionsdosen er normalt høj. Bakterien udskilles med fæces og overføres gennem forurenet vand eller dårlig hygiejne. Dette organisme har imidlertid ikke fremkaldt tilfælde i Skandinavien i årtier og vurderes derfor ikke i denne sammenhæng.
Yersinia. Yersiniose er en zoonotisk infektion, som forekommer globalt. Den fremkaldes af Yersinia enterocolitica, Yersinia pseudotuberculosis eller tilsvarende stammer. Bakterien kan være i vækst ved lave temperaturforhold (4°C). Organismen udskilles med fæces og smitten foregår gennem kontaminerede fødevarer og vand. Infektionsdosen er ikke klart fastslået. Smittebærere i adskillige måneder kan forekomme og bakterien kan også udskilles fra dyr, såsom grise, hunde og fugle. Medtages ikke fordi smittevejene ikke er kendte i denne sammenhæng.
5.2.2 Virus
Udover de nedenfor nævnte vira kan også Echovirus, Adenovirus, Astrovirus og Coronavirus være vigtige. De er ikke indeholdt i kommentarerne nedenfor enten på grund af manglende kendskab til smitte karakteristika i naturen eller fordi de har en reaktion og overlevelsesevne som svarer til grupperne nævnt nedenfor. For vira gælder generelt, at de kan overleve længe udenfor den menneskelige krop, men at de kun kan opformeres via en vært samt at de har en lav infektionsdosis.
Calicivirus. Denne gruppe omfatter mange forskellige typer vira, såsom Norwalk virus, Norwalk lignende virus eller klassiske calicivira. Disse vira udskilles med fæces. Infektionsdosen formodes at være nogle få viruspartikler, men der foreligger ikke egentlige undersøgelser. Udskillelse og smitte kan forekomme et par dage efter helbredelse, hvorimod kronisk smittebærere ikke er kendt. Calicivirus kan ikke dyrkes og påvises i miljøprøver hvorfor henfaldsdata er ukendte. Derfor inddrages calicivirus ikke i risikovurderingen, selv om den umiddelbart var det oplagte valg.
Coxsacki infectioner. Coxsacki B vira kan overføres såvel via fæces som via luften.Infektionsdosen er nogle få partikler. Vira kan overleve i måneder under de rette forhold. Den dominerende smittevej er person-person via aerosoler og fækal-oral transmission. Coxsacki B virus er påvist i spildevand og derfor kan vand være en mulig smittevej, men denne antagelse er ikke blevet bekræftet. Derfor inddrages Coxsacki ikke i risikovurderingen.
Hepatitis A. Denne virus forekommer globalt og forårsager smitsom leverbetændelse, der kan medføre sygemelding på mere end 6 måneder. Smitte spredes gennem forurenet vand og miljø. Denne virus kan overleve i længere perioder i naturen (måneder) og i vand med en lav infektionsdose - nogle få partikler. I materiale kan det tåle udtørring, der har imidlertid ikke været gennemført omfattende undersøgelser i fækalt materiale. Hepatitis A medtages i risikovurderingen på grund af det i nogle tilfælde alvorlige sygdomsforløb.
Rotavirus. Denne globalt forekommende viral agens kan forårsage voldsom diarre. Smitten rammer fortrinsvis børn. Vira udskilles i store mængder fra fæces og smitte spredes fra person til person eller gennem forurenet miljø såvel som vand og fødevarer. Inkubationstiden er 1-3 dage. De klareste symptomer er diarre og opkast i en periode på 4-6 dage. Overlevelsesperioden for rotavirus i miljøet er lang - måneder. Infektionsdosen er lav. Rotavirus medtages i risikovurderingen på grund af den for virus typiske karakteristika kombineret med en høj incidens og tilgængelige undersøgelser om dosis-respons sammenhængen.
5.2.3 Parasitter (protozoer, metazoer og orm)
Giardia: Giardiasis forårsages af Giardia intestinalis (også kaldet Giardia lamblia og G. duodenalis). Giardia er en zoonose, dvs. den påvirker både mennesker og dyr. Parasitter forekommer enten i et vegetativt stade (trophozoider) eller i et hvilende stade (som cyster). Smitte sker i det sidstnævnte stade. Cysterne er resistente overfor varme (op til 60°C). De er relativt påvirkelige af fugtindhold og kan ikke opformere udenfor værtsorganismen. Overlevelse kan under de rette forhold overleve i måneder i naturen. Giardia udskilles med fæces. Infektionsdosen er lav - mindre end 100 cyster - og udskillelse kan forsætte i måneder og år. Giardia medtages i risikovurderingen fordi incidensen er relativt stor og parasitten er velbeskrevet.
Cryptosporidium. Cryptosporidiosis er en parasitær protozo infektion og en zoonose, dvs. at den påvirker både mennesker og dyr. Der findes mange arter af Cryptosporidium, men sygdom hos mennesket fremkaldes fortrinsvis af Cryptosporidium parvum. Infektionsdosen for modtagelige individer er lav - fra nogle få til hundrede oocysts. Oocysts er meget resistente overfor påvirkninger, herunder desinfektion. Overlevelsestiden bliver undersøgt og menes at være måneder. Den kan dog være følsom overfor udtørring. Cryptosporidium medtages i risikovurderingen fordi den er velbeskrevet og har en rimelig incidens i Danmark.
Entamoeba histolytica (organismen som forårsager "amøbedysenteri" og giver komplikationer). Infektionsdosen er lav - bare nogle få cyster kan inficere en modtagelig person. Asymptomatiske smittebærere kan forekomme i længere perioder (år). Inkubationstiden er normalt mellem 2 og 4 uger. Kommentarer: I realiteten findes der 2 arter, Entamoeba histolytica og Entamoeba dispar. Sidstnævnte er ikke sygdomsfremkaldende, men kan ikke skelnes ved mikroskopi. I tarmene forekommer parasitterne i sin vegetative form, trophozoiter, men udskilles fra kroppen som cyster med fæces. Trophozoiterne er antiinfektiøse og påvirkes let af lav fugtighed og høje temperaturer, hvorimod cyster er meget mere resistente. Cyster kan leve og være infektiøse i jord, vand og fækalt materiale i måneder og år. De kan ikke opformeres i naturen. Protozoen medtages ikke i risikovurderingen fordi incidensen i Danmark er lav og fordi henfaldsraterne er høje sammenlignet med Giardia og Cryptosporidium.
Cyclospora. Cyclospora cayetanensis er en forholdsvis nyopdaget parasitær protozo som forårsager diarre. Reservoiret for organismen er ikke kendt. Organismen udskilles i fæces og smitter ved direkte indtagelse, forurenet vand, frugter eller grønsager. Infektionsdosen er ikke tilstrækkelig undersøgt, men sandsynligvis lav. Det er ikke sandsynligt at der forekommer smitte fra person til person. Inkubationstiden er ca. 1 uge. Udskillelsestiden er usikker. Organismens overlevelsestid i naturen er ikke kendt, men ligger sandsynligvis på måneder. Cyclospora er ligesom andre sygdomsfremkaldende parasitære protozoer meget resistent overfor disinfektion såsom kloring. Cyclospora medtages ikke i risikovurderingen fordi viden om karakteristika og incidens er mangelfuld og at karakteristika menes at være som Cryptosporidium.
Ascaris. Ascaris lumbricoides er en af de mest almindeligt forekommende parasitorm, som påvirker mennesket. Den findes primært i områder med dårlig hygiejne med smittespredning fra fæcalt forurenet jord og grønsager. A. lumbrocoides kan ikke inficere andre dyr. Æggene skal have en latenstid uden for kroppen på ca. 2 uger før de bliver inficeret. Smitte kan ikke spredes direkte fra person til person. Æggene forbliver inficeret i lange perioder i naturen - op til flere år. Inkubationstid kan ikke fastslås men livscyklus i kroppen varer mellem 4 og 8 uger. Infektion med og forekomst af nogle få orm forårsager oftest ingen symptomer, hvorimod mange orm kan forårsage ernæringsforstyrrelser for det inficerede individ. Ascaris medtages i risikovurderingen på grund af den lave infektionsdosis og lave henfaldsrater.
Enterobius. Enterobius eller børneorm er en globalt forekommende parasitær infektion, som forårsager voldsom kløe omkring anus. Den forårsages af en spolorm, Enterobius vermicularis, som er ca. 10 mm lang. Mennesket er det eneste reservoir. Ormene udskilles med fæcalt materiale eller overføres ved direkte kontakt. Sekundær smitte gennem naturen kan forekomme. Ormen medtages ikke i risikovurderingen fordi den generelt ikke forefindes i fæces og den dominerende smittevej er direkte fækal-oral.
5.2.4 Valg af patogener der indgår i risikovurderingen
På baggrund af diskussionen af de mulige patogener i det foregående afsnit er en række organismer valgt til at belyse risici for infektion med patogener. Udvælgelsen er baseret på følgende kriterier:
- Alle typer af organismer skal være repræsenteret, dvs. indikatorer, bakterier, vira og parasitter
- Organismerne skal i rimeligt omfang være til stede i Danmark
- De mest overlevelsesdygtige organismer skal være medtaget
- Orgamismer med lave infektiøse doser skal være repræsenteret.
- Organismer med alvorlige symptomer skal i højere grad medtages.
- Der skal være et rimeligt kendskab til organismen
På den baggrund er følgende organismer udvalgt til at indgå i beregningerne:
- Indikatorer
- E. coli
- Enterokokker
- Bakteriofager
- Bakterier
- Toxisk E. coli (EHEC)
- Salmonella
- Virus
- Rotavirus
- Hepatitis A
- Parasitter
- Giardia
- Cryptosporidium
- Ascaris
5.3 Modeller for udvalgte patogener
For at kunne modellere risikoen for infektion via lokalt komposteret fæces er det nødvendigt at beskrive mængden af patogener fra det tidspunkt hvor de udskilles i beholderen til en person eksponeres. Det er dermed nødvendigt at beskrive følgende hoved-processer:
- Mængde og hyppighed af udskilning af patogener i beholderen
- Henfald af patogener i beholderen
- Henfald af patogener i haven
Hver af disse processer fastlægges i det følgende.
5.3.1 Mængde og hyppighed af udskilning af patogener i fæces
Forekomsten modelleres ud fra langtids-simuleringer af tilfælde af infektioner hos en husstand med fire personer. Der er simuleret mange dynamiske fyldninger og tømninger af komposteringsbeholderen, alle med udgangspunkt i, at én af personerne i husstanden på et tilfældigt tidspunkt i løbet af fyldningsåret er blevet inficeret. Mængden af udskilte patogener ved hver infektion modelleres herefter ud fra varigheden af udskilningen af patogener samt hvor mange patogener der udskilles. Det antages, at personen er syg hjemme, således at alle patogener opsamles i beholderen. Til gengæld for denne konservative antagelse er det antaget, at kun én af personerne inficeres i løbet af én fyldning, svarende til, at risikoen for sekundær smitte i familien ikke er medtaget i modellen, hvilket er en antagelse, der generelt vil undervurdere den faktiske mængde patogener i de tilfælde hvor et medlem af familien er inficeret. Sekundær smitte kan dog forekomme i forbindelse med alle smitteveje. I den forbindelse bør det fremhæves at risikoen for at en inficeret person som udsondrer mikroorganismer via fæces har meget højere sandsynlighed for at smitte familiemedlemmer direkte end via opsamlet og opmagasineret fæces.
Data er skønnet på baggrund af data fra bilag A. Der er væsentlig usikkerhed i forbindelse med simuleringen af forekomsten af patogener i beholderen, altså hvor tit en inficeret person vil benytte det pågældende toilet. Antallet er skønnet på baggrund af hyppigheden af infektioner (incidenser) i Danmark. Generelt forventes det, at antallet af inficerede er 5 - 20 gange større end de officielle indrapporterede tal. Faktoren menes at afhænge af symptomernes alvorlighed og varighed, således at f.eks. de officielle tal for rapporterede forekomster af Hepatitis A er mere retvisende end for eksempel de tilsvarende tal for infektioner med Salmonella og parasitter.
Der er også væsentlig usikkerhed på hvor store mængder af patogener der udskilles under infektion. Typisk er der i de få undersøgelserne der er foretaget fokuseret på at bestemme den maksimale mængde der udsondres i den eller de dage hvor infektionen topper. Det vides, at der i en del tilfælde fortsat udskilles patogener lang tid efter den almene varighed og at en del af befolkningen udskiller mindre mængder af patogener uden symptomer, såkaldte raske smittebærere. I forbindelse med nærværende undersøgelse antages det, at de raske smittebærere udskiller så små mængder patogener, at der i praksis kun er lille risiko for infektion.
Incidensskøn er baseret på tre kilder: de rapporterede forekomster af patogenet fra Zoonosecenteret og Statens Serum Institut, Hald og Andersen (2003) samt skøn over mørketal. Mørketallene er skønnet ud fra symtomerne på sygdommen, således at alvorlige infektioner af f.eks. Hepatitis A har lavere mørketal end infektion med Salmonella. Baggrunden for de skønnede incidenser er yderligere uddybet i bilag A og de benyttede fordelinger er beskrevet i bilag C. Udskilningen er baseret på de undersøgelser der er afrapporteret i litteraturen, typisk en enkelt undersøgelse af hvert patogen. Varigheden er den bedst beskrevne, idet den er skønnet ud fra typiske sygdomsforløb.
Tabel 5.1 Modeller for Incidens, udskilning og varighed for udvalgte indikatorer og patogener.
| Incidens, I(Antal inficerede pr år*100.000) | Udskilning, U(antal/g vådvægt) | Varighed, V(dage) | ||||
| Typisk | Variation | Typisk | Variation | Typisk | Variation | |
| Indikator organisme | ||||||
| E. coli | 100.000 | - | 107,5 | 106 - 109 | 365 | - |
| Enterokokker | 100.000 | - | 105,5 | 105 - 106 | 365 | - |
| Bakteriofager | 100.000 | - | 102,5 | 102 - 103 | 365 | - |
| Bakterie | ||||||
| Salmonella | 500 | 300-700 | 106,0 | 104 - 108 | 37 | 25 - 55 |
| EHEC | 30 | 20-40 | 102,5 | 101,5 - 103,5 | 8 | 5 - 13 |
| Virus | ||||||
| Rotavirus | 1200 | 800-1600 | 109,0 | 107 - 1011 | 5 | 0,5 - 60 |
| Hepatitis A | 6 | (4-8) | 105,0 | 104 - 106 | 20 | 12 - 33 |
| Parasitter | ||||||
| Giardia | 1100 | 900-1300 | 106,5 | 105 - 108 | 90 | 22 - 365 |
| Cryptosporidium | 200 | 150-250 | 107,5 | 107 - 108 | 7 | 1 - 40 |
| Ascaris | 20 | 14-26 | 104,0 | 103,5 - 104,5 | 245 | 90 - 665 |
5.3.2 Vækst og henfald af indikatorer og patogener i beholder
I bilag B er alle relevante data for henfaldsrater fra litteraturstudiet gennemgået og sammenstillet. Det er kendetegnende, at ikke er ret mange undersøgelser og at der er stor variation mellem resultaterne.
Mikrobielt henfald beskrives ofte ved hjælp af en eksponentiel model. Denne model opsamler viden om henfaldet ved at beregne en T90-værdi, der er den tid som det tager at inaktivere 90% af de udskilte
patogener. For en eksponentiel model vil T90-værdien altid være den samme, uanset antallet af patogener.
Den eksponentielle model passer ofte meget fint med eksperimenter, men kan ved lange forløb passe dårligt med virkeligheden fordi der efter lang tids henfald sker et af to: enten er de sidste patogener
meget resistente eller også henddør de sidste pludseligt. Der er dog ikke data til at modellere hvornår denne periode indtræffer og hvorvidt der er tale om persistente mikroorganismer eller pludseligt henfald.
Derfor estimeres kun T90 værdien for hver organisme. Data er analyseret og vigtigheden er bedømt fortrinsvis ud fra:
- formen af data, f.eks. er total inaktivation mindre brugbart end log-reduktion. Log-reduktion indikerer samtidig at studiet indeholder mere grundige undersøgelser.
- indgangsvinklen til det vurderede system, f.eks. materialetype og temperaturområde brugt i studiet.
Data er delt i to temperaturområder, lavt temperaturområde (4°C) og højt temperaturområde (20°C). Dette er gjort eftersom studier ofte gennemføres under forskellige temperaturforhold. Temperaturområderne repræsenterer to ekstremer for latrinbeholdere og jord. Der er i risikovurderingen taget udgangspunkt i, at beholderen opbevares indenfor ved ca. 20°C (altså højt temperaturområde) indtil udspredning og at temperaturen i haven i eksponeringsperioden svarer til lavt temperaturområde. Begge temperaturområder er dog angivet for begge miljøer, således at varierende temperaturforhold kan diskuteres kvalitativt.
Udover temperaturer er der en række faktorer der influerer på levedygtigheden, f.eks. fugtindhold og pH, som listet i tabellerne. Disse informationer mangler imidlertid i mange tilfælde. En præcis sammenligning med systemer vurderet i Danmark kan derfor ikke gennemføres. Mikrobiel konkurrence, sollys, tilstedeværelse af ammonium og andre skadelige kemiske forbindelser kan også påvirke levedygtigheden. Hvor det er muligt, er forholdene og deres evt. påvirkning for den enkelte organisme behandlet i de følgende afsnit.
Kun få studier omfattede direkte optælling af patogener for fækale (gødning, slam osv.) eller jord matricer. De studier som inkluderede fækale og jordmatricer omhandlede typisk påvirkningen ved ændring af en enkelt miljømæssig stressfaktor af gangen. Konklusionen er, at der er et stort behov for omfattende studier af kombination af miljømæssige stressfaktorer, især protozoer og viruspatogener. Herudover bør der være en øget forståelse for at de biologiske faktorer spiller en rolle, f.eks. antogonisme, konkurrence og predation. Kun få studier undersøger påvirkningen fra disse faktorer ved evaluering af inaktivation og transport af patogener. Det vil tage nogen tid før disse huller er fyldt ud. I mellemtiden må man sætte sin lid til antagelser og forholdsmæssige skøn.
Henfaldet af bakterier opgøres som T90-værdier. Hvor det ikke fremgår af referencen er T90-værdier beregnet i dage. Hvis referencen angiver en rækkevidde af reduktioner, f.eks. 2-3 log på 40-60 dage er værdien 2.5 log og 50 dage anvendt. En forudsætning om lineær inaktivering er nødvendig for at bruge disse antagelser.
Resultatet af gennemgangen af bilag B har medført skøn over henfald af patogener som vist i Tabel 5.2. Nedenfor er diskuteret antagelserne der har ført til de angivne værdier.
Tabel 5.2 Data som bruges ved modellering af overlevelse i fæces. Den statistiske model er baseret på det høje temperaturområde svarende til indendørs opbevaring. Den præcise model er beskrevet i bilag C. De fundne henfald for virus virker usandsynligt lave, idet man ofte antager, at virus er inaktiveret efter et år (Stenström, 2003).
| Organismer til modellering | 4°C/lavt temperaturområdeT90 (dage) | 20°/højt temperaturområdeT90 (dage) | Model for henfaldi fæces | |
| Typisk | Variation | |||
| Indikatororganisme | ||||
| E.coli* | 70-100 | 15-35 | 25 | 17 - 33 |
| Enterococci* | 100-200 | 150 | 110 - 190 | |
| Bakteriofager | 20-200 | 10-100 | 28 | 9 - 45 |
| Bakterielle patogener | ||||
| Salmonella* | 10-50 | 30 | 14 - 46 | |
| EHEC* | 10-30 | 20 | 12 - 28 | |
| Virus | ||||
| Rotavirus | Konservativ model - ingen reduktion100-300 | 20-100 | 60 | 28 - 92 |
| Hepatitis A | Konservativ model - ingen reduktion100-600 | 20-50 | 55 | 19 - 91 |
| Parasitære protozoer | ||||
| Giardia | 15-100 | 5-50 | 28 | 9-45 |
| Cryptosporidium | 30-200 | 20-120 | 70 | 30 - 110 |
| Parasitorm | ||||
| Ascaris | 100-400 | 50-200 | 125 | 65 - 185 |
* Evt. vækst ikke medtaget
Indikatorbakterier. Reduktionstider mangler fortrinsvis i nyere litteratur omhandlende human fæces. Som substitut er anvendt værdier for dyregødning og slam (afvandet slam). Vanskeligheden ved at fastslå reduktionsmulighederne er generelt mangel på data vedrørende miljøparametre. For eksempel er henfald i dyregødning hurtigere end forventet i tørt opsamlet fækalt materiale. Det skyldes at det høje urinindhold medfører højere pH på grund af indholdet af ammonium. Modsat er fugtindholdet i fæces lavere end i dyregødning, hvilket forkorter levetiden i fæces sammenlignet med dyregødning. Generelt resulterer en lav temperatur i en langsommere reduktionstid (højere T90-værdi), hvorimod temperaturer over organismens vækstminimum kan resultere i genvækst, hvis materialet ikke stabiliseres (det samme kan være tilfældet efter en vis overrisling af tørt opsamlet materiale, der ikke er komposteret). En sådan genvækst kan resultere i fluktuerende antal i en længere periode.
E. coli. Der er lavet en række danske studier om overlevelse af E. coli ved lave temperaturer i dyregødning, selvom såvel pH som fugtindhold formodentlig er højere. Det franske studie (Gantzer et al. 2001) blev gennemført udendørs og rapporterede overlevelsesdata fra vinterperioden, hvilket må formodes at omfatte lavere temperaturer end ved fækal lagring i kældre eller lignende. Et skøn baseret på en kombination af disse to referencer er en T90 værdi på 70-100 dage. For at opnå bredere temperaturområder kan yderligere referencer inkluderes. Da det er usandsynligt at temperaturerne overstiger 20°C, anvendes værdierne fra Feachem et al. (1983) som den laveste temperaturgruppe (omtrent som den danske), hvilket resulteret i et skøn på 15-35 dage. Et skøn baseret på erfaringer er derimod, at minimums T90-værdier er gældende snarere end maksimumværdierne (Stenström, personlig kommentar). Hvis temperaturen stiger til væsentligt mere end 20°C kan genvækst forekomme, svarende til en negativ T90-værdi.
Enterokokker. Genvækst kan også forekomme for den fækale indikator enterokokker (tidligere kaldet fækal streptokok). Denne organisme kan under gunstige forhold være i vækst ved temperaturer under 10°C, men udviser fortrinsvis en forlænget levetid. Enterokokker er foreslået som en relevant indikator for slam og kompostmateriale under processer ved høje temperaturer. I undersøgelsen gennemført af Gantzer et al. (2001) viste enterokokker en reduktion og genvækstværdi svarende til coliforme omtalt ovenfor. I den tilsvarende undersøgelse gennemført af Gibbs et al. (1997), viste de imidlertid en umiddelbar meget lavere reduktion efterfulgt af en stigning i antallet. På baggrund af disse referencer er forudsat en langsommere uddøen af enterokokker end af fækale coliforme, hvor der som T90-værdi er valgt et gennemsnit af undersøgelserne udført af Ganzer et al. 2001 og Gibbs et al, 1997. Ligesom for E.coli synes inaktivation at være noget højere. Data er opgivet for "udendørs studier" og efter det høje temperaturområde, men det synes usandsynligt med lavere inaktivation ved det lave temperaturområde.
Bakteriofager. Bakteriofager fundet i fæces kan opdeles i somatiske colifager, F-specifikke (F+) bakteriofager og fager som påvirker anaerobe organismer (bacteroides). De somatiske colifager påvirker fortrinsvis E. coli og er den mest forekomne fage i human fæces. Antallet er imidlertid ofte lavt (<103/g) eller ligefrem upåviselig. F-specifikke fager synes ikke overvældende, 0 - 2 % mennesker er rapporteret at have udskilt disse fager, og for bakteriofager generelt er det tilsvarende tal 5 - 10 %. Brugen af fager som indikator for henfald af enterovirus i human fæces kan derfor være begrænset. Da de imidlertid formerer sig i spildevandssystemer har de andre implikationer i påvisning af fækal forurening.
Ligesom for enterovirus kan karakteristika for bakteriofager variere betydeligt. Der er publiceret flere studier om fagers overlevelse i vand, som illustrerer en varierende modstandskraft overfor miljøpåvirkninger. Studier om human fæces og lignende materiale er mere sjældent forekomne. Referencerne i bilag B viser T90 på 5 - 39 dage for F+ fager. Lignende resultater er opnået for Salmenella fager, men kortere levetid er reporteret ved studier af tørlatriner tilført aske, hvilket forøger pH. Højere pH som resultat af urin i dyregødning giver en hurtigere uddøen af F+ fager. Tallene i Tabel 5.2 inkluderer højere T90 værdier som kun tilpasses uddøen i fæces. En højere værdi findes, idet Salmonella fager var mere persistent end rotavirus i det citerede urin-eksperiment.
Bakterielle patogener
En ofte anvendt reference og "standard" værdi for maksimum overlevelses tid for enterobakterielle patogener er givet af Kowan, 1985, f.eks. i EPA (1999). Dette er en normal maksimal levetid på 2 måneder med et absolut maksimum på 1 år ved usædvanlige forhold (f.eks. fugt og beskyttede forhold). Dette er formodentlig fortrinsvis baseret på foreløbige mængder i ubehandlet slam. Ud fra denne værdi vil 1 års lagring af opsamlet fæces være tilstrækkelig til at sikre den videre behandling af materialet og genbrug til havebrug og på landbrugsarealer med reference til entero bakterielle patogener.
Salmonella. Alle referencer om salmonellas levetid ved lave temperaturer vedrører materiale med højt fugtindhold. Der hvor det er angivet, er pH værdien ikke væsentlig højere end forventet i human fæces. Kvægfæces kan anvendes som surrogat, men er forskellig alt afhængig af kost og fordøjelse. Beregning af denne T90 omfatter også adskillige usikre parametre. Tilsvarende værdier er opnået ved udendørs lagring af spildevandsslam. I tabellen med det høje temperaturområde, er der visse modsvarende resultater som teoretisk resulterer i en lavere overlevelsesgrad. En kombination fra alle referencer blev derfor anvendt - en rækkevidde for T90 på ca. 10-50 dage. Temperaturen er en styrende faktor for henfald med længere levetider (men mindre mulighed for genvækst) ved lavere temperaturer.
EHEC. Som nævnt ovenfor er der for EHEC også mulighed for genvækst i materiale ved favorable/ufavorable forhold. Ellers vil maksimum levetiden sandsynligvis ligge tæt på den for fækale coliforme/E.coli, som vil kunne anvendes. Maksimum levetid i kogødning ligger i området 56-100 dage (Wang et al. 1996; Hegrestad 2001) med nogle få højere værdier. Med baggrund i Himathongkham et al (1999) og Wang et al (1996) er anvendt en gennemsnitlig T90 værdi på 10-30 dage for temperaturområdet 4-20°C. Begge kilder er baseret på kontrollerede laboratorieundersøgelser. Værdierne er samlet, eftersom længere levetider blev rapporteret for de højere temperaturer omkring 20°C af Himathongkham et al. (1999).
Patogene vira
Overlevelsesgraden for virus i fæces og slam refereres ofte som en gylden standard iflg. Feachem (1983). Den forventede maksimum levetid er her opgivet til mellem 20-100 dage. I løbet af det sidste årti er der imidlertid sket store fremskridt indenfor virologi, hvilket har givet bedre muligheder for at gennemføre studier af virus. Mange af disse studier indikerer at virus er persistente i miljøet, og med en lav infektionsdosis regnes de ofte som den gruppe patogener der udgør den største risiko. Et stort antal forskellige enterovirus kan udskilles fra fæces og deres karakteristika og dermed deres persistens i miljøet kan variere betydeligt.
Rotavirus. I dette studie blev det valgt at bruge rotavirus til risikovurdering. Der eksisterer imidlertid meget få data om smitte efter langvarig lagring af fæces eller andet materiale ved omgivelsestemperaturer.
En maksimal levetid på 32 måneder for svine rotavirus (Ramos et al 2000) er sandsynligvis ikke relevant ved yderligere risikovurdering. Baseret på registrerede værdier af lave temperaturer i slam for enterovirus og i human fæces for Hepatitis A virus (HAV) angivet i Bilag B, er der opstillet et teoretisk scenario for værst tænkelige tilfælde lig med ingen reduktion (forsigtig modellering). En langsom men betydelig reduktion i området opgivet for HAV tilført human fæces og dyregødning kan forekomme. Blandet affald, som indeholder urin (og dermed ammonium) er sandsynligvis skrappere mod virus end fæces. Lagring af rotavirus i urin med en pH på 9 (5°C) havde stort set ingen effekt og det er tidligere påvist at rotavirus ikke påvirkes af ammonium (Knowlton & Ward, 1987). Dette indikerer at rotavirus kan være mere resistent end HAV i denne form for materiale. Rotavirus var det mest robuste virus i studiet gennemført af Pesaro et al. 1995. Det foreslås at anvende et forsigtigt skøn eller et område med høje T90 værdier.
Ved høje temperaturer (20-25°C) er der en tydelig inaktiveringe af alle virus i Bilag B, som ligger i den samme størrelsesorden. T90 værdier i området 21-91 dage er rapporteret og foreslås anvendt som input til Tabel 5.2. Dette understøttes endvidere af studier af salmonellafager i Mexico og Vietnam, til trods for at disse studier er gennemført ved højere temperaturer og pH, hvilket skulle resultere i en højere inaktivationsrate. Der ses en hurtigere reduktion ved højt pH og lav fugtindhold, som vist i Bilag B.
Hepatitis A
Der er et enkelt studie specifikt på Hepatitis A udført ved (25°C), der afrapporterer T90 på 35 dage. Usikkerheden på denne værdi er skønnet til 15 dage. Ved lavere temperaturer var der to undersøgelser med væsentligt forskellige resultater. Undersøgelsen af henfald i ren human fæces skønnede en T90 værdi på 600 dage svarende til intet henfald. Dette er benyttet som en nedre grænse for henfaldet. Se i øvrigt diskussionen under Rotavirus.
Parasitter
Ældre referencer (f.eks. Feachem 1983) der opgiver overlevelsesgraden af protozoer i fæces og slam er ofte baseret på studier og kendskab til Entamoeba. Der har været større interesse for både Giardia og Cryptosporidium i de sidste år, men selvom der er foretaget megen forskning er det mest relateret til tilstedeværelsen og levetiden for cyster og oocyster i vand. Overlevelsen i animalsk fæces (og jord) er rapporteret som både kortere og længere sammenlignet med vand. Generelt regnes Giardia og Cryptosporidium for at være mere resistente overfor miljøpåvirkninger end Entamoeba. Ligeledes er Cryptosporidium generelt mere resistent end Giardia. Den gamle "gyldne standard" regnes derfor som mindre vigtig i vurderingen.
Selv ved lave koncentrationer af ammonium påviste Jenkins et al. (1998) en betydelig nedgang i levedygtigheden for Cryptosporidium oocyster in vitro. De fandt at en procentdel af virkningsløse oocyster var omvendt proportionale til eksponeringstid og koncentration af ammonium. Herudover, ser det ud til at en interaktion mellem ammonium og komponenter i urin understøtter inaktivation af Cryptosporidium oocyster (Höglund og Stenström, 1999). Dette antyder at inaktivation af protozoer generelt og især for Cryptosporidium er hurtigere i affaldsmateriale der indeholder urinfraktioner end i fæces.
De gennemførte analyser af levedygtigheden af Giardia og Cryptosporidium er meget omdiskuterede. Hovedspørgsmålet er sammenhængen mellem levedygtighed og infektionsdygtighed. Der ligger også begrænsninger i metoderne for hvor store reduktioner (hvor mange logaritmer) der kan måles. Ved mikroskopi metoder er det muligt at måle 2, højst 3 log reduktioner.
Giardia. I et studie (to tests) blev inaktivation af Giardia i slam ved omgivelsestemperaturer undersøgt. Cyster var stadig til stede efter henholdsvis 6 måneder og >1 år lagring. Koncentrationerne varierede gennem studieforløbet, men var ved begge tests reduceret ved testens afslutning. I kvæg fæces var levetiden markant kortere og en temperaturforskel blev rapporteret. Ved gennemførelse af smittedygtigheds studier (mus) var Giardia cyster smittedygtige i maksimalt 1 uge ved begge temperaturområder. Området for T90 værdier i Tabel 5.2 er minimumsværdier baseret på studier i kvæg fæces, hvorimod maksimumværdierne er anslåede værdier, hvilket giver et bredt område, men stadig lavere værdier end indikeret i slamstudiet.
Cryptosporidium. De forventede temperaturforskelle kan ikke påvises ud fra resultaterne i Tabel 5.2. Resultater fra studier hvor overlevelse i både jord og (kvæg) fæces blev undersøgt indikerer en tilsvarende inaktivationsrate. Der er ikke fundet undersøgelser der viser de ekstreme værdier opgivet for jord af Jenkins et al. (2002), men T90 værdierne er vurderet med et temmeligt højt maksimum med baggrund i dette studie og fordi det er velkendt at Cryptosporidium oocyster generelt er persistente mikroorganismer. Levetiden ved lave temperaturer er ændret til at være længere end ved høje temperaturer.
Ascaris. Adskillige studier om overlevelsen af spolormeæg i human fæces er gennemført ved SIDA-finansierede projekter i forskellige asiatiske lande. Tilsætning af aske (som adsorbent) forhøjer normalt pH og resulterer i en hurtigere inaktivation. Normalt tælles ikke mere 100-300 æg, når man vurderer tabet af levedygtighed. Detektionsgrænsen er derfor højere end for andre mikroorganismer og maksimum 2 log inaktivationer kan måles. Harske æg er mest sensitive overfor udtørring og temperaturer over 40°C. Skønnede T90 værdier er vist i Tabel 5.2.
5.3.3 Henfald af indikatorer og patogener i jord
Paradigmet for opstilling af henfaldskoefficienter for patogener i jord er det samme som for opbevaring i beholderen uden tilledning og det er ligeledes data fra bilag B der er benyttet. I Tabel 5.3 er angivet de resulterende værdier. Diskussionen af værdierne er angivet nedenfor.
Tabel 5.3 Data til modellering for overlevelse i jord. Den statistiske model er baseret på det lave temperaturområde da den gennemsnitlige temperatur i de relevante måneder er ca. 11°C og dermed oftest nær det lave temperaturområde.
| Organismer til modellering | 4°C/lavt temperaturområdeT90 (dage) | 20°/højt temperaturområdeT90 (dage) | Model for henfald i jord | |
| Typisk | Variation | |||
| Indikatororganisme | ||||
| E.coli* | 20-100 | 15-70 | 60 | 28 - 92 |
| Enterokokker* | 20-80 | 15-50 | 50 | 26 - 74 |
| Bakteriofager | 10-100 | 5-50 | 55 | 19 - 90 |
| Bakterielle patogener | ||||
| Salmonella* | 20-50 | 15-35 | 35 | 23 - 47 |
| EHEC* | 10-40 | 25 | 13 - 37 | |
| Virus | ||||
| Rotavirus | 10-50 | 5-30 | 30 | 14 - 46 |
| Hepatitis A | 50-100 | 10-50 | 75 | 55 - 95 |
| Parasitære protozoer | ||||
| Giardia | 20-40 | 5-20 | 30 | 22 - 38 |
| Cryptosporidium | 40-950 | 30-400 | 495 | 131 - 860 |
| Parasitorm | ||||
| Ascaris | 250-1000 (i jord) | 15-100 (på jord) | 625 | 375 - 925 |
* Evt. vækst ikke medtaget
Indikatorbakterie
Såfremt der foreligger data på patogener, er indikatororganismerne af begrænset interesse.
E.coli. Ved inkludering af fækale coliforme ligger T90 for E.coli på 23-70 dage. Dette omfatter både dele af det lave temperaturområde (ned til 9°C) og det højere temperaturområde. Referencer for jord indikerer et tilsvarende eller til dels højere henfald sammenlignet med fæces, gylle og lignende produkter. Dette stemmer overens med de generelle værdier rapporteret af Feachem (1983). Der mangler referencer for det lave temperaturområde, derfor er max. værdien skønnet for T90 ved disse temperaturer.
Enterokokker. Enterokokker reduceres hurtigere end E. coli i det omtalte studie. Dette stemmer ikke med skønnene for inaktivation i fæces (eller lignende materiale). Studiet indikerer en temperaturpåvirkning, derfor er der skønnet lavere T90 værdier for det høje temperaturområde. Det er antydet at inaktivation i jord er betydelig hurtigere end i fæces. Ifølge referencerne er der skønnet en mindre forskel for E. coli. Derfor og med baggrund i de få referencer er T90 værdier tilpasset til højere værdier end rapporteret af Lau og Ingham (2001).
Bakteriofager. Muligheden for brug af bakteriofager som indikator for henfald af enterovirus er omtalt ovenfor. Såfremt de er tilstede eller tilføres i større mængder er det naturligvis muligt at følge inaktivation over en periode. En reference angiver at colifager er meget persistente ved lave temperaturer (ingen reduktion ved et 20-dages eksperiment). T99 værdier for MS2 fager rapporteret i et andet studie var imidlertid lave, svarende til T90 værdier på 11 dage ved 15°C. På grund af manglende referencer og viden om general modstandsdygtighed for fager er T90 groft skønnet til temmelig høje værdier.
Bakterielle patogener
Salmonella. Den maksimale levetid for Salmonella kan ved usædvanlige forhold være mere end 6 måneder (Albihn og Stenström, 1998). T90 værdierne ved brug af dyregødning eller slam kan blive påvirket af jordforhold med moderate værdier på 2-4 uger (Lewis-Jones og Winkler, 1991), hvilket svarer til værdierne fundet af Natvig et al (2002) ved forskellige jordforhold. Der findes ingen specifikke data for lavere temperaturer. Der forventes en højere T90 værdi sammenlignet med højere temperaturer. Overlevelse i jord er formodentlig højere end på jord, specielt på afgrøder. Forhøjet fugtighed, f.eks. ved nedsivning, kan forårsage en stigning af Salmonella på adskillige dekader.
EHEC. Laboratorieundersøgelsen gennemført af Jiang et al (2002) ved forskellige temperaturer på sandblandet ler tilført kogødning viste T90 værdier på 8-32 dage. Modsat hvad der kunne forventes, overlevede EHEC længere ved varme temperaturer. Materialet var temmelig tørt, hvilket kan have forkortet levetiden. T90 blev derfor forhøjet med nogle få dage for at inkludere mere fugtige forhold. Ligesom Salmonella, kan EHEC også vokse efter regn.
Patogene vira
Bakteriofager med sammenlignelige isoelektriske punkter kan være egnede som potentielle indikatorer for den adsorberende reaktion af humane patogene virus. Ved jord, har det imidlertid været vanskeligt at finde data på virus såvel som på fager.
Rotavirus. Der findes få resultater om overlevelse af virus i jord. Det var betydelig nemmere at finde data om overlevelse på afgrøder, f.eks. på overfladeafgrøder, hvilket formentlig kan sammenlignes med jordoverflade. Nogle af disse data var relateret til markvanding med spildevand eller lignende. Fæces og jord giver et mere beskyttet miljø, som resulterer i længere levetid. Dette er også indikeret af Damgaard-Larsen (1977), som fandt virus i jord (Danmark) i op til næsten et halvt år. Selv ved sommertemperaturer i Florida var levetiden vurderet til 2-4 uger, hvilket resulterede i T90 værdier på 1-2 uger eller mindre, såfremt en 99% reduktion eller mere kunne måles. Ved modellering af levetid på afgrøder (ekskl. rodfrugter såsom gulerødder m.v.) kan høje inaktivationsrater derfor være nyttige.
Hepatitis A
Der er fundet enkelte undersøgelser på overlevelse af Hepatitis A i jord. I en af undersøgelserne afrapporteres T90 værdier på 10-50 dage ved 25°C og en anden undersøgelse angiver 35 dage. Disse værdier svarer til henfald i fæces. Ved lavere temperaturer angives lavere estimater.
Parasitære protozoer
For de parasitære protozoer gælder de samme generelle kommentarer for nedbrydning på og i jord, som blev nævnt under nedbrydning i fæces, blandt andet fordi de primære undersøgelser er foretaget i forbindelse med vandbårne sygdomme.
Giardia. T90 værdierne beregnet af Hu et al. (1996) vist i Bilag B er fra et varmere klima (sammenlignet med Danmark), der er imidlertid ikke angivet noget temperaturområde. Jorden havde en høj surhedsgrad og et lavt fugtindhold, hvilket formentlig har forhøjet inaktivationsraten. Det andet studie viste en forventet temperaturpåvirkning og er givet en højere vægtning ved vurderingen i Tabel 5.3. Som det fremgår af resultaterne i Bilag B, er Giardia mindre resistent end Cryptosporidium. De lave Cryptosporidium værdier adskilte sig dog ikke væsentligt fra Giardia værdierne, og i nogle tilfælde er det foreslået at anvende den samme inaktivationsrate som for Cryptosporidium for en forsigtig modellering.
Cryptosporidium. Der er gennemført en grundig undersøgelse af Jenkins et al. (2002) hvor levetider for Cryptosporidium blev undersøgt ved forskellige jordtyper, tre forskellige temperaturer og tre forskellige fugtighedsgrader. Fugtindhold havde ikke den store indvirkning på levetiden, derfor er samlede T90 værdier vist i Bilag B. Jordtypen adskilte sig ved indholdet af sand, silt og ler (f.eks. partikelstørrelse) og havde derfor forskellige karakteristika. Udover temperatur, menes pH at påvirke levetiden med en lavere inaktivationsrate i neutral jord sammenlignet med sur jord. Inaktivationsraten for oocyster var imidlertid langsom ved alle jordtyper og af samme størrelsesorden. Derfor er alle resultater ved henholdsvis 4°C og 20°C anvendt ved beregning af maksimumværdien (gennemsnit af de tre jordtyper) vist i Tabel 5.3. Fugtighed havde ingen indvirkning på oocysters overlevelse i andre studier (f.eks. Jenkins et al., 1999). Det er derimod sandsynligt at temperatur har en større påvirkning. Dette studie afveg væsentligt fra de to andre rapporterede studier. Ved lave temperaturer var inaktivationsraten omtrent en størrelsesorden højere, hvilket resulterer i T90 værdier med en stor spændevidde.
Ascaris. Ifølge litteraturstudie udført af Lewis-Jones og Winkler (1991) overlever Ascaris 1 måned i jord. Levetiden i jord er forlænget betydeligt med overlevelse fra 1½ år op til 14 år (hvilket er en ekstremværdi). Omgivelsestemperaturen og fugtigheden er imidlertid ikke nævnt. På afgrøder blev der ikke fundet æg efter 10 dage, idet afgrøderne blev overvandet og pga. inaktiveringseffekt fra sollys, iflg. forfatterne. Ellers er udtørring den mest sandsynlige mekanisme for inaktivering af overfladeafgrøder. Forsigtige skøn er at foretrække grundet mangel på information om forholdene hvorunder disse levetider er registreret. I stedet for at vise T90 værdier for forskellige temperaturer, er der lavet en deling af æg i jord og på jordoverfladen.
6 Human eksponering
For hver proces og hver eksponering skønnes et indtag af lokalt komposteret fæces. Indtaget vil afhænge af de enkelte scenarier og af, hvorvidt det er en voksen eller et barn der eksponeres. Det antages, at kun oralt indtag kan medføre en uønsket hændelse, idet det respiratoriske indtag er meget lille og ingen af de modellerede patogener smitter via kontakt.
Eksponeringen overfor den lokalt komposterede fæces foregår ved, at personer indtager en lille klump kompost, eventuelt opblandet med jord. I forbindelse med eksponeringerne er der to ting, der skal fastlægges:
- Hvor meget man udsættes for pr gang man eksponeres
- Hvor tit man eksponeres
Først fastlægges det generelle niveau for, hvor meget jord man udsættes for i forbindelse med et ophold i haven. I forbindelse med de enkelte typer af eksponeringer fastlægges herefter såvel antallet af eksponeringer som forholdet mellem jord og fæces i den jord-blanding man udsættes for.
6.1 Indtaget jord/fæces mængde per eksponering
Mange undersøgelser anvender en værdi på 200 mg jord pr. dag som en standard værdi for børns eksponeringer overfor jord. Larsen (1998) angiver på baggrund af et litteraturstudie forskellige værdier, der alle foreslår standardværdier på dette niveau og konstaterer, at værdien svarer til omtrent 90-95% fraktilen i de fundne fordelinger. Fælles for undersøgelserne er også, at nogle børn indtager mere jord end andre og at der er variationer mellem dage afhængigt af hvor stor en del af tiden der tilbringes udendørs. Alt i alt betyder det, at der er store forskelle på hvorvidt der opgives middelværdier eller medianer.
Værdierne fra litteraturen i Larsen (1998) er optegnet i Figur 6.1. I Larsen (1998) er angivet det absolutte maksimum til 5-10 g. Den fittede model svarer til at et sådant indtag forekommer sjældnere end hvert 10. år ved eksponering hver dag.
Der er ikke afrapporteret tilsvarende grundige undersøgelser af voksnes indtag. Disse er derfor skønnet ud fra de tilsvarende standardværdier for indtagelse. Disse værdier ligger på 15-50% af indtaget for børn. Endvidere er det maksimale indtag sat til maksimalt 100 mg/d, svarende til en mindre spredning. Børns indtag topper omkring 1 år og falder hurtigt derefter. Som seks-årig forventes indtaget således at være på niveau med voksne.
I nærværende undersøgelse udføres beregninger med standard-familien bestående af et lille barn og et større barn og to voksne. Da det antages, at opholdet i haven vil udgøre en tilsvarende sammensætning vil der i modelberegningerne blive benyttet den sorte kurve, der svarer til, at 25% af eksponeringerne sker med et lille barn og 75% med et stort barn eller voksne.
På Figur 6.2 er vist modellen af voksnes indtag sammen med et "standard-medlem" af familien svarende til en vægtning af de enkelte medlemmers eksponeringer i en samlet fordeling.
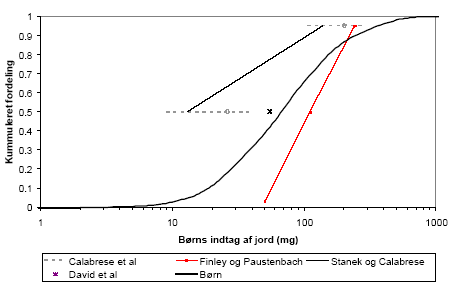
Figur 6.1 Børns Indtag af jord mv. per dag med eksponering. Middelværdien af den estimerede fordeling er 155 mg pr .dag. Værdien 200 mg jord pr. dag overskrides ved 80% fraktilen for børn.
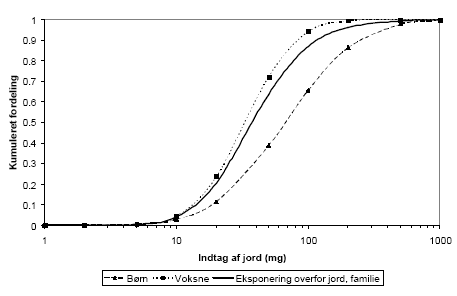
Figur 6.2 Børns og voksnes indtag af jord mv per dag med eksponering. Endvidere er indtegnet det forventede indtag af et "standard-medlem" af familien.
I kapitel 2 diskuteres de forskellige scenarier, hvor der skelnes mellem udlægning og indarbejdning. Ved udlægning lægges den lokalt komposterede fæces oven på jorden og indarbejdes kun lidt, mens der ved indarbejdning sker en væsentlig mindskelse af eksponeringen, bortset fra den ene eksponering, hvor man indarbejder jorden.
I Politiken (2002) er det refereret, at det hovedsageligt er de voksne der udfører havearbejdet. Imidlertid må det forventes, at børnene ofte er i nærheden, om end de ikke deltager aktivt i selve havearbejdet. Derfor vurderes det, at indtaget pr. eksponering er svarende til standard-familiens indtag, som beskrevet på Figur 6.1, dog korrigeret for, at en del af indtaget vil være jord og ikke lokalt komposteret fæces.
Forholdet mellem jord og komposteret fæces er ca. 1:10 og 1:100 ved hhv. udlægning og indarbejdning. Disse forholdstal er benyttet til at konstruere fordelinger for indtaget af komposteret fæces ved hhv. udlægning og indarbejdning. Skaleringen er foretaget ved at fastholde 50% fraktilen og derefter øge spredningen så man i nogle tilfælde vil indtage hvad der svare til ren fæces.. De resulterende modeller for eksponering er vist på Figur 6.3. Parametre for de forskellige modeller er angivet i Tabel 6.1.
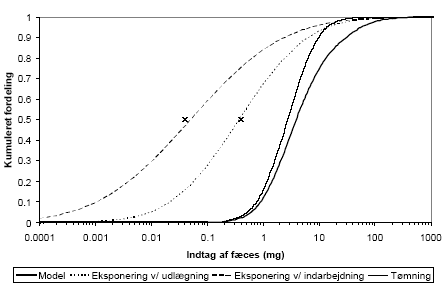
Figur 6.3 Indtag af fæces pr gang en person er eksponeret. Krydserne angiver støttepunkter for optegning af fordelingerne. Kurven for tømning er identisk med kurven for Voksnes indtagelse af jord på Figur 6.2.
Tabel 6.1 Modellerede indtag af fæces når man udsættes for en dagsdosis af en blanding af jord og fæces. Den statistiske beskrivelse af indtaget er beskrevet i bilag C.
| Indtag af fæces(mg/eksponering) | ||
| Typisk | Variation | |
| Børn, "ufortyndet" materiale | 67 | 9 - 500 |
| Voksne, "ufortyndet" materiale | 33 | 8 - 134 |
| Eksponering i område med udlagt materiale | 3 | 0,01 - 164 |
| Eksponering i området med indarbejdet materiale | 0,4 | 0,004 - 37 |
6.2 Antal eksponering pr. år
6.2.1 Tømning af kompostbeholder
Tømningen af kompostbeholderen medfører, at en voksen person eksponeres én gang årligt. Denne eksponering sker for ufortyndet fæces, dvs. indtagelse af en fæcesklump af størrelse svarende til et dagligt indtag af jord for voksne.
6.2.2 Dyrkning af områder og ophold i haven
Eksponeringen ved ophold i gødede og andre arealer afhænger af, hvor stor en del af den lokalt komposterede fæces, der er tilgængeligt, dvs. hvor kontamineret det område er, som personerne befinder sig i. Det vil være antagelsen i nærværende undersøgelse, at især børn, men også voksne, ikke vil skelne mellem hvilke dele af haven der er kontaminerede og hvilke dele af haven der ikke er kontaminerede. Derfor vil ophold i haven medføre den samme mængde indtag pr eksponering som ved havearbejde. Fordelingen af indtaget af komposteret fæces pr. eksponering er således identisk med eksponeringen ved havearbejde. Antagelsen er også nødvendigt fordi der ikke foreligger oplysninger der kan nuancere den.
Der foreligger kun meget sparsomme oplysninger om antallet af gange pr. år danske husejere opholder sig i haven for at dyrke eller høste afgrøder eller andre former for ophold i haven. Der er i 1980erne lavet sociologisk studier, som undersøger, hvorledes befolkningen anvender deres fritid, men det giver ikke svar på hvad husejere foretager sig når de opholder sig i deres have. Endvidere er undersøgelsen efter forfatternes oplysninger forældede. Vilstrup har gennemført en spørgeskemaundersøgelse, hvor antallet af timer der anvendes på havearbejde pr. uge er opgjort, se Tabel 6.2 (Politiken, 2002). Med alle de forbehold som er tilknyttet denne type undersøgelser er det det bedste grundlag der er for at skønne antallet af eksponeringer pr. år.
Tabel 6.2 Ugentligt antal timer benyttet til havearbejde for en husstand (Politiken, 2002)
| Havearbejde | Ophold i have | |
| Ingen | 10 | 10 |
| under 1 time | 17 | 2 |
| 1-5 timer | 50 | 17 |
| 6 - 10 timer | 14 | 50 |
| 11 - 15 timer | 5 | 14 |
| 16 - 20 timer | 2 | 5 |
| Mere end 20 timer | 2 | 2 |
| Ved ikke | 1 | 0 |
For at kunne omregnet værdierne fra Tabel 6.2 til et antal eksponeringer er der lavet følgende antagelser:
- Hvis ikke man bruger tid på havearbejde vil man ikke installere og drive et kompost-toilet. Fordelingen korrigeres herfor.
- Én eksponering svarer til to timers havearbejde, svarende til, at man i gennemsnit arbejder i køkkenhaven i to timer pr. gang.
- Man kan maksimalt eksponeres to gange på én dag.
Ud fra de forudsætninger er antallet af eksponeringer modelleret som angivet i Tabel 6.3. Det svarer til, at ca. 50% af alle husstande bliver eksponeret for havearbejde én gang om ugen og for ophold i haven ca. 3,5 gange om ugen. Ophold i haven sker noget hyppigere, men til gengæld over en kortere tidsmæssig periode.
Tabel 6.3 Skønnet antal eksponeringer pr uge ved havearbejde og ved ophold i haven.
| Antal eksponeringer pr. uge | Sæson | ||
| Typisk | Variation | ||
| Havearbejde | 1 | 0,1 - 11 | maj - september |
| Ophold i haven | 3 | 1 - 13 | juni - august |
7 Dosis-respons kurver
- 7.1 Modeller for sammenhæng mellem dosis og respons
- 7.2 Beskrivelse af dosis-respons kurver i den kvantitative risikovurdering
Sammenhænge mellem dosis og respons for mikroorganismer er vanskelige at fastlægge fordi de kan variere stærkt afhængigt af dyreart, eksponeringsmåde og modstandskraft. Oftest er de søgt fastlagt for raske yngre forsøgspersoner eller forsøgsdyr udsat for relativt høje doser, og herefter har man forsøgt at ekstrapolere til lavere doser ved hjælp af semi-mekanistiske modeller og brug af usikkerhedsfaktorer for at tage hensyn til personer med nedsat modstandskraft. En anden metode er at tage udgangpunkt i konkrete hændelser, hvor en population har været udsat for et patogen og registrere antallet af påvirkede personer, men her er den dosis som folk har været udsat for meget svær at estimere.
Viden om antal mikroorganismer og deres virulens kan for mange mikroorganismers vedkommende være lidet kendt, da de kan være vanskelige at dyrke i laboratoriet specielt i medier der anvendes til at vurdere patienters infektionsstatus og antal og virulens kan derfor være meget svære at vurdere.
Der er kun meget begrænset viden om variationen i immunstatus i befolkningen og nedsat immunforsvar kan komme til udtryk i nogle enkelte organer afhængig af om kontakten sker gennem indånding af aerosoler, ved hudkontakt eller ved indtagelse. Desuden varierer modstandsdygtigheden med alder, årstid, sundhedstilstand mm.
7.1 Modeller for sammenhæng mellem dosis og respons
De matematiske modeller for dosis-respons kurver er baseret på risikoen for, at et patogen medfører, at personen bliver inficeret. Der er to modeller, der almindeligvis benyttes. Den simple model antager, at hver mikroorganisme medfører en risiko for infektion der er uafhængig af hvor mange mikroorganismer, der angriber værten. Den mere komplicerede model antager, at der opstår en synergieffekt når mange ens mikroorganismer på én gang angriber værten.
7.1.1 Risiko for infektion er uafhængig af antallet af patogener (Eksponentiel model)
Når risikoen for infektion er afhængigt af hver enkelt patogens smittegrad benyttes en simpel eksponentiel model af typen
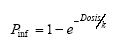 | (7.1) |
hvor k er større end 1. Et lavt k betyder, at risikoen for infektion er høj. Hvis k sættes lig 1 benævnes modellen "Maksimum risk" modellen svarende til, at det er sikkert, at man bliver inficeret hvis man bliver eksponeret for patogenet.
7.1.2 Risiko for infektion er afhængigt af antallet af patogener (Beta Poisson-model)
I det tilfælde benyttes en parameter mere i modellen, svarende til, at sammenhængen mellem dosis og respons er mere kompliceret:
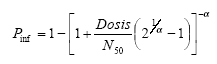 | (7.2) |
hvor N50 er medianen i fordelingen, dvs. den dosis der medfører, at 50% af populationen bliver inficeret, mens er en dimensionsløs parameter.
Det bemærkes, at der er begrænsninger i de værdier, som N50 og kan antage. Hvis N50 er lav er der risiko for, at den beregnede sandsynlighed for infektion er højere end sandsynligheden for at blive inficeret ved indtag af mindst en organisme jf. maksimum risk modellen, hvilket ikke er fysisk muligt. Derfor bør en Beta-Poisson model altid verificeres i forhold til "Maksimum-risk" modellen for at sikre, at modellen ikke overestimerer sandsynligheden for at blive inficeret. Dette diskuteres f.eks. i Teunis og Havelaar (2000)
7.1.3 Litteratursøgning på estimerede dosis-respons kurver
I Tabel 7.1 er angivet de mest anerkendte undersøgelser af sammenhænge mellem dosis og respons for de relevante patogener. Informationerne er vist grafisk i Figur 7.1. Det fremgår at bakterier kræver de største doser for at medføre infektion, mens virus er mere infektiøst, specielt overfor nogle personer. Det er i overensstemmelse med de generelle erfaringer på området.
I Tabel 7.1 er der medtaget en reference for EHEC, der angiver en mere præcis og samtidigt meget højere infektiv dosis end de øvrige referencer. Referencen er baseret på undersøgelser af kaniner. De enkelte patogener kan have meget forskellige karakteristika overfor forskellige værter og derfor er denne reference ikke inddraget ved estimation af dosis-respons kurven for EHEC. For Ascaris benyttes maximum-risk modellen, da ét æg er tilstrækkeligt til infektion.
Tabel 7.1 Resultat af litteraturstudie på dosis-respons sammenhænge for relevante mikroorganismer ved oral indtagelse. De to afrapporterede modeller på hhv. Giardia og Cryptosporidium er baseret på det samme datamateriale.
| Patogen | Dose-response middelværdi | Reference |
| Salmonella | N50=23600; = 0,3126 | Haas et al., 1999 |
| EHEC | Infective dose 10 | Hegrestad, 2001 |
| Infective dose 100-1000 (O157) | Stenström, 2003 | |
| Infective dose <100 | Szewzyk et al., 2000 | |
| N50=5,96*105; α= 0,49 (kaniner) | Haas et al, 2000 | |
| Rotavirus | N50=5,60; α= 0,265 | Haas et al., 1993 based on data from Ward et al., 1986 |
| Hepatitis A | N50=30; α= 0,2 | Shuval et al, 1997 |
| Giardia | k=50,23 | Rose et al., 1991 |
| k=50,25 | Teunis et al.,1996 | |
| Cryptosporidium | k=238,6 | Haas et al., 1996 |
| k=249 | Teunis et al., 1996 | |
| Ascaris | Principelt er ét æg tilstrækkeligt til infektion. For at udskille æg kræves indtagelse af såvel han- som hunæg. |
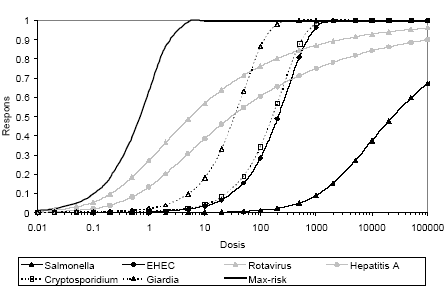
Figur 7.1 Oversigt over estimerede dosis-respons kurver i litteraturen. Justeres så relevante patogener med.
7.2 Beskrivelse af dosis-respons kurver i den kvantitative risikovurdering
Kurverne i Figur 7.1 ligner de kurver, som benyttes til at beskrive usikkerheden på de øvrige variable såsom f.eks. indtaget i jord beskrevet i Figur 6.2. Der er dog væsentlig forskel. Dosis-respons kurverne i Figur 7.1 er en kurve af middelværdier. For hver dosis er der en beregnet sandsynlighed for infektion. Denne sandsynlighed er behæftet med en vis usikkerhed, se Figur 7.2.
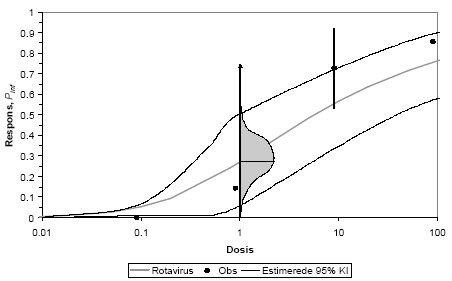
Figur 7.2 Dosis-respons kurve for Rotavirus med indtegnede 95% konfidensgrænser. Den "sande" kurve ligger med 95% sandsynlighed i intervallet mellem de stiplede linier for den undersøgte gruppe af personer. De sorte prikker angiver procentdelen af inficerede, baseret på 5-11 forsøgspersoner. Der er også forsøgsusikkerhed på disse enkelte kurver som angivet ved punktet med dosis = 9. Usikkerheden mindskes ved at inddrage flere personer og flere doser i en samlet model for dosis-respons sammenhængen.
Som det fremgår af det foregående er kendskabet til infektiøse doser og dosis-respons sammenhænge begrænset, ligesom den naturlige variation mellem forskellige individer er stor. Ved opstillingen af operationelle dosis-respons kurver er der benyttet afrapporterede undersøgelser af usikkerheden på dosis-respons sammenhænge. Der er væsentlige forbehold overfor disse studier:
- Undersøgelserne er baseret på studier af en forholdsvist homogen gruppe af forsøgspersoner. De personer der eksponeres for fæces vil være mere heterogen end forsøgsgruppen, fordi også sårbare grupper og ekstra resistente grupper indgår i undersøgelsen.
- Der er benyttet store doser i forhold til de doser man typisk vil blive udsat for i forbindelse med lokal håndtering af fæces. Den mindste dosis der er undersøgt i de 51 doser med forskellige typer af Salmonella og forsøgspersoner er 12000 bakterier.
- Undersøgelserne er baseret på et indtag af en veldefineret undertype af patogenet. Der er i praksis flere udgaver (strains) af patogenet. Disse strains kan have forskellige karakteristika, herunder infektivitet. Datamaterialet er væsentligt bedre for Salmonella end for de øvrige patogener.
Faktorer bevirker, at den faktiske usikkerhed ofte være større end den som er rapporteret i de foretagne undersøgelser.
De afrapporterede undersøgelser angiver usikkerhederne i form af enten konfidensbånd som angivet på Figur 7.2 eller i form af plots af usikkerhederne på hhv. k i eksponential modellen og N50 og i Beta-Poisson modellen. Som led i denne undersøgelse er disse usikkerheder beskrevet ved hjælp af statistiske modeller for usikkerheden på parametrene k, N50 og . Ved beskrivelsen af usikkerhederne er der lagt vægt på følgende karakteristika:
- Den beregnede dosis-respons kurve kan ikke overstige maksimum-risk kurven svarende til k = 1 i eksponential modellen. Hvis den beregnede dosis-respons kurve overstiger denne værdi angives en respons svarende til maksimum risk.
- De resulterende konfidensintervaller for dosis-respons kurven skal i almindelighed være mindst lige så brede som de i undersøgelserne angivne intervaller. Den modellerede øvre konfidensgrænse skal være højere end den i undersøgelsen angivne øvre konfidensgrænse.
- Der lægges mest vægt på usikkerhederne i de lave områder, svarende til de doser som man i praksis vil blive udsat for i forbindelse med de scenarier der analyseres for.
De variationer der er benyttet i dosis-respons modellerne er beskrevet i bilag C. Typisk betyder variationerne, at dosis kan variere med en op til en faktor 100 for en given risiko for infektion.
8 Risikomodel
- 8.1 Forekomst af patogener i frisk fæces og efter opbevaring i tønden
- 8.2 Opstilling af risikomodel for eksponering overfor patogener
- 8.3 Resultater af beregninger
- 8.4 Opsamling
- 8.5 Risikoreducerende tiltag
8.1 Forekomst af patogener i frisk fæces og efter opbevaring i tønden
I det følgende beregnes:
- Fordeling af patogener i spanden givet at der har været ét tilfælde af infektion i husstanden i løbet af året. Fordelingerne angives for
- Materiale opbevaret i 0 måneder (Alder på fæces 0 - 12 måneder)
- Materiale opbevaret 6 måneder (alder på fæces 6 - 18 måneder)
- Materiale opbevaret 12 måneder(alder på fæces 12 - 24 måneder)
Beregningerne foregår ved at antage, at der ikke er nogen forekomst af den pågældende organisme til tiden 0. Udsondringen af organismerne begynder ved dag 1 og fortsætter så længe som forventet med den pågældende organisme. Henfaldet starter øjeblikkeligt. Det medfører følgende formelsæt til beregning af antallet af organismer til dag i:
| (8.1a) | ||
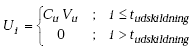 | (8.1b) | |
| (8.1c) | ||
| (8.1d) |
hvor
Mi er antallet af patogener i beholderen på dag i
Ui er udskilningen af patogener fra den inficerede person på dag i
Hi er henfaldet af patogener i tønden på dag i
Cu er koncentrationen af patogenet i den udskildte fæces
Vu er den udskildte mængde fæces af en person i en dag
tudskildning er den varighed udskildningen har
T90,fæces er den tid det tager at nedbryde patogenet i fæces med én log-reduktion
ti er dag i
t1 er den dag hvor udskilningen af det pågældende patogen påbegynder
Input-data til simuleringerne, Cu, tudskildelse og T90,fæces , er angivet kvalitativt i Tabel 5.1 og Tabel 5.2 og de præcise statistiske fordelinger er angivet i bilag C. Vu er angivet i afsnit 2.3. De fire input er alle stokastiske variable, der beskrives ved hjælp af en statistisk fordeling.
Det bemærkes, at følgende processer ikke er medtaget i simuleringerne:
- Årstidsvariationer af infektioner
- Aldersvariation i forekomst af specifikke sygdomme
- Mulighed for sekundær-tilfælde
- Der er ikke patogener i beholderen i de år hvor der ikke har været en inficeret person i husstanden.
- Hospitalsindlæggelse eller andre årsager til, at defækering ikke sker i husstanden.
Usikkerheden herfra vurderes ikke at have stor betydning for resultatet.
Under antagelse af at infektioner og tømning af beholderen sker uafhængigt af hinanden er fordelingen af antallet af den pågældende organisme givet ved:
- Materiale opbevaret i 0 måneder Mi ; i∈ [1; 365]
- Materiale opbevaret 6 måneder: Mi ; i∈ [183; 547]
- Materiale opbevaret 12 måneder: Mi ; i∈ [366; 730]
Hvilket svarer til, at tønden tømmes et tilfældigt antal dage efter at infektionen er påbegyndt, dog med minimum den angivne opbevaringstid. Hvis Mi <1 svarer det til, at der er mindre end ét patogen i beholderen. I dette tilfælde sættes antallet til 0.
Beregningsmetoderne er gennemgået i Bilag C. Resultatet af beregninger er opsummeret i Tabel 8.3.
8.2 Opstilling af risikomodel for eksponering overfor patogener
I nærværende rapport opstilles én risikomodel der gælder for alle patogener og for alle scenarier. Denne risikomodel benyttes herefter til beregning af alle scenarier ved at variere parametre og variable i risikomodellen.
Følgende resultater ønskes beregnet for hvert scenarie:
Indikatorer: Mængde i haven på dag j efter udlægning, Mj.
Dosis pr eksponering på dag j efter udlægning, Dosisj
Patogener: Mængde i haven på dag j efter udlægning, Mj.
Risiko for infektion pr. eksponering på dag j efter udlægning, Pinf, j
Risiko for infektion pr år det første år efter udlægning,
Pinf, år
Bidragets størrelse fra hver delproces afhænger især af følgende faktorer:
- hvor mange patogener er aktive på det pågældende tidspunkt
- hvordan er miljøbetingelserne (vækst og henfald af patogener)
- hvor stor er den aktuelle eksponering (kontaminering af fodtøj, hænder, børns leg, husdyr, etc.).
- Hvad er forholdet mellem dosis og respons
Beregningerne sker for patogener på dagsbasis ud fra følgende formelsæt:
| (8.2a) | ||
| (8.2b) | ||
| (8.2c) | ||
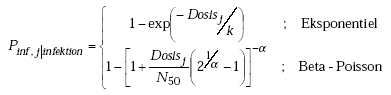 | (8.2d) | |
| (8.2e) | ||
| (8.2f) | ||
| (8.2g) |
hvor
Vtotal er mængden af fæces i beholderen pr. år, angivet i Tabel 2.4
Mj er mængden af patogener til dag j. M0 er mængden ved tømning, angivet i Tabel 8.3
Cj er koncentrationen af patogener i fæces på dag j givet infektion
T90,jord er den tid det tager at nedbryde patogenet opblandet i jord med én log-reduktion, se tabel Tabel 5.3
Qindtag er indtaget af fæces som angivet i Tabel 6.1
Dosisj er indtaget af patogener på dag j givet infektion
k er parameter i den eksponentielle model for dosis-respons kurven, se Tabel 7.1 og bilag C
N50 er parameter i Beta-Poisson modellen for dosis-respons kurven, se Tabel 7.1 og bilag C
α er parameter i Beta-Poisson modellen for dosis-respons kurven, se Tabel 7.1 og bilag C
Pinf,i|infektion er risiko for infektion på dag j givet infektiøst indhold i beholderen
Pinfmånedi|infektion er risiko for infektion i løbet af en måned men n eksponeringer i den måned
I er incidensen af tønder med det pågældende patogen, Tabel 5.1.
Pinf,j er risikoen for infektion på dag j
n er antallet af eksponeringer pr år, se Tabel 6.3
Pinf,år er den samlede risiko pr. tønde pr år. Den angivne approximationen er god op til en beregnet risiko på omkring 10-2.
For indikatorer er formelsættet det samme bortset fra at mængden af indikatorer er justeret svarende til at alle personer i husstanden hele tiden udskiller indikatoren.
Det første led i formel (8.2e) angiver andelen af beholdere, der er inficeret med det pågældende patogen. Det bemærkes, at formlen er en approximation idet det ikke medtages, at hvis beholderen tømmes mens der er infektion i husstanden vil der det efterfølgende år også være det samme patogen i beholderen. Det antages altså, at dette materiale efter et års ekstra opholdstid ikke længere vil være infektivt. Beregningen af risikoen pr. år. pr. beholder, (8.2f), er en approximation idet det traditionelt antages, at der maximalt kan være én infektion pr. år og at en indtruffen infektion dermed udelukker yderligere infektioner dette år.
Dermed er risikomodellen fastlagt. Da alle væsentlige input beskrives som stokastiske variable er resultatet også en stokastisk variabel, som kan beskrives ud fra middelværdi, spredning, største og mindste værdier osv. Beregningsmetoden er beskrevet i Bilag C.
Modelformuleringen betyder, at eksponeringerne simuleres hen over året, dag for dag. Selv om indtaget af fæces og antallet af eksponeringer er uændret over året vil henfaldet af patogener betyde, at jo senere på året man eksponeres desto mindre er risikoen for at blive inficeret.
For hvert patogen og for hvert scenarie er der flere processer, der kan medføre risiko for infektion. Disse er:
1. Pinfektion ved tømning af kompostbeholder
2. Pinfektion ved ophold i have
3. Pinfektion ved havearbejde
Resultaterne angives både som risikoen for infektion givet at det pågældende patogen er i beholderen og som risikoen for infektion i en tilfældig have hvor der er udspredt det lokalt komposterede materiale.
8.3 Resultater af beregninger
Risikoen for at blive inficeret ved at tømme beholderen og opholde sig i haven udregnes i alt 5000 gange ved at simulere 5000 forskellige kombinationer af koncentration af patogener i fæces, mængde fæces indtaget, dosis-respons for den konkrete person samt antallet af eksponeringer pr. år. For hver af disse simuleringer beregnes risikoen for infektion pr. eksponering og pr. år i den konkrete situation. Den konkrete situation betyder i denne sammenhæng, at en given person med en given modtagelighed (dosis-respons sammenhæng) under tømning af beholderen eller ved ophold i haven indtager en given mængde af patogener.
I nogle tilfælde vil der være tale om at en person med høj resistens overfor det pågældende patogen indtager en lille mængde fæces med lav koncentration af patogener. I denne situation er risikoen for infektion lavere end normalt. I andre tilfælde vil det være en sårbar person (f.eks. barn eller immuno-suprimeret) der på grund af en uheldig håndtering indtager usædvanligt meget fæces der tilfældigvis har en høj koncentration af patogener. I den situation vil risikoen for infektion være meget højere end i de fleste tilfælde.
I denne rapport er der fokuseret på den "typiske risiko" og en "worst-case" risiko. Den typiske risiko er den infektionshyppighed der beregningsmæssigt overskrides i 50% af eksponeringerne. Risikoen svarende til "worst-case" er den risiko, der beregningsmæssigt vil være i op til 5% af eksponeringerne. Denne værdi svarer til den værst mulige situation, hvor det er en sårbar person der indtager mere fæces end normalt og hvor fæces er mere forurenet end normalt. Det bemærkes, at "worst-case" vil være et konservativt bud på den værste risiko, idet der igennem alle beregningerne er en vis risiko på beskrivelsen af processerne. Dette betyder en større variation på de beregnede risici og dermed en høj værdi i "worst-case" situationen.
Ud over en beregning af risikoen pr. eksponering udregnes også risikoen for infektion pr. år. Denne beregning har nogle væsentlige antagelser:
- Mængden af indtaget fæces er det samme for alle eksponeringerne det pågældende år (svarende til, at det er den samme person med samme adfærd, der eksponeres)
- Det er en samme person (eller flere personer med samme modstandsdygtighed), der eksponeres hver gang.
- Personen har ikke været inficeret af patogenet inden den konkrete eksponering, idet det medfører en højere resistens.
Den sidste antagelse betyder principelt, at den inficerede person har samme sandsynlighed for at blive inficeret som alle andre. For nogle af patogenerne, f.eks. Cryptosporidium, vides det, at der opbygges en vis resistens. Tilsvarende kan man også argumentere for, at eksponeringerne vil være forskellige. Samlet må man forvente, at især den årlige risiko alt i alt overvurderes i "worst-case" beregningerne og at der også er en risiko for, at risikoen overvurderes i beregningen af den "typiske" risiko.
Risikoen i "typisk" og "worst-case" er angivet i tabeller, hvor den beregnede risiko kan aflæses. I Figur 8.1 er hele fordelingen af den beregnede koncentration af patogener i materiale efter 0 måneders opbevaring vist under antagelse af, at én person i husstanden har været inficeret det pågældende fyldningsår. Det ses, at der typisk er en faktor 10 på den risiko som man i almindelighed udsætter sig for og den risiko som man i værste tilfælde udsætter sig for.
8.3.1 Bestemmelse af andel af beholdere der bliver inficeret i løbet af et år.
Ud fra de angivne incidenser i Tabel 5.1 kan man beregne, hvor stor sandsynligheden er, for at der er et eller flere patogener i beholderen, se Tabel 8.1 og Tabel 8.2. Sandsynligheden for at beholderen er inficeret domineres af Rotavirus og Giardia. De beregnede værdier er følsomme overfor antallet af personer i husholdningen. Hvis der kun er 3 personer i husholdningen falder sandsynligheden for, at beholderen er inficeret med Rotavirus fra 4,7% til 3,6%.
Tabel 8.1 Andel af beholdere, der i et tilfældigt år er inficeret med det pågældende patogen. Den typiske værdi svarer til den skønnede incidens, mens variationen angiver usikkerheden på hvor mange personer der faktisk er inficerede. Andelene er beregnet under forudsætning om en husstand på 4 personer.
| Andel af beholdere, der er inficerede (%) | ||
| Typisk | Variation | |
| Salmonella | 2.0 | 1,2 - 2,8 |
| EHEC | 0,1 | 0,1 - 0,2 |
| Rotavirus | 4,7 | 3,2 - 6,2 |
| Hepatitis A | 0,0 | 0,02 - 0,03 |
| Giardia | 4,3 | 3,6 - 5,1 |
| Cryptosproridium | 0,8 | 0,6 - 5,1 |
| Ascaris | 0,1 | 0,16 - 0,10 |
Tabel 8.2 Sandsynligheden for, at der er udskilt patogener i beholderen i løbet af året. Beregningerne er foretaget med de typiske værdier for incidenser i en husstand med 4 personer, se Tabel 8.1. Ved beregningerne er der ikke taget hensyn til forskellige personers livsstil og alder, hvilket kan forrykke billedet noget.
| Sandsynlighed | ||
| 0 patogener | 88,4 % | |
| 1 patogen | 11,1 % | |
| 2 patogener | 0,5 % | |
| Mere end 2 patogener | 0,0 % | |
8.3.2 Bestemmelse af antal patogener i beholderen ved tømning og udbringning
I det følgende er der angivet fordelingerne for hvor mange patogener der vil være til stede såfremt én person i husstanden har været inficeret. Først angives koncentrationen af patogener i beholderen i begyndelsen af det år hvor beholderen med patogener spredes i haven i Tabel 8.3 og dernæst angives koncentrationen af patogener i haven i slutningen af det år hvor beholderen med patogener spredes i haven i Tabel 8.4. Den totale fordeling af risiko for infektion ved eksponering overfor en tilfældig tønde findes ved at gange de fundne risici med incidenserne af de enkelte patogener.
Den samlede mængde materiale vejer 160 kg. Hvis der er angivet en koncentration på mindre end 6 10-9 i Tabel 8.3 svarer det derfor til, at der under de givne omstændigheder er mindre end en af den pågældende mikroorganisme i tønden. Det ses at være tilfældet for E.coli, bakteriofager, Salmonella, EHEC, Hepatitis A og Giardia i den typiske situation efter 12 måneders opbevaring af materialet. Ved at betragte worst-case beregningerne må det konkluderes at der ved opbevaring efter 12 måneder er en næsten fuldstændig nedbrydning af E.coli, bakteriofager, Salmonella og EHEC. Andre organismer overlever længe i materialet, f.eks. enterokokker og Ascaris og er langt fra nedbrudt.
Tabel 8.3 Koncentration af patogener i materialet ved tømning af beholderen givet at der har været infektion af én person i husholdningen. For indikatorer er den samlede koncentration ved udskilning fra alle personer angivet. Beregningerne af worst-case koncentrationerne er domineret af personer, der har været inficeret længe og har udskilt et højt antal patogener gennem hele perioden. Enhed: Antal/mg materiale
| Typisk | Worst case | |||||
| 0 mdr | 6 mdr | 12 mdr | 0 mdr | 6 mdr | 12 mdr | |
| E.coli | 1 103 | 4 10-5 | 2 10-12 | 2 104 | 5 10-3 | 6 10-9 |
| Enterokokker | 7 101 | 4 100 | 3 10-1 | 2 102 | 1 101 | 1 100 |
| Bakteriofager | 1 10-2 | 3 10-9 | 6 10-12 | 3 10-2 | 9 10-7 | 4 10-11 |
| Salmonella | 2 10-4 | 1 10-10 | 1 10-16 | 2 100 | 2 10-4 | 2 10-9 |
| EHEC | 2 10-12 | 2 10-21 | 2 10-30 | 3 10-4 | 1 10-12 | 2 10-20 |
| Rotavirus | 4 100 | 3 10-3 | 3 10-6 | 9 103 | 2 101 | 5 10-2 |
| Hepatitis A | 1 10-3 | 6 10-7 | 3 10-10 | 1 100 | 2 10-3 | 6 10-6 |
| Giardia intestinalis | 6 10-2 | 1 10-8 | 4 10-15 | 2 102 | 3 100 | 1 10-5 |
| Cryptosporidium parvum | 5 10-1 | 1 10-3 | 3 10-6 | 1 102 | 7 10-1 | 6 10-3 |
| Ascaris | 3 10-1 | 7 10-2 | 2 10-3 | 1 100 | 8 10-1 | 4 10-1 |
I Figur 8.1 er vist koncentrationerne i beholderen ved tømning under forudsætning af, at én person har været inficeret. For at finde koncentrationerne i en tilfældig tønde skal koncentrationerne af patogenerne korrigeres i forhold til incidenserne. Betydningen af denne korrektion er antydet i Figur 8.2.
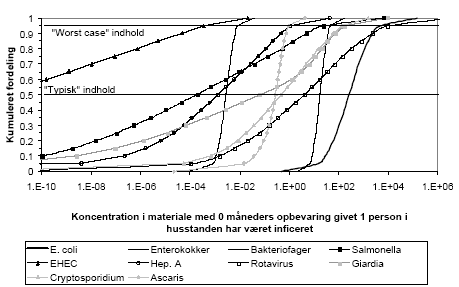
Figur 8.1 Koncentration i materiale med 0 måneders opbevaring hvis en person i husstanden har været inficeret i løbet af fyldningsåret. En lille T90-værdi medfører en stor spredning i koncentrationerne. Hovedparten af mikroorganismerne har en variation på 1-2 størrelsesordner på den største og mindste koncentration.
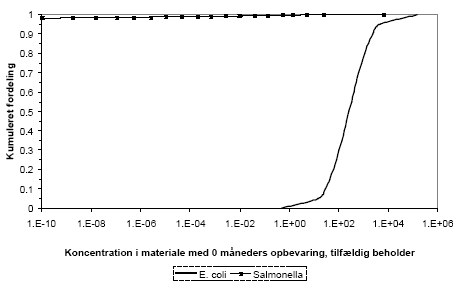
Figur 8.2 Koncentration af E. coli og Salmonella i materiale med 0 måneders opbevaring i en tilfældig beholder. Der vil være E. coli i alle tønder mens der beregningsmæssigt ikke vil være Salmonella bakterier i ca. 98% af tønderne, se Tabel 8.1.
Efter tømning af beholderen udlægges eller indarbejdes materialet i jorden, hvorved koncentrationen falder hhv. en faktor 10 eller 100, jævnfør afsnit 2.6.1. Endvidere fortsætter nedbrydningen med de konstanter der er angivet i Tabel 5.3. Startkoncentrationerne i haven kan derfor beregnes umiddelbart ud fra Tabel 8.3. I Tabel 8.4 er angivet de tilsvarende koncentrationer i blandingen af jord og materiale i oktober måned, svarende til 6 måneder efter udbringningen.
Tabel 8.4 Koncentration af patogener i blandingen af jord og fæces i oktober måned ved udlægning på jorden 6 måneder før. For indikatorer er den samlede koncentration ved udskilning fra alle personer angivet. Enhed: Antal/mg materiale
| Typisk | Worst-case | |||||
| 0 mdr | 6 mdr | 12 mdr | 0 mdr | 6 mdr | 12 mdr | |
| E.coli | 9 10-1 | 3 10-8 | 2 10-15 | 2 102 | 2 10-5 | 7 10-10 |
| Enterokokker | 2 10-2 | 1 10-3 | 5 10-5 | 3 10-1 | 2 10-2 | 1 10-3 |
| Bakteriofager | 6 10-6 | 5 10-13 | 1 10-19 | 1 10-4 | 1 10-9 | 4 10-14 |
| Salmonella | 1 10-9 | 8 10-16 | 7 10-22 | 7 10-4 | 2 10-8 | 1 10-13 |
| EHEC | 9 10-20 | 6 10-29 | 6 10-38 | 1 10-10 | 6 10-19 | 2 10-26 |
| Rotavirus | 2 10-6 | 2 10-9 | 1 10-12 | 1 10-1 | 3 10-4 | 1 10-6 |
| Hepatitis A | 5 10-6 | 2 10-9 | 1 10-12 | 8 10-3 | 2 10-5 | 5 10-8 |
| Giardia intestinalis | 6 10-8 | 1 10-14 | 4 10-21 | 7 10-4 | 2 10-5 | 2 10-10 |
| Cryptosporidium parvum | 2 10-1 | 4 10-4 | 1 10-6 | 7 101 | 4 10-1 | 3 10-3 |
| Ascaris | 1 10-1 | 3 10-2 | 1 10-3 | 5 10-1 | 5 10-1 | 2 10-1 |
Af tabellerne fremgår det blandt andet at:
- Der vil blive udskilt patogener til i alt 11,6% af beholderne i et tilfældigt år. Heraf vil 0,5% af beholderne indeholde mere end 1 patogen.
- Variationen i koncentrationen af patogener i beholderen varierer meget selv under den simple antagelse om, at én person bliver inficeret én gang i løbet af ét års fyldning. Variationen er på 2 - 10 størrelsesordener for hvert enkelt patogen. Dette er variationen i risiko for hver enkelt eksponering.
- Variationerne skyldes både uvidenhed om processerne, systematisk variation og tilfældig variation. Undersøgelser kan mindskes uvidenheden om processerne, men der vil stadig være væsentlig variation som følge af tilfældige og systematiske variationer. Den tilfældige variation i befolkningens sårbarhed og indtag per eksponering vil gøre, at antallet af inficerede pr år har en mindre variation end den variation der er opgivet i tabellerne.
- Bakteriofager nedbrydes hurtigere end virus. Hvis bakteriofager måles som indikator for risiko for virus infektion indikerer beregningerne at man vil undervurdere risikoen for infektion med virus. Denne konklusion er meget afhængig af modellen for henfald af organismer.
- Det er usandsynligt at EHEC og Salmonella udgør en infektionsrisiko såfremt beholderen opbevares minimum et år efter tilledningen er ophørt.
- For infektioner med vira og parasitter fremgår det umiddelbart, at der er en risiko for infektion på grund af disse patogeners lange overlevelsestid. Dette gælder især rotavirus, Cryptosporidium og Ascaris.
8.3.3 Risiko for infektion ved tømning
Beregningerne tager udgangspunkt i de forekomster af indikatorer og patogener der er beregnet i Tabel 8.3. Derefter er der beregnet et indtag af indikatorer samt en risiko for infektion baseret på formelsættet i (8.2) med j=0. Resultatet er angivet i tabel 8.5 og Tabel 8.6 for scenarie 1 og 5, svarende til de scenarier der har hhv. den højeste og den laveste risiko.
Resultaterne i tabellerne angives i risikoen pr. gang et menneske eksponeres. For Salmonella beregnes f.eks. en risiko på 810-7 pr. eksponering. Det betyder, at 1 ud af 1/810-7 personer beregningsmæssigt bliver inficeret, svarende til 1 ud af 1.250.000 personer. For Ascaris beregnes tilsvarende en risiko på 1 ud af 1 personer bliver inficeret, altså at tømning af en beholder inficeret med Ascaris med sikkerhed vil medføre at personen bliver inficeret.
Der angives såvel en risiko givet at der har været en infektion og en risiko svarende til, at man tømmer en tilfældig beholder. Begge tal kan være relevante. Risikoen givet infektion er uafhængigt af den aktuelle hyppighed (incidens) i befolkningen mens risikoen ved at tømme en tilfælding beholder giver et billede af den faktiske risiko givet de aktuelle forhold i Danmark. Man kan i princippet som led i risikohåndteringen vælge at agere forskelligt afhængigt af hvorvidt familien oplyser, at der det sidste år har været en infektion i familien. Det bemærkes dog, at oplysningerne fra familien vil være usikre, dels fordi man kan glemme en kortvarig diarre og dels fordi en person i husstanden kan være rask smittebærer eller have været inficeret uden at det har resulteret i sygdom.
Tabel 8.5 Scenarie 1: Tømning af beholder og udbringning af materiale opbevaret i 0 måneder. Det ses, at hvis beholderen indeholder patogener er der en høj risiko for infektion. Dette scenarie tager primært udgangspunkt i fejlhåndtering eller ombytning af beholdere.
| Typisk | Worst-case | |||||
| Dosis | Risiko givet infektion | Risiko | Indtag | Risiko givet infektion | Risiko | |
| E.coli | 3 104 | - | - | 1 106 | - | - |
| Enterokokker | 2 103 | - | - | 1 104 | - | - |
| Bakteriofager | 4 10-1 | - | - | 2 100 | - | - |
| Salmonella | 7 10-3 | 8 10-7 | 2 10-8 | 3 103 | 2 10-1 | 5 10-3 |
| EHEC | 1 10-10 | 3 10-13 | 4 10-16 | 2 10-2 | 9 10-5 | 1 10-7 |
| Rotavirus | 1 102 | 8 10-1 | 3 10-2 | 1 106 | 1 | 5 10-2 |
| Hepatitis A | 4 10-2 | 9 10-3 | 2 10-6 | 9 101 | 6 10-1 | 2 10-4 |
| Giardia intestinalis | 3 100 | 6 10-2 | 2 10-3 | 2 104 | 1 | 5 10-2 |
| Cryptosporidium parvum | 2 101 | 6 10-2 | 5 10-4 | 7 103 | 1 | 9 10-3 |
| Ascaris | 9 100 | 1 | 8 10-4 | 6 101 | 1 | 1 10-3 |
Tabel 8.6 Scenarie 3 & 5: Tømning af beholder og udbringning af materiale opbevaret i 12 måneder. Den høje infektivitet og overlevelsesevne betyder, at Ascaris, der har en lav incidens, er det patogen, der hyppigst vil medføre infektioner.
| Typisk | Worst-case | |||||
| Dosis | Risiko givet infektion | Risiko | Indtag | Risiko givet infektion | Risiko | |
| E.coli | 8 10-11 | - | - | 6 10-7 | - | - |
| Enterokokker | 8 100 | - | - | 7 101 | - | - |
| Bakteriofager | 2 10-14 | - | - | 3 10-9 | - | - |
| Salmonella | 5 10-15 | n.r. | n.r. | 2 10-7 | 6 10-11 | 1 10-12 |
| EHEC | 7 10-29 | n.r. | n.r. | 2 10-18 | n.r. | n.r. |
| Rotavirus | 9 10-5 | 4 10-5 | 2 10-6 | 1 101 | 7 10-1 | 3 10-2 |
| Hepatitis A | 9 10-9 | 2 10-9 | 4 10-13 | 6 10-4 | 2 10-4 | 5 10-8 |
| Giardia intestinalis | 2 10-13 | 3 10-15 | 1 10-16 | 2 10-3 | 8 10-5 | 4 10-6 |
| Cryptosporidium parvum | 9 10-5 | 4 10-7 | 3 10-9 | 5 10-1 | 2 10-3 | 2 10-5 |
| Ascaris | 8 10-2 | 7 10-2 | 6 10-5 | 2 101 | 1 | 9 10-4 |
n.r.: Negligibel risiko, risikoen er så lav at den benyttede software ikke kan beregne den (typisk under 110-14 pr. eksponering)
Af tabellerne fremgår det bl.a. at:
- For mere end halvdelen af de undersøgte patogener fremgår det at man vil indtage mere end et patogen såfremt der tømmes og udbringes materiale der ikke har været opbevaret. Kun for EHEC, Salmonella og Hepatitis A vil man generelt indtage mindre end et patogen.
- Afhængig af det konkrete forhold mellem dosis og respons beregnes også en høj risiko for infektion ved eksponering overfor materiale der ikke har været opbevaret. Risikoen beregnes til typisk at være mere end 5% (1 ud af 20 eksponeringer) for følgende patogener: rotavirus, Giardia, Cryptosporidium og Ascaris.
- I worst case situationen beregnes en risiko på mere end 1% (1 ud af 100 eksponeringer) for alle patogener undtagen EHEC ved håndtering af materiale der ikke har været opbevaret.
- Ved 12 måneders opbevaring beregnes stadig en væsentlig risiko for infektion med primært rotavirus og Ascaris. I worst-case er risikoen for alle vira og parasitter højere end 110-8.
8.3.4 Risiko for infektion ved havearbejde og ophold i haven
Risikoen for infektion pr. eksponering ved havearbejde og ophold i haven er beregningsmæssigt ens på samme tid af året. Der er to faktorer der gør, at de beregnede risici på årsplan ikke er ens:
- Havearbejde foregår i perioden maj - oktober, mens ophold i haven kun foregår i månederne juni, juli og august.
- Ophold i haven foregår væsentligt mere intensivt i de 3 måneder hvor man beregningsmæssigt eksponeres.
De to faktorer påvirker resultatet i hver sin retning, således at den samlede risiko vil være størst ved havearbejde hvis patogenet nedbrydes hurtigt i haven mens den vil være størst ved ophold i haven hvis patogenet nedbrydes langsomt i haven.
De beregningsmæssigt største og mindste risici vil forekomme ved hhv. Scenarie 1: Udlægning af materiale opbevaret i 0 måneder og Scenarie 5: Indarbejdning af materiale opbevaret i 12 måneder. Resultaterne er angivet i de følgende 4 tabeller. De øvrige resultater er angivet i Bilag D.
Tabel 8.7 Scenarie 1: Udlægning af materiale opbevaret i 0 måneder. Risiko ved havearbejde. Beregningsmæssigt er det næsten sikkert, at beholdere inficeret med parasitter vil medføre sekundære infektioner i løbet af den efterfølgende sæsons havearbejde, hvis ikke materialet opbevares.
| Pinf|infektion pr. eksponering ifm have-arbejde i maj | PinfIinfektion ifm have-arbejde i maj | Pinf, havearbejde gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | 1 10-8 | 1 10-2 | 7 10-8 | 1 10-1 | 2 10-9 | 4 10-3 |
| EHEC | 3 10-15 | 1 10-6 | 2 10-14 | 1 10-5 | 2 10-17 | 2 10-8 |
| Rotavirus | 3 10-1 | 1 | 9 10-1 | 1 | 4 10-2 | 6 10-2 |
| Hepatitis A | 3 10-4 | 4 10-1 | 2 10-3 | 1 | 1 10-6 | 3 10-4 |
| Giardia intestinalis | 5 10-4 | 1 | 4 10-3 | 1 | 2 10-4 | 5 10-2 |
| Cryptosporidium parvum | 5 10-3 | 1 | 3 10-2 | 1 | 1 10-3 | 9 10-3 |
| Ascaris | 5 10-1 | 1 | 1 | 1 | 8 10-4 | 1 10-3 |
Tabel 8.8 Scenarie 5: Indarbejdning af materiale opbevaret i 12 måneder. Risiko ved havearbejde. Beregningsmæssigt vil en ud af 50.000 personer blive inficeres med Ascaris ved havearbejde i en tilfældig have hvor materialet er indarbejdet
| Pinf|infektion pr. eksponering ifm have-arbejde i maj | PinfIinfektion ifm have-arbejde i maj | Pinf, havearbejde gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | n.r. | 5 10-13 | n.r. | 4 10-12 | n.r. | 1 10-13 |
| EHEC | n.r. | n.r. | n.r. | n.r. | n.r. | n.r. |
| Rotavirus | 4 10-8 | 2 10-1 | 3 10-7 | 8 10-1 | 2 10-8 | 3 10-2 |
| Hepatitis A | 7 10-12 | 2 10-6 | 5 10-11 | 1 10-5 | 4 10-14 | 1 10-8 |
| Giardia intestinalis | n.r. | 9 10-6 | n.r. | 4 10-5 | n.r. | 2 10-6 |
| Cryptosporidium parvum | 3 10-9 | 6 10-5 | 2 10-8 | 3 10-4 | 9 10-10 | 1 10-5 |
| Ascaris | 8 10-4 | 5 10-1 | 6 10-3 | 1 | 2 10-5 | 9 10-4 |
n.r.: Negligibel risiko, risikoen er så lav at den benyttede software ikke kan beregne den (typisk under 110-14 pr. eksponering)
Tabel 8.9 Scenarie 1: Udlægning af materiale opbevaret i 0 måneder. Risiko ved ophold i haven. Når materialet ikke er indarbejdet men kun udlagt vil de beregnede risici være noget højere. Det gælder især for de patogener hvor risikoen givet infektion ikke er meget høj.
| Pinf|infektion pr. eksponering ifm ophold i haven i juni | PinfIinfektion ifm have-arbejde i juni | Pinf, havearbejde gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | 2 10-9 | 2 10-3 | 2 10-8 | 5 10-2 | 7 10-10 | 2 10-3 |
| EHEC | n.r. | 1 10-7 | n.r. | 3 10-6 | n.r. | 5 10-9 |
| Rotavirus | 4 10-2 | 9 10-1 | 5 10-1 | 1 | 3 10-2 | 2 10-1 |
| Hepatitis A | 1 10-4 | 3 10-1 | 2 10-3 | 1 | 1 10-6 | 7 10-4 |
| Giardia intestinalis | 5 10-5 | 7 10-1 | 8 10-4 | 1 | 5 10-5 | 1 10-1 |
| Cryptosporidium parvum | 4 10-3 | 1 | 6 10-2 | 1 | 1 10-3 | 3 10-2 |
| Ascaris | 4 10-1 | 1 | 1 | 1 | 2 10-3 | 3 10-3 |
n.r.: Negligibel risiko, risikoen er så lav at den benyttede software ikke kan beregne den (typisk under 110-14 pr. eksponering)
Tabel 8.10 Scenarie 5: Indarbejdning af materiale opbevaret i 12 måneder. Risiko ved ophold i haven.
| Pinf|infektion pr. eksponering ifm ophold i haven i juni | PinfIinfektion ifm ophold i haven i juni | Pinf, ophold i haven gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | n.r. | 2 10-13 | n.r. | 2 10-12 | n.r. | 7 10-14 |
| EHEC | n.r. | n.r. | n.r. | n.r. | n.r. | n.r. |
| Rotavirus | 3 10-9 | 3 10-2 | 6 10-8 | 5 10-1 | 4 10-9 | 5 10-2 |
| Hepatitis A | 3 10-12 | 7 10-7 | 4 10-11 | 1 10-5 | 2 10-14 | 5 10-9 |
| Giardia intestinalis | n.r. | 2 10-6 | n.r. | 7 10-5 | n.r. | 5 10-6 |
| Cryptosporidium parvum | 2 10-9 | 4 10-5 | 4 10-8 | 8 10-4 | 9 10-10 | 2 10-5 |
| Ascaris | 7 10-4 | 4 10-1 | 1 10-2 | 1 | 2 10-5 | 2 10-3 |
n.r.: Negligibel risiko, risikoen er så lav at den benyttede software ikke kan beregne den (typisk under 110-14 pr. eksponering)
De beregningsmæssige resultater kan opsummeres som følger:
- Forskellen på risikoen for at blive inficeret ved at udføre havearbejde eller ved at opholde sig i haven er lille og reelt inden for usikkerheden på risikomodellen.
- Hvis materialet ikke har været opbevaret inden udbringning er de beregnede risici så store, at der ofte vil være mere end en infektion af parasitter pr. inficeret beholder, fordi en risiko pr. måned nær 1 nogle gange vil give infektion i flere måneder. Risikoen for at blive inficeret med Hepatitis A er også høj hvis beholderen har været inficeret.
- Efter opbevaring i 12 måneder er risikoen for at blive inficeret med EHEC og Salmonella lav og i nogle tilfælde for lille til at kunne beregnes med den valgte software.
- Ved opbevaring i 12 måneder falder risikoen med en 3-6 størrelsesordener i beregning af den typiske risiko. Ved beregning af worst-case risikoen falder risikoen mindre fordi risikoen for infektion generelt er høj.
8.4 Opsamling
Hvis materialet ikke har været opbevaret er der generelt tale om beregnede risici, der ligger i intervallet "høj risiko" efter WHOs forslag til klassificering af risici. Risikoen er specielt stor for parasitter og Rotavirus. Blandt parasitterne er risikoen for Giardia infektioner dominerende, bl.a. på grund af en høj incidens i befolkningen. Hvis Ascaris er til stede er risikoen meget stor, men på grund af den ringe forekomst i Danmark vil den ubetingede risiko være lille.
Såfremt materialet opbevares uden at mennesker eksponeres for det i 12 måneder og herefter indarbejdes godt i haven af en person fra husstanden uden hjælp fra andre er det primært Ascaris og rotavirus, der vil udgøre en risiko ud fra den nuværende sundhedstilstand. Ascaris er i denne sammenhæng interessant fordi det er en sygdom hvor alle personer med denne infektion pt. antages at være smittet i udlandet.
Antagelserne i modellen vedrørende havearbejde og ophold i haven er grove og det faktiske resultat kan afvige flere størrelsesordner fra det beregnede. Nogle af de væsentligste faktorer i denne forbindelse er:
- Resistens i familien overfor patogener de tidligere har været eksponeret for er ikke medtaget i modellen
- Transport af patogener i haven og til andre haver i form af vektorer er ikke medtaget i modellen
- Modelleringen af antallet af eksponeringer er foretaget på baggrund af en simpel spørgeskemaundersøgelse.
- Antagelsen om indtaget af patogener er baseret på simple antagelser om, hvor godt materialet blandes op i havejorden.
Kun den første af disse antagelser gælder også for tømning af beholderen, hvorfor de beregnede risici i den forbindelse antages at være bedre bestemt. Der er dog stadig en væsentlig usikkerhed på de beregnede resultater.
Risikoen ved tømning af beholderen og udbringning i haven medfører i sig selv en høj risiko hvis der er patogener i beholderen.
8.5 Risikoreducerende tiltag
Der er i beregningerne taget udgangspunkt i hvordan den lokale håndteringe af fæces finder sted i de pilotprojekter der foregår i Danmark og de projekter der udføres i Sydsverige. Det skal bemærkes, at der i udlandet i nogle tilfælde er et stort behov for at håndtere fæces lokalt, enten fordi der er et behov for at udnytte næringsstofferne eller fordi der ikke er ressourcer til en effektiv central behandling. Nedbrydningen af patogener søges da fremmet primært gennem to tiltag:
- Justering af pH
pH justeres til høje værdier, f.eks. ved tilsætning af kalk eller aske. Derved henfalder organismerne hurtigt. Aske virker endvidere udtørrende, hvilket også fremmer nedbrydningen. - Varmebehandling
Ved opvarmning til det termofile område 50-60°C nedbrydes bakterierne hurtigt. Opvarmningen kan f.eks. ske i form af en central kompostering.
9 Sundhedsmæssig vurdering
I dette kapitel foretages en samlet sundhedsmæssig vurdering af anvendelse af fæces i haver på baggrund af de foreliggende data og de risikovurderinger der er foretaget for kemiske stoffer og udvalgte mikrorganismer.
Som det fremgår af de foregående kapitler er grundlaget for en sundhedsmæssig risikovurdering af anvendelsen af fæces i haver usikkert på en række områder.
Der mangler detaljeret viden om omfang og varighed af udskillelse af kemiske stoffer og mikroorganismer i afføring og overlevelse af mikroorganismer i beholdere og have. Der findes heller ikke detaljeret viden om børns og voksnes adfærd i forbindelse med opbevaring og tømning af beholder og ved transport og spredning af afføring. Det samme gælder indtagelse af afføring i forbindelse hermed og ved kontakt med komposteret jord og ved indtagelse af afgrøder.
For kemiske stoffer i fæces har det været muligt at lave skøn over risici ved eksponering for primært metaller og medicinrester. Beregningerne tyder ikke umiddelbart på at menneskers eksponering for kemiske stoffer ved anvendelse af komposteret afføring i haver udgør en væsentlig sundhedsrisiko, mens der for 2 af de 3 analyserede medicinrester påpeges miljømæssige problemer ud fra en kemisk risikovurdering. Det skal dog understreges at der i beregningerne er foretaget en lang række skøn og antagelser og at data er få og usikre. Det må forventes, at mere viden om medicinrester vil medføre, at flere stoffer påpeges at udgøre en sundhedsmæssig risiko.
Der er foretaget beregninger for de udvalgte patogene mikroorganismer, for hvilke der er fundet tilstrækkelige data. De valgte patogener formodes tilsammen at give et rimeligt billede af de forventede risici, bl.a. fordi de repræsenterer de mest modstandskraftige organismer, hvorfor andre bakterier, vira og parasitter formodes at medføre lavere risici.
Ved beregningerne af den mikrobielle risiko er der gjort en række væsentlige antagelser, som kun i et vist omfang afspejler de virkelige forhold. Af disse kan især fremhæves:
- at én og kun en person i husstanden har været inficeret
- at de personer der beregningsmæssigt eksponeres ikke har været inficeret før
Det indikerer, at de øvrige familiemedlemmer ikke er blevet inficeret mens den pågældende person udskilte organismerne, men at de kan inficeres mens de arbejder og opholder sig i haven. Dette er en problematisk antagelse fordi risikoen for infektion generelt vil være meget højere fra person til person end via udspredning i haven og efterfølgende eksponering. Antagelsen har været nødvendig for at kunne udføre beregningerne.
Risikoen for infektion pr. år vurderes derfor at være noget højere end den beregnede værdi. De beregnede risici pr. eksponering formodes derimod at være repræsentative f.eks. ved eksponering af besøgende gæster i haven, når dyr transporterer jord/fæces klumper ind i andre haver mv. Endvidere er der risici, der ikke er medtaget i modellen, f.eks. når disse gæster indtager uforarbejdede grøntsager dyrket i haven.
Resultatet af beregningerne tyder på er der en væsentlig infektionsrisiko forbundet med anvendelse af komposteret afføring i haver specielt i relation til Rotavirus og indvoldsormen Ascaris. Dette gælder selv efter opbevaring af afføring i 12 måneder før anvendelse. Såfremt afføringen ikke er opbevaret i 12 måneder er der beregnet meget høje risici for alle vira og parasitter såfremt et medlem af familien har været inficeret.
De sygdomme der kan komme på tale kan manifestere sig fra symptomløse tilfælde til svære diareer og eventuelt alvorlige almene og langvarige påvirkninger af organismen. Sværhedsgraden vil afhænge af en række faktorer, herunder alder, immunforsvar og infektionstype.
Der er i rapporten desuden beregnet en samlet sandsynlighed for infektion i løbet af et år, hvor infektionerne hos den primært syge i familien optræder med samme hyppighed som incidensen i den danske befolkning. Det indebærer, at mange af eksponeringerne ikke vil indebære en risiko, fordi der ikke er udskildt patogener til beholderen i løbet af året og den udspredte fæces derfor ikke indeholder patogene mikroorganismer. De beregnede risici er derfor mindre.
Det skal bemærkes at manglende observerbar sygdom i husstanden ikke giver sikkerhed for at der ikke er nogen i husstanden, der udskiller mikroorganismer, idet mange infektioner kan forløbe uden eller med kun lette symptomer.
10 Konklusion
Nærværende undersøgelse belyser nogle af de sundhedsmæssige konsekvenser ved at håndtere fæces lokalt i parcelhuse. Udgangspunktet for undersøgelsen er, at lokal håndtering ikke bliver så udbredt, at den generelle sundhedstilstand ændres, fordi antallet af infektioner øges på grund af den nye mulige smittevej.
Det antages i undersøgelsen, at der i husstanden er to voksne og to børn og at disse benytter et toilet, der separerer fæces fra urin. Opsamlet fæces opbevares og udspredes i deres egen have. Urinen bortskaffes på anden vis, f.eks. via salg til landbruget som gødning.
Der er udført kvantitative risikovurderinger men i nogle tilfælde har der været så få data at det ikke har været rimeligt at udføre en beregning. I disse tilfælde er risikoen vurderet kvalitativt eller der er gjort opmærksom på, at denne risiko ikke kan vurderes.
Kemisk risikovurdering, herunder lægemidler
Den kemiske risikovurdering omfatter tungmetallerne bly, cadmium, kobber, krom, kviksølv, nikkel og zink, giften dioxin samt 28 lægemidler, herunder de 25 mest anvendte. Der vurderes ikke at være væsentlige problemer med tungmetallerne og dioxin i forbindelse med den ønskede håndtering, idet det dog bemærkes, at slambekendtgørelsens tungmetalkrav for affald til jordbrugsformål formodentlig vil være overskredet for cadmium og kviksølv. Disse krav er dog ikke gældende for udbringning af komposteret fæces i private haver.
Lægemidler vurderes at være meget stabile i miljøet og der vil forekomme en ophobning i haven hvis et eller flere medlemmerne i familien er under kontinuerlig medicinering. Selv uden at tage denne ophobning med i vurderingen viser beregningerne, at der for to af de tre vurderede lægemidler er et miljøproblem ved den foreslåede håndtering. Det er Østradiol (klimakterielle gener) og Ibuprofen (gigt/smertestillende), mens Digoxin (hjertemedicin) beregningsmæssigt kun potentielt er et problem hvis alle i husstanden tager denne type medicin.
Hjertemedicin er dog sammen med en række andre medicinrester af en type, hvor nogle forskere foreslår, at der af forsigtighedshensyn anvendes et "nul-tolerance" princip. Der har ikke været data til at foretage en vurdering af de øvrige 25 medicinrester. På det nuværende datagrundlag kan en effekt på miljøet ikke afvises for kemiske stoffer, om end det anses for at være usandsynligt at mennesket påvirkes væsentligt fra de kemiske stoffer selv ved tilfældig indtagelse af komposteret fæces fra jorden.
Mikrobiel risikovurdering
Den mikrobielle risikovurdering har indbefattet bakterierne Salmonella og toxisk E. coli (EHEC), parasitterne Giardia, Cryptosporidium og Ascaris samt Rotavirus og Hepatitis A. Der er vurderet tre typer af eksponeringer: ved tømning og udbringning i haven, ved havearbejde og ved ophold i haven. Tømning foregår beregningsmæssigt en gang årligt mens de to øvrige aktiviteter foregår flere gange i løbet af sommerhalvåret. Diskussionen nedenfor er baseret på risikoen for infektion i løbet af et år i to tilfælde, dels hvor der er infektiøst indhold i beholderen og dels hvor der tages udgangspunkt i en tilfældig beholders indhold uden at vide om det er infektiøst. Beregningerne viser, at der er stor forskel på infektionsrisikoen mellem forskellige patogener mens de tre typer af eksponeringer alle er vigtige. Infektionsrisikoen diskuteres derfor for hvert patogen separat.
Den amerikanske miljøstyrelse anbefaler, at risikoen for at blive inficeret med parasitter via drikkevand er mindre end 1 ud af 10.000 personer årligt. Dette tal kan måske sammenlignes med de rapporterede risici i det følgende.
De afrapporterede risici er baseret på beregninger med en matematisk model, der er baseret på en række antagelser om patogeners udskilning og henfald, menneskers indtag af jord og infektivitet overfor de pågældende patogener. Alle disse forhold er behæftet med en betydelig usikkerhed, hvilket også er reflekteret i afrapporteringen af både en "typisk" og en "worst case" risiko.
Efter opbevaring af materialet er risikoen for infektion forårsaget af de bakterielle patogener, Salmonella og EHEC, meget lav. Såfremt materialet ikke opbevares i 12 måneder er der en vis risiko for infektion med Salmonella.
Risikoen for infektion med Hepatitis A beregnes typisk til en lav risiko for infektion såfremt materialet har været opbevaret i 12 måneder. Opbevaring af beholdere inficeret med Hepatitis A i 12 måneder er vigtig, idet risikoen for infektion uden opbevaring i særlige tilfælde er over 1 ud af 10000 eksponerede personer årligt. Særlige tilfælde betyder i nærværende forbindelse eksponering af udsatte grupper, særligt højt indtag mv. Risikoen for infektion ved hyppige ophold i en have hvor der er udspredt friskt materiale inficeret med Hepatitis A er meget høj.
For Rotavirus er der en vis risiko for infektion, hvis der er infektiøst indhold i beholderen. Efter 12 måneders opbevaring vil man typisk have en risiko på knap end 1 ud af 10000 hvis der er Rotavirus i beholderen, med en beregnet risiko i særlige tilfælde på 7 infektioner pr 10 tømninger og udbringninger af materialet. Hvis materialet ikke opbevares er der en særdeles høj risiko for infektion også fra en tilfældig beholders indhold.
Protozoerne Giardia intestinalis og Cryptosporidium parvum har en risiko for infektion på omkring 1 ud af 10000 i særlige tilfælde ved opbevaring i 12 måneder. Hvis materialet ikke er opbevaret er der tale om meget høje risiko for infektion og i nogle tilfælde vil materialet fra én inficeret beholder kunne inficere flere personer i løbet af sommeren.
Indvoldsormen Ascaris er karakteriseret ved høj udskilning, lang overlevelse i fæces og på jord samt en god evne til at inficere mennesker. De beregnede risici er alle højere end 1 ud af 10000 pr. eksponering såfremt materialet indeholder ormens æg i materialet. Risikoen pr. eksponering er så høj, at der ved ophold i haven og havearbejde i praksis vil ske flere infektioner pr. inficeret beholder også efter en opbevaring i 12 måneder. Såfremt materialet ikke opbevares i 12 måneder er det ret sikkert at der vil ske flere infektioner pr. inficeret beholder.
11 Referencer
Albihn, A og TA Stenström (1998): Systemanalys VA - Hygienstudie. VA-FORSK rapport 1998:16, VAV AB, Stockholm, Sverige.
Andersen, JS og T Hald (2001): Risikovurdering vedrørende anvendelse af vandingskanoner til udspredning af gylle fortyndet med vand. Miljørapport nr. 606. ISBN 87-7944-564-0. Miljøstyrelsen, København.
Anonym (2002a): Annual Report on Zoonoses in Denmark 2001. Zoonose-Nyt, 9, 2, 4-19.
Anonym (2002b): EPI-nyt uge 40. Statens Serum Institut.
Anonymous (2003): Giardia and giardiasis. http://www.leeds.ac.uk/civil/ceri/water/tphe/publicat/
watsan/sandis/sandis21.pdf Accessed March 13, 2003.
ANZFA (2001): 19th ATDS Supplementary Information - Part 4: Definitions and Glossary of Terms used in determining safe exposures and regulatory limits for pesticide residues and contaminants. Australia New Zealand Food Authority.
Badawy, AS, JB Rose og CP Gerba (1990): Comparative survival of enteric viruses and coliphage on sewage irrigated grass. Journal of Environmental Science and Health A25(8):937-952.
Belongia, EA, MT Osterholm, JT Soler, DA Ammend, JE Braun og KL MacDonald (1993): Transmission of Escherichia coli O157:H7 infection in Minnesota child day-care facilities. JAMA 269: 883¯888.
Bendixen, HJ (1994): Safeguards against Pathogens in Danish Biogas Plants. Water Science and Technology 30:171-180.
Berg, G, G Sullivan og AD Venosa (1988): Low-temperature stability of viruses in sludges. Applied and Environmental Microbiology 54(3):839-841.
Bergstrøm, K og G Langeland (1981): Overlevning av spolormegg, salmonellabakterier og termostabile koliforme bavterier i jord og på grønnsaker dyrket i infisert jord (Survival of ascaris eggs, salmonella and fecal coli in soil and on vegetables grown in infected soil). Nord. Vet. Med. 33:23-32.
Biermann, U, W Herbst og T Schliesser (1990): The persistence of bovine enterovirus and pseudorabies virus in liquid cattle manure at different storage temperatures. Berl. Munch. Tierarztl. Wochenschr. 103(3):88-90. In: Guardabassi, L, M Sobsey og A Dalsgaard (2002): Occurrence and survival of viruses in composted human faeces. Udgives af Miljøstyrelsen, Copenhagen.
Bitton, G, OC Pancorbo og SR Farrah (1984): Virus transport and survival after land application of sewage sludge. Applied Environmental Microbiology 47:905-909.
Blanc, R og A Nasser (1996): Effect of effluent quality and temperature on the persistence of viruses in soil. Water Science and Technology 33(10-11):237-242.
Burge og Parr (1980): cited in Lewis-Jones og Winkler (1991): Sludge parasites and other pathogens. Ellis Horwood Limited, Chichester, UK.
Bøtner, A (1990): Modelstudier vvedrörende overlevelse af virus i gylle under traditionel opbevaring og under udrådning i biogasanaeg. Statens Veterinaere Institut for Vurusforskning, Lindholm. I: Albihn, A. and Stenström, T.A. 1998. Systemanalys VA - Hygienstudie. VA-FORSK rapport 1998:16, VAV AB, Stockholm, Sverige.
Calabrese EJ, EJ Stanek, RC James og SM Roberts (1999): Soil ingestion. A concern for acute toxicity in children. J. Environ Health 61: 18-23
Carlander, A and T Westrell (1999): A microbiological and sociological evaluation of urine-diverting, double-vault latrines in Cam Duc, Vietnam. Report no. 91, International Office, Swedish University of Agricultural Sciences, Uppsala, Sverige.
Chick, SE, JS Koopman, S Soorapanth og ME Brown (2001): Infection transmission system models for microbial risk assessment. The Science of The Total Environment 274:197-207.
Chien, BT, DT Phi, BC Chung, TA Stenström, A Carlander, T Westrell og U Winblad (2001): Biological study on retention time of microorganisms in faecal material in urine-diverting eco-san latrines in Vietnam. Abstract volume First International Conference on Ecological Sanitation, 5-8 November, Nanning, Kina. p.120-124.
Damgaardlarsen, S, KO Jensen, E Lund og B Nissen (1977): Survival and movement of enterovirus in connection with land disposal of sludges. Water Research 11503-508. In: Guardabassi, L, M Sobsey og A Dalsgaard (2003): Occurrence and survival of viruses in composted human faeces. Miljøstyrelsen, Copenhagen. In Press.
Danmarks Statistik (2002): Oplysninger om husstande mv. hentet på www.dst.dk
Davis, S, P Waller, R Buschbom, J Ballau og P White(1990): Quantitative estimates of soil ingestion in normal children between the ages of 2 and 7 years: Population based estimates estimates using aluminium, silicon and titanium as soil tracer elements. Archives of Environmental Health, 45, 112-122. In: Larsen, PB (1998): Afskæringskriterier for forurenet jord. Miljøprojekt 425, Miljøstyrelsen, København.
Deng, MY og DO Cliver (1995): Persistence of inoculated hepatitis A virus in mixed human and animal wastes. Applied and Environmental Microbiology 61(1):87-91.
ECB (1997): EUSES, European System for the Evaluation of Substances. User manual 1.0. Joint Research Centre, Ispra, Italy.
Eilersen, AM, JC Tjell, M Henze (1998): Muligheder for jordbrugsanven-delse af affald fra husholdninger. I Magid, J. (Ed.): Recirkulering fra by til land? - om næringsstoffer på afveje. pp. 11-40. Institut for Jordbrugsvidenskab, KVL, København.
EIP (1997): Dioxins Source Identification. Report prepared by EIP Associates for Palo Alto Regional Water Quality Control Plant. Sept. 1997.
EMEA (2001): Discussionpaper on enviromental risk assesment of non-GMO containing medicinal products.
EPA (1999): Environmental regulations and technology – Control of pathogens and vector attraction in sewage sludge. EPA/625/R-92-013, U.S. Environmental Protection Agency, Cincinnati, Ohio, USA.
Ethelberg, S (2003): Personlig kommunikation. Statens Seruminstitut.
EU (European Union) (1996): Technical Guidance Documents in support of the Comission directive 93/67/EEC on Risk Assessment for New Notified Substances and the Comission Regulation (EC 1488/94 on Risk Assessment for Existing Substances. EU Commision.
EU (2002): Note for guidance on environmental risk assessment of non-genetically modified organism (non-GMO) containing medicinal products for human use. CPMP/SWP/4447/00. London, 27 June 2002
FDA (2002): Bad Bug Book, U.S. Food & Drug Administration, Center for Food Safety & Applied Nutrition, Foodborne Pathogenic Microorganisms and Natural Toxins Handbook. http://www.cfsan.fda.gov/~mow/chap33.html Accessed August 15, 2002.
Feachem, RG, DJ Bradley, H Garelick og D Mara (1983): Sanitation and Disease - Health Aspects of Excreta and Wastewater Management. John Wiley & Sons, Chichester, UK. 501 pp.
Fewtrell, L og J Bartram (2001): Water Quality: Guidelines, standards and health. Assessment of risk and risk management for water-related infectious desease. IWA Publishing for WHO, London. ISBN 1 900222 28 0.
Finley og Paustenbach (1994): The benefits of probalistic exposure assessment: Three case studies involving contaminated air, water, and soil. Risk Analysis, 14, 53-73. In: Larsen, PB (1998): Afskæringskriterier for forurenet jord. Miljøprojekt 425, Miljøstyrelsen, København.
Franzén, H. and Skott, F. 1999. A study of the use and functioning of urine-diverting dry toilets in Cuernevaca, Mexico - Virus survival, user attitudes and behaviours. Report no. 85, International Office, Swedish University of Agricultural Sciences, Uppsala, Sweden.
Friedman, K (1994): Ken Friedman's Home Page: Material Backgrounder: Heavy Metals (Cadmium, Lead, Nickel, Chromium).
(http//www.lehigh.edu/kaf3/public/www-data/background/hvymtl2.html).
Gantzer, C, P Gaspard, L Galvez, A Huyard, N Dumouthier og J Schwartzbrod (2001): Monitoring of bacterial and parasitological contamination during various treatment of sludge. Water Reserach 35:3763-3770.
Geyer, HJ, KW Schramm, EA Feicht, A Behechti, C Steinberg, R Brüggemann,H Poiger, B Henkelmann og A Kettrup (2002): Halflives of tetra-, penta-, hexa-, hepta-, and octachlorodibenzo-p-dioxin in rats, monkeys and humans - a critical review. Chemosphere 48 (2002) 631-644.
Gibbs, RA, CJ Hu, GE Ho og I Unkovich (1997): Regrowth of faecal coliforms and salmonellae in stored biosolids and soil amended with biosolids. Water Science and Technology 35:269-275.
Girdwood, RWA og HV Smith (1999): Cryptosporidium. Encyclopaedia of Food Microbiology. Robinson, R., Batt, C. and Patel, P. London and New York, Academic Press. p 487-497.
Gray, M, RD Leon, BE Tepper og MD Sobsey (1993): Survival of hepatitis A virus (HAV), poliovirus 1 and F-specific coliphages in disposable diapers and landfill leachates. Water Science and Technology 27(3-4):429-432.
Gaasenbeek, CP og FH Borgsteede (1998): Studies on the survival of Ascaris suum eggs under laboratory and simulated field conditions. Vet Parasitol 75(2-3):227-34.
Hald, T og JS Andersen (2003): Risikovurdering vedrørende eksponering for smitstoffer i forbindelse med anvendelse af human urin som gødning. Miljøprojekt, Miljøstyrelsen, København. Under udarbejdelse.
Halling-Sørensen, B, S Nors Nielsen, PF Lanzky, F Ingerslev, HC Holten Lützhøft og SE Jørgensen (1998): Occurrence, fate and effects of pharmaceutical substances in the environment - a review. Chemosphere 36, pp 357-393.
Halling-Sørensen, B, J Jensen and S Nors Nielsen (2002): Environmental Assessment of Veterinary Medicinal Products in Denmark. Report to the Danish Medical Agency and The Danish Environmental Agency. pp 100 www.mst.dk november 2002
Hanon, FX (2002): Personlig kommunikation. Statens Serum Institut.
Havelaar, AH, M Butler, SR Farrah, J Jofre, E Marques, A Ketratanakul, MT Martins, S Ohgaki,MD Sobsey og U Zaiss (1991): Bacteriophages as model viruses in water quality control. Water Research 25(5):529-545.
Hegrestad, AL (2001): EHEC – ett livsmedelshygieniskt gissel. Svensk Veterinärtidning 53(12):619-625.
Himathongkham, S, B Saipul, H Riemann og D Cliver (1999): Survival of Escherichia coli O157:H7 and Salmonella Typhimurium in cow manure and cow slurry. FEMS Microbiology letters 178:251-257.
Hu, CJ, RA Gibbs, NR Mort, HT Hofstede, GE Ho og I Unkovich (1996): Giardia and its implications for sludge disposal. Water Science and Technology 34(7-8):179-186
Höglund, CE og TAB Stenström (1999): Survival of Cryptosporidium parvum oocysts in source separated human urine. Canadian Journal of Microbiology 45(9):740-746.
Höglund, C, TA Stenström og N Ashbolt (2002): Microbial risk assessment of source-separated urine used in agriculture. Waste Manag. Res 20(3):150-161.
Haas, CN, A Thayyar-Madabusi, JB Rose og CP Gerba (2000): Development of a dose-response relationship for Escherichia coli O157:H7. International Journal of Food Microbiology 56: 153-159.
Haas, CN, CS Crockett, JB Rose, CP Gerba og AM Fazil (1996): Assessing the risk posed by oocysts in drinking water. Journal of American Water Works Association 88:131-136.
Haas, CN, JB Rose og CP Gerba (1999): Quantitative microbial risk assessment. John Wiley & Sons, Inc, New York. 449 pp.
Haas, CN, JB Rose, CP Gerba og S Regli (1993): Risk assessment of virus in drinking water. Risk Analysis 13(5):545-552.
Haas, CN, A Thayyar-Madabusi, JB Rose og CP Gerba (2000): Development of a dose-response relationship for Escherichia coli O157:H7. International Journal of Food Microbiology 56:153-159.
ICON (2001): Pollutants in Urban Waste Water and Sewage Sludge. Report prepared by ICON (IC Consultants Ltd., London) for the European Commission, Directorate General Environment.
Ingerslev, F (2000): Biodegradability of medical compounds in the environment. Ph.D. Thesis, Royal Danish School of Pharmacy. Copenhagen, Denmark.
Jeffrey, HC og RM Leach (1975): Atlas of Helminthology and Protozoology, 1st ed. Churchill & Livingstone, Edinburgh, Scotland. In: Lewis-Jones, R. and Winkler, M. 1991. Sludge parasites and other pathogens. Ellis Horwood Limited, Chichester, UK.
Jenkins, MB, DD Bowman og WC Ghiorse (1998): Inactivation of Cryptosporidium parvum oocysts by ammonia. Applied and Environmental Microbiology 64(2):784-788.
Jenkins, MB, DD Bowman, EA Fogarty og WC Ghiorse (2002): Cryptosporidium parvum oocyst inactivation in three soil types at various temperatures and water potentials. Soil Biology & Biochemistry 341101-1109.
Jenkins, MB, MJ Walker, DD Bowman, LC Anthony og WC Ghiorse (1999): Use of a sentinel system for field measurements of Cryptosporidium parvum oocyst inactivation in soil and animal waste. Applied and Environmental Microbiology 65(5):1998-2005.
Jiang, X, J Morgan og MP Doyle (2002): Fate of Escherichia coli O157:H7 in Manure-Amended Soil. Applied and Environmental Microbiology 68:2605-2609.
Knowlton, DR og RL Ward (1987): Characterization of virucidal agents in activated sludge. Applied and Environmental Microbiology 53(4):621-626.
Kowal, NE (1985): Health effects of land application of municipal sludge. Pub. No.: EPA/600/1-85/015. Research Triangle Park, NC: US EPA Health Effects Research Laboratory. In: EPA (1999): Environmental regulations and technology – Control of pathogens and vector attraction in sewage sludge. EPA/625/R-92-013, U.S. Environmental Protection Agency, Cincinnati, Ohio, USA.
Lan, Y, L Xueming, W Qinhua, X Hongbo, N Caiyun og N Lianghong (2001): Observation of the inactivation effect on eggs of Ascaris ssum in urine diverting toilets. Abstract volume First International Conference on Ecological Sanitation, 5-8 November, Nanning, Kina. p.125.
Larsen, HE og B Munch (1981): Sygdoms og miljømæssige problemer i forbindelse med behandling og spredning af flydendehusdyrgødning (gylle). Edited by the Royal Vet. and Agric. Univ., Copenhagen.
Larsen, PB (1998): Afskæringskriterier for forurenet jord. Miljøprojekt 425, Miljøstyrelsen, København. ISBN 87-7909-068-0.
Lau, MM og SC Ingham (2001): Survival of faecal indicator bacteria in bovine manure incorporated into soil. Letters in Applied Microbiology 33:131-136.
Lewis-Jones, R og M Winkler (1991): Sludge parasites and other pathogens. Ellis Horwood Limited, Chichester, UK.
Loke, ML, J Tjørnelund, B Halling-Sørensen (2002): Determination of the distribution coefficient (log kd) of oxytetracycline, tylosin, olaquindox and metronidazole in manure. Chemosphere 48:351-361
Lægemiddelstyrelsen (2002): Lægemiddelstatistik for 2000, Danmark. Fra Lægemiddelstyrelsens internetside www.dkma.dk. Maj 2002.
Miljøministeriet (2003): Bekendtgørelse om anvendelse af affald til jordbrugsformål. Bekendtgørelse nr. 623 af 30. juni 2003.
Miljøstyrelsen (1995): Forekomst og effekter af miljøfremmede organiske stoffer i spildevandsslam. Arbejdsrapport nr. 15, 1995 fra Miljøstyrelsen.
Miljøstyrelsen (2001): Spildevandsslam fra kommunale og private renseanlæg i 1999. Orientering fra Miljøstyrelsen Nr. 3, 2001.
Møller, J (2002): Statusrapport mht. projekterne: "Vurdering af forskellige komposttoiletters funktion og evne til at reducere smitstoffer i human afføring" og "Smitstofreduktion ved centraliseret efterkompostering af human afføring fra komposttoiletter". 24. april 2002. Forskningscentret for Skov og Landskab, Hørsholm. Ikke publiceret.
Nasser, AM, R Glozman og Y Nitzan (2002): Conribution of microbial activity to virus reduction in saturated soil. Water Research 362589-2595.
Nativg, EE, SC Ingham, BH Ingham, LR Cooperband og TR Roper (2002): Salmonella enterica serovar Thyphimurium and Escherichia coli contamination of root and leaf vegetables grown in soils with incorporated bovine manure. Applied and Environmental Microbiology 68:2737-2744.
NHMRC (2002): Dioxins: Proposal for setting an Australian tolerable monthly intake. Draft Report. National Health and Medical Research Council, Canberra, Australia, January 2002.
Nordic Council of Ministers (1995): Environmental Hazard Classification - data collection and interpretation guide. TemaNord 1995:581.
Norin, E, TA Stenström og A Albihn (1996): Stabilisation and disinfection of blackwater and organic waste by liquid composting. Vatten 52(3):165-176
O'Donnell, CJ, KB Meyer, JV Jones, T Benton, ES Kaneshiro, JS Nichols og FW Schaefer (3rd- 1984): Survival of parasite eggs upon storage in sludge. Appl Environ Microbiol 48(3):618-25.
OECD (1992): Report of the OECD workshop on the extrapolation of laboratory aquatic toxicity data to the real environment. OECD Environment Monographs no. 59, pp 72.
Olsen, J, HE Elmerdahl Larsen og P Nansen (1985): Smitstofreduktion ved biogasproduktioni husdyrbruget. STUB report No. 20 edited by the Danish Inst. of Technol., Div. Chem. Technol., Tåstrup.
Olson, ME, J Goh, M Phillips, N Guselle og TA McAllister (1999): Giardia cyst and Cryptosporidium oocyst survival in water, soil, and cattle feces. Journal of Environmental Quality 28(6):1991-1996.
Oomen (2000): Determinants of oral bioavailability of soil-borne contaminants. Ph.D-thesis. Ritox, Utrecht, University, The Netherland. (in english)
Palisade (2002): @RISK [EDB-program], version 4.5. Palisade Corporation, Newfield, NY, USA.
Pesaro, F, I Sorg og A Metzler (1995): In situ inactivation of animal viruses and a coliphage in nonaerated liquid and semiliquid animal wastes. Applied and Environmental Microbiology 61(1):92-97.
Plachy, P og P Juris (1995): Survival of the Model Helminth Ascaris-Suum Eggs in the Sludge Drying Beds of Sewage-Treatment Plants. Veterinarni Medicina 40(1):23-27.
Politiken (2002): Få skovlen under ukrudtet. Artikel i havesektionen, 9. maj 2002.
Ramos, APD, CC Stefanelli, R Elisa, C Linhares, BGD Brito, N Santos, V Gouvea, R Lima og C Nozawa (2000): The stability of porcine rotavirus in faeces. Veterinary Microbiology 711-8. In: Guardabassi, L, M Sobsey og A Dalsgaard (2002): Occurrence and survival of viruses in composted human faeces. Udgives af Miljøstyrelsen, Copenhagen.
Rang, HP og MM Hale (1991): Pharmacology, Churchill Livingstone, 2nd edition.
Rose, JB, CN Haas og S Regli (1991) Risk assessment and the control of waterbe giardiasis. American Journal of Public Health 81:709-713.
Sanz JL, N Rodriguez og R Amils (1996): The action of antibiotics on the anaerobic digestion process. Appl. Microbiol Biotechnol. 46:587-92.
Shuval, H, Y Lampert og B Fattal (1997): Development of a risk assessment approach for evaluating wastewater reuse standards for agriculture. Water Science and Technology, 35, 11-12, 15-20.
Smith, HV, LJ Robertson og JE Ongerth (1995): Cryptosporidiosis and giardiasis: the impact of waterborne transmission. J Water SRT - Aqua 44:258-274.
Stanek, EJ og EJ Calabrese (1995): Daily estimates of soil ingestion in children. Environmental Health Perspectives, 103, 3, 276-285. In: Larsen, PB (1998): Afskæringskriterier for forurenet jord. Miljøprojekt 425, Miljøstyrelsen, København.
Stenström, TA (1987): Kommunalt avloppsvatten från hygienisk synpunkt - mikrobiologiska undersökningar, Report 4683. Swedish Environmental Protection Agency, Stockholm.
Stenström, TA (1996): Sjukdomsframkallande mikroorganismer i avloppssystem - Riskvärdering av traditionella och alternativa avloppslösningar. Rapport 4683, Swedish Environmental Protection Agency and National Board of Health and Welfare, Stockholm, Sverige.
Stuer-Lauridsen, F, M Birkved, L Hansen, H C Holten Lützhøft og B Halling-Sørensen (2000): Environmental Risk Assessment of Human Pharmaceuticals in Denmark after Normal Therapeutic Use. Chemosphere, Vol. 7, pp 783-793.
Stuer-lauridsen, F, L Hansen, M Birkved, J Kjølholt, S Mikkelsen (2002): Litteraturudredning vedrørende human medicin i miljøet. Miljørapport 661.
Szewzyk, U, R Szewzyk, W Manz og KH Schleifer (2000): Microbiological safety of drinking water. Annual Review on Microbiology 54: 81-127.
Szewzyk, U, R Szewzyk, W Manz og KH Schleifer (2000): Microbiological safety of drinking water. Annual Review on Microbiology 54:81-127.
Teunis, PFM, OG van der Heijden, JWB van der Giessen og AH Havelaar (1996): The dose-response relation in human volunteers for gastro-intestinal pathogens. Report 284550 002, National Institute of Public Health and the Environment, Bilthoven, the Netherlands.
Teunis, PFM og AH Havelaar (2000): The Beta Poisson Dose-Response model is not a single-hit model. Risk Analysis, 20, 4, 513-520.
Tolls, J (2001): Sorption of veterinary pharmaceuticals in soils: A review. Environ. Sci. Technol. 35:3397-3406.
Uhnoo, I, G Wadell, L Svensson, E Olding-Stenkvist, E Ekwall og R Möllby (1986): Aetiology and epidemiology of acute gastro-enteritis in Swedish children. Journal of Infection 13:73-89.
Wang, G, T Zhao og MP Doyle (1996): Fate of enterohemorrhagic Escherichia coli O157:H7 in bovine feces. Applied and Environmental Microbiology 62:2567-2570.
Wang, JQ (1999): Reduction of microorganisms in dry sanitation due to different adsorbents under low temperature conditions. Abstracts from the 9th Stockholm Water Symposium, 9-12 August, Stockholm, Sweden. p. 396-398.
Ward, RL, DI Bernstein, EC Young, JR Sherwood, DR Knowlton og GM Schiff (1986): Human rotavirus studies in volunteers: Determination of infectious dose and serological response to infection. The Journal of Infectious Diseases 154(5):871-880.
Wrisberg, S, AM Eilersen, SB Nielsen, K Clemmensen, M Henze og J Magid (2001): Vurdering af muligheder og begrænsninger for recirkulering af næringsstoffer fra by til land. Økologisk byfornyelse og spildevandsrensning nr 14. Miljøstyrelsen, København.
Bilag A
Nedenfor er baggrundsdata for de valgte modeller for incidens, varighed og udskillelse af indikatorer og patogener angivet i form af kilder til de enkelte tal.
Tabel A.1 Incidens.
| Mirkoorganismer | Registreret antal i 2001 | Antal pr 100.000, incidens | Skønnet mørketal | Bemærkning | Ref. |
| Bakterie | |||||
| Salmonella | 2918 | 55 | Anonym (2002a) | ||
| 10 | Ethelberg (2003) | ||||
| EHEC | 92 | 1,7 | Anonym (2002a) | ||
| 20 | Der er en væsentlig underrapportering fra nogle amter. Mørketallet for "gode" amter svarer til Salmonella. | Ethelberg (2003) | |||
| Virus | |||||
| Rotavirus | 284 | 5,3 | Antal positive prøver hos SSI. Der er ikke krav om national indrapportering. | Hanon (2002) | |
| 1200 | Skøn over faktisk antal incl. mørketal | Hald og Andersen (2003) | |||
| Hepatitis A | 63 | 1,2 | Anonym (2002b) | ||
| 6 | Mørketallet er skønnet lavt ud svarende til sygdommens almindeligvis alvorlige karakter | ||||
| Parasitter*** | |||||
| Giardia | 313 | 5,9 | Anonym (2002a) | ||
| 1100 | Skøn over faktisk antal incl. mørketal. | Hald og Andersen (2003) | |||
| Cryptosporidium | 56 | 1,0 | Anonym (2002a) | ||
| 200 | Skøn over faktisk antal incl. mørketal | Hald og Andersen (2003) | |||
| Ascaris**** | 23 | 0,4 | Anonym (2002a) |
*** Hald og Andersen skønner 1343 incidenser samlet for Giardia og Cryptosporidium. Ascaris er tildelt relativt samme incidens-rate.
**** Antallet af incidenser er større end antallet af udskildninger fordi det kræver infektion af såvel han- som hunorm.
Antallet af incidenser af udskildning af Ascaris kan skønnes ud fra forholdet mellem rapporterede og skønnede faktiske forekomster af de øvrige parasitter. Antallet af udskillede æg vil dog være mindre idet æg først udskilles når der er orm af begge køn til stede. Denne frekvens er skønnet til 0,2.
Tallene i tabel 1 repræsenterer de bedste skøn over antallet af infektioner årligt. For alle patogenerne er der en større eller mindre andel af befolkningen, der er raske smittebærere. Der er kun sparsom litteratur til at belyse betydningen heraf.
Tabel A.2. Udskillelse
| Mikroorganisme | Udskilning
(Antal/g fæces vådvægt) |
Reference | Bemærkninger |
| Indikatororganisme: | |||
| E. coli | 106-9 | Stenström, 1987 | |
| Enterokokker | 105-6 | Stenström, 1987 | |
| Bakteriofager | Colifager <103 | Havelaar et al. 1991 | |
| Bakterier | |||
| Salmonella | 106, 104-1010 | Feachem et al., 1983 | |
| EHEC | Kvæg 102-105 | Himathongkham et al., 1999 | |
| Virus: | |||
| Rotavirus | maximum 1011
=108 108-1010 /ml |
Feachem et al., 1983
Szewzyk et al., 2000 FDA 2002 |
|
| Parasiter: | |||
| Giardia | 105-7/g
up to 1010 cysts/day |
Feachem et al.,1983
Smith et al., 1995 |
|
| Cryptosporidium | 1010 (per day)*
107 |
Smith et al., 1995
Girdwood and Smith, 1999 |
|
| Ascaris | Mean 104 | Faechem et al., 1983 |
* Det fremgår ikke klart af referencen hvad enheden er. Ud fra de øvrige referencer på parasitter antages det at der er tale om en daglig udskillelse.
Tabel 3. Varighed
| Mikroorganisme | Varighed | Reference | Bemærk-ninger |
| Bakterier | |||
| Salmonella | Børn <15 år: 34 dage (15-42 dage)
4-6 uger, i visse tilfælde flere måneder/år |
Uhnoo et al., 1986 | |
| EHEC | 90% af patienterne er raske efter 1 uge
Middel for børn <5 år: 17 dage, 38% udskille i mere end 20 dage |
Hegrestad, 2001
Belongia et al.,1993 |
|
| Virus: | |||
| Rotavirus | Op til 30 dage
1-8 dage, kan vare i over 20 dage |
Uhnoo et al., 1986
Feachem et al., 1983 |
|
| Parasiter: | |||
| Giardia | Op til 41 dage, børn op til flere år, 2/3 (såvel børn som voksne) mere end 3 måneder | Anonymous, 2003 | |
| Cryptosporidium | 1 uge
<3-30 dage, middel 12 dage, kan komme igen efter at symptomer er aftaget og fortsætte i 50 dage, gennemsnittet er dog 7 dage |
Chick et al. 2001
Smith et al., 1995 |
|
| Ascaris | Ormens levetid er generelt <10 måneder, max. 1,5 år. Udskilning af æg gennem hele levetiden. Ny smitte giver orm af anden alder i tarmene |
Bilag B
Oversigt over de fundne relevante referencer der er benyttet til at skønne henfaldstider for de organismer som er omfattet af risikovurderingen.
Tabel B.1 Inaktivationsrater for indikatororganismer og patogener i fæces og andet materiale (gylle, dyre fæces)
Tabel B.2 Inaktivationsrater for indikatororganismer og patogener i jord, jord tilført fækalt materiale og græsafgrøder (kan betragtes som jordoverflade i visse tilfælde)
Bilag C
C.1 Metode
Hvis alle de stokastiske variable har samme fordelingstype er det relativt enkelt at udregne den resulterende fordeling eksakt. I denne sammenhæng benyttes flere typer af fordelinger og modeller, f.eks. log-normal fordeling for udskilelsen af patogener pr g. fæces, antallet af inficerede om året er beskrevet ved en normalfordeling og sammenhængen mellem dosis og respons beskrives ved at estimere en parameter i en model. I det tilfælde benyttes ofte Monte Carlo simuleringer som en hurtig og bekvem måde at beregne den resulterende fordeling.
Monte Carlo simuleringer er simple at udføre og tolke når modellen er opstillet og usikkerheden på de stokastiske variable beskrevet. Simuleringen udføres ved mange gange tilfældigt at udtage mulige værdier af input variablene og dermed udregne mulige udfald af indtag af indikatorvariable, risikoen for infektion pr gang og risikoen for infektion pr. år. Hvert af disse mulige anfald anses for at være lige sandsynlige. Ved simuleringens afslutning rangordnes de (lige sandsynlige) udfald og beskrives som en fordelingsfunktion for den resulterende fordeling.
De afrapporterede risici i nærværende rapport er udført med EDB-programmet @RISK (Palisade, 2002) på baggrund af 5.000 simuleringer. Derved er de resulterende fordelinger så godt beskrevet som muligt ud fra de fordelinger der er angivet.
C.2 Beskrivelse af input-variable til de enkelte organismer og processer
I det følgende er der kort givet en oversigt over de præcise beskrivelser af de input som ikke er præcist beskrevet i rapporten. X N(m,s) betyder at X er en stokastisk normalfordelt variabel med middelværdi m og spredning s. Når Ln(X) er normalfordelt med middelværdi m1 og spredning s1 betegnes fordelingen LN(m1, s1).
Tabel C.1 Fordelinger for incidens, udskilning og varighed for udvalgte organismer.
| Organisme | Incidens pr. 100.000, I | Udskilning, U (antal/g vådvægt) | Varighed, V (dage) |
| Indikator organisme | |||
| E. coli | LN(17,3; 1,7) | ||
| Enterokokker | LN(12,7; 0,6) | ||
| Bakteriofager | LN(5,8; 0,6) | ||
| Bakterie | |||
| Salmonella | N(500; 100) | LN(13,8; 2,3) | LN(3,6; 0,2) |
| EHEC | N(30; 5) | LN(5,8; 1,2) | LN(2,1; 0,25) |
| Virus | |||
| Rotavirus | N(1200; 200) | LN(20,7; 2,3) | LN(1,6; 1,25) |
| Hepatitis A | N(6; 1) | LN(11,5; 1,2) | LN(3,0; 0,25) |
| Parasitter | |||
| Giardia | (1100; 100) | LN(15,0; 1,7) | LN(4,5; 0,7) |
| Cryptosporidium | N(200; 25) | LN(17,3; 0,6) | LN(2,0; 0,85) |
| Ascaris | N(20; 3) | LN(9,2; 0,6) | LN(5,5; 0,5) |
Tabel C.2 Fordelinger for henfald af organismer i fæces og i jord.
| Mirkoorganismer | Henfald i fæcesT90, fæces(dage) | Henfald i jordT90, jord(dage) |
| Indikator organisme | ||
| E. coli | N(25;4) | N(60;16) |
| Enterokokker | N(150;20) | N(50;12) |
| Bakteriofager | N(27,5;9) | N(55;18) |
| Bakterie | ||
| Salmonella | N(30,8) | N(35;6) |
| EHEC | N(20;4) | N(25;6) |
| Virus | ||
| Rotavirus | N(60,16) | N(30;8) |
| Hepatitis A | N(55,18) | N(75;10) |
| Parasitter | ||
| Giardia | N(27,5;9) | N(30;4) |
| Cryptosporidium | N(70,20) | N(495;182) |
| Ascaris | N(125;30) | N(625;150) |
Tabel C.3 Fordelinger af indtag af fæces ved indtagelse af en dagsdosis af en blanding af fæces og jord.
| Fordeling | |
| Børn | LN(4,2; 1,0) |
| Voksne | LN(3,5; 0,7) |
| Udlægning | LN(1,1; 2,0) |
| Indarbejdning | LN(-1,0; 2,3) |
Tabel C.4 Fordeling af antal eksponeringer pr uge ved havearbejde og ved ophold i haven pr person. Det faktiske antal eksponeringer fremkommer derved ved at finde et gennemsnitligt antal eksponeringer for hele familien og dernæst trunkere dette tal til et positivt heltal.
| Fordeling | Sæson | |
| Havearbejde | LN(0,0; 1,2) | maj - september |
| Ophold i haven | LN(1,2; 0,7) | juni - august |
Tabel C.5 Modeller for usikkerheden på parametrene i dosis-respons kurverne. Modellerne for Beta-Poisson er ikke alment gældende, idet hele variationen er tilskrevet den vigtigste parameter i det interval der har interesse.
| Patogen | Modeltype | Parametre |
| Salmonella | Beta-Poisson | ln(N50) N(10,0; 0,7), = 0,3126 |
| EHEC | Eksponentiel | k N(300; 50) |
| Rotavirus | Beta-Poisson: | ln(N50) N(1,7; 1,2), = 0,265 |
| Hepatitis A | Beta-Poisson | ln(N50) N(3,4; 1,2), = 0,2 |
| Giardia | Eksponentiel model | ln(k) N(3,9; 0,7) |
| Cryptosporidium | Eksponentiel model | ln(k) N(5,5; 0,4) |
| Ascaris | Eksponentiel model | k=1 |
Som eksempel på de resulterende konfidensintervaller er på figur C.1 angivet de oprindeligt estimerede 95% konfidensintervaller i Teunis og Havelaar (2000) og de konfidensintervaller, som fremkommer ved brug af parametrene i tabel C.5. Det ses, at de beregnede responser begrænses af maksimum-risk modellen for doser under 0,5.
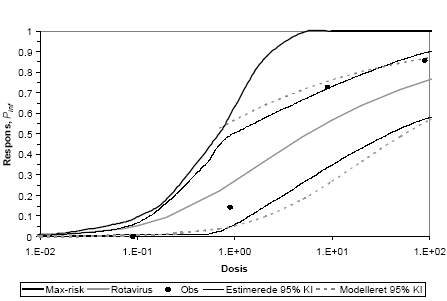
Figur C.1 Resulterende konfidensintervaller af den modellerede variation for parametrene for Rotavirus. For doser under 0,7 benyttes maksimum-risk modellen som øvre grænse for responsen.
Bilag D
Nedenfor er angivet tabeller med beregningsresultaterne for alle scenarier i den mikrobielle risikovurdering.
D.1 Risiko ved tømning
Tabel D.1 Scenarie 1: Tømning af beholder og udbringning af materiale opbevaret i 0 måneder.
| Typisk | Worst-case | |||||
| Dosis | Risiko givet infektion | Risiko | Dosis | Risiko givet infektion | Risiko | |
| E.coli | 3 104 | - | - | 1 106 | - | - |
| Enterokokker | 2 103 | - | - | 1 104 | - | - |
| Bakteriofager | 4 10-1 | - | - | 2 100 | - | - |
| Salmonella | 7 10-3 | 8 10-7 | 2 10-8 | 3 103 | 2 10-1 | 5 10-3 |
| EHEC | 1 10-10 | 3 10-13 | 4 10-16 | 2 10-2 | 9 10-5 | 1 10-7 |
| Rotavirus | 1 102 | 8 10-1 | 3 10-2 | 1 106 | 1 | 5 10-2 |
| Hepatitis A | 4 10-2 | 9 10-3 | 2 10-6 | 9 101 | 6 10-1 | 2 10-4 |
| Giardia intestinalis | 3 100 | 6 10-2 | 2 10-3 | 2 104 | 1 | 5 10-2 |
| Cryptosporidium parvum | 2 101 | 6 10-2 | 5 10-4 | 7 103 | 1 | 9 10-3 |
| Ascaris | 9 100 | 1 | 8 10-4 | 6 101 | 1 | 1 10-3 |
Tabel D.2 Scenarie 2&4: Tømning af beholder og udbringning af materiale opbevaret i 6 måneder.
| Typisk | Worst-case | |||||
| Dosis | Risiko givet infektion | Risiko | Dosis | Risiko givet infektion | Risiko | |
| Salmonella | 6 10-9 | 6 10-13 | 1 10-14 | 4 10-2 | 5 10-6 | 1 10-7 |
| EHEC | 9 10-20 | n.r. | n.r. | 2 10-10 | 5 10-13 | 6 10-16 |
| Rotavirus | 1 10-1 | 4 10-2 | 2 10-3 | 3 103 | 9 10-1 | 4 10-2 |
| Hepatitis A | 2 10-5 | 4 10-6 | 1 10-9 | 1 10-1 | 4 10-2 | 1 10-5 |
| Giardia | 5 10-7 | 1 10-8 | 4 10-10 | 5 102 | 1 | 4 10-2 |
| Cryptosporidium | 3 10-2 | 1 10-4 | 1 10-6 | 6 101 | 3 10-1 | 2 10-3 |
| Ascaris | 2 100 | 9 10-1 | 6 10-4 | 5 101 | 1 | 9 10-4 |
Tabel D.3 Scenarie 3 & 5: Tømning af beholder og udbringning af materiale opbevaret i 12 måneder.
| Typisk | Worst-case | |||||
| Dosis | Risiko givet infektion | Risiko | Dosis | Risiko givet infektion | Risiko | |
| E.coli | 8 10-11 | - | - | 6 10-7 | - | - |
| Enterokokker | 8 100 | - | - | 7 101 | - | - |
| Bakteriofager | 2 10-14 | - | - | 3 10-9 | - | - |
| Salmonella | 5 10-15 | n.r. | n.r. | 2 10-7 | 6 10-11 | 1 10-12 |
| EHEC | 7 10-29 | n.r. | n.r. | 2 10-18 | n.r. | n.r. |
| Rotavirus | 9 10-5 | 4 10-5 | 2 10-6 | 1 101 | 7 10-1 | 3 10-2 |
| Hepatitis A | 9 10-9 | 2 10-9 | 4 10-13 | 6 10-4 | 2 10-4 | 5 10-8 |
| Giardia intestinalis | 2 10-13 | 3 10-15 | 1 10-16 | 2 10-3 | 8 10-5 | 4 10-6 |
| Cryptosporidium parvum | 9 10-5 | 4 10-7 | 3 10-9 | 5 10-1 | 2 10-3 | 2 10-5 |
| Ascaris | 8 10-2 | 7 10-2 | 6 10-5 | 2 101 | 1 | 9 10-4 |
D.2 Risiko ved havearbejde
Tabel D.4 Scenarie 1: Udlægning af materiale opbevaret i 0 måneder. Risiko ved havearbejde.
| Pinf|infektion pr. eksponering ifm havearbejde i maj | PinfIinfektion ifm havearbejde i maj | Pinf, havearbejde gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | 1 10-8 | 1 10-2 | 7 10-8 | 1 10-1 | 2 10-9 | 4 10-3 |
| EHEC | 3 10-15 | 1 10-6 | 2 10-14 | 1 10-5 | 2 10-17 | 2 10-8 |
| Rotavirus | 3 10-1 | 1 | 9 10-1 | 1 | 4 10-2 | 6 10-2 |
| Hepatitis A | 3 10-4 | 4 10-1 | 2 10-3 | 1 | 1 10-6 | 3 10-4 |
| Giardia intestinalis | 5 10-4 | 1 | 4 10-3 | 1 | 2 10-4 | 5 10-2 |
| Cryptosporidium parvum | 5 10-3 | 1 | 3 10-2 | 1 | 1 10-3 | 9 10-3 |
| Ascaris | 5 10-1 | 1 | 1 | 1 | 8 10-4 | 1 10-3 |
Tabel D.5 Scenarie 2: Udlægning af materiale opbevaret i 6 måneder. Risiko ved havearbejde.
| Pinf|infektion pr. eksponering ifm havearbejde i maj | PinfIinfektion ifm havearbejde i maj | Pinf, havearbejde gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | 1 10-14 | 5 10-7 | 7 10-14 | 4 10-6 | 2 10-15 | 1 10-7 |
| EHEC | n.r. | 2 10-14 | n.r. | 8 10-14 | n.r. | 1 10-16 |
| Rotavirus | 4 10-4 | 9 10-1 | 3 10-3 | 1 | 2 10-4 | 5 10-2 |
| Hepatitis A | 1 10-7 | 3 10-3 | 1 10-6 | 2 10-2 | 6 10-10 | 2 10-5 |
| Giardia | 1 10-10 | 3 10-1 | 1 10-9 | 9 10-1 | 7 10-11 | 4 10-2 |
| Cryptosporidium | 1 10-5 | 4 10-2 | 7 10-5 | 3 10-1 | 3 10-6 | 7 10-3 |
| Ascaris | 1 10-1 | 1 | 6 10-1 | 1 | 7 10-4 | 1 10-3 |
Tabel D.6 Scenarie 3: Udlægning af materiale opbevaret i 12 måneder. Risiko ved havearbejde.
| Pinf|infektion pr. eksponering ifm havearbejde i maj | PinfIinfektion ifm havearbejde i maj | Pinf, havearbejde gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | n.r. | 7 10-12 | n.r. | 6 10-11 | n.r. | 2 10-12 |
| EHEC | n.r. | n.r. | n.r. | n.r. | n.r. | n.r. |
| Rotavirus | 4 10-7 | 5 10-1 | 3 10-6 | 1 | 2 10-7 | 4 10-2 |
| Hepatitis A | 7 10-11 | 1 10-5 | 5 10-10 | 6 10-5 | 3 10-13 | 6 10-8 |
| Giardia | n.r. | 2 10-5 | n.r. | 2 10-4 | n.r. | 1 10-5 |
| Cryptosporidium | 3 10-8 | 3 10-4 | 2 10-7 | 9 10-1 | 8 10-9 | 1 10-4 |
| Ascaris | 7 10-3 | 1 | 5 10-2 | 1 | 2 10-4 | 9 10-4 |
Tabel D.7 Scenarie 4: Indarbejdning af materiale opbevaret i 6 måneder. Risiko ved havearbejde.
| Pinf|infektion pr. eksponering ifm havearbejde i maj | PinfIinfektion ifm havearbejde i maj | Pinf, havearbejde gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | 9 10-16 | 6 10-8 | 7 10-15 | 5 10-7 | 2 10-16 | 1 10-8 |
| EHEC | n.r. | 2 10-15 | n.r. | 1 10-14 | n.r. | 1 10-17 |
| Rotavirus | 4 10-5 | 7 10-1 | 3 10-4 | 1 | 2 10-5 | 5 10-2 |
| Hepatitis A | 2 10-8 | 5 10-4 | 1 10-7 | 4 10-3 | 7 10-11 | 2 10-6 |
| Giardia | 1 10-11 | 6 10-2 | 1 10-10 | 4 10-1 | 8 10-12 | 3 10-2 |
| Cryptosporidium | 1 10-6 | 6 10-3 | 9 10-6 | 5 10-2 | 3 10-7 | 2 10-3 |
| Ascaris | 2 10-2 | 9 10-1 | 1 10-1 | 1 | 5 10-4 | 9 10-4 |
Tabel D.8 Scenarie 5: Indarbejdning af materiale opbevaret i 12 måneder. Risiko ved havearbejde.
| Pinf|infektion pr. eksponering ifm havearbejde i maj | PinfIinfektion ifm havearbejde i maj | Pinf, havearbejde gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | n.r. | 5 10-13 | n.r. | 4 10-12 | n.r. | 1 10-13 |
| EHEC | n.r. | n.r. | n.r. | n.r. | n.r. | n.r. |
| Rotavirus | 4 10-8 | 2 10-1 | 3 10-7 | 8 10-1 | 2 10-8 | 3 10-2 |
| Hepatitis A | 7 10-12 | 2 10-6 | 5 10-11 | 1 10-5 | 4 10-14 | 1 10-8 |
| Giardia intestinalis | n.r. | 9 10-6 | n.r. | 4 10-5 | n.r. | 2 10-6 |
| Cryptosporidium parvum | 3 10-9 | 6 10-5 | 2 10-8 | 3 10-4 | 9 10-10 | 1 10-5 |
| Ascaris | 8 10-4 | 5 10-1 | 6 10-3 | 1 | 2 10-5 | 9 10-4 |
D.3 Risici ved ophold i haven
Tabel D.9 Scenarie 1: Udlægning af materiale opbevaret i 0 måneder. Risiko ved ophold i haven.
| Pinf|infektion pr. eksponering ifm ophold i haven i juni | PinfIinfektion ifm have-arbejde i juni | Pinf, havearbejde gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | 2 10-9 | 2 10-3 | 2 10-8 | 5 10-2 | 7 10-10 | 2 10-3 |
| EHEC | n.r. | 1 10-7 | n.r. | 3 10-6 | n.r. | 5 10-9 |
| Rotavirus | 4 10-2 | 9 10-1 | 5 10-1 | 1 | 3 10-2 | 2 10-1 |
| Hepatitis A | 1 10-4 | 3 10-1 | 2 10-3 | 1 | 1 10-6 | 7 10-4 |
| Giardia intestinalis | 5 10-5 | 7 10-1 | 8 10-4 | 1 | 5 10-5 | 1 10-1 |
| Cryptosporidium parvum | 4 10-3 | 1 | 6 10-2 | 1 | 1 10-3 | 3 10-2 |
| Ascaris | 4 10-1 | 1 | 1 | 1 | 2 10-3 | 3 10-3 |
Tabel D.10 Scenarie 2: Udlægning af materiale opbevaret i 6 måneder. Risiko ved ophold i haven.
| Pinf|infektion pr. eksponering ifm ophold i haven i juni | PinfIinfektion ifm have-arbejde i juni | Pinf, ophold i haven gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | 1 10-15 | 1 10-7 | 2 10-14 | 2 10-6 | 6 10-16 | 4 10-8 |
| EHEC | n.r. | 2 10-15 | n.r. | 2 10-14 | n.r. | 2 10-17 |
| Rotavirus | 3 10-5 | 8 10-1 | 5 10-4 | 1 | 4 10-5 | 1 10-1 |
| Hepatitis A | 6 10-8 | 1 10-3 | 8 10-7 | 2 10-2 | 4 10-10 | 9 10-6 |
| Giardia | 1 10-11 | 5 10-2 | 2 10-10 | 5 10-1 | 1 10-11 | 4 10-2 |
| Cryptosporidium | 9 10-6 | 4 10-2 | 2 10-4 | 5 10-1 | 3 10-6 | 1 10-2 |
| Ascaris | 1 10-1 | 1 | 9 10-1 | 1 | 2 10-3 | 3 10-3 |
Tabel D.11 Scenarie 3: Udlægning af materiale opbevaret i 12 måneder. Risiko ved ophold i haven.
| Pinf|infektion pr. eksponering ifm ophold i haven i juni | PinfIinfektion ifm have-arbejde i juni | Pinf, ophold i haven gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | n.r. | 2 10-12 | n.r. | 2 10-11 | n.r. | 6 10-13 |
| EHEC | n.r. | n.r. | n.r. | n.r. | n.r. | n.r. |
| Rotavirus | 3 10-8 | 2 10-1 | 5 10-7 | 1 | 3 10-8 | 9 10-2 |
| Hepatitis A | 2 10-11 | 6 10-6 | 4 10-10 | 1 10-4 | 2 10-13 | 5 10-8 |
| Giardia | n.r. | 4 10-6 | n.r. | 5 10-5 | n.r. | 3 10-6 |
| Cryptosporidium | 2 10-8 | 3 10-4 | 3 10-7 | 5 10-3 | 7 10-9 | 1 10-4 |
| Ascaris | 6 10-3 | 1 | 8 10-2 | 1 | 2 10-4 | 3 10-3 |
Tabel D.12 Scenarie 4: Indarbejdning af materiale opbevaret i 6 måneder. Risiko ved ophold i haven.
| Pinf|infektion pr. eksponering ifm ophold i haven i juni | PinfIinfektion ifm have-arbejde i juni | Pinf, ophold i haven gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | 2 10-16 | 1 10-8 | 3 10-15 | 2 10-7 | 5 10-17 | 5 10-9 |
| EHEC | n.r. | n.r. | n.r. | n.r. | n.r. | n.r. |
| Rotavirus | 4 10-6 | 6 10-1 | 6 10-5 | 1 | 4 10-6 | 1 10-1 |
| Hepatitis A | 6 10-9 | 2 10-4 | 1 10-7 | 3 10-3 | 5 10-11 | 1 10-6 |
| Giardia | 2 10-12 | 9 10-3 | 3 10-11 | 1 10-1 | 2 10-12 | 9 10-3 |
| Cryptosporidium | 1 10-6 | 5 10-3 | 2 10-5 | 8 10-2 | 4 10-7 | 2 10-3 |
| Ascaris | 1 10-2 | 9 10-1 | 2 10-1 | 1 | 5 10-4 | 3 10-3 |
Tabel D.13 Scenarie 5: Indarbejdning af materiale opbevaret i 12 måneder. Risiko ved ophold i haven.
| Pinf|infektion pr. eksponering ifm ophold i haven i juni | PinfIinfektion ifm ophold i haven i juni | Pinf, ophold i haven gennem et år | ||||
| typisk | worst case | typisk | worst case | typisk | worst case | |
| Salmonella | n.r. | 2 10-13 | n.r. | 2 10-12 | n.r. | 7 10-14 |
| EHEC | n.r. | n.r. | n.r. | n.r. | n.r. | n.r. |
| Rotavirus | 3 10-9 | 3 10-2 | 6 10-8 | 5 10-1 | 4 10-9 | 5 10-2 |
| Hepatitis A | 3 10-12 | 7 10-7 | 4 10-11 | 1 10-5 | 2 10-14 | 5 10-9 |
| Giardia intestinalis | n.r. | 2 10-6 | n.r. | 7 10-5 | n.r. | 5 10-6 |
| Cryptosporidium parvum | 2 10-9 | 4 10-5 | 4 10-8 | 8 10-4 | 9 10-10 | 2 10-5 |
| Ascaris | 7 10-4 | 4 10-1 | 1 10-2 | 1 | 2 10-5 | 2 10-3 |
Version 1.0 Juli 2005 • © Miljøstyrelsen.