|
Miljøprojekt nr. 1025, 2005 Undersøgelse af reaktiviteten af reducerende stoffer i nogle danske sedimenter – et pilotstudieIndholdsfortegnelse3 Undersøgelser af reaktiviteten af sedimenter 4 Resultater af laboratorieundersøgelser 5 Samlet vurdering af reaktivitets- forsøgene ForordUnder naturlige forhold vil det nedsivende vand kunne bringe oxiderende forbindelser som eksempelvis opløst ilt, i kontakt med de reducerende forbindelser , der findes indlejret i en lang række sedimenter. Herved vil ilten blive reduceret og samtidig vil en tilsvarende del af de reducerende forbindelser blive oxideret og dermed opbrugt. I områder med vandindvinding og forholdsvis hurtig vandbevægelse vil reaktionsprocesser og -mønster mellem oxiderende og reducerende forbindelser kunne ændres sammenlignet med under naturlige forhold, dersom kontakttiden mellem det nedsivende vand og sedimentet herved bliver kortere. Det betyder samtidig at den aktive pulje af hurtigt reagerende reducerende forbindelser vil være mindre end den totale pulje af reducerende forbindelser i områder med naturlig grundvandsdannelse. Den aktive (også kaldet den aktuelle) pulje af reducerende forbindelser beregnes ofte ved forskellen mellem indholdet af reducerende forbindelser henholdsvis i den reducerede zone og den oxiderede zone for samme sedimentype. Denne beregning giver dermed en indikation for hvor stor den tilgængelige mængde af reducerende forbindelser er i den pågældende sedimenttype samt hvorledes fordelingen af de reducerende forbindelser fordeler sig på lokaliteten. Reduktionskapacitet giver imidlertid ikke indblik i reaktiviteten af de reducerende forbindelser . Formålet med nærværende undersøgelse har derfor været at opnå et indledende kendskab til såvel reaktiviteten af reducerende forbindelser i forskellige sedimenter som procesforløbet ved tilførsel af et oxiderende stof i form af ilt. Desuden har det været hensigten at optimere analysemetoden med henblik på fremtidige laboratorieundersøgelser. Projektet er gennemført med midler fra Miljøstyrelsen. Dertil kommer at Nordjyllands Amt, Ringkøbing Amt, Roskilde Amt, Vejle Amt og Århus Amt venligst har stillet sedimentprøver samt analyseresultater og geologiske oplysninger til rådighed for projektet. En tak til amterne for deres bidrag til projektet. Sammenfatning og konklusionerFormålet med nærværende undersøgelse har været at opnå et indledende kendskab til reaktiviteten af forskellige reducerende forbindelser i sedimenter og procesforløbet ved tilførsel af et oxiderende stof i form af ilt. Herunder at optimere analysemetoden med henblik på fremtidige laboratorieundersøgelser. Indledende forsøg viste at det var hensigtsmæssigt at begrænse forbEHandlingen af de anvendte sedimentprøver til et minimum for dermed i videst mulig omfang at bevare sedimenternes oprindelige mikrobielle og mineralogiske egenskaber. Efter nogle indledende forsøg blev det besluttet at gennemføre reaktivitetsforsøgene med naturfugtige sedimentprøver, der efter sigtning gennem en 2 mm sigte blev blandet med demineraliseret vand i forholdet 1:4. Ved beregning af sedimentets vægt blev der taget hensyn til det naturlige vandindhold og vægten af sedimentet er beregnet på baggrund af ovntør (105 °C) vægt. Opslæmninger af sediment og vand blev tilført ilt under omrøring i 1 liters reaktionkar. Det tilførte ilt blev efter vandmætning i en vaskeflaske tilført opslæmningen gennem et gasfilterfordelingsrør for derved at sikre en god kontakt mellem opslæmning og ilt. Reaktionskarret var under forsøgene dækket med aluminiumsfolie for at reducere omfanget af fotokemiske processer. Forsøgene blev gennemført ved stuetemperatur (ca. 25 °C) og strakte sig typisk over 175 til 400 timer. Samtidig med tilførslen af ilt blev pH-værdien og redoxpotentialet målt i opslæmningen og desuden blev der i nogle af reaktivitetsforsøgene løbende udtaget delprøver, der efter centrifugering, blev anvendt til analyse af sulfat i væskefasen. Reaktivitetsundersøgelserne viste forholdsvis stabile pH- og redoxforhold i opslæmninger med iltede sedimentprøver hvor indholdet af reducerende forbindelser var brugt op allerede under de naturgivne forhold. I opslæmninger med reducerede sedimentprøver skete der typisk en stigning i pH-værdien ved tilførsel af ilt, antagelig som følge af mikrobiel omsætning af organisk stof og en heraf følgende alkalinitetsfrigørelse. Stigningen i pH-værdien forekom typisk indenfor de første 48 timer af forsøgsperioden og kunne følges over en periode, der ikke kunne afgrænses på grund af en samtidig syredannelse i forbindelse med oxidation af pyrit. Oxidationen af pyrit og den samtidige udviklingen i pH-værdien i opslæmningen afhænger i høj grad af sedimenternes naturlige bufferkapacitet og evne til neutralisere den dannede syre. I sedimenter med ringe bufferkapacitet resulterede syredannelsen som følge af oxidationen af pyrit således i markant faldende pH-værdier. For en enkelt prøve var faldet i pH fra omkring 7 til omkring 4 efter tilførsel af ilt over 195 timer. På baggrund af de målte parametre har det ikke været muligt at afgrænse forløbet af de enkelte delprocesser bestemt ved typen af reducerende stof. Dog tyder de foreliggende resultater på, at der sker en alkalinitetsfrigivelsen i forbindelse med omsætningen af organisk stof umiddelbart efter tilførsel af ilt. Dernæst følger resultatet af syreproduktionen i forbindelse med iltningen af pyrit. Iltningen af bl.a. reducerede jern- og mangan-former kan ikke identificeres på baggrund af de her gennemførte forsøg. Ved fortsatte undersøgelser kan det anbefales at følge udviklingen i flere end de her analyserede analyseparametre under tilførslen af ilt til opslæmningen. Det vil være værdifuldt at supplere målingerne af pH og redoxpotentiale med analyser af bl.a. alkalinitet, opløst organisk kulstof, opløst kvælstof, sulfat, ferrojern og evntuelt også udvalgte tungmetaller. Desuden kan det anbefales at reaktivitetsforsøgene gennemføres over længere tid end her anvendt for pilotforsøget, hvorved det også bliver muligt at få indblik i iltningen af de forskellige puljer af reducerende forbindelser . Summary and conclusionsThe present pilot-study was conducted to assess the reactivity of reduced compound in sediments during oxidation caused by oxygen. A suitable lab set up was developed and tested on sediment samples with different inherited amounts of reduced compounds collected from the oxidized and reduced sediment environments at 7 locations within Denmark. During the supply of oxygen to a suspension of sediment (< 2 mm) and deionized water with a sediment:water ratio of 1:4 the development in pH and redox potention were monitored in the suspension over time. The reaction time varied from 175 hours to approximately 400 hours. The pH and redox conditions showed up to be fairly constant in suspension prepared with oxidized sediments. In suspensions prepared with reduced sediments the introduction of oxygen lead to an increase in the pH within the first 24-48 hours, most likely due to mineralization of bioavailable organic matter in the sediments. After some time the increase in pH vas followed by a drop in pH due to the oxidation of pyrite. In a suspension made of low buffered sediment the pH changed from 7 to about 4 after 195 hours supply of oxygen. On the basis of the information obtained during the present study a separation of the contributions from the different reduced compounds to the development of the quality of the suspension has not been possible. In future studies on oxidation of reduced compounds in sediments it may be valuable to increase the number of parameters to be monitored and include e.g., measurements on alkalinity, dissolved organic carbon, dissolved nitrogen, sulphate, ferrous iron and heavy metals in the solute phase of the suspension. It is also recommended to continue the experiments over longer time than used in the present study. A longer reaction time may bring important information on the oxidation of pools of reduced compounds characterised by different reactivity. 1 IndledningNår vandet siver ned gennem jordlagene vil det i varierende grad reagere med de heri forekommende forskellige mineraler. Reaktionerne vil bl.a. være bestemt ved typen af mineraler samt den hastighed hvormed vandet siver ned gennem jordlagene. De reducerende forbindelser i sedimenterne vil således kunne reagerer med opløste oxiderende forbindelser i det nedsivende vand, som eksempelvis ilt (O2) og nitrat (NO3-), og dermed påvirke koncentrationen af disse i det nedsivende vand. I områder med naturlig grundvandsdannelse vil reduktionen af oxiderende forbindelser foregå indenfor en forholdsvis svæver zone hvis sedimenterne indEHolder store koncentrationer af reducerende forbindelser , mens reduktionen i sedimenter med lavere indhold af reducerende forbindelser vil foregår over en bredere zone og endelig vil reduktionen i sedimenter uden indhold af reducerende forbindelser være yderst ringe og være knyttet til mikromiljøer med mikrobiel aktivitet (Ernstsen et al., 2000). Ved en forceret grundvandsdannelse, som eksempelvis i indvindingsområder, vil oxidationen af reducerende forbindelser selvfølgelig også være knyttet til såvel indholdet som reaktiviteten af reducerende forbindelser . Nogle reducerende forbindelser må således forventes at reagere hurtigere end andre hvorfor karakteren af processen/processerne må forventes at ændre sig over tid. Således må det forventes at de hurtigst reagerende forbindelser - de mest reaktive - vil dominere procesforløbet i begyndelsen hvorefter de mere langsomt reagende forbindelser - de mindre reaktive - gradvis vil komme til at spille en stadig mere dominerende rolle for udviklingen i grundvandets kemiske sammensætning. De reducerende forbindelser i sedimenterne kan bestå af varierende mængder af bl.a. organisk stof, reducerede jern- og manganforbindelser samt reducerede svovlforbindelser, herunder pyrit. Reaktiviteten af reducerende forbindelser i danske sedimenter er for indeværende kun undersøgt i begrænset omfang. Der findes således ikke nogen enkel metode til at undersøge tilgængeligheden og reaktiviteten af reducerende forbindelser i sedimenter. Tilgængeligheden beregnes derfor ofte ved forskellen mellem indholdet af reducerende forbindelser i de endnu reducerede sedimenter og indholdet af reducerende forbindelser i tilsvarende oxiderede sedimenter (Ernstsen et al., 2000). Denne teoretisk beregnede tilgængelighed giver imidlertid ingen fornemmelse af hvor hurtigt (hvor reaktivt) de forskellige reducerende forbindelser i sedimenterne er, ej heller i hvilke rækkefølge de forskellige reducerende forbindelser opbruges. Et øget kendskab til såvel tilgængelighed som reaktivitet er begge nøgleparametre når udviklingen i kvaliteten og sårbarheden af en given grundvandsressource skal vurderes. Formålet med nærværende pilotundersøgelse har været at skaffe et indledende kendskab til reaktiviteten af reducerende forbindelser i nogle typiske danske sedimenter under kontrollerede laboratorieundersøgelser med opslæmninger af jord og vand og under tilførsel af atmosfærisk luft eller ilt. Disse resultater påregnes anvendt ved senere og mere omfattende reaktivitetsstudier af danske sedimenter. De økonomiske rammer for projektet har betydet at de anvendte prøver er indsamlet og stillet til rådighed af Nordjyllands Amt, Roskilde Amt, Ringkøbing Amt, Vejle Amt, Århus Amt samt GEUS der ligeledes har bidraget med oplysninger om sedimenternes indhold af reducerende forbindelser , bl.a. organisk stof, pyrit og ferrojern. 2 Redoxforhold i sedimenterDer er en begrebsmæssig en analogi i mellem reduktion-oxidation reaktioner (redox) og syre-base reaktioner. På lignende måde som syre og baser optræder som protondonorer og protonacceptorer, er reduktanter og oxidanter defineret som henholdsvis elektrondonorer og elektronacceptorer (Bjerrum, 1932; Stumm og Morgan, 1996). Reduktanters og oxidanters evne til at reducere eller oxidere beskrives udfra redoxpotentialet EH. Termodynamisk kan et redoxpotentiale defineres udfra nedenstående ligning, hvor Ox betegner oxidanten og Red den korresponderende reducerede forbindelse: Ox + ne- →Red med n som antallet af ombyttelige elektroner. Denne ligning kaldes en halvcelle reaktion og skrives for nemheds skyld med det oxiderede stof på venstre side i reaktionsligningen. Da der ikke kan forekomme frie elektroner, kan ovenstående halvcelle reaktion kun forløbe, hvis en anden forbindelse stiller elektroner til rådighed for reaktionen, det vil sige at et reduceret stof skal være tilstede. En redoxreaktion vil der derfor altid involvere et oxiderende stof og et reducerende stof. Måles redoxpotentialet til en positiv værdi er der et overskud af oxiderende forbindelser, mens negative værdier betyder at der er overskud af reducerende forbindelser, jf. figur 2.1.
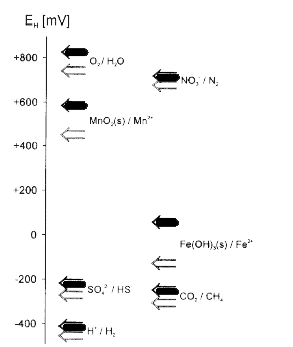
Figur 2.1 Typisk forekommende redoxpotentialer [mV] i naturlige systemer med neutrale pH-værdier. Positive redoxpotentialer (op til omkring +800 mV ) tyder på tilstedeværelse af stærke oxidanter, mens negative værdier tyder på tilstedeværelse af stærke reduktanter (modificeret efter Sigg, 2000). Redoxpotentialet i naturlige systemer er begrænset i den negative retning af reduktionen af vand til brint (H2O →H2 (g)) og i den positive retning af oxidationen af vand til ilt (H2O →O2 (g)). Ved neutrale til let basiske forhold befinder redoxpotentialet sig derfor i området ca. –400 mV til ca. +800 mV (Stumm og Morgan, 1996). Som det fremgår af figur 2.2, befinder de hyppigst naturlige forekommende redoxpar sig spredt ud over hele området, idet ilt (O2), nitrat (NO3-) og manganoxid (MnO2) er oxiderende forbindelser, mens svovl (S), brint (H2) og methan (CH4) er reducerede forbindelser. Figuren viser også for de viste redoxpar, at redoxpotentialet afhænger af pH-forholdene, idet redoxpotentialet generelt er højere ved en pH-værdi på 7 end ved en pH-værdi på 8.
Figur 2.2. Redoxpotentialer for nogle af de vigtigste redoxpar i vand ved pH 7 (mørke pile) og pH 8 (lyse pile). Redoxpotentialerne er beregnet ved aktiviteterne {Red} = 1 og {Ox} = 1 samt formodede aktiviteter af Mn2+ og Fe2+ ved henholdsvis {Mn2+} = 10-6 M og {Fe2+} = 10-6 M (efter Sigg, 2000). 3 Undersøgelser af reaktiviteten af sedimenterReaktiviteten af reducerende forbindelser i sedimenter er kun blevet undersøgt i et begrænset omfang. Hartog et al. (2002) målte således reaktiviteten af sediment fra et grundvandsmagasin i Holland ved inkubation med O2 og efterfølgende målinger af CO2 udvikling. En anden undersøgelse er udført af Barcelona og Holm (1991) som beskrev reaktiviten af sedimenter ved nedbrydningskinetikken for hydrogenperoxid (H2O2). Resultaterne fra dette forsøg viste endvidere, at nedbrydningen af H2O2 sker væsentligt hurtigere under tilstedeværelse af mikroorganismer end ved ren kemisk nedbrydning af H2O2. De reducerende forbindelser i sedimenter består hovedsageligt af organisk materiale, opløst ferrojern (FeII), samt i jern- og svovlholdige mineraler som pyrit (FeS2), siderit (FeCO3) og jernholdige lermineraler. Reaktiviteten af disse forbindelser variere betragteligt. Således for organisk stof hvor typen er vigtig, og hvor eksempelvis humus med meget lignin eller med let tilgængelige aminosyrer vil reagere i meget forskellig grad med opløst oxygen. Det samme gør sig gældende for mineralerne, idet amorfe forbindelser med ringe krystalstruktur normalt reagerer lettere end velkrystallinske forbindelser. Samtidig er reaktiviteten af de reducerende forbindelser meget betinget af tilgængelig, idet strukturelt bundne former antages at gennemløbe en langsommere oxidation end frie former af ferrojern. 3.1 Sedimentprøver anvendt til reaktivitetsforsøgeneTil brug for reaktivitetsforsøgene er inddraget sedimentprøver fra forskellige lokaliteter rundt om i Danmark. Oversigten vist i tabel 3.1. viser hvor de anvendte sedimentprøver stammer fra, type af sediment samt redoxforhold. I tabel 3.2 karakteriseres sedimentprøverne desuden ved indhold af reducerende forbindelser så som, organisk stof (TOC), pyrit (FeS2) og ferrojern (Fe2+) samt det totale kulstofindhold (TC), det totale svovlindhold (TS) og det totale indhold af jern (Fe-total) i fraktionen < 2 mm. Tabel 3.1. Oversigt over de i undersøgelsen anvendte sedimentprøver med oplysninger om amt, DGU arkiv nr., dybde, redoxforhold samt geologiske forhold.
Tabel 3.2. Oversigt over indhold af reducerende forbindelser (TOC, pyrit og Fe(II)) samt TC, TS og Fe-total i sedimenter anvendt ved forsøgene. Tomme felter viser at den pågældende analyse ikke er gennemført.
3.2 ForsøgsopstillingReaktivitetsforsøgene er gennemført i opstillinger som vist i figur 3.1 og 3.2. Reaktionen foregår i et 1 liter rundbundet reaktionskar med 5 udgange. I centeret af reaktionskaret er placeret en propel, der ved hjælp af en omrøre (Heidolph RZR 2020 eller Heidolph RZR 1) sikre en ensartet oprøring af jord-vand opslæmningen ved en hastighed på 400 rpm. Forsøgene er gennemført ved stuetemperatur (ca. 25 °C) og under konstant tilførsel af atmosfærisk luft eller ilt (99,999 %), der efter vandmætning i en vaskeflaske med gasfordelingsrør (porøsitet 2) er ført frem til reaktionskarret gennem et gasfilterfordelingsrør (porøsitet 0) for derved at sikre en god kontakt mellem opslæmningen og luft/ilt.
Figur 3.1 Reaktivitetsforsøg med 4 opstillinger. Reaktionskarrene er dækket af aluminiumsfolie og omrøring sker under tilførsel af atmosfærisk luft eller ilt. Under forsøget blev kolben dækket med aluminiumsfolie for derved at reducere omfanget af photokemiske processer. Den overskydende luft/gas blev ledt bort fra reaktionskaret gennem en kanyle placeret i en af de 5 udgange. Redoxpotentialet (EH) i opslæmningen blev målt ved brug af en redox-elektrode (Metrohm 6.0418.120) og pH i opslæmningen blev målt ved brug af en kombineret pH-mikroelektrode (Metrohm 6.0234.110). Målingerne blev foretaget på et pH instrument af mærket WTW pH196. Delprøver fra opslæmningen til brug for måling af sulfat blev løbende udtaget med en engangssprøjte påmonteret en 10 cm lang silikoneslange. Forud for målingen blev delprøven overført til et 40 ml centrifugerør og centrifugeret ved 10000 rpm i 15 minutter hvorefter supernantanten blev opsamlet og opbevaret på køl indtil analyse. Sulfat blev bestemt ved ionkromatografi (Dionex LC20). Reaktionsforsøgene er gennemført med et sediment-væske forhold på 1:4 svarende til 125 g sediment (baseret på tør, 105 °C, jord) i 500 ml demineraliseret vand (MilliQ gradient, Millipore).
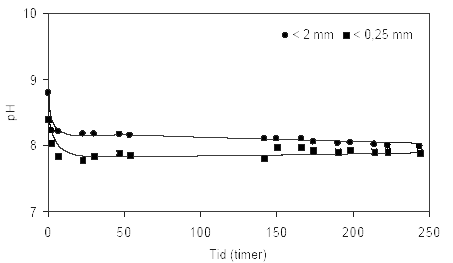
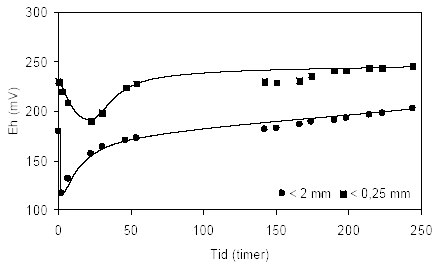
Figur 3.2. Forsøgsopstilling med opslæmning af jord og demineraliseret vand (milliQ gradient, Millipore). Opslæmning på billedet er tilberedt med iltet sediment udtaget fra boringen DGU arkivnr. 104.2404 i dybden 8,85–9,35 m ved Uhre, Ringkøbing Amt. 4 Resultater af laboratorieundersøgelser4.1 Resultater fra reaktivitetsforsøgeneDersom langt den overvejende del af de reducerende forbindelser forventes at forekomme i de finere fraktioner af sedimenterne blev der gennemført indledende forsøg for at belyse hvilke størrelsesfraktioner det ville være hensigtsmæssigt at anvende ved reaktivitetsforsøgene. For at optimere prøveforberedelsen yderligere blev der ligeledes gennemført forsøg med naturfugtige og ovntørre sedimentprøver med en kornstørrelsessammensætning < 2mm. Disse forsøg skulle hjælpe til med at anskueliggøre mulige effekter på sedimenternes evne til at reagere som følge af tørring. 4.1.1 Reaktivitetsforsøg med forskellig kornstørrelserBetydningen af det anvendte sediments kornstørrelsessammensætning blev undersøgt for en reduceret sandprøve fra 42,5 meters dybde udtaget ved Præstbro, Nordjyllands Amt. Den anvendte prøve blev først tørret ved 105 °C, dernæst sigtet gennem en 2 mm sigte. En del af den sigtede prøve blev yderligere nedknust til < 0,250 mm. Reaktiviteten i en opslæmning af disse to prøver ved tilførsel af atmosfærisk luft er beskrevet ved pH i figur 4.1 og ved redoxpotentiale i figur 4.2. Udviklingen i pH forløbet over tid er relativ ens for de to prøver. På figur 4.1 ses det, at pH-værdien falder omkring en enhed indenfor de første 2 timer for sedimentprøven < 2mm, hvorefter værdien fremstår konstant frem til forsøgets afslutning efter 248 timer. For prøven < 0,250 mm ses ligeledes et hurtigt fald i den målte pH-værdi indenfor de første 6 timer af forsøget, hvorefter værdien stabiliseres på et lidt lavere niveau end for prøven < 2mm gennem forsøgets første 148 timer, hvorefter pH-værdien tiltager svagt til et niveau stort set svarende til det der måltes efter 244 timer i opslæmningen med materiale < 2mm. Ændringerne i redoxpotentialet for de to prøver med forskellig kornstørrelse efter tilførsel af atmosfærisk luft fremgår af figur 4.2. Heraf fremgår det at redoxpotentialet faldt markant fra 180 mV til 117 mV over de første 2 timer i opslemningen med fraktionen < 2mm, hvorefter redoxpotentialet steg forholdsvis hurtigt gennem forsøgets næste 50 timer til 170 mV, hvorefter stigningen fortsatte - om end noget langsommere - til 204 mV efter 244 timer. Kurveforløbet for opslæmningen med fraktionen < 0,250 mm er tilnærmelsesvis det samme som for opslæmningen med fraktionen < 2 mm. Her forekommer ligeledes et markant fald i begyndelse af forsøget, fra 230 mV ved forsøget start til 190 mV efter 24 timer. Herefter stiger redoxpotentialet atter forholdsvis hurtigt over de næste 24 timer til 228 mV, hvorefter en svagere stigning sætter ind og redoxpotentialet når op på 246 mV efter 244 timer, og således omkring 40 mV højere end for opslæmningen med fraktionen < 2mm. Forskellen i det målte redoxpotentiale for de to opslæmninger forbliver stort set uændret gennem hele måleperioden, idet redoxpotentialet højere og opslæmningen generelt mere iltet for fraktionen < 250 μm end < 2mm.
Figur 4.1. Udviklingen i pH-værdien i opslæmninger fremstillet med kornstørrelser henholdsvis < 2 mm og < 0,250 mm udtaget fra en kalkholdig sandprøve udtaget fra 42,5 meters dybde ved Præstbro, Nordjyllands Amt (DGU arkivnr. 18.310). Den oprindelige sedimentprøve blev tørret ved 105 °C forud for opdeling i kornstørrelser.
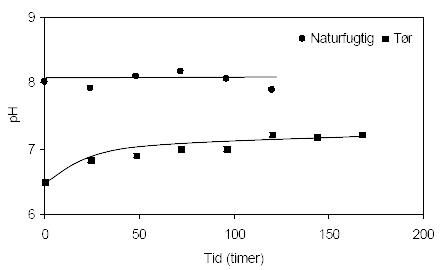
Figur 4.2. Udviklingen i redoxpotentialet (EH) i opslæmninger fremstillet med kornstørrelser henholdsvis < 2 mm og < 0,250 mm. Prøverne stammer fra en kalkholdig sandprøve udtaget i 42,5 meters dybde ved Præstbro, Norjyllands Amt (DGU arkivnr. 18.310). Den oprindelige sedimentprøve blev tørret ved 105 °C forud for opdeling i fraktioner. 4.1.1.1 SammenfatningPå baggrund af resultaterne fra disse forsøg blev det besluttet at fortsætte reaktivitetsundersøgelsen med opslæmninger tilberedt af partikler < 2mm, idet nedknusning og findeling specielt synes at påvirke redoxpotentialet og dermed iltforbruget i opslæmningen. 4.1.2 Reaktivitetsforsøg med naturfugtige og tørrede sedimenterTo forskellige forbEHandlinger af sedimentprøver blev undersøgt. Naturfugtige prøver blev sigtet gennem en 2 mm sigte og herefter anvendt til forsøg og ovntørre sedimentprøver blev tørret ved 105 °C til konstant vægt og efterfølgende sigtet gennem en 2 mm sigte. Sidstnævnte prøvetype betegnes herefter som tørre sedimentprøver. De anvendte opslæmning blev som allerede nævnt fremstillet med en sedimentmængde svarende til 125 g tørret sediment i 500 ml demineraliseret vand (milliQ gradient, Millipore). Derfor har det været nødvendigt at justere mængden af naturfugtigt prøve på baggrund det naturlige vandindhold bestemt ved 105 °C hvorved samtlige forsøg er gennemført med et jord-væskeforhold på 1:4. Under tilførslen af ilt blev der gennemført samtidige målinger af pH og EH. 4.1.2.1 Reaktivitetsforsøg med sedimentprøve udtaget i 3 meters dybde ved Davling, Vejle AmtUdviklingen i pH-værdien i opslæmniger forberedt med henholdsvis naturfugtig og tør prøve (< 2mm) fremgår af figur 4.3. I opslæmningen med naturfugtig prøve var pH-værdien stort set konstant, omkring 8, gennem hele forsøgsperioden på 120 timer. I opslæmningen med den tørre prøve blev pH-værdien indledningsvis målt til 6,5, hvorefter værdien steg langsomt til 7,2 efter 120 timer hvorefter pH-værdien forblev stort set uændret til forsøgets afslutning efter 168 timer. Den målte pH-værdi i opslæmningen med tørret prøve var således gennem hele forsøgsperioden tæt ved 1-1½ enhed lavere end de værdier der måltes i opslæmningen med naturfugtig jord.
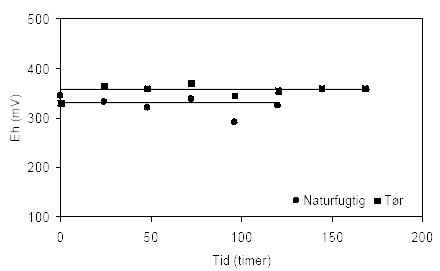
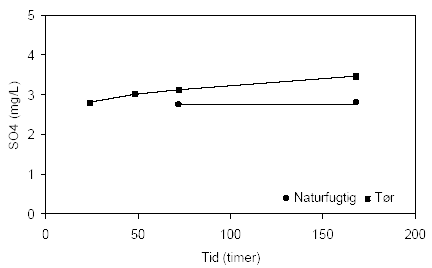
Figur 4.3. Udviklingen i pH-værdien i opslæmninger med henholdsvis naturfugtig og tørret prøve, begge er < 2 mm. Prøverne stammer fra en iltet, kalkfri sandprøve udtaget i 3 meters dybde ved Davding, Vejle Amt (DGU arkivnr. 97.952). I figur 4.4 er udviklingen i redoxpotentialet vist for samme prøve fra Davding. For begge opslæmningen er redoxpotentialet ret stabilt gennem forsøgsperioden (120 og 168 timer) hvor det ligger på omkring 330 mV og 360 mV for henholdsvis den naturfugtige og den tørre prøver. Indholdet af sulfat (SO42-) i begge opslæmningen ligger forholdsvis konstant og tæt på 3 mg sulfat per liter gennem forsøgsperioden på 168 timer, figur 4.5.
Figur 4.4. Udviklingen i redoxpotentialet (EH) i opslæmninger med henholdsvis naturfugtig og tørret sedimentprøve, begge < 2 mm. Prøverne stammer fra en iltet, kalkfri sandprøve udtaget i 3 meters dybde ved Davding, Vejle Amt (DGU arkivnr. 97.952).
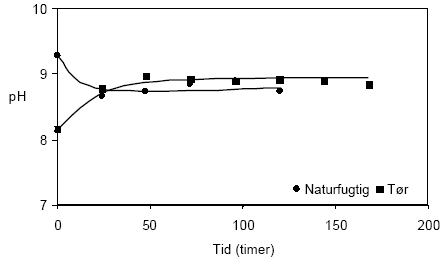
Figur 4.5. Udviklingen i koncentrationen af sulfat (SO42-) under tilførsel af ilt til opslæmninger med henholdsvis naturfugtig og tørret prøve, begge < 2 mm. Prøverne stammer fra en iltet, kalkfri sandprøve udtaget i 3 meters dybde ved Davding, Vejle Amt (DGU arkivnr. 97.952). 4.1.2.2 Reaktivitetsforsøg med sedimentprøve udtaget i 49 meters dybde ved Davling, Vejle AmtI figur 4.6 er udviklingen i pH-værdien vist for opslæmninger med henholdsvis naturfugtig prøve og tørret prøver stammende fra en reduceret, kalkholdig lerprøve fra 49 meters dybde ved Davding, Vejle Amt. For opslæmningen med den naturfugtige prøve aftager pH-værdien indenfor de første 24 timer fra 9,3 til 8,7 hvorefter den forbliver stort set uændret gennem frem til forsøgets afslutning efter 120 timer. I opslæmningen med tørret sedimentprøve stiger pH-værdien fra 8,2 ved forsøgets begyndelse til 8,8 efter 24 timer hvorefter pH-værdien forbliver stort set uændret frem til forsøgets afslutning efter 168 timer.
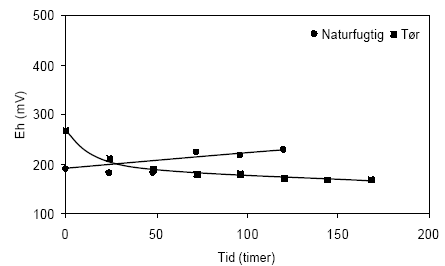
Figur 4.6. Udviklingen i pH-værdien under tilførsel af ilt til opslæmninger med naturfugtig og tørret prøve, begge < 2 mm. Prøverne stammer fra en reduceret, kalkholdig lerprøve udtaget i 49 meter ved Davding, Vejle Amt (DGU arkivnr. 97.952). Den samtidige udvikling i redoxpotentialerne i opslæmninger med naturfugtig og tørret sedimentprøve fremgår af figur 4.7. Det ses på figuren, at redoxpotentialet i opslæmningen med den naturfugtige prøve stiger fra 190 mV til 230 mV gennem forsøget, hvilket tyder på at tilførslen overstiger forbruget af ilt, hvorved gradvis mere iltrige forhold bygges op. Udviklingen i redoxpotentialet antyder ligeledes at forbruget af ilt er forholdsvis stort, dersom stigningen i potentialet sker forholdsvis langsomt. I opslæmningen med den tørrede prøve sker der et fald i redoxpotentialet fra 270 mV til 180 mV indenfor de første 48 timer hvorfor forbruget af ilt her synes at være større end den tilførte mængde, med stadig mere reducerende forhold op i opslæmningen til følge. Ved afslutningen af forsøget, efter 168 timer, måltes et redoxpotentialet på 171 mV.
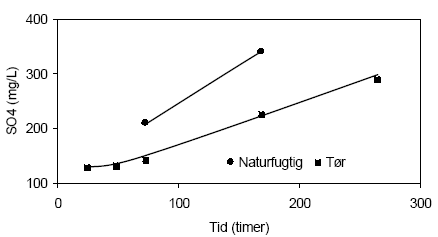
Figur 4.7. Udviklingen i redoxpotentialet (EH) under tilførsel af ilt til opslæmninger med henholdsvis naturfugtig og tørret sedimentprøve, begge < 2 mm. Prøverne stammer fra en reduceret, kalkholdig lerprøve udtaget i 49 meter ved Davding, Vejle Amt (DGU arkivnr. 97.952). Løbende målinger af sulfatindholdet i opslæmningerne i forbindelse med tilførslen af ilt fremgår af figur 4.8. I opslæmningen med den naturfugtige prøve stiger koncentrationen af sulfat fra 210 mg sulfat pr. liter målt efter 72 timer til 340 mg sulfat pr. liter målt efter 168 timer. I opslæmningen med den tørre prøve sker der ligeledes en stigning i indholdet af sulfat, fra 143 mg sulfat målt efter 72 timer til 291 mg sulfat målt efter 264 timer. I begge prøver må det antages at stigningen i indholdet af sulfat er knyttet til en iltning af prøvens oprindelige indhold af pyrit.
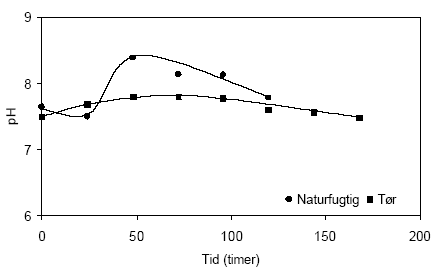
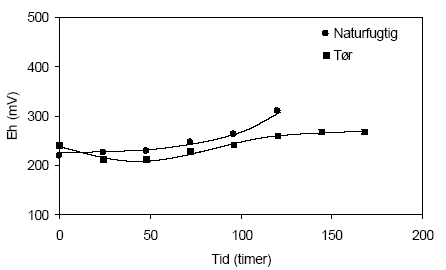
Figur 4.8. Udviklingen i koncentrationen af sulfat (SO42-) under tilførsel af ilt til opslæmninger med henholdsvis naturfugtig og tørret sedimentprøve, begge prøver er < 2 mm. prøverne stammer fra en reduceret, kalkholdig lerprøve udtaget i 49 meter ved Davding, Vejle Amt (DGU arkivnr. 97.952). 4.1.2.3 Reaktivitetsforsøg med sedimentprøve udtaget i 60 meters dybde ved Davling, Vejle AmtUdviklingen i pH-værdien målt i opslæmninger med henholdsvis naturfugtig og tørret sedimentprøve udtaget i 60 meters dybde ved Davling i Vejle Amt fremgår af figur 4.9. I begyndelsen af forsøget er de målte pH-værdier forholdsvis ens i de to opslæmninger, omkring 7,5. Den målte pH-værdi i opslemningen med tørret prøve forbliver stort set uændret gennem hele forsøget mens pH-værdien i opslæmningen med den naturfugtige prøve stiger markant efter de første 48 timer til 8,4, hvorefter pH-værdien atter aftager og når en værdi på 7,8 efter 120 timer. Stigningen i pH-værdien efter de første 48 timer af forsøget kan formodentligt forklares ved iltning af organisk materiale, der er forholdsvis højt i denne prøve med et indhold på 4,3 % C. Omsætningen af organisk stof træder tydeligst frem i forsøgets 24 til 48 timer hvorefter en del af den forøgede mængde alkalinitet antagelig skjules ved en samtidig dannelse af syre i forbindelse med iltning af pyrit. En mindre mikrobiologisk aktivitet i den tørrede prøve som følge af opvarmning til 105 °C er antagelig årsagen til at stigningen i pH-værdien her er langt mindre udtalt i denne opslemning end tilsvarende for opslæmningen med den naturfugtige prøve. Opslæmningen med den tørrede jord har et svagt højere redoxpotentiale (241 mV) end opslæmningen med den naturfugtige prøve (220 mV) ved begyndelsen af forsøget, figur 4.10. Herefter aftager redoxpotentialet for opslæmningen med den tørre jord gennem forsøgets første 48 timer til 214 mV hvorefter redoxpotentialet atter stiger, om end meget svag til 268 mV, ved forsøget afslutning efter 168 timer. Denne stigning tyder på at mængden af ilt der tilføres opslæmningen er lidt højere end den mængde der forbruges. I opslæmningen med den naturfugtige prøve hvor den mikrobielle aktivitet antages at være større forbruges den tilførte ilt og først ved forsøgets afslutning efter 125 timer begynder redoxpotentialet til stige og er her 311 mV.
Figur 4.9. Udviklingen i pH-værdien i opslæmninger fremstillet med henholdsvis naturfugtig og tørret sedimentprøve, begge med partikler < 2 mm. Prøverne stammer fra en reduceret prøve af glimmerler udtaget i 60 meter ved Davding, Vejle Amt (DGU arkivnr. 97.952).
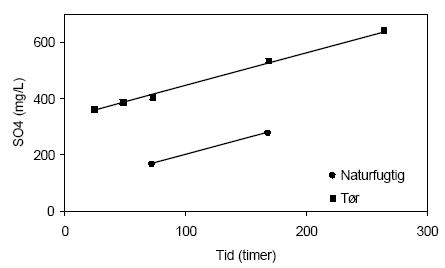
Figur 4.10. Udviklingen i redoxpotentialet (EH) i opslæmninger fremstillet med henholdsvis naturfugtig og tørret sedimentprøve, begge med partikler < 2 mm. Prøverne stammer fra en reduceret prøve af glimmerler udtaget i 60 meter ved Davding, Vejle Amt (DGU arkivnr. 97.952). Indholdet af sulfat i opslæmningerne steg markant, figur 4.11. For opslæmningen med den naturfugtige prøve steg koncentrationen fra 167 mg pr. liter målt efter 72 timer til 279 mg sulfat pr. liter efter 168 timer. I opslæmningen med den tørrede prøve hvor den tilførte ilt i mindre grad forbruges ved mikrobiel omsætning af organisk stof stiger koncentrationen af sulfat fra 362 mg pr. liter efter 24 timer til 643 mg sulfat pr. liter efter 264 timer.
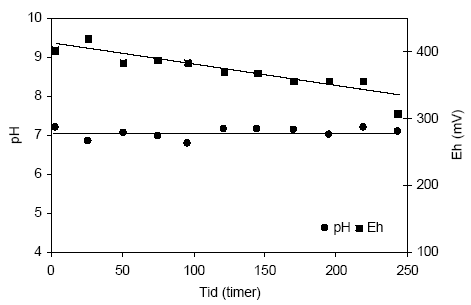
Figur 4.11. Udviklingen i koncentrationen af sulfat (SO42-) i opslæmninger fremstillet med henholdsvis naturfugtig og tørret sedimentprøve, begge med partikler < 2 mm. Prøverne stammer fra en reduceret prøve af glimmerler udtaget i 60 meter ved Davding, Vejle Amt (DGU arkivnr. 97.952). 4.1.2.4 SammenfatningPå baggrund af forsøgene med prøverne fra Davding hvor det viste sig at tørringen påvirkede prøvens naturlige egenskaber, ved bl.a. den mikrobielle aktivitet, blev det besluttet at gennemføre de følgende reaktivitetsforsøg med naturfugtige sedimentprøver sigtet gennem en 2 mm sigte. Sedimentprøver der forud for forsøgene blev opbevaret nedfrossen blev opbevaret i køleskab ved ca. 5 °C i en uge forud for analyse for at etablere prøvens oprinde mikrobielle egenskaber. 4.1.3 Reaktivitetsforsøg med sedimenter fra Ringkøbing Amt4.1.3.1 Reaktivitetsforsøg med sedimentprøve udtaget i 8,85-9,35 meter ved Uhre, Ringkøbing AmtUdviklingen i pH og redoxpotentiale i en opslæmning med naturfugtigt jord fra Uhre (DGU arkivnr. 104.2404) fremgår af figur 4.12. pH-værdien i opslæmningen er forholdsvis konstant, omkring 7,1 , gennem hele forsøgsperioden. Redoxpotentialet blev ved begyndelsen af forsøgets målt til 403 mV og faldt svagt gennem forsøget til 307 mV efter 243 timer. Forbruget af ilt i denne iltede sedimentprøve kan bl.a. skyldes et forbrug foranlediget af mikrobiel aktivitet og/eller iltning af jernforbindelser, der kun meget langsomt iltets under naturlige forhold.
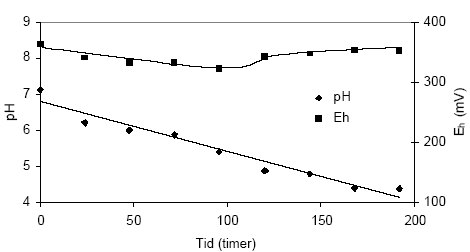
Figur 4.12. Udviklingen i pH og redoxpotentialet (EH) i en opslæmning fremstillet med naturfugtig sedimentprøve, < 2 mm. Prøven stammer fra en iltet, kalkfri sandprøve udtaget fra boringen DGU arkivnr. 104.2404 i dybden 8,85-9,35 meter ved Uhre, Ringkøbing Amt. 4.1.3.2 Reaktivitetsforsøg med sedimentprøve udtaget i 25,15-25,65 meter ved Uhre, Ringkøbing AmtUdviklingen i pH og redoxpotentialet under tilførsel af ilt til en opslæmning af naturfugtig, reduceret ler fra dybden 25,15-25,65 m ved Uhre (DGU arkivnr. 104.2404) fremgår af figur 4.13. Her ses pH-værdien i opslæmningen at falde markant gennem forsøgsperioden, fra 7.1 ved forsøgets start til 4,5 ved afslutningen af forsøget efter 195 timer. Redoxpotentialet i opslæmningen falder svagt gennem forsøgets første 96 timer til hvorefter redoxpotentialet atter stiger svagt til ca. 350 mV efter 195 timer.
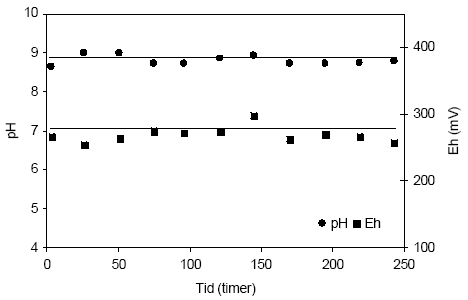
Figur 4.13. Udviklingen i pH og redoxpotentialet (EH) i en opslæmning fremstillet med naturfugtig sedimentprøve, < 2 mm. Prøven stammer fra reduceret ler udtaget fra boringen DGU arkivnr. 104.2404 i dybden 25,15-25,65 meter ved Uhre, Ringkøbing Amt. 4.1.3.3 Reaktivitetsforsøg med sedimentprøve udtaget i 13,2-13,7 meter ved Uhre, Ringkøbing AmtUdviklingen i pH og redoxpotentiale i opslæmningen af naturfugtig iltet sandprøve udtaget i dybden 13,2-13,7 m ved Uhre, Ringkøbing amt, (DGU arkivnr. 94.2757) fremgår af figur 4.14. Her ses pH-værdien at forblive konstant omkring 8,9 gennem hele forsøget. Redoxpotentialet varierer ligeledes kun lidt og ligger på omkring 270 mV. Som ventet betyder tilførselen af ilt meget lidt for såvel pH som redoxpotentiale for denne iltede sandprøve.
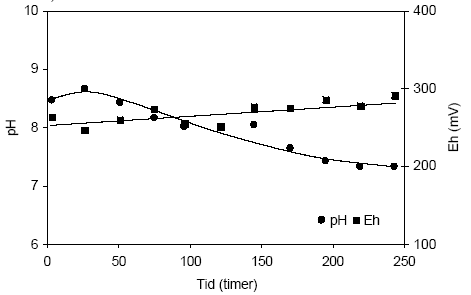
Figur 4.14. Udviklingen i pH og redoxpotentialet (EH) i en opslæmning med naturfugtig sedimentprøve, < 2 mm. Prøven stammer fra en iltet sandprøve udtaget fra boringen DGU arkivnr. 94.2757 i dybden 13,2-13,7 meter ved Uhre, Ringkøbing Amt. 4.1.3.4 Reaktivitetsforsøg med sedimentprøve udtaget i 8,45-8,70 meter ved Brande, Ringkøbing AmtUdviklingen i pH og redoxpotentialet i opslæmningen med en reduceret sandprøve udtaget i dybden 8,45 – 8,70 m ved Brande i Ringkøbing Amt (DGU105.1798) fremgår af figur 4.15. Det ses på figuren, at pH falder gennem forsøget, fra en værdi på 8,5 ved begyndelsen af forsøget til 7,3 ved afslutning af forsøget efter 243 timer. Samtidig stiger redoxpotentialet fra 264 mV ved begyndelsen af forsøget til 292 mV ved afslutningen af forsøget. De forholdsvis høje pH-værdier indledningsvis i forsøget tyder på at der dannes alkalinitet som følge at mikrobiel aktivitet og senere betyder iltningen af bl.a. pyrit at der samlet set sker et fald i pH-værdien. Udviklingen i redoxpotentialet mod stadig højere værdier tyder på at tilførslen af ilt overstiger forbruget til såvel mikrobielle processer som iltningen af reducerende forbindelser, hvilket også er i overensstemmelse med et forholdsvis lavt indhold af reducerende forbindelser i denne sedimentprøve. Således steg indholdet af sulfat i væsken fra opslæmningen fra 3,5 mg pr. liter ved begyndelsen af forsøget til 10 mg pr. liter ved slutningen af forsøget (data ikke vist).
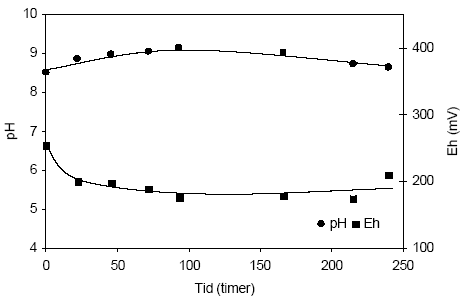
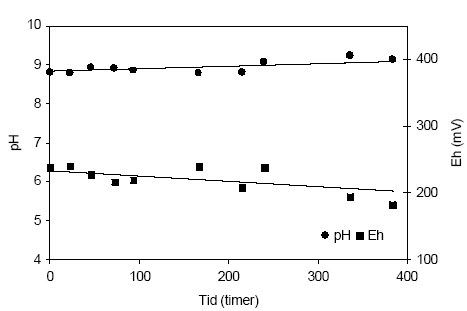
Figur 4.15. Udviklingen i pH og redoxpotentialet (EH) i en opslæmning fremstillet med naturfugtig sedimentprøve, < 2 mm. Prøven stammer fra iltet sandprøve udtaget fra boringen DGU arkivnr. 105.1798 i en dybde af 8,45-8,70 meter ved Brande, Ringkøbing Amt. 4.1.4 Reaktivitetsforsøg med sedimenter fra Roskilde Amt4.1.4.1 Reaktivitetsforsøg med sedimentprøve udtaget i 5 meter ved Lille-Skensved, Roskilde AmtUdviklingen i pH og redoxpotentiale i en opslemning med sedimentprøve udtaget i 5,0 meter ved Lille-Skensved, Roskilde Amt (DGU arkivnr. 212.1308), fremgår af figur 4.16. pH-værdien i opslæmningen steg fra 8,5 til 9,1 gennem de første 93 timer, hvorefter værdien atter aftog jævnt gennem resten af forsøget, til 8,6 efter 240 timer. Dette forløb tyder på, at der i begyndelsen sker en iltning af let tilgængeligt organisk stof (ved forsøgsstart 0,17 % C), hvorefter andre processer synes at styre udviklingen i pH, herunder iltningen af pyrit, der ved begyndelsen af forsøget udgjorde 0,32 % FeS2. Redoxpotentialet er ved begyndelsen af forsøget målt til 254 mV, hvorefter det aftager markant gennem de første 22 timer til 200 mV og yderligere aftager - om end svagere - til 176 mV efter 93 timer, hvorefter redoxpotentialet atter stiger gennem resten af forsøgsperioden til 210 mV efter 240 timer. 4.1.4.2 Reaktivitetsforsøg med sedimentprøve udtaget i paleocænt kalk ved Køge, Roskilde AmtUdviklingen i pH og redoxpotentiale i en opslæmninger med paleocænt kalk fra Køge, Roskilde Amt (DGU arkivnr. 212.1310), fremgår af figur 4.17. Den paleocæne kalk er karakteriseret ved yderst ringe indhold af reducerende forbindelser samt et lille indhold af organisk stof. I begyndelsen af forsøget er pH-værdien 8,8 og værdien stiger svagt gennem forsøget til 9,1 efter 384 timer. Samtidig med at der indtræder en svag stigning i pH-værdien sker der et svagt fald i redoxpotentialet i opslæmningen, fra 239 mV ved begyndelsen af forsøget til 183 mV ved slutningen af forsøget, svarende til 384 timer.
Figur4.16. Udviklingen i pH og redoxpotentialet (EH) i en opslæmning fremstillet med naturfugtig sedimentprøve, < 2 mm. Prøven stammer fra en reduceret kalkholdig lerprøve udtaget fra boringen med DGU arkivnr. 212.1308 i dybden 5,0 meter ved Lille-Skensved, Roskilde Amt.
Figur 4.17. Udvikling i pH og redoxpotentialet (EH) i en opslæmning fremstillet med naturfugtig sedimentprøve, < 2 mm. Prøven stammer fra boringen DGU arkivnr. 212.1310 og er udtaget fra paleocænt kalk i en boring ved Køge, Roskilde Amt. 4.1.5 Reaktivitetsforsøg med sedimenter fra Århus Amt4.1.5.1 Reaktivitetsforsøg med sedimentprøve udtaget i 32,0-32,5 meter ved Boulstrup, Århus AmtUdviklingen i pH og redoxpotentiale i opslemningen af sediment fra iltet sand udtaget i dybden 32-32,5 m ved Boulstrup, Århus Amt; (DGU arkivnr. 108.241) fremgår af figur 4.18. Her fremgår det at pH-værdien i opslæmningen stiger en anelse fra 8,4 ved forsøgets start til 8,6 efter 46 timer hvorefter der sker et generelt fald til 7,7 målt efter 384 timer. Redoxpotentialet er målt til 295 mV ved begyndelsen af forsøget hvorefter det aftager til 232 mV efter 22 timer for atter at stige til 250 mV efter 384 timer. Den tilførte ilt bruges således til at opbygge gradvis mere iltrige forhold i denne opslæmning.
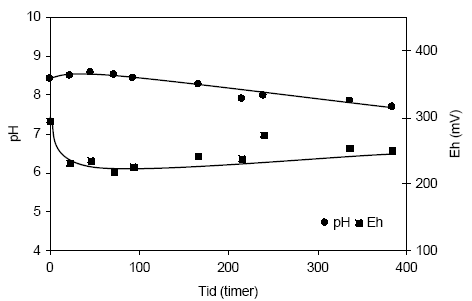
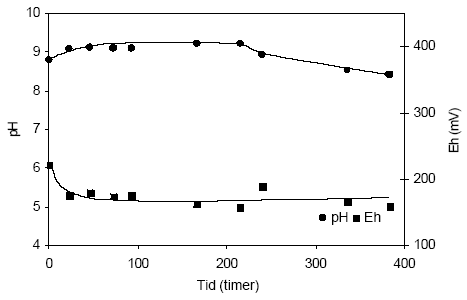
Figur 4.18. Udviklingen i pH og redoxpotentialet (EH) i en opslæmning fremstillet med naturfugtig sedimentprøve, < 2 mm. Prøven stammer fra iltet sand udtaget fra boringen DGU arkiv nr. 104.2404 i dybden 32,0-32,5 meter ved Boulstrup, Århus Amt. 4.1.5.2 Reaktivitetsforsøg med sedimentprøve udtaget i 57,0-57,5 meter ved Boulstrup, Århus AmtUdviklingen i pH og redoxpotentiale i opslæmningen med naturfugtigt sediment fra dyben 57,0-57,5 m fra Broulstrup, Århus Amt (DGU arkivnr. 108.241) fremgår af figur 4.19. I denne opslæmning er udgangsværdien for pH målt til 8,8, hvorefter den stiger til 9,1 efter 22 timer. Dette niveau holdes frem til 215 timer efter forsøgsstart hvor pH-værdien atter begynder at aftage svagt til 8,41 målt efter 384 timer. Forløbet antyder at der der indledningsvis sker en mikrobiel omdannelse af organisk stof og en samtidig dannelse af alkalinitets samt en iltning af pyrit, der i sidste del af forsøget markeres for Redoxpotentialet er målt til 222mV ved begyndelsen af forsøget hvorefter det aftager til 176 mV efter 22 timer hvorefter det holder sig nogen lunde konstant indtil afslutningen af forsøget, svarende til 384 timer. Tilførslen af ilt svarer således til den mængde der anvendes mikrobielle og kemiske processer i dette sediment.
Figur 4.19. Udviklingen i pH og redoxpotentialet (EH) i en opslæmning med naturfugtig sedimentprøve, < 2 mm. Prøven stammer fra boringen DGU arkivnr. 104.2404 i dybden 57,0-57,5 meter ved Broulstrup, Århus Amt. 5 Samlet vurdering af reaktivitets- forsøgeneI forbindelse med disse indledende undersøgelser af sedimenters reaktivitet er der inddraget sedimenter med forskellige geokemiske og mineralogiske egenskaber fra forskellige steder i Danmark. Undersøgelser viste at det var hensigtsmæssigt at begrænse forbEHandlingen af de anvendte sedimentprøver, idet forbEHandlingen i sig selv kunne afstedkomme ændringer i prøvens såvel mikrobielle som mineralogiske egenskaber og som dermed i betydeligt omfang kunne indvirke på udviklingen i bl.a. pH og EH under tilførsel af ilt. Således viste det sig at en nedknusning af prøvematerialet til < 250 m blotlagde mineralflader og som dermed påvirkede redoxpotentialet i et omfang der ikke kunne erkendes i det sigtede prøvematerialet < 2 mm. Begge prøver stammede fra en reduceret sandprøve. En opvarmning af sedimentprøven til 105 °C forud sigtning ændrede markant de mikrobielle forhold og førte bl.a. til et mindre iltforbrug end for den ikke opvarmede prøve. Reaktivitetsforsøgene er således gennemført med naturfugtige sedimenter, der forud for brug blev sigtet og kun fraktionen < 2 mm er efterfølgende anvendt i opslæmninger af med vand. Indhold af større partikler var ikke muligt ved den valgte forsøgsopstilling. I opslæmningerne var forholdet mellem sediment og vand 1:4, beregnet på baggrund af ovntør (105 °C) jords vægt, hvorved der blev taget hensyn til forskelle i det naturlige vandindhold. Ved anvendelse af prøver, der blev opbevaret nedfrossen, blev prøverne opbevaret i køleskab gennem en uge før end prøven blev anvendt til forsøg, med henblik på i videst mulig omfang at genetablere sedimentprøvens mikrobielle egenskaber. Reaktivitetsforsøgene med naturfugtige, iltede sedimentprøver viste ingen eller kun svage ændringer i de målte pH-værdier og redoxpotentialer gennem forsøgsperioden. Dette var ligeledes ventet dersom det oprindelige indhold af reducerende forbindelser formodes allerede opbrugt ved naturlige processer. De små ændringer der blev bemærket kan bl.a. for pH-værdien skyldes at der som følge af frysning af prøven er sket en ændring i bindingen af det organiske stof, hvorved det er blevet mere biotilgængeligt. Desuden kan det tænkes at tilbageblevne reducerede forbindelser i iltede sedimentet ikke umiddelbart eller kun uhyre langsomt iltes ved den almindelige ilttransport gennem jordlagene men som ved massiv påvirkning af ilt lader sig ilte. Mulighederne for iltning kan selvfølgelig også være øget som følge af opsplitningen/sigtningen af sedimentprøven, hvorved reducerede forbindelser eventuelt er blevet blotlagt. I opslæmninger med naturfugtige reducerede sedimentprøver sker der typisk en stigning i pH-værdien i begyndelsen af forsøget, antagelige som følge af mikrobiel omsætning af organiske stof og en heraf følgende alkalinitetsfrigivelse. Hvor markant denne forøgelse bliver vil afhænge af såvel mængden som sammensætningen af det tilstedeværende organiske stof. I sedimenter der ligeledes indEHolder pyrit vil stigningen i pH-værdien i opslæmningen blive mindre når der samtidig sker en syredannelse i forbindelse med iltningen af pyrit. I sedimenter med lav bufferkapacitet kan iltningen af pyrit resultere i et betydeligt fald i pH-værdien i opslæmningen, som ved Uhre fra pH omkring 7 til pH omkring 4 efter tilførsel af ilt over 195 timer. Ved de målte parametre er det således vanskeligt at opdele de forskellige procesforløb. Samtidige målinger af bl.a. alkalinitet og sulfat vil kunne hjælpe til at afklare bl.a. iltningen af organisk stof og pyrit. En tilpasning af forsøgsmetoden vil ligeledes kunne øge kendskabet til hvornår og i hvilket omfang iltningen af ferrojern-holdige forbindelser sætter ind i sammenligning med iltningen af reducerende forbindelser som bl.a. organisk stof og pyrit. Et flertal af reaktivitetsforsøgene viser generelt faldende eller eventuelt stabile redoxpotentialer hvilket tyder på at den tilførte mængde ilt har modsvaret eller været mindre end det iltforbrug der var i opslæmningen. Længerevarende forsøg vil kunne vise hvornår iltbEHovet aftager og redoxpotentialet i opslæmningen atter stiger. 6 Fremtidige undersøgelserPå baggrund af de foreliggende forsøgsresultater vil det kunne anbefales at gennemføre supplerende undersøgelser af reducerende prøver med forskellige mineralogiske egenskaber, ved bl.a. indhold af organisk stof, pyrit og ferrojernforbindelser. Reaktivitetsundersøgelserne skal om muligt planlægges til at have en varighed minimum svarende til at en stigning i redoxpotentialet begynder at kunne registreres. Desuden vil det være værdifuldt at supplere de her anvendte målinger af pH og redoxpotentiale med analyser af delprøver af opslæmningen ved bl.a. alkalinitet, opløst organisk stof, opløst kvælstof, sulfat samt ferrojern gennem forsøgsperioden for derigennem at øge kendskabet til den tidsmæssige udbredelse af de forskellige processer. De tre førstnævnte parametre knyttet sig specielt til iltningen af organisk stof, mens sulfat knytter sig til iltningen af pyrit og ferrojern til iltningen af jernholdige mineraler. Dertil kommer målinger af for eksempel tungmetaller, der frigives i forbindelse med oxidationen af sedimenterne. Ved længerevarende forsøg kan det overvejes at lade iltningen ske ved tilførsel af almindelig atmosfærisk luft, for dels at reducerer udgifterne dels i højere grad efterligne iltningsforløbet under naturlige forhold. Ligeledes vil det være hensigtsmæssigt at anvende forskellige forsøgstemperaturer for nogle få udvalgte prøver for derigennem at beskrive proceshastigheden som supplement til forsøgene ved stuetemperatur hvor der i højere grad lægges vægt på procesforløbet. 7 ReferencerBarcelona, M.J og T.R. Holm. 1991. Oxidation-reduction capacities of aquifer solids. Environmental Science & Technology 25:1565-1572 Bjerrum, N. 1932. Lærebog i uorganisk kemi. 3. udgave Thorsøe-Olsen & Co. København. 367 s. Ernstsen, V., H.J. Henriksen og F. von Platen. 2001. Principper for beregning af nitratreduktion i jordlagene under rodzonen. Arbejdsrapport fra Miljøstyrelsen, nr. 24. http://www.mst.dk/udgiv/publikationer/2001/87-7944-713-9/html Hartog, N, J. Griffioen og C.H. van der Weijden. 2002. Distribution and reactivity of O2-reducing components in sediments from a layered aqifer. Environmental Science & Technology 36:2338-2344 Sigg, L. 2000. Redox potential measurements in natural waters: Significance, concept and problems. ss 1-12 i J. Schüring, H.D. Schulz, W.R. Ficher, J. Böttcher og W.H.M. Duijnisveld (eds.) Redox – Fundamentals, processes and applications. Springer. Heidelberg. 251s. Stumm og Morgan.1996. Aquatic chemistry. Chemical equilibria and rates in natural waters. Third edition. John Wiley & Sons, Inc. New York. 1024 s.
|
![Figur 2.1 Typisk forekommende redoxpotentialer [mV] i naturlige systemer med neutrale pH-værdier. Positive redoxpotentialer (op til omkring +800 mV ) tyder på tilstedeværelse af stærke oxidanter, mens negative værdier tyder på tilstedeværelse af stærke reduktanter (modificeret efter Sigg, 2000)](images/fig2_1.gif)