|
| Forside | | Indhold | | Forrige | | Næste |
Undersøgelse af reaktiviteten af reducerende stoffer i nogle danske sedimenter – et pilotstudie
2 Redoxforhold i sedimenter
Der er en begrebsmæssig en analogi i mellem reduktion-oxidation reaktioner (redox) og syre-base reaktioner. På lignende måde som syre og baser optræder som protondonorer og protonacceptorer, er
reduktanter og oxidanter defineret som henholdsvis elektrondonorer og elektronacceptorer (Bjerrum, 1932; Stumm og Morgan, 1996). Reduktanters og oxidanters evne til at reducere eller oxidere
beskrives udfra redoxpotentialet EH. Termodynamisk kan et redoxpotentiale defineres udfra nedenstående ligning, hvor Ox betegner oxidanten og Red den korresponderende reducerede forbindelse:
Ox + ne- →Red
med n som antallet af ombyttelige elektroner. Denne ligning kaldes en halvcelle reaktion og skrives for nemheds skyld med det oxiderede stof på venstre side i reaktionsligningen. Da der ikke kan forekomme
frie elektroner, kan ovenstående halvcelle reaktion kun forløbe, hvis en anden forbindelse stiller elektroner til rådighed for reaktionen, det vil sige at et reduceret stof skal være tilstede. En redoxreaktion vil
der derfor altid involvere et oxiderende stof og et reducerende stof.
Måles redoxpotentialet til en positiv værdi er der et overskud af oxiderende forbindelser, mens negative værdier betyder at der er overskud af reducerende forbindelser, jf. figur 2.1.
![Figur 2.1 Typisk forekommende redoxpotentialer [mV] i naturlige systemer med neutrale pH-værdier. Positive redoxpotentialer (op til omkring +800 mV ) tyder på tilstedeværelse af stærke oxidanter, mens negative værdier tyder på tilstedeværelse af stærke reduktanter (modificeret efter Sigg, 2000)](images/fig2_1.gif)
Figur 2.1 Typisk forekommende redoxpotentialer [mV] i naturlige systemer med neutrale pH-værdier. Positive redoxpotentialer (op til omkring +800 mV ) tyder på tilstedeværelse af stærke oxidanter, mens
negative værdier tyder på tilstedeværelse af stærke reduktanter (modificeret efter Sigg, 2000).
Redoxpotentialet i naturlige systemer er begrænset i den negative retning af reduktionen af vand til brint (H2O →H2 (g)) og i den positive retning af oxidationen af vand til ilt (H2O →O2 (g)). Ved neutrale til let
basiske forhold befinder redoxpotentialet sig derfor i området ca. –400 mV til ca. +800 mV (Stumm og Morgan, 1996). Som det fremgår af figur 2.2, befinder de hyppigst naturlige forekommende redoxpar
sig spredt ud over hele området, idet ilt (O2), nitrat (NO3-) og manganoxid (MnO2) er oxiderende forbindelser, mens svovl (S), brint (H2) og methan (CH4) er reducerede forbindelser. Figuren viser også
for de viste redoxpar, at redoxpotentialet afhænger af pH-forholdene, idet redoxpotentialet generelt er højere ved en pH-værdi på 7 end ved en pH-værdi på 8.
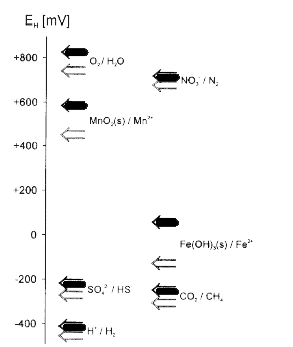
Figur 2.2. Redoxpotentialer for nogle af de vigtigste redoxpar i vand ved pH 7 (mørke pile) og pH 8 (lyse pile). Redoxpotentialerne er beregnet ved aktiviteterne {Red} = 1 og {Ox} = 1 samt formodede
aktiviteter af Mn2+ og Fe2+ ved henholdsvis {Mn2+} = 10-6 M og {Fe2+} = 10-6 M (efter Sigg, 2000).
| Forside | | Indhold | | Forrige | | Næste | | Top |
Version 1.0 Juli 2005, © Miljøstyrelsen.
|