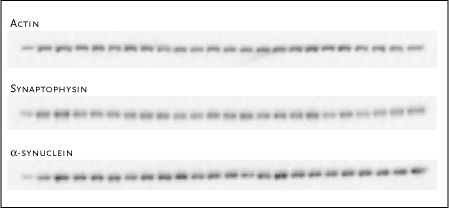
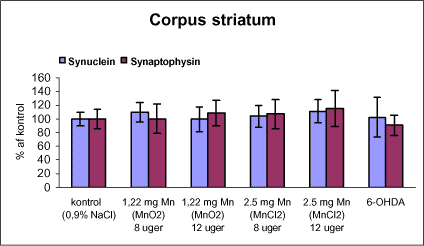
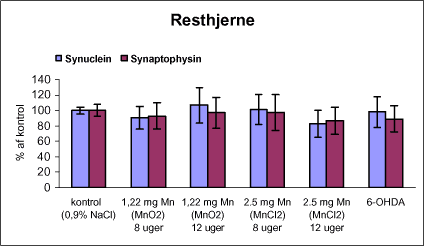
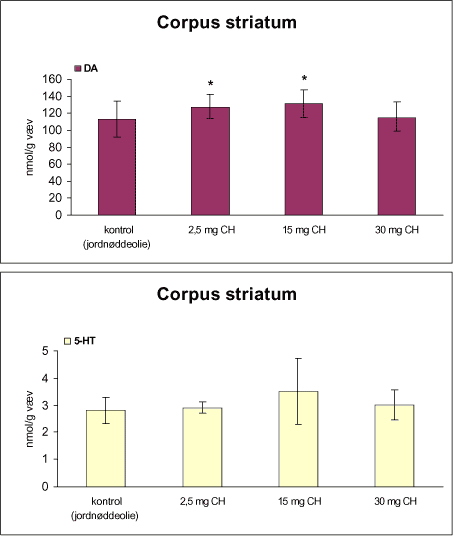
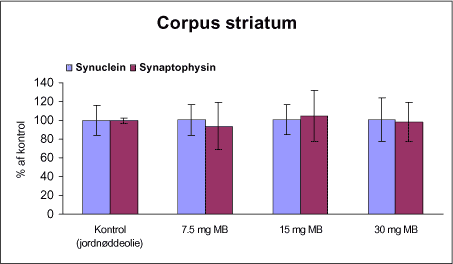
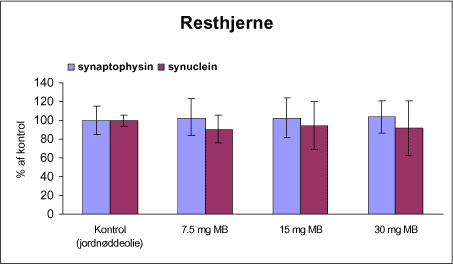
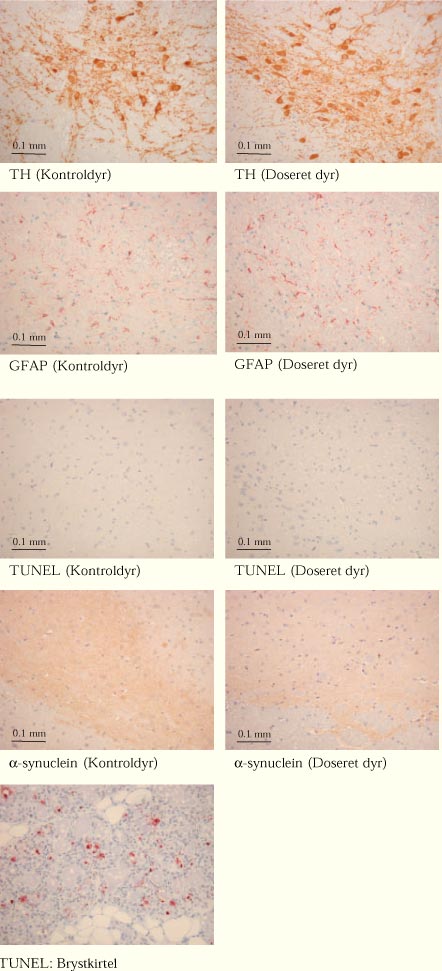
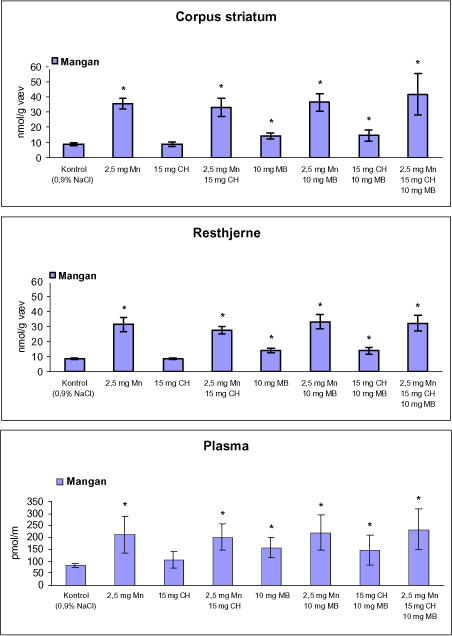
|
Bekæmpelsesmiddelforskning fra Miljøstyrelsen nr. 95, 2005 Virkningsmekanismer for neurotoksisk effekt af mangan og kombinationseffekt af mangan og chlorpyrifos og manebIndholdsfortegnelse
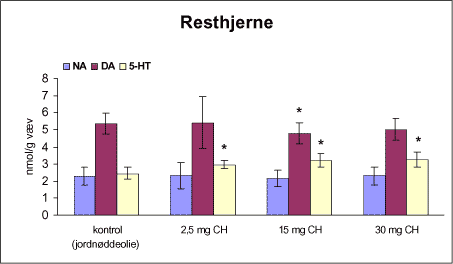
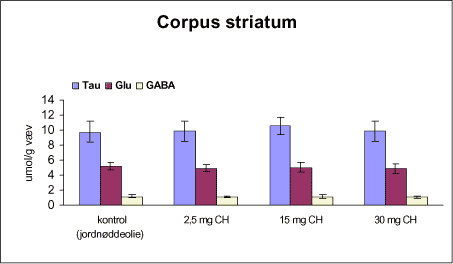
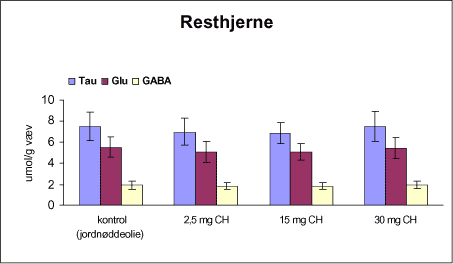
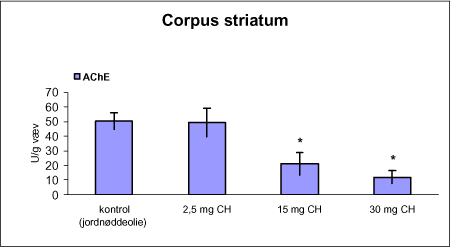
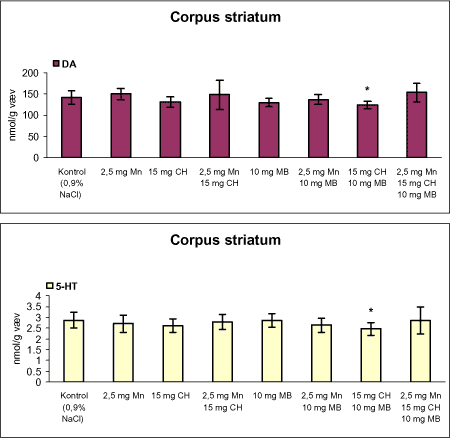
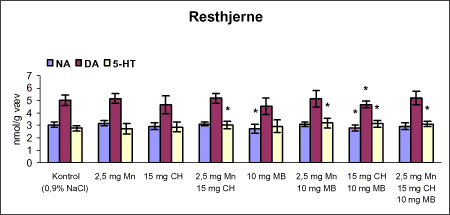
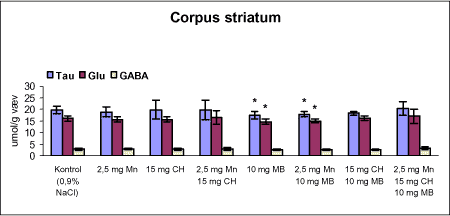
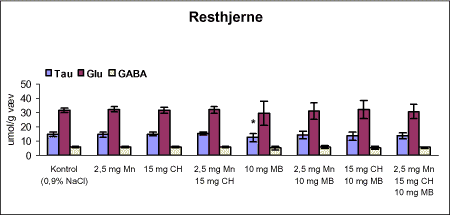
ForordNærværende projekt: ”Virkningsmekanismer for neurotoksisk effekt af mangan, chlorpyrifos og maneb” blev påbegyndt 1. juni 2002 og afsluttet 31. december 2004. Projektet blev støttet af midler fra Miljøstyrelsens Program for Bekæmpelsesmiddelforskning. Dette projekt var ikke blevet udført uden stor og faglig kompetent indsats af laboranter og dyrepassere. Herfor vil forfatterne gerne takke: Amer Mujezinovic, Annette Landin, Kai Vest, Lena Kristensen, Trine Gejsing, Vibeke Kegel, Vibeke Kjær, Birgitte Koch Herbst, Karen Bielefeldt Pedersen, Lisbeth Pihlkjær Christensen samt hele dyrestaldspersonalet. Herudover takkes professor Mikael Aschner, Vanderbilt University Center, TN, USA, for personlige oplysninger om egne undersøgelser og fund af mangans effekt på koncentrationen i nervevæv af aminosyrer med signalfunktion. Medicinalfirmaet NeuroSearch takkes for stereotaktisk dosering med 6-hydroxydopamin og hjælp til etablering af dissektionsteknik for corpus striatum. Professor Harry Roels, Université Catholique de Louvain, Bruxelles, Belgien, takkes for informationer vedrørende mangandosering og hjælp til fremskaffelse af fintkornet mangandioxid. En stor tak rettes også til Karina Petersen, Lundbeck for generøs donation af α-synuclein antistof til western blot. En følgegruppe for projektet blev etableret under ledelse af specialkonsulent Jørn Kirkegaard fra Miljøstyrelsen. Medlemmerne var overlæge dr. med. Peter Arlien-Søborg, Neurologisk Afdeling, Rigshospitalet; professor dr. pharm. Steen Honoré Hansen, Danmarks Farmaceutiske Universitet; professor dr. med. Philippe Grandjean, Miljømedicin, Syddansk Universitet og afdelingsleder Arne Møller medicinalfirmaet NeuroSearch, som dog i 2004 udtrådte af følgegruppen. Lektor Sven Edelfors, Farmakologisk Institut, Københavns Universitet, og lektor Henrik Leffers, Rigshospitalet, har begge deltaget i de to sidste følgegruppemøder. Mørkhøj, 24. juni 2005 Dansk resumeMangan er en vidt anvendt co-formulant i pesticidpræpatater og udgør en integreret, organisk bunden del af to pesticider: maneb og mancozeb. Mangan kan forårsage neurotoksicitet, manganisme/parkinsonisme, efter erhvervsmæssig eksponering. Manganisme deler mange symptomer med Parkinson’s sygdom. Epidemiologiske undersøgelser dokumenterer, at arbejdere i landbrug, havebrug og personer som bor nær områder med hyppig anvendelse af pesticider har forøget risiko for at udvikle symptomer på Parkinson’s sygdom. Der er mulighed for interaktion, endog potensering, mellem mangan og pesticider i relation til neurotoksicitet. Der vides intet sikkert om sådan potentiel interaktion, men dette projekt søger at bidrage med viden herom. Resultaterne kan i givet fald anvendes til at beskytte mennesker mod erhvervsmæssig og miljømæssig eksponering for mangan og pesticider alene eller i kombination. Der antages at være en interaktion mellem de neurotoksiske effekter forårsaget af mangan og pesticider specielt i relation til Parkinson’s sygdom. De tilgrundliggende mekanismer og deres mulige interaktion søges belyst gennem en integreret, multidisciplinær indfaldsvinkel bestående af morfologiske, immunhistokemiske og neurokemiske metoder under anvendelse af unge Sprague Dawley hanrotter som model. Udover mangan, doseret som manganklorid, valgtes to pesticider: chlorpyrifos som er vidt anvendt og har veldokumenterede effekter på det cholinerge nervesystem og maneb, et fungicid med organisk bundet mangan. Der udførtes dose-range indersøgelser for hvert af disse tre kemikalier for at sikre egnede doseringsniveauer i kombinationsstudiet, i hvilket de tre kemikalier blev administreret alene, i alle kombinationer med to kemikalier, og når de alle tre blev doseret sammen. I patienter med Parkinson’s sygdom, reduceres dopaminkoncentrationen dramatisk i hjernens basalgaglier, specielt i corpus striatum, som en konsekvens af degeneration af dopaminerge neuroner, som udspringer i substantia nigra og sender udløbere til corpus striatum. Den basale, tilgrundliggende mekanisme herfor kendes ikke, men induktion af oxidativt stress og apoptose synes at være centrale elementer. Dopaminkoncentrationen valgtes som en vigtigt effektparameter ligesom koncentrationerne af noradrenalin, 5-hydroxytryptamin og forskellige aminosyrer med neurotransmitter funktion [glutamat, taurin og GABA (γ-aminosmørsyre)] og aktiviteten af cholinesteraser blev undersøgt. Disse effektparametre anvendtes som indikatorer, biomarkører, for påvirkning af tilhørende dele af centralnervesystemet. Herudover foretoges kvantitativ bestemmelse af to relevante proteiner, α-synuclein og synaptophysin, og af aktiviteten af caspase-3 enzymet, som er tæt forbundet med apoptotisk neurodegeneration. Histokemiske farvninger valgtes for at diskriminere mellem nekrotisk og apoptotisk neurodegeneration og effekterne på det catacholaminerge system, det vil sige haematoxylin-eosin, gliafibrillært surt protein, TUNEL og tyrosin hydroxylase. Fokus blev rettet mod corpus striatum og substantia nigra, men resten af hjernen blev også undersøgt. Der var alvorlige problemer med den intraperitoneale dosering med manganklorid, fordi dyrene blev tydeligt generet heraf. Denne doseringsvej anvendes ofte i manganundersøgelser, men sådanne symptomer er ikke raporteret. Den højeste dosis manganklorid var 2,5 mg/kg legemsvægt/dag for maksimalt 12 uger. Dette øgede mangankoncentrationen i corpus striatum, resthjernen og plasma. Dosering med manganklorid i 12 uger reducerede svagt de striatale koncentrationer af dopamin, glutamat, taurin, GABA og acetylcholinesteraseaktiviteten. Disse reduktioner var minimale og anses ikke at give anledning til neurotoksicitet. Koncentrationerne af α-synuclein og synaptophysin og de histologiske parametre var ikke påvirkede. Dose-range undersøgelsen med subkutan dosering med chlorpyrifos i doserne 2,5, 15 og 30 mg/kg legemsvægt/uge i 12 uger viste øget dopaminkoncecntration svarende til de to laveste doser. Der var ingen effekt på koncentrationerne af striatale aminosyrer med neurotransmitterfunktion, hvorimod aktiviteten af acetylcholinesterase reduceredes dosisafhængigt. Koncentrationerne af α-synuclein og synaptophysin og de histologiske parametre var ikke påvirkede. Dose-range undersøgelsen med intraperitoneal dosering med maneb i doserne 7,5, 15 og 30 mg/kg legemsvægt/uge i 12 uger viste dosisafhængig øget mangankoncentration i corpus striatum. Koncentrationen af 5-hydroxytryptamin øgedes dosisafhængigt i både corpus striatum og resthjernen, hvilket betragtes som tidligt tegn på neurotoksicitet. Den striatale aktivitet af acetylcholinesterase var ikke påvirket. Koncentrationen i corpus striatum og resthjerne af aminosyrer med neurotransmitterfunktion, α-synuclein og synaptophysin samt de histologiske parametre var ikke påvirkede. Det var udenfor dette projekts rammer at identificere specieringen i hjernen af det mangan, som stammede fra maneb. Derfor kunne effekter ikke fortolkes i relation til manganspeciering. På basis af resulteterne fra disse tre studier udvalgtes følgende doser til kombinationsstudiet: mangan, 2,5 mg mangan/kg legemsvægt/dag i 12 uger som intraperitoneal dosering med manganklorid; chlorpyrifos, 15 mg chlorpyrifos/kg legemsvægt/uge i 12 uger som subkutan dosering; maneb, 10 mg maneb/kg legemsvægt/uge i 12 uger som intraperitoneal dosering. Udover kontrolgruppen doseredes med mangan, chlorpyrifos og maneb enten alene, i alle tre kombinationer med to kemikalier og hvor alle tre blev doseret, det vil sige i alt 8 grupper. Mangan og maneb øgede den striatale koncentration af mangan. Ved samtidig doesring med mangan og maneb var koncentrationerne i overensstemmelse med additiv effekt. Samtidig eksponering med chlorpyrifos og maneb reducerede striatale dopamin og 5-hydroxytryptamin koncentrationer. Aktiviteten af acetylcholinesterase i striatum blev reduceret i alle grupper doseret med chlorpyrifos, hvilket også iagttoges ved enkeltdosering med maneb og samtidig dosering med mangan og maneb. Det var bemærkelsesværdigt, at enkeltdosering med maneb og samtidig dosering med mangan og maneb også reducerede striatale koncentrationer af glutamat, taurin og GABA. Aktiviteten af caspase-3, koncentrationerne af α-synuclein og synaptophysin og de histologiske parametre blev ikke påvirket af nogen dosering. Det konkluderes, at enkeltdosering med mangan, chlorpyrifos og maneb påvirkede forskellige neurokemiske effektparametre af relevans for induktion af neurotoksicitet relateret til Parkinson’s sygdom. I kombinationsstudiet påvistes også ændrede neurokemiske effektparametre. Der var intet klart, konsistent mønster af ændringer og ingen synergistiske effekter, herunder potensering, blev afsløret under de forsøgsomstændigheder, som anvendtes i projektet. Dette udelukker imidlertid ikke, at andre forsøgsomstændigheder ikke ville have kunnet afsløre et konsistent mønster af ændrede biomarkører og synergistiske effekter. Der er stadig et potentiale for sådanne effekter som behøver at blive grundigt undersøgt. AbstractManganese is widely used as an additive to pesticide formulations, and constitutes an integrated and organically bound part of two pesticides: maneb and mancozeb. Manganese can cause neurotoxicity, manganism/parkinsonism, in workers occupationally exposed to manganese. Manganism shares many symptoms with Parkinson's disease. Epidemiological investigations document that workers in agriculture and horticulture, and people living near areas with frequent use of pesticides have increased risk of developing symptoms of Parkinson's disease. There may be an interaction, even a potentiation, between manganese and pesticides with respect to neurotoxicity. Nothing certain is known about such potential interaction. This project may therefore add knowledge to this question, enabling the results to be used to protect people against occupational and environmental exposure to manganese and pesticides, alone and in combination. This project hypothesizes an interaction between neurotoxic effects induced by manganese and pesticides, especially in relation to Parkinson's disease. Underlying mechanisms and their potential interaction can be illuminated by an integrated multidisciplinary approach including morphological, immunohistochemical, and neurochemical methods applying the young male Sprague Dawley rat as the model. In addition to manganese (dosed as manganese chloride), two pesticides were selected for the studies: chlorpyrifos that is widely used and has a documented effect on the cholinergic system, and maneb, a fungicide with organically bound manganese. Dose-range studies were performed for each of these to select proper concentrations in the combination study in which the three chemicals were administered alone, in all combinations with two chemicals, and when all three were administered. In patients with Parkinson's disease, the dopamine concentration is dramatically reduced in the basal ganglia, including corpus striatum, as a consequence of degeneration of dopaminergic neurons originating in substantia nigra and projecting to corpus striatum. The basal underlying mechanisms are unknown, but induction of oxidative stress and apoptosis seem to be central elements. The dopamine concentration was selected as an important endpoint, as were the concentrations of noradrenaline, 5-hydroxytryptamine, and various amino acid neurotransmitters [glutamate, taurine and GABA (gamma-aminobutyric acid)] and the activity of acetylcholinesterase. These endpoints were used as indices, biomarkers, of affected related parts of the central nervous system. Additionally, quantitative determination of two relevant proteins α-synuclein and synaptophysin - was applied, as was the activity of the caspase-3 enzyme closely related to apoptotic neurodegeneration. Histochemical stainings were chosen to discriminate between necrotic and apoptotic neurodegeneration and effects on the catecholaminergic nervous system i.e. haematoxylin-eosine, glial fibrillary acidic protein, tyrosine hydroxylase and TUNEL. Focus was placed on corpus striatum and substantia nigra, but also the rest of the brain was investigated. There were serious problems with the intraperitoneal administration of manganese chloride, because the animals experienced discomfort. This route of administration is often used in investigations, but such symptoms are not reported in literature. The highest dose of manganese chloride was 2.5 mg/kg body weight/day for a maximum of 12 weeks. This increased the manganese concentration in corpus striatum, the rest of the brain and plasma. Administration of manganese chloride for 12 weeks slightly reduced the striatal concentrations of dopamine, glutamate, taurine, GABA, and the acetylcholinesterase activity. These reductions were minimal, and were not regarded as manifested manganese-induced neurotoxicity. The concentrations of α-synuclein and synaptophysin and the histological parameters were not affected. The dose-range study with chlorpyrifos subcutaneous dosing (2.5, 15 and 30 mg chlorpyrifos/kg bodyweight/week for 12 weeks) revealed increased dopamine concentrations to be induced by the two lowest doses. There was no effect on striatal neurotransmitter amino acids, whereas the acetylcholinesterase activity was reduced in a dose-related manner. The concentrations of α-synuclein and synaptophysin and the histological parameters were not affected. The dose-range study with maneb intraperitoneal dosing (7.5, 15 and 30 mg maneb/kg bodyweight/week for 12 weeks) demonstrated dose-related increased manganese concentration in corpus striatum. The striatal concentration of 5-hydroxytryptamine increased in a dose related manner as did the 5-hydroxytryptamine concentration in the rest of the brain, indicating early sign of neurotoxicity. Striatal acetylcholinesterase activity was not affected. The concentrations of neurotransmitter amino acids in corpus striatum and the rest of the brain were not changed. The concentrations of α-synuclein and synaptophysin and the histological parameters were not affected. Identification of the speciation in brain tissue of manganese originating from maneb was outside the scope of this project. Consequently, effects could not be interpreted in terms of manganese speciation. Based on the results in the above studies, in the combinatory study the following doses were chosen: manganese, 2.5 mg Mn/kg body weight/day for 12 weeks as intraperitoneal doses of manganese chloride; chlorpyrifos, 15 mg chlorpyrifos/kg bodyweight/week for 12 weeks as subcutaneous doses; maneb, 10 mg maneb/kg bodyweight/week for 12 weeks as intraperitoneal doses. Beside a control group, manganese, chlorpyrifos and maneb were administered either alone, in all three combinations with two chemicals, and when all three were co-administered i.e. a total of eight groups. Manganese and maneb increased the striatal concentration of manganese. When administered together data were in accordance with an additive effect on the manganese concentration. Coexposure to chlorpyrifos and maneb decreased striatal dopamine and 5-hydroxytryptamine concentrations. The acetylcholinesterase activity in corpus striatum was reduced in all groups administered chlorpyrifos as when single exposed to maneb and coexposed to manganese and maneb. Remarkably, single exposure to maneb and coexposure to manganese and maneb also reduced striatal concentrations of glutamate, taurine and GABA. The caspase-3 activity was unaffected by all treatments as were the concentrations of α-synuclein and synaptophysin and the histological parameters. In conclusion, single exposure to manganese, chlorpyrifos, and maneb showed affection of various neurochemical effect parameters of relevance for induction of neurotoxicity related to Parkinson's disease. The combinatory study also revealed affected neurochemistry. However, no consistent pattern of changes emerged, and no obvious synergistic effects, including potentiations, were disclosed under the conditions applied in this project. This does not exclude that another setup for the investigations would not have revealed a consistent pattern of affected biomarkers and synergistic effects. A potential for such effects still exists, which needs to be thoroughly investigated. 1 Introduktion
1.1 BaggrundMangan anvendes i ikke ubetydelige mængder som hjælpestof i adskillige kommercielle pesticidformuleringer. Det bruges i form af forskellige mangansalte eksempelvis som –sulfat og -sulfid (Miljøstyrelsen 2003a). Der findes herudover manganholdige pesticider (maneb, mancozeb) med organisk bundet mangan. Der er en dokumenteret relation mellem menneskers eksponering for pesticider og mangan og udviklingen af meget alvorlige nervebeskadigende effekter, herunder Parkinsons sygdom. De tilgrundliggende mekanismer kendes ikke i tilstrækkeligt omfang. Det er dog sandsynligt, at det drejer sig om forskellige virkningsmekanismer for pesticider og mangan, og at der også kan være risiko for interaktion (større samlet effekt) ved samtidig eksponering for både mangan og pesticider. Undersøgelser og data for sådanne interaktioner mangler. Maneb og mancozeb frembyder måske specielle problemer på grund af deres indhold af mangan. 1.2 Projekt og formålProjektet er relevant både nationalt og internationalt. Dets resultater, som kan bibringe ny viden, vil i givet fald kunne anvendes til at beskytte mennesker mod sundhedsrisiko ved kompleks eksponering for mangan og pesticider. I projektet undersøgtes relevante, potentielle virkningsmekanismer for mangans og pesticiders nervebeskadigende effekt, og der blev foretaget specifikke kvantitative mangananalyser i hjernevæv og plasma. Der blev herudover foretaget en integreret evaluering af resultaterne, herunder en vurdering af sundhedsrisiko ved brug af mangan som hjælpestof til pesticidpræparater. 1.3 ArbejdshypoteserDer er interaktion (samspilseffekt) mellem de neurotoksiske effekter forårsaget af pesticidhjælpestoffet mangan og pesticider specielt i relation til udvikling af parkinsonisme. De potentielle, tilgrundliggende virkningsmekanismer og disses interaktion kan belyses ved morfologiske, immunhistokemiske og neurokemiske metoder under anvendelse af rotten som model. 1.4 projektets undersøgelser og effektparametreProjektets ide var ved at imitere inhalationseksponering (indånding) af mennesker ved at foretage intraperitoneale injektioner af rotter med mangansalt(e) at etablere en rottemodel med dokumenteret statistisk signifikant forøgede mangankoncentrationer i hjernen. Dette tjente også til valg af manganspeciering (manganforbindelse), -dosis og -doseringsvarighed i kombinationsundersøgelsen. Der udførtes også dose-range undersøgelser af chlorpyrifos og maneb til fastsættelse af respektive doser i kombinationsundersøgelsen. På basis heraf udførtes kombinationsundersøgelsen. I disse undersøgelser studeredes doseringens effekt på udvalgte neurokemiske og histologiske parametre i hjernedele, som er relevante for udvikling af Parkinsons sygdom. Herved undersøgtes for effekter på størstedelen af hjernen, idet dennes cholinerge, noradrenerge og serotonerge systemer alle blev screenet for effekt. Effekter på hjernedele som betjener sig af aminosyrer som signalstoffer undersøgtes også. Endvidere lokaliseredes effekter til de vigtigste celletyper i hjernen: neuroner og gliaceller, og det blev specificeret om eventuel neurodegeneration skyldtes nekrose eller apoptose. Herudover undersøgtes effekt på specifikke biomarkørproteiner med relevans for Parkinsons sygdom. Liste over udvalgte forkortelser anvendt i rapporten
2 Baggrund
Mange epidemiologiske undersøgelser viser, at der hos landmænd, arbejdere i gartneri og havebrug og hos personer bosat i områder med eksponering for pesticider ses forøget risiko for udvikling af symptomer på Parkinsons sygdom (Schoenberg et al. 1987; Ho et al. 1989; Koller et al. 1990; Semchuk et al. 1992; Gorell et al. 1997; Golbe 1998; Gorell et al. 1998; Engel et al. 2001). Dette er også dokumenteret i en undersøgelse af arbejdere i danske landbrug (Tüchsen & Jensen 2000). Det har ikke været muligt at relatere årsagen til specifikke pesticider. Der har været specielt fokus på pyrethroiderne og de manganholdige pesticider som mulige ætiologiske faktorer. Pyrethroiderne har været under mistanke, fordi de strukturmæssigt ligner 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridin (MPTP), et modelstof som anvendes til eksperimentel udvikling af Parkinsons sygdom (Russel 1992; Bachurin et al. 1991). Organophosphatholdige pesticider påvirker det cholinerge nervesystem og kan således bidrage indirekte til udviklingen af Parkinsons sygdom. Et tidligere meget anvendt organophosphatholdigt pesticid er chlorpyrifos. Udover effekten på det cholinerge system besidder chlorpyrifos også en mere generel neurotoksisk effekt, som ikke nødvendigvis hænger sammen med hæmning af acetylcholinesterase (AChE), men også kan have bertydning for udvikling af Parkinsons sygdom. Dette er specielt belyst i en række undersøgelser af chlorpyrifos’ effekt på hjernens udvikling (Slotkin 2004a,b). Undersøgelser fra metalindustrien viser, at manganeksponering ved inhalation er særdeles neurotoksisk og kan fremkalde Parkinson-lignende symptomer (parkinsonisme, manganisme) (Zayed et al. 1990; Calne et al. 1994; Gorell et al. 1997; Huang et al. 2003). De tilgrundliggende virkningsmekanismer kendes ikke (Veldman 1998), men de menes på flere punkter at være forskellige fra dem, der udløser Parkinsons sygdom (Arlien-Søborg 2001). Disse problemer er også aktuelle i Danmark. Danmarks Fødevareforskning har vurderet faren ved anvendelse af forskellige hjælpestoffer til pesticidpræparater og udarbejdet en farlighedsvurdering af forskellige mangansalte, hvoraf nogle anvendes som hjælpestoffer i pesticidformuleringer (Miljøstyrelsen 2003a). 2.1 EksponeringPesticiderPesticider anvendes i vid udstrækning i moderne landbrug, havebrug og private husholdninger til mange forskellige formål. Til trods for, at der i Danmark er nøje regulering og krav til uddannelse og brug af beskyttelsesmidler ved erhvervsmæssig anvendelse af disse kemikalier, så sker der stadig eksponering i et omfang, der kan give anledning til neurologiske symptomer (Tüchsen & Jensen 2000). Det meste af eksponeringen foregår ved inhalation, hudkontakt og via mavetarmkanalen (Newsome 1976; Newsome 1979; McGeer et al. 1988; Patsakos et al. 1992; Thiruchelvam et al. 2000a,b). ManganMangan er naturlig forekommende i miljøet og et essentielt mikronæringsstof, som indgår i flere livsnødvendige enzymsystemer f.eks. pyruvat decarboxylase, superoxiddismutase og i leverenzymet arginase. Optagelsen af mangan i mave-tarmkanalen reguleres nøje, men undersøgelser i laboratoriedyr viser, at regulering af mangans absorption kan ”overloades” og føre til forøget koncentration i hjernen og ændringer i adfærd og signalstoffers metabolisme (ATSDR 2000). I forbindelse med eksponering for mangan ved inhalation findes derimod en alternativ, ikke regulerbar optagelsesvej gennem lugtenerven og direkte ind i hjernen (Tjalve et al. 1996; Gianutsos et al. 1997; Brenneman et al. 2000; Vitarella et al. 2000). Det antages også, at mangan kan optages fra lungerne. Sådan eksponering er aktuel ved anvendelse af mangansalte som hjælpestof til pesticidpræparater, for arbejdere i metalindustrien og via brugen af tilsætningsstoffet methylcyclopentadienil mangantricarbonyl til blyfri benzin. De højeste mangankoncentrationer efter inhalationseksponering ses i basalganglierne (striatum, nucleus caudatus, globus pallidus og substantia nigra) hos mus, rotte, abe og menneske (Barbeau 1984; Newland et al. 1989; Tjalve et al. 1996; Gianutsos et al. 1997; Brenneman et al. 2000; Vitarella et al. 2000). 2.2 Parkinsons sygdomGenereltParkinsons sygdom er en meget alvorlig, kronisk og fremadskridende lidelse i hjernen. I Danmark rammes cirka 1 ud af 1000 personer, og for indeværende findes 5000-6000 patienter med denne sygdom. Parkinsons sygdom tilhører en gruppe af neurologiske sygdomme (parkinsonisme) karakteriseret ved et fælles symptomkomplex. Symptomerne omfatter tremor (rysten), muskelstivhed, bradykinesi (langsom udførelse af bevægelser), forstyrret balanceevne og koordinering af bevægelser. Alle symptomer behøver ikke at være tilstede hos den enkelte patient. Parkinsons sygdom opstår når neuroner i basalganglierne, specifikt i substantia nigra, degenererer eller dør (Marsden 1994). Disse neuroner anvender dopamin som signalstof. Derved ødelægges nerveforbindelsen mellem substantia nigra og corpus striatum, hvilket medfører at personen bliver ude af stand til at kontrollere sine bevægelser på normal vis. Under neuronernes degeneration dannes fibrillære cytoplasmatiske inklusioner, kendt som Lewy bodies, som indeholder proteinerne ubiquitin og α-synuclein (Gibb & Lees 1988; Marsden 1994; Baba et al. 1998). ÅrsagerÅrsagen til denne destruktive ødelæggelse af nerveceller i substantia nigra kendes ikke med sikkerhed. Der er ingen overbevisende dokumentation for en genetisk basis for idiopatisk Parkinsons sygdom, hvilket har rettet fokus mod kemiske stoffer som udløsende faktorer (Thiruchelvam et al. 2000a,b), specielt pesticider og mangan. Parkinsons sygdom menes at være en multifaktoriel sygdom forårsaget af en kombination af alder, genetik og kemiske stoffer (Veldman et al. 1998; Ball 2001) med enkelte undtagelser: autosomal dominant familiær Parkinsons sygdom med mutationer i α-synuclein- og parkin-genet. Eksperimentelle dyremodeller til undersøgelse af parkinsonismeKemisk-inducerede og genetiske modificerede eksperimentelle dyremodeller bruges i vid udstrækning til studier af Parkinsons sygdom og til udvikling af effektive farmaka til symptombehandling heraf. Både reserpin, der er et tidligere anvendt middel mod skizofreni, 6-hydroxydopamin (6-OHDA), MPTP og methamphetamin har været anvendt i flere forskellige dyrearter. MPTP kan anvendes i mus og minigrise, men virker ikke i rotter. Specielt den unilaterale 6-OHDA model, hvor rotter énsidigt doseres intracerebralt eller intraventrikulært med 6-OHDA, er meget benyttet i medicinalindustrien og til anden forskning. Dosering med 6-OHDA kan replikere de neurokemiske, morfologiske, neurologiske og adfærdsmæssige ændringer, som ses i mennesker (Tolwani et. al. 1999). En meget interessant undersøgelse har vist, at kronisk eksponering for pesticidet rotenon ved kontinuert, intravenøs dosering via en indopereret osmotisk pumpe forårsagede selektiv nigrostrial fremadskridende dopaminerg degeneration. Neuronerne i substantia nigra hos rotenonbehandlede rotter akkumulerede cytoplasmatiske inklusioner, som indeholdt ubiquitin og α-synuclein. Resultaterne viste, at kronisk eksponering af rotter for rotenon kan reproducerede anatomiske, neurokemiske, adfærdsmæssige og neuropatologiske karakteristika for Parkinsons sygdom i rotter (Betarbet et al. 2000). Rotenon-modellen har lovende fremtidsperspektiver, men er for indeværende langt mere teknisk krævende end 6-ODHA modellen. 2.3 Virkningsmekanismer for pesticider og manganOxidativt stress og apoptoseMeget tyder på, at induktion af oxidativt stress er et central for udvikling af parkinsonisme (Lai & Yu 1997; Stokes et al. 1999; Lewen et al. 2000) via mekanismer, hvori også dopamin synes involveret (Cohen & Heikkila 1974; Hastings 1995). Oxidativt stress: Kemikalie-kompromitterede mitochondriale funktioner og oxidation af dopamin (autooxidation, mangan-induceret) (Gavin et al. 1999; Shen & Dryhurst 1998) kan føre til ukontrolleret dannelse af frie radikaler og reaktive oxygen-species (ROS) (Dexter et al. 1989; Betarbet et al. 2000) og derved være tilgrundliggende faktor for nigrale dopaminerge neuroners selektive degeneration (Junn & Mouradian 2001; Panet et al. 2001). Nyere undersøgelser viser, at manganeksponering inducerer oxidativt stress i rottehjernen (Erikson et al. 2004a). Apoptose: De grundlæggende molekylære mekanismer for udvikling af neurodegenerative sygdomme kendes ikke i detaljer, men apoptotiske processer, som kendetegnes ved programmeret celledød, vides at have central betydning (Jellinger & Stadelmann 2000a,b). Dopamin synes også involveret i disse mekanismer (Stokes et al. 1999; Cohen 2000). Apoptose er en essentiel, fysiologisk normal funktion i alle flercellede organismer. Apoptotisk degeneration af neuroner og neurondød er fundamentale, naturlige processer, som dog også er ansvarlige for kliniske manifestationer af flere forskellige neurologiske sygdomme. Sygdommene inkluderer Alzheimers sygdom, Parkinsons sygdom, parkinsonisme og cerebral iskæmi. Ved denne proces aktiveres caspaser, der sker DNA fragmentering og specifikke morfologiske ændringer af cellerne. Oxidative mekanismer, induktion af ROS og oxidativt stress, er centrale elementer for senere induktion af apoptose (Ladefoged et al. 2000; Kannan & Jain 2000; Mattson et al. 2000; Mattson et al. 2001). Ændringer i mitocholdrial respiration via complex-1 i den oxidative phosphorylering, caspase aktivering, DNA fragmentering (Tatton 2000) og morfologiske ændringer forenelige med apoptose er observeret i postmortem hjerner fra Parkinsonpatienter (Jellinger et al. 2000a,b; Hartmann et al. 2001) og det vides, at dopamin kan fremkalde apoptose primært via ROS induktion efterfulgt af caspase aktivering (Junn & Mouradian 2001). Apoptose involverer både neuroner og gliaceller. Neurondegeneration og -død forårsager reaktivitet i gliacellerne, hvorunder der sker forøget aflejring af glial fibrillary acidic protein (GFAP) i disse (Ladefoged et al. 1995). Det er vist, at mangan kan stimulere caspase-3 aktivitet i pherochromocytom-celler (PC12) (Roth et al. 2000) og apoptose-specifik DNA fragmentering (Hirata et al. 1998). Bestemmelse og påvisning af caspase aktivitet (enzym centralt for apoptose) og apoptotisk nedbrudt DNA ved TUNEL-farvning (histopatologiske parametre apoptose) er vigtige parametre for påvisning af apoptose ved parkinsonisme. Mere end en parameter er nødvendig, så udover disse to anvendes også morfologiske parametre vurderet ved klassisk haematoxylin-eosin (HE) farvning (Ladefoged et al. 2000). Virkningsmekanismer for pesticiders neurotoksicitetPesticider og dopamin: Der er flere undersøgelser som viser dopamin optagelsens centrale betydning for pesticiders påvirkning af det dopaminerge nervesystem (Bougria et al. 1995). Både rotenon (Marey-Semper et al. 1993), chlordecon (Desaiah 1985), diethyldithiocarbamater (Di Monte et al. 1989), fungicidet triadimefon og dets metabolit triadimenol (Walker & Mailman 1996) og designerdrug forureningen MPTP (Bougria et al. 1995; Barc et al. 2001) hæmmer således optagelsen af dopamin i dopaminerge neuroner og kan derved danne basis for regional reduceret dopamin koncentration. Maneb (mangan-ethylen-bis-dithiocarbamat) er et manganholdigt fungicid med udbredt anvendelse. I to tilfælde er der beskrevet udvikling af Parkinssons sygdom hos yngre mænd, som har arbejdet med maneb (Meco et al. 1994). Undersøgelser med oralt doseret maneb viser, at stoffet optages hurtigt fra mave-tarm kanalen. I kroppen omsættes det til en række vandopløselige metabolitter, som omfatter ethylenthiourinstof (ETU) og ethylendiamin (EDA) med flere (Figur 1) (Kontou et al. 2004). ETU er påvist i urin hos mennesker, der sprøjtede med maneb (ATSRD 2000).
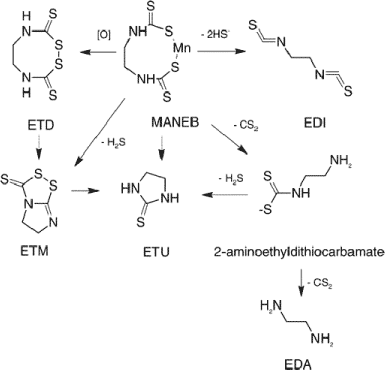
Figur 1. Foreslåede nedbrydningveje af maneb (som monomer) til ethylenthiourinstof (ETU) og ethylendiamin (EDA) med følgende mulige intermediære nedbrydningsprodukter: ethylenthiuram disulfid (ETD), ethylenthiuram monosulfid (ETM), ethylendiisothiocyanat (EDI) samt 2-aminoethyldithiocarbamat (Kontou et al. 2004) Maneb antages at være i stand til at krydse den barrier der normalt begrænser stoffers passage fra blod til hjerne (blod hjerne barrieren, BBB). I dyreforsøg er det vist, at maneb kan påvirke den motoriske aktivitet og forstærke effekten af MPTP på motoriske aktivitet. Dosering med akutte doser af maneb virker CNS-depressivt (centralnervesystem), antageligt via det dopaminerge system (Uversky 2004) Toksikokinetik og vikningsmekanismer for mangans neurotoksicitetNår mangan er optaget i blodet bindes det til transferrin og plasmaproteiner. Mangan med valens tre bindes til transferrin, hvorimod divalent mangan bindes til albumin og -2-makroglobulin. Bundet mangan vil kunne transporteres til lever og optages i levercellerne. Fra leveren vil mangan enten blive udskilt via galden eller blive transporteret med blod til andre væv, inklusiv hjernen. Mangan kan passere udenom BBB i plexus choroidea og ophobes her. Ved høje mangankoncentrationer i plasma transporteres det videre til cerebrospinalvæsken og optages herfra til hjernevæv (Aschner 2000a,b). Der er foreslået adskillige transportmekanismer for mangan over blod-hjerne barrieren afhængigt af oxidationstrin. Trivalent mangan passerer BBB via en transferrinreceptor medieret endocytose (Arbejdsmiljø-instituttet 2004) og divalent mangan optages enten som fri ion eller via non-specifikke transportmekanismer, hvor det konkurrerer med bl.a. calcium og jern (Aschner 2000a,b). Når mangan er lokaliseret i hjernen, enten via transport i plexus choidea eller ved transport over BBB, ophobes det primært i astrocytterne, fordi disse indeholder glutamin systhetase (Aschner 1999), som er et vigtigt intracellulært bindingsprotein for mangan. Optagelse i neuronerne finder sted via ukendte mekanismer (Malecki et al. 1999). Ved inhalation kan mangan udover absorption i luftvejene også komme ind i hjernen via lugtenerven til olfaktorisk cortex. Undersøgelser hos rotter viser, at inhalation af mangan medfører større akkumulation i centralnervesystemet, end når mangan optages fra mave-tarmkanalen (Aschner 2000a,b). Den mængde som transporteres videre herfra er afhængig af mængden i lugtekolberne (Tjalve & Henriksson 1999). Nyere undersøgelser påviser, at mangan subcellulært opkoncentreres i mitochondrierne (Zhang et al. 2003a,b). Akkumulering af mangan i hjernen er regions-selektiv (Oversigt over undersøgelser af dosering med mangan og efterfølgende mangankoncentration i hjernen) med hovedvægt på basalganglierne (St-Pierre et al. 2001; Erikson et al. 2004b), herunder corpus striatum (Roels et al. 1997; Lai et al. 1999; Montel et al. 2001; Gwiazda et al. 2002; Baek et al. 2003). Magnetic resonance imaging (MRI) af hjerner hos mangan-intoksikerede personer har vist speciel akkumulering i basalganglierne (globus pallidus) (Nelson et al. 1993). Dette bekræftes af forsøg med eksponerede aber (Bird et al. 1984). Hos mennesker forårsager mangan i store doser neurokemiske og neuropatologiske ændringer specielt i globus pallidus, som er en del af basalganglierne, hvilket resulterer i symptomer på parkinsonisme via ikke afklarede mekanismer. Oversigt over undersøgelser af dosering med mangan og efterfølgende mangankoncentration i hjernen Mangan og dopamin: Selektiv effekt af mangan på det dopaminerge system og mangan-induceret mitochondriel dysfunktion er begge vigtige elementer for mangans neurotoksiske effekt (Verity 1999). Dette er vist i både laboratoriedyr og i mennesker (Bird et al. 1984). Der er rapporteret forskellige effekter på dopamin koncentrationen (Oversigt over dosering med mangan og effekt på dopaminkoncentrationen i hjernen). En bemærkelsesværdig effekt i relation til Parkinsons sygdom er reduktion i corpus striatum, hvilket er vist i både mus, rotter og aber (Autissier et al. 1982; Gianutsos & Murray 1982; Bird et al. 1984; Kawata 1990; Komura & Sakamoto 1992; Ingersoll et al. 1995, 1999). I andre undersøgelser er der vist øget koncentration (Chandra et al. 1983; Ali et al. 1985; Desole et al. 1995) og ikke påvirket koncentration (Witholt et al. 2000; Dorman et al. 2000; Gwiazda et al. 2002; Baek et al. 2003; Ali et al. 1995). Data fra tilgængelige undersøgelser viser, at mangandoseringsregimen og manganspeciering er meget centrale for absorption, fordeling og effekt af mangan i hjernen (ATSDR 2000). Med den rette absorption og fordeling i hjernen synes effekten at blive en reduktion i dopaminkoncentrationen (ATSDR 2000). Effekter på dopamin optagelsen i nervevæv fra laboratoriedyr er ikke entydige: in vitro undersøgelser er der påvist både reduceret (Lai et al. 1981; Chandra et al. 1984; Lai et al. 1984; Hussain et al. 1987) og forøget optagelse (Leung et al. 1982). En relevant, nyere dansk undersøgelse med hjerne-scanning af mennesker har derimod vist normalt optagelse af dopamin i striatum hos mangan eksponerede patienter med klinisk dokumenterede symptomer på parkinsonisme (manganisme), hvilket er i modsætning til hvad der ses hos patienter med Parkinsons sygdom (Arlien-Søborg 2001). Oversigt over dosering med mangan og effekt på dopaminkoncentrationen i hjernen Mangan og aminosyrer: En række nyere undersøgelser (Tomas-Camardiel et al. 2002; Erikson & Aschner 2003) samt personlig kontakt (Mikael Aschner 2004) har peget på, at aminosyrer med signalstoffunktion og enzymet glutamat decarboxylase (GAD) kan være vigtige virkningsmekanismer for manganinduceret parkinsonisme. Kombinationseffekter mellem mangan og pesticiderDer er således indikationer for, at nogle af virkningsmekanismerne i forbindelse med mangans og pesticiders neurotoksicitet er forskellige og at der kan være sammenfald i andre. A priori må man forvente, at der er et poteniale for en kombinationseffekt mellem mangan og pesticider via både fælles og forskellige virkningsmekanismer. 2.4 Valg af effektparametreDet er vigtigt at kunne påvise tidlige indikationer for Parkinsons sygdom. I dette afsnit beskrives og begrundes valg af de effektparametre, som anvendes i projektets undersøgelser. Signalstoffer og aminosyrer med signalfunktionParkinsons sygdom er forbundet med neurodegeneration i det dopaminerge system ledsaget af dramatisk fald i hjernens indhold af dopamin, specielt i corpus striatum. I en række undersøgelser i dyremodeller er der påvist mangan-inducerede ændringer i det dopaminerge nervesystem. Det må således forventes, at det er ændringer i det dopaminerge nervesystem, som på sigt vil medføre de neurologiske symptomer, som ses hos Parkinson patienter. Derfor undersøges ændringer i regionale koncentrationer af dopamin. Effekter på andre dele af hjernen hvori der anvendes andre signalstoffer undersøges via de dertil relaterede signalstoffer (noradrenalin, 5-hydroxytryptamin, glutamat, taurin, GABA) (Newland 1999; ATSDR 2000). Nyere undersøgelser samt personlig kontakt (Mikael Aschner 2004), har medført, at projektet integrerer supplerende analyser af aktiviteten af enzymet glutamat decarboxylase (GAD) som mulig virkningsmekanisme for manganinduceret parkinsonisme (Tomas-Camardiel et al. 2002; Erikson & Aschner 2003). CholinesteraserAcetylcholinesterase spalter og inaktiverer signalstoffet acetylcholin (ACh) når dette frigives ved impulsledning i det cholinerge nervesystem. Når dette enzym hæmmes i en organisme, forlænges effekten af ACh, hvilket fører til den neurotoksisk/letale effekt, som er baggrunden for flere pesticiders virkning. Mange pesticider hæmmer aktiviteten af AChE i hjernen (ATSDR 2000). Andre cholinesteraser kan også hæmmes af pesticider, f.eks butyrylcholinesterase (BuChE) (Clegg & van Gemert, 1999a,b). Hertil kommer at case-stories har vist at organofosfater kan bidrage til udvikling af Parkinsons sygdom (Davies et al. 1978). ProlaktinHypofysens sekretion af hormonet prolaktin reguleres (hæmmes) af det dopaminerge system og af mange hormoner. En stigning i plasma prolaktin koncentration kan anvendes som indirekte biomarkør for kemikalieinduceret reduceret dopaminerg hæmning i CNS (Manzo et al. 1996; Mutti & Smargiassi 1998; Smargiassi & Mutti 1999). Det er derfor bemærkelsesværdigt, at prolaktin koncentrationen i plasma netop har vist sig forøget hos arbejdere eksponeret for mangan (Alessio et al. 1989; Mutti et al. 1996; Mutti & Smargiassi 1998; Smargiassi & Mutti 1999; Niu et al. 2001). Der findes ingen relevante undersøgelser vedrørende manganinduceret øget prolaktin koncentration i laboratoriedyr. Der findes flere undersøgelser af pesticiders effekt på plasma prolaktin koncentrationen i forbindelse med studier af pesticiders østrogene effekt. Denne hormonale effekt gør imidlertid ekstrapolation fra effekt induceret af sådanne pesticider på plasma prolaktin koncentrationen til effekt på det dopaminerge system meget kompleks (Ali et al. 1982; Lafuente et al. 2000). Caspase-3 aktivitetSom caspase er valgt caspase-3, fordi denne er en central caspase, som udgør ”point of no return” for apoptose, dvs, når caspase-3 er aktiveret vil cellen undergå apoptotisk celledød (Ladefoged et al. 2000). α-synucleinUnder neuronernes degeneration hos patienter med ideopatisk Parkinssons sygdom dannes fibrillære cytoplasmatiske inklusioner, kendt som Lewy bodies, som blandt andet indeholder proteinet α-synuclein (Gibb & Lees 1988; Marsden 1994; Baba et al. 1998). α-synuclein tilhører en nyopdaget gruppe af proteiner, som mistænkes for at kunne ophobes og aflejres i neuroner (amyloidose) og derved bidrage til udvikling af neurodegenerative sygdomme (Trojanowski et al. 2002). I velkendte modeller for Parkinsons sygdom som f.eks MPTP- og rotenon-modellen har det vist sig, at der kan induceres dannelse af inklusionslegemer, som indeholder α-synuclein (Bohlen & Hallbach 2004). En del af forklaringen på denne ophobning er mangel på autofagi af α-synuclein (Cuerco et al. 2004) Det har også vist sig, at mutation i α-synuclein-genet fører til selektiv akkumulering af dette protein i dopaminerge neuroner i substantia nigra hos parkinsonpatienter (Lee et al. 2001). Meget tyder på, at α-synuclein øger cellernes følsomhed for kemikaliers toksicitet (Kanda et al. 2000; Ball 2001; Lee et al. 2001). Der findes ingen relevante undersøgelser af effekten af pesticider (rotenon dog undtaget) eller mangan på α-synuclein. Koncentrationen af dette protein bestemmes ved kvantitativ western blot og påvises ved immunhistokemiske farvemetoder. SynaptophysinSynaptophysin er det hyppigst forekommende integrerede membranprotein i de små presynaptiske vesikler, som indeholder signalstoffer. Det findes i alle centrale og perifere neuroner samt neuroendokrine celler. Dette protein bruges generelt som en synapsespecifik markør. Synaptophysin koncentrationen anvendes som markør for antallet af synapser (kontaktpunkter mellem neuroner). Koncentrationen bestemmes ved kvantitativ western blot. ActinActin er et af de mest velbevarede proteiner gennem arternes udviklingshistorie og er sammen med myosin det hyppigst forekommende protein i cellestrukturer. Det findes i mange forskellige celletyper og vævstyper, og er involveret i de fleste cellulære processer. På grund af det generelt høje ekspressionsniveau i de fleste vævs- og celletyper bruges dette protein som kontrol og normaliseringsparameter for påsat mængde væv i western blot undersøgelser. GFAPVævsbeskadigelser og beskadigelser i specifikke celletyper i CNS forårsager astrocytreaktivitet. Dette kan følges ved kvalitativ og kvantitativ analyse af det astrocyt specifikke protein gliafibrillært surt protein (GFAP). Ved immunoassay-analyser er det demonstreret, at dette protein kan anvendes som markør for dosis-, tids- og regionsafhængige beskadigelser forårsaget af forskellige neurotoksiske stoffer på både neuroner og gliaceller (O’Callaghan 1993; O’Callaghan et al. 1995). Ændret GFAP ekspression sker både efter massive beskadigelser ledsaget af celletab forårsaget af både apoptose og nekrose, og efter mindre beskadigelser som f. eks. tab af nerveterminaler og specifikke neuroner i en specifik region forårsaget af MPTP (O`Callaghan et al. 1990a,b), pesticider (Deamer et al. 1994), mangan (Zhang et al. 1998; Henriksson & Tjalve 2000) og organiske opløsningsmidler (Lam et al. 2000a,b). GFAP er en uspecifik markør for neurotoksicitet, som ikke siger noget om, hvorvidt det er neuroner eller astrocyter, som påvirkes direkte af neurotoksiner. Immunhistokemisk farvening er en meget velevalueret metode, som anvendes som supplement til traditionelle histopatologiske farvemetoder til dokumentation af skader på nervesystemet. TyrosinhydroxylaseTyrosinhydroxylase (TH) er det hastighedsbestemmende enzym i syntesen af dopamin og noradrenalin og kan således anvendes som markør for effekt på det dopaminerge og noradrenerge nervesystem. Det har bl.a. fundet anvendelse i MPTP dyremodeller for Parkinsons sygdom (Kurosaki et al. 2004). Histopatologiske undersøgelserSom udgangspunkt for undersøgelser af morfologiske og histologiske ændringer i hjernen foretages HE farvninger af snit skåret sagittalt og coronalt eller af specielle tværsnit til brug ved studierne af ændringer i corpus striatum og substantia nigra. Der foretages immunhistokemiske farvninger for GFAP og TH, samt TUNEL-farvning. De de to sidstnævnte anvendes som markør for apoptose. Der foretages også immunohistokemisk farvning for α-synuclein. 2.5 anvendte effektparametre og hvad de er markør forNedenfor ses en oversigt over de effektparametre, som anvendes i projektets undersøgelser. Herudover angives hvad stofinduceret ændring i hver enkelt effektparameter viser effekt på.
2.6 Rotten som modelDer er i neurotoksikologiske undersøgelser et stort behov for at udvikle og evaluere dyremodeller, som kan belyse virkningsmekanismerne for kemikalie-induceret neurotiksicitet. I en velegnet dyremodel til undersøgelser af Parkinsons sygdom skal der udtrykkes og kunne induceres mange neurokemiske, histologiske, kliniske og adfærdsmæssig karakteristika for Parkinsons sygdom. Kan dette ikke opnås i tilfredsstillende grad med en model, må flere komplementere hinanden. Model med 6-hydroxydopamin: Dette er den tidligst anvendte model til studier af årsager til Parkinsons sygdom. Modelstoffet forårsager tab af dopaminerge neuroner i corpus striatum og virkningsmekanismen antages at være dannelse af ROS (Tolwani et. al. 1999). Model med MPTP: Denne model blev introduceret i 1980`erne efter at et antal unge stofmisbrugere udviklede Parkinsons sygdom efter intravenøs injektion af syntetisk heroin forurenet med MPTP. MPTP er ikke toksisk i sig selv men passerer let BBB og omdannes derefter til det aktive toksin MPP+ (1-methyl-4-phenylpyridin-ionen), som selektivt transporteres ind i de dopaminerge neuroner og ophobes i disses mitochondrier, hvor det hæmmer den oxidative fosforylering på complex-1 niveauet og forårsager dannelse af ROS. Modellen er i stand til at inducere de karakteristiske træk ved idiopatisk Parkinsons sygdom (O’Callaghan et al. 1990a,b; Baek et al. 2003). En væsentlig ulæmpe ved denne model er, at MPTP er ekstremt neurotoksisk for mennesker, hvilket frembyder alvorlige tekniske problemer med dosering, opstaldning og håndtering af laboratoriedyr. Model med rotenon: Dette er en nyere model, som er taget i anvendelse og baserer sig på en styret, kontinuert intravenøs injektion af pesticidet rotenon, som er et alment brugt fungicid, der virker som en effektiv hæmmer af compleks-1 og derved fører til dannelse af ROS (Betarbet et al. 2000). Model med paraquat og maneb: Denne model baserer sig på at dosere en kombination af paraquat og maneb (Uversky 2004). Virkningsmekanismen er ikke endeligt klarlagt, men er formentlig en påvirkning af det dopaminerge nervesystem uden nødvendigvis at medføre ændringer i koncentrationen af dopamin i corpus striatum. Det antages, at maneb hæmmer glutamat transporten og ødelægger dopamins optagelse og frigivelse fra neuronerne (Thiruchelvam et al. 2002a,b). En yderligere virkningsmekanisme for maneb kan være, at det modulerer forsvaret mod ROS (Barlow et al. 2005). I litteraturen diskuteres det også om interaktionen kan skyldes en toksikokinetisk (stoffers optagelse, fordeling, omdannelse og udskillelse) ændring af regionale koncentrationer af paraquat forårsaget af dosering med maneb (Barlow et al. 2003; Barlow et al. 2004). Model med mangan: Det har vist sig at doseringsvej, doseringshyppighed og -længde udover specieringen af mangansalte er af afgørende betydning for den fordeling af mangan, der finder sted i hjernen hos rotten og for de neurokemiske ændringer dette medfører (ATSDR 2000). En toksikokinetisk undersøgelse af dosering med MnO2 både intraperitonealt og intratrachealt (doseret direkte i luftrøret) har demonstreret øget indhold af mangan i blod og i forskellige hjerneregioner herunder corpus striatum (Roels et al. 1997). Oral dosering viser, at reguleringen af mangans absorption kan ”overloades” og føre til forøget koncentration i hjernen og ændringer i adfærd og signalstof metabolisme i laboratoriedyr (ATSDR 2000). Ved inhalation og oral dosering af uorganisk mangan er der beskrevet kliniske symptomer både hos mennesker og laboratoriedyr. Ved inhalation, oral dosering og ved dermal applikation ses kliniske symptomer hos mennesker, som også ses ved oral og dermal dosering hos laboratoriedyr (ATSDR 2000). Intraperitonal injektion af mangansalte er en relevant doseringsvej som alternativ til teknisk besværlig inhalationsdosering i relation til effekter på det dopaminerge nervesystem (ATSDR 2000). Rotten er egnet til at undersøge manganinducerede neurokemiske ændringer og til generelt at studere mekanismen for den neurotoksiske effekt af mangan (Newland 1999). Sammenfattende konkluderes, at rotten ved dosering med modelstoffer, mangan og pesticider er i stand til at udtrykke mange af de karakteristika som ses ved Parkinsons sygdom, dette gælder såvel neurokemiske, histologiske, kliniske og adfærdsmæssige. Derudover gælder, at de fleste af de toksikologiske undersøgelser, der anvendes til at vurdere de sundhedsmæssige aspekter ved brug af pesticider traditionelt udføres med rotten som forsøgsdyr. Endelig er rotten den praktisk bedst egnede model, den man har størst erfaring med og mest referencedata fra. Derfor anvendes rotten som dyremodel i dette projekt. Som en kontrol af dens anvendelighed indlægges en delundersøgelse, hvori det kontrolleres, at unilateral intrakranial injektion med 6-OHDA ved corpus striatum medfører signifikant reduceret dopaminkoncentration heri. 3 Undersøgelsesdesign
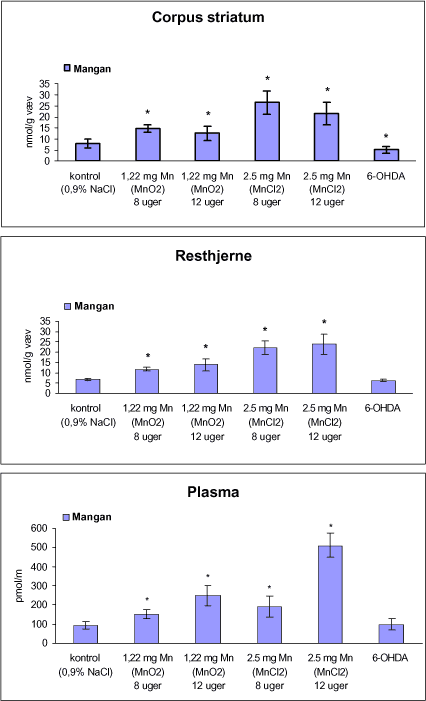
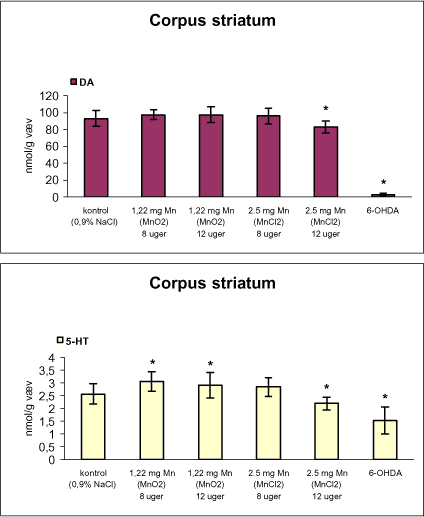
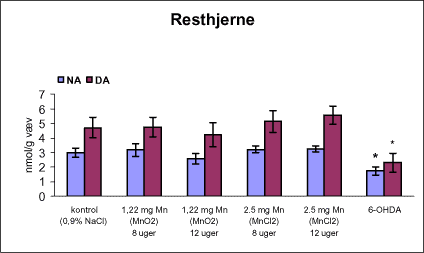
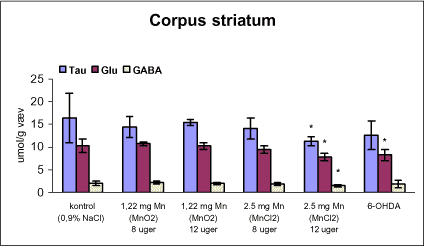
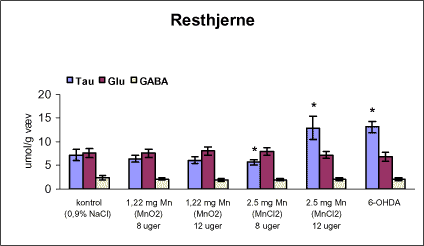
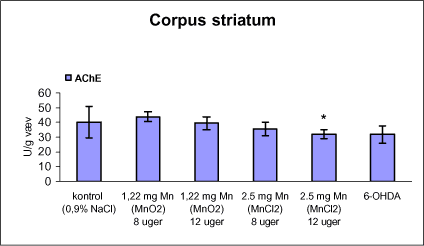
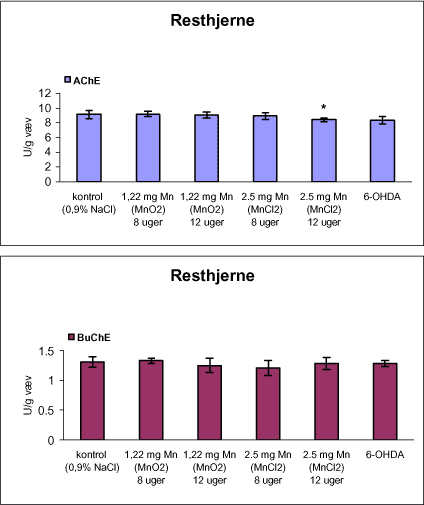
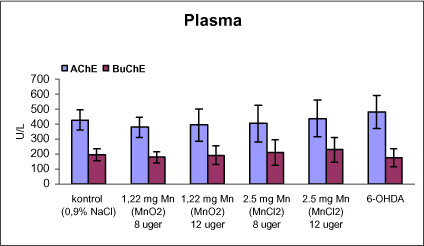
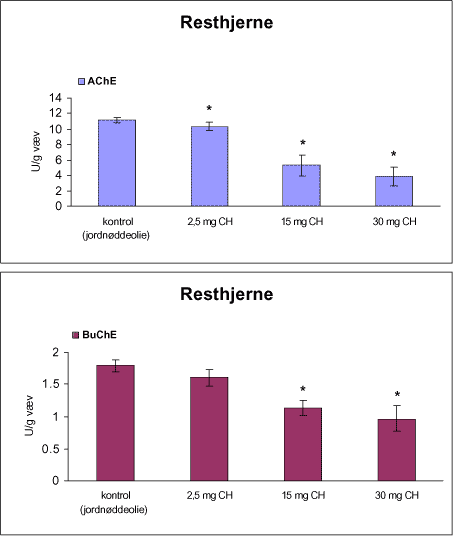
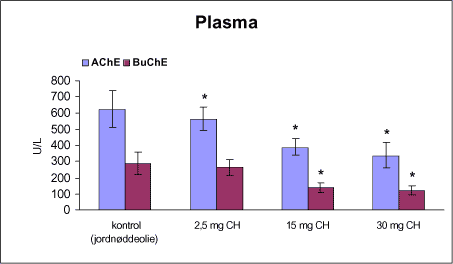
3.1 Oversigt over projektets undersøgelserOversigten viser et flow-diagram over projektets undersøgelser. I en række præliminære studier blev det undersøgt om dyrerne kunne tåle dosering med mangandioxid, manganklorid, chlorpyrifos, maneb og den valgte kombinationsbehandling. Det blev undersøgt om speciering og doseringslængde af mangansalte havde betydning for effekter på de udvalgte neurokemiske parametre og for deponering af mangan regionalt i hjernen. For chlorpyrifos’ og manebs vedkommende blev der gennemført dose-range undersøgelser, som anvendtes som basis for valg af doser i kombinationsundersøgelsen. Klik her for at se illustration over projektets undersøgelser 3.2 ManganundersøgelserDer valgtes intraperitoneal injektion af mangansalte for at omgå de homeostatiske mekanismer, som regulerer/begrænser absorptionen fra mave-tarmkanalen og fordi subkutan injektion kun medfører ringe absorption og tillige har stor lokalirriterende effekt ved injektionsstedet. Herudover har intraperitonal injektion vist sig at være en relevant, alternativ doseringsvej til inhalationsdosering (ATSDR 2000). Præliminære undersøgelser med dosering med mangandioxidDer er foretaget omfattende toksikokinetiske undersøgelser af dosering med MnO2 (Roels et al. 1997). I disse var dosis 1,22 mg mangan/kg legemsvægt (som mangan i MnO2) svarende til 1,93 mg MnO2/kg legemsvægt. Denne dosering blev valgt som udgangspunkt for mangandosering. Daglig intraperitoneal dosering i 7 dage med kommercielt mangandioxid: I første undersøgelse blev det studeret, hvorledes forskellige doser kommercielt tilgængeligt mangandioxid doseret dagligt intraperitonealt gennem 1 uge klinisk påvirkede rotterne. Dette var nødvendigt for at kunne fastsætte, hvilke dosis-muligheder der var for dosering af længere varighed. Der blev foretaget intraperitoneal dosering af Wistar hanrotter hver dag i 7 dage med tre forskellige MnO2 doser (1,22, 3,0 eller 5,0 mg mangan/kg legemsvægt). Der anvendtes kommercielt tilgængeligt mangandioxid (Sigma, M3138). Der var 6 dyr per gruppe. Der blev ikke foretaget nogen kemiske eller neurokemiske analyser. Intraperitoneal dosering i 4 uger med fintkornet mangandioxid: Denne præliminære dose-range undersøgelse blev gennemført som et 4 ugers intraperitonealt doseringsforsøg ved dosering med 1,22 mg mangan/kg legemsvægt een eller to gange/uge eller med 3,0 mg/kg legemsvægt 1 gang/uge under anvendelse af en fintkornet MnO2-præparation (Roels et al. 1997). Der var 6 dyr per gruppe. Fra kontrolgruppens dyr blev der foretaget mikrodissektion i corpus striatum og substantia nigra og analyser for dopamin og protein heri. Dose-range undersøgelsenEfter disse undersøgelser blev der foretaget et andet, mere omfattende dose-range studium, hvori det undersøgtes om det var muligt at dosere med MnO2 og MnCl2 i 8 og 12 uger, hvilke doser som kunne anvendes, og om dette påvirkede neurokemiske parametre i corpus striatum og resthjernen, specielt dopamin koncentrationen. Herudover undersøgtes det, hvordan mangan speciering og doseringsvarighed påvirkede vævskoncentrationen af mangan i corpus striatum, resthjerne og plasma. En supplerende gruppe doseret med 6-OHDA skulle sikre, at der kunne induceres og dokumenteres en reduceret dopamin koncentration i corpus striatum. Det var oprindeligt planlagt at dosere med 15 mg mangan/kg legemsvægt som manganklorid, men allerede første dosering gav så alvorlige problemer for dyrene, at det blev besluttet ikke at fortsætte med denne dosis. Efter en seponeringsperiode valgtes at genstarte manganklorid doseringen med en dosis på 2,5 mg mangan/kg legemsvægt/dag. Dette forsinkede doseringen med manganklorid, og der måtte derfor fremskaffes en ekstra kontrolgruppe på 12 dyr for at få kontroldyr, som blev aflivet på samme tidspunkt og var alderssvarende med de manganklorid doserede dyr. Dose-range undersøgelsen foregik således: Der anvendtes Sprague Dawley hanrotter. Der blev foretaget intraperitoneal dosering med fintkornet MnO2 og med MnCl2. Udover kontroldosering med vehikel (0,9% NaCl) blev der doseret med 1,22 mg mangan (som MnO2)/kg legemsvægt to gange/uge i 8 og 12 uger og med 2,5 mg mangan (som MnCl2)/kg legemsvægt/dag i 8 uger eller 12 uger. Der var 12 dyr pr. gruppe. Der blev udtaget poolet (højre plus venstre) corpus striatum og resthjerne fra alle dyr, undtagen dyrene i den supplerende 6-OHDA gruppe, hvorfra højre og venstre corpus striatum blev behandlet hver for sig. Koncentrationen af mangan blev bestemt i corpus striatum, resthjerne og plasma. Der foretoges neurokemiske analyser i corpus striatum og resthjerne af koncentrationen af noradrenalin, dopamin og 5-hydroxytryptamin og aminosyrer med signalstoffunktion (glutamat, taurin, GABA) samt af aktiviteten af acetylcholin- og butyrylcholinesterase og koncentrationen af α-synuclein og synaptophysin. Herudover blev koncentrationen af plasmaprolaktin bestemt. Supplerende undersøgelser med højere doser manganklorid og supplement i drikkevandI en række supplerende undersøgelser blev det forsøgt at øge manganoptagelsen ved at øge mangandosis, mangandoseringshyppighed og mangandoseringsvarighed med det formål at øge vævskoncentrationen og dermed effekten af mangan på den striatale dopaminkoncentration. Der blev doseret med manganklorid, idet det letopløselige manganklorid var bedre egnet end det tungtopløselige mangandioxid. Efter dose-range undersøgelsen blev der foretaget supplerende undersøgelser. Hertil anvendtes to højere doser, 5,0 og 7,5 mg mangan/kg legemsvægt/dag, som hver blev doseret uden og med supplement af manganklorid (5 gram/L) via drikkevand. Der var 20 dyr/gruppe. Der blev kun foretaget kliniske observationer af disse dyr. 3.3 ChlorpyrifosundersøgelserOprindeligt var det planlagt at foretage undersøgelsen med chlorpyrifos som en 28 dages undersøgelse med dosering via foderet. Men da en tidligere undersøgelser udført i et andet projekt med chlorpyrifos dosering via foder gav anledning til alvorlige problemer vedrørende homogenietet og stabilitet, blev det i stedet besluttet at dosere subcutant. Udgangspunkt herfor var en artikel, som viste reduceret AChE aktivitet i corpus striatum efter subcutan dosering med 30 mg chlorpyrifos/kg legemsvægt/uge i 4 uger (Huff et al. 2001). Præliminær undersøgelseDer blev udført en indledende undersøgelse for at sikre, at dyrene kunne tåle den planlagte dosering og til at specificere dosisniveauer i det senere dose-range studium. Sprague-Dawley hanrotter blev doseret med vehikel, 2,5 og 30 mg chlorpyrifos/kg legemsvægt/uge subcutant i 12 uger. Der var 4 dyr per gruppe. Dose-range undersøgelsenDose-range undersøgelsen havde til formål at undersøge virkningsmekanismer for chlorpyrifos’ neurotoksiske effekt, når chlorpyrifos blev doseres alene og til at fastsætte dosis i kombinationsundersøgelsen. Sprague Dawley hanrotter blev doseret med vehikel, 2,5, 15 eller 30,0 mg chlorpyrifos/kg legemsvægt/uge subcutant. Der var 12 dyr pr. gruppe til neurokemiske undersøgelser og 12 til histopatologiske undersøgelser. Der blev udtaget poolet corpus striatum og resthjerne fra alle dyr til neurokemiske undersøgelser samt blod. Der foretoges neurokemiske analyser i corpus striatum og resthjerne af koncentrationen af noradrenalin, dopamin og 5-hydroxytryptamin og aminosyrer med signalstoffunktion (glutamat, taurin, GABA) samt af aktiviteten af acetylcholin- og butyrylcholinesterase og koncentrationen af α-synuclein og synaptophysin. 3.4 ManebundersøgelserOprindeligt var det planlagt at foretage dose-range undersøgelsen med maneb som en 28 dages undersøgelse ved dosering via foder. Da en tidligere undersøgelser udført i et andet projekt med mancozeb dosering via foder gav anledning til alvorlige problemer vedrørende homogenietet og stabilitet, blev det i stedet besluttet at dosere maneb subkutant. Præliminær undersøgelseDer blev foretaget en indledende undersøgelse for at sikre, at dyrene kunne tåle den planlagte dosering og til at specificere dosisniveauer i den endelige dose-range undersøgelse. Det var oprindeligt planlagt at dosere med ugentlige maneb doser, som var molækvivalente med den MnCl2 dosis, som blev fastlagt i dose-range undersøgelsen for mangan. En enkeltdosis på 11,9 mg maneb/kg legemsvægt svarer til den fastlagte daglige mangandosis på 2,5 mg manganion/kg legemsvægt. Som udgangspunkt for den ugentlige manebdosis valgtes derfor doserne 15, 30, 60 eller 120 mg/kg legemsvægt/uge subkutant. Der var 6 dyr/gruppe. Da dyrene ikke kunne tåle disse doseringer blev kontrolgruppens 6 dyr doseret intraperitonealt med 0, 15 eller 30 mg maneb/kg legemsvægt/uge én gang om ugen i 12 uger for at undersøge om dette var et bedre doseringsregie. Denne dosering kunne dyrene tåle uden sundhedsmæssige problemer. Dose-range undersøgelsenDose-range undersøgelsen med maneb havde til formål at undersøge virkningsmekanismer for manebs neurotoksiske effekt, når det blev doseret alene og til at fastsætte dosis i kombinationsundersøgelsen. Eventuelle effekter induceret af maneb skulle sammenlignes med dem, der blev induceret af mangansalt alene. Der blev doseret intraperitonealt med 0; 7,5; 15 og 30 mg maneb/kg legemsvægt/uge i 12 uger. Der var 10 dyr pr. gruppe til mangananalyser og neurokemiske undersøgelser og 12 til histopatologiske. Der blev udtaget poolet corpus striatum og resthjerne fra alle dyr til neurokemiske undersøgelser samt blod. Der foretoges neurokemiske analyser i corpus striatum og resthjerne af koncentrationen af noradrenalin, dopamin og 5-hydroxytryptamin og aminosyrer med signalstoffunktion (glutamat, taurin, GABA) samt af aktiviteten af acetylcholinesterase og butyrylcholinesterase og koncentrationen af α-synuclein og synaptophysin. Mangan blev analyseret i poolet corpus striatum. 3.5 KombinationsundersøgelserDenne undersøgelse havde til formål at undersøge virkningsmekanismer for mangans, chlorpyrifos og manebs neurotoksiske effekt i relation til parkinsonisme, når de blev doseret alene og i kombination. Doseringsregimen blev valgt på basis af resulteterne i de foregående dose-range undersøgelser med mangan, chlorpyrifos og maneb doseret alene. Præliminær kombinationsundersøgelseDer blev udført en indledende undersøgelse for at sikre, at dyrene kunne tåle den planlagte kombinationsdosering, fordi sådan kombinationsdosering ikke er foretaget tidligere i projektet endsige beskrevet i litteraturen. Der foretoges kun klinisk observationer af dyrenes sundhedstilstand. Kontrolgruppen blev doseret intraperitonealt med 0,9% NaCl/dag. Kombinations-gruppen blev doseret intraperitonealt med 2,5 mg Mn/kg/dag; subcutant med 15 mg chlorpyrifos/kg/uge og intraperitonealt med 10 mg maneb/kg/uge. Der blev doseret i 12 uger. Der var 10 dyr pr. gruppe. KombinationsundersøgelsenDa dyrene kunne tåle denne kombinationsbehandling valgtes efter 10 ugers dosering at iværksætte kombinationsundersøgelsen med samme doser. I kombinationsundersøgelsen blev der doseret således:
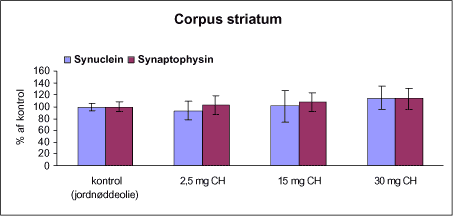
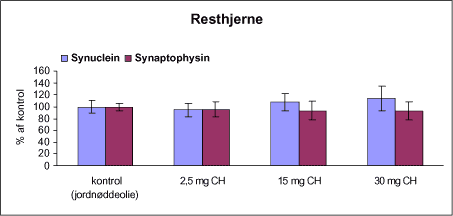
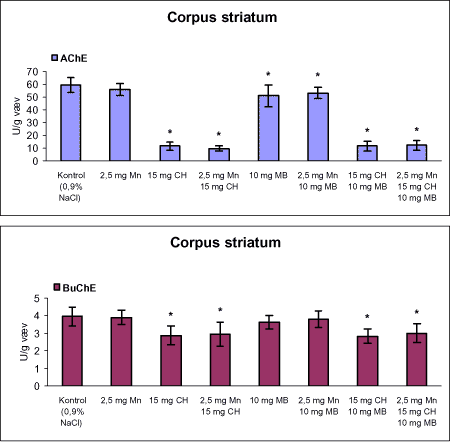
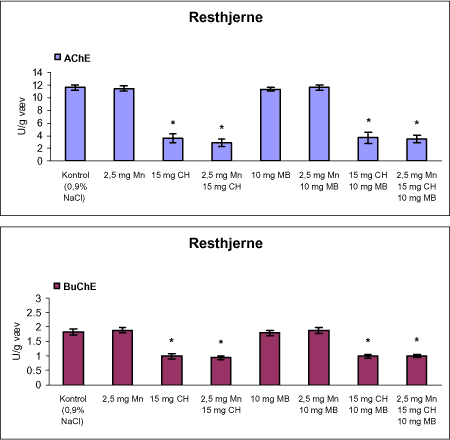
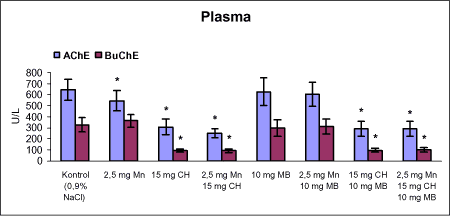
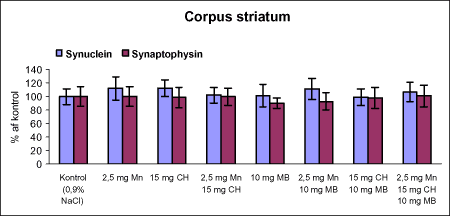
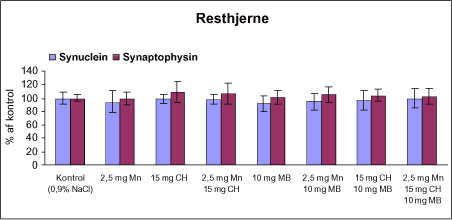
Der var 10 dyr til neurokemi og mangananalyser og 10 dyr til histopatologi. Der blev udtaget poolet corpus striatum og resthjerne fra alle dyr til mangananalyser og neurokemiske analyser samt blod. Der foretoges neurokemiske analyser i corpus striatum og resthjerne af koncentrationen af noradrenalin, dopamin og 5-hydroxytryptamin og aminosyrer med signalstoffunktion (glutamat, taurin, GABA) samt af aktiviteten af enzymer (acetylcholinesterase, butyrylcholinesterase, caspase-3, glutamatdecarboxylase) og koncentrationen af α-synuclein og synaptophysin. Herudover blev koncentrationen af plasmaprolaktin bestemt. 4 Materialer og metoder
I dette kapitel beskrives detaljerede forhold vedrørende laboratoriedyr, udtagning og præparation af prøver samt analyser heraf. 4.1 Laboratoriedyr og dyreholdI en enkelt indledende undersøgelse med mangandosering anvendtes Wistar hanrotter. I alle andre undersøgelser anvendtes 6 uger gamle Sprague Dawley hanrotter (Tac:SPRD N@Mol outbred rat, SPF) fra M&B A/S, DK-8680 Ry, Danmark. Straks efter ankomst til dyrestald blev dyrenes sundhedstilstand kontrolleret, de blev randomiseret og fordelt i hold med samme gennemsnitlige legemsvægt. Før doseringsstart blev dyrene akklimatiseret mindst en uge. De gik 2 per bur (Macrolon) i dyrerum med reguleret, konstant klima. Rumtemperaturen var 22±1°C, den relative luftfugtighed 55%±5% og der var en 12 timers lys:mørke cyklus. Rotterne blev fodret med standardfoder (Altromin No. 1324) og citronsyresyrnet vand (pH 3,5 for at hindre vækst af mikroorganismer) begge ad libitum. Dyrene blev tilset 2 gange dagligt af staldpersonalet. Kliniske observationer blev straks rapporteret og tilset af dyrlæge. 4.2 Dyreetik og antal anvendte dyrAlle anvendte dyr blev doseret og behandlet i henhold til gældende lovgivning på området. Af dyreetiske hensyn anvendes i alle undersøgelser det minimale antal rotter skønnet tilstrækkeligt til at tillade solid statistisk analyse. Dette skøn var baseret på årelang erfaring med dyreeksperimentelt arbejde. 4.3 Aflivning, udtagning og præparation af blod, hjernevæv og andre organerAflivningRotter blev decapiteret i CO2/O2 narkose. Ved decapiteringen blev der opsamlet så meget blod som muligt. Heparin anvendtes som antikoagulans. Efter forsigtig blanding henstod blodet i isbad indtil plasmapræparation. Præparation af plasmaEfter forsigtig blanding blev blod centrifugeret ved 1000 g ved 0-4°C i 10 minutter, hvorefter plasma nøje blev dekanteret fra. Plasma henstod ved –80°C indtil analyser for mangan, AChE, BuChE eller prolaktin. RandomiseringerVed alle projektets undersøgelser blev der skiftevis aflivet dyr fra hver enkelt gruppe, aldrig flere/alle dyr fra samme gruppe samtidigt. Mangananalyser, neurokemiske analyser og histopatologiske vurderinger blev foretaget randomiseret, det vil sige, prøverne var blindet for laborant og andet personale. Mikrodissketion af små hjerneskriverI forbindelse med en indledende undersøgelse blev der udviklet metoder til reproducerbar isolation af små, cirkulære vævsskiver (micropunch) fra hjernens corpus striatum og substantia nigra. Hertil blev isafkølet hjerne placeret i formstøbt, isafkølet metalblokmatrice med 1 mm skæreriller vinkelret på hjernens længdeakse. Svarende til lokalisation af corpus striatum og substantia nigra blev der udskåret 1 mm tykke skiver af hjernevæv vinkelret på længdeaksen. Disse skiver blev lagt på en isafkølet metalblok. Herefter blev der med ”propbor” udstanset en cirkulær skive med en diameter på 2 mm (corpus striatum) eller 1 mm (substantia nigra). Disse vævsprøver var for små til at blive vejet uden kompromitterende tekniske problemer (afdampning, vejning tog for lang tid forhold til dopamin’s stabilitet). I stedet overførtes skiverne umiddelbart efter udstansning til 0,2 M HClO4 for at stabilisere signalstofferne. Dette blev straks herefter ultrasonikeret, centrifugeret ved 10000 g i 10 minutter og delt i supernatant og sediment. Supernatanten blev anvendt til dopamin analyse, sedimentet til protein analyse efter opløsning i 0,1 M NaOH. Prøverne henstod ved –80°C indtil disse analyser. Regional dissektion af corpus striatum og resthjerneHjerner og hjernedele, her specifikt corpus striatum, blev udtaget og isoleret som beskrevet af Glowinski & Iversen (1966) og efter vejledning fra NeuroSearch. Ved isolation af corpus striatum udtoges først højre halvdel som blev vejet i iskold 0,32 M sukroseopløsning, derefter venstre halvdel som overførtes til samme glas, som derefter blev vejet. Derved kunne vægt af højre, venstre og poolet corpus striatum udregnes seperat. Herefter blev det fremstillet homogenat af således poolet corpus striatum. Kun fra dyr doseret med 6-OHDA udtoges, vejedes, homogeniseredes og analyseredes højre og venstre halvdel af corpus striatum separat. Dette skyldtes, at doseringen skete ensidigt ved højre corpus striatum. Resthjernen overførtes til afvejet glas med iskold 0,32 M sukrose, hvorefter der blev vejet igen. Heraf fremstilledes sukrosehomogenat. Det var meget vigtigt for efterfølgende analysers kvalitet, at alle disse procedurer skete så hurtigt som overhovedet muligt, og at kølekæden aldrig blev brudt. Homogenisering af hjernevævSukroseopløsning, 0,32 M, med vævsprøver blev hurtigst muligt homogeniseret ved ultrasonikering (Microscan ™) under anvendelse af iskappe. På sektionsstuen blev sukrosehomogenatet hurtigst muligt fordelt til de enkelte analyser og prøvematerialet blev hurtigst muligt præpareret til efterfølgende neurokemiske og kemiske analyser. Dette specificeres nedenfor for hver analyse. Præparation af blindprøver af homogenater til mangananalyserHver dag, der på sektionsstuen blev udtaget hjernevæv til mangananalyser, blev der homogeniseret blindprøver af 0,32 M sukroseopløsning uden corpus striatum og resthjerne. Herved sikredes udover en blindværdi også løbende kontrol af eventuel kontaminering med mangan fra anvendte metalutensilier. Udtagning af andre organerI dose-range undersøgelserne for chlorpyrifos og maneb og i kombinationsundersøgelsen blev der udtaget og vejet lever, nyrer, binyrer, milt, thymus og testikler. 4.4 Kemiske analyserMangananalyserAnalyseprincip og apparatur: Mangan bestemtes i plasma og i udvalgte hjernedele ved mikrobølge-assisteret oplukning i koncentreret salpetersyre efterfulgt af induktivt koblet plasma massespektroskopi (ICP-MS). Dertil benyttedes et særligt ICP-MS instrument med dynamisk reaktionscelle, der eliminerede interferenser i målingen (Sloth & Larsen 2000). Prøvepræparation før analyse: Inden analyse blev der gennemført vådforaskning af hjernehomogenater og af plasma. Prøverne blev forasket med ultraren koncentreret salpetersyre i mikrobølgeovn. Analysekontrol: Til kontrol af nøjagtigheden blev der parallelt med prøverne foretaget genfinding af mangan-standard tilsat prøverne inden foraskning. Kalibrering blev gennemført med en intern standard på 3 koncentrationsniveauer. 4.5 Neurokemiske analyserDe biogene aminer noradrenalin, dopamin og 5-hydroxytryptaminUmiddelbart efter homogenisering tilsattes 1 mL sukrosehomogenat 2 mL 0,5 M HClO4. Dette blev blandet grundigt og opbevaret ved –80°C indtil analyse. Ved analysen blev prøverne tøet op, blandet grundigt og centrifugeret ved 10.000 g i 10 minutter. Supernatanten blev derefter dekanteret fra og anvendt som prøvemateriale. En aliquot tilsattes en opløsning af dihydroxybenzylamin (DHBA) og N--met-5-hydroxytryptamin (N-ω-met-5-HT) til passende response for analytter og interne standarder. DHBA fungerede som intern standard for noradrenalin og dopamin, N-ω-met-5-HT var intern standard for 5-hydroxytryptamin. Koncentrationen af noradrenalin, dopamin og 5-hydroxytryptamin blev målt ved HPLC med elektrokemisk detektion (Lam et al. 1992). 5-hydroxytryptamin blev kvantificeret i uoprenset prøve, noradrenalin og dopamin efter aluminiumoxid oprensning. Analysen foregik ved stuetemperatur på en Hewlett-Packard 1100 HPLC monteret en ESA MD-150 kolonne (3 mm ID x 15 cm, C-18, 5 µm partikelstørrelse)(ID: indre diameter) og en ESA Model 5200A Coulochem II elektrokemisk detektor. Elueringsbufferen havde sammensætningen 75 mM NaH2PO4 , 1,7 mM octansulfonat, 100 µL triethylamin/L, 25 µM EDTA (ethylendiamintetraeddikesyre), 5% acetonitril og var indstillet til pH=3,0 med H3PO4. Flowrate var 0,8 mL/minut. Detektorens ”guard cell” potentiale var +350 mV, og potentialet for elektrode E1 var –150 mV og +220 mV for den analytiske elektrode E2. Der blev kromatograferet i 30 minutter for hver injektion. Denne metode er udviklet og detaljeret bekrevet af Lam et al. 1992. Aminosyrerne glutamat, taurin og GABAUmiddelbart efter homogenisering tilsattes 1 mL sukrosehomogenat 2 mL 0,5 M HClO4. Dette blev blandet grundigt og opbevaret ved –80°C indtil analyse. Her blev prøverne tøet op, blandet grundigt og centrifugeret ved 10.000 g i 10 minutter. Supernatanten blev dekanteret fra og anvendt til aminosyreanalyser. Dette var en HPLC metode, hvorved bl.a. aminosyrer automatisk blev derivatiseret med ortophthalaldehyd on-line umiddelbart før injektion på kolonnen. Derivaterne fluorescerer kraftigt. De blev adskilt på en RP-18 (ESA) søjle, som blev elueret med 0,1 M phosphatbuffer med 25% metanol. Flowrate var 1 mL/minut. Excitations- og emissionsbølge-længderne var henholdsvis 230 nm og 455 nm. Denne metode er udviklet til projektet og endnu ikke publiceret i detaljer. Protein bestemmelseUmiddelbart efter homogenisering blev 100 µL sukrosehomogenat tilsat 1900 µL 0,05 M NaOH. Dette blev blandet grundigt og opbevaret ved –80°C indtil proteinanalyse efter en metode oprindeligt beskrevet af Lowry (1951) og modificeret af Hartree (1972) under anvendelse af bovin albumin fraktion V som standard. Aktivitet af AChE og BuChEUmiddelbart efter homogenisering tilsattes 500 µL sukrosehomogenat 500 µL 2% (v/v) Triton X-100. Dette blev blandet grundigt og opbevaret ved –80°C indtil analyse. Ved analyse blev prøverne tøet op, blandet grundigt hvorefter de henstod ved stuetemperatur i 60 minutter for opløsning af protein- og lipidstrukturer og frigivelse af AChE og BuChE. Derefter centrifugeredes ved 10.000 g i 10 minutter. Supernatanten anvendtes til analyse. AChE aktivitet: Analysen var en modifikation af en oprindelige metode beskrevet af Ellman et al. (1961). Analysen foregik ved 37°C på analyserobot (Cobas Mira). 400 µL buffer med chromogen [Na-phosphatbuffer: 52 mM; 5,5’dithio-bis(2-nitrobenzoic acid) 0,26 mM; pH 7,2] tilsattes 20 µL prøve. Derefter tilsattes 14 µL substratblanding (vandig opløsning af acetylthiocholin iodid, 156 mM). Farveudviklingen ved 405 nm blev registreret som funktion af tid og omregnet til aktivitet (U/L) ved anvendelse af CFAS (Calibrator for Automated Systems®, Roche) som kalibrator. BuChE aktivitet: Analysen var en modifikation af den oprindelige metode beskrevet af Ellman et al. (1961). Analysen foretoges analogt med analysen for AChE, blot var substratet i denne analyse butyrylthiocholin iodid i en koncentration på 218 mM Aktivitet af glutamat decarboxylase (GAD)Der anvendtes sukrosehomogenat til aktivitetsbestemmelse efter en inkubationsmetode, hvorved dannelseshastigheden for GABA udfra glutamat som substrat blev bestemt ved 37°C efter inkubation i 60 minutter (Holdiness 1983; Rossetti et al. 1996). GABA blev kvantificeret ved samme HPLC metode som blev anvendt til aminosyrerne. Aktivitet af caspase-3 aktivitetUmiddelbart efter homogenisering tilsattes 500 µL sukrosehomogenat 500 µL buffer (50 mM HEPES, 1 mM dithiotreitol, 0,1 mM Na2EDTA, 10% glycerol, 0,1% CHAPS, 1% Triton X-100, pH 7,4) tilsat en cocktail af proteasehæmmere (CalbioChem Cat. No. 53134). Dette blev blandet grundigt og opbevaret ved –80°C indtil caspase-3 analyse. Aktiviteten blev målt efter en meget specifik og følsom metode (Dalgaard et al. 2001; Ladefoged et al. 2004). Kort beskrevet foregik det således: Optøet, modificeret sukrosehomogenat blev blandet og centrifugeret ved 30.000 g i 10 minutter ved 4°C. Supernatanten blev dekanteret fra. Efterfølgende pipetteringer og inkubationer ved 37°C skete med analyserobot (RoSys, Plato) som 3-dobbelt bestemmelse. Der anvendtes mikrotiterbakker med 96-brønde. Assay buffer (100 mM NaCl; 50 mM HEPES; 10 mM DTT; 1 mM EDTA; 10% glycerol; 0,1% CHAPS, pH 7,4) blev blandet med prøve og inkuberet med (3 inkubationer) og uden specifik (3 andre inkubationer) caspase-3 hæmmer (Ac-DEVD-CHO, Calbiochem Cat. No. 235420) i 10 minutter. Derefter blev reaktionen startet ved tilsætning af kolorimetrisk substrat (Ac-DEVD-pNA, Calbiochem Cat. No. 235400), hvorfra caspase-3 fraspalter 4-nitroanilin (4-NA), hvilket gav anledning til absorption ved 405 nm. Der blev inkuberet i 60 minutter, hvorefter reaktionen blev stoppet ved tilsætning af stopreagens (0,1 M HClO4) indeholdende den interne standard 3-nitroanilin (3-NA). 4-NA blev kvantiteret på HPLC med 3-NA som intern standard. Analysen foregik ved stuetemperatur på en Hewlett-Packard 1100 HPLC monteret med diode-array detektor, hvor absorptionen blev registreret ved 380 nm. Søjlen var en Merck kolonne (3 mm ID x 25 cm, C-18, 7 µm partikelstørrelse). Kolonnetemperaturen var 22-24°C og elueringsmidlet var en 30% vandig acetonitril opløsning med flowrate på 1 mL/minut. Kvantitativ western blot af α-synuclein, synaptophysin og actinForbehandling af prøver: Sukrosehomogenat blev tøet på isbad og efterfølgende behandlet med ultralyd. Derefter blev homogenat fortyndet på basis af de tidligere proteinanalyser til en ønsket proteinkoncentration ved tilsætning af sample buffer (Bio-Rad Cat. No. 161-0791 og 161-0792) og proteasehæmmer cocktail (Calbiochem Cat. No. 539134). Dette blev kogt 5 minutter på vandbad og centrifugeret (Laemmli et al. 1970). Påsætning på geler: Centrifugerede prøver blev sat på forstøbte geler (Criterion XT 12 % Bis-Tris med 26 brønde, Bio-Rad Cat. No. 345-0119) sammen med proteinmarkører(molekylevægtsstandard) (Bio-Rad Cat. No. 161-0373 og 161-0363). På hver 26 brønds gel blev sat 2 proteinmarkører, 3 standardprøver (fra kontrolhold) af forskellig proteinkoncentration og 21 prøver fordelt på de enkelte hold. Elektroforese, blotning og blokering: Elektroforesen forløb i 2 timer ved et potentiale på 200 V med et Criterion XT-MOPS buffer system (Bio-Rad Cat. No 161-0788) (Laemmli et al. 1970). Efterfølgende overførtes proteiner fra gel til immobiliserende polyvinylidindifluorid membran (PVDF) ved hjælp af en ”semidry”elektroblotter med grafitelektroder (Bio-Rad). Der blev anvendt en transferbuffer indeholdende: 50 mM Tris-base, 40 mM glycin, 0.037 % natrtiumdodecylsulfat og 20% Metanol. Overførslen foregik ved et potentiale på 15 V i 35 minutter. PVDF membranen blev blokeret med 5 % skummetmælk pulver opløst i vaske buffer: 25 mM Tris-HCl, 137 mM NaCl, 0.15 % tween 20 (pH 7.4). Blokeringen foregik natten over ved 4°C (Towbin et al. 1979). Analyse af de enkelte proteiner: Efter blokering blev membranen klippet i to stykker, et som indeholdt α-synuclein og og et som indeholdt synaptophysin. Det første membranstykke blev inkuberet med primært antistof for α-synuclein [polyklonalt aα-synuclein (kanin) fra Lundbeck] i 2 timer, behandlet med sekundært antistof og kvantificeret som beskrevet nedenfor. Det andet membranstykke blev inkuberet i 2 timer med primært antistof for synaptophysin [monoklonalt synaptophysin (mus) fra Neomarkers Cat. No. MS-1227P], med sekundært antistof og kvantificeret (se nedenfor). Herefter blev det strippet, inkuberet i 2 timer med primært antistof for actin [monoklonalt actin (mus) fra SIGMA Cat. No A5441], med sekundært antistof og kvantificeret (se nedenfor). Behandling med sekundært antistof: Efter behandling med primært antistof blev membranen vasket i 3x10 minutter i vaskebuffer, hvorefter der blev inkuberet i 2 timer med det sekundære antistof (kanin anti-mus fra DAKO Cat. No. P0260; ged anti-kanin fra Zymed Cat. No. 81-6120), som var HRP-enzymkoblet (horse radish peroxidase). Derefter blev membranen vasket i 3x10 minutter i vaskebuffer. Kvantificering: Membranen blev herefter inkuberet i 5 minutter med et chemiluminescens substrat kit (Bio-Rad Cat. No. 170-5040), hvorefter luminescensen blev kvantificeret via et imaging system (ChemiDoc Imaging system fra Bio-Rad), så der blev opnået talmæssig beskrivelse af udsendt lys, som i det anvendte koncentrationsområde var ligefrem proportional med proteinmængden i båndet. Kontrol af proteinernes identitet: Molekylvægten på proteiner i bånd fra homogenatprøverne blev kontrolleret udfra proteinmarkøren så det sikredes, at molekylvægten var i overensstemmelse med molekylvægten på de undersøgte proteiner: α-synuclein (17 kDa), synaptophysin (38 kDa) og actin (42 kDa). Reproducerbarhed: Gentagne analyser af samme prøve udført både på samme gel og på forskellige geler viste procentvise standardafvigelser på mindre end 15% for begges vedkommende, hvilket vurderes som tilfredsstillende. Koncentration af prolaktin i plasmaAnalyse for prolaktin i plasma foregik ved hjælp af et kommercielt tilgængeligt enzymimmunoassay kit (Biotrak™) specielt udviklet til analyse af rotteplasma. 4.6 Histologiske og immunhistokemiske undersøgelserDer anvendtes klassisk histokemisk HE farvning til påvisning af histologiske ændringer samt immunhistokemiske farvemetoder til påvisning af GFAP og DNA fragmentering, TUNEL, TH og α-synuclein. Hjernen blev udtaget fra kraniet og overført til formalin. Efter 24 timer blev hjernen gennemskåret med to tværsnit: et ud for corpus striatum og et ud for substantia nigra. Alle farvninger blev udført på 3 tykke snit af formalin fikseret, paraffinindstøbt hjernevæv. Dette blev afparaffineret og rehydreret inden farvningen ved behandling med petroleum i 2x10 minutter, alkohol med faldende koncentrationer fra 99%-70% hvert 5. minut for til sidst at henstå i rindende vand inden farvningen.
Figur 2. Tværsnit af hjernen ud for området indeholdende substantia nigra. SNC: Substantia nigra compacta, SNL: Substantia nigra lateralis, SNR: Substantia nigra reticularis. Klassisk histokemisk haematoxylin-eosin farvningSnittene blev kernefarvet med Mayers haematoxylin (LAB00254 Bie & Berntsen) i 10 minutter efterfulgt af blåning i rindende vand i 10 minutter. Snittene overførtes til bad med eosin i 2 minutter og de blev derefter skyllet kort i rindende vand og dehydreret i alkohol med stigende koncentration fra 70%-99%. Til sidst blev snittene monteret med Eukitt. Immunhistokemisk GFAP farvningDer anvendtes en modificeret metode oprindeligt beskrevet af Ladefoged et al. 2000. Farvningen foregik således: Snittene blev demaskeret i mikrobølgeovn i 0,01 M natriumcitrat-buffer pH 6,0 i 2x5 minutter og derefter afkølet i 20 minutter i bufferen. Snittene blev skyllet i 5 minutter i PBS-buffer. Der blev blokeret for endogen peroxidaseaktivitet med 3% H2O2 i 10 minutter, hvorefter der blev skyllet i skylle-buffer i 3x5 minutter. Uspecifik baggrundsfarvning blev blokeret med 5% svineserum/PBS i 20 minutter. Det primære antistof for GFAP blev fortyndet 1:200 i 5% svineserum/PBS og snittene blev inkuberet hermed natten over ved 4°C. Snittene blev så skyllet i 3x5 minutter i skylle-buffer og inkuberet med EnVision+ polyklonalt antistof i 30 minutter ved stuetemperatur. Der blev skyllet igen i 3x5 minutter i skylle-buffer og derefter fremkaldt i DAB+ (3,3-diaminobenzidine) i 15 minutter Overskydende DAB+ blev fjernes i rindende vand og snittene blev kernefarvet med Mayers hæmatoxylin i 1 minut efterfulgt af blåning i rindende vand i 5 minutter. Snittene blev så dehydreret i alkohol med stigende koncentration fra 70%-99% for til sidst at blive monteret med Eukitt. Immunhistokemisk tyrosin hydroxylase farvningDer anvendtes en ikke publiceret metode udviklet i samarbejde med medicinalfirmaet NeuroSearch. Farvningen foregik således: Snittene blev skyllet i 5 minutter i PBS-buffer. Der blev derefter blokeret for endogen peroxidase aktivitet med 3% H2O2 i 10 minutter, hvorefter der blev skyllet i skylle-buffer i 3x5 minutter. Uspecifik baggrundsfarvning blev blokeret med 1% bovint serum albumin BSA/PBS i 20 minutter Det primære TH antistof blev fortyndet 1:8000 i 1% BSA/PBS og snittene blev inkuberet hermed natten over ved 4 C. Snittene blev så skyllet i 3x5 minutter i skylle-buffer og inkuberet med EnVision+™ polyklonalt i 30 minutter ved stuetemperatur. Der blev hertefter skyllet igen i 3x5 minutter i skylle-buffer og fremkaldet i DAB+ (3,3-diaminobenzidine) i 15 minutter Overskydende DAB+ blev fjernet i rindende vand og snittene blev kernefarvet med Mayers hæmatoxylin i 1 minut efterfulgt af blåning i rindende vand i 5 minutter. Til sidst blev snittene dehydreret i alkohol med stigende koncentration fra 70%-99% og monteret med Eukitt. Immunhistokemisk TUNEL farvningDer anvendtes en modificeret metode oprindeligt beskrevet af Dalgaard et al. 2001. Farvningen foregik således: Snittene blev skyllet i 5 minutter i PBS-buffer, forbehandlet med 0,001% Proteinase K/PBS i 10 minutter og skyllet i PBS-buffer 2x2 minutter. Endogen peroxidase aktivitet blev blokeret med 3% H2O2 i 5 minutter, hvorefter der blev skyllet i skylle-buffer i 2x5 minutter. Snittene blev så inkuberet med equilibration-buffer i 30 minutter ved stuetemperatur. Overskydende buffer blev tørret af glassene og snittene inkuberedes med TdT (terminal-deoxynucleotidyl-transferase)-enzym opløsning i 1 time ved 37°C. Snittene blev så skyllet grundigt i stop-buffer i 15 sekunder og henstod derefter yderligere i bufferen 10 minutter. Der blev skyllet i skylle-buffer 3x1 minut og inkuberet med anti-digoxigenin peroxidase konjugat i 30 minutter ved stuetemperatur. Der blev skyllet i 4x2 minutter i skylle-buffer og derefter fremkaldt i DAB+ (3,3-diaminobenzidine) i 15 minutter. Overskydende DAB+ blev fjernet i rindende vand, hvorefter snittene blev kernefarvet med Mayers hæmatoxylin i 1 minut efterfulgt af blåning i rindende vand i 5 minutter. Efter dehydrering i alkohol med stigende koncentration fra 70%-99% blev snittene monteret med Eukitt. Immunhistokemisk α-synuclein farvningDer anvendtes en ikke publiceret metode udviklet i samarbejde med medicinalfirmaet Lundbeck. Farvningen foregik således: Snittene blev demaskeret i mikrobølgeovn i 0,01 M natriumcitrat-buffer pH 6,0 i 2x5 minutter og afkølet i 20 minutter i bufferen. Snittene blev så skyllet i 5 minutter i PBS-buffer og der blev blokeret for endogen peroxidase aktivitet med 3% H2O2 i 10 minutter og skyllet i skylle-buffer i 3x5 minutter. Uspecifik baggrundsfarvning blev blokeret med 1% bovint serum albumin (BSA)/PBS i 20 minutter. Det primære α-synuclein antistof blev fortyndet 1:2000 i 1% BSA/PBS og snittene inkuberedes heri natten over ved 4°C. Snittene blev så skyllet i 3x5 minutter i skylle-buffer og inkuberet med EnVision+™ polyklonalt i 30 minutter ved stuetemperatur. Derefter blev der skyllet igen i 3x5 minutter i skylle-buffer og fremkaldt i DAB+ (3,3-diaminobenzidine) i 15 minutter Overskydende DAB+ blev fjernet i rindende vand og snittene blev kernefarvet med Mayers hæmatoxylin i 1 minut efterfulgt af blåning i rindende vand i 5 minutter. Til sidst blev snittene dehydreret i alkohol med stigende koncentration fra 70%-99% og monteret med Eukitt. 4.7 Anvendte kemikalier til doseringManganDer blev brugt to forskellige mangansalte til mangandosering: Manganklorid: Der anvendtes manganklorid-tetrahydrat, MnCl2 x 4H2O (Sigma, M 3634) med renhed: >99%. Molvægten var 197,9 g/mol ogCAS No. er 13446-34-9. Mangandioxid, MnO2: Dette har molvægten 86,94 g/mol og CAS No. 1313-13-9. Til de indledende doseringer anvendtes en kommercielt tilgængelig, grovkornet præparation (Sigma M3138). Til specieringsundersøgelsen anvendtes en fintkornet præparation doneret af Sedema-division of Sadacem S.A., Belgien. Dette produkt havde en gennemsnitlige partikelstørrelse på 4,791±4,523µm med en median størrelse på 3,583µm. Renheden var >99%. 6-hydroxydopaminModelstoffet 6-hydroxydopamin (6-OHDA) var hjemkøbt og doseret af NeuroSearch. Renheden var ≥99% og CAS No. er 5720-26-3 PesticiderChlorpyrifos. Der blev anvendt et ultrarent product for at sikre, at effekter skyldtes chlorpyrifos per se. Stoffet blev leveret af ChemService Inc., katalognummer PS-674. Renheden var 99,5%. Chlorpyrifos’ bruttoformel er C9H11Cl3NO3PS. Molvægten er 350,59 g/mol og CAS No. er 2921-88-2. Nedenfor ses chlorpyrifos’ strukturformel:
Maneb. Der blev anvendt et produkt så rent som muligt for at sikre, at effekter skyldtes maneb per se. Stoffet blev leveret af ChemService Inc., katalognummer PS-22. Renheden var 95%. Maneb, [1,2-ethylendiylbis[carbamodithioato](2)]mangan, har den monomere bruttoformel C4H6MnN2S4 med molvægten på 265,3 g/mol og CAS No. 12427-38-2 Nedenfor ses manebs strukturformel som polymer, hvor X angiver antallet af monomere.
4.8 Statistiske analyserAlle statistiske analyser blev foretaget med SAS version 6.12 (SAS Institute Inc. Cary, NC). Som generelt niveau for statistisk signifikans anvendtes P < 0,05. Der angives generelt ikke specifikke P-værdier i rapporten. Data undersøgtes for varianshomogenitet og normalfordeling. Var dette opfyldt, udførtes GLM, hvilket ikke specificeres i rapporten. Var der ikke varianshomogenitet eller normalfordeling udførtes Kruskal-Wallis test, hvilket bliver specificeret under pågældende tabel eller figur. 5 Resultater
5.1 ManganundersøgelserPræliminære undersøgelserDaglig intraperitoneal dosering i 7 dage med kommercielt mangandioxid: Denne undersøgelse havde til formål at kontrollere om dosering påvirkede dyrens sundhedstilstand. Dosering medførte ikke sundhedsmæssige problemer vurderet udfra de daglige kliniske inspektioner af dyrerne og det forhold, at dosering ikke påvirkede dyre- eller hjernevægt på aflivningstidspunktet. Derimod blev der ved sektionen konstateret vævsreaktioner i bughulen og omkring testikler med vævsindkapsling af ikke absorberet MnO2 - mindst udtalt svarende til laveste dosis. Dette viste, at der ikke uden problemer kunne foretages daglige injektioner i 7 dage, heller ikke med laveste dosis svarende til 1,22 mg mangan/kg legemsvægt/dag. Intraperitoneal dosering i 4 uger med fintkornet mangandioxid: De daglige kliniske inspektioner af dyrerne viste ikke sundhedsmæssige problemer. Men også i denne undersøgelse blev der ved sektionen konstateret vævsreaktioner i bughule og omkring testikler med vævsindkapsling af ikke absorberet MnO2 mest udtalt ved højeste dosis (3,0 mg Mn/kg legemsvægt/uge). En og to ugentlige doseringer med 1,22 mg mangan viste også vævsreaktioner, men ved én ugentlig injektion var niveauet så acceptabelt, at der kunne fortsættes hermed i de efterfølgende undersøgelser. Det blev vurderet ud fra restmængden i bughulen, at fintkornet MnO2 lettere absorberedes end den kommercielle præparation, som anvendtes i første undersøgelse. Protein og dopaminkoncentration i vævsskiver og hele corpus striatum: Beregnes de procentvise standardafvigelser for protein- (Corpus striatum: 33,7%; Substantia nigra: 31,6%) og dopamin koncentration (Corpus striatum: 42,2%; Substantia nigra: 83,7%) i udtaget væv ses, at disse er store, specielt for dopamin koncentrationens vedkommende. Trods individuel dyr-til-dyr variation kan dette ikke være forklaringen. En sandsynligere årsag er store subregionale forskelle i dopamin koncentrationen kombineret med ikke helt reproducerbar lokalisation af vævsprøver i corpus striatum og substantia nigra trods store anstrengelser for reproducerbar udskæring af vævsskiver i metalmatrice og udstansning af væv fra skiven. Med disse store variationer vil det ikke være muligt at dokumentere små mangan-inducerede ændringer i dopamin koncentrationer i vævsskiver. I stedet blev det besluttet at udtage hele corpus striatum og foretage neurokemiske analyser heri. I en supplerende undersøgelse i 6 kontroldyr blev der udtaget og vejet corpus striatum til efterfølgende dopaminanalyse. Den procentvise standardafvigelse i dopamin koncentrationen var 6,4 %, hvilket var meget tilfredsstillende. Med denne lave standardafvigelse vil det være muligt at dokumentere små manganinducerede ænringer i dopamin koncentrationer i corpus striatum. Derfor udtages corpus striatum i de efterfølgende undersø-gelser. Men ved analyser i hele corpus striatum reduceres ”opløsningsevnen”, fordi der ikke opnås oplysninger om neurokemiske ændringer i specifikke, små lokalisationer. Uanset hvor lille en prøve som udtages, vil der på mikroskopisk niveau altid være heterogenitet i neurokemiske parametre. Dette kan til dels minimeres ved at foretage neurokemiske analyser i mikroskopiske snit. Her kunne f.eks. in situ hybridisering og fluorescensmikroskopi bruges. Fluoroscensmikroskopi kan anvendes til visualisering af f.eks. signalstof koncentrationer, men herved bliver kvantificeringen og reproducerbarheden for lokalisation i snit fra forskellige hjerner det sårbare punkt. Dose-range undersøgelsenVurderet udfra de daglige kliniske inspektioner af dyrerne i deres bure medførte ingen dosering sundhedsmæssige problemer. Men på trods af, at der nu blev anvendt fintkornet MnO2, blev der alligevel ved sektionen igen konstateret vævsreaktioner i bughulen og omkring testikler med vævsindkapsling af ikke absorberet MnO2 i en udstrækning, som komprommiterede dosering med dette salt. Der var også ophobning af MnO2–rester i bughulen, specielt de lavere liggende områder: tunica albicans omkring peritoneums afgrænsning af bughulen ind mod testiklerne. Tabel 1 viser vægte af dyr, højre og venstre corpus striatum, beregnet poolet corpus striatum (beregnet sum af højre og venstre) samt resthjerne. Det skal poienteres, at højre og venstre halvdel af corpus striatum blev vejet og poolet for alle holds vedkommende, undtagen holdet doseret med 6-hydroxydopamin, da dette blev injiceret ensidigt i højre corpus striatum. Kemiske og neurokmiske undersøgelser blev således foretaget i poolet corpus striatum for alle holds vedkommende, undtagen holdet doseret med 6-hydroxydopamin, hvori analyserne foregik i højre og venstre separat. Legemsvægte: Der var fald i legemsvægt af dyr doseret med 2,5 mg mangan (som MnCl2)/kg legemsvægt/dag i 8 uger (400±36 g) og stigning i legemsvægt for dyr doseret med 6-OHDA(485±31 g) i forhold til kontroldyr (463±41 g). Der var ingen ændringer i legemsvægt af dyr doseret med MnO2 i 8 eller 12 uger (Tabel 1). Corpus striatum: Der var stigning af vægt af poolet corpus striatum fra dyr doseret med 1,22 mg mangan (som MnO2)/kg legemsvægt/uge i 8 uger (46,6±8,6 mg) og i højre (31,0±5,8 mg) og venstre corpus striatum (25,6±5,8 mg) fra dyr doseret med 6-OHDA i forhold til kontrol (Højre 21,9±5,8 mg, venstre 20,2±4,7 mg, poolet 40,9±6,2 mg) (Tabel 1). Resthjerne: Der var stigning af vægt af resthjerne fra dyr doseret med 1,22 mg mangan (som MnO2)/kg legemsvægt/uge i 8 uger(1,78±0,05 g) og efter dosering med MnCl2 i 12 uger (1,78±0,05 g) i forhold til kontrol (1,70±0,11 g) (Tabel 1). Tabel 1: Legemsvægt og vægt af corpus striatum og resthjerne fra rotter doseret intraperitonealt dagligt i 8 eller 12 uger med vehikel (kontrol, 0,9% NaCl), mangandioxid, manganklorid eller intracranialt ved stereotaktisk injektion (højre corpus striatum) af engangsdosis af 6-hydroxydopamin (6-OHDA).
Tabellen angiver gennemsnit standardafvigelse. Antallet af dyr var 24 i kontrolgruppen og 10-12 i alle andre grupper. Data blev testet for varianshomogenitet og normalfordeling. Mangankoncentrationer: Målingen på ICP-MS (m/z 55) var næsten fri for polyatomisk interferens (40Ar15N), idet blindværdien hvori denne interferens er tilstede var lav og stabil i signalintensitet. Standardafvigelser på blindværdier af 0,32 M sukrose var så lav, at den estimerede detektionsgrænse muliggjorde påvisning af mangan i alle prøverne. I Figur 3 ses koncentrationen af mangan i corpus striatum, resthjerne og plasma. Det fremgår, at alle doseringer med MnO2 og MnCl2 øgede koncentrationen af mangan i corpus striatum, resthjerne og plasma i forhold til kontrolgruppen (Figur 3). Doseringer med MnCl2 gav generelt højere koncentrationer i corpus striatum og resthjerne og til dels i plasma end dosering med MnO2 (Figur 3). Dosering med både MnO2 og MnCl2 i 12 uger gav højere plasma mangankoncentrationer end 8 ugers dosering. Det blev antydet, at ophobningsgraden af mangan i resthjernen var af samme størrelsesorden ved dosering med MnO2 og MnCl2 taget i betragtning, at mangan doseret som MnCl2 blev doseret i ca. dobbelt så stor dosis som med MnO2. Dette var ikke så tydeligt i corpus striatum. Efter dosering med 6-OHDA faldt koncentrationen af mangan i højre corpus striatum. Der var ingen forskel med hensyn til mangankoncentrationen i resthjerne og plasma mellem kontrolholdet og holdet der blev doseret med 6-OHDA. Der var ikke forskel i mangan koncentrationen i corpus striatum (8,01±2,02 nmol/g væv) og resthjerne (6,72±0,53 nmol/g væv) fra kontroldyr. Der var heller ikke regional forskel i mangan koncentrationen i corpus striatum og resthjerne hvadenten der blev doseret med MnO2 eller MnCl2 eller om dette foregik 8 eller 12 uger (Figur 3). Der var således ingen regional opkoncentrering.
Figur 3. Koncentrationen af mangan i corpus striatum, resthjerne og plasma fra rotter doseret intraperitonealt dagligt i 8 eller 12 uger med vehikel (kontrol, 0,9% NaCl), mangandioxid, manganklorid eller intracranialt ved stereotaktisk injektion (højre corpus striatum) af engangsdosis af 6-hydroxydopamin (6-OHDA). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper undtagen gruppen doseret med 6-OHDA, hvor der kun vises data for højre corpus striatum. Der var 21 dyr i kontrolgruppen, 9-12 i de andre grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Noradrenalin, dopamin og 5-hydroxytryptamin koncentrationer: I Figur 4 og 5 ses koncentrationen af signalstoffer i henholdsvis corpus striatum og resthjerne. Det var ikke muligt at måle noradrenalinkoncentrationen i corpus striatum, da denne lå under detektorens detektionsgrænse. På grund af defekt i den fryser, hvori prøver blev opbevaret før bestemmelse af 5-hydroxytryptamin koncentrationen i resthjerne, var det ikke muligt at måle denne. Figur 4 viser, at der var markant reduceret dopaminkoncentration i højre corpus striatum fra dyr doseret med 6-OHDA (2,97±5,15 nmol/g væv) i forhold til kontrolholdet (poolet striatum: 92,9±9,6 nmol/g væv). Der blev demonstreret en mindre reduktion i dopamin-koncentrationen som følge af dosering med MnCl2 i 12 uger (83,1±7,1 nmol/g væv) i forhold til kontrolholdet (poolet striatum: 92,9±9,6 nmol/g væv) (Figur 4). Dosering med MnO2 i 8 (3,070,39 nmol/g væv) og 12 uger (2,910,50 nmol/g væv) og i 12 uger med MnCl2 (2,20±0,25 nmol/g væv) ændrede 5-HT koncentrationen i poolet corpus striatum i forhold til kontroldyrs (2,58±0,40 nmol/g væv). Ensidig dosering med 6-OHDA i højre corpus striatum reducerede koncentratonen af 5-HT (1,54±0,53 nmol/g væv) i denne i forhold til kontrolholdet (poolet striatum: 2,58±0,40 nmol/g væv) (Figur 4).
Figur 4. Koncentrationen af dopamin (DA) og 5-hydroxytryptamin (5-HT) i corpus striatum fra rotter doseret intraperitonealt dagligt i 8 eller 12 uger med vehikel (kontrol, 0,9% NaCl), mangandioxid, manganklorid eller intracranialt ved stereotaktisk injektion (højre corpus striatum) af engangsdosis af 6-hydroxydopamin (6-OHDA). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper undtagen gruppen doseret med 6-OHDA, hvor der kun vises data for højre corpus striatum. Der var 21 dyr i kontrolgruppen, 9-12 i de andre grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Mangandosering ændrede ikke på koncentrationen af noradrenalin og dopamin i resthjerne, hvorimod dosering med 6-OHDA markant reducerede koncentrationen af både noradrenalin (1,74±0,27 nmol/g væv) og dopamin (2,30±0,66 nmol/g væv) i forhold til kontrol (noradrenalin: 3,01±0,31 nmol/g væv; dopamin: 4,72±0,68 nmol/g væv) (Figur 5).
Figur 5. Koncentrationen af noradrenalin (NA) og dopamin (DA) i resthjerne fra rotter doseret intraperitonealt dagligt i 8 eller 12 uger med vehikel (kontrol, 0,9% NaCl), mangandioxid, manganklorid eller intracranialt ved stereotaktisk injektion (højre corpus striatum) af engangsdosis af 6-hydroxydopamin (6-OHDA). Data præsenteres som gennemsnit ±standardafvigelse. Der var 24 dyr i kontrolgruppen, 10-12 i de andre grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Koncentration af aminosyrer med signalfunktion: I Figur 6 og 7 ses koncentrationen af aminosyrer med signalfunktion i henholdsvis corpus striatum og resthjerne. Dosering med MnCl2 i 12 uger reducerede koncentrationen af taurin (11,2±1,0 nmol/g væv), glutamat(7,79±0,87 nmol/g væv) og GABA (1,44±0,23 nmol/g væv) i corpus striatum i forhold til kontrol (taurin: 16,4±5,4 nmol/g væv; glutamat: 10,3±1,5 nmol/g væv; GABA: 2,02±0,51 nmol/g væv) (Figur 6). Glutamatkoncentrationen reduceredes i højre corpus striatum (8,21±1,25 nmol/g væv) efter dosering med 6-OHDA i forhold til kontrol (poolet: 10,3±1,5 nmol/g væv). Dosering med MnCl2 i 8 uger reducerede koncentrationen taurin i resthjernen (doseret: 5,64±0,51 nmol/g væv; kontrol: 7,21±1,26 nmol/g væv), hvorimod taurinkoncentrationen i resthjerne (12,9±2,4 nmol/g væv) steg markant efter 12 ugers dosering med MnCl2 i forhold til kontrol (7,21±1,26 nmol/g væv) og var af samme størrelsesorden som den øgning 6-OHDA inducerede (13,1±1,2 nmol/g væv) (Figur 7).
Figur 6. Koncentrationen af taurin (Tau), glutamat (Glu) og γ-aminosmørsyre (GABA) i corpus striatum fra rotter doseret intraperitonealt dagligt i 8 eller 12 uger med vehikel (kontrol, 0,9% NaCl), mangandioxid, manganklorid eller intracranialt ved stereotaktisk injektion (højre corpus striatum) af engangsdosis af 6-hydroxydopamin (6-OHDA). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper undtagen gruppen doseret med 6-OHDA, hvor der kun vises data for højre corpus striatum. Der var 21 dyr i kontrolgruppen, 9-12 i de andre grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 7. Koncentrationen af taurin (Tau), glutamat (Glu) og γ-aminosmørsyre (GABA) i resthjerne fra rotter doseret intraperitonealt dagligt i 8 eller 12 uger med vehikel (kontrol, 0,9% NaCl), mangandioxid, manganklorid eller intracranialt ved stereotaktisk injektion (højre corpus striatum) af engangsdosis af 6-hydroxydopamin (6-OHDA). Data præsenteres som gennemsnit ±standardafvigelse. Der var 24 dyr i kontrolgruppen, 10-12 i de andre grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Aktivitet af acetylcholin- og butyrylcholinesterase: I Figur 8, 9 og 10 ses aktiviteten af enzymerne AChE og BuChE i henholdsvis corpus striatum, resthjerne og plasma. Det var ikke muligt at måle BuChE aktivitet i corpus striatum, derfor er intet angivet. Der blev påvist reduceret AChE aktivitet i corpus striatum (32,0±3,1 U/g væv) (Figur 8) og resthjerne (8,43±0,24 U/g væv) (Figur 9) efter dosering med 2,5 mg mangan/kg legemsvægt/dag i 12 uge i forhold til kontrol (corpus striatum: 40,21±0,8 U/g væv; resthjerne: 9,12±0,56 U/g væv). Der var ingen effekt på AChE og BuChE aktivitet i plasma (Figur 10).
Figur 8. Enzymaktiviteten af acetylcholinesterase (AChE) i corpus striatum fra rotter doseret intraperitonealt dagligt i 8 eller 12 uger med vehikel (kontrol, 0,9% NaCl), mangandioxid, manganklorid eller intracranialt ved stereotaktisk injektion (højre corpus striatum) af engangsdosis af 6-hydroxydopamin (6-OHDA). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper undtagen gruppen doseret med 6-OHDA, hvor der kun vises data for højre corpus striatum. Der var 21 dyr i kontrolgruppen, 9-12 i de andre grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 9. Enzymaktiviteten af acetylcholinesterase (AChE) og butyrylcholinesterase (BuChE) i resthjerne fra rotter doseret intraperitonealt dagligt i 8 eller 12 uger med vehikel (kontrol, 0,9% NaCl), mangandioxid, manganklorid eller intracranialt ved stereotaktisk injektion (højre corpus striatum) af engangsdosis af 6-hydroxydopamin (6-OHDA). Data præsenteres som gennemsnit ±standardafvigelse. Der var 24 dyr i kontrolgruppen, 10-12 i de andre grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 10. Enzymaktiviteten af acetylcholinesterase (AChE) og butyrylcholinesterase (BuChE) i plasma fra rotter doseret intraperitonealt dagligt i 8 eller 12 uger med vehikel (kontrol, 0,9% NaCl), mangandioxid, manganklorid eller intracranialt ved stereotaktisk injektion (højre corpus striatum) af engangsdosis af 6-hydroxydopamin (6-OHDA). Data præsenteres som gennemsnit ±standardafvigelse. Der var 24 dyr i kontrolgruppen, 10-12 i de andre grupper. Data blev testet for varianshomogenitet og normalfordeling. Kvantificering af α-synuclein, synaptophysin: Figur 11 viser typiske western blots af proteinerne actin (kontrolprotein for prøvemængde), synaptophysin og α-synuclein udført med prøvemateriale fra corus striatum.
Figur 11. Eksempel på et repræsentativt western blot af actin, synaptophysin og α-synuclein i prøver fra corpus striatum. Figuren viser, for hvert af de 3 proteiner, 24 prøver hvoraf de 3 første fra venstre er kontrolprøver (kontrolhold) i vævskoncentrationerne 2,5 µg, 5 µg og 7,5 µg protein. Resten er prøver i vævskoncentrationen 5 µg protein. I Figur 12 og 13 ses koncentrationen af hjerneproteinerne α-synuclein og synaptophysin i henholdsvis corpus striatum og resthjerne efter kvantificering af western blots. Data vises som koncentrationen i doserede dyr i procent af koncentrationen i kontroldyr. Disse to figurer viser, at mangandosering ikke ændrede koncentrationen af hverken α-synuclein eller synaptophysin i corpus striatum (Figur 12) eller resthjerne (Figur 13).
Figur 12. Kvantitative målinger af α-synuclein og synaptophysin i corpus striatum fra rotter doseret intraperitonealt dagligt i 8 eller 12 uger med vehikel (kontrol, 0,9% NaCl), mangandioxid, manganklorid eller intracranialt ved stereotaktisk injektion (højre corpus striatum) af engangsdosis af 6-hydroxydopamin (6-OHDA) ud fra western blots målt ved densitometri. Niveauet af aα-synuclein og synaptophysin er i % af kontrolholdet. Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper undtagen gruppen doseret med 6-OHDA, hvor der kun vises data for højre corpus striatum. Der var 21 dyr i kontrolgruppen, 9-12 i de andre grupper. Data blev testet for varianshomogenitet og normalfordeling.
Figur 13. Kvantitative målinger af α-synuclein og synaptophysin i resthjerne fra rotter doseret intraperitonealt dagligt i 8 eller 12 uger med vehikel (kontrol, 0,9% NaCl), mangandioxid, manganklorid eller intracranialt ved stereotaktisk injektion (højre corpus striatum) af engangsdosis af 6-hydroxydopamin (6-OHDA) ud fra western blots målt ved densitometri. Niveauet af aα-synuclein og synaptophysin er i % af kontrolholdet. Data præsenteres som gennemsnit ±standardafvigelse. Der var 24 dyr i kontrolgruppen, 10-12 i de andre grupper. Data blev testet for varianshomogenitet og normalfordeling. Koncentrationen af prolaktin i plasma: Koncentrationen af plasmaprolaktin blev bestemt i kontolgruppen og den gruppe, hvori der blev påvist reduceret koncentration af dopamin i corpus striatum (2,5 mg mangan/kg legemsvægt doseret i 12 uger). Koncentrationerne var henholdsvis 100±45% og 155±78% udtrykt i procent af kontrol, det vil sige, mangandoseringen påvirkede ikke prolaktinkoncentrationen i plasma. Dosering med højere doser manganklorid og supplement i drikkevandVed sektion af dyr efter intraperitoneal dosering med MnCl2 i doser på 5,0 og 7,5 mg Mn/kg/dag med og uden supplement MnCl2 i drikkevand (5 eller 15 g/L) påvistes så alvorlige vævsskader i bughulen, at sådan dosering ikke vil kunne tolereres. Herudover øgede levertoksiciteten koncentrationen af mangan i corpus striatum (54,73±5,7 nmol/g væv, n=4) og resthjerne (36,71±6,7 nmol/g væv, n=4), til niveauer svarende til cirka en faktor to højere end ved dosering med manganklorid 2,5 mg/kg legemsvægt/dag i 12 uger (corpus striatum 21,7±5,1 nmol/g væv, n=10; resthjerne 23,9±4,8 nmol/g væv, n=10). Udover at inducere vævsskader i bughulen og levertoksicitet betyder de store procentcise spredninger i mangankoncentrationerne i hjernevæv, at højere dosering end dosering med manganklorid i doser på 2,5 mg mangan/kg legemsvægt/dag i 12 uger ikke er velegnet til studier af dosis-effekt relationer. Valg af mangandosis og -doseringslængde i kombinationsundersøgelsen Undersøgelsen viste, at der som minimum skulle doseres 12 uger intraperitonealt med 2,5 mg/kg MnCl2 for at opnå reduceret dopamin koncentration i corpus striatum, og at det også var muligt at dosere således uden alt for store vævsforandringer, hvorimod dosering væsentligt udover 12 uger vil frembyde dyreetiske problemer. Derfor blev det besluttet at dosere intraperitonealt med manganklorid i en dosis på 2,5 mg mangan/kg legemsvægt/dag i 12 uger i kombinationsundersøgelsen og at forlænge doseringen med chlorpyrifos og maneb til 12 uger i dose-range undersøgelserne. 5.2 ChlorpyrifosundersøgelserPræliminær undersøgelseDen præliminære undersøgelse med subkutan dosering af 2,5 eller 30 mg chlorpyrifos/kg legemsvægt/uge viste, at dyrene kunne tåle begge de valgte doseringer i 12 uger, selvom der var lokalirritation på injektionsstedet. Chlorpyrifos reducerede dosisrelateret aktiviteten af AChE (Kontrol: 52,2±4,7; 2,5 mg chlorpyrifos: 45,8±2,2; 30 mg chlorpyrifos: 8,23±0,86 U/g væv) og BuChE (Kontrol: 3,36±0,46; 2,5 mg chlorpyrifos: 3,12±0,28; 30 mg chlorpyrifos: 2,91±0,57 U/g væv) i corpus striatum. Der var lignende fald i aktiviteten af begge enzymer i resthjerne og plasma. Der blev ikke foretaget egentlig statistisk analyse, da der kun var 4 dyr i hvert hold. På basis af disse fund valgtes chlorpyrifos doserne 2,5; 15 og 30 mg/kg legemsvægt en gang om ugen i dose-range undersøgelsen. Dose-range undersøgelsenVurderet udfra de daglige kliniske inspektioner af dyrerne i deres bure medførte chlorpyrifos ingen sundhedsmæssige problemer. Ved sektion vistes dosisrelaterede injektionsskader af lettere grad. Herudover blev der ikke påvist makroskopiske forandring, som kunne tilskrives dosering. Vægt af dyr, hjerne og andre organer: Tabel 2 viser legemsvægte og vægte af totalhjerne, lever, nyrer, binyrer, testikler, milt og thymus. Højeste dosis reducerede nyrervægten (2,90±0,26 g) i forhold til kontrol (3,30±0,18 g) og øgede vægten af binyrer (0,058±0,010 g) i forhold til kontrol (0,050±0,008 g). Der var ingen bemærkelsesværdig effekt på vægt af andre organer. Tabel 2: Legems- og organvægte af rotter doseret subkutant 1 gang om ugen i 12 uger med vehikel (kontrol, jordnøddeolie) eller chlorpyrifos. Histokemi og immunhistokemi: Der blev ikke påvist histopatologiske forandringer i corpus striatum eller substantia nigra ved HE-farvning. Farvning efter apoptotiske celler ved TUNEL-farvning viste ingen tegn på apoptose i corpus striatum eller substantia nigra. Der medgives ingen histopatologiske billeder. Noradrenalin, dopamin og 5-hydroxytryptamin koncentrationer: I Figur 14 og 15 ses koncentrationen af signalstoffer i henholdsvis corpus striatum og resthjerne. Der var ikke målelige mængder noradrenalin i prøverne fra corpus striatum, derfor vises ingen data. Koncentrationen af dopamin i corpus striatum var øget ved de to laveste doser (henholdsvis 128±14 nmol/g væv og 132±16 nmol/g væv) i forhold til kontrol (113±21 nmol/g væv), men ikke ved højeste dosering (Figur 14). Der var ingen effekt på 5-HT koncentrationen i corpus striatum (Figur 14). I resthjernen reducerede mellemste dosis koncentrationen af dopamin (4,81±0,59 nmol/g væv) i forhold til kontrol (5,36±0,60 nmol/g væv), hvorimod 5-HT koncentrationen i resthjernen blev øget dosisrelateret (2,94±0,25; 3,21±0,38, 3,24±0,45, nmol/g væv) i forhold til kontrol (2,45±0,35) (Figur 15).
Figur 14. Koncentrationen af dopamin (DA) og 5-hydroxytryptamin (5-HT) i corpus striatum fra rotter doseret subkutant 1 gang om ugen i 12 uger med vehikel (kontrol, jordnøddeolie) eller chlorpyrifos (CH). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 12 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 15. Koncentrationen af noradrenalin (NA), dopamin (DA) og 5-hydroxytryptamin (5-HT) i resthjerne fra rotter doseret subkutant 1 gang om ugen i 12 uger med vehikel (kontrol, jordnøddeolie) eller chlorpyrifos (CH). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 12 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Koncentration af aminosyrer med signalfunktion: I Figur 16 og 17 vises koncentrationen af aminosyrer med signalfunktion i henholdsvis corpus striatum og resthjerne. Der var ingen effekt af chlorpyrifos på koncentrationen af de målte aminosyrer i hverken corpus striatum (Figur 16) eller resthjerne (Figur 17).
Figur 16. Koncentrationen af taurin (Tau), glutamat (Glu) og γ-aminosmørsyre (GABA) i corpus striatum fra rotter doseret subkutant 1 gang om ugen i 12 uger med vehikel (kontrol, jordnøddeolie) eller chlorpyrifos (CH). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 12 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling.
Figur 17. Koncentrationen af taurin (Tau), glutamat (Glu) og γ-aminosmørsyre (GABA) i resthjerne fra rotter doseret subkutant 1 gang om ugen i 12 uger med vehikel (kontrol, jordnøddeolie) eller chlorpyrifos (CH). Data præsenteres som gennemsnit ±standardafvigelse. Der var 12 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. Aktivitet af acetylcholin- og butyrylcholinesterase: I Figur18, 19 og 20 ses aktiviteten af enzymerne AChE og BuChE i corpus striatum, resthjerne og plasma. Det var ikke muligt at måle BuChE aktivitet i corpus striatum, da aktiviteten var under detektionsgrænsen. Der iagttoges dosisrelateret reduceret aktivitet af AChE i corpus striatum efter dosering med 15 og 30 mg chlorpyrifos/kg legemsvægt (21,0±7,7 og 12,0±4,4 U/g væv) i forhold til kontrol (50,3±5,7 U/g væv). Der var dosisrelateret reduceret aktivitet af AChE og BuChE i resthjerne (Figur 19) og plasma (Figur 20).
Figur 18. Enzymaktiviteten af acetylcholinesterase (AChE) i corpus striatum fra rotter doseret subkutant en gang pr. uge i 12 uger med vehikel (kontrol, jordnøddeolie) eller chlorpyrifos (CH). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 12 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 19. Enzymaktiviteten af acetylcholinesterase (AChE) og butyrylcholinesterase (BuChE) i resthjerne fra rotter doseret subkutant en gang pr. uge i 12 uger med vehikel (kontrol, jordnøddeolie) eller chlorpyrifos (CH). Data præsenteres som gennemsnit ±standardafvigelse. Der var 12 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 20. Enzymaktiviteten af acetylcholinesterase (AChE) og butyrylcholinesterase (BuChE) i plasma fra rotter doseret subkutant en gang pr. uge i 12 uger med vehikel (kontrol, jordnøddeolie) eller chlorpyrifos (CH). Data præsenteres som gennemsnit ±standardafvigelse. Der var 12 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Kvantificering af α-synuclein og synaptophysin: I Figur 21 og 22 ses koncentrationen af hjerneproteinerne α-synuclein og synaptophysin i henholdsvis corpus striatum og resthjerne. Data vises som koncentrationen i doserede dyr i procent af koncentrationen i kontroldyr. Disse to figurer viser, at chlorpyrifosdosering ikke ændrede koncentrationen af hverken α-synuclein eller synaptophysin i corpus striatum (Figur 21) eller resthjerne (Figur 22).
Figur 21. Kvantitative målinger af α-synuclein og synaptophysin i corpus striatum fra rotter doseret subkutant 1 gang pr. uge i 12 uger med vehikel (kontrol, jordnøddeolie) eller chlorpyrifos (CH) ud fra western blots målt ved densitometri. Niveauet af α-synuclein og synaptophysin er i % af kontrolholdet. Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 12 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling.
Figur 22. Kvantitative målinger af α-synuclein og synaptophysin i resthjerne fra rotter doseret subkutant 1 gang pr. uge i 12 uger med vehikel (kontrol, jordnøddeolie) eller chlorpyrifos (CH) ud fra western blots målt ved densitometri. Niveauet af α-synuclein og synaptophysin er i % af kontrolholdet. Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper Der var 12 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. Valg af chlorpyrifos dosis i kombinationsundersøgelsenDer valgtes en subkutan dosis på 15 mg/kg lgv/uge, så der er mulighed for at se både additive og antagonistiske effekter i kombinationsundersøgelsen. 5.3 ManebundersøgelserPræliminær undersøgelseDer viste sig hurtigt så store skader på injektionsstedet, at alle maneb doserede dyr måtte aflives efter kun 4 ugers dosering. Kontroldyrene kunne godt tåle den efterfølgende intraperitoneal dosering i begge niveauer af maneb (15 og 30 mg maneb/kg legemsvægt/uge) i 4 uger. Denne dosering kan også anvendes i dose-range undersøgelsen, dog ønskes indlagt en mellemdosis for at opnå bedre dosis-response forhold og gøre det muligt at udvælge den dosis, der skal anvendes i kombinationsundersøgelsen. Dose-range undersøgelsenVurderet udfra de daglige kliniske inspektioner af dyrerne i deres bure medførte maneb ingen sundhedsmæssige problemer. Ved sektion blev der observeret alvorlige irritations- og betændelsesskader i bughulen ved dosering med 30 mg/kg legemsvægt. Ved 15 mg/kg legemsvægt var skaderne stadig markante. Ved 7,5 mg var der to dyr, der havde skader, mens resten ingen skader havde. Det vurderes, at doser meget højere end 7,5 mg maneb/kg legemsvægt ikke er mulige. Vægt af dyr, hjerne og andre organer: Tabel 3 viser legemsvægte og vægte af totalhjerne, lever, nyrer, binyrer, testikler, milt og thymus. Laveste dosis maneb øgede legemsvægt (509±64 g), hjernevægt (2,17±0,06 g) og testikelvægt (4,30±0,40 g) i forhold til kontroldyr (legemsvægt: 476±30 g; hjernevægt: 2,08±0,11 g; testikelvægt: 3,84±0,40 g), hvorimod højere dosering ingen effekt havde. Højeste dosis øgede vægten af binyrer (0,052±0,005 g) i forhold til kontrol (0,046±0,005 g). Manebdosering øgede dosisrelateret vægten af milt (1,17±0,19 g; 1,18±0,14 g; 1,22±0,14 g) i forhold til kontrol (0,98±0,10 g) (Tabel 3). Tabel 3: Legems- og organvægte af rotter doseret intraperitonealt 1 gang om ugen i 12 uger med vehikel (kontrol, 0,9% NaCl) eller maneb. Histopatologiske undersøgelser: Der blev ikke påvist vævsforandringer i corpus striatum og substantia nigra ved HE-farvning. Der blev farvet for enzymet TH i corpus striatum og substantia nigra. Der blev ikke påvist ændringer i ekspressionen heraf. TUNEL farvning viste ingen apoptotiske celler i corpus striatum eller substantia nigra. Der medgives ingen histopatologiske billeder. Mangankoncentrationer: I Figur 23 ses koncentrationen af mangan i corpus striatum. Mangankoncentrationen i denne undersøgelses kontrolhold (11,5±3,7 nmol/g væv) (Figur 23) lå på samme niveau som for tidligere kontrolhold (8,01±2,02 nmol/g væv) (Figur 3). Dosering med maneb øgede koncentrationen af mangan i corpus striatum (Figur 23), og der var en klar dosis koncentrations sammenhæng (17,6±2,3, 20,7±5,9 og 30,4±8,7 nmol/g væv). Tidligere vistes, at der ikke var forskel på mangan koncentrationen i corpus striatum og resthjerne ved mangandoseringer (Figur 3), derfor valgtes corpus striatum som eneste målorgan for manebundersøgelsens manganmålingerne.
Figur 23. Koncentrationen af mangan i corpus striatum fra rotter doseret intraperitonealt 1 gang om ugen i 12 uger med vehikel (kontrol, 0,9% NaCl) eller maneb (MB). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Noradrenalin, dopamin og 5-hydroxytryptamin koncentrationer: I Figur 24 og 25 ses koncentrationen af signalstoffer i henholdsvis corpus striatum og resthjerne. Det var ikke muligt at måle koncentrationen af noradrenalin i prøverne fra corpus striatum, da den lå under apparaturets detektionsgrænse. Maneb havde ingen effekt på koncentrationen af dopamin i corpus striatum, hvorimod der iagttoges dosisrelateret øget koncentration af 5-HT i corpus striatum for 7,5, 15 og 30 mg maneb/kg/uge (3,09±0,37; 3,10±0,97 nmol; 3,20±0,70 nmol/g væv) i forhold til kontrol (2,43±0,29 nmol/g væv) (Figur 24). Manebdosering påvirkede ikke noradrenalin eller dopamin koncentrationen i resthjernen, hvorimod alle tre doses øgede koncentrationen af 5-HT (2,38±0,18; 2,42±0,24 nmol; 2,36±0,27 nmol/g væv) i resthjernen i forhold til kontrol (2,05±0,27 nmol/g væv) (Figur 25).
Figur 24. Koncentrationen af dopamin (DA) og 5-hydroxytryptamin (5-HT) i corpus striatum fra rotter doseret intraperitonealt 1 gang om ugen i 12 uger med vehikel (kontrol, 0,9% NaCl) eller maneb (MB). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 25. Koncentrationen af noradrenalin (NA), dopamin (DA) og 5-hydroxytryptamin (5-HT) i resthjerne fra rotter doseret intraperitonealt 1 gang om ugen i 12 uger med vehikel (kontrol, 0,9% NaCl) eller maneb (MB). Data præsenteres som gennemsnit ±standardafvigelse. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Koncentration af aminosyrer med signalfunktion: I Figur 26 og 27 ses koncentrationen af aminosyrer med signalfunktion i henholdsvis corpus striatum og resthjerne. Disse to figurer viser, at manebdoseringen ikke påvirkede koncentrationen af taurin, glutamat eller GABA i hverken striatum eller resthjerne.
Figur 26. Koncentrationen af taurin (Tau), glutamat (Glu) og γ-aminosmørsyre (GABA) i corpus striatum fra rotter doseret intraperitonealt 1 gang om ugen i 12 uger med vehikel (kontrol, 0,9% NaCl) eller maneb (MB). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling.
Figur 27. Koncentrationen af taurin (Tau), glutamat (Glu) og γ-aminosmørsyre (GABA) i resthjerne fra rotter doseret intraperitonealt 1 gang om ugen i 12 uger med vehikel (kontrol, 0,9% NaCl) eller maneb (MB). Data præsenteres som gennemsnit ±standardafvigelse. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. Aktivitet af acetylcholin- og butyrylcholinesterase: I Figur 28, 29 og 30 ses aktiviteten af enzymerne AChE og BuChE i corpus striatum, resthjerne og plasma. Manebdosering påvirkede ikke AChE aktiviteten i corpus striatum, hvorimod BuChE aktiviteten blev forøget i denne hjernedel ved højeste dosis (3,70±0,68 U/g væv) i forhold til kontrol (3,17±0,21 U/g væv) (Figur 28). Manebdosering øgede aktiviteten af AChE i resthjerne ved de to højeste doseringer (13,3±0,3; 13,4±0,3 U/g væv) i forhold til kontrol (13,0±0,3 U/g væv), hvorimod kun højeste dosering (1,91±0,09 U/g væv) øgede aktiviteten af BuChE i denne hjernedel i forhold til kontrol (1,83±0,07 U/g væv) (Figur 29). Figur 30 viser, at kun den mellemste manebdosis påvirkede aktiviteten af BuChE i plasma, idet denne var forøget (Kontrol: 228±50 U/L; 15 mg maneb/kg legemsvægt: 275±45 U/L), hvorimod der ikke var nogen effekt på aktiviteten af AChE i plasma.
Figur 28. Enzymaktiviteten af acetylcholinesterase (AChE) og butyrylcholinesterase (BuChE) i corpus striatum fra rotter doseret intraperitonealt 1 gang om ugen i 12 uger med vehikel (kontrol, 0,9% NaCl) eller maneb (MB). Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 29. Enzymaktiviteten af acetylcholinesterase (AChE) og butyrylcholinesterase (BuChE) i resthjerne fra rotter doseret intraperitonealt 1 gang om ugen i 12 uger med vehikel (kontrol, 0,9% NaCl) eller maneb (MB). Data præsenteres som gennemsnit ±standardafvigelse. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 30. Enzymaktiviteten af acetylcholinesterase (AChE) og butyrylcholinesterase (BuChE) i plasma fra rotter doseret intraperitonealt 1 gang om ugen i 12 uger med vehikel (kontrol, 0,9% NaCl) eller maneb (MB). Data præsenteres som gennemsnit ±standardafvigelse. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Kvantificering af α-synuclein og synaptophysin: I Figur 31 og 32 ses koncentrationen af hjerneproteinerne α-synuclein og synaptophysin i henholdsvis corpus striatum og resthjerne. Data vises som koncentrationen i doserede dyr i procent af koncentrationen i kontroldyr. Disse to figurer viser, at manebdosering ikke ændrede koncentrationen af hverken α-synuclein eller synaptophysin i corpus striatum (Figur 31) eller i resthjerne (Figur 32).
Figur 31. Kvantitative målinger af α-synuclein og synaptophysin i corpus striatum fra rotter doseret intraperitonealt 1 gang om ugen i 12 uger med vehikel (kontrol, 0,9% NaCl) eller maneb (MB) udfra western blots målt ved densitometri. Niveauet af α-synuclein og synaptophysin er i % af kontrolholdet. Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling.
Figur 32. Kvantitative målinger af α-synuclein og synaptophysin i resthjerne fra rotter doseret intraperitonealt 1 gang om ugen i 12 uger med vehikel (kontrol, 0,9% NaCl) eller maneb (MB) udfra western blots målt ved densitometri. Niveauet af α-synuclein og synaptophysin er i % af kontrolholdet. Data præsenteres som gennemsnit ±standardafvigelse. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. Valg af maneb dosis i kombinationsundersøgelsenPå basis af undersøgelsens resultater valgtes en intraperitoneal dosis på 10 mg/kg legemsvægt/uge til kombinatonsundersøgelsen, primært begrundet i graden af vævsskader efter injektion af 7,5 og 15 mg maneb. 5.4 KombinationsundersøgelserPræliminær undersøgelseDe daglige kliniske observationer af dyrene i deres bure viste ingen sundhedsmæssige problemer. Ved den efterfølgende sektion påvistes vævsirritation og betændelsesreaktioner hos en del af de doserede dyr, men i en grad, som ikke udelukkede at foretage kombinationsundersøgelsen med de doser, som var anvendt i den præliminære undersøgelse. KombinationsundersøgelsenKliniske observationer og fund ved sektion: Bedømt ud fra de daglige kliniske observationer af dyrene i deres bure var der ingen sundhedsmæssige problemer. I kontrolholdet blev der fundet en rotte med kryptorchisme (manglende nedsigning af testiklerne til pungen under fosterudviklingen). I holdet doseret med chlorpyrifos alene blev der fundet en død rotte med ascites (væskeophobning) i bughulen og med atrofisk højre testikel. I chlorpyrifos+maneb holdet blev en rotte aflivet på grund af kraftige blødninger fra endetarmen. Efterfølgende sektion afslørede kraftige blødninger i bageste del af tyndtarmen forårsaget af fejlinjektion. I alle hold behandlet med teststofferne blev der fundet varierende grader af injektionsskader forårsaget af de mange doseringer. Der var ingen leverskader. Vægt af dyr, hjerne og andre organer: Tabel 4 viser vægte af dyr, totalhjerne, lever, nyrer, binyrer, testikler, milt og thymus. Ingen dosering påvirkede dyrenes legemsvægt, levervægt eller thymusvægt. Når der blev doseret med manganklorid alene (2,03±0,06 g) reduceredes hjernevægten i forhold til kontrol (2,11±0,06 g). Kombinationsdosering med manganklorid og chlorpyrifos (2,85±0,26 g) øgede nyrervægten i forhold til kontrol (2,68±0,22 g). Der var gennemgribende effekter af dosering på vægten af binyrer, idet alle doseringer med undtagelse af dosering med chlorpyrifos og maneb alene øgede vægten af binyrer (Tabel 4). Miltens vægt blev øget af dosering med manganklorid (1,27±0,27 g) i forhold til kontrol (1,07±0,12 g). Tabel 4: Legems- og organvægte af rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos, intraperitonealt 1 gang om ugen i 12 uger med maneb eller med kombinationer heraf i 12 uger. Histopatologiske undersøgelser: Da der ikke blev fundet nogen forskelle af biologisk betydning mellem gruppernes hjernevægte, blev der kun gennemført histopatologiske undersøgelser af kontrol hold og holdet doseret med alle tre teststoffer. Dette begrundes også i manglende effekter i de tidligere histopatologiske undersøgelser udført i hjernerne fra dyr doseret med højere doser af de tre enkeltstoffer. Figur 33 viser immunhistokemiske farvninger i substantia nigra for TH, GFAP, TUNEL og α-synuclein samt en kontrolfarvning for TUNEL i brystkirtelvæv, som er positiv for TUNEL farvningen. Der var ikke effekt af kombinationsbehandlingen med manganklorid, chlorpyrifos og maneb på HE- , GFAP-, TH- og TUNEL-farvning i corpus striatum (ikke vist) eller substantia nigra (se Figur 33).
Figur 33. Figurerne viser histopatologiske billeder af kontroldyr (venstre kolonne) og dyr behandlet med blandingen af mangan, chlorpyrifos og maneb (højre kolonne). Alle snit er fra substantia nigra. TH:Tyrosinhydroxylase GFAP: Glial fibrillært surt protein, TUNEL: Specifik farvning for apoptose. Mangankoncentrationer I Figur 34 vises koncentrationen af mangan i corpus striatum, resthjerne og plasma. Generelt blev det ved sammenligning med konrol påvist, at dosering med manganklorid og maneb begge øgede mangankoncentrationen i de undersøgte væv, og at manganklorid øgede vævskoncentrationerne mere end maneb gjorde. Der var samme mønster i doseringernes effekt på mangan-koncentrationen i corpus striatum, resthjerne og plasma. Corpus striatum: Der fandtes specifikt for denne region, at dosering med manganklorid (35,6±3,7 nmol/g væv), manganklorid og chlorpyrifos i kombination (33,0±6,0 nmol/g væv), maneb (14,2±2,2 nmol/g væv), manganklorid og maneb i kombination (36,45,6 nmol/g væv), chlorpyrifos og maneb i kombination (14,6±3,8 nmol/g væv) og kombinationen af manganklorid, chlorpyrifos og maneb (41,81±3,7 nmol/g væv) øgede koncentrationen af mangan i corpus striatum i forhold til kontrol (8,81±0,97 nmol/g væv). Resthjerne: I resthjernen fandtes, at dosering med manganklorid (31,3±4,6 nmol/g væv), manganklorid og chlorpyrifos i kombination (27,7±2,5 nmol/g væv), maneb (13,8±1,5 nmol/g væv), manganklorid og maneb i kombination (33,2±4,6 nmol/g væv), chlorpyrifos og maneb i kombination (13,7±2,5 nmol/g væv) og kombinationen af manganklorid, chlorpyrifos og maneb (32,1±5,3 nmol/g væv) øgede koncentrationen af mangan i corpus striatum i forhold til kontrol (8,66±0,49 nmol/g væv). Kombinationseffekt af manganklorid og maneb i hjerne: Tabel 5 viser den beregnede gennemsnitlige manganklorid- og maneb-inducerede stigning i mangankoncentration i corpus striatum og resthjerne i forhold til kontrol. Tallene viser, at samtidig dosering med manganklorid og maneb øgede mangankoncentrationen i corpus striatum og resthjerne mere, end hvis der kun blev doseret med manganklorid, og at dette må tilskrives manebdoseringen, specielt var denne additive effekt tydelig i corpus striatum efter kombinationsbehandlingen med manganklorid, chlorpyrifos og maneb. Sammenligning af mangankoncentrationer i corpus striatum og resthjerne: Det ses, at mangankoncentrationerne i corpus striatum (8,81±0,97 nmol/g væv) og resthjerne fra kontroldyr (8,66±0,48 nmol/g væv) ikke var forskellige (Figur 34). Figuren viser også, at ingen form for dosering inducerede forskellige mangankoncentrationer i corpus striatum og resthjerne. Plasma: Dosering med manganklorid (250±145 nmol/g væv), manganklorid og chlorpyrifos i kombination (20154 nmol/g væv), maneb (157±44 nmol/g væv), manganklorid+maneb i kombination (220±74 nmol/g væv), chlorpyri-fos+maneb i kombination (146±64 nmol/g væv) og kombinationen af man-ganklorid, chlorpyrifos og maneb (233±85 nmol/g væv) øgede koncentra-tionen af mangan i corpus striatum i forhold til kontrol (83,9±8,4 nmol/g væv).
Figur 34. Koncentrationen af mangan i corpus striatum, resthjerne og plasma fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid (Mn) i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos (CH), intraperitonealt 1 gang om ugen i 12 uger med maneb (MB) eller med kombinationer heraf i 12 uger. Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Tabel 5: Beregnet gennemsnitlig stigning i mangankoncentrationen i forhold til koncentrationen i kontroldyr
Noradrenalin, dopamin og 5-hydroxytryptamin koncentrationer: I Figur 35 og 36 ses koncentrationen af signalstoffer i henholdsvis corpus striatum og resthjerne. Der var reduceret koncentration af dopamin (124±9 nmol/g væv) og 5-HT (2,46±0,28 nmol/g væv) i corpus striatum efter dosering med chlorpyrifos+maneb i forhold til kontrol (dopamin: 142±16 nmol/g væv; 5-HT: 2,87±0,37 nmol/g væv) (Figur 35). Der iagttoges reduceret koncentration af noradrenalin i resthjerne ved dosering med maneb (2,72±0,37 nmol/g væv) og chlorpyrifos+maneb (2,80±0,23 nmol/g væv) i forhold til kontrol (3,04±0,22 nmol/g væv) (Figur 36). Der påvistes reduceret koncentration af dopamin i resthjerne ved kombinationsdosering med chlorpyrifos og maneb (4,68±0,28 nmol/g væv), idet koncentrationen i kontrol var 5,03±0,41 nmol/g væv (Figur 36). Der var flere dosisrelaterede effekter på 5-HT koncentrationen i resthjerne. Der påvistes forøgede koncentrationer af 5-HT i resthjerne som følge af kombinationsdoseringer med manganklorid og chlorpyrifos (3,02±0,29 nmol/g væv), manganklorid og maneb (3,20±0,39 nmol/g væv), chlorpyrifos og maneb (3,14±0,27 nmol/g væv) og manganklorid og chlorpyrifos og maneb (3,10±0,21 nmol/g væv), idet koncentrationen i kontrol var (2,76±0,23 nmol/g væv) (Figur 36).
Figur 35. Koncentrationen af dopamin (DA) og 5-hydroxytryptamin (5-HT) i corpus striatum fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid(Mn) i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos (CH), intraperitonealt 1 gang om ugen i 12 uger med maneb (MB) eller med kombinationer heraf i 12 uger. Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 36. Koncentrationen af noradrenalin (NA), dopamin (DA) og 5-hydroxytryptamin (5-HT) i resthjerne fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid (Mn) i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos (CH), intraperitonealt 1 gang om ugen i 12 uger med maneb (MB) eller med kombinationer heraf i 12 uger. Data præsenteres som gennemsnit ±standardafvigelse. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Koncentration af aminosyrer med signalfunktion: I Figur 37 og 38 ses koncentrationen af aminosyrer med signalfunktion i henholdsvis corpus striatum og resthjerne. Der var flere effekter af dosering på aminosyrekoncentrationerne i corpus striatum og resthjerne. Det blev påvist, at koncentrationen af glutamat og taurin i corpus striatum blev reduceret af dosering med maneb (glutamat: 14,8±1,1 nmol/g væv; taurin 17,6±1,5 nmol/g væv) og lidt mindre ved dosering med manganklorid og maneb i kombination (glutamat: 15,1±0,7 nmol/g væv; taurin 18,0±1,1 nmol/g væv) i forhold til kontrol (glutamat: 16,2±1,1 nmol/g væv; taurin 19,7±1,6 nmol/g væv) (Figur 37). Koncentrationen af taurin i resthjerne blev reduceret af maneb (12,5±2,8 nmol/g væv) i forhold til kontrol (14,8±1,4 nmol/g væv) (Figur 38).
Figur 37. Koncentrationen af taurin (Tau), glutamat (Glu) og γ-aminosmørsyre (GABA) i corpus striatum fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid (Mn) i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos (CH), intraperitonealt 1 gang om ugen i 12 uger med maneb (MB) eller med kombinationer heraf i 12 uger. Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 38. Koncentrationen af taurin (Tau), glutamat (Glu) og γ-aminosmørsyre (GABA) i resthjerne fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid (Mn) i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos (CH), intraperitonealt 1 gang om ugen i 12 uger med maneb (MB) eller med kombinationer heraf i 12 uger. Data præsenteres som gennemsnit ±standardafvigelse. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Aktivitet af acetylcholin og butyrylcholinesterase: Figurerne 39, 40 og 41 viser aktiviteten af enzymerne AChE og BuChE i corpus striatum, resthjerne og plasma. Der var markante, doseringsrelaterede effekter på cholinesterase aktiviteterne i både corpus striatum, resthjerne og plasma. Generelt reduce-redes aktiviteten af begge enzymer ved enhver dosering med chlorpyrifos. For hvert væv gælder specifikt: Corpus striatum: I forhold til kontrol (59,3±5,8 U/g væv) blev aktiviteten af AChE i corpus striatum reduceret af chlorpyrifos (11,8±3,2 U/g væv), manganklorid og chlorpyrifos i kombination (9,81±2,21 U/g væv), maneb (50,9±8,4 U/g væv), manganklorid og maneb i kombination (53,1±4,4 U/g væv), chlorpyrifos og maneb i kombination (11,7±3,7 U/g væv) og mangan-klorid, chlorpyrifos og maneb i kombination (12,3±3,9 U/g væv) (Figur 39). Samme mønster af effekter påvistes på BuChE aktiviteten, dog ikke ved dosering med maneb alene og ved kombinationsbehandling med mangan-klorid og maneb (Figur 39). Resthjerne: I forhold til kontrol (AChE: 11,60,4 U/g væv; BuChE: 1,83±0,10 U/g væv) blev aktiviteten af AChE og BuChE i resthjerne reduceret af chlor-pyrifos (AChE: 3,63±0,73 U/g væv; BuChE: 0,986±0,079 U/g væv), mangan-klorid og chlorpyrifos i kombination (AChE: 2,87±0,61 U/g væv; BuChE: 0,934±0,074 U/g væv), chlorpyrifos og maneb i kombination (AChE: 3,67±0,90 U/g væv; BuChE: 0,989±0,068 U/g væv) og ved kombinationsbehandling med manganklorid, chlorpyrifos og maneb (AChE: 3,44±0,61 U/g væv; BuChE: 0,994±0,059 U/g væv) (Figur 40). Plasma: I forhold til kontrol (645±96 U/L) blev aktiviteten af AChE i plasma reduceret af manganklorid (544±94 U/L), chlorpyrifos (304±72 U/L), manganklorid og chlorpyrifos i kombination (249±40 U/L), chlorpyrifos og maneb i kombination (293±68 U/L) og af kombinationsbehandling med manganklorid, chlorpyrifos og maneb (288±67 U/L) (Figur 41). Samme mønster af effekter blev påvist på BuChE aktiviteten, dog ikke ved dosering med manganklorid (Figur 41).
Figur 39. Enzymaktiviteten af acetylcholinesterase (AChE) og butyrylcholinesterase (BuChE)) i corpus striatum fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid (Mn) i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos (CH), intraperitonealt 1 gang om ugen i 12 uger med maneb (MB) eller med kombinationer heraf i 12 uger. Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 40. Enzymaktiviteten af acetylcholinesterase (AChE) og butyrylcholinesterase (BuChE)) i resthjerne fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid (Mn) i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos (CH), intraperitonealt 1 gang om ugen i 12 uger med maneb (MB) eller med kombinationer heraf i 12 uger. Data præsenteres som gennemsnit ±standardafvigelse. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05).
Figur 41. Enzymaktiviteten af acetylcholinesterase (AChE) og butyrylcholinesterase (BuChE)) i plasma fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid (Mn) i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos (CH), intraperitonealt 1 gang om ugen i 12 uger med maneb (MB) eller med kombinationer heraf i 12 uger. Data præsenteres som gennemsnit ±standardafvigelse. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. * Angiver statistisk signifikant forskellig fra kontroldata (P<0,05). Kvantificering af α-synuclein og synaptophysin: I Figur 42 og 43 ses koncentrationen af hjerneproteinerne α-synuclein og synaptophysin i henholdsvis corpus striatum og resthjerne. Data vises som koncentrationen i doserede dyr i procent af koncentrationen i kontroldyr. Disse to figurer viser, at ingen dosering ændrede koncentrationen af hverken α-synuclein eller synaptophysin i corpus striatum (Figur 42) eller resthjerne (Figur 43).
Figur 42. Kvantitative målinger af α-synuclein og synaptophysin i corpus striatum fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid (Mn) i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos (CH), intraperitonealt 1 gang om ugen i 12 uger med maneb (MB) eller med kombinationer heraf i 12 uger udfra western blots målt ved densitometri. Niveauet af α-synuclein og synaptophysin er i % af kontrolholdet. Data præsenteres som gennemsnit ±standardafvigelse. Corpus striatum var poolet i alle grupper. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling.
Figur 43. Kvantitative målinger af α-synuclein og synaptophysin i resthjerne fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid (Mn) i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos (CH), intraperitonealt 1 gang om ugen i 12 uger med maneb (MB) eller med kombinationer heraf i 12 uger udfra western blots målt ved densitometri. Niveauet af α-synuclein og synaptophysin er i % af kontrolholdet. Data præsenteres som gennemsnit ±standardafvigelse. Der var 10 dyr i alle grupper. Data blev testet for varianshomogenitet og normalfordeling. Plasma prolaktin koncentration: I Tabel 6 ses koncentrationen af hormonet prolaktin i plasma. Data vises som koncentrationen i doserede dyr i procent af koncentrationen i kontroldyr. Der var ingen ændring af prolaktinkoncentrationen i plasma som følge af doseringen, hvilket er i overensstemmelse med, at der ikke iagttoges reduceret dopaminkoncentration i corpus striatum eller resthjerne (Figur 35 og 36). Tabel 6: Koncentrationen af prolaktin i plasma fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos, intraperitonealt 1 gang om ugen i 12 uger med maneb eller med kombinationer heraf i 12 uger. Angives i procent af kontrol.
Tabellen angiver gennemsnit standardafvigelse. Antallet af dyr var 10 i hver gruppe. Data blev testet for varianshomogenitet og normalfordeling. Caspase-3 aktivitet: Tabel 7 viser aktiviteten af det apoptoserelaterede enzym caspase-3. Aktiviteten var ikke detekterbar i corpus striatum fordi den lå under apparaturets detektionsgrænse. Der var ingen effekt på caspase-3 aktiviteten i resthjerne som følge af nogen dosering (Tabel 7). Tabel 7: Enzymaktiviteten af caspase-3 i corpus striatum og resthjerne fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos, intraperitonealt 1 gang om ugen i 12 uger med maneb eller med kombinationer heraf i 12 uger.
Tabellen angiver gennemsnit standardafvigelse. Antallet af dyr var 10 i hver gruppe. Data blev testet for varianshomogenitet og normalfordeling. Aktivitet af glutamat decarboxylase: I Tabel 8 ses aktiviteten af enzymet GAD i corpus striatum og resthjerne. Der var ingen effekt af nogen behandling på aktiviteten af GAD i hverken corpus striatum eller resthjerne. Tabel 8: Enzymaktiviteten af glutamatdecarboxylase (GAD) i corpus striatum og resthjerne fra rotter doseret intraperitonealt dagligt i 12 uger med vehikel (kontrol, 0,9% NaCl), intraperitonealt dagligt med manganklorid i 12 uger, subkutant 1 gang om ugen i 12 uger med chlorpyrifos, intraperitonealt 1 gang om ugen i 12 uger med maneb eller med kombinationer heraf i 12 uger.
Tabellen angiver gennemsnit standardafvigelse. Antallet af dyr var 10 i hver gruppe. Data blev testet for varianshomogenitet og normalfordeling. 6 Diskussion
Der blev undersøgt effekter forårsaget af dosering med mangansalte, chlorpyrifos, maneb og kombinationer heraf på parametre, som hver især er biomarkør for påvirkning af specifikke dele af rottens centralnervesystem. Derved blev effekter på størstedelen af centralnervesystemet dækket. Påviste effekter må betragtes som tidlig varsling af neurotoksisk effekt (Østergaard et al. 1983; Ladefoged et al. 2001). Effekter påvist i mangan-, prolaktin-, signalstof-, aminosyre-, α-synuclein- og synaptophysinkoncentrationer samt i AChE og BuChE aktiviteter skønnes at vedvare mindst så længe dosering pågår. Derimod kan ændringer i GFAP, caspase-3 aktivitet og TUNEL-farvning være forbigående og derfor problematiske at ”fange”, hvis ikke det mest optimale tidspunkt vælges (Ladefoged et al. 2000; Lam et al. 2000a,b). 6.1 ManganundersøgelserMangandioxid er tungtopløseligt, og det var oprindeligt tilsigtet at udnytte dette, således at tilstedeværelsen af tungtopløseligt mangandioxid i bughulen skulle sikre langvarig, kontinuert manganabsorption mellem doseringerne. Inden dose-range undersøgelsen blev der foretaget nogle præliminære undersøgelser med det formål at identificere den maksimale dosis mangandioxid, som kunne tolereres af rotterne. Trods fund af irritation i bughulen som følge af doseringen, blev det vurderet ud fra dyrenes sundhedstilstand, at højeste mulige dosering med mangandioxid var 1,22 mg/kg legemsvægt/dag i mindst 4 uger. Dose-range undersøgelsenDenne undersøgelse havde til formål at undersøge betydningen af manganspeciering og -doseringsvarighed på mangans neurotoksicitet, at klarlægge virkningsmekanismer herfor og at fastsætte mangandosering i kombinationsundersøgelsen. Der blev doseret intraperitonealt med to forskellige mangansalte - mangandioxid og manganklorid - i doser på henholdsvis 1,22 og 2,5 mg mangan/kg legemsvægt/dag i 8 eller 12 uger. Manganklorid blev valgt, fordi det i litteraturen er rapporteret, at dette er det mest toksiske af de to mangansalte (ASTDR 2000). Nyere undersøgelser viser også, at toksiciteten in vitro vurderet ud fra dannelsen af ROS er størst for manganklorids vedkommende (Erikson et al. 2004a). Netop dette er betydningsfuldt, fordi induktion af ROS dannelse er relevant for udviklingen af Parkinsons sygdom (Dexter et al. 1989; Betarbet et al. 2000; Junn & Mouradian 2001; Panet et al. 2001). Et betydningsfuldt fund i undersøgelsen var, at Mn2+-ionen virkede ekstremt lokalirriterende ved intraperitoneal injektion. Dette er ikke beskrevet i litteraturen på trods af, at der er udført adskillige undersøgelser med intraperitoneal injektion i højere doser end dose-range undersøgelsens (ASTDR 2000). Mangankoncentrationer: Det blev påvist, at dosering med mangandioxid og manganklorid øgede mangankoncentrationen i corpus striatum og resthjerne i forhold til kontrol (Corpus striatum: 8,01±2,02; resthjerne: 6,72±0,53 nmol/g væv). For både corpus striatums og resthjernens vedkommende medførte 12 ugers dosering med begge salte (Corpus striatum. MnO2: 12,6±3,3; MnCl2: 21,7±5,1 nmol/g væv. Resthjerne. MnO2: 13,9±2,8; MnCl2: 23,9±4,8 nmol/g væv) ingen yderligere ophobning end efter 8 ugers behandling (Corpus striatum. MnO2: 14,8±1,8; MnCl2: 26,6±5,3 nmol/g væv. Resthjerne. MnO2: 11,8±0,8; MnCl2: 22,4±3, nmol/g væv). Dette viste, at der var opnået mætning af kapaciteten for ophobning af mangan under de benyttede doseringsbetingelser allerede efter 8 ugers behandling. Begge mangansalte forårsagede øget plasmakoncentration af mangan, hvis der blev doseret i 12 uger (MnO2: 513±62; MnCl2: 249±53 pmol/L) i forhold til dosering i 8 uger (MnO2: 153±24; MnCl2: 191±53 pmol/L) (Tabel 3). Dette antyder, at mekanismen til eliminination af mangan via leveren nåede sin maksimale kapacitet allerede efter de første 8 ugers dosering. At dette ikke gav anledning til forøget koncentration i hjernen, kan skyldes, at blod-hjerne barrieren effektivt beskyttede hjernen for influx af yderligere mængder mangan. Nyere undersøgelser har studeret mangans neurotoksicitet og virkningsmekanismen herfor, når mangan blev doseret alene eller sammen med pesticider (Normandin et al. 2002; Erikson & Aschner 2003; Zhang et al. 2003a,b; Erikson et al. 2004a). Ligeledes er det undersøgt, hvorledes manganspecieringen ved inhalationsdosering påvirker hjernekoncentrationen (Normandin et al. 2004). Fælles for disse undersøgelser er, at koncentrationen af mangan regionalt kan øges i forhold til kontrol ved såvel inhalationsdosering som oral dosering. Dette er i lighed med, hvad der blev påvist i dose-range undersøgelserne af mangan og af det manganholdige pesticed: maneb. Dette understøtter således anvendelsen af intraperitoneal dosering som alternativ til inhalationsdosering. I den oprindelige undersøgelse beskrevet af Roels et al. (1997) blev der doseret intraperitoneal med mangandioxid og manganklorid begge i en dosis på 1,22 mg mangan/kg legemsvægt/dag. Mangankoncentrationerne i corpus striatum var ca. 13 og 9,3 nmol/g væv (aflæst og omregnet fra figur) ved dosering med henholdsvis mangandioxid og manganklorid. Dette er i overensstemmelse med dose-range undersøgelsen, hvori der også blev doseret med 1,22 mg mangan som mangandioxid men med 2,5 mg mangan som manganklorid dog i 8 uger, og hvor de striatale mangankoncentrationer da var henholdsvis 14,8 og 26,6 nmol/g væv. Det kan konkluderes, at mangandosering øgede mangankoncentratonen i rottehjernen, hvilket er en nødvendig forudsætning for induktion af neurotoksicitet. Noradrenalin, dopamin og 5-hydroxytryptamin koncentrationer: Der blev påvist en 10,5% reduceret dopaminkoncentration i corpus striatum som følge af dosering med MnCl2 i 12 uger (83,1±7,1 nmol/g væv) i forhold til kontrol (92,9±9,6 nmol/g væv). Denne reduktion var lille og vurderes ikke at kunne give anledning til åbenbare neurotoksiske effekter. Basis for denne vurdering er sammenligning med den dramatiske 97% reducerede striatale dopamin koncentration i dyr, som fik 6-OHDA (2,97±5,15 nmol/g væv) (Figur 4) og deres sundhedstilstand samt det faktum, at patienter med Parkinsons sygdom skal have hen ved 80% reduktion i antallet af dopaminerge neuroner i corpus striatum, førend kliniske symptomer bliver åbenbare. Undersøgelsen påviste derfor ikke nogen entydig mekanisme som involverede dopamin. Den påviste 10,5% reduktion i striatal dopaminkoncentration kunne ikke eftervises i kombinationsundersøgelsen. Den tilgængelige litteratur dokumenterer forskellige effekter på dopamin koncentrationen, den overvejende effekt er reduktion specielt i corpus striatum, hvilket er vist i mus, rotter og aber (Autissier et al. 1982; Gianutsos & Murray 1982; Bird et al. 1984; Kawata 1990; Komura & Sakamoto 1992; Ingersoll et al. 1995). I en enkelt undersøgelse er der imidlertid også vist øget dopamin koncentration (Ali et al. 1985) mens to andre ikke påviste effekt på dopamin koncentrationen (Witholt et al. 2000; Baek et al. 2003). En samlet, overordnet vurdering af data viser, at mangandoseringsregimen og manganspeciering er meget centrale for absorption, fordeling og effekt af mangan i hjernen (ATSDR 2000), og at der ved den rette absorption og fordeling i hjernen synes at ske en reduktion af dopamin koncentrationen (ATSDR 2000). Dose-range undersøgelsen påviste også manganinducerede ændringer i 5-HT koncentrationen i corpus striatum efter dosering med mangandioxid i 8 (3,07±0,39 nmol/g væv) og 12 uger (2,91±0,50 nmol/g væv) og dosering med manganklorid i 12 uger (2,20±0,25 nmol/g væv) i forhold til kontrol (2,58±0,40 nmol/g væv). Disse ændringer var små og vurderes derfor ikke at kunne give anledning til åbenbare neurotoksiske effekter. Koncentration af aminosyrer med signalfunktion: Koncentrationen i corpus striatum af glutamat (7,79±0,87 mol/g væv), taurin (11,2±1,0 mol/g væv) og GABA (1,44±0,23 mol/g væv) faldt ved dosering med manganklorid i 12 uger i forhold til kontrol (glutamat: 10,3±1,5; taurin: 16,4±5,4 og GABA: 2,02±0,51 mol/g væv), hvilket ikke blev genfundet i kombinations-undersøgelsen. Nyere undersøgelser påviser forskellige effekter af mangandosering på disse aminosyrer, hvilket forklares ved forskel i doseringsregimen og dosisstørrelse (Erikson & Aschner 2003). Disse undersøgelser poienterer, at det GABAerge nervesystem synes mere sårbart overfor mangan end det dopaminerge, og at effekterne ses tidligere i det GABAerge system. Det er vist, at manganinducerede ændringer af glutaminerg og GABAerg funktion kan bidrage til ændret striatal dopamin metabolisme (Page et al. 2001; Castro & Zigmond 2001) og derved indirekte føre til ændret dopaminerg funktion (Erikson & Aschner 2003). Det er bemærkelsesværdigt, at koncentrationen af alle tre aminosyrer faldt. Imidlertid er faldene så små, at de vurderes ikke at kunne give anledning til åbenbare neurotoksiske effekter. Aktivitet af acetylcholinesterase: Aktiviteten af AChE faldt i corpus striatum (32,0±3,1 U/g væv) og resthjerne (8,43±0,24 U/g væv), men ikke i plasma efter 12 ugers dosering med MnCl2, i forhold til kontrol (Corpus striatum: 40,2±10,8; resthjerne: 9,12±0,56 U/g væv). Disse små fald påvirkede ikke dyrenes sundhedstilstand, fordi det meget større chlorpyrifos-inducerede fald påvist i dose-range undersøgelsen heller ikke gjorde det. Ekspression af α–synuclein eller synaptophysin: Der var ingen manganinduceret effekt på ekspressionen af α–synuclein eller synaptophysin. Da α-synuclein er biomarkør for Parkinsons sygdom, er manglende effekt på denne parameter i overensstemmelse med det manglende konsistent mønster af effekter. Uændret synaptophysin ekspression antyder, at antallet af kontaktpunkter mellem nervecellerne ikke var ændret, hvilket ellers skulle forventes som tidligt tegn på neurodegeneration. Prolaktinkoncentration i plasma: Der var ingen ændring i koncentrationen af prolaktin i plasma fra dyrene doseret i 12 uger med 2,5 mg Mn/kg legemsvægt/dag. Da det var i disse dyr, der blev demonstreret reduceret dopamin koncentration i corpus striatum kunne den hypotetiske sammenhæng mellem mangan-reduceret dopamin koncentration i corpus striatum og øget prolaktin koncentration i plasma ikke understøttes. Supplerende undersøgelser med højere doser manganklorid og supplement i drikkevandDen forholdsvis lille reduktion i dopamin koncentrationen understregede, at det var vigtigt at dosere med så store doser af manganklorid som muligt. Der blev derfor doseret med manganklorid intraperitonealt i doser på 2,5, 5,0 og 7,5 mg Mn/kg legemsvægt/dag. De to højeste doser fremkaldte organskader, primært i lever og testikler. Supplement af manganklorid i drikkevand kunne øge neurotoksiciteten af den intraperitoneale injektion, specielt hvis de homeostatiske reguleringsmekanismer i mave-tarmkanalen blev overskredet. Det blev derfor forsøgt ved at supplere den intraperitoneale dosering med 2,5 mg Mn/kg legemsvægt/dag med manganklorid via drikkevand i koncentrationer på 5 og 15 g/L. Den laveste koncentration på 5 g/L påvirkede tydeligt dyrenes sundhedstilstand og 15 g/L var for udtalt levertoksisk. Sammenfatning vedrørende virkningsmekanismerDosering med manganklorid i doser på 2,5 mg Mn/kg legemsvægt/dag i 12 uger var det højeste doseringsregimen, dyrene kunne udsættes for ved intraperitoneal injektion. Et yderligere supplement af mangan via drikkevand var ikke muligt. Det var netop dosering med manganklorid i doser på 2,5 mg Mn/kg legemsvægt/dag i 12 uger, som forårsagede de fleste neurokemiske effekter. Derfor valgtes dette doseringsregimen til kombinationsundersøgelsen. Dosering med mangansalte medførte opkoncentrering af mangan i hjernen, hvilket er en nødvendig forudsætning for induktion af neurotoksicitet. De påviste reducerede straitale dopamin, glutamat og GABA koncentrationer og acetylcholinesterase aktivitet efter 12 ugers dosering med manganklorid afspejler generel, omfattende effekt på hjernen. Der blev dog ikke identificeret nogen entydig mekanisme, som involverede dopamin eller nogen af de andre undersøgte parametre, som kunne tænkes at give anledning til sundhedsmæssige problemer. Det kan alligevel konkluderes, at der blev påvist forøgede mangankoncentrationer i hjernen og flere ændringer i koncentrationer af stoffer med signalfunktion, hvilket traditionelt opfattes som tidlig varsling af neurotoksikologisk effekt (Ladefoged et al.1991; Østergaard et al. 1993). 6.2 ChlorpyrifosundersøgelserInden dose-range undersøgelsen var det nødvendigt at gennemføre en præliminær undersøgelse til fastsættelse af doseringsregie. Præliminær undersøgelseDoseringen med chlorpyrifos blev valgt på basis af en undersøgelse publiceret af Huff et al. i 2001. Projektets undersøgelser viste, at det var muligt at injecere chlorpyrifos subkutant i nakkeregionen een gang om ugen i 12 uger i doser på 15 og 30 mg/kg legemsvægt. Udover kliniske inspektioner, som ikke viste sundhedsmæssige problemer ved dosering, valgtes cholinesterase aktivitet som effektparameter, da organophosphater som chlorpyrifos hæmmer cholinesterase aktivitet. Begge doser hæmmede striatal cholinesterase aktivitet som indikation på chlorpyrifos nåede frem til corpus striatum Dose-range undersøgelsenDenne undersøgelse havde til formål at identificere mulige virkningsmekanis-mer for chlorpyrifos’ neurotoksicitet og at fastsætte dosisforhold i kombinationsundersøgelsen. Der blev doseret subkutant i nakkeregionen med doser på 2,5, 15 eller 30 mg/kg legemsvægt en gang om ugen i 12 uger. Dette gav ikke anledning til kliniske indikationer på komprommiteret sundhedstilstand. Der var enkelte spredte effekter på vægt af nyrer og binyrer, men intet bemærkelsesværdigt. Histokemi og immunhistokemi: Cellemorfologi, TUNEL farvning og farvning for caspase-aktivitet påviste ikke indikationer på neurodegeneration, herunder induktion af ROS og apoptose. I litteraturen findes ingen relevante undersøgelser af effekten af chlorpyrifos på induktion af oxidativt stress i voksne dyrs hjerner. Noradrenalin, dopamin og 5-hydroxytryptamin koncentrationer: Chlorpyrifos havde ikke effekt på koncentrationen af noradrenalin i corpus striatum eller resthjerne. Det var bemærkelsesværdigt, at chlorpyrifos øgede koncentrationen af dopamin i corpus striatum ved de to laveste doser(128±14; 132±16 nmol/g væv), men ikke ved den højeste (116±17 nmol/g væv) i forhold til kontrol (113±21 nmol/g væv). Ved dosering øgedes resthjernens 5-HT koncentration ved alle tre doser på en dosisrelateret måde (2,94±0,25; 3,21±0,38; 3,24±0,45 nmol/g væv) i forhold til kontrol (2,45±0,35 nmol/g væv). Der er kun publiceret lidt omkring chlorpyrifos’ effekt på det dopaminerge og noradrenerge system. Det er påvist, at chlorpyrifos reducede dopamins optagelse i striatale synaptosomer efter 2 ugers dosering (Karen et al. 2001; Bloomquist et al. 2002) og reducede noradrenalin og dopamin turnover (Slotkin et al. 2002). Der er også rapporteret øget dopamin turnover (Karen et al. 2001). Det er ikke umiddelbart muligt at se, hvorledes disse fund kan forklare undersøgelsens resultater. De påviste generelle chlorpyrifos inducerede stigninger i dopamin og 5-HT koncentrationer i henholdsvis striatum og resthjerne var bemærkelsesværdige, specielt da der i resthjernen var tale om ændringer forenelige med dosis-response. Ændringerne var dog så små, at de ikke antages at give anledning til toksikologiske problemer. Koncentration af aminosyrer med signalfunktion: Doseringen med chlorpyrifos ændrede ikke koncentrationen af glutamat, taurin eller GABA. Intet tydede således på, at det glutaminerge eller GABAer system blev påvirket af chlorpyrifos, hvilket der heller ikke er dokumentation for i litteraturen. Cholinesterase aktiviteter: Chlorpyrifos inducerede dosis-relateret reduktion i aktiviteten af AChE i corpus striatum (Figur 18), resthjerne (Figur 19) og plasma (Figur 20). Der var også dosisrelateret reduktion i aktiviteten af BuChE i resthjerne (Figur 19) og plasma (Figur 20). Dette vides at være en generel effekt hos organophosphatholdige pesticider som chlorpyrifos. Den højeste dosis chlorpyrifos gav reduktioner af AChE aktiviteten til henholdsvis 23% og 35% i corpus striatum og resthjerne i forhold til kontrolværdierne. Dette demonstrerede kraftig påvirkning af hjernens cholinerge system, men det er almindeligt kendt, at sådan reduktion ikke nødvendigvis påvirker dyrene sundhedstilstand (Jacobsen et al. 2004). Ekspression af α–synuclein eller synaptophysin: Der var ingen effekt på ekspressionen af α–synuclein eller synaptophysin. Da α-synuclein er biomarkør for Parkinsons sygdom, er manglende effekt på denne parameter i overensstemmelse med, at chlorpyrifos ikke reducerede, men øgede dopaminkoncentrationen i corpus striatum. Den uændrede synaptophysin ekspression antydede, at chlorpyrifos ikke ændrer antallet af kontaktpunkter mellem nervecellerne, hvilket skulle forventes hvis der var tegn på neurodegeneration. Sammenfatning vedrørende virkningsmekanismerDer blev påvist flere effekter på koncentrationen af stoffer med signalfunktion, hvilket traditionelt opfattes som tidlig varsling af neurotoksikologisk effekt (Ladefoged et al. 1991; Østergaard et al. 1993). Det var bemærkelsesværdigt, at chlorpyrifos øgede koncentrationen af dopamin i corpus striatum. Der var signifikante effekter af alle doser af chlorpyrifos på aktiviteten af AChE i corpus striatum. Undersøgelsen var således velegnet til valg af chlorpyrifos dosis i kombinationsundersøgelsen. På basis af undersøgelsens dosis-effekt forløb for hæmning af AChE aktiviteten valgtes en ugentlig subkutan chlorpyrifosdosis på 15 mg/kg legemsvægt til kombinationsundersøgelsen, da denne dosis også ville kunne ”plads” til kombinationseffkter i begge retninger. 6.3 ManebundersøgelserInden dose-range undersøgelsen var det nødvendigt at gennemføre en præliminær undersøgelse til fastsættelse af doseringsregie. På basis heraf udførtes dose-range undersøgelsen. Dose-range undersøgelsenFormålet med denne undersøgelse var at identificere mulige virkningsmeka-nismer for manebs neurotoksicitet og at fastsætte dosisforhold i kombinationsundersøgelsen. Der blev doseret intraperitonealt med 0; 7,5; 15 og 30 mg maneb/kg legemsvægt/uge i 12 uger. Da en dosis på 10 mg maneb/kg legemsvægt ækvivelerer en mangandosis på 2,1 mg manganion/kg legemsvægt svarer den ugentlige mangandosering som 30 mg maneb kun til 36% af den ugentlige mangandosis med manganklorid. Ved sektionen var der imidlertid rester af ikke absorberet maneb i bughulen, hvilket viste kontinuert absorption i løbet af ugen, hvilket modsvarer menneskers langtidsdosering med mindre doser. Vægt af dyr,hjerne og andre organer: Det mest bemærkelsesværdige fund var, at manebdosering dosisrelateret øgede miltens vægt (1,17±0,19 g; 1,18±0,14 g; 1,22±0,14 g) i forhold til kontrol (0,98±0,10 g). Dette var foreneligt med effekt på immunsystemet, hvilket ikke er publiceret for manebs vedkommende, men bør undersøges nøjere i andet regi. Histkemi og immunhistokemir: Cellemorfologi, TUNEL farvning og farvning for caspase-aktivitet påviste ikke indikationer på neurodegeneration, herunder induktion af ROS og apoptose. I litteraturen findes ingen relevante undersøgelser af effekten af maneb på induktion af oxidativt stress i voksne dyrs hjerner. Mangankoncentrationer: Der blev ikke foretaget mangananalyser i resthjernen. Det var bemærkelsesværdigt, at dosering med maneb så markant øgede koncentrationen af mangan i corpus striatum (17,6±2,3; 20,7±5,9; 30,4±8,7 nmol/g væv) på en dosisrelateret måde i forhold til kontrol (11,5±3,7 nmol/g væv). Mangankoncentrationen i striatum var højere efter dosering med højeste dosis maneb (30,4±8,7 nmol/g væv) end efter dosering med manganklorid i 8 (26,6±5,3 nmol/g væv) og 12 (21,±5,1 nmol/g væv) uger, selvom den ugentlige dosis mangan med maneb kun udgjorde 36% af mangandosis med manganklorid, hvilket kunne tolkes som forskellig toksikokinetik for de to manganspecies, endskønt dette ikke umiddelbart synes at kunne forklare den store forskel. Mangan i hjernen måltes som uorganisk mangan efter foraskning. Derved ødelagdes alt organisk materiale, så der ikke kunne opnås information om mangans eventuelle organiske speciering. Der kunne derfor ikke specificeres om iagttagne effekter forårsaget af manebdosering skyldtes manganionen per se eller en eventuel organisk speciering af mangan. Under alle omstændigheder burde den dokumenterede dosis-respons sammenhæng undersøges nærmere, herunder i hvilken konformation og speciering mangan findes i hjernen efter maneb-dosering. Resultaterne dokumenterede tydeligt, at oprindeligt maneb-specieret mangan passerer blodhjernebarrieren. Alt andet lige vil der være en forøget risiko for at udvikle neurodegenerative lidelser i bl.a. corpus striatum og tidligere debut af Parkinsons sygdom ved ophobning af mangan uanset manganspeciering (Rasmussen et al. 2004). Noradrenalin, dopamin og 5-hydroxytryptamin koncentrationer: Undersøgelsen viste ikke effekter på koncentrationen af noradrenalin eller dopamin i corpus striatum eller resthjerne. Andre undersøgelser viser imidlertid, at manebdosering kan inducere efflux af dopamin fra striatum og derved bidrage til reduceret dopamin koncentration (Zhang et al. 2003a) og dopaminerg neurodegeneration, når maneb doseres alene (Zhou et al. 2004) og i kombination med paraquat (Fitsanakis et al. 2002; Thiruchelvam et al. 2000a,b; Thiruchelvam et al. 2003). Disse uoverensstemmelse mellem litteraturens og dose-range undersøgelsens resultater er svære at forklare. Dyreetiske aspekter begrænsede muligheden for at øge manebdosis i dose-range undersøgelsen. Højere manebdoser kunne via øget koncentration af mangan reducere dopamin koncentration i corpus striatum, hvilket dose-range undersøgelsen for mangan netop viste. Dette kunne være en mulig forklaring af uoverensstemmelsen. Manebdosering øgede 5-HT koncentrationen i corpus striatum (3,09±0,37; 3,10±0,94; 3,20±0,70 nmol/g væv) i forhold til kontrol (2,43±0,29 nmol/g væv) på en måde, som var forenelig med dosis-response. Der påvistes også forøget 5-HT koncentration i resthjernen (2,38±0,18; 2,42±0,24; 2,36±0,27 nmol/g væv) ved alle tre dosisniveauer i forhold til kontrol (2,05±0,27 nmol/g væv). Der var således tydelig effekt på det serotonerge nervesystem. Det er uvist, hvilke sundhedsmæssige manifestationer disse konsistente ændringer af 5-HT niveau kan medføre. Traditionelt opfattes sådanne ændringer som tidlig varsling af neurotoksikologisk effekt (Ladefoged et al. 1991; Østergaard et al. 1993). Der er ingen relevante undersøgelser i laboratoriedyr af effekten af manebdosering på koncentrationen af 5-HT i hjernen. Koncentration af aminosyrer med signalfunktion: Der var ingen effekter på aminosyrekoncentrationer i corpus striatum eller resthjerne. Dette antyder, at hverken det glutaminerge og GABAerge nervesystem blev påvirket af manebdoseringen. Der findes ingen relevante undersøgelser i laboratoriedyr af effekten af manebdosering på koncentrationen glutamat, taurin eller GABA i hjerner fra laboratoriedyr. Aktivitet af acetylcholin- og butyrylcholinestease: Der var stigninger i aktiviteten af acetylcholin- og butyrylcholinesterase i corpus striatum og resthjerne, specielt ved højeste dosis. Stigninger ses sjældent og kan ikke umiddelbart forklares på anden måde end øget ekspression af de pågældende enzymer. Den biologiske betydning af sådanne stigninger kendes ikke. Umiddelbart vil øget aktivitet medføre hurtigere hydrolyse af acetylcholin og deraf følgende kortere virkningstid ved receptorerne og reduceret cholinerg aktivitet i nervesystemet. Der findes ingen relevante undersøgelser af effekten af manebdosering på cholinesterase aktiviteter. Ekspression af α–synuclein eller synaptophysin: Der var ingen effekter på ekspressionen af α–synuclein eller synaptophysin i resthjerne eller corpus striatum. I en ny undersøgelse er det vist, at maneb in vitro i cellekulturer inducerer dannelse af cytoplasmatiske inklusioner, som indeholder α-synuclein (Zhou et al. 2004). Da α-synuclein er biomarkør for Parkinsons sygdom er dose-range undersøgelsens manglende effekt på denne parameter i overensstemmelse med, at maneb ikke reducerede dopaminkoncentrationen i corpus striatum. Uændret synaptophysin ekspression antyder at chlorpyrifos ikke ændrede antallet af kontaktpunkter mellem nervecellerne, hvilket skulle forventes, hvis der var tegn på neurodegeneration. Sammenfatning vedrørende virkningsmekanismerUndersøgelsen dokumenterede, at oprindeligt maneb-specieret mangan passerede blodhjernebarrieren og blev opkoncentreret dosis-relateret i corpus striatum. Opkoncentrering af mangan fra maneb er en nødvendig forudsætning for induktion af neurotoksicitet. Der blev påvist flere effekter på koncentrationen af stoffer med signalfunktion specielt for 5-HT’s vedkommende, hvor der var dosis-relateret stigning i corpus striatum. Traditionelt opfattes sådanne ændringer som tidlig varsling af neurotoksikologisk effekt (Ladefoged et al. 1991; Østergaard et al. 1993). Herudover var undersøgelsen velegnet til valg af maneb dosis i kombinationsundersøgelsen. På basis af undersøgelsens resultater valgtes en ugentlig intraperitoneal manebdosis på 10 mg/kg legemsvægt til kombinationsundersøgelsen. 6.4 KombinationsundersøgelsenDer findes ingen kombinationsundersøgelser i den tilgængelige litteratur, som undersøger neurotoksisk effekt af kombinationer af mangan, chlorpyrifos og maneb. Dette skyldes udover de mange kombinationsmuligheder også, at sådanne studier er yderst komplicerede, langvarige og dyre at udføre. Der er dog øget interesse og behov for at undersøge kombinationseffekter af pesticider (Miljøstyrelsen 2003). Kliniske observationer og fund ved sektionDet var bemærkelsesværdigt, at doseringen med manganklorid inducerede toksiske effekter i form af reduceret hjernevægt (2,03±0,06 g) samt øget vægt af binyrer (0,053±0,007 g) og milt (1,27±0,27 g) (Tabel 4) i forhold til kontrol (Hjerne: 2,11±0,06 g; binyrer: 0,048±0,006 g; milt (1,07±0,12 g). Reduceret hjernevægt kunne ikke bekræftes i undersøgelsen med 8 og 12 ugers dosering med MnO2 og MnCl2 (Tabel 1). Det var også bemærkelsesværdigt, at binyrernes vægt generelt var påvirket af dosering. Udover manganklorid, øgedes binyrernes vægte også efter dosering med kombinationer af manganklorid og chlorpyrifos (0,064±0,007 g), manganklorid og maneb (0,054±0,006 g), chlorpyrifos og maneb (0,054±0,009 g) og kombinationen af alle tre stoffer (0,057±0,006 g) i forhold til kontrol (0,048±0,006 g). Dette tolkes som en generel effekt af mangan. Den øgede vægt af binyrer og milt skyldtes antageligt en reaktion på den inflammatoriske tilstand, som opstod i bughulen efter injektion. MangankoncentrationerDoseringerne med manganklorid og maneb øgede mangankoncentrationen i corpus striatum, resthjerne og plasma. Generelt øgede dosering med manganklorid mangankoncentrationerne mere end maneb gjorde, hvilket er i overensstemmelse med, at den ugentlige mangandosis med maneb kun udgør 24% af mangandosis med manganklorid (Figur 34). Sammenligning af resultaterer opnået i de to dose-range undersøgelser for henholdsvis manganklorid og maneb viste højere mangankoncentration i corpus striatum ved dosering med maneb. Dette blev i manebundersøgelsen tolket som mulig forskel i toksikokinetik. Kombinationsundersøgelsen viste dog, at det nok snarere skyldtes, at det var resultater fra to forskellige undersøgelser, som blev sammenlignet. I Tabel 5 ses, at samtidig dosering med manganklorid og maneb øgede mangankoncentrationen i corpus striatum og resthjerne mere, end hvis der kun blev doseret med manganklorid, hvilket tilskrives manebdoseringen. Specielt var denne additive effekt tydelig i corpus striatum efter kombinationsbehandlingen med manganklorid, chlorpyrifos og maneb. Det kan konkluderes, at der var en tilnærmet additiv relation mellem mangankoncentration i corpus striatum og doseringerne med manganklorid og maneb. Effekter på signalstoffer, aminosyrer og cholinesterase aktiviteterDosering med manganklorid, chlorpyrifos og maneb i kombinationsunder-søgelsen havde en række effekter på de neurokemiske parametre, i nogle tilfælde var de sammenfaldende med de effekter, som blev påvist i de tre dose-range undersøgelser med disse stoffer, i andre tilfælde ikke. Dosering med manganklorid alene Signalstoffer: I kombinationsundersøgelsen påvirkede dosering med manganklorid ikke koncentrationen af dopamin og 5-HT i corpus striatum eller resthjerne. I dose-range undersøgelsen påvistes derimod reduceret koncentration af både dopamin og 5-HT i corpus striatum efter dosering med manganklorid i 12 uger. Som i kombinationsundersøgelsen var der ikke effekt på koncentrationen af noradrenalin eller dopamin i resthjernen. Aminosyrer: I kombinationsundersøgelsen påvirkede dosering med manganklorid ikke koncentrationen af nogen aminosyre med signalfunktion i corpus striatum eller resthjerne. Dose-range undersøgelsen påviste derimod reduceret koncentration af glutamat, taurin og GABA i corpus striatum efter dosering med manganklorid i 12 uger, hvorimod taurinkoncentrationen steg i resthjernen i modsætning til i kombinationsundersøgelsen. Cholinesteraser: I kombinationsundersøgelsen påvirkede dosering med manganklorid ikke aktiviteten af acetyl- og butyrylcholinesterase i corpus striatum eller resthjerne. Dose-range undersøgelsen påviste derimod reduceret aktivitet af acetylcholinesterase i både corpus striatum og resthjerne. Virkningsmekanismer: Som det ses af ovenstående, var der en bemærkelsesværdig generel forskel mellem neurokemiske effekter i corpus striatum induceret af manganklorid i kombinationsundersøgelsen og i dose-range undersøgelsen: Koncentrationerne af dopamin, 5-HT, glutamat, taurin og GABA samt aktiviteten af cholinesteraser faldt generelt i dose-range undersøgelsen, medens der ikke var effekt i kombinationsundersøgelsen. Dette kan ikke umiddelbart forklares endegyldigt, men en mulighed årsag kunne være, at der efter 12 ugers dosering i dose-range undersøgelsen indtraf gliose i corpus striatum, og at dette af ukendte årsager ikke skete i kombinationsundersøgelsen, hvilket understøttes af de histopatologiske undersøgelser i kombinationsunderøgelsen. Ved gliose kunne neuroner - herunderdopaminerge neuroner - i corpus striatum blive erstattet af gliaceller. Gliacellerne ville da bidrage med vægt til corpus striatum, men ville ikke i samme omfang bidrage med dopamin, aminosyrer med signalfunktion og cholinesterase aktivitet, hvilket således kunne forklare de generelle fald i koncentrationer og enzymaktiviteter, selvom corpus striatums vægt ikke var påvirket i forhold til kontrol. Resultaterne fra kombinationsundersøgelsen og dose-range undersøgelsen viste ingen konsistente effekter på resthjernens koncentration af noradrenalin, dopamin, 5-HT og aminosyrer samt cholinesterase aktiviteter. Dosering med chlorpyrifos alene Signalstoffer: I kombinationsundersøgelsen var der ingen effekt på koncentrationen af NA, dopamin eller 5-HT i corpus striatum (Figur 35) eller i resthjernen (Figur 36), når chlorpyrifos blev doseres alene. I dose-range undersøgelsen øgede chlorpyrifos derimod koncentrationen af dopamin i corpus striatum ved dosering med 2,5 og 15 mg/kg (Figur 14), men ikke ved højeste dosis. Disse ændringer kunne imidlertid ikke tillægges nogen biologisk betydning, dels på grund af deres ringe størrelsesorden, dels den kendsgerning, at de ikke blev genfundet i kombinationsundesøgelsen. I dose-range undersøgelsen var der heller ingen ændringer i koncentrationen af noradrenalin i resthjernen (Figur 15). For dopamin’s vedkommende påvistes et fald i koncentrationen i resthjernen ved dosering med 15 mg/kg legemsvægt (Figur 15) og en dosisrelateret stigning i 5-HT koncentrationen ved alle tre doser (Figur 15). Resultaterne fra kombinationsundersøgelsen kunne ikke bekræfte dette, hvorfor kan ikke umiddelbart forklares. Aminosyrer: I kombinationsundersøgelsen var der ingen effekt af chlorpyrifos på koncentrationen af nogen aminosyre i hverken corpus striatum (Figur 37) eller resthjerne (Figur 38), hvilket er i fuldstændig overensstemmelse med resultaterne fra dose-range undersøgelsen (Figur 26 og 27). Cholinesteraser: I kombinatrionsundersøgelsen var der reduceret aktivitet af acetylchloinesterase og butyrylcholinesterase i corpus striatum, resthjerne og plasma (Figur 39, 40, 41). Dette understøttes af resultaterne i dose-range undersøgelsen, hvor der blev demonstreret dosisrelateret, markant reduceret AChE aktivitet i corpus striatum (Figur 18), resthjerne (Figur 19) og i plasma (Figur 20) efter 12 ugers dosering med chlorpyrifos. Virkningsmekanismer: Der blev således påvist fælles, generelle effekter af chlorpyrifos i kombinationsundersøgelsen og dose-range undersøgelsen, idet cholinesterase aktiviteter blev reduceret i corpus striatum, resthjerne og plasma. Herudover viste ingen af de to undersøgelser effekt på nogen aminosyrekoncentration i corpus striatum. Derimod var der forskel i effekt på dopaminkoncentrationen i corpus striatum, som kun kan forklares ved biologisk variation. Udover de reducerede aktiviteter af cholinesteraser, viste resultaterne fra kombinationsundersøgelsen og dose-range undersøgelsen ingen konsistente effekter på resthjernens koncentration af noradrenalin, dopamin, 5-HT og aminosyrer. Dosering med maneb alene Signalstoffer: I kombinationsunderesøgelsen ses, at manebdosering ikke påvirkede dopamin eller 5-HT koncentrationerne i corpus striatum (Figur 35). I resthjernen var der et mindre et fald i noradrenalin koncentrationen (Figur 36), som næppe kan tillægges nogen biologisk betydning. I dose-range undersøgelsen havde manebdosering ikke effekt på koncentrationen af dopamin i hverken corpus striatum (Figur 24) eller resthjerne (Figur 25). Derimod var der en konsistent tilsyneladende svag dosisrelateret mindre stigning af koncentrationen af 5-HT i corpus striatum (Figur 24). En tilsvarende stigning, dog ikke dosisrelateret, blev også set i koncentrationen af 5-HT i resthjernen (Figur 25). Dette antyder, at det serotoninerge system blev påvirket af manebdosering. Aminosyrer: I kombinationsundersøgelsen reducerede manebdosering koncentrationen af glutamat og taurin i corpus striatum (Figur 37). I resthjernen reduceredes kun taurinkoncentrationen (Figur 38). Dette var ikke i overensstemmelse med resultaterne i dose-range undersøgelsen, som slet ikke viste effekter på aminosyrekoncentrationerne i corpus stratum eller resthjerne. Cholinesteraser: I kombinationsundersøgelsen reducerede manebdosering aktiviteten af AChE i corpus striatum (Figur 39). Faldet var imidlertid for lille til at få biologisk betydning. Der var ingen ændringer i hverken AChE eller BuChE aktiviteterne i resthjernen (Figur 40). I dose-range undersøgelsen havde manebdosering derimod ikke effekt på aktiviteten af AChE i corpus striatum (Figur 28) og gav kun marginale stigninger i resthjernens AChE og BUChE aktiviteter (Figur 29). Der var ingen generel effekt i plasma (Figur 30). Virkningsmekanismer: Der var forskel på undersøgelsernes effekt på striatale koncentrationer af 5-HT, glutamat og taurin og acetylcholinesterase aktivitet. Disse forskelle i effekter kan ikke umiddelbart forklares ved andet end biologisk variation. Resultaterne fra kombinationsundersøgelsen og dose-range undersøgelsen viste ingen konsistente effekter på resthjernens koncentration af noradrenalin, dopamin, 5-HT og aminosyrer samt cholinesterase aktiviteter. Dosering med manganklorid og chlorpyrifos i kombination Signalstoffer: I kombinationsundersøgelsen var der er ingen effekt på dopamin og 5-HT koncentrationerne i corpus striatum (Figur 35), hvilket er i overensstemmelse med, at kombinationsundersøgelsens enkeltdoseringer med manganklorid og chlorpyrifos heller ikke viste effekt på striatale dopamin og 5-HT koncentrationer. I kombinationsundersøgelsen steg 5-HT koncentrationen i resthjerne, hvilket også var tilfældet ved doseringen med chlorpyrifos alene (Figur 36), hvorfor kombinationsbehandlingens effekt kan tilskrives chlorpyrifos alene. Aminosyrer: Som ved enkeltstofdosering med manganklorid og chlorpyrifos var der ingen effekter på koncentrationen af nogen aminosyre i corpus striatum (Figur 37) eller resthjerne (Figur 38). Cholinesteraser: Ændringerne af aktiviteterne af AChE og BuChE i corpus striatum (Figur 39), resthjerne (Figur 40) og plasma (Figur 41) var konsistente med ændringerne ved dosering med chlorpyrifos alene. Interaktion: Kombinationsundersøgelsen påviste ingen interaktion mellem manganklorid og chlorpyrifos på neurokemiske effektparametre. Dosering med manganklorid og maneb i kombination Signalstoffer: I overensstemmelse med kombinationsundersøgelsens enkeltdoseringer med manganklorid og maneb, var der er ingen effekt på NA, dopamin og 5-HT koncentrationer i corpus striatum ved kombinationsbehandlingen (Figur 35), hvorimod 5-HT koncentrationen i resthjerne var øget (Figur 36), som det også blev påvist ved enkeltdosering med maneb (Figur 36), hvorfor kombinationsbehandlingens effekt i resthjernen kan tilskrives maneb alene. Aminosyrer: Kombinationsdoseringen sænkede glutamat og taurin koncentrationerne i corpus striatum (Figur 37), men ikke i resthjerne (Figur 38). Sænkningen i glutamat og taurin blev også set ved enkeltdosering med maneb, hvorfor kombinationsbehandlingens effekt på koncentrationen af disse to aminosyrer i corpus striatum kan tilskrives maneb alene. Cholinesteraser: I corpus striatum var aktiviteten af acetylcholinesterase reduceret (Figur 39), og der var ingen effekt på butyrylcholinesterase aktivitet (Figur 39), hvilket også påvistes ved enkeltdosering med maneb, som således kan forklare kombinationsbehandlingens effekt. Der var ingen effekt på aktivitet af de to cholinesteraser i resthjerne (Figur 40). Interaktion: Kombinationsundersøgelsen påviste ingen interaktion mellem manganklorid og maneb på neurokemiske effektparametre Dosering med maneb og chlorpyrifos i kombination Signalstoffer: I kombinationsundersøgelsen reduceredes koncentrationen af dopamin og 5-HT i corpus striatum (Figur 35). Som ved enkeltstof doseringerne øgede kombinationsdoseringen også 5-HT i resthjerne (Figur 36), hvorimod koncentrationen af noradrenalin og dopamin faldt ved kombinationsbehandling (Figur 36). Da kombinationsundersøgelsens effekt ved enkeltdosering med maneb og chlorpyrifos var stigninger i koncentrationen af henholdsvis 5-HT og dopamin, var der en tilsyneladende antagonistisk interaktion mellem maneb og chlorpyrifos med hensyn til de påviste reducerede koncentrationer af dopamin og 5-HT i corpus striatum ved kombinationsbehandlingen, hvilket ikke blev påvist i resthjernen. Aminosyrer: Som ved enkeltdosering med maneb eller chlorpyrifos var der ingen effekt af kombinationen på aminosyrekoncentrationer i corpus striatum (Figur 37) eller resthjerne (Figur 38). Cholinesteraser: Ændringer i aktiviteterne af AChE og BuChE i corpus striatum og resthjerne (Figur 39 og 40) samt plasma (Figur 41) var konsistente med ændringerne ved dosering med chlorpyrifos alene. Interaktion: Udover en tilsyneladende samspilseffekt mellem maneb og chlorpyrifos, som medførte til reduceret koncentration af dopamin og 5-HT i corpus striatum, var der ingen interaktion. De reducerede dopamin og 5-HT koncentrationer i corpus striatum er dog så små, at de ikke anses at medføre biologiske effekter. Dosering med manganklorid, chlorpyrifos og maneb i kombination Signalstoffer: I corpus striatum var der ingen effekt på koncentrationen af dopamin og 5-HT (Figur 35). 5-HT koncentrationen steg i resthjernen (Figur 36), hvilket er i overensstemmelse med, at kombinationsdoseringen med chlorpyrifos og maneb også inducerede stigning (Figur 36). Aminosyrer: Kombinationen gav ingen ændringer i aminosyrekoncentrationer i corpus striatum (Figur 37) eller resthjerne (Figur 38). Der kunne forventes en svag kombinationseffekt i corpus striatum med hensyn til koncentrationerne af glutamat og taurin i corpus striatum, fordi der blev påvist et koncentrationsfald efter dosering med kombinationen af manganklorid og maneb (Figur 37). Denne uoverensstemmelse kan umiddelbart kun forklares ved biologisk variation eller ved, at manganklorid antagonistisk ophævede kombinationseffekten af maneb og chlorpyrifos. Cholinesteraser: Ændringerne af aktiviteterne af AChE og BuChE corpus striatum (Tabel 32), resthjerne (Tabel 33) og plasma (Tabel 33) var konsistente med ændringerne ved dosering med chlorpyrifos alene. Caspase-3 og GAD aktivitet samt α-synuclein og synaptophysin ekspression: De neurokemiske undersøgelser viste ikke effekt på caspase-3 aktivitet, hvilket var i overensstemmelse med manglende fund i de histopatologiske undersøgelser. GAD-aktiviteten var ikke påvirket, hvilket var i overensstemmesle med uændrede koncentrationer af glutamat og GABA. α-synuclein er biomarkør for Parkinsons sygdom. Neurokemiske undersøgelser viste, at denne parameter ikke var påvirket. Uændret synaptophysin ekspression antydede, at antallet af kontaktpunkter mellem nervecellerne ikke var ændret, hvilket ellers skulle forventes, som tidligt tegn på neurodegeneration. Interaktion: Der var ingen entydige interaktion ved samtidig dosering med manganklorid, chlorpyrifos og maneb. Den viste samspilseffekt mellem maneb og chlorpyrifos med hensyn til reduceret striatal koncentration af dopamin og 5-HT kunne således ikke eftervises, hvilket ikke udelukker, at manganklorid antagoniserede manebs og chlorpyrifos’ samspilseffelt. Er dette tilfældet, er der også tale om en samspilseffekt, om end det ikke er foreneligt med øget risiko for Parkinsons sygdom . Plasmaprolaktin koncentrationDer var ingen doseringsrelateret effekt på koncentrationen af prolaktin i plasma. Dette var i overensstemmelse med manglende effekt på dopamin koncentrationen. Histopatologiske undersøgelserUndersøgelsen viste ikke ændringer i farvning for tyrosinhydroxylase som markør for effekt på det dopaminerge system, hvilket var i overensstemmelse med de manglende effekter på dopamin koncentrationen målt ved neurokemiske analyser. En blandt flere sandsynlige mekanismer for mangans neurotoksicitet er induktion af oxidativt stress (Erikson et al. 2004a). Mangan vides at kunne inducere ROS, og bedømt ud fra induktion af ROS påvist i in vitro undersøgelser i Cath.a celler, som er specielt velegnede til undersøgelser af det dopaminerge system, så er manganklorid mere toksisk end mangandioxid (Worley et al. 2002). Oxidativt stress kan føre til neurodegeneration via apoptose. Undersøgelserne viste ingen histopatologiske (morfologi, caspase-3 farvning og TUNEL farvning) indikationer herpå. Dette kunne skyldes, at hjernerne blev undersøgt på et uhensigtsmæssigt stadium af apoptosen. Imidlertid fandtes, som andre også har vist (ASTDR 2000; Zhang et al. 2003b), en reduceret hjernevægt som mulig indikation på neurodegeneration. Sammenfatning vedrørende virkningsmekanismerDer blev påvist flere ændringer i koncentrationen af stoffer med signal-funktion (noradrenalin, dopamin, 5-HT, glutamat, taurin, GABA) og aktivitet af acetylcholinesterase, hvilket traditionelt opfattes som tidlig varsling af neurotoksikologisk effekt (Ladefoged et al. 1991; Østergaard et al. 1993). Vurderet på basis af de målte neurokemiske og histopatologiske parametre blev der ikke påvist entydige virkningsmekanismer for mangan eller maneb i corpus striatum eller resthjerne, hvorimod chlorpyrifos konsistent reducerede aktiviteten af cholinesteraser i både -corpus striatum og resthjernen. Der var en tilsyneladende interaktion mellem maneb og chlorpyrifos i corpus striatum, idet kombinationsbehandling med disse to stoffer reducerede koncentrationerne af både dopamin og 5-HT, dog kun til et niveau som ikke skønnes at få biologisk betydning. Under alle omstændigheder var specielt faldet i dopaminkoncentration i overensstemmelse med relationen mellem fald i striatal dopaminkoncentration og Parkinson’s sygdom. Resultaterne for samtidig dosering med manganklorid, chlorpyrifos og maneb kunne imidlertid ikke bekræfte dette, hvilket kan forklares ved biologisk variation eller ved muligheden af, at manganklorid antagoniserede samspilseffekten af maneb og chlorpyrifos, hvilket i givet fald også er en samspilseffekt. Der blev ikke påvist histopatologiske forandringer i nærværende undersøgelsesdesign. Dette udelukker dog ikke, at der indenfor de 12 uger kunne have været forbigående induktioner af GFAP ekspression og apoptose, hvilket så ikke kunne registreres ved afslutningen af undersøgelserne efter 12 ugers dosering. Der blev påvist en interessante interaktion på toksikokinetisk niveau. Dette var interaktionen mellem mangan og maneb, idet resultaterne var forenelige med en svag additiv effekt på ophobning af mangan i hjernen. Såfremt manganophobningen i hjernen har betydning for risiko for udvikling af Parkinsons sygdom, så må det konkluderes, at denne interaktion vil øge risikoen for at udvikle Parkinsons sygdom. 7 Konklusion7.1 Virkningsmekanismer, arbejdshypoteser og interaktionerChlorpyrifos reducerede aktiviteten af cholinesteraser konsistent i både corpus striatum og resthjernen. Herudover blev der ikke identificeret entydige virkningsmekanismer for mangan, chlorpyrifos eller maneb i corpus striatum eller resthjerne ved sammenligning af resultaterne opnået i dose-range undersøgelserne med enkeltstofferne og i kombinationsundersøgelsens dosering med enkeltstofferne. Derfor kunne de gennemførte undersøgelser med rotten som model og anvendelsen af morfologiske, immunhistokemiske og neurokemiske effektparametre ikke bekræfte den oprindelige arbejdshypotese om interaktion mellem mangan og pesticider i relation til udvikling af parkinsonisme. Forklaringen herpå er delvist, at det ikke har været teknisk muligt at presse doseringen højt nok op til at inducere reelle neurotoksiske effekter af mangan, der svarer til de effekter, der ses ved inhalation af mangan. Herudover kan det ikke afvises, at andre doseringsregimer og aflivningstidspunkter måske ville have været mere velegnede. Der blev dog påvist en række neurotoksiske effekter af doseringerne. Den striatale dopaminkoncentration blev valgt som en åbenbar parameter for effekt af mangandosering. I dose-range undersøgelsen med mangansalte kunne en mindre reduktion påvises, men ved gentagelsen i kombinationsundersøgelsen kunne denne ændring ikke genfindes. Generelt ses lignende inkonsistens i de effekter af mangandosering, som er beskrevet i litteraturen. I dose-range undersøgelserne af chlorpyrifos og maneb blev der fundet effekter, som også er blevet påvist i undersøgelser publiceret af andre. Der blev dokumenteret en relativ god dosis afhængig ophobning af mangan i hjernen efter dosering med manganklorid og maneb doseret alene og i kombination. Der påvistes en interaktion med hensyn til mangankoncentrationen i hjernen, idet resultaterne var i overensstemmelse med en svag additiv effekt af manganklorid og maneb. Tilsyneladende var der en begrænsning af muligheden for ophobning af mangan i corpus striatum, idet dose-range undersøgelsen viste, at mangankoncentrationen efter 12 ugers dosering ikke var forskellig fra 8 ugers dosering. Det kunne ikke afgøres om nogle af de udvalgte parametre ændredes tidsafhængigt. Dette gjalt især GFAP, TUNEL og caspase-3 aktivitet, og det kunne ikke udelukkes, at homeostatiske mekanismer kunne have reetablere normale forhold for signalstoffer efter 12 ugers dosering. Sammenfattende kan det konkluderes, at det under de anvendte undersø-gelsesbetingelser ikke var muligt at dokumentere konsistente effekter på neurokemiske eller histopatologiske markører for tidlig neurodegeneration. Der var tilsyneladende kun tale om interaktioner ved den manganophobning i hjernen, der skete efter samtidig dosering med manganklorid og maneb og ved den reduktion i 5-HT koncentrationen, som skete ved samtidig dosering med chlorpyrifos og maneb. 7.2 Rotten som modelDet var ikke muligt at dosere rotterne med mere end 2,5 mg mangan/kg legemsvægt/dag i 12 uger. De tre dose-range undersøgelser var velegnede til fastsættelse af doseringsregimen i kombinationsundersøgelsen. I den periode, hvori projektet blev gennemført, har der været en ”eksplosion” i antallet af publikationer, som på forskellig vis har forsøgt at udforske sundhedsrisiko ved eksponering for pesticider, herunder manganholdige. Projektes undersøgelser viste i lighed hermed, at rotten var i stand til at udtrykke mange af de karakteristika, som ses ved Parkinsons sygdom, såvel neurokemiske som histologiske. Undersøgelserne viste, at dosis, doseringshyppighed og doseringsvarighed udover specieringen af mangansalt var af afgørende betydning for den fordeling af mangan, der fandt sted i hjernen hos rotten. Det faktum, at det ikke var muligt at påvise et konsistent mønster af effekter som følge af dosering med mangan, chlorpyrifos eller maneb er ikke ensbetydende med, at andre doseringsregimer og aflivningstidspunkter ikke ville kunne have gjort dette i rotten. Derfor anses rotten stadig som den praktisk bedst egnede model, og den model man har størst erfaring med og mest referencedata fra. 8 Perspektivering8.1 Forskningsfaglige aspekter og perspektiverDer er et potentielt sundhedsmæssigt problem med samspilseffekter mellem mangan og pesticider og som rapporten belyser ved at opsummere den viden, der i de senere år er samlet om pesticider, mangan og Parkinsons sygdom er der behov for at undersøge dette yderligere. Et afgørende perspektiv for sådanne videre studier må baseres på andre måder for mangandosering, eventuelt andre laboratoriedyr end rotten. Ideelt skulle mangan antagelig doseres ved inhalation. Dette er teknisk meget krævende og forbundet med for alvorlige dyreetiske problemer. Et alternativ er at anvende andre laboratoriedyr end rotten, her er specielt minigrise relevante, selv om aben ville være endnu bedre egnede. Indledningsvis ville det dog være vigtigt at supplere projektets undersøgelser med andre doseringsvarigheder til afsløring af, om projektets manglende konsistente effekter skyldtes normaliseringer eller kompensationer af inducerede effekter. Mangan ophobningen i hjernen kunne tænkes at forårsage hjerneskader, når hjernen ældes via den veldokumenterede mekanisme: ROS induktion. Undersøgelse af dette vigtige perspektiv ville kræve enten længerevarende dosering eller undersøgelse af hjernens funktion ved en højere alder. Manganholdige pesticider, specielt maneb, kan stadig udgøre et sundhedsmæssigt problem, specielt hvis eksponeringen er tilstrækkelig stor. Der findes dog ingen undersøgelser, der specifikt analyserer eksponeringens størrelse hos mennesker. Den neurotoksiske effekt af maneb er vanskelig at påvise ved klassiske guideline undersøgelser, hvilket aktualiserer nye metoder. Nuværende procedurer og praktis for godkendelse af nye pesticider og til revurdering af eksisterende pesticider på markedet baseres primært på guideline undersøgelser i rotter. Disse guidelines er ikke specielt designede til at kunne påvise neurodegeneration. Der er derfor behov for yderligere specialundersøgelser i rotter for at kunne vurdere denne arts anvendelsesmuligheder og begrænsninger til påvisning af tidlige neurodegenerative tilstande. Effekter af mangansalte, chlorpyrifos og maneb og kombinationer heraf vil kunne studeres på mekanistisk plan ved anvendelse af in vitro undersøgelser i egnede cellelinier. En relevant cellelinie i forhold til kemikaliers effekt på udvikling af Parkinsons sygdom er Cath.a cellelinien, idet denne er specielt velegnet til at undersøge effekter på det dopaminerge system. Herudover har in vitro metoder den store fordel, at der hurtigt og prisbilligt kan undersøges mange stoffer og kombinationer heraf. Herudover vil QSAR være et stærk supplerende redskab til kvalificeret udvælgelse af de pesticider, som ville være relevante at teste. Ud fra den eksisterende viden var der valgt relevante parametre til at beskrive virkningsmekanismerne for udvikling af parkinsonisme. Disse parametre blev også udtrykt i rotten. For visse af parametrenes vedkommende kunne man forestille sig, at en korterevarende dosering og aflivning af dyrene efter f.eks. 4 uger, tydeligere kunne have vist ændringer, som også beskrevet i udvalgte pesticidundersøgelser i litteraturen. Dette kunne dreje sig om astrocytaktivering med GFAP ændringer og apoptose både undersøgt morfologisk og ved caspase-3 aktivering. Muligheden for at anvende andre, tidlige markører for neurodegeneration eksisterer, men rationalet for deres udvælgelse er ikke så velfunderet, som det var for projektets parametre. Et vigtigt perspektiv for forståelse af interaktionsmulighederne mellem mangan og maneb er det faktum, at maneb med sit indhold af mangan bidrager til en øgning af mangankoncentrationen regionalt. De manganforbindelser, som hjernen indeholder som følge af manganklorid og maneb doseringen, påkalder sig et behov for flere undersøgelser for bedre at kunne forstå doseringens eventuelle sammenhænge med udvikling af Parkinsons sygdom og mangans binding og speciering regionalt. Der er derfor behov for supplerende analytisk forskningsarbejde med henblik på at karakterisere, hvilke speciering mangan har i de undersøgte hjernedele. 8.2 Administrative aspekter og perspektiverDet er vigtigt at holde sig for øje, at den manglende påvisning af effekter på det dopaminerge system i nærværende undersøgelser ikke er ensbetydende med, at menneskers eksponering for mangan og pesticider ikke udgør et reelt sundhedsmæssigt problem, som skal vurderes nøje i fremtiden. Essentielle elementer hertil er stedse at være up-to-date med ny relevant litteratur og at støtte forskningen på området, så manglende viden kan blive tilvejebragt. Det er også vigtigt at forbedre data for fremtidig godkendelse af nye pesticider og revurdering af på markedet værende pesticider. Hertil er der behov for at intensivere arbejdet med at forbedre internationale guidelines. Dette bør ske ved udvikling og validering af specielle dyremodeller og cellekulturer, som er egnede til påvisning af kemiske stoffers potentiale for at inducere neurodegenerative tilstande efter længerevarende, lavdosis eksponering. 9 ReferencerAlessio,L., Apostoli,P., Ferioli,A., and Lombardi,S. (1989) Interference of manganese on neuroendocrinal system in exposed workers. Preliminary report. Biol.Trace.Elem.Res., 21, 249-253. Ali,M.M., Murthy,R.C., Mandal,S.K., and Chandra,S.V. (1985) Effect of low protein diet on manganese neurotoxicity: III. Brain neurotransmitter levels. Neurobehav.Toxicol.Teratol., 7, 427-431. Ali,S.F., Hong,J.S., Wilson,W.E., Lamb,J.C., Moore,J.A., Mason,G.A., and Bondy,S.C. (1982) Subchronic dietary exposure of rats to chlordecone (Kepone) modifies levels of hypothalamic beta-endorphin. Neurotoxicology, 3, 119-124. Ali,S.F., Duhart,H.M., Newport,G.D., Lipe,G.W., and Slikker,W., Jr. (1995) Manganese-induced reactive oxygen species: comparison between Mn+2 and Mn+3. Neurodegeneration, 4, 329-334. Arbejdsmiljøinstituttet (2004). Manganudsættelse ved metalstøbning og -forarbejdning i Danmark. En udredning om eksisterende viden med fokus på eksponering og helbredseffekter. Rapport. Arlien-Soborg, P. (2001) Chronic Toxic Encephalopathy Following Occupational Manganese Exposure. 8th Meeting of the International Neurotoxicology Association, 87. Aschner,M. (1999) Manganese homeostasis in the CNS. Environ.Res., 80, 105-109. Aschner,M. (2000a) Manganese: brain transport and emerging research needs. Environ.Health. Perspect., 108, 429-432. Aschner,M. (2000b) Neuron-astrocyte interactions: implications for cellular energetics and antioxidant levels. Neurotoxicology, 21, 1101-1107. ATSDR. (2000) Toxicological Profile for Manganese (Update). U. S. Department of Health & Human services. Public Health Services. Agency for Toxic Substances and Disease Registry. September. Autissier,N., Rochette,L., Dumas,P., Beley,A., Loireau,A., and Bralet,J. (1982) Dopamine and norepinephrine turnover in various regions of the rat brain after chronic manganese chloride administration. Toxicology, 24, 175-182. Baba,M., Nakajo,S., Tu,P.H., Tomita,T., Nakaya,K., Lee,V.M., Trojanowski,J.Q., and Iwatsubo,T. (1998) Aggregation of α-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. Am. J. Pathol., 152, 879-884. Bachurin,S.O., Tkachenko,S.E., and Lermontova,N.N. (1991) Pyridine derivatives: structure-activity relationships causing parkinsonism-like symptoms. Rev.Environ.Contam. Toxicol., 122, 1-36. Baek,S.Y., Lee,M.J., Jung,H.S., Kim,H.J., Lee,C.R., Yoo,C., Lee,J.H., Lee,H., Yoon,C.S., Kim,Y.H., Park,J., Kim,J.W., Jeon,B.S., and Kim,Y. (2003) Effect of manganese exposure on MPTP neurotoxicities. Neurotoxicology, 24, 657-665. Ball,J. (2001) Current advances in Parkinson's disease. Trends Neurosci., 24, 367-369. Barbeau,A. (1984) Manganese and extrapyramidal disorders (a critical review and tribute to Dr. George C. Cotzias). Neurotoxicology, 5, 13-35. Barc,S., Page,G., Fauconneau,B., Barrier,L., and Huguet,F. (2001) A new in vitro approach for investigating the MPTP effect on DA uptake. Neurochem.Int., 38, 243-248. Barlow,B.K., Thiruchelvam,M.J., Bennice,L., Cory-Slechta,D.A., Ballatori,N., and Richfield,E.K. (2003) Increased synaptosomal dopamine content and brain concentration of paraquat produced by selective dithiocarbamates. J.Neurochem., 85, 1075-1086. Barlow,B.K., Richfield,E.K., Cory-Slechta,D.A., and Thiruchelvam,M. (2004) A fetal risk factor for Parkinson's disease. Dev.Neurosci., 26, 11-23. Barlow,B.K., Lee,D.W., Cory-Slechta,D.A., and Opanashuk,L.A. (2005) Modulation of antioxidant defense systems by the environmental pesticide maneb in dopaminergic cells. Neurotoxicology, 26, 63-75. Betarbet,R., Sherer,T.B., MacKenzie,G., Garcia-Osuna,M., Panov,A.V., and Greenamyre,J.T. (2000) Chronic systemic pesticide exposure reproduces features of Parkinson's disease. Nat.Neurosci., 3, 1301-1306. Bird,E.D., Anton,A.H., and Bullock,B. (1984) The effect of manganese inhalation on basal ganglia dopamine concentrations in rhesus monkey. Neurotoxicology, 5, 59-65. Bloomquist,J.R., Barlow,R.L., Gillette,J.S., Li,W., and Kirby,M.L. (2002) Selective effects of insecticides on nigrostriatal dopaminergic nerve pathways. Neurotoxicology, 23, 537-544. Bohlen Und,H.O. (2004) Synucleins and their relationship to Parkinson's disease. Cell Tissue Res., 318, 163-174. Bonilla,E. and Diez-Ewald,M. (1974) Effect of L-DOPA on brain concentration of dopamine and homovanillic acid in rats after chronic manganese chloride administration. J.Neurochem., 22, 297-299. Bougria,M., Vitorica,J., Cano,J., and Machado,A. (1995) Implication of dopamine transporter system on 1-methyl-4-phenylpyridinium and rotenone effect in striatal synaptosomes. Eur. J. Pharmacol., 291, 407-415. Brenneman,K.A., Wong,B.A., Buccellato,M.A., Costa,E.R., Gross,E.A., and Dorman,D.C. (2000) Direct olfactory transport of inhaled manganese ((54)MnCl(2)) to the rat brain: toxicokinetic investigations in a unilateral nasal occlusion model. Toxicol. Appl. Pharmacol., 169, 238-248. Calne,D.B., Chu,N.S., Huang,C.C., Lu,C.S., and Olanow,W. (1994) Manganism and idiopathic parkinsonism: similarities and differences. Neurology, 44, 1583-1586. Castro,S.L. and Zigmond,M.J. (2001) Stress-induced increase in extracellular dopamine in striatum: role of glutamatergic action via N-methyl-D-aspartate receptors in substantia nigra. Brain Res., 901, 47-54. Chandra,S.V. (1983) Psychiatric illness due to manganese poisoning. Acta Psychiatr.Scand.Suppl., 303, 49-54. Chandra,S.V., Murthy,R.C., Husain,T., and Bansal,S.K. (1984) Effect of interaction of heavy metals on (Na+ -K+) ATPase and the uptake of 3H-DA and 3H-NA in rat brain synaptosomes. Acta Pharmacol. Toxicol. (Copenh.), 54, 210-213. Clegg,D.J. and van Gemert,M. (1999a) Determination of the reference dose for chlorpyrifos: proceedings of an expert panel. J.Toxicol.Environ.Health B Crit.Rev., 2, 211-255. Clegg,D.J. and van Gemert,M. (1999b) Expert panel report of human studies on chlorpyrifos and/or other organophosphate exposures. J.Toxicol.Environ.Health B Crit.Rev., 2, 257-279. Cohen,G. and Heikkila,R.E. (1974) The generation of hydrogen peroxide, superoxide radical, and hydroxyl radical by 6-hydroxydopamine, dialuric acid, and related cytotoxic agents. J.Biol.Chem., 249, 2447-2452. Cohen,G. (2000) Oxidative stress, mitochondrial respiration, and Parkinson's disease. Ann.N.Y..Acad.Sci., 899, 112-120. Cuervo,A.M., Stefanis,L., Fredenburg,R., Lansbury,P.T., and Sulzer,D. (2004) Impaired degradation of mutant α-synuclein by chaperone-mediated autophagy. Science, 305, 1292-1295. Dalgaard,M., Nellemann,C., Lam,H.R., Sorensen,I.K., and Ladefoged,O. (2001) The acute effects of mono(2-ethylhexyl)phthalate (MEHP) on testes of prepubertal Wistar rats. Toxicol.Lett., 122, 69-79. Davis,K.L., Yesavage,J.A., and Berger,P.A. (1978) Single case study. Possible organophosphate-induced parkinsonism. J.Nerv.Ment.Dis., 166, 222-225. Deamer,N.J., O'Callaghan,J.P., and Genter,M.B. (1994) Olfactory toxicity resulting from dermal application of 2,6-dichlorobenzonitrile (dichlobenil) in the C57Bl mouse. Neurotoxicology, 15, 287-293. Desaiah,D. (1985) Chlordecone interaction with catecholamine binding and uptake in rat brain synaptosomes. Neurotoxicology, 6, 159-165. Desole,M.S., Esposito,G., Migheli,R., Fresu,L., Sircana,S., Zangani,D., Miele,M., and Miele,E. (1995) Cellular defence mechanisms in the striatum of young and aged rats subchronically exposed to manganese. Neuropharmacology, 34, 289-295. Dexter,D.T., Carter,C.J., Wells,F.R., Javoy-Agid,F., Agid,Y., Lees,A., Jenner,P., and Marsden,C.D. (1989) Basal lipid peroxidation in substantia nigra is increased in Parkinson's disease. J.Neurochem., 52, 381-389. Di Monte,D., Irwin,I., Kupsch,A., Cooper,S., DeLanney,L.E., and Langston,J.W. (1989) Diethyldithiocarbamate and disulfiram inhibit MPP+ and dopamine uptake by striatal synaptosomes. Eur. J.Pharmacol., 166, 23-29. Dorman,D.C., Struve,M.F., Vitarella,D., Byerly,F.L., Goetz,J., and Miller,R. (2000) Neurotoxicity of manganese chloride in neonatal and adult CD rats following subchronic (21-day) high-dose oral exposure. J.Appl.Toxicol., 20, 179-187. Ellman,G.L., Courtney,K.D., Andres,V., Jr., and Feather-Stone,R.M. (1961) A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem.Pharmacol., 7, 88-95. Engel,L.S., Checkoway,H., Keifer,M.C., Seixas,N.S., Longstreth,W.T., Jr., Scott,K.C., Hudnell,K., Anger,W.K., and Camicioli,R. (2001) Parkinsonism and occupational exposure to pesticides. Occup .Environ. Med., 58, 582-589. Erikson,K.M. and Aschner,M. (2003) Manganese neurotoxicity and glutamate-GABA interaction. Neurochem.Int., 43, 475-480. Erikson,K.M., Syversen,T., Steinnes,E., and Aschner,M. (2004b) Globus pallidus: a target brain region for divalent metal accumulation associated with dietary iron deficiency. J.Nutr.Biochem., 15, 335-341. Erikson,K.M., Dobson,A.W., Dorman,D.C., and Aschner,M. (2004a) Manganese exposure and induced oxidative stress in the rat brain. Sci.Total Environ., 334-335, 409-416. Fitsanakis,V.A., Amarnath,V., Moore,J.T., Montine,K.S., Zhang,J., and Montine,T.J. (2002) Catalysis of catechol oxidation by metal-dithiocarbamate complexes in pesticides. Free Radic.Biol.Med., 33, 1714-1723. Gavin,C.E., Gunter,K.K., and Gunter,T.E. (1999) Manganese and calcium transport in mitochondria: implications for manganese toxicity. Neurotoxicology, 20, 445-453. Gianutsos,G. and Murray,M.T. (1982) Alterations in brain dopamine and GABA following inorganic or organic manganese administration. Neurotoxicology, 3, 75-81. Gianutsos,G., Morrow,G.R., and Morris,J.B. (1997) Accumulation of manganese in rat brain following intranasal administration. Fundam.Appl.Toxicol, 37, 102-105. Gibb,W.R. and Lees,A.J. (1988) The relevance of the Lewy body to the pathogenesis of idiopathic Parkinson's disease. J.Neurol.Neurosurg.Psychiatry, 51, 745-752. Golbe,L. (1998) Parkinson's disease: nature meets nurture. Lancet, 352, 1328-1329. Gorell,J.M., Johnson,C.C., Rybicki,B.A., Peterson,E.L., Kortsha,G.X., Brown,G.G., and Richardson,R.J. (1997) Occupational exposures to metals as risk factors for Parkinson's disease. Neurology, 48, 650-658. Gorell,J.M., Johnson,C.C., Rybicki,B.A., Peterson,E.L., and Richardson,R.J. (1998) The risk of Parkinson's disease with exposure to pesticides, farming, well water, and rural living. Neurology, 50, 1346-1350. Gwiazda,R.H., Lee,D., Sheridan,J., and Smith,D.R. (2002) Low cumulative manganese exposure affects striatal GABA but not dopamine. Neurotoxicology, 23, 69-76. Hartmann,A., Michel,P.P., Troadec,J.D., Mouatt-Prigent,A., Faucheux,B.A., Ruberg,M., Agid,Y., and Hirsch,E.C. (2001) Is Bax a mitochondrial mediator in apoptotic death of dopaminergic neurons in Parkinson's disease? J.Neurochem., 76, 1785-1793. Hartree,E.F. (1972) Determination of protein: a modification of the Lowry method that gives a linear photometric response. Anal.Biochem., 48, 422-427. Hastings,T.G. (1995) Enzymatic oxidation of dopamine: the role of prostaglandin H synthase. J.Neurochem., 64, 919-924. Henriksson,J., Tallkvist,J., and Tjalve,H. (1999) Transport of manganese via the olfactory pathway in rats: dosage dependency of the uptake and subcellular distribution of the metal in the olfactory epithelium and the brain. Toxicol..Appl.Pharmacol., 156, 119-128. Henriksson,J. and Tjalve,H. (2000) Manganese taken up into the CNS via the olfactory pathway in rats affects astrocytes.Toxicol.Sci., 55, 392-398. Hirata,Y., Adachi,K., and Kiuchi,K. (1998) Activation of JNK pathway and induction of apoptosis by manganese in PC12 cells. J.Neurochem., 71, 1607-1615. Ho,S.C., Woo,J., and Lee,C.M. (1989) Epidemiologic study of Parkinson's disease in Hong Kong. Neurology, 39, 1314-1318. Holdiness,M.R. (1983) Chromatographic analysis of glutamic acid decarboxylase in biological samples. J.Chromatogr., 277, 1-24. Huang,C.C., Weng,Y.H., Lu,C.S., Chu,N.S., and Yen,T.C. (2003) Dopamine transporter binding in chronic manganese intoxication. J.Neurol., 250, 1335-1339. Huff,R.A., Abu-Qare,A.W., and Abou-Donia,M.B. (2001) Effects of sub-chronic in vivo chlorpyrifos exposure on muscarinic receptors and adenylate cyclase of rat striatum. Arch.Toxicol., 75, 480-486. Hussain,T., Ali,M.M., and Chandra,S.V. (1987) The combined effect of Pb2+ and Mn2+ on monoamine uptake and Na+, K+-ATPase in striatal synaptosomes. J.Appl.Toxicol., 7, 277-280. Ingersoll,R.T., Montgomery,E.B., Jr., and Aposhian,H.V. (1995) Central nervous system toxicity of manganese. I. Inhibition of spontaneous motor activity in rats after intrathecal administration of manganese chloride. Fundam..Appl.Toxicol., 27, 106-113. Ingersoll,R.T., Montgomery,E.B., Jr., and Aposhian,H.V. (1999) Central nervous system toxicity of manganese. II: Cocaine or reserpine inhibit manganese concentration in the rat brain. Neurotoxicology, 20, 467-476. Jacobsen,H., Ostergaard,G., Lam,H.R., Poulsen,M.E., Frandsen,H., Ladefoged,O., and Meyer,O. (2004) Repeated dose 28-day oral toxicity study in Wistar rats with a mixture of five pesticides often found as residues in food: alphacypermethrin, bromopropylate, carbendazim, chlorpyrifos and mancozeb. Food Chem.Toxicol., 42, 1269-1277. Jellinger,K.A. and Stadelmann,C. (2000a) Mechanisms of cell death in neurodegenerative disorders. J.Neural Transm., 59, 95-114. Jellinger,K.A. and Stadelmann,C.H. (2000b) The enigma of cell death in neurodegenerative disorders. J.Neural Transm., 60, 21-36. Junn,E. and Mouradian,M.M. (2001) Apoptotic signaling in dopamine-induced cell death: the role of oxidative stress, p38 mitogen-activated protein kinase, cytochrome c and caspases. J.Neurochem., 78, 374-383. Kanda,S., Bishop,J.F., Eglitis,M.A., Yang,Y., and Mouradian,M.M. (2000) Enhanced vulnerability to oxidative stress by α-synuclein mutations and C-terminal truncation. Neuroscience, 97, 279-284. Kannan,K. and Jain,S.K. (2000) Oxidative stress and apoptosis. Pathophysiology, 7, 153-163. Karen,D.J., Li,W., Harp,P.R., Gillette,J.S., and Bloomquis,J.R. (2001) Striatal dopaminergic pathways as a target for the insecticides permethrin and chlorpyrifos. Neurotoxicology, 22, 811-817. Kawata,F. (1990) [Studies on monoamine metabolism in the rat brain with overdosage of manganese]. Nippon Hoigaku Zasshi, 44, 137-146. Kessler,K.R., Wunderlich,G., Hefter,H., and Seitz,R.J. (2003) Secondary progressive chronic manganism associated with markedly decreased striatal D2 receptor density. Mov.Disord., 18, 217-218. Koller,W., Vetere-Overfield,B., Gray,C., Alexander,C., Chin,T., Dolezal,J., Hassanein,R., and Tanner,C. (1990) Environmental risk factors in Parkinson's disease. Neurology, 40, 1218-1221. Komura,J. and Sakamoto,M. (1992) Effects of manganese forms on biogenic amines in the brain and behavioral alterations in the mouse: long-term oral administration of several manganese compounds. Environ.Res., 57, 34-44. Kontou,S., Tsipi,D., and Tzia,C. (2004) Kinetics of maneb degradation during thermal treatment of tomatoes. J.Agric.Food Chem., 52, 1212-1219. Kurosaki,R., Muramatsu,Y., Kato,H., and Araki,T. (2004) Biochemical, behavioral and immunohistochemical alterations in MPTP-treated mouse model of Parkinson's disease. Pharmacol.Biochem.Behav., 78, 143-153. Ladefoged,O., Strange,P., Moller,A., Lam,H.R., Ostergaard,G., Larsen,J.J., and Arlien-Soborg,P. (1991) Irreversible effects in rats of toluene (inhalation) exposure for six months. Pharmacol.Toxicol., 68, 384-390. Ladefoged,O., Lam,H.R., Østergaard,G., Nielsen,E., and Arlien-Søborg,P. (1995) Neurotoxicology - Review of Definitions, Methodology and Criteria. Miljøprojekt nr.282.Ministry of Environment and Energy, Denmark.Danish Environmental Protection Agency,1-110. Ladefoged,O., Lam,H.L., Sørensen,I.K., Thorup,I.P.K., and Edellfors,S. (2000) Chemical induced apoptosis. TemaNord, 578, 1-104. Ladefoged,O., Hougaard,K.S., Hass,U., Sorensen,I.K., Lund,S.P., Svendsen,G.W., and Lam,H.R. (2004) Effects of combined prenatal stress and toluene exposure on apoptotic neurodegeneration in cerebellum and hippocampus of rats. Basic Clin.Pharmacol.Toxicol., 94, 169-176. Laemmli,U.K. (1970) Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 227, 680-685. Lafuente,A., Marquez,N., Pousada,Y., Pazo,D., and Esquifino,A.I. (2000) Possible estrogenic and/or antiandrogenic effects of methoxychlor on prolaktin release in male rats. Arch.Toxicol., 74, 270-275. Lai,C.T. and Yu,P.H. (1997) Dopamine- and L-beta-3,4-dihydroxyphenylalanine hydrochloride (L-Dopa)-induced cytotoxicity towards catecholaminergic neuroblastoma SH-SY5Y cells. Effects of oxidative stress and antioxidative factors. Biochem.Pharmacol., 53, 363-372. Lai,J.C., Lim,L., and Davison,A.N. (1981) Differences in the inhibitory effect of Cd2+, Mn2+ and Al3+ on the uptake of dopamine by synaptosomes from forebrain and from striatum of the rat. Biochem.Pharmacol., 30, 3123-3125. Lai,J.C., Leung,T.K., and Lim,L. (1984) Differences in the neurotoxic effects of manganese during development and aging: some observations on brain regional neurotransmitter and non-neurotransmitter metabolism in a developmental rat model of chronic manganese encephalopathy. Neurotoxicology, 5, 37-47. Lai,J.C., Minski,M.J., Chan,A.W., Leung,T.K., and Lim,L. (1999) Manganese mineral interactions in brain. Neurotoxicology, 20, 433-444. Lam,H.R., Ladefoged,O., Ostergaard,G., and O'Callaghan,J.P. (2000a) Inhalation exposure to white spirit causes region-dependent alterations in the levels of glial fibrillary acidic protein. Neurotoxicol.Teratol., 22, 725-731. Lam,H.R., Ladefoged,O., Ostergaard,G., Hass,U., Lund,S.P., and Simonsen,L. (2000b) Four weeks' inhalation exposure of Long Evans rats to 4-tert-butyltoluene: effect on evoked potentials, behaviour, and brain neurochemistry. Pharmacol.Toxicol., 87, 11-17. Lam,H.R., Lof,A., and Ladefoged,O. (1992) Brain concentrations of white spirit components and neurotransmitters following a three week inhalation exposure of rats. Pharmacol.Toxicol., 70, 394-396 Lee,M., Hyun,D., Halliwell,B., and Jenner,P. (2001) Effect of the overexpression of wild-type or mutant α-synuclein on cell susceptibility to insult. J.Neurochem., 76, 998-1009. Leung,T.K., Lai,J.C., Tricklebank,M., Davison,A.N., and Lim,L. (1982) Chronic manganese treatment of rats alters synaptosomal uptake of dopamine and the behavioural response to amphetamine administration. J.Neurochem., 39, 1496-1499. Lewen,A., Matz,P., and Chan,P.H. (2000) Free radical pathways in CNS injury. J.Neurotrauma, 17, 871-890. Lowry,O.H., Rosebrough,N.J., Farr,A.L., and Randall,R.J. (1951) Protein measurement with the Folin phenol reagent. J.Biol.Chem., 193, 265-275. Malecki,E.A., Devenyi,A.G., Beard,J.L., and Connor,J.R. (1999) Existing and emerging mechanisms for transport of iron and manganese to the brain. J.Neurosci.Res., 56, 113-122. Manzo,L., Artigas,F., Martinez,E., Mutti,A., Bergamaschi,E., Nicotera,P., Tonini,M., Candura,S.M., Ray,D.E., and Costa,L.G. (1996) Biochemical markers of neurotoxicity. A review of mechanistic studies and applications. Hum.Exp.Toxicol., 15, S20-S35. Marey-Semper,I., Gelman,M., and Levi-Strauss,M. (1993) The high sensitivity to rotenone of striatal dopamine uptake suggests the existence of a constitutive metabolic deficiency in dopaminergic neurons from the substantia nigra. Eur.J.Neurosci., 5, 1029-1034. Marsden,C.D. (1994) Parkinson's disease. J Neurol.Neurosurg.Psychiatry, 57, 672-681. Mattson,M.P., Culmsee,C., and Yu,Z.F. (2000) Apoptotic and antiapoptotic mechanisms in stroke. Cell Tissue Res., 301, 173-187. Mattson,M.P., Duan,W., Pedersen,W.A., and Culmsee,C. (2001) Neurodegenerative disorders and ischemic brain diseases. Apoptosis, 6, 69-81. Meco,G., Bonifati,V., Vanacore,N., and Fabrizio,E. (1994) Parkinsonism after chronic exposure to the fungicide maneb (manganese ethylene-bis-dithiocarbamate). Scand.J.Work Environ.Health, 20, 301-305. McGeer,P.L., Itagaki,S., Akiyama,H., and McGeer,E.G. (1988) Rate of cell death in parkinsonism indicates active neuropathological process. Ann.Neurol., 24, 574-576. Miljøstyrelsen (2003c) Combined Actions and Interactions of Chemicals in Mixtures. Fødevarerapport 2003:12. Miljøstyrelsen (2003a) Pesticides Research. No. 80. Report on the Health Effects of Selected Pesticides Coformulants. Rapport. Miljøstyrelsen (2003b) Pesticides Research. No. 81. In Vivo Investigation of Dietary Exposure to 5 Pesticides. Rapport. Montes,S., Alcaraz-Zubeldia,M., Muriel,P., and Rios,C. (2001) Striatal manganese accumulation induces changes in dopamine metabolism in the cirrhotic rat. Brain Res., 891, 123-129. Mutti,A., Bergamaschi,E., Alinovi,R., Lucchini,R., Vettori,M.V., and Franchini,I. (1996) Serum prolaktin in subjects occupationally exposed to manganese. Ann.Clin.Lab.Sci., 26, 10-17. Mutti,A. and Smargiassi,A. (1998) Selective vulnerability of dopaminergic systems to industrial chemicals: risk assessment of related neuroendocrine changes. Toxicol.Ind.Health, 14, 311-323. Nelson,K., Golnick,J., Korn,T., and Angle,C. (1993) Manganese encephalopathy: utility of early magnetic resonance imaging. Br.J.Ind.Med., 50, 510-513. Newland MC (1999) Animal models of manganese`s neurotoxicity. Neurotoxicology, 20, 415-32. Newland,M.C., Ceckler,T.L., Kordower,J.H., and Weiss,B. (1989) Visualizing manganese in the primate basal ganglia with magnetic resonance imaging. Exp.Neurol., 106, 251-258. Newsome,W.H. (1976) Residues of four ethylenebis(dithiocarbamates) and their decomposition products on field-sprayed tomatoes. J.Agric.Food Chem., 24, 999-1001. Newsome,W.H. (1979) Residues of mancozeb, 2-imidazoline, and ethyleneurea in tomato and potato crops after field treatment with mancozeb. J.Agric.Food Chem., 27, 1188-1190. Niu,Q., He,S., Chen,Y., and Dai,F. (2001) [Effect on manganese exposure on blood prolaktin and plasma renin activity]. Wei Sheng Yan Jiu, 30, 91-92. Normandin,L., Panisset,M., and Zayed,J. (2002) Manganese neurotoxicity: behavioral, pathological, and biochemical effects following various routes of exposure. Rev.Environ.Health, 17, 189-217. Normandin,L., Ann,B.L., Salehi,F., Pierre,A., Kennedy,G., Mergler,D., Butterworth,R.F., Philippe,S., and Zayed,J. (2004) Manganese distribution in the brain and neurobehavioral changes following inhalation exposure of rats to three chemical forms of manganese. Neurotoxicology, 25, 433-441. O'Callaghan,J.P., Miller,D.B., and Reinhard,J.F., Jr. (1990a) Characterization of the origins of astrocyte response to injury using the dopaminergic neurotoxicant, 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Brain Res., 521, 73-80. O'Callaghan,J.P., Miller,D.B., and Reinhard,J.F., Jr. (1990b) 1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)-induced damage of striatal dopaminergic fibers attenuates subsequent astrocyte response to MPTP. Neurosci.Lett., 117, 228-233. O'Callaghan,J.P. (1993) Quantitative features of reactive gliosis following toxicant-induced damage of the CNS. Ann.N.Y.Acad Sci., 679, 195-210. O'Callaghan,J.P., Jensen,K.F., and Miller,D.B. (1995) Quantitative aspects of drug and toxicant-induced astrogliosis. Neurochem.Int., 26, 115-124. Ostergaard,G., Lam,H.R., Ladefoged,O., and Arlien-Soborg,P. (1993) Effects of six months' white spirit inhalation exposure in adult and old rats. Pharmacol.Toxicol., 72, 34-39. Page,G., Peeters,M., Najimi,M., Maloteaux,J.M., and Hermans,E. (2001) Modulation of the neuronal dopamine transporter activity by the metabotropic glutamate receptor mGluR5 in rat striatal synaptosomes through phosphorylation mediated processes. J.Neurochem., 76, 1282-1290. Panet,H., Barzilai,A., Daily,D., Melamed,E., and Offen,D. (2001) Activation of nuclear transcription factor kappa B (NF-kappaB) is essential for dopamine-induced apoptosis in PC12 cells. J.Neurochem., 77, 391-398. Patsakos,P.G., Liapis,K., Miliadis,G.E., and Zafiriou,K. (1992) Mancozeb residues on field sprayed apricots. Bull.Environ.Contam.Toxicol., 48, 756-761. Rasmussen A.A, Thulstrup A.M, Kolstad H.A, and Ellekilde-Bonde J.P (2004) Risiko for ekstrapyramidal lidelse ved udsættelse for mangan under nutidige danske arbejdsforhold. Ugeskrift for Læger, 49, 4461-4464. Roels,H., Meiers,G., Delos,M., Ortega,I., Lauwerys,R., Buchet,J.P., and Lison,D. (1997) Influence of the route of administration and the chemical form (MnCl2, MnO2) on the absorption and cerebral distribution of manganese in rats. Arch.Toxicol., 71, 223-230. Rossetti,V. and Lombard,A. (1996) Determination of glutamate decarboxylase by high-performance liquid chromatography. J.Chromatogr.B.Biomed.Appl., 681, 63-67. Roth,J.A., Feng,L., Walowitz,J., and Browne,R.W. (2000) Manganese-induced rat pheochromocytoma (PC12) cell death is independent of caspase activation. J.Neurosci.Res, 61, 162-171. Russell T (1992) Environmental risk factors in Parkinson’s disease. Food Chem.Toxicol., 30, 343-348. Schoenberg,B.S. (1987) Environmental risk factors for Parkinson's disease: the epidemiologic evidence. Can.J.Neurol.Sci., 14, 407-413. Semchuk,K.M., Love,E.J., and Lee,R.G. (1992) Parkinson's disease and exposure to agricultural work and pesticide chemicals. Neurology, 42, 1328-1335. Shen,X.M. and Dryhurst,G. (1998) Iron- and manganese-catalyzed autoxidation of dopamine in the presence of L-cysteine: possible insights into iron- and manganese-mediated dopaminergic neurotoxicity. Chem.Res.Toxicol., 11, 824-837. Sloth,J. and Larsen,E.H. (2000) The application of inductively coupled plasma reaction cell mass spectrometry for measurement of selenium isotopes, isotope ratios and chromatographic detection of selenoamino acids. J.Anal.At.Spectrom., 15, 669-672. Slotkin,T.A., Tate,C.A., Cousins,M.M., and Seidler,F.J. (2002) Functional alterations in CNS catecholamine systems in adolescence and adulthood after neonatal chlorpyrifos exposure. Brain Res.Dev.Brain Res., 133, 163-173. Slotkin,T.A. (2004a) Cholinergic systems in brain development and disruption by neurotoxicants: nicotine, environmental tobacco smoke, organophosphates. Toxicol.Appl.Pharmacol., 198, 132-151. Slotkin,T.A. (2004b) Guidelines for developmental neurotoxicity and their impact on organophosphate pesticides: a personal view from an academic perspective. Neurotoxicology, 25, 631-640. Smargiassi,A. and Mutti,A. (1999) Peripheral biomarkers and exposure to manganese. Neurotoxicology, 20, 401-406. St Pierre,A., Normandin,L., Carrier,G., Kennedy,G., Butterworth,R., and Zayed,J. (2001) Bioaccumulation and locomotor effect of manganese dust in rats. Inhal.Toxicol., 13, 623-632. Stokes,A.H., Hastings,T.G., and Vrana,K.E. (1999) Cytotoxic and genotoxic potential of dopamine. J.Neurosci.Res., 55, 659-665. Subhash,M.N. and Padmashree,T.S. (1990) Regional distribution of dopamine beta-hydroxylase and monoamine oxidase in the brains of rats exposed to manganese. Food Chem.Toxicol., 28, 567-570. Subhash,M.N. and Padmashree,T.S. (1991) Effect of manganese on biogenic amine metabolism in regions of the rat brain. Food Chem.Toxicol., 29, 579-582. Tatton,N.A. (2000) Increased caspase 3 and Bax immunoreactivity accompany nuclear GAPDH translocation and neuronal apoptosis in Parkinson's disease. Exp.Neurol., 166, 29-43. Thiruchelvam,M., Brockel,B.J., Richfield,E.K., Baggs,R.B., and Cory-Slechta,D.A. (2000a) Potentiated and preferential effects of combined paraquat and maneb on nigrostriatal dopamine systems: environmental risk factors for Parkinson's disease? Brain Res., 873, 225-234. Thiruchelvam,M., Richfield,E.K., Baggs,R.B., Tank,A.W., and Cory-Slechta,D.A. (2000b) The nigrostriatal dopaminergic system as a preferential target of repeated exposures to combined paraquat and maneb: implications for Parkinson's disease. J.Neurosci., 20, 9207-9214. Thiruchelvam,M., Richfield,E.K., Goodman,B.M., Baggs,R.B., and Cory-Slechta,D.A. (2002) Developmental exposure to the pesticides paraquat and maneb and the Parkinson's disease phenotype. Neurotoxicology, 23, 621-633. Thiruchelvam,M., McCormack,A., Richfield,E.K., Baggs,R.B., Tank,A.W., Di Monte,D.A., and Cory-Slechta,D.A. (2003) Age-related irreversible progressive nigrostriatal dopaminergic neurotoxicity in the paraquat and maneb model of the Parkinson's disease phenotype. Eur.J.Neurosci., 18, 589-600. Tjalve,H., Henriksson,J., Tallkvist,J., Larsson,B.S., and Lindquist,N.G. (1996) Uptake of manganese and cadmium from the nasal mucosa into the central nervous system via olfactory pathways in rats. Pharmacol.Toxicol., 79, 347-356. Tjalve,H. and Henriksson,J. (1999) Uptake of metals in the brain via olfactory pathways. Neurotoxicology, 20, 181-195. Tolwani,R.J., Jakowec,M.W., Petzinger,G.M., Green,S., and Waggie,K. (1999) Experimental models of Parkinson's disease: insights from many models. Lab.Anim.Sci., 49, 363-371. Tomas-Camardiel,M., Herrera,A.J., Venero,J.L., Cruz Sanchez-Hidalgo,M., Cano,J., and Machado,A. (2002) Differential regulation of glutamic acid decarboxylase mRNA and tyrosine hydroxylase mRNA expression in the aged manganese-treated rats. Brain Res.Mol.Brain Res., 103, 116-129. Towbin,H., Staehelin,T., and Gordon,J. (1979) Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc.Natl.Acad.Sci.U.S.A, 76, 4350-4354. Trojanowski,J.Q. and Lee,V.M. (2002) Parkinson's disease and related synucleinopathies are a new class of nervous system amyloidoses. Neurotoxicology, 23, 457-460. Tuchsen,F. and Jensen,A.A. (2000) Agricultural work and the risk of Parkinson's disease in Denmark, 1981-1993. Scand.J.Work Environ.Health, 26, 359-362. Uversky,V.N. (2004) Neurotoxicant-induced animal models of Parkinson's disease: understanding the role of rotenone, maneb and paraquat in neurodegeneration. Cell Tissue Res., 318 , 225-241. Veldman,B.A., Wijn,A.M., Knoers,N., Praamstra,P., and Horstink,M.W. (1998) Genetic and environmental risk factors in Parkinson's disease. Clin.Neurol.Neurosurg., 100, 15-26. Verity,M.A. (1999) Manganese neurotoxicity: a mechanistic hypothesis. Neurotoxicology, 20, 489-497. Vitarella,D., Wong,B.A., Moss,O.R., and Dorman,D.C. (2000) Pharmacokinetics of inhaled manganese phosphate in male Sprague-Dawley rats following subacute (14-day) exposure. Toxicol.Appl.Pharmacol., 163, 279-285. Walker,Q.D. and Mailman,R.B. (1996) Triadimefon and triadimenol: effects on monoamine uptake and release. Toxicol.Appl.Pharmacol., 139, 227-233. Witholt,R., Gwiazda,R.H., and Smith,D.R. (2000) The neurobehavioral effects of subchronic manganese exposure in the presence and absence of pre-parkinsonism. Neurotoxicol.Teratol., 22, 851-861. Worley,C.G., Bombick,D., Allen,J.W., Suber,R.L., and Aschner,M. (2002) Effects of manganese on oxidative stress in CATH.a cells. Neurotoxicology, 23, 159-164. Zayed,J., Ducic,S., Campanella,G., Panisset,J.C., Andre,P., Masson,H., and Roy,M. (1990) [Environmental factors in the etiology of Parkinson's disease]. Can.J.Neurol.Sci., 17, 286-291. Zhang,D., He,X., Zhang,W., and Tan,J. (1998) [Effect of manganese on the growth and development of rat offspring]. Wei Sheng Yan Jiu, 27, 237-240. Zhang,J., Fitsanakis,V.A., Gu,G., Jing,D., Ao,M., Amarnath,V., and Montine,T.J. (2003a) Manganese ethylene-bis-dithiocarbamate and selective dopaminergic neurodegeneration in rat: a link through mitochondrial dysfunction. J.Neurochem., 84, 336-346. Zhang,S., Zhou,Z., and Fu,J. (2003b) Effect of manganese chloride exposure on liver and brain mitochondria function in rats. Environ.Res., 93, 149-157. Zheng,W., Zhao,Q., Slavkovich,V., Aschner,M., and Graziano,J.H. (1999) Alteration of iron homeostasis following chronic exposure to manganese in rats. Brain Res., 833, 125-132. Zhou,Y., Shie,F.S., Piccardo,P., Montine,T.J., and Zhang,J. (2004) Proteasomal inhibition induced by manganese ethylene-bis-dithiocarbamate: relevance to Parkinson's disease. Neuroscience, 128, 281-291.
|