Fungiciders påvirkning af mykorrhizasvampes diversitet og funktion
2 Forsøgsmark og generelle metoder
- 2.1 Forsøgsareal og -jord
- 2.2 Fungicider
- 2.3 Forsøgsplanter og mykorrhizasvampe
- 2.4 Molekylære metoder
- 2.5 Kvantificering af mykorrhizasvampes vækst og fosfatoptagelse
- 2.6 Statistisk analyse
2.1 Forsøgsareal og –jord
Projektet gennemføres med jord og svampe fra to marker ved Snubbekorsgård i Tåstrup. Markerne indgår i henholdsvis et økologisk (mark 29) og et konventionelt (mark 21) sædskifte (Figur 2.1). Pesticider har ikke været anvendt i det økologiske sædskifte i de seneste 15 år. De to marker blev dyrket med vinterhvede i 2002 og med markært i 2003. I hver af markerne blev der udlagt to transekter, og forsøgsjord og mykorrhizasvampe er indsamlet langs disse transekter.
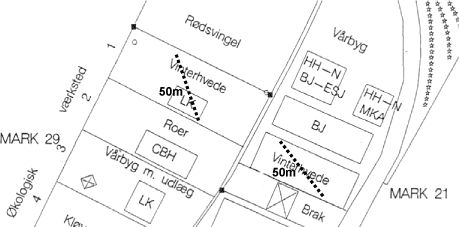
Figur 2.1. Svampe og jord til projektet er indsamlet langs to 50m transekter i økologiske (mark 29) og konventionelt (mark 21) dyrkede sædskifter ved Snubbekorsgaard, Tåstrup.
Jorden er en sandblandet lerjord (grovsand 23.7 %, finsand 26.2 %, silt 31.8 %, ler 16 %, organisk stof 2.3 %.) med pH 7.1 og et fosfortal på 2.7 og 4.0 i henholdsvis det økologiske og det konventionelle sædskifte.
2.2 Fungicider
Mancozeb er udvalgt som det centrale testfungicid i dette projekt, fordi mancozeb-forbruget tegnede sig for lidt over halvdelen af det samlede fungicidforbrug både i 2000 og 2004 (Anon., 2001; Anon., 2005). Mancozeb anvendes overvejende til kartofler, men også til bekæmpelse af ærtesyge. Mancozeb, det aktive stof i handelsvaren (fx. Dithane NT), er et polymer dithiocarbamate kontaktfungicid, som danner komplekser med metal-holdige enzymer og dermed hæmmer aktiviteten af bla. enzymer, der er involveret i produktion af adenosin triphosphate (ATP). Adsorptions koefficienten er høj (Koc ~ 6000) og mobiliteten i jordmatrix er derfor lav. Persistensen i jord er forholdsvis lav (T½ = 1-7 dage), men nedbrydningsproduktet ethylenethiourea (ETU) er mere persistent (T½ = 3-4 uger) (Jacobsen & Bossi, 1997). Halveringstider for mancozeb angives dog som 7-139 d af Christensen og Helweg (2003) med henvisning til The ARS Pesticide Properties Database, USDA.
Carbendazim har en kendt negativ virkning på mykorrhizasvampene (Kjoller & Rosendahl, 2000b; Schweiger & Jakobsen, 1998) og er derfor medtaget som referencestof, selv om stoffet ikke længere anvendes i Danmark. Carbendazim er et systemisk benzimidazole fungicide, som hæmmer polymeriseringen af tubulinmolekyler. Carbendazim adsorberes stærkt i jord (Koc ~ 3000) og er meget persistent (T½ = 6-12 måneder).
Når fungiciderne blev indblandet i jorden, blev den markækvivalente dosis beregnet på baggrund af en antagelse om, at hele markdosis opblandes i det øverste 5 cm jordlag. Dette estimat vil i betydeligt omfang afhænge af fungicidets adsorptions- og persistensegenskaber, samt af den mængde fungicid der tilbageholdes af afgrøden efter sprøjtning. De anvendte handelsvarer var Dithane DG NT (750 g mancozeb kg-1) og Derosal fl. (516 g carbendazim L-1) hvor anbefalet markdosis er hhv. 2 kg ha-1 og 0,7 L ha-1.
Indledende blev det vurderet i hvilket omfang effekten af de to fungicider på mykorrhizadannelse og –funktion ville afhænge af tilførselsmetode. I et potteforsøg med ært blev markdosis af hvert fungicid tilført enten direkte til jordoverfladen eller ved opblanding i jorden. Overfladetilførsel af carbendazim reducerede rodkolonisering fra 50 % til 36 %, medens opblanding resulterede i en stærk hæmning af mykorrhizaudviklingen til 2 %, og disse negative effekter kunne også aflæses i planternes fosfatindhold (2,0; 1,6 og 1,0 mg P pr. plante). Derimod havde mancozeb ikke signifikant effekt på hverken rodkolonisering eller P optagelse. Resultaterne viser, at tilførselsmetode kan have stor betydning for fungicideffekter på mykorrhiza. Det blev besluttet at anvende opblandingsmetoden i projektets planlagte eksperimenter for at sikre tilstedeværelsen af en kendt mængde fungicid i det jordvolumen, hvorfra mykorrhizasvampenes P optagelse skulle måles vha. radioaktivt P. Dette ville sikre den størst mulige reproducerbarhed i eksperimenterne.
2.3 Forsøgsplanter og mykorrhizasvampe
Ært cv Solare blev anvendt i alle eksperimenter bortset fra sammenligningen af svampeisolater inden for samme art (kapitel 4.2), hvor modelplanten Medicago truncatula blev anvendt i stedet. Ært blev valgt som primær forsøgsplante, fordi en række af de metoder, der skulle anvendes i nærværende projekt, delvis var udviklet i PEASE-projektet under Den Tværvidenskabelige Pesticidforskningsindsats. Valget af M. truncatula er begrundet i afsnit 4.2. Mykorrhizasvampe, som er anvendt i dyrkningsforsøgene, blev overvejende isoleret fra det økologiske sædskifte, mark 29, ved Snubbekorsgaard. Svampene blev i alle tilfælde opformeret i potter med jordkløver dyrket i 2-3 måneder en P-fattig bestrålet jord-sand blanding. Mykorrhizainokulum består af lufttør dyrkningssubstrat fra disse pottekulturer, med indehold af koloniserede rodstykker og sporer. Alt inokulum anvendt i projektet gennemløb en kvalitetstest i form af et bioassay, hvor koloniseringen af jordkløverplanter, dyrket i en 9:1 jord-inokulum blanding, blev målt efter tre ugers vækst. Der blev ikke anvendt inokulum, som resulterede i < 30 % kolonisering af testplanterne.
2.4 Molekylære metoder
2.4.1 PCR detektion af arbuskulær mykorrhizasvampe i planterødder
Sammenlignende undersøgelser af arbuskulære mykorrhizasvampe vanskeliggøres af, at svampene ikke kan dyrkes på kunstige medier. Samtidig er det ikke umiddelbart muligt at adskille svampearter i rødder på baggrund af forskelle i deres udseende. Hvis man ønsker at bestemme hvilke svampe der er til stede i en given plante, er det derfor nødvendigt at benytte en molekylærbiologisk strategi.
Anvendeligheden af molekylærbiologisk baserede detektionsmetoder afhænger af kendskabet til de organismer, man ønsker at detektere. Jo bedre kendskab man har til organismernes diversitet, jo bedre er mulighederne for at finde karakterer, der er specifikke for den givne organisme. Hvis man anvender en specifik DNA sekvens som mål (target) for sin detektion, er det derfor nødvendigt at have adgang til en database med nukleotidsekvenser fra beslægtede organismer, således at man kan vurdere sekvensens specificitet. I mange tilfælde kan man anvende sekvenser fra GenBank, som er tilgængelig via internettet (http://www.ncbi.nlm.nih.gov/).
Ved hjælp af PCR metoden mangfoldiggør man et specifikt stykke DNA til millioner af kopier. Metoden kræver at man kender lidt af den sekvens, man er interesseret i for at kunne fastgøre nogle små stykker syntetisk fremstillet DNA (ca 20 bp lange), de såkaldte primere. Primerne binder sig til de komplementerende sekvenser på DNA-prøven og definerer dermed, hvor der bliver amplificeret. PCR reaktionsbufferen indeholder foruden primere og DNA-prøve, også nukleotider til opbygning af de nye kopier og en varmestabil DNA polymerase, der indbygger nukleotiderne på de rigtige steder. Nukleotidsekvensen i det mangfoldiggjorte DNA kan herefter bestemmes og sammenlignes med kendte organismers nukleotidsekvens.
2.4.2 T-RFLP
Terminal Restriction Fragment Length Polymorphism (T-RFLP) anvendes ofte til at undersøge diversiteten af mikroorganismer i en prøve. Et bestemt gen fra prøven bliver mangfoldiggjort vha. universelle primere. Sekvensforskelle mellem de forstærkede gener visualiseres ved at skære generne med et eller to enzymer, der genkender specifikke områder i generne, hvor der er kendte forskelle. Fragmenterne kan derefter adskilles elektroforetisk efter deres længde, fx på en sekvenator. I princippet vil hvert fragment repræsentere en genetisk enhed fx en art eller en type. Teknikken kan på den måde anvendes til at estimere antallet af arter i en given prøve.
Mens teknikken er god til at lave relative sammenligninger af diversiteten i forskellige prøver, kan det være svært at verificere hvilke organismer, der er tale om. Generelt er der to måde at verificere eller identificere organismerne. En metode er at fremstille et klon-bibliotek på baggrund af sekvensering af klonede PCR prøver. Længden af sekvenserne i klon-biblioteket kan derefter sammenlignes med de fundne fragmenter. Alternativt kan sammenligne de fundne fragmenter med kendte sekvenser fra en database. Denne metode anvendes på organismegrupper, hvor genomet i forvejen er velkendt.
2.5 Kvantificering af mykorrhizasvampes vækst og fosfatoptagelse
Mykorrhizasvampes kolonisering af rødder bestemmes ved mikroskopi efter en klarings- og farvningsprocedure. Observation af mykorrhizastatus i skæringspunkterne mellem et antal tilfældigt placerede liniestykker og rødderne i tælleskålen gør det muligt at kvantificere både den koloniserede og den totale rodlængde (Newman, 1966). Svampenes hyfelængde i jorden bestemmes efter et lignende princip, hvor hyferne fra en jordprøve opsamles på et membranfilter, og hvor okularet indeholder et kvadratnet i stedet for et liniestykke (Jakobsen et al., 1992).
Mykorrhizasvampes P optagelse kan måles direkte ved anvendelse af dyrkningssystemer, der indeholder et rodfrit jordvolumen, som er mærket med radioaktivt P, 33P. Den radioaktive jord i det såkaldte hyfekammer er adskilt fra jord med rødder vha. et fintmasket net, der let passeres af de tynde hyfer, men ikke af rødder, og svampenes P optagelse kan måles som indholdet af 33P i planten (Schweiger et al., 1999). Et plastbæger fyldt med jord og lukket med et 25µm nylonnet havde i tidligere eksperimenter vist sig at være velegnet som hyfekammer (Smith et al., 2003), og det blev undersøgt, om hyfekammerets udformning ville påvirke mykorrhizasvampenes P optagelse til værtplanten (Figur 2.2).
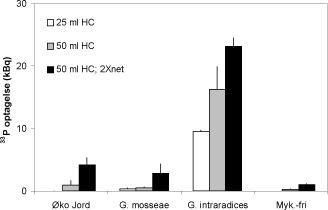
Figur 2.2. Mykorrhizasvampes optagelse af 33P fra jord placeret i nedgravet 25 ml eller 50 ml plastcylinder, hvor én åbning var forseglet med med nylonnet. Den sorte søjle angiver resultaterne med en 50 ml cylinder, hvor begge åbninger var forseglet med net. Ærteplanter blev dyrket i jord med det naturlige svampesamfund (øko-jord), i bestrålet jord tilsat Glomus mosseae eller G. intraradices eller i bestrålet jord uden tilsætning af mykorrhizasvampe. Middelværdier og standardfejl er angivet.
Glomus intraradices optog mest 33P, og optagelsen blev forøget både et større volumen af 33P mærket jord (50 ml HC) og et større areal for indvækst af mycelium (2 x net; Figur 2.2) Betydningen af det større areal for mycelieindvækst var også tydelig for de øvrige mykorrhiza-behandlinger og anvendelse af en 50 ml cylinder med net over begge åbninger vil derfor maksimere svampenes optagelse af 33P i testsystemet. Måling på forskellige tidspunkter bekræftede at 33P optagelse forøges med længden af vækstperioden.
2.6 Statistisk analyse
Styrkeberegninger blev gennemført for en række centrale variable og resultaterne viste, at anvendelse af 5 gentagelser af en given forsøgsbehandling gav en restvarians, som var tilstrækkelig lav til, at de forventede behandlingseffekter kunne måles. Begge hovedeksperimenter anvendte derfor 5 gentagelser (Kapitel 5 og 6). Behandlingseffekter blev analyseret vha. variansanalyse (S-Plus og SAS).
Version 1.0 September 2006, © Miljøstyrelsen.