|
Оценка поступлений ртути в окружающую среду с территории Российской Федерации 1 Введение1.1 Предыдущие исследования по проблеме ртутного загрязнения окружающей среды 1.1 Предыдущие исследования по проблеме ртутного загрязнения окружающей средыВ 1998 г. Комитет по экологии Государственной Думы Российской Федерации и Правительство Российской Федерации поручили Государственному комитету по охране окружающей среды Российской Федерации (Госкомэкологии РФ) подготовить Государственный Доклад .О ртутном загрязнении окружающей среды в Российской Федерации и его воздействии на здоровье населения.. К сожалению, это поручение не было выполнено. Тем не менее Научно-исследовательский центр по проблемам управления ресурсосбережением и отходами (НИЦПУРО) при Минэкономики России и Госкомэкологии России в 1999 г. при участии специалистов других организаций подготовил отчет по теме .Анализ ртутного загрязнения окружающей среды в Российской Федерации. [198], основной задачей которого являлись определение источников ртутного загрязнения территории страны и разработка рекомендаций для подготовки соответствующей Государственной программы по его изучению и снижению. В указанном отчете основными источниками ртутного загрязнения в России признаны отходы производства и потребления. Отмечено также, что из-за недостаточного государственного контроля за потреблением и применением ртути и ртутьсодержащих соединений невозможно было полномасштабно и с точностью оценить объемы техногенного поступления ртути в окружающую среду от каждого источника. Кроме того, были определены отличительные черты и специфические условия России, которые должны быть приняты во внимание при разработке Государственной программы по изучению и снижению ртутного загрязнения окружающей среды, а именно:
Была также в определенной степени систематизирована нормативно-правовая база, разработанная в 1970-1980-е г.г. и регулирующая вопросы, связанные с ртутным загрязнением. Установлено, что существующие нормативные документы, как правило, затрагивают только общие вопросы ртутного загрязнения и обращения с ртутью и ртутьсодержащими отходами и не включают конкретные требования. По мнению авторов указанного отчета, одной из основных причин ртутного загрязнения в России является отсутствие в стране системы обращения с ртутьсодержащими отходами, обеспечивающей их сбор, хранение, транспортировка и обезвреживание. Сбор, хранение и транспортировка ртутьсодержащих отходов признаны наиболее сложной проблемой в области их утилизации и обезвреживания. Отсутствие согласованных документов и наличие противоречивых требований, предъявляемых различными ведомствами и местными органами власти, не позволяют осуществлять эффективный сбор и доставку ртутьсодержащих отходов к месту переработки/размещения. Авторы отчета пришли к выводу, что решение проблемы Программы .Отходы., для реализации которой в части управления ртутьсодержащими отходами рекомендованы следующие мероприятия:
1.2 Регулирование поступления ртути в окружающую средуСодержание ртути в различных объектах окружающей среды регулируется установлением уровней предельно допустимых концентраций (ПДК), которые включены в нормативно-методические документы, утвержденные исполнительными органами власти Российской Федерации и/или бывшего СССР (табл. 1,1-1,6). Таблица 1.1 Перечень основных нормативно-методических документов по защите окружающей среды и населения от потенциально опасных загрязнений, в том числе ртути и ее соединений
Таблица 1.2 ПДК ртути и ее соединений в атмосферном воздухе населенных мест [62]
* Все нормируемые вещества относятся к 1-му классу опасности. Таблица 1.3 ПДК ртути и ее соединений в воздухе рабочей зоны [63, 245]
* Все нормируемые вещества относятся к 1-му классу опасности. Таблица 1.4 ПДК ртути и ее соединений в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования [64]
* Все нормируемые вещества относятся к 1-му классу опасности. Таблица 1.5 Допустимые остаточные количества (ДОК) содержания ртути в продуктах питания [245]
Таблица 1.6 ПДК валовой концентрации ртути и допустимые уровни ее содержания по показателям вредности в почве [60]
** Транслокационный показатель вредности характеризует возможность перехода ртути в сельскохозяйственные растения и накапливаться там в концентрациях, превышающих установленную для них ПДК. Миграционный водный показатель вредности характеризует способность перехода ртути из почвы в грунтовые и поверхностные воды и концентрироваться в них в количествах, превышающих установленную для воды ПДК. Миграционный воздушный показатель вредности характеризует возможность перехода ртути из почвы в атмосферный воздух с достижением концентраций, превышающих уровень ПДК, установленный для атмосферы. Общесанитарный показатель вредности характеризует влияние ртути на самоочищающую способность и биологическую активность почвы. Российским законодательством определено, что тот показатель вредности, который имеет наименьшую пороговую величину, избирается как лимитирующий показатель вредности и принимается за ПДК данного химического элемента (вещества) в почве. В случае с ртутью – это транслокационный показатель, равный 2,1 мг/кг. Правила сбора, хранения, упаковки, транспортирования и приема ртутьсодержащих отходов в свое время были определены в Инструкции Министерства цветной металлургии СССР, утвержденной 27.0.1966 г., многие положения которой к настоящему времени устарели. Сейчас в регионах Российской Федерации, где имеются предприятия по сбору и переработке ртутьсодержащих отходов потребления (главным образом, люминесцентных ламп), разработаны региональные правила обращения с указанными видами отходов. 1.3 Методология оценкиНастоящая оценка поступления ртути в окружающую среду с территории России была выполнена с применением так называемого метода жизненного цикла. По каждой области целевого применения ртути и по каждому виду хозяйственной деятельности, в результате которой происходит мобилизация ртути, содержащейся в качестве естественной примеси в используемых материалах или сырье, оценивалась ее судьба (жизненный цикл), начиная от приобретения/добычи и заканчивая эмиссией в окружающую среду или поступлением в отходы. Методология данного подхода основана на принципе масс-баланса: вся ртуть, поступившая в обращение (в техносферу), рано или поздно в конечном итоге поступает в окружающую среду в составе отходов, выбросов, стоков. Для каждой области целевого использования ртути осуществлялся анализ ее поведения и распределения в производственных процессах и содержания в продукции, который базировался на информации, предоставленной конкретными предприятиями или, если такая информация была недоступна, на результатах предыдущих исследований. Оценка объемов эмиссии ртути в окружающую среду выполнялась на основе данных, полученных непосредственно от предприятий, с использованием официальной статистической информации Госкомстата РФ по поступлению ртути в атмосферу, водные объекты и отходы (см. Приложение 1). В ходе выполнения работ экспертами были посещены российские предприятия, являющиеся основными потребителями ртути. По областям хозяйственной деятельности, где ртуть поступает в технологические процессы в качестве естественной примеси в перерабатываемых/используемых сырье и материалах, расчет общего количества мобилизованного металла производился путем умножения его концентрации в материалах или сырье (например, в угле) на массу (объем) этого сырья. В целом это может быть выражено следующим образом:
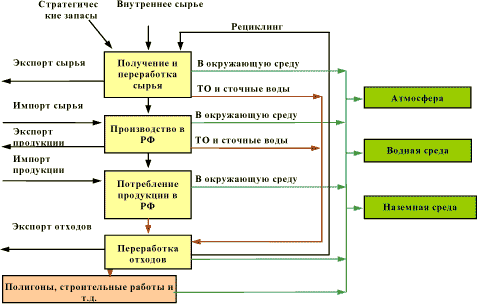
где общее масса мобилизованной ртути (.мобилизация.) рассчитывается путем сложения количества ртути во всех использованных сырьевых материалах. Количество ртути, содержащееся в каждом сырьевом продукте, рассчитывается путем умножения массы (объема) потребляемого сырья (.потреблениеx.) на концентрацию ртути в сырье (.концентрацияx.). Расчет поступления ртути в различные компоненты окружающей среды в результате производственных процессов (например, при сжигании угля) производится путем умножения общего количества мобилизованной ртути (.мобилизация.) на коэффициент удельного специфического распределения ртути (.распределение.): Выбросвоздух = Мобилизация * Распределениевоздух, где Распределениевоздух – это коэффициент распределения, выражающий долю всей мобилизованной ртути, попадающей в атмосферу в результате производственного процесса. Коэффициенты распределения определяются либо на основе специальных исследований производственных процессов в Российской Федерации, либо на основе коэффициентов распределения, полученных для других стран, применяющих схожие технологии. Практически все данные, использованные для оценки, имеют ту или иную степень неопределенности. Насколько это возможно, все величины были представлены как .наилучшая оценка. и с указанием конкретной степени неопределенности. В большинстве случаев неопределенность невозможно оценить с использованием стандартных статистических методов; эта оценка скорее может быть основана на экспертных суждениях. Диапазоны, используемые при оценке, должны отражать диапазоны, в рамках которых эксперты оценивают точность/правильность значения с вероятностью в 90%. Это означает, что для 10% оценок истинное значение может выходить за рамки указанного диапазона. Распределение вероятностей необязательно является симметричным распределением вокруг среднего значения. Например очень неопределенные оценки скорее должны предполагать логнормальное распределение (вероятность, того, что истинное значение в два раза превышает .наилучшую оценку. равна вероятности того, что она составляет половину .наилучшей оценки.). Возможное потребление ртути в оборонной промышленности в данном исследовании не рассматривалось. Главной целью настоящей оценки являлось изучение поведения ртути в техносфере (рис. 1.1). Особенности концентрирования и распределения ртути в различных компонентах окружающей среды, а также ее воздействие на здоровье населения и природные экосистемы кратко описаны в некоторых главах, но в целом в отчете эти вопросы не рассматриваются.
Рисунок 1.1.Схематическое изображение перемещения ртути в техносфере 1.4 Химия ртутиРтуть и некоторые ее соединения используются человеком с древнейших времен. Первое письменное упоминание о ртути принадлежит Аристотелю и относится примерно к 350 г. до н. э. О ртути писал также его ученик, основатель минералогии Тиртамос из Эреза, прозванный Феофрастом (т. е. божественным оратором). Химический знак ртути “Hg” образован от ее латинского названия “hydrargyrum.. Считается, что латинское название ртути “hydrargyrum” (от греческих слов “hydor” - вода и “árgyros” – серебро, т. е. “жидкое серебро”, или “серебряная вода”) впервые встречается у Плиния Старшего (I в. н. э.). Некоторые историки автором этого термина называют жившего в I в. н. э. древнегреческого врача Диоскорида. Алхимики назвали ртуть “mercurius” в честь римского бога торговли, прибыли и обогащения, охранителя дорог, путешественников и мореплавателей, покровителя искусств и ремесел, знатока тайн магии и астрологии, проводника душ в мире мертвых Меркурия, отождествлявшегося с греческим Гермесом. Происхождение русского названия .ртуть. не установлено. Приоритет утверждения ртути самостоятельным металлом принадлежит знаменитому Агриколе. Твердая ртуть впервые получена в 1759 г. в Петербурге М.П. Брауном и М.В. Ломоносовым, которым удалось заморозить ее в смеси снега с концентрированной азотной кислотой. Представленная далее информация главным образом взята из Справочника .The Global Mercury Assessment., подготовленного UNEP Chemicals (UNEP 2002), из “Химической энциклопедии” [304], Справочника “Свойства элементов” [257] и “Геологического справочника по ртути” [296]. Ртуть – химический элемент II группы периодической системы Менделеева; атомный номер 80, относительная атомная масса 200,59. Известно 7 стабильных и более 20 радиоактивных изотопов ртути. Ртуть в обычных условиях представляет собой тяжелый жидкий металл. В специальной литературе такую ртуть называют “элементарной” или “металлической” (Hg(0) или Hg0). Ртуть относительно редко встречается в природе в жидком (металлическом) состоянии, чаще ее можно найти в составе органических и неорганических соединений , в которых она может быть как одновалентной, так и – чаще всего - двухвалентной - Hg(I) и Hg(II) (или Hg2+) соответственно. Под воздействием некоторых микроорганизмов и естественных (гипергенных) процессов ртуть в природе может изменять форму своего нахождения. Элементарная ртуть, содержащаяся в виде паров в атмосфере, может трансформироваться в неорганические ртутные соединения, обеспечивая тем самым значительную возможность для осаждения поступающей в воздух “техногенной” ртути. В природе ртуть – весьма редкий элемент; ее среднее содержание в земной коре и основных типах горных пород, по разным оценкам, колеблется в пределах 3.9 * 10-6 % (по массе). Масса ртути, сосредоточенная в поверхностном слое земной коры мощностью в 1 км оценивается в 100000000000 т (сто миллиардов тонн), их которых в ее собственных месторождениях находится только 0,02%. Оставшаяся часть ртути существует в состоянии крайнего рассеяния, по преимуществу в горных породах. Именно эта рассеянная ртуть создает природный геохимический фон, на который накладывается ртутное загрязнение, обусловленное деятельностью человека. К настоящему времени в природе обнаружено более 80 ртутных и несколько десятком ртутьсодержащих минералов. Основным рудным минералом, определяющим промышленную значимость собственно ртутных месторождений, является киноварь (сульфид ртути, HgS). Самородная (металлическая) ртуть, метациннабарит, ливингстонит и ртутьсодержащие блеклые руды имеют резко подчиненное значение и добываются попутно с киноварью. Всего в мире зафиксировано около 5000 ртутных месторождений, рудных участков и рудопроявлений, получивших самостоятельные наименования, из них в разные годы разрабатывались около 500. В последние годы установлено, что ртуть образует заметные концентрации не только в собственных ее месторождениях, но и в рудных месторождениях нертутного состава: колчеданных, полиметаллических, медных, золоторудных и других, а также в газовых и газонефтяных месторождениях. В промышленности для получения металлической ртути используют главным образом два варианта технологии ее извлечения из руд: окислительно-дистилляционный обжиг (в основном киноварных руд) при температуре выше 540°С с выделением ртути из газовой фазы и (реже) комбинированный способ, включающий предварительное обогащение руд и затем пирометаллургическую переработку полученных концентратов. Элементарная ртуть – это блестящий серебристо-белый металл, имеющий жидкое состояние при комнатной температуре; он традиционно используется для изготовления термометров и некоторых типов электрических переключателей. Удельный вес металлической ртути при 20оС составляет 13,54616 г/см³; температура плавления равна –38,89°С, кипения +357,25°С. При замерзании (при –38,89°С) ртуть становится твердой и легко поддается ковке. Обладая высоким потенциалом ионизации, высоким положительным окислительным потенциалом, ртуть является относительно стойким в химическом отношении элементов. Это обусловливает ее способность восстанавливаться до металла из различных соединений и объясняет случаи ее нахождения в природе в самородном состоянии. Даже в обычных условиях элементарная ртуть обладает повышенным давлением насыщенных паров и испаряется с довольно высокой скоростью, которая с ростом температуры увеличивается. Это приводит к созданию опасной для живых организмов ртутной атмосферы. При действии на ртутные пары вольтовой дуги, электрической искры и рентгеновских лучей наблюдаются явления люминесценции, флюоресценции и фосфоресценции. В вакуумной трубке между ртутными электродами при электрических разрядах получается свечение, богатое ультрафиолетовыми лучами, что используется в технике при конструировании ртутных ламп. Еще одно свойство элементарной ртути связано с тем, что при растворении в ней металлов образуются амальгамы – металлические системы, одним из компонентов которых является ртуть. Они не отличаются от обычных сплавов, хотя при избытке ртути представляют собой полужидкие смеси. Амальгамированию подвергаются только металлы, смачиваемые ртутью. Соединения, получающиеся в результате амальгамирования, легко разлагаются ниже извлечении золота и серебра из руд. Из неорганических ртутных соединений наибольшее практическое значение имеют сульфид ртути (HgS), оксиды ртути (HgO и Hg2O), иодная ртуть (HgI), хлористая ртуть, или каломель (Hg2Cl2), хлорная ртути, или сулема (HgCl2). Эти соединения также называют солями ртути. Сульфид ртути HgS – самое распространенное в природе соединение ртути, которое известно в 3-х модификациях: красная (идентичная минералу киноварь), черная (черный сульфид ртути, или метациннабарит) и .-киноварь (в природных условиях не обнаружена). Иодная ртуть существует в 2-х модификациях – красной и желтой. Каломель представляет собой бесцветные тетраэдрические кристаллы, постепенно темнеющие вследствие распада под действием света на сулему и ртуть. Сулема имеет вид бесцветных кристаллов ромбической формы. При продолжительном нагреве до температур, близких к температуре кипения, элементарная ртуть соединяется с кислородом воздуха, образуя красный оксид (II) ртути HgO, в котором степень окисления ртути равны +2. Желтый оксид ртути HgO получается при добавлении щелочей к водному раствору соли Hg(II). Существует оксид ртути черного цвета (Hg2O), нестойкое соединение, степень окисления ртути в котором равна +1. Во всех соединениях ртути (I) ее атомы связаны между собой, образую двухвалентные группы –Hg2– или –Hg–Hg–. Подобная связь сохраняется и в растворах солей ртути (I). Из других неорганических соединений известны гремучая ртуть Hg(ONC)2, нитрат ртути Hg(NO3)2, сульфат ртути HgSO4, сульфит ртути HgSO3 и др. При воздействии на соли ртути аммиака образуются многочисленные комплексные соединения. Некоторые соли ртути (например HgCl2) являются достаточно летучими для того, чтобы содержаться в атмосферном газе. Однако водорастворимость и химическая реактивность этих неорганических (ионных) ртутных газов способствует гораздо более быстрому осаждению их из атмосферы, чем в случае с металлической ртутью. Это существенно сокращает срок пребывания в атмосфере этих ионных (например, двухвалентных) ртутных газов по сравнению с парами металлической ртути. Существует большое количество ртутьсодержащих органических соединений, в которых атомы металла связаны с атомами углерода. Химическая связь углерода и ртути очень устойчива. Она не разрушается водой, ни слабыми кислотами, ни основаниями. Известны два основных типа ртутьсодержащих органических соединений: R–Hg–R‘ и R–HgX, где R и R‘ - органические радикалы, Х – кислотный остаток. Первая группа включает неполярные соединения, почти нерастворимые в воде и очень летучие. Вторая группа включает соединения ртути, характеризующиеся хорошей водной и липидной растворимостью и высокой устойчивостью в водной среде, например, ион метилртути (СН3–Hg+). Наиболее известны такие ртутьорганические соединения, как диметилртуть, фенилртуть, этилртуть и метилртуть, причем до настоящего времени наиболее распространенным из них является метилртуть. С позиций опасности для живых организмов наиболее токсичными из органических соединений ртути являются алкилртутные соединения с короткой цепью, в которых ртуть присоединяется к атому углерода из метиловой, этиловой и прониловой группы (прежде всего, метилртуть). Так же как и неорганические ртутные соединения метилртуть и фенилртуть существуют в виде .солей. (например, хлорид метилртуть или фенилртутьацетат). В чистом виде метилртуть и фенилртуть в большинстве случаев являются белыми кристаллическими твердыми веществами; диметилртуть представляет собой бесцветную жидкость. Метилртуть может образовываться в природе (особенно в водоемах) в результате метаболизма микробов (биотические процессы) и в результате химических процессов, в которых не участвуют живые организмы (абиотические процессы). Основными продуктами природного метилирования ртути являются моно- и диметилртуть. Если образуется диметилртуть, то благодаря своей низкой растворимости в воде и высокой летучести она легко испаряется в атмосферу, где подвергается разложению до элементарной ртути под воздействием ультрафиолета солнечной радиации. Если же образуется монометилртуть (ее чаще и называют метилртутью), то она способна активно и быстро накапливаться в живых организмах до токсичных уровней. Считается, что образование метилртути в природе происходит главным образом благодаря биотическим процессам. Основные прямые антропогенные источники метилртути на настоящий момент не известны, хотя существуют определенные исторические сведения на этот счет. Тем не менее антропогенное загрязнение косвенно способствует росту уровня содержания этого соединения в природе из-за возможности ее образования из других поступающих в окружающую среду соединений ртути. Примером непосредственного сброса органических соединений ртути в окружающую среду является известный случай в Минамате, который произошел в 1950-х годах, когда с промышленной установки по производству ацетальдегида осуществлялся сброс ртутьорганических соединений в морскую бухту, что привело к накоплению метилртути в морепродуктах и к массовому отравлению и гибели японских рыбаков, употреблявших их в пищу. Не менее известен и случаи массового отравления и гибели людей в Ираке, когда мука, полученная из семян, обработанных смесью, содержащей органическую ртуть, была использована для выпечки хлеба. Недавние исследования показали, что метилртуть может поступать в окружающую среду непосредственно с полигонов бытовых отходов и с канализационных очистных сооружений, но пока неизвестно насколько существенный вклад в общее ртутное загрязнение вносят эти источники. Будучи химическим элементом, ртуть не может распадаться или разлагаться, превращаясь в безопасные вещества. Она может изменять состояние и формы нахождения в процессе своего жизненного цикла, но ее простейшая форма – элементарная ртуть - сама по себе представляет опасность для здоровья человека и окружающей среды. Как только происходит высвобождение ртути при переработке руд, сжигании ископаемых топлив или в результате ее дегазации из земной коры в биосферу, она может быть очень мобильной, циркулируя между поверхностью земли и атмосферой. Почвенный покров, водные объекты и донные отложения являются своеобразными первичными приемниками, временно депонирующими ртуть. 1.5 Круговорот соединений ртути в природе – концептуальная модельКонцептуальные модели, как правило, содержат письменное и графическое описание ситуации на основе имеющихся знаний о:
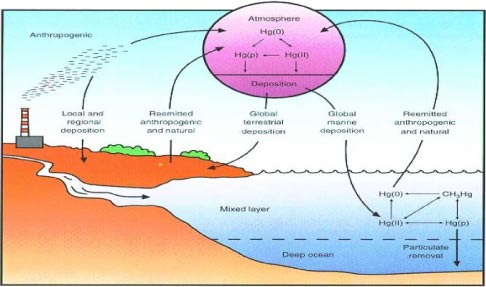
Подобные модели предоставляют необходимую информацию об основных объектах мониторинга (напр. источниках, средах и рецепторах), а также необходимости проведения временного или пространственного мониторинга какого-либо химического соединения. Кроме того, можно получить информацию о взаимосвязи между различными средами, что позволит представить полную мультимедийную картину поведения вещества в окружающей среде. Концептуальная модель циркуляции ртути в окружающей среде представлена на Рис 1,1. Как видно из данного рисунка, выбросы ртути в атмосферу происходят из естественных и антропогенных источников, и ртуть может циркулировать в глобальном масштабе, постоянно перемещаясь из одной среды в другую, посредством сложных схем переноса и трансформации и, в конечном итоге, оказывает воздействие на человека и живую природу. Одним из основных путей поступления ртути в окружающую среду являются выбросы в атмосферу. Во многих странах, крупнейшими источниками атмосферных выбросов ртути являются угольные электростанции, промышленные котельные и различные виды установок ртути в атмосферу, например вулканы. Ртуть может поступать в окружающую среду и другими путями, например, со стоками промышленных предприятий, сбрасываемыми в водные объекты. Несмотря на то, что сбросы ртути в водную среду в большинстве стран считаются незначительными, по сравнению с атмосферными выбросами, они могут иметь существенное локальное воздействие. Например, сбросы ртути в поверхностные водные объекты с заброшенных золоторудных и ртутных месторождений часто является причиной содержания метилртути в рыбе. Рисунок 1.2 Круговорот соединений ртути . концептуальная модель
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||