Vaskemidler og Kemikalier på offentlige og private vaskerier
Miljø- og sundhedsvurdering
Bilag 4 Blegemidler
B.4.1 Natriumhypochlorit
B.4.2 Natriumdichloroisocyanurat
B.4.3 Peroxid
B.4.4 Hydrogenperoxid (brintoverilte)
B.4.5 Pereddikesyre
B.4.6 Eddikesyre
B.4.7 Diskussion
B.4.8 Konklusion
B.4.9 Referencer
Det har som tidligere omtalt ikke været projektets formål at gå i dybden med tensidernes eller de øvrige indholdsstoffers specifikke miljømæssige egenskaber. Chlorblegemidlerne har imidlertid givet specielle problemer, da de med deres høje toksicitet ikke har kunnet indplaceres i scoringsmodellen, idet konsekvensen ville være, at alle vaskerecepter, hvor chlor indgår, ville falde udenfor rammerne af de opstillede kriterier. Det ville umuliggøre den relative vurdering af de øvrige faktorer alene på grund af et enkelt stof. De chlorbaserede blegemidler er derfor holdt udenfor scoringsmodelvurderingerne og i stedet peget ud, når de indgik.
Chlorblegemidlerne indtager desuden en speciel status. Nogle vaskerier mener, at visse tøjtyper kræver chlorblegning for at opnå et tilfredsstillende blegningsresultat (f.eks. restaurationstøj).
Graden af den opnåelige blegeeffekt er afhængig af en række faktorer såsom hvilket blegemiddel, dets koncentration i procesvandet og tøjets opholdstid i vaske- eller renseprocessen, vandets temperatur, typen af snavs samt typen af tekstil.
Chlorblegemidlerne har andre effekter i vaskeprocesserne end blegning, der gør, at de løser visse problemer, der ellers kunne opstå, idet de virker som desinfektionsmidler, der hæmmer/hindrer en uhensigtsmæssig opvækst af mikroorganismer (f.eks. bakterier, mug), holder maskineriet rent, osv.
Blegemidler
De vigtigste oxidative blegemidler i industrien er
| Natriumhypochlorit | |
| Kaliumhypochlorit | |
| Kalciumhypochlorit | |
| Chlor | |
| Hydrogenperoxid og dets derivater (f.eks. pereddikesyre, natriumperborat) | |
| Ozon | |
| Nitrogendioxid |
Tekstilblegning
I Danmark er chlorblegemidler de mest anvendte. I Sverige er det primært hydrogenperoxid (brintoverilte) baserede midler.
Chlorblegemidler
Hypochlorit
I alkalisk medium omdannes hypochlorit blegemidler til den aktive hypochlorit anion:
HOCl + OH- « ClO- + H2O
Til blegning anvendes i vaskerierne normalt en vandig opløsning af natriumhypochlorit (NaOCl) som hypochlorit kilde.
B.4.1 Natriumhypochlorit
Natriumhypochlorit ("klorbleg"), NaOCl, er det mest anvendte chlorblegemiddel. Den oxiderende effekt af et iltatom er ækvivalent med effekten af to chloratomer. Natriumhypochlorit et letopløseligt i vand med en vandopløselighed på 294 g/l ved 0oC. I vand omdannes natriumhypochlorit hurtigt til natriumchlorid og oxygen:
NaOCl ® NaCl + [O]
Natriumhypochlorit er ustabilt i vand ved tilstedeværelse af organisk materiale. I kloakvand kan udvikles chloraminer, som giver en karakteristisk klorlugt (IUCLID).
Økotoksicitet
Tabel B4-1
Toksicitet overfor vandlevende organismer (IUCLID, 1995).
Toxicity towards aquatic organisms (IUCLID, 1995).
| Organisme | Art | Effekt | mg/l | Bemærkninger |
| Fisk | Pimephales promelas | EC50 , 96t | 0,22-0,62 | F, ferskvandsorg. |
| Alburnus alburnus | EC50 , 96 t | 32-37 | F, brakvand.7 0000 salt,8-12% Cl | |
| Dafnier | Ceriodaphnia sp. | EC50 , 24 t | 0,006 | som hypochlorit-ion |
| Daphnia magna* | EC50 , 24 t | 0,07-0,7 | 12.7% Cl2 opløsning. | |
| Algae | Phaeodactylum tricornutum | NOEC, 72h | 0,2 | Static, ECETOC 56 |
| Dunaliella primolecta | EC50 ,72 t NOEC, 72 t |
0,4 0,1 |
Static, ECETOC 56 | |
| Pavlowa lutheri | NOEC, 72 t | 3,0 | Static, ECETOC 56 |
* Toksiciteten af omdannelsesprodukterne i samme opløsning var for monochloramin 0,016 mg/l og for dichloramin 0,027 mg/l også udtrykt som hypochlorit-ion.
Med den givne giftighed overfor vandlevende organismer vil en klassifikation af stoffet forventes at være: N; R50
B.4.2 Natriumdichloroisocyanurat
Organiske klorholdige midler som f.eks. natriumdichloroisocyanurat, som hydrolyseres til hypochlorit i alkalisk medium, anvendes også til tekstilblegning i industrielle erhvervsvaskerier.
Natriumdichloroisocyanurat er et hypochlorit-baseret produkt, og det betyder, at der dannes hypochlorit, når stoffet bringes i vandig opløsning. Vandopløseligheden er 250 g/l (IUCLID, 1995, Sax). Hypochlorit omdannes i vand hovedsagelig til natriumchlorid.
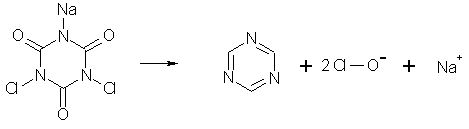 |
Økotoksicitet
Tabel B4-2
Økotoksicitet for vandlevende organismer (IUCLID, 1995).
Ecotoxicity towards aquatic organisms (IULID, 1995).
| Organisme | Art | Effekt | mg/l | Bemærkninger |
| Fisk | Salmo gairdneri | LC50 ,96 t | 0,13 | ferskvandsorg, IUCLID |
| Lepomis macrochirus | LC50 , 96 t | 0,28 0,46 |
ferskvandsorg, to referencer i IUCLID | |
| Dafnier | Daphnia magna | EC50 , 48 t | 0,28 | IUCLID |
| Alger | ingen resultater fundet |
Med den givne giftighed overfor vandlevende organismer vil en klassifikation af stoffet forventes at være: N; R50.
B.4.3 Peroxid
Peroxid baseret blegning sker primært med hydrogenperoxid (brintoverilte, H2O2), men også andre peroxider kan/bliver anvendt, perborater, pereddikesyre, osv. Perborater anvendes normalt ikke i industrielle erhvervsvaskerier men kan indgå i husholdningsvaskemidler. Ved peroxid forstås forbindelser indeholdende to til hinanden bundne iltatomer (R- O- O- R), altså derivater af hydrogenperoxid. Denne stoftype repræsenterer et særligt oksidationstrin, hvor stofferne er meget reaktionsdygtige og reagerer som udprægede oxidationsmidler.
B.4.4 Hydrogenperoxid (brintoverilte)
Hydrogenperoxid bliver i alkalisk medium omdannet til det aktive mellemstof: hydrogenperoxid-anion.
H2O2 + OH- Û H2O + HO2-
Koncentrationen af det blegeaktive hydrogenperoxid anion øges med stigende pH og temperatur. Det vil sige, at til hydrogenperoxid blegning anvendes let til stærkt alkaliske betingelser eventuelt ved tilsætning af alkali (f.eks. natriummetasilikat) for at øge blegeeffekten. Natriumhydroxid er mindre anvendeligt, da det let giver for høj pH og en ukontrolleret blegning.
Anvendes natriumhydroxid som alkalikilde fås reaktionen:
HOOH + OH- Þ HOO- + H2O
Økotoksiciteten er ikke omtalt, da stoffet er vurderet og indgår i DID-databasen (bilag 5).
B.4.5 Pereddikesyre
Organiske persyrer (R- CO- O- OH) som f.eks. pereddikesyre, CH3COOOH, har også oxiderende egenskaber og kan anvendes som blegemiddel og desinfektionsmiddel. Da pereddikesyre er et kemisk reaktivt stof, kan det forventes at ville reagere med organisk materiale, metal-ioner og komplekser, der eksisterer i vandigt miljø. Organiske peroxysyrer anses for ustabile, og pereddikesyre forventes at hydrolyseres langsomt til eddikesyre og hydrogen peroxid:
CH3COOOH +H2O ® CH3COOH + H2O2
Pereddikesyre er dog ikke let bionedbrydeligt (inherent). Med en pKa på 8.2 ved 25oC kan pereddieksyre eksistere i både ioniseret og ikke-ioniseret form i vandmiljø, hvor procenten af ionisering afhænger af pH med 50% ionisering ved pH 8.2. Log Kow er estimeret at være omkring -1, og derudfra kan Koc estimeres til ca. 7.5 for ikke ioniseret materiale det vil sige lav adsorption. Adsorptionen af ioniseret materiale kan ikke estimeres, men ville kræve et undersøgelse.
Økotoksicitet
Tabel B4-3
Økotoksicitetsdata.
Data on ecotoxocity.
| Organisme | Art | Effekt | mg/l | Bemærkninger | |
| Fisk | Pleuronectes platessa | LC50 , 96 t | 89,1 | marin, målt konc.* | |
| Salmo gairdneri | LC50 , 96 t | 13 | semistatisk, målt konc.* | ||
| Dafnier | Daphnia magna | EC50 , 48 t | 3,3 | semistatisk, målt konc.* | |
| Alger | ssp (flere arter) | EC50 , 72-96 t | 0,7-16 | ||
* 15% PAA, 15% H2O2, 25% HOAc
B.4.6 Eddikesyre
Eddikesyre anvendes ikke som blegemiddel, men er omtalt som nedbrydningsprodukt af pereddikesyre. Eddikesyre er let bionedbrydeligt, og giftigheden overfor vandlevende organismer er væsentlig lavere end for pereddikesyre.
Økotoksicitet
Tabel B4-4
Økotoksicitet for vandlevende organismer (IUCLID 1995, Nikunen).
Ecotoxicty for aquatic organisms (IULID, 1995, Nikunen).
| Organisme | Art | Effekt | mg/l | Bemærkninger |
| Fisk | Pimephales promelas | LC50 , 96 t | 88 | statisk, iuclid |
| Lepomis macrochirus | LC50 , 96 t | 75 | ferskvandsorg, iuclid | |
| Dafnier | Daphnia magna | EC50 , 24 t | 47 | |
| Alger | Scenedesmus quadricauda | LOEC | 4000 | reprod, 7 d (Nik) |
| Microcystis aeruginosa | LOEC | 90 | reprod, 8 d (Nik) |
B.4.7 Diskussion
I vaskeprocesser, hvor chlorblegemidler er anvendt, findes, afhængig af pH, en blanding af dissocierede og udissocierede chlorforbindelser som f.eks. fri chlor (Cl2), chlor-anion (Cl-), hypochlorsyre (HClO), hypochlorit (ClO-), chloraminer, trichlormetan (chloroform), forskellige salte (chlorider) samt chlorerede aromatiske stoffer.
På grund af de mange mulige stoffer analyserer man ikke for de enkelte stoffer separat men ved en samlet metode for adsorberbare organiske halider (AOX), som er den totale mængde af organisk bundet chlor, som tilbageholdes af en carbon adsorbent. Målingen giver dog ingen oplysninger om strukturer eller art af de organiske stoffer, som chlor er bundet til.
Hypochlorit frigiver chlor i vandig opløsning. Chlor er giftigt for vandlevende organismer i overfladevand og især for ferskvandsorganismer. Chlor forventes dog ikke at nå frem til rensningsanlægget i form af frit chlor (Cl2) men "nedbrydes" (neutraliseres), mens det endnu befinder sig i kloaksystemet ved kemiske reaktioner med andre kemiske stoffer som f.eks. ammonium og forskellige organiske stoffer, som allerede er oxiderede eller chlorerede. Chlor er et meget reaktivt stof og vil væsentligt optræde som chlorider. Dannelsen af mange forskellige uorganiske og organiske chlorforbindelser i kloaksystemet er derfor mulig. Mange af de mulige organiske chlorforbindelser er vurderet til at være skadelige for vandlevende organismer i overfladevand og/eller svært nedbrydelige. En del af disse stoffer er optaget på EUs liste over kemiske stoffer, der er farlige for vandmiljøet (Direktiv 76/464/EEC, Bro-Rasmussen et al. 1994). Eksempler på mulige kemiske omdannelsesprodukter er vist i tabel B4-5 med de anbefalede vandkvalitetsværdier (WQO-værdier), som anses for at ville opfylde betingelserne i Rådets Direktiv 76/464 (EEC 1976).
B.4.8 Konklusion
Anvendelsen af klorblegemidler er ud fra et økotoksikologisk synspunkt ikke ønskværdig, da reaktionen mellem chlor og organisk stof kan føre til dannelse af uønskede (giftige og/eller svært nedbrydelige) organiske chlorforbindelser. På grund af omdannelserne i afløbssystemet forventes den direkte giftighed af chlorholdige blegemidler at være lavere end de resultater, der er fundet i laboratorietests. Men indholdet af andre chlorerede forbindelser i afløbssystemet og muligheden for dannelse af højere chlorerede organiske forbindelser eller andre skadelige chlorforbindelser anses chloblegemidlerne for potentielt miljøskadelige. Hvor det er muligt, vil det derfor være anbefalelsesværdigt ud fra et miljøsynspunkt at anvende peroxidbaserede blegemidler i vaskerierne.
Tabel B4-5
Eksempler på chlorreaktionsprodukter optaget på EU liste 1 (Bro-Rasmussen).
Examples on products reacting on chloric which have been introduced on the EU list 1 (Bro-Rasmussen.
| EC76/464 Liste 1 Nr. |
CAS Nr. | Kemisk navn | Molekylformel | Struktur | WQO value * |
| 14 | 302-17-0 | chloral hydrate | C2HCl3O.H2O | 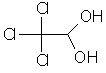 |
|
| 16 | 79-11-8 | chloroacetic acid | C2H3ClO2 | 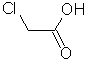 |
|
| 23 | 67-66-3 | chloroform | CHCl3 | 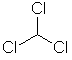 |
10 µg/l |
| 58 | 75-34-3 | 1,1-dichloroethane | C2H4Cl2 | 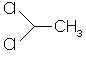 |
|
| 59 | 107-06-2 | 1,2-dichloroethane | C2H4Cl2 | 10 µg/l | |
| 62 | 75-09-2 | dichloromethane | CH2CL2 | 10 µg/l | |
| 20 | 108-90-7 | monochlorobenzene | C6H5Cl | 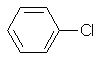 |
1 µg/l |
| 53 54 55 |
95-50-1 541-73-1 106-46-7 |
1,2-, 1,3-, 1,4-dichlorbenzene |
C6H4Cl2 | 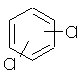 |
10 µg/l |
| 117 | 3 isomere | trichlorbenzenes | C6H3Cl3 | 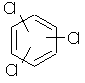 |
0,1 µg/l |
| 33 34 35 |
95-57-8 108-43-0 106-48-9 |
2-, 3-, 4-, mono-chlorphenol |
C6H5ClO | 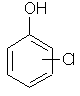 |
|
| 64 | 120-83-2 | 2,4-dichlorphenol | C6H4Cl2O | 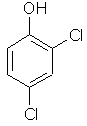 |
10 µg/l |
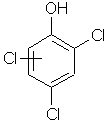
| 122 | 95-95-4 88-06-2 |
2,4,5-, 2,4,6-trichlorphenol |
 |
1 µg/l | |
| 121 | 79-01-6 | trichlorethylene | C2HCl3 | 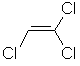 |
10 µg/l |
WQO: recommended water quality objectives
B.4.9 Referencer
Bro-Rasmussen F, Calow P, Canton JH, Chambers PL, fernandes AS, Hoffmann L, Jouany JM, Klein W, Persoone G, Scoullos M, Tarazona JV Vighi M (1994): EEC water quality objectives for chemicals dangerous to the aquatic environments (List 1). Rev. Envir. Contam. Toxicol. Vol. 137.
EEC 1976: Council Directive 76/464. Official Journal of the European Communities No. L 129 of 18 May 1976, p.23.
Nikunen E, Leinonen R, Kultamaa A (1990): Environmental properties of chemicals. research Report 91/1990. Ministry of the Environment. VAPK-Publishing, Helsinki.