Nye metoder til overvågning af miljøfremmede stoffer i vandmiljøet
Bilag 2: Metodebeskrivelser
2.1 Semipermeable membrane device (SPMD)
2.1.1 Dimensioner og materialer
SPMD'er er tynde polyethylenmembraner som omslutter en lipidopløsning bestående af triolein. Membranerne tillader samme molekylstørrelser at passere som en biologisk membran (< ca. 600 Dalton), og lipidet er det typiske neutrale lipid i fisk //.
Dimensionerne for en standard SPMD er 2,54 x 91,4 cm (ca. 400 cm2), og 0,915 g (1 mL) af vægten er triolein (20%). Membranen er ca. 75-90 m m tyk.
Figur 2.1 Feltholder til SPMD (fra SPMD hjemmeside).
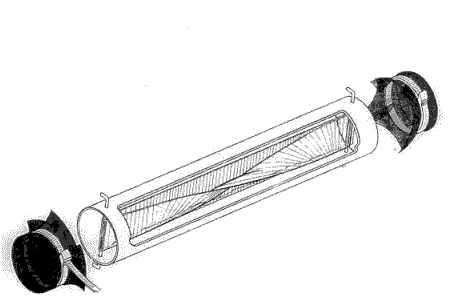
Deployment device for SPMDs (from SPMD homepage).
Alle fedtopløselige stoffer kan optages over membranen, men generelt optages kun stoffer som ikke er ioner. Man skal derfor være opmærksom på om de stoffer som er relevante forekommer ioniseret ved miljøets pH. Særligt har visse pesticider og overfladeaktive stoffer denne egenskab.
Den mængde af et stof som kan optages i en SPMD er relateret til dets fordelingskoefficient mellem triolein og vand (Ktw). Der findes en opgørelse over Ktw for en række stoffer, men den langt mere almindelige oktanol-vand fordelingskoefficient (Kow) kan anvendes i stedet, og vil kun give anledning til en lille fejl.
For stoffer som har en oktanol-vand fordelingskoefficient <1000 (logKow < 3) er kapaciteten i membranen lille og SPMD er ikke en optimal indsamler, med mindre der tilsættes kompleksdannere.
Figur 2.2 Triolein indeholdende SPMD vist med opstillingsaggregat (fra SPMD hjemmeside)
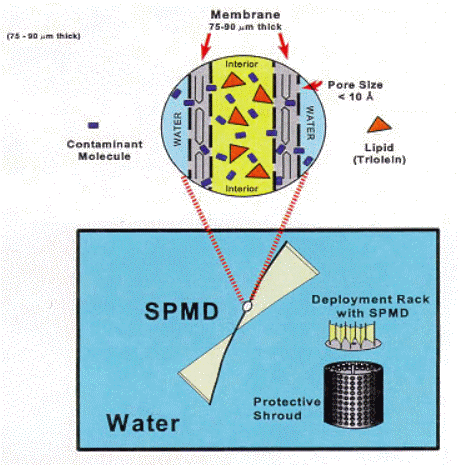
Triolein containing SPMD. Here illustrated with deployment rack (from SPMD homepage).
2.1.2 Anvendelse
SPMD'er blev præsenteret i 1990, hvor de blev anvendt til opkoncentrering af pesticider i ferskvand. Siden har de været anvendt monitering af en lang række fedtopløselige miljøfremmede stoffer.
- Organochlorerede pesticider
- Organophosphater
- Pyrethroider
- Phenoler
- Triaziner
- Pyrethroider
Bioakkumulering
Metoden har vist sig at simulere biokoncentrering af fedtopløselige fremmedstoffer i fisk og invertebrater, både i laboratoriet og i felten. SPMD vil dog også akkumulere molekyler (især 1- og 2-rings aromater inkl. heterocykliske og halogenerede forbindelser), som ikke akkumuleres i biota. Disse stoffers toksicitet udtrykkes ofte akut, men i monitering med organismer kan de let overses som miljøproblem, fordi de når at blive nedbrudt, inden organismerne kan indsamles.
Det er kun den opløste fraktion af stoffer, som optages og det er også den biotilgængelige fraktion for de fleste akvatiske organismer. Biokoncentrering af fedtopløselige stoffer i fisk sker på samme måde som optagelsen i SPMD'er, som derfor kan bruges til at estimere potentialet for biokoncentrering (BCF potentialet) i et bestemt vandmiljø. SPMD'er er lavet af syntetisk materiale og er selvfølgelig mere standardiserede end selv omhyggeligt udvalgte organismer.
Miljøfremmede stoffer i vandfasen
SPMD'er kan under konstante eksponeringsbetingelser anvendes til måling af vandkoncentrationen af de i membranen akkumulerede stoffer. Dette kan med fordel anvendes ved forekomst af persistente stoffer i lave koncentrationer, som ikke, eller kun med store vanskeligheder, kan måles med traditionel kemisk analyse. Dette gælder f.eks. PAH, heterocykliske polyaromatiske forbindelser, PCB og andre halogenerede biphenyler.
Udsætning af biota
SPMD'er kan erstatte udsætninger med organismer fra rene områder til overvågningslokaliteten (transplatation), og kan yderligere eksponeres under betingelser, hvor akkumuleringsresulater indhentet med organismer vil være en umulighed eller svært fortolkelige pga. organismernes kondition.
SPMD'er kan med fordel anvendes til overvågning, hvor der er mistanke om kortvarige udledninger til vandmiljøet. SPMD'er optager fedtopløselige stoffer hurtigere end de afgiver dem, fordi de er baseret på opkoncentrering i et medie med "uendelig" opløselighed af de miljøfremmede stoffer, sammenlignet med opløseligheden i vand, CSPMD>>Cvand. De afgiver meget langsomt det stof som allerede er optaget, og vil derfor registrere forbigående høje koncentrationer af stoffet selvom koncentrationen i vandet udenfor falder igen.
Sammenlignet med konventionel stikprøvetagning mindsker SPMD'er også risikoen for at konkludere "ingen stoffer", selvom der har været en episode med udledning (falsk negative).
Sediment
SPMD'er kan også anvendes i sediment, hvor forholdet mellem bundne og opløste faser af miljøfremmede stoffer formodes at være afgørende for biotilgængeligheden for mange sedimentlevende organismer. SPMD'er optager lipofilt fremmedstof gennem passiv diffusion fra vandets opløste fase i lighed med organismer, og SPMD'er kan derfor bruges som et mål for fremmedstof i den biotilgængelige fase. SPMD har ikke været brugt ret meget til eksponeringer i sediment, hvor faktorer, som styrer biotilgængelighed og frigivelse af fremmedstof fra partikler til vandfase, er dårligt kendte.
Begrænsninger
SPMD'er er ikke organismer og vil derfor typisk "overestimere" forekomsten af bionedbrydelige stoffer, sammenlignet med resultater fra muslinger etc. ligesom stoffer med kort opholdstid i organismer (højt turnover) vil "overestimeres" af SPMD'er. Metoden er også kun anvendelig på stoffer som optages passivt og igennem vandfasen. Forekomsten af næringsstoffer, vitaminer og mineraler som optages gennem organismernes aktive transportsystem kan ikke estimeres, og bioakkummuleringen af meget fedtopløselige stoffer (typisk logKow > 6-7), som primært optages gennem føden, vil heller ikke kunne estimeres.
Begroninger
Der vil typisk begynde at vokse alger o. lign. på SPMD'en i løbet af en uges tid. Begroningen er ikke en fare for SPMD'en kapacitet, men vil efterhånden sænke optagelseshastigheden. Ved ekstreme begroninger nær spildevandsudløb er der målt op til 70% reduktion i optagelseshastighed. Hvis det ønskes kan dette tjekkes med en intern standard med kendt tabsrate fra SPMD'en (PRC=permeability reference compound).
2.2 Solvent-fyldte dialyseslanger
Den "oprindelige" PAI metode består af et rør af en almindelig cellulosebaseret dialysemembran, som omslutter et volumen organisk opløsningsmiddel, typisk hexan //. Hydrofobe miljøfremmede stoffer søger ind i den fase fra vandet og stofferne opkoncentreres. Metoden er simpel og billig at udføre.
Membranen tillader stort set samme molekylstørrelser (molekylvægt cut-off 1000 Dalton » 1000 g/mol) at passere som en biologisk membran (600 Da). Metoden er baseret på samme diffusionsprincipper som biokoncentrering af hydrophobe fremmedstoffer i fisk og invertebrater. Solvent-fyldte dialyseslanger kan bruges til at estimere relative bidrag til bioakkumulation fra den potentielt biotilgængelige frit opløste fase. Solvent-fyldte dialyseslanger akkumulerer ikke fra den partikulært bundne fase, men udelukkende fra vandfasen, og kan derfor bruges til at estimere relative bidrag til bioakkumulation fra disse potentielt biotilgængelige faser både i felten og i laboratoriet.
Solvent-fyldte dialyseslanger kan principielt under konstante eksponeringsbetingelser anvendes til måling af vandkoncentrationen af de i membranen akkumulerede stoffer, men er ikke velegnede. Dette gælder f.eks. PCB, som har meget lange ligevægtstider. Solvent-fyldte dialyseslanger kan erstatte transplantationsudsætninger med organismer i vandfasen, og kan yderligere eksponeres under betingelser, hvor akkumuleringsresulter indhentet med organismer vil være er umulighed eller svært fortolkelige pga. organismernes kondition, men der vil især genereres kvalitative data.
I forhold til monitering og analyse af organismer er solvent-fyldte dialyseslanger af ensartede dimensioner og sammensætning , de er simplere at håndtere i laboratoriet end muslinger og kræver ofte mindre oprensning, da en del interfererende stoffer ikke passerer membranen. Det har dog vist sig vanskeligt at beskrive akkumulationen prediktivt.
Anvendelse af solvent-fyldte dialyseslanger betyder, at der ikke anvendes mere end få mL organiske opløsningsmidler til ekstraktion af vandprøver. Typiske opløsningsmidler er hexan, heptan m.v.
Solvent-fyldte dialyseslanger kræver ingen strøm eller mekanisk påvirkning, og tidsintegreret indsamling af prøver vil derfor være billig og simpel med stor sikkerhed for indhentning af intakte prøver
2.3 Empore filtre
2.3.1 Dimensioner og materialer
I Empore disks består den adsorberende fase af C18-kolonne materiale på et filter. I konventionel analyser anvendes Empore disks til samtidig filtrering og ekstraktion af vandprøver. Som PAI eksponeres Empore disken i prøven eller in situ og opsamler hydrofobe fremmedestoffer i vandfasen.
På samme vis som for SPMD og SPME benyttes det i denne metode, at stofferne har en langt større affinitet over for denne fase (C18) end for vandfasen.
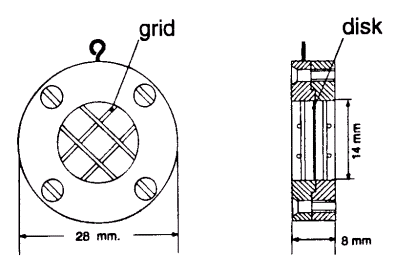
Diskene kan både bruges in situ eller til analyse af separate prøver i laboratoriet. Ved anvendelse in situ monteres diskene i en specielt fremstillet holder (se Figur 2.1) og henligger/hænger i vandløb eller søer.
Figur 2.1: Empore disk monteret i diskholderen /3/.
Empore disk mounted in disk holder /3/.
Metoden benytter sig analogt med SPMD metoden af, at det ikke er nødvendigt at opnå ligevægt mellem den adsorberende fase og vandfasen for at kunne bestemme vandfasekoncentrationen eksakt. Koncentrationen kan dog også bestemmes ved, at man lader de to faser komme i ligevægt.
Efter endt prøvetagning desorberes stofferne igen ved ekstraktion i cyclohexan, der slutteligt analyseres kromatografisk.
2.4 Passive sampling devices (PSD)
Under denne overskrift er der samlet en række forskellige metoder, som lever op til PAI definitionen, men som ikke er anvendt i mere end nogle ganske få projekter. De består alle af en membran omkring en organisk fase (et solvent eller en absorberende resin). De engelske navne er bevaret for at lette identifikationen i forhold til beskrivelserne i litteratur.
2.4.1 PISCES
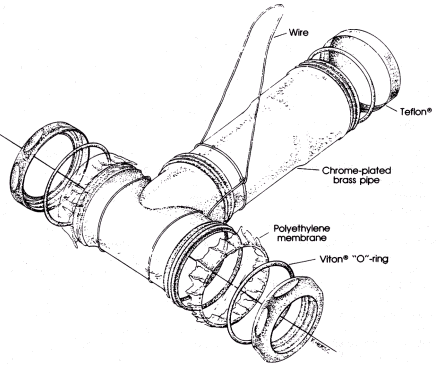
En PISCES består af to 10 cm stykker forkromet messingrør med en diameter på 3,8 cm sat sammen med rørfittings således at disse former et T. De to ender i den øverste del er lukket med en polyethylen membran, mens bunden af T'et er lukket med en messing kapsel (se Figur 2.1).
PISCES'en fyldes før anvendelse delvist op med hexan, der i denne metode fungerer som akkumulerende fase.
Denne metode benytter sig ligeledes af at lipophile stoffer har en lagt større affinitet overfor hexanen end for vandfasen og derved opkoncentreres i hexanfasen.
Hexanfasen kan umiddelbart efter oprensning og inddampning analyseres kromatografisk.
Figur 2.1: Opbygning af PISCES /4/
Illustration of PISCES /4/
2.4.2 Permeation sampling
I overvågning af elleve phenoliske stoffer, som er på US EPAs liste over prioriterede stoffer i vandmiljøet, er denne metode blevet anvendt //. Som i andre PSD metoder omslutter en membran (silicone polycarbonat) et sorptionsmateriale (XAD-7, Tenax-TA), som blev eksponeres mellem 4 timer og 2 dage i testen. Vandkoncentrationen bestemmes efter ligevægt er indtrådt og metoden blev afprøvet ved koncentrationer af phenolforbindelser mellem 5 og 200 ppb. Begge materialer kommes på glasrør (1,2 gram i 55´ 66 mm for XAD-7 og 0,2 gram i 21´ 66 for Tenax-TA), der i den ene ende er lukket med en gummiprop mens den anden ende er lukket med en silikone polycarbonat membran.
2.4.3 Amberlite
I overvågning af perkolat og grundvand bruges rutinemæssigt kolonnematerialer, f.eks. Tenax, til opsamling af flygtige organiske stoffer. Der er for nyligt lanceret en passiv akkumulerende indsamler, hvor kolonnematerialet Amberlite (IRA 743) eksponeres bag en keramisk membran. Denne type prøveopsamlere består af et keramisk rør (10 cm i diameter og 1,5 mm. vægtykkelse) fyldt med Amberlite (C18-kolonne har også været anvendt). Enderne af røret er indvendigt lukket med en silikone prop og udvendig med et teflon/silikone septum. Hele røret indsættes før brug i et beskyttende lille bur af finmasket ståltrådsnet.
I denne metode er der ikke direkte kontakt mellem sorbenten og vandfasen, idet den keramiske membran er impermeabel for vand //. Optagelsesraten var lineær sålænge testen varede (10 dage). Metoden har været testet til brug for grundvandsmonitering for PAH, PCB og pesticider direkte i vandfanen, men der foreligger endnu ikke ret mange data, ligesom metoden ikke har været anvendt i overfladevand.
Indsamlerne eksponeres typisk i 30 dage og indholdet ekstraheres efter endt prøveopsamling i et passende solvent.
2.4.4 Polyurethan propper
Anvendelsen af polyurethan propper følger samme principper som f.eks. Blue Cotton. Polyurethan propperne, der vejer ca. 2 g., er under anvendelsen indpakket i et fiberglasnet, der er lukker med kobbertråd //. Propperne akkumulerer stoffer indtil der er etableret ligevægt mellem vandfasen og polyurethanen, hvilket typisk sker efter ca. 15 dage. Efter endt prøveopsamling tages propperne ud af netten og vrides, så overskydende vand løber af, hvorefter propperne anbringes i en 1:1 blanding af acetone og hexan til ekstraktion af de akkumulerede stoffer.
Ekstraktet anvendes direkte til kvantifikation og evt. identifikation vha. GC i kombination med MS til identifikation af stofferne.
2.4.5 Polymerposer med adsorberende resiner
Disse passive prøveopsamlere består af en polyethylen pose fyldt med enten XAD-4, C18 kolonne materiale eller 2,2,4-trimethylpentan // og //. Poserne eksponeres typisk i 21 dage og ekstraheres efter endt prøveopsamling i et passende solvent. En egentlig sammenhæng mellem den akkumulerede mængde stof og f.eks. koncentrationen i mediet er så vidt vides ikke etableret.
2.4.6 Passiv dosimetri
Dette dosimeter består af en akrylglas cylinder (1 cm. høj og 5 cm i diameter) med 72 huller (1 mm i diameter) //. Cylinderen er skruet på en bund, hvori der befinder sig ca. 1,5 gram aktivt kul. Kullet og cylinderen adskilles af et fint net. Princippet i dette dosimeter er, at stofferne i vandfasen, der ønskes analyseret, skal bevæge sig (ved passiv diffusion) gennem kanalerne og ned til det aktive kul, hvortil stofferne adsorberes.
Dosimeterne eksponeres i tidsrummet 5-49 dage afhængig af stofkoncentrationen. Efter endt prøveopsamling ekstraheres det aktive kul i f.eks. carbondisulfid eller methylenchlorid og solventen analyseres på traditionel vis.
2.4.7 "Passive Sampler"
Denne PAI består af en PTFE cylinder med en PTFE bund, hvor på der er monteret et filter med et kromatografisk materiale og yderst mod eksponeringsmediet en diffusionsbegrænsende membran //. Princippet er tilsvarende SPMD, at stofferne i vandfasen skal bevæge sig (ved passiv diffusion) gennem et diffusionsbegrænsende lag og ind i en fase med stor kapacitet. PAI findes i tre udgaver: non-polære stoffer, polære stoffer og metaller. Det anbefales at eksponere i 1-2 uger for alle type.
2.4.8 Passiv indsamler testet i estuarier
Passiv indsamling i en "klassisk" simpel udformning er testet med denne PAI /12/. I gennemstrømningsakvarier er dialyseslanger, low og high density polyethylen slanger testet med forskellige organiske opløsningsmidlersom akkumulerende fase (tetradecan, iso-octan, n-octan og hexan). Den type som blev testet i et floddelta (estuarie) var iso-octan omsluttet af low density polyethylen. Vandkoncentration af chlordan og dieldrin kunne estimeres efter 21 eller 42 dages eksponering in situ.
2.4.9 Indsamler til flygtige aromater i vand
Denne PAI er af en type som indsamler stoffer fra et luftfyldt rum i indsamleren //. Ofte ved eksponering til en omgivende luftfase, men i dette tilfælde eksponeres der til en vandfase, og der måles for flygtige aromater. Membranen er en silicone polycarbonat membran med enten Porapak Q eller Tenax-TA kolonne materiale. Metoden er kun anvendt i laboratorieundersøgelser.
2.5 Andre passive metoder
2.5.1 Blue cotton
Blue cotton metoden har så vidt vides ikke været kvantificering af stoffer. Metoden anvendes derimod til opsamling af stoffer til div. in vitro forsøg. //. Metoden benytter sig analogt med SPME metoden af stoffernes har langt større affinitet for den faste fase, der her er phthalocyanin trisulfonat, end for vand fase.
Blue cotton kan anvendes in situ eller til ekstraktion af prøver i laboratoriet. Materialet (ofte flere kg) lægges blot i prøven eller f.eks. vandløbet i ca. 1 døgn, hvorefter stofferne frigøres fra materialet ved ekstraktion i methanol. Stofferne isoleres derefter ved inddampning af methanolfasen og opløses efterfølgende i DMSO, hvorefter blandingen kan anvendes i f.eks. et salmonella/microsome assay.
2.6 Solid phase micro extraction (SPME)
2.6.1 Dimensioner og materialer
Som det fremgår af navnet på denne metode er der tale om meget småt udstyr. Pga. størrelsen på udstyret er dette også temmelig skrøbeligt.
Traditionelle SPME'er er udformet som en sprøjte med påmonteret kanyle. På stemplet i sprøjten er der monteret en fiber, som ved aktivering af stemplet, trykkes ud gennem kannylen og ned i selve prøven (se Figur 2.1).
Man kan med metoden enten måle direkte på væskefasen af prøven eller på gasfasen over prøven (head space sampling). Head space sampling egner til bedst til flygtige stoffer som f.eks. VOC'er, men kan anvendes bredt.
SPME-fibre er hyppigst belagt med poly-dimethylsiloxan (PDMS), men kan være belagt med andre materialer. Af andre coatingmaterialer kan nævnes polyacrylate (PA), poly-dimethylsiloxan-divinylbenzen (PDMS-DVB), carbowax-divinylbenzen (CW-DVB) og carboxen-polydimethylbenzen (CX-PDMS).
Valget af coatning foretages ud fra stoffernes polaritet. Chlorerede organiske forbindelser og non-polære pesticider, som metoden i miljøsammenhæng, oftest har været anvendt til, har størst affinitet over for non-polære coatninger som PDMS og PDMS-DVB. Der er derfor mulighed for at målrette anvendelsen mod specielle stoffer.
Figur 2.1 : SPME fiber eksponeret til den flydende del af en prøve.
(fra Varian Inc. hjemmeside).
SPME fiber exposed to the liquid phase of the sample
(from Varian Inc. homepage).
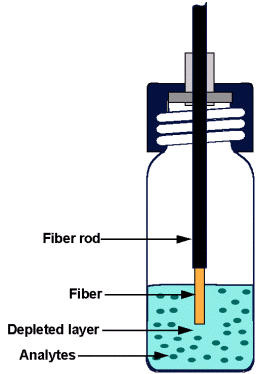
Tykkelsen af fiberen varierer alt efter stofkoncentrationen og den ønskede præcision, fra enkelte m m til flere hundrede m m i diameter. Man opnår ved anvendelse af de tykkere fibre at ekstrahere (sorbere) større mængder stoffer, men samtidig sænkes præcisionen, da den efterfølgende desorption kræver længere tid.
Som noget relativt nyt er det blevet muligt at derivatisere svært analyserbare stoffer (stoffer der ikke egner sig til f.eks. GC) direkte på fiberen. Det er på denne måde muligt at foretage ekstraktion og derivatisering i et trin.
2.6.2 Benyttede principper
SPME metoden benytter sig af, at der mellem de opløste stoffer (og evt. stoffer i gasfasen) og de på fiberen sorberede stoffer eksisterer en ligevægt, der favoriserer sorption på fiberen. Fordelingskoefficienten mellem de frie stoffer i væske- eller gasfasen og stofferne sorberet på fiberen benævnes KSPME og er for non-polære stoffer proportional med stoffernes oktanol-vand fordelingskoefficient
Idet sorptipon for stofferne er termodynamisk favorabelt kan man ved selv relativt lave koncentrationer sorbere relativt meget stof på fiberen, da stofferne har langt større affinitet over for coatningen end overfor f.eks. vandfasen.
For at øge aktiviteten af stofferne og dermed deres affinitet overfor coatningen er det ofte nødvendig at tilsætte salte til prøven. Endvidere benyttes det ofte at justere prøvens pH-værdi således at stofferne med sikkerhed befinder sig på deres ikke-ioniserede form.
Den typiske eksponeringstid for SPME'er ligger på 10 - 30 min. Hyppigst udføres ekstraktionen over så langt et tidsrum således, at der når at etableres ligevægt mellem sorberede og ikke-sorberede stoffer.
Når ekstraktionen er fuldendt desorberes stofferne igen ved opvarmning af fiberen i en specielt injektions port til enten GC eller LC. Den resterende analyse udføres analogt med traditionelle kromatografiske analyser.
SPME metoden udmærker sig i forhold til den traditionelle liquid-liquid-extraction ved at være solvent fri og dels ved at have et relativ lav tidsforbrug pr. analyse (i størrelsesordenen af timer).
Derimod er metoden på dens nuværende stadie ikke egnet til tidsvægtet gennemsnit ved in situ prøveopsamling i vandmiljø.
Referencer:
1. Huckins, J., Petty, J.D., Lebo, J.A., Orazio, C.E., Prest, H.F., Tillitt, D.E., Ellis, G.S., Johnson, B.T. & G.K. Manuweera (1996). Semipermeable Membrane Devices (SPMDs) for the Concentration and Assessment of Bioavailable Organic Contaminants on Aquatic Environments. In: Techniques in Aquatic Toxicology (Ed: G. Ostrander,)., Lewis Publisher, Boca Raton, Florida.
2. Södergren, A. (1987). Solvent-filled dialysis membranes simulate uptake of pollutants by aquatic organisms. Environ. Sci. Technol. 21, 855-859.
3. van Loon, W.M.G.M., Wijnker, F.G., Verwoerd, M.E. & J.L.M. Hermens (1996). Quantitative Determination of Total Molar Concentrations of Bioaccumulatable Organic Micropollutants In Water Using C18 Empore Disk and Molar Detection Techniques. Anal. Chem. 68, 2916-2926.
4. Litten S., Mead B. & J. Hassett (1993). Application of passive samplers (pisces). to locating a source of PCBs on the Black River, New York. Environ. Toxicol. Chem. 12, 639-647.
5. Zhang, G-Z. & J.K. Hardy (1989). Determination of phenolic pollutants in water using permeation sampling. J. Environ. Sci. Health. A24(3). 279-295.
6. Grathwohl, P. & T. Schiedek (1997). Passive Samplers as a Long-Term Monitoring System for Hydrophobic Organic Contaminants. In: Gottlieb, J. et al. Field Screening Conference, Karlsruhe '97, Kluwer Academic Publs., 33-36.
7. Madsen, E.L., Thomas, C.T., Wilson, M.S,. Sandoli, R.L. & S.E. Bolotta (1996). In Situ Dynamics of Aromatic Hydrocarbons and Bacteria Capable of AH Metabolism in a Coal Tar Waste-Contaminated Field Site. Environ. Sci. Technol. 30, 2414-2416.
8. Zabik J.M., Aston L.S. & J.N. Seiber (1992). Rapid characterization of pesticide residues in contaminated soils by passive sampling devices. Environ. Toxicol. Chem. 11,765-770.
9. Johnson, K.A., Naddy, R.B. & C.P. Weisskopf (1995). Passive sampling devices for rapid determination of soil contaminant distributions. Toxicol. Environ. Chem. 51, 31-44.
10. DiGiano, F.A., Elliot, D.& D. Leith (1989). Application of passive dosimetry to the detection of trace organic contaminants in water. Environ Sci. Technol. 22, 1365-1367.
11. Kingston, J., Mills, G. & R. Greenwood (1999). Letter and hand-outs from Workshop on Passive Sampler Round Robin Trial held in Ijmuiden, the Netherlands 12th Nov. 1999.
12. Peterson, S.M., S.C. Apte, G.E. Batley & G. Coade (1995). Passive sampling for chlorinated pesticides in estuarine waters. Chem. Spec. Bioavail. 7, 83-88.
13. Lee, H.L. & J.K. Hardy (1998). Passive sampling of monocyclic aromatic priority pollutants in water. Intern. J. Environ. Anal. Chem. 72, 83-97.
14. Sayato, Y., Nakamuro, K., Ueno, H., & R. Goto (1990). Mutagenicity of adsorbates to a copper-phthalocyanine derivative recovered from municipal river water. Mutation Research, 242, 313-317.
|
|