|
Elektrodialytisk rensning af jord fra træimprægneringsgrunde 2. Elektrokinetisk og elektrodialytisk jordrensning
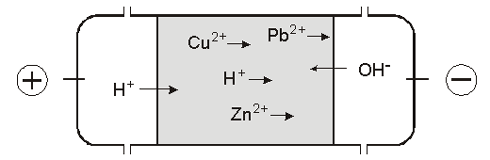
2.1 Elektrokinetiske fænomenerI metalliske ledere bliver elektrisk strøm båret af elektroner, men når strømmen ledes gennem væsker, så er det derimod ioner, som er ladningsbærere. Positive ioner (kationer) vil blive transporteret mod den negative elektrode (katoden) og negative ioner (anioner) vil blive transporteret mod den positive elektrode (anoden). Denne bevægelse af ioner i en væskefase i et påtrykt elektrisk felt kaldes for elektromigration. Når elektroderne sænkes ned i en væske, vil elektrodeprocesser omdanne den elektronbårne strøm i den metalliske leder til strøm båret af ioner i væsken. Det er en meget bred vifte af elektrodeprocesser, som kan forekomme afhængig af ioner i væsken, spændingsforskel m.m. For elektrokemisk jordrensning resulterer de væsentligste elektrodeprocesser dog i en pH-sænkning ved anoden og en pH-stigning ved katoden, se f.eks. (Acar, 1993). Når en jord påtrykkes et elektrisk felt vil den elektriske strøm blive båret af elektromigrerende ioner i væskefasen, og hvis der i jordvæsken er tungmetaller, vil disse bevæge sig mod elektroderne, hvor de opkoncentreres, og det er netop på denne måde, at jordrensningen forløber. I tillæg til elektromigrationen vil der også i jorden foregå et væskeflow i jorden i retning fra anode mod katode. Denne væskestrøm kaldes elektroosmose, og den kan være med til at fjerne de tungmetaller, som ligger opløste i væskefasen. Væskestrømmen kan også benyttes til at lede forskellige additiver, der kan være med til at bryde de bindinger, som fastholder tungmetallerne til jordpartiklerne, ind i selv de fineste porer i den forurenede jord. 2.2 Elektrokinetisk jordrensningPrincippet for elektrokinetisk jordrensning er vist på figur 2.1. Figuren illustrerer en laboratoriecelle, som er inddelt i tre kamre. Den tungmetalforurenede jord er placeret i det midterste, og i hvert at de to yderste kamre er der placeret en elektrode, og der cirkuleres en elektrolyt rundt i kammeret. Når rensningen er fuldført, vil tungmetallerne være at finde i disse væsker.
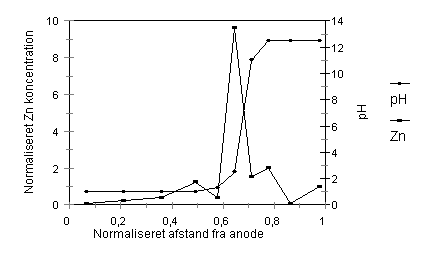
Figur 2.1: Når den elektriske strøm påtrykkes, vil de frie ioner i jorden blive transporteret mod en af elektroderne alt efter ladning. Yderligere vil der fra anodesiden, forekomme en forsuring af jorden, fordi der produceres H+-ioner på overfladen af anoden, og disse H+-ioner vil blive transporteret ind i jorden af strømmen. På tilsvarende måde vil der produceres OH--ioner på overfladen af katoden, og de vil blive transporteret ind i jorden fra den anden side. Herved opbygges der et pH-profil i jorden, hvor pH er lav fra anodeenden og høj fra katodeenden. Generelt vil tungmetaller som Cu, Zn, Pb og Cd desorbere under sure forhold og adsorbere til jordpartiklerne ved højere pH-værdier. Der hvor de to fronter mødes, er der en stor pH-ændring indenfor en lille afstand. På figur 2.2 vises et sådant pH-profil. Figuren er taget fra en af de tidligste publikationer (Probstein, 1993) hvor det aktuelt handlede om at fjerne Zn fra kaolinit, og den viser, at der udløses et problem, hvis pH får lov til at udvikle sig på denne måde. Når pH sænkes i jorden fra anodesiden desorberes Zn og fjernes fint i retningen mod katoden, men der hvor jordens pH igen bliver neutral udfælder og adsorberer Zn til jorden, bliver immobil. Den Zn mængde som er fjernet fra anodesiden af jorden akkumuleres således i pH-springet. Hovedformålet med at få Zn ud i katodekammeret er altså ikke løst.
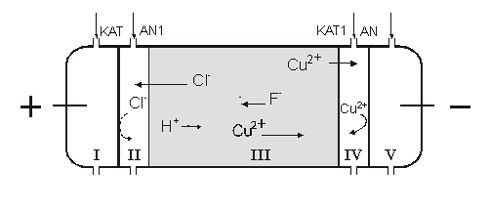
Ud fra de tidlige resultater, som det ovenfor nævnte eksempel, blev det klart, at det var nødvendigt at forhindre udviklingen af den basiske front i jorden. Dette gøres typisk ved at tilsætte syre kontinuerligt til væsken i katodekammeret. På Danmarks Tekniske Universitet er processen yderligere optimeret, og den danske metode kaldes elektrodialytisk jordrensning 2.3 Elektrodialytisk JordrensningI elektrodialyse-processer er den mest centrale ting ionbyttermembraner – anionbyttermembraner (AN), som kun tillader passage af anioner og kationbytter membraner (KAT), som kun tillader passage af kationer. I ionbyttermembraner er væggene i porerne ladede og for at opveje dette vil der i porevæsken være en tilsvarende ladning fordelt på frie ioner. Det betyder at ionerne i porevæsken kun kan udbyttes med andre ioner af samme ladning. Der benyttes et system på op til fire ionbyttermembraner. Der placeres en anionbyttermembran (AN1) for enden af jorden i anodesiden og der placeres en kationbyttermembran (KAT1) for enden af jorden mod katodesiden, se figur 2.3.
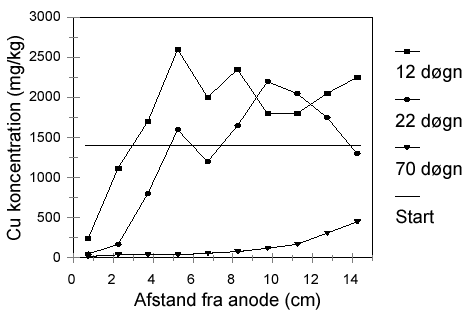
Figur 2.3: Dette sæt af de inderste ionbyttermembraner (AN1 og KAT1) i elektrodialytisk jordrensning har flere formål: (a) at forhindre den basiske front i at udvikle sig ind gennem jorden og (b) at øge den del af strømmen, som går til at fjerne tungmetaller. Ionbyttermembranerne forhindrer transport gennem jorden af harmløse ioner fra elektrolytterne som cirkuleres i kammer (II) og (IV), f.eks. Na+ fra kammer (II) gennem jorden til kammer (IV). Det betyder, at strømmen kun bliver brugt til at transportere ioner, som oprindelig kommer fra jorden. Ionbyttermembranerne betyder i praksis, at den slutkoncentration af tungmetaller i jorden som kan opnås efter rensning, er lavere for elektrodialytisk jordrensning end for elektrokinetisk jordrensning, fordi der ikke er konkurrence mellem de meget mobile ioner fra elektrolytterne og tungmetalionerne i jorden (Hansen et al, 1997). På trods af AN1 vil jorden blive forsuret fra anodesiden. Denne forsuring skyldes egenskaber ved anionbyttermembranen, som gør at den splitter vand til H+ og OH-. Mekanismerne bag denne vandsplitning er ikke undersøgt til bunds, men vandsplitningen er også fundet indenfor andre anvendelsesområder for anionbyttermembraner. Brintionerne vil af strømmen blive ført gennem jorden, medens hydroxylionerne vil blive transporteret ud i kammer (II) (Ottosen et al., 2000). Det yderste sæt af ionbyttermembraner skal sikre, at elektrodeprocesserne kan styres. De kationer, som er fjernet fra jorden kan ikke komme til at indgå i elektrodeprocessen på katoden pga. AN2. Det betyder, at f.eks. Cu ikke kan komme til at udfælde på katoden, og få denne til at vokse ukontrolleret. I den modsatte ende forhindres anionerne fra jorden i at komme ud til anoden af KAT2. Dette er hensigtsmæssigt i nogle tilfælde, f.eks. hvis jorden indeholder F- idet denne ion vil vandre mod anoden, hvor der vil dannes flussyre som ødelægger anoden. Fluor har f.eks. været benyttet under træimprægnering. I hver enkelt sag vurderes det, hvorvidt alle fire membraner er nødvendige. På figur 2.4 vises Cu-koncentrationsprofiler i jordkammeret til tre forskellige tidspunkter under rensningen. Det ses, at Cu fjernes fra anodesiden mod katodesiden. Den Cu, som er fjernet fra de første skiver akkumulerer i de efterfølgende skiver, og hvor langt ind i jorden Cu er fjernet, er bestemt af hvor langt den sure front er nået, fordi Cu kun er mobil i den sure del af jorden. Når den sure front er nået igennem jorden, er hele voluminet rent. I det aktuelle tilfælde var det efter 70 døgn. I modsætning til det resultat, som blev vist på figur 2.2, med elektrokinetisk rensning, blev alt Cu transporteret ud i væsken ved katoden i denne opstilling.
Figur 2.4: 2.4 Genindvinding af tungmetallerUnder den elektrokinetiske og elektrodialytiske rensningsproces vil tungmetaller blive opkoncentreret i elektrolytopløsningerne i opkoncentreringskamrene. Fra disse opløsninger kan tungmetallerne genindvindes ved brug af forskellige teknikker. Elektrolyseprocessen kan bruges til at fælde f.eks. Cu, Zn, Pb og Cd som metal på en katode. På figur 2.5 vises Cu-klumper, som er udfældet ved elektrolyse fra elektrolytvæsker. Kobberet er oprindeligt blevet fjernet fra en forurenet jord med den elektrodialytiske proces.
Figur 2.5: |