|
Afgivelse af organisk stof fra polymere materialer - mikrobiel vækst Bilag C
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| /Niemelä, 1983/ |
Ci: antal kolonier fra enkel udstrygning i fortyndingsrækken
Wi: volumen udstrøget
De højst opnåede kimtal for P17 og NOX omregnes til AOC-værdier ved brug af udbyttekonstanter på acetat. Prøvens total AOC-værdi bestemmes som:
AOCTotal = AOCP17 + AOCNOX
C.1.1. Rensningsprocedure for udstyr
Flasker, låg og finnpipetter anvendes udelukkende til AOC-bestemmelse for at hindre, at anden tidligere anvendelse medfører afgivelse af organisk stof eller stof, der virker hæmmende på bakterievækst.
For at fjerne organisk kulstof rengøres testflasker og låg inden brug ved følgende procedure:
| Skylles med MilliQ-vand | |
| Henstand i 10% salpetersyre i minimum et døgn | |
| Skylles 6 gange med MilliQ-vand | |
| Mundinger dækkes med stanniol | |
| Glasflasker glødes ved 220° C i 5 timer - ‘red cap’-låg ved 180° C i 6 timer |
Pipettespidser renses ikke specielt før brug, men tages direkte fra leveringsposer. Spidser, der skal i direkte kontakt med prøve, pakkes iført vinyl-engangshandsker for at begrænse overførsel af organisk materiale. Eppendorf-rør og pipettespidser autoklaveres og tørres derefter ved 80° C.
Til desinficering af arbejdsområde og drigalskispatler anvendes der ikke sprit, da dette vil kontaminere prøverne med organisk stof og resultere i forhøjet P17 koncentrationer. Arbejdsområde aftørres med en 0,05% CTMAK-opløsning (cetyltrimethylammoniumchlorid), og drigalskispatler glødes i gasflamme og afkøles inden brug.
C.1.2. Podekulturer
Separate podekulturer af P17 og NOX fremstilles ved opdyrkning af bakterierne ved 15° C i næringssaltsmedie med 1 mg/L acetat /van der Kooij et al., 1995/. Bakteriernes vækst følges ved overfladeudsæd på R2A, indtil et maksimalt bakterieantal er opnået. Herefter opbevares kulturene i køleskab, hvor de har en holdbarhed på omkring et halvt år.
C.2. Ændringer i forhold til van der Kooij metode
Den ovenfor beskrevet arbejdsgang ved udførelse af AOC-metoden afviger på nogle punkter fra /van der Kooij et al., 1995/. I Tabel 0-1 er de afgørende punkter listet. I den oprindelige AOC-metode udføres bestemmelserne i 1 L Erlenmeyerkolber. Det er imidlertid ofte mere hensigtsmæssigt at benytte "red cap"-flasker til bestemmelserne. Transport og håndtering af prøver er lettere i "red cap"-flasker end i Erlenmeyerkolber, da "red cap"-lågene er skruet fast og dækker hele flaskemundingen. Ved brug af Erlenmeyerkolber risikeres det endvidere, at propperne hopper op under transport og pasteurisering. Der er således umiddelbart langt mindre risiko for at prøverne kontamineres fra omgivelserne ved at anvende "red cap"-flasker. I projektets arbejde var det endvidere hensigtsmæssigt pga. mængden af testmateriale og ønsket om fastholdt S/V-forhold at benytte mindre vandvolumener end 600 mL, hvorfor der blev valgt 250 mL flasker.
Tabel C-1:
Punkter hvor udførelsen af AOC-metoden gennemgået i afsnit 0 afviger fra
/van der Kooij et al., 1995/.
Parameter |
/van der Kooij et al., 1995/ |
IMT |
||||||||||||||||||||||||||
Testflasker |
1000 mL Erlenmeyer kolbe med glasslib og tilhørende glasprop |
250 mL ‘red cap’-flasker med ‘red cap’-låg |
||||||||||||||||||||||||||
Vandvolumen |
600 mL |
200 mL |
||||||||||||||||||||||||||
Renseprocedure |
Alternativt:
|
|
||||||||||||||||||||||||||
Pipetter |
Glødede stangpipetter af glas |
Finnpipetter med engangsspidser af polypropylen |
||||||||||||||||||||||||||
Fortyndings- |
9 mL postevand autoklaveret i fortyndingsrør tilsættes 1 mL prøve |
0,900 mL autoklaveret postevand i eppendorf-rør tilsættes 0,100 mL prøve |
Rensningen af testflaskerne er modificeret i forhold til van der Kooij et al.´s forskrift
/1995/, da de færreste laboratorier har kapacitet til at gløde et større antal flasker
ved 550° C. Den forskrevne metode anses for bedre end den
alternative metode foreslået af van der Kooij et al. /1995/, da syrevasken er forlænget,
og der anvendes MilliQ-vand (lavt indhold af organisk stof) til skylning.
Autoklavering af fortyndingsrør med fortyndningsvæske medfører ofte en ukontrolleret fordampning af fortyndingsvæsken, hvilket vil give usikkerheder ved fortyndingen. Der opnås derfor en større præcision ved at udmåle fortyndingsvæsken efter autoklaveringen. Derved kan det samtidigt forsvares at anvende mindre volumener ved fremstilling af fortyndingsrækker, så de kan fremstilles i eppendorf-rør og med finnpipetter fremfor stangpipetter, da dette håndteringsmæssigt er mere praktisk (automatpipetter med engangsspidser anvendes af Standard Methods /1998/).
C.3. Undersøgelse af forskellige flaske- og lågtyper
En mulig risiko ved at anvende "red cap"-flasker med tilhørende låg fremfor Erlenmeyerkolber kunne være, at der blev afgivet forbindelser fra lågenes teflon-indlæg til vandfasen, som vil kunne påvirke bestemmelsen. For at kontrollere dette blev der foretaget en sammenlignende undersøgelse med både Erlenmeyerkolber og "red cap"-flasker. Teflon-indlæggene i "red cap"-lågene kan kun holde til at undergå rensningsproceduren et begrænset antal gange, før de skal udskiftes. Det blev derfor endvidere undersøgt, om der var en effekt af, om indlæg (monteret i lågene) havde gennemgået rensningsproceduren én eller flere gange.
C.3.1. ForsøgsgangUndersøgelsen blev udført med 250 mL Erlenmeyerkolber med tilhørende propper med glasslib og 250 mL "red cap"-flasker med låg, hvor lågenes indlæg henholdsvis havde undergået rensningsproceduren en enkelt gang ("nye" indlæg) eller mere end én gang ("gamle" indlæg). Efter pasteurisering af testvandet (200 mL) i flaskerne, blev flaskerne inkuberet ved 20° C under omrystning (95 min-1).
Erlenmeyerkolberne blev inkuberet med et omvendt bægerglas over for at undgå kontamineringer med støv (ifølge van der Kooij et al. /1995/). To sæt "red cap"-flasker blev inkuberet med låget opad (ingen kontakt imellem indlæg og vandfase) og to sæt med låget nedad (kontakt imellem indlæg og vandfase) - et med "gamle" indlæg og et med "nye" indlæg. Undersøgelsen blev således udført med 3 Erlenmeyerkolber, 2´ 3 "red cap"-flasker med "nye" indlæg og 2´ 3 "red cap"-flasker med "gamle" indlæg.
Dag 7 blev alle "red-cap"-flasker og Erlenmeyerkolber podet med P17, og derefter indkuberet (uden kontakt mellem vandfase og indlæg) ved 15° C med kimtalsbestemmelse dag 0, 5, 7, 10, 14, 20, 25. Dag 25 blev alle flasker og kolber tilsat 1 mL acetat-opløsning (der resulterede i omkring 25 mg acetat-C/L i de enkelte prøver) for at undersøge om der var hæmmende faktorer i vandfasen. Efterfølgende blev kimtallet bestemt dag 28 og 30, idet P17 med den anvendte acetat-koncentration ville være udvokset inden for 5 døgn).
C.3.2. ResultaterDer var mindre end 20 CFU/mL P17 i vandfasen i to af flaskerne, hvor "nye" indlæg var i kontakt med vandfasen, hvorfor disse blev podet med P17 på ny dag 25, forud for kimtalsbestemmelse og tilsætning af acetat. Vækstkurver for P17 er afbilledet på Figur 0-1, og maksimale AOCP17-koncentrationer er angivet i Tabel 0-1.
De meget høje værdier efter tilsætning af acetat til Erlenmeyerkolberne samt værdien for "Erlenmeyer 3" dag 25 skal nok ikke tolkes som et reelle respons. Propperne satte sig fast i slibene imellem de enkelte kimtalsbestemmelser, hvilket betød, at der blev rørt meget ved området omkring kolbehalsen og proppen (især ved de tre sidste gange). Desuden stod der vand i slibene; såfremt dette var blevet fjernet ved opvarmning af kolbehalsen over en gasflamme ville det (pga. den lille flaskestørrelse) have medført en for kraftig opvarmning af vandfasen.
I to af prøverne, hvor vandfasen var i kontakt med "nye" indlæg, forekom der ingen vækst af P17, heller ikke efter repodning og tilsætning af acetat. I de øvrige flasker var der en tilfredsstillende tilvækst af P17 efter tilsætning af acetat (jævnfør Tabel C-2).
Tabel C-2:
AOCP17-værdier i vandprøver målt dels i "red
cap"-flasker og Erlenmeyerkolber. Vandprøverne blev efter pasteurisering inkuberet
ved 20° C under omrystning i 7 døgn. Efterfølgende blev AOC
bestemt ved 15° C. Til kontrol for hæmning i vandfasen fik
prøverne tilsat acetat dag 25 efter podning
|
"Red cap"-flasker |
Erlenmeyer- |
|||
Vandfase/Indlæg |
Kontakt |
Ingen kontakt |
Ingen kontakt |
||
Antal rensninger af indlæg |
Én |
Mere end én |
Én |
Mere end én |
|
|
[mg acetat-C/L] |
[mg acetat-C/L] |
[mg acetat-C/L] |
||
Max. AOCP17 |
0 |
7 |
6 |
5 |
8 |
Tilvækst i AOCP17 ved til-sætning af 25 m g acetat-C/L |
0 |
25 |
29 |
29 |
32 |
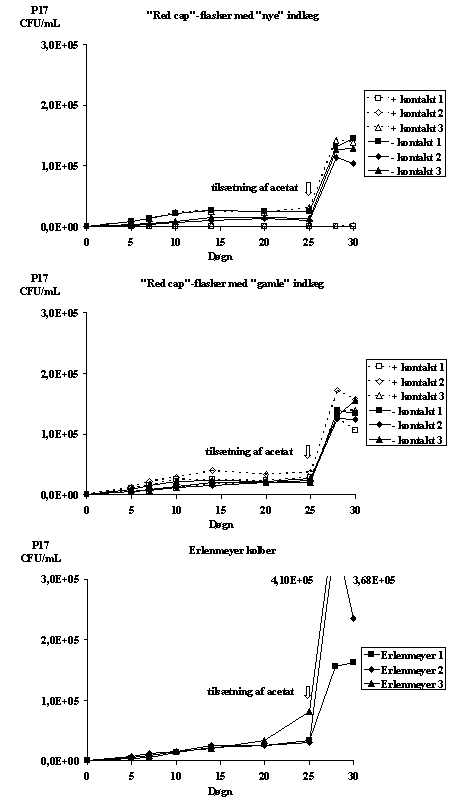
Figur C-1:
Vækstkurver for P17 i vandprøver inkuberet i Erlenmeyerkolber med propper
med glasslib og i "red cap"-flasker med låg med henholdsvis "nye" og
"gamle" indlæg. "Red cap"-flaskerne blev inkuberet med og uden
kontakt imellem indlæg og vandfase. Flaskerne blev inkuberet ved 20°
C under omrystning i 7 døgn, hvorefter de blev podet med P17 og inkuberet ved 15° C. Dag 25 blev prøverne tilsat acetat.
Den udeblevne vækst i de to flasker kan enten tilskrives tilstedeværelsen af toksiske/hæmmende stoffer i vandfasen eller, at vandfasen har været kontamineret med bakterier, som ikke blev registreret på R2A pladerne. I et sådant tilfælde har de pågældende bakterier haft 7 døgns forspring og således udkonkurreret P17. Ved tilsætning af acetat har disse bakterier i stærkt overtal kunne omsætte acetaten, før P17 kunne vokse op. Væksten i den tredje af flaskerne hvor "nye" indlæg var i kontakt med vandfasen var i overensstemmelse med væksten i de øvrige flasker. Sammenholdt med de senere udførte undersøgelser i Kapitel 8, er det mest sandsynligt at den udeblivende vækst af P17 i de to flasker skyldes en kontaminering med uønskede bakterier.
Ses der bort fra de to prøver uden vækst, var der på et 5% signifikantsniveau ikke forskel i P17 koncentrationer som følge af de forskellige inkuberinger under inkuberingsforløbet - hellere ikke hvis der opdeles imellem "nye" indlæg, "gamle" indlæg og Erlenmeyerkolber eller kontakt , ingen kontakt og Erlenmeyerkolber (heller ikke når der ses bort fra Erlenmeyerkolbe nr. 3 dag 25). Det kan således ikke siges, at der er effekt af valg af flasketype eller antallet af rensninger "red cap"-lågenes indlæg har undergået.
International ringest af AOC-bestemmelse
AOC-metoden som beskrevet i afsnit 0 blev anvendt af ÌMT ved en ringtest, der omfattede fem europæiske laboratorier. Indenfor ringtesten blev der anlyseret 30 AOC-prøver med tre forskellige koncentrationer. Fire laboratorier opnåede overensstemmende resultater - heriblandt KIWA og IMT /Jørgensen et al., 2000/. Den anførte udførelse til bestemmelse af AOC kan således betragtes som velegnet.