|
Undersøgelse af bakterieantal og eftervækstpotentiale i vandværksvand 2. Bakteriel vækst i drikkevand2.1 Mikrobiel vækst og omsætningMikroorganismer kan deles op i 2 hovedgrupper, heterotrofe organismer, der udnytter organisk kulstof som kulstofkilde, og autotrofe organismer, der udnytter uorganisk kulstof fra CO2. I dette afsnit beskrives kort principperne for den mikrobielle vækst og omsætning. 2.1.1 Heterotrofe organismerDe heterotrofe organismer udnytter organisk kulstof som energikilde og kulstofkilde. Ved nedbrydning af organisk stof kan bakterierne udnytte den energi, der er lagret i kulstoffet. Endvidere omdanner bakterierne det organiske stof til en række små "biokemiske byggesten", som herefter bruges til opbygning af ny biomasse. Ud over kulstof, har bakterierne behov for en række næringssalte for at kunne vokse. De vigtigste af disse er kvælstof og fosfor, men de har også behov for f.eks. kalium, svovl og metaller. Bakteriers væksthastighed afhænger af mange faktorer men især af hvilke bakteriearter, der er tale om, typen og koncentrationen af de organiske stoffer, der nedbrydes, og af temperaturen. I dansk drikkevand er det formentlig kulstof, der er det næringsstof, der begrænser væksten. Det er som regel de heterotrofe mikroorganismer, der er af størst betydning i drikkevand. 2.1.2 Autotrofe organismer.De autotrofe organismer kan defineres som organismer, der udnytter uorganiske forbindelser (eller lys) som energikilde og CO2 som kulstofkilde. De nitrificerende bakterier er et eksempel på (chemo)autotrofe bakterier. De opnår energi ved oxidation af ammonium eller nitrit med O2. I forbindelse med disinfektion af drikkevand med kloramin, kan der opstå gode vækstbetingelser for de nitrificerende bakterier, da der dannes NH4+ ved chloraminhenfald og chloraminen er tilsat NH4+. Udover de nitrificerende bakterier kan der også være gode forhold for både svovl- og jernoxiderende mikroorganismer. En gruppe af mikroorganismer, der både har fællestræk med de autotrofe og de heterotrofe bakterier, er de metanotrofe bakterier. De kan vokse på metan, som kan være tilstede i råvandet og i drikkevandet. De autotrofe og metanotrofe bakterier vokser i reglen ikke frem på de substrater, der anvendes til kimtalsbestemmelse, og bidrager dermed ikke direkte til forhøjede kimtal, men deres vækst kan tilføre organiske stoffer til vandet, som siden hen kan udnyttes af heterotrofe mikroorganismer og dermed indirekte give anledning til forhøjede kimtal.
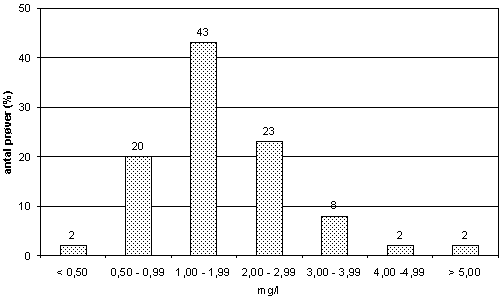
Figur -2.1: 2.2 Forekomst af organisk stof i grundvand og drikkevandIndeholdet af organisk stof i drikkevand overvåges rutinemæssigt på større danske vandværker. Figur 2-1 præsenterer resultater fra analyse af 4.231 prøver i en treårs periode fra 1997 til 1999. Figuren viser, at NVOC koncentrationen i hovedparten af prøverne ligger mellem 0,5 mg/l og 3 mg/l med hovedvægten i intervallet mellem 1 mg/l og 2 mg/l. Det organiske stof, der forekommer i drikkevand, kan være naturligt forekommende, skyldes forurening eller afgives fra filtre på vandværket. Det naturligt forekommende organiske stof stammer fra det grundvandsmagasin, hvor grundvandet indvindes fra. Dette organiske stof er som regel gammelt, og umiddelbart skulle man forvente, at den letnedbrydelige del af var nedbrudt for længst. Undersøgelser viser dog, at en del af det organiske stof, der er tilstede i grundvand, er nedbrydeligt (Grøn et al. 1992), og at grundvand indeholder aktive bakterier (se bl.a. Aamand et al. 1989). Det nedbrydelige organiske stof må tilføres udefra, eller det kan tænkes at blive udskilt fra de aktive bakterier, der findes i magasinet, eller blive frigivet fra døde eller døende bakterier. En årsag til at organisk stof, der har ligget unedbrudt i mange år i et grundvandsmagasin, kan nedbrydes, skal muligvis findes i de fysiske påvirkninger, det udsættes for ved udvindingen af vandet. Det typiske indhold af opløst organisk stof i dansk grundvand er < 4 mg/l (Grøn, 1991). En anden kilde til organisk stof i drikkevand og grundvand er forurening. Der kan være tale om forurening fra landbrug, forurenede grunde og lossepladser, nedsivning fra kloaker etc. Drikkevandsbekendtgørelsen (Miljøministeriet, 1988) tillader en vis mængde af organisk forurening. F.eks. må koncentrationen af anioniske detergenter være op til 100 µg/l, og opløste eller emulgerede kulbrinter op til 10 µg/l, hvilket er rigeligt højt til at give anledning til betydelig vækst. Endelig er der mulighed for, at vandbehandlingen påvirker det organiske stof. Dels kan tilførslen af ilt under beluftningen medføre, at den del af det organiske stof, der var unedbrydeligt under iltfrie forhold i grundvandsmagasinet, kan nedbrydes. Dels kan der afgives nedbrydelige stoffer fra filtrene på vandværket, idet de autotrofe og de metanotrofe bakterier kan bidrage med organisk stof via deres metabolisme, og heterotrofe bakterier kan afgive organisk stof, der kan bidrage til eftervækstpotentialet. Filtrering kan også have den modsatte effekt, idet de heterotrofe bakterier nedbryder en del af det organiske stof, der kommer med råvandet. 2.3 Bestemmelse af vækstpotentiale og nedbrydeligt organisk stof i drikkevand.Forskellige typer af organisk kulstof har forskellige egenskaber med hensyn til nedbrydelighed. Nogle typer, som f.eks. humus er svært nedbrydeligt, mens andet kulstof, som f.eks. sukkerstoffer og små fedtsyrer, nedbrydes meget let. De kemiske metoder til bestemmelse af organisk kulstof kan ikke skelne mellem let nedbrydeligt og vanskeligt eller unedbrydeligt organisk stof. Metoderne til bestemmelse af let nedbrydeligt organisk stof er alle udformet som bioassays, der er baseret på, at bakterier nedbryder det organiske stof. Metoderne kan deles op i to hovedgrupper, afhængigt af om den bakterielle aktivitet bestemmes som bakteriel vækst eller som fjernelse af organisk stof. Metoderne giver anledning til 2 definitioner af nedbrydeligt organisk stof (Huck 1990):
Metoderne til bestemmelse af AOC kan deles op i to grupper, afhængig af om der anvendes renkulturer eller naturlige podematerialer. Van der Kooij (1982) beskrev en metode, hvor prøven først pasteuriseres for at inaktivere de naturligt forekommende bakterier og dernæst tilsættes to bakterielle kulturer (Pseudomonas fluorescens strain P17 og Spirillum sp. strain Nox). De to kulturer er velbeskrevet med hensyn til udbyttekonstant for acetat (µg C/bakterie) og hvilke substrater, de kan nedbryde. Efter tilsætning af bakterierne henstår prøverne ved 15 °C og antallet af P17 og Nox følges i en periode på 15 – 20 dage. Antallet af bakterier i vandet bestemmes ved overfladeudsæd. De to bakterier kan tælles på den samme plade, da de kan adskilles fra hinanden på koloniernes udseende. Indholdet af AOC kan herefter beregnes ved at multiplicere den højeste koncentration (Nmax) med udbyttekonstanten for den enkelte stamme. Kvantificering sker ved standardkurver (se i øvrigt bilag A). De øvrige metoder, der anvender inokulering med kendte kulturer, kan ses som varianter af van der Kooij metoden. Kemmy et al. (1989) har foreslået anvendelse af 4 kulturer. I denne metode udtages kun prøver efter 6 dage og der laves standardkurver for den blandede kultur. LeChevalier et al. (1993) har foreslået en analyse, der foregår ved højere temperatur for at forkorte analysetiden og hvor bakteriebiomassen bestemmes ved måling af ATP. I Standard Methods (1995) er beskrevet en metode, hvor prøven hældes ud i flere flasker, hvor hver bestemmelse af kimtal sker fra en ny flaske for at undgå forurening. I modsætning til anvendelse af renkulturer anvender Werner (1984), Standfield og Jago (1987) og Servais et al. (1987) naturligt podemateriale fra den aktuelle vandprøve eller fra sandfiltre. Der er ikke enighed om hvilke af disse metoder, der er mest anvendelig til vurdering af eftervækstpotentialet i drikkevand. Anvendelse af kendte bakterier som inokulum har den fordel, at der er bedre muligheder for at standardisere metoden og sammenligne mellem vandtyper og laboratorier, mens anvendelse af naturlige inokula er mere repræsentativ for de mikrobielle forhold i den pågældende vandtype. Fælles for metoderne er, at det er bakterievæksten i vandfasen, der bestemmes og anvendes til beregning af det let omsættelige kulstof. Erfaringerne med anvendelse af Nox og P17 viser, at de næsten udelukkende vokser frit i vandfasen og ikke på forsøgsflaskens inderside. Anvendelse af naturligt podemateriale indebærer derimod en risiko for vækst på siderne, hvilket vil medføre en undervurdering af vækstpotentialet. Rice et al. (1991) har foreslået en metode til bestemmelse af det coliforme vækstpotentiale, hvor der inokuleres med E. coli eller Enterobacter cloacae. Metoden giver et bud på om AOC/BDOC er tilstrækkeligt til at understøtte coliform vækst og evt. mulighed for, at der kan etableres en population af coliforme bakterier i ledningsnettet. BDOC bestemmes som forskellen i indholdet af DOC før og efter inkubation af drikkevandet. Servais et al. (1987) anvendte filtrerede prøver og tilsatte 5 ml vand som inokulum, og analyserede indholdet af DOC før og efter en inkubation på op til 4 uger. Inokulum blev filtreret (2 µm) for at fjerne eventuelle protozoer. Joret og Levi (1986) anvendte i stedet vasket filtersand som inokulum for at opnå en kortere analysetid, som er typisk 3 til 5 dage. Ribas et al. (1991) udviklede en anderledes metode, hvor vandet passerer over en biofilm i glassøjler med sintret glas eller sand. BDOC bestemmes som forskellen mellem DOC i ind- og udløb. Analysen kan gennemføres på 2 til 3 timer, og kan f.eks. anvendes til overvågning på vandværker, men der kræves 2 uger til 2 måneder til at etablere biofilmen. Generelt er AOC metoderne mere arbejdskrævende end BDOC metoderne. For begge typer af metoder findes hurtige og langsomme varianter. BDOC metoderne har en detektionsgrænse på typisk 0,2 mg/l, mens AOC metoderne har en væsentligt lavere detektionsgrænse (~ 2 µg/l). AOC metoderne med anvendelse af renkulturer som inokulum medtager ofte en mindre del af det organiske stof end de øvrige metoder. Dette kan skyldes, at de anvendte bakterier er begrænsede i deres substratvalg. Alle metoderne bygger på den antagelse, at kulstof er den faktor der begrænser væksten. Dette er ikke altid tilfældet. Miettinen et al. (1996) fandt, at fosfat kan være begrænsende for væksten i drikkevand. Hvorvidt man skal anvende den ene eller den anden type af metode afhænger af undersøgelsens formål. Hvis formålet er at bestemme vækstpotentialet er de biomassebaserede metoder (AOC) de mest anvendelige, hvorimod BDOC metoderne er mere anvendelige, når formålet er bestemmelse af reduktion af det organiske stof. En alternativ metode til at bestemme vækstpotentialet i drikkevand er egentlige vækstforsøg, hvor drikkevandet anvendes, som det er. En fordel ved denne type forsøg er, at forsøgsomstændighederne er nærmere på de egentlige forhold i ledningsnettet. Vækstforsøg kan udformes på forskellige måder, f.eks. som henstandsforsøg i flasker (Dott 1983) eller i egentlige rentvandstanke på et vandværk (Schoenen 1986), kimtalsundersøgelser i forskellige afstande fra vandværket (Albrechtsen et al. 1999, Payment et al. 1988, Gibbs et al. 1993) eller ved analyse af kimtal i stagnant vand i "blinde" rør (Jaeggi og Schmidt-Lorenz 1988). Resultaterne af vækstforsøg er meget afhængige af hvilken metode, der anvendes til bestemmelse af kimtallet. Her er især 4 faktorer af betydning: A) inkuberingstemperaturen er afgørende for hvilke bakterier, der vokser op. Ved lave temperaturer (~20 °C) vokser væsentlig flere op end ved høje temperaturer (~37 °C). B) Forskellige dyrkningssubstrater tillader vækst af forskellige arter. Der er en tendens til, at der vokser flere bakterier op jo lavere kulstofindhold, der er i dyrkningssubstratet. C) Længere inkubationstid tillader fremvækst af flere bakterier. Dette har især betydning for substrater med lavt kulstofindhold, da chancen for overgroning her er lille. D) Overfladeudsæd giver større kimtal end dybdeudsæd. Ved sammenligning af forskellige studier er det derfor vigtigt at gøre sig klart hvilke metoder, der er anvendt til bestemmelse af kimtal.
|