|
Kemisk/biologisk filter til nedbrydning af klorerede opløsningsmidler i grundvand 5 Appendix 1 : Anvendelse af Fe(0) som oprensningskomponent
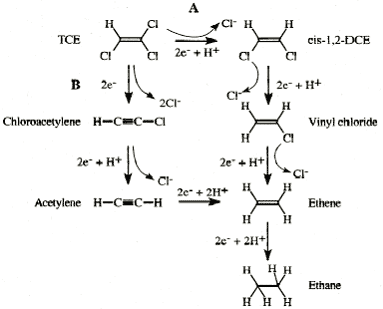
Den abiotiske nedbrydning i filteret skal ske via nul-valent jern, Fe(0). I litteraturen er der utallige eksempler på, at Fe(0) kan reducere PCE, TCE, DCE og VC til ethen, ethan, kuldioxid og vand. Ved brug af Fe(0) er det derfor forudsat, at de klorerede ethener vil nedbrydes. Reaktionsmekanismerne bliver derfor ikke beskrevet nærmere i nærværende notat. Det skal dog nævnes, at f. eks TCE formodes at nedbrydes via 2 forskellige mekanismer (se figur 1), og at nedbrydningspotentialet for Fe(0) i forhold til TCE er en første ordens reaktion.
Figur 1: 5.1 Generelt - reaktive processerNår Fe(0) kommer i vand, vil det korrodere (anaerob jernkorrision). Fe(0) vil donere elektroner til reduktion af reducerbare stoffer. Ved tilstedeværelse af ilt foregår korrosionsprocessen forholdsvis hurtigt, mens processen er langsom, hvis det er et iltfrit miljø. Det, at den anaerobe korrosionsproces er en langsom proces, er årsagen til, at Fe(0) i det hele taget kan komme på tale som en oprensningsmetode for klorerede opløsningsmidler, idet jernforbruget ved denne sideproces er begrænset. Hvis der er ilt til stede i grundvandet, vil ilten være den foretrukne elektronacceptor. Ved tilstedeværelse af tilstrækkelige mængder ilt vil genereret Fe(II) ligning 1 oxideres videre til Fe(III) ligning 2.
Ligning 4 viser den anaerobe korrosionsproces, som vil være fremherskende i grundvand, da dette altid indeholder under 10 mg O2/l. Når ilten i vandet er opbrugt, vil dette sammen med den anaerobe korrosion medføre et kraftigt fald i redoxpotentialet. Ved et lavt redoxpotentiale vil andre stoffer end ilt oxidere det metalliske jern. F.eks. vil PCE, der er i et oxideret stadie pga. klor, fungere som elektronacceptor f.eks. via nedenstående proces.
Det vurderes, at ovenstående dekloreringsproces med Fe(0) forløber hurtigst for PCE og TCE, mens halveringstiden for DCE og VC er større. Det skyldes, at for PCE er kulstofatomet i oxidationstrin +2, mens det i DCE er i oxidationstrin 0, så populært sagt står DCE og VC lavere i spændingsrækken end PCE og TCE, hvilket betyder, at der skal et kraftigere reduktionsmiddel (mere energi) til at deklorere DCE og VC. Det skal påpeges, at den anaerobe korrosion medfører dannelse af brint, ligning 4, som vil danne gasbobler, der enten afgasser eller bliver tilbageholdt i filtermatricen. I et fint granuleret jernfilter vurderes det, at gasdannelse kan have en væsentlig indflydelse på permeabiliteten / strømningsmønstret i filteret. 5.2 Udfældninger og effekter på nedbrydningBåde ligning 1 og 4 vil resultere i en pH stigning i systemet, da der dannes hydroxylioner (OH-). Den reelle stigning i pH styres af vandets buffer-kapacitet. Ved korrosionen af jern vil der således dannes ferri- eller ferrooxider / hydroxider (lig. nr. 3 og 5), der vil udfældes. Endvidere vil stigningen i pH give anledning til, at balancen i carbonatsystemet forskydes. Bicarbonat (HCO3-) vil omdannes til carbonat (CO32-). Dette betyder, at der kan udfældes calcium- og jerncarbonatforbindelser som f.eks. siderit (FeCO3) og magnesiumhydroxycarbonater. Derudover kan der udfældes sulfider, mv. Udfældningerne af hydroxyl-, oxid-, carbonat- og sulfidforbindelser kan resultere i:
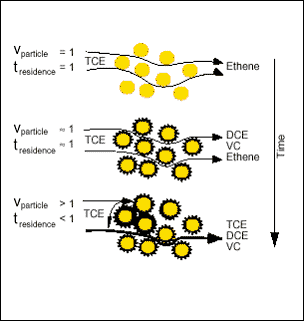
Dette er illustreret i figur 2. Mængden, der kan udfældes, vil være afhængig af pH-ændringen og grundvandets indhold af makroioner. Som det fremgår af ovenstående, er specielt vandets hårdhed en væsentlig parameter.
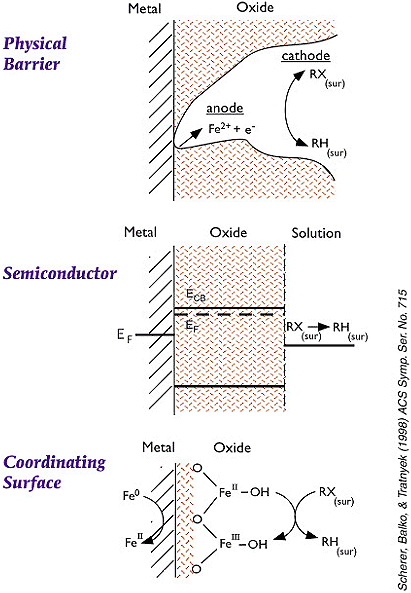
Figur 2: At jernforbindelser vil udfælde er vist i flere forsøg. Ved kolonneforsøg med Fe(0) er det ofte observeret, at jernkoncentrationen stiger i starten af kolonnen, mens den falder i kolonnens bagerste ende i takt med, at jern udfældes. Hvis der er ilt tilstede i vandet, er korrosionsprocessen dog så hurtig, at jernet udfældes i den forreste del af kolonnen. Der er dog forsøg, som indikerer, at opbygning af oxider, carbonater, sulfider mv. på jernoverfladen ikke har en væsentlig effekt i forhold til nedbrydnings-potentialet af f.eks. TCE. Bl.a. har EnviroMetal Technologies Inc (ETI) påvist, at jern, der har ligget på jorden i over et år, stadig kan være fuld reaktiv /13/. Dette kan f.eks. skyldes en af de i figur 3 angivne mekanismer. Der kan også være involveret andre mekanismer. Bl.a. har Hans Chr. Brun Hansen, professor ved den Kgl. Veterinær- og Landbohøjskole påvist, at "grøn rust" har / kan have en positiv effekt i forhold til en nedbrydning af nogle forureninger.
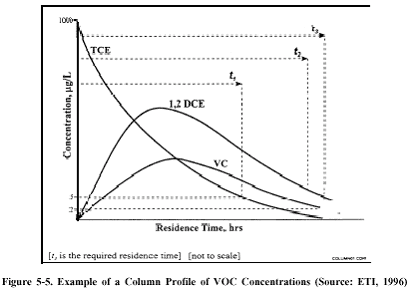
Figur 3: Hans Chr. Brun Hansen har oplyst, at "grøn rust" er et 6-kantet lermineral, som de ved laboratorieforsøg har påvist, kan nedbryde tetraklor kulstof /14/. Grøn rust fældes let fra delvis oxiderede opløsninger af Fe (II) ved pH over 7, men ifølge Hans Chr. Brun Hansen medfører kolloidkemien, at det ikke "klistrer" så let sammen. Selve kemien for grøn rust er dårligt beskrevet, men det forventes, at det med tiden omlejres til f.eks. magnetit, som igen kan omlejres til maghemite. Grøn rust forbindelsen er meget ustabil under aerobe forhold og ved fotokemiske reaktioner, og under anaerobe forhold kan den omlejres. I litteraturen er det beskrevet, at grøn rust fasen kan være et vigtigt mellemled ved dannelse og omsætning af jernoxider og oxyhydroxider. I en reaktor, der både indeholder jern og sand i forholdet 14:86, har Erik Søgård (Ålborg Universitetscenter, Esbjerg) påvist en halveringstid på 30-35 min /4/, og ved sammenligning mellem rent jern og jern / sand fandt de en signifikant hurtigere nedbrydning af TCE i jern / sand forsøget. 5.3 Dimensionering af jernfilterEn væsentlig parameter ved dimensioneringen af et reaktiv filter er bl.a. at kende sammensætningen og koncentrationsfordelingen af de stoffer, der ønskes oprenset. F.eks. er halveringstiden for vinylklorid ca. 6 gange så stor som for triklorethylen. Dvs., at der ikke skal være ret store mængder vinylklorid i grundvandet, før det er koncentrationen af vinylklorid, der bliver en af de dimensionsgivende parametre for filterets størrelse. Dette er afbilledet i figur 4.
Figur 4: Ved dimensionering af et reaktivt filter er potentialet for nedbrydning af klorerede ethener hovedsagelig afhængig af opholdstiden i filteret. Dvs. filterets størrelse og derved mængden af jern fastlægges ud fra en nødvendig opholdstid, og dimensioneringsgrundlaget er således et spørgsmål om kinetik. I modsætning hertil kan nævnes, at det ved dimensionering af oprensning af chromholdigt grundvand er kapaciteten af jernet, der er afgørende for den nødvendige jernmængde. Dette skyldes, at chrom coater jernet, så det bliver inaktivt /7/.
|