|
Økologisk byfornyelse og spildevandsrensning nr. 45, 2004 Overlevelse af enterokokker og protozoen Cryptosporidium parvum i urin fra menneskerIndholdsfortegnelse1 Indledning og baggrund for undersøgelserne
3 Resultater - Projekt 1 Bakteriologi
4 Resultater - Projekt 2 Parasitologi
Bilag A Metodebeskrivelser for bakteriologiske undersøgelser Bilag C Antal suspekte termotolerante coliforme bakterier - Projekt 1 Bilag D Bakteriologiske målinger - Projekt ForordDenne rapport er en fælles afrapportering af resultaterne fra de to projekter "Undersøgelse af overlevelse og vækst af enterokokker og kimtal ved 37ºC i lagret separeret urin" og "Undersøgelse af overlevelse, viabilitet og infektivitet af Cryptosporidium parvum og Giardia spp. i lagret separeret human urin" som blev gennemført i perioden 2002-2003. Baggrunden for projekterne var resultater fra et tidligere projekt "Vurdering af muligheder og begrænsninger for recirkulering af næringsstoffer fra by til land – Mikrobiologiske undersøgelser af lagret urin fra separationstoiletter" (Dalsgaard og Tarnow, 2001) finansieret af Miljøstyrelsen, som indikerede at nogle indikatorbakterier kunne udvise vækst i separeret lagret human urin. Der fandtes endvidere få protozoæg af Cryptosporidium parvum i enkelte urinopsamlingstanke som overlevede selv efter lang tids lagring, ligesom sådanne æg også kunne give infektion af mus. På denne baggrund ønskede Miljøstyrelsen at få disse problemstillinger yderligere belyst i kontrollerede laboratorieforsøg med henblik på at indhente data som ville kunne bruges til fastsættelse af hygienekrav og lagringstider for human urin som påtænkes anvendt til landbrugs- og havebrugsformål. Undersøgelserne var opdelt i en bakteriologisk og en parasitologisk del som havde følgende formål:
Projekterne, herunder laboratorieforsøgene, blev udført ved Institut for Veterinær Mikrobiologi, KVL. Undersøgelserne af overlevelse og infektivitet af C. parvum blev lavet i samarbejdet med afdeling for Patologi og Epidemiologi, Danmarks Veterinærinstitut. Projekterne er blevet fulgt af en Styregruppe bestående af Linda Bagge fra Miljøstyrelsen, samt Anders Dalsgaard og Lise Tønner Jørgensen fra Institut for Veterinær Mikrobiologi, KVL. Sammenfatning og konklusionerBaggrunden for undersøgelserne i denne rapport var resultater fra et tidligere projekt finansieret af Miljøstyrelsen: "Vurdering af muligheder og begrænsninger for recirkulering af næringsstoffer fra by til land – Mikrobiologiske undersøgelser af lagret urin fra separationstoiletter" (Dalsgaard og Tarnow, 2001), som indikerede at nogle indikatorbakterier kunne udvise vækst i separeret lagret human urin. Der fandtes endvidere få protozoæg af Cryptosporidium parvum i enkelte urinopsamlingstanke som overlevede selv efter lang tids lagring, ligesom sådanne æg også kunne give infektion af mus. På denne baggrund ønskede Miljøstyrelsen at få disse problemstillinger yderligere belyst i kontrollerede laboratorieforsøg med henblik på at indhente data som ville kunne bruges til fastsættelse af hygienekrav og lagringstider for human urin som eventuelt påtænkes anvendt til landbrugs- og havebrugsformål. Undersøgelserne bestod af to dele; dels en bakteriologisk del som adresserede spørgsmålet om mulig eftervækst af enterokokker og kimtal ved 37ºC i lagret separeret urin fra mennesker og dels en parasitologisk del som undersøgte spørgsmålet om protozoen C. parvum's overlevelse i lagret separeret urin fra mennesker. Bakteriologisk delDer blev udtaget urin fra 4 forskellige lokaliteter, repræsenterende dels tættere boligbyggeri (Lokalitet 1 og 2) og dels kolonihavehusstande (Lokalitet 3 og 4). Urinen blev lagret ved 4, 10 og 20ºC i 6 måneder. Med ca. 1 måneds intervaller blev pH og ammoniumkoncentration målt samtidig med at den mikrobiologiske kvalitet blev bedømt udfra antallene af indikatorbakterierne enterokokker, kimtal ved 37ºC og suspekte termotolerante coliforme. pH holdt sig stabilt omkring en værdi på 8,5 til 9, men var højest i urin fra lokalitet 3 og 4 hvor der havde været mindst tilblanding af vand fra toiletskyl. Ammoniumkoncentrationen var ligeledes stabil og højest ved Lokalitet 3 og 4 (ca. 8 ppm for åben tank og 16-17 ppm for lukket tank). Det højere pH og ammoniumniveau i den relativt mere koncentrede urin fra lokaliteterne korrelerede med lavere startkimtal og dårligere kimtalsoverlevelse. Efter en generel reduktion i antal enterokokker til under detektionsgrænsen (1 cfu per ml.) efter 1-4 måneders lagring, blev der efter 5-6 måneders lagring observeret en svag stigning i antal enterokokker efter lagring ved 4, 10 og 20ºC. Denne stigning tyder på en øget overlevelse og/eller evne til multiplikation af enterokokker ved langvarig lagring af urin ved flere temperaturer. Enterokokker syntes derfor uegnede som indikatorer på fækel forurening i urin, idet deres forekomst kan indikere en længere overlevelse af eventuelt tilstedeværende patogene bakterier end hvad der reelt er tilfældet. Det bør istedet overvejes at anvende E. coli som indikator da denne syntes mere følsom i urin sammenlignet med enterokokker. Da andre bakterieslægter og arter end Enterococcus eventuelt kan vokse på Slanetz & Bartley agarplader var det vigtigt at få bestemt slægt og art af de bakteriekolonier som voksede på agarpladerne. Det var endvidere også vigtigt at få fastlagt om det var enkelte bakteriestammer (kloner) eller mange forskellige stammer som kunne overleve og opformeres i lagret urin. Dette blev fastlagt ved Pulsed Field Gel Elektroforese (PFGE; "DNA fingeraftryk") typning af bakterieisolaternes DNA. Der blev ialt udvalgt 34 bakterieisolater fra Slanetz & Bartley agarplader, som alle kunne identificeres som tilførende slægten Enterococcus ved traditionel biokemisk karakterisering og PCR. Langt hovedparten af testede isolater fra Lokalitet 1 var E. faecium, som havde identisk PFGE type A. Dette indikerer, at disse isolater er tæt beslæget, eksempelvis kan de stamme fra samme person og/eller de er klonalt relateret som følge af opformering i urinen. Det ser således ud til at en identisk E. faecium stamme udviste øget overlevelse og/eller evne til multiplikation i urinflaskerne ved de tre temperaturer. E. faecium betragtes normalt som en strikt fækal enterokokart, som kun i yderst begrænset omfang kan forekomme og overleve i det eksterne miljø. Typning af E. faecium isolater fra Lokalitet 2 viste tre forskellige PFGE typer. Der forekom således flere forskellige E. faecium stammer i urinen som overlevede længere tids lagring og/eller havde evnen til at kunne opformeres. I urin fra Lokalitet 2 blev alle 12 bakterieisolater bestemt som E. gallinarum, en enterokokart som normalt forekommer hos fjerkræ. E. gallinarum blev isoleret fra såvel åben og lukket tank ved de tre undersøgte temperaturer og havde alle en identisk PFGE type F. Det ser således ud til at en identisk E. gallinarum stamme udviste øget overlevelse og/eller evne til multiplikation i urinflaskerne ved de tre temperaturer. Det er uvist om E. gallinarum stammen er blevet tilført urinopbevaringsbeholderne via afføring eller fra jordmiljøet, eksempelvis via utætheder i beholderne. Der blev kun påvist en begrænset reduktion i kimtal ved 37ºC i løbet af 6 måneders lagring af urin og også for denne parameter fandtes der tegn på genvækst. Anvendelse af kimtal ved 37ºC til vurdering af den hygiejniske kvalitet af lagret urin syntes således begrænset på grund af genvækst. Parasitologisk delDer blev udtaget urin fra 2 forskellige lokaliteter, repræsenterende tættere boligbyggeri (Lokalitet 1 og 2). Urinen blev lagret ved 4, 10 og 20ºC og med ca. en måneds interval måltes der pH, ammoniumkoncentration samtidig med at den mikrobiologiske kvalitet blev bedømt udfra antallene af indikatorbakterierne enterokokker, kimtal ved 37ºC og suspekte termotolerante coliforme. Semipermeable kapsler indeholdende æg af protozoen C. parvum blev tilsat og udtaget efter 14 dage, 1 måned og 2 måneder. Æggene (oocysterne) blev dernæst undersøgt for deres levedygtighed (viabilitet) og smitsomhed (infektivitet) i mus. Oocyster af C. parvum overlevede relativt kort tid i human urin, <14 dage ved 20ºC og 1-2 måneder ved 10 og 4ºC, ligesom ingen mus kunne inficeres med oocyster fra urin der havde været lagret 14 dage ved 20ºC, 1 måned ved 10ºC og 2 måneder ved 4ºC. Der var således god overensstemmelse mellem resultater fra viabilitetsundersøgelser og podningsforsøg. Bestemmelse af manglende levedygtighed (<2% viable æg) med den anvendte cellefarvningsmetode til differentiering af levende og døde æg syntes således at kunne bruges som indikator for æggenes manglende smitsomhed . I modsætning til tidligere danske undersøgelser, men i overensstemmelse med svenske undersøgelser, fandtes det derfor at urin der har været lagret i minimum 2 måneder var fri for levedygtige (viable) og smitsomme (infektive) æg af C. parvum. En lagring på to måneder ville også betyde elimination af Giardia æg, idet denne protozo vides at være mere følsom overfor miljøpåvirkninger end Cryptosporidium. Der er derfor ikke lavet forsøg med overlevelse af Giardia i dette projekt. Summary and conclusionsThe background for the studies described in this report was the outcome of a previous project financed by the Danish EPA "Evaluation of the possibilities and constraints for re-circulating nutrients from cities to agriculture – microbiological studies of stored urine from urine separating toilets" (Dalsgaard and Tarnow, 2001). The former study indicated that some indicator bacteria could multiply in stored urine from separation toilets, and, thus, questioned the usefulness of using such indicators for assessing the hygienic quality of stored urine. Furthermore, a low number of protozoan oocysts (eggs) of Cryptosporidium parvum were found in a few urine storage tanks. These oocysts survived long-term storage and could infect mice in experimental infections. To follow up these finding, the Danish EPA wished to initiate controlled laboratory experiments for further assessments of these problems, with the aim of obtaining information that could possibly be used to define hygienic guidelines and suggest required storage times for human urine to be used in agri- and horticulture. The studies were divided into two parts. The first part investigated the question of possible (re)growth of enterococci and total viable counts at 37°C in stored, separated human urine, and the second part investigated the survival of the protozoa C. parvum’s in stored, separated human urine. Bacteriological partUrine samples for the experiments were collected from four different localities and urine storage tanks representing densely populated urban housing areas (localities 1 and 2), and from garden allotments (localities 3 and 4). The urine was stored at 4, 10 and 20°C for up to six months. The pH, the ammonia concentration and microbiological parameters were measured at one month intervals. The microbiological quality of the urine was assessed based on numbers of the indicator bacteria enterococci, total viable counts at 37°C and suspected numbers of thermotolerant coliforms. The pH values were stable around 8.5 to 9 and highest in urine from localities 3 and 4, where the use of water for flushing the toilets had been smaller. The ammonia concentration was also stable, with the highest concentrations found in urine from localities 3 and 4 (approx. 8 ppm for urine collected from open storage tanks and 16-17 ppm in urine from closed storage tanks). The higher pH and ammonia concentration in the relatively more concentrated urine from these localities correlated well with lower initial bacterial counts and reduced bacterial survival. After 1-4 months storage, a general reduction was found in the number of enterococci, to below the detection limit (1 cfu per ml.). However, after 5-6 months a slight increase in numbers of enterococci was seen after storage at 4, 10 and 20° C. This indicates that enterococci can survive and/or multiply during long-term storage of human urine at different temperatures. Enterococci may therefore be poor indicators of faecal pollution of urine, because their occurrence will then indicate a longer survival of pathogens than is really the case. It should therefore be considered to use E. coli as an indicator of faecal pollution, because the survival of E. coli seems more sensitive to the urine environment compared with enterococci. As bacterial genuses and species other than Enterococcus may grow on Slanetz & Bartley agar, it was important to determine the genus and species of the different bacterial colony types that grew on the agar plates. Furthermore, it was important to determine if only few bacterial types (clones) or many different bacterial types could survive and multiply in stored urine. Typing by the Pulsed Field Gel Electroforesis technique (PFGE; "DNA finger printing") was used to show if few or many different bacterial types were isolated on Slanetz & Bartley agar. All 34 bacterial isolates selected from the Slanetz & Bartley agar plates could be identified as belonging to the genus Enterococcus by traditional biochemical testing and PCR. The majority of tested isolates from locality 1 were E. faecium with an identical PFGE type A. This indicates that these isolates are closely related, i.e. the isolates may originate from the same person and/or the isolates belong to the same clone that has multiplied in the urine. Thus, it looks as if an identical E. faecium strain showed better survival and/or ability to multiply in the urine flasks stored at the three temperatures. The origin of E. faecium is normally seen as being strictly faecal, and it may only to a very limited degree be present and survive outside the gastro-intestinal tract. PFGE typing of E. faecium isolates from locality 2 revealed three different PFGE types, which indicates that different E. faecium strains were present in the urine where they survived long-term storage and/or had the ability to multiply. All 12 bacterial isolates tested from locality 2 were identified as E. gallinarum, which is normally associated with poultry. E. gallinarum was isolated from both urine that originated from open and closed urine storage tanks at the three different temperatures under study, and all isolates had an identical PFGE type F. This suggests that an identical E. gallinarum strain showed increased survival and/or the ability to multiply in the urine flasks stored at the three different temperatures. It could not be determined if the E. gallinarum strains were introduced into the urine storage tanks through human faeces or from the soil environment, e.g. through leaks in the storage tanks. Only a limited reduction was seen in total viable counts at 37° C during the six months storage. Slight increases in viable counts were seen in some urine flasks suggesting bacterial multiplication. The use of total viable counts at 37° C to assess the hygienic quality of stored urine seems limited because of an apparent ability for naturally occurring bacteria to multiply. Parasitological partUrine was collected and analyzed from two different localities representing densely populated urban areas (localities 1 and 2). Urine was stored at 4, 10 and 20°C with measurements of pH and ammonia being made monthly together with analyses of the microbiological quality, which was determined by enumerating the indicator bacteria: enterococci, total viable counts at 37°C, and suspected thermotolerant coliforms. Semi-permeable capsules containing C. parvum oocysts were inoculated into the urine, and samples were obtained for analysis after 14 days, one month, and after two months storage. The viability of the oocysts was then determined in colour staining assays, and the infectivity of the oocysts was assessed in experimental infection of mice. Oocysts of C. parvum survived for a relatively short time in human urine, <14 days at 20° C and 1-2 months at 10 and 4° C. It was not possible to infect mice with oocysts from urine that had been stored for 14 days at 20° C, one month at 10° C and two months at 4° C. Thus, a good correlation was found between the results from the viability testing and the infection experiments with mice. The assessment of lack of viability (<2% viable oocysts) with the colour staining assay, which makes it possible to differentiate between live and dead oocysts, seems then to be a good indicator of the oocysts’ ability to infect mice. Oocysts that can infect mice would normally also be able to infect humans. In contrast to the previous Danish study (Dalsgaard and Tarnow, 2001), but in agreement with a Swedish study, it was shown that urine that had been stored for a minimum of two months did not contain viable and infective C. parvum oocysts. Two months storage would also eliminate eggs (ocysts) of Giardia, because this protozoa is seen as being more sensitive to environmental stress than Cryptosporidium. Accordingly, this project did not include any survival studies of Giardia.
1 Indledning og baggrund for undersøgelserneResultaterne af en tidligere undersøgelse finansieret af Miljøstyrelsen (Dalsgaard og Tarnow, 2001) indikerede, at kimtal 37ºC og antal enterokokker, efter et markant fald efter 1-2 måneders lagring af separeret human urin, blev øget ved en efterfølgende 3-6 måneders lagring. Resultaterne tillod dog ikke en sikker vurdering af om der var tale om en reel vækst af kimtal 37ºC og antal enterokokker. Den samme undersøgelse viste også, at der forekom æg (oocyster) af parasitterne Cryptosporidium parvum og Giardia spp. i flere opsamlingstanke med human urin. Begge parasitter er protozoer og vigtige årsager til tarminfektioner hos mennesker. Deres udbredelse er dog ukendt i Danmark. Undersøgelserne viste endvidere, at æg af C. parvum var levende og medførte infektion i mus. Antal æg i urinprøverne var dog for lavt til gennemførsel af regelrette infektionsundersøgelser i mus. Der var således et behov for at få fastlagt om antal kim ved 37ºC og enterokokker vil kunne øges ved lagring af separeret urin. En eventuel vækst af disse bakteriegrupper vil kunne indikerer, at egentlige bakterielle smitstoffer også vil kunne vokse i lagret urin, ligesom en kimtalsvækst ville kunne stille spørgsmål ved anvendeligheden af de to parametre som bakterielle hygiejne indikatorer i urin. Trods påvisningen af C. parvum og Giardia spp. i separeret urin er det dog usikkert hvor længe parasitæggene kan overleve og opretholde deres infektivitet efter eksponering i lagret urin. Projektet havde følgende formål: Bakteriologisk del, projekt 1:
Parasitologisk del, projekt 2:
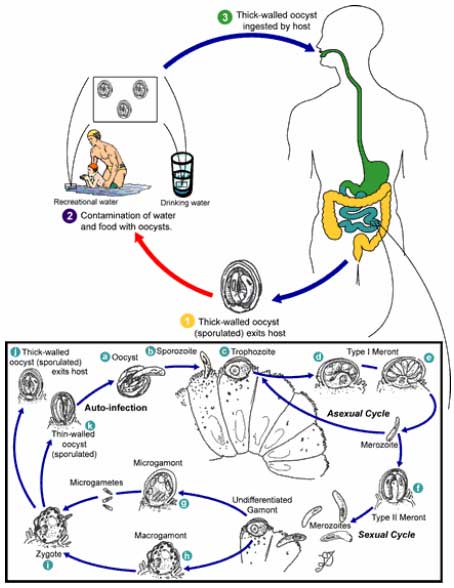
1.1 Mikroorganismer og smitstoffer i urin og fækalier1.1.1 UrinHos raske personer er urinen i urinblæren samt den øvre del af urinrøret steril. Ved transport af urinen i og ud af urinrøret blandes urinen med forskellige typer hudbakterier og når urinen forlader kroppen indeholder den typisk <10.000 bakterier per ml (Jönsson et al., 2000). 1.1.1.1 Urinvejsinfektion 1.1.2 FækalierI et urinseparerende toilet er den største risiko for tilførsel af smitstoffer til urinen forurening med fækalier. Risikoen synes størst, når brugerne er børn eller ved diarrétilfælde, men toiletudforming og brugererfarenhed har også betydning for tilblanding af urinen med fækalier. Diarrétilfælde, hvor smitstoffer findes i afføringen i høje koncentrationer (>107 bakterier pr. gram), repræsenterer den største risiko for tilførsel af smitstoffer til urinen. 1.1.2.1 Bakterier 1.1.2.2 Virus 1.1.2.3 Parasitter Hvis en person som benytter et separationstoilet udskiller parasitter med fækalier, kan disse tilføres urinen gennem fækal forurening. Selvom parasitter kan forårsage sygdomssymptomer, vil mennesker ofte have parasitinfektioner uden at vise sygdomstegn og den udskilte parasitmængde (æg) hos sådanne individer varierer betydeligt. Forekomsten af rundorme, bændelorm og protozoer er ukendt, men menes lav i den danske befolkning. 1.2 Indikatorer til undersøgelse for forekomst af smitstoffer1.2.1 Bakterielle indikatorerEnterokokker Definitionen af slægten Enterococcus omfatter nu 23 arter herunder arterne: E. avium, E. casseliflavus, E. durans, E. faecalis, E. faecium, E. gallinarum og E. malodoratus (Facklam et al. 2002). Enterokokker udgør en del af gruppen af fækale streptokokker som inkluderer S. bovis, S. suis, og S. equinus. Analyse for enterokokker foretrækkes i dag i stedet for analyse for fækale streptokokker. De to betegnelser anvendes ofte synonymt, selvom dette ikke er helt korrekt. Enterokokker findes i menneskers og dyrs tarmkanal og udviser generelt større resistens overfor udtørring, varme og andre ydre påvirkninger end E. coli, Salmonella og de fleste andre Gram-negative sygdomsfremkaldende bakterier. Ved at anvende enterokokker som indikatorbakterium synes der at være en god sikkerhed for, at henfaldet af disse modsvares af et tilsvarende eller hurtigere henfald af sygdomsfremkaldende bakterier. Coliforme bakterier Termotolerante coliforme (fækale coliforme) bakterier E. coli Antal udskilte indikatorbakterier i fækalier I fækalier findes høje koncentrationer af de nævnte indikatorbakterier. Et raskt menneske udskiller i alt ca. 107-109 indikatorbakterier pr. gram fæces med nogen variation mellem de enkelt indikatorer. Kimtal ved 37ºC 1.2.2 Virale indikatorerBakteriofager er virus som kun inficerer bakterier. Fagernes overlevelse i miljøet anvendes i stigende grad til at studere overlevelsen af sygdomsfremkaldende virus i miljøet. Flere forskellige bakteriofager har været foreslået som indikatorer bl.a. F-specifikke bakteriofager og colifager (Lewis, 1995; Tree et al., 1997; Armon et al., 1995). F-specifikke bakteriofager er især aktuelle som indikatorer, da de udviser stor resistens i miljøet og kan påvises ved relative simple og billige laboratoriemetoder. Betegnelsen F henviser til fagernes affinitet for bakteriers flageller. Salmonella typhimurium fag 28B (Lilleengen 1948) har p.g.a. en relativ høj overlevelsesevne i miljøet sammenlignet med andre fager været anvendt i sporingsstudier til påvisning af forurening mellem afløb og rentvandsreservoir (Stenström 1996) og til at spore forurening af grundvand ved vanding med afløbsvand (Carlander et al. 2000, Johansson et al. 1998). S. typhimurium fag 28B har desuden været anvendt som hygiejneindikator ved kontrollering af termofile processer f.eks. ved vådkompostering (Eller 1995, Norin et al. 1996) og pasteurisering (Sahlström et al. 2003). Fag 28B er 60 nm i diameter og resistent overfor høje pH-værdier. 1.2.3 Parasitære indikatorerI dette projekt blev Cryptosporidium parvum benyttet som indikator på protozoers overlevelse i lagret urin fra mennesker. Protozoer er små encellede parasitter som udvikles i tarmkanalen af fugle og pattedyr, inklusive mennesket. Der findes forskellige undertyper af Cryptosporidium hvoraf C. parvum og C. hominis kan smitte mennesker. C. parvum er en relativ almindelig infektion i kvægbruget, som især giver sygdomsproblemer hos spædkalve (Enemark, 2002). Da Giardia æg er mere følsom overfor miljøpåvirkninger end Cryptosporidium er der ikke lavet forsøg med overlevelse af Giardia i dette projekt. C. parvum blev første gang sat i forbindelse med infektion hos mennesker i midten af 70'erne og der er siden da rapporteret et stigende antal tilfælde af infektion med denne parasit både i udviklingslande og i den industrialiserede del af verden. Udbrud i den industrialiserede del af verden skyldes ofte en forurening af vandreservoirer og overfladevand som benyttes til drikkevand, hvorimod en forurening af grundvand med denne parasit ikke anses for at være særlig sandsynlig. Til de største udbrud af C. parvum-infektion hører et udbrud i 1994 i Milwaukee i USA, hvor mere 400.000 mennesker blev angrebet af diarré (Mac Kenzie et al., 1994). I Danmark blev der i 2002 diagnosticeret i alt 38 tilfælde af cryptosporidiose ved Statens Seruminstitut (Anonymous, 2003). Tidligere undersøgelser har vist at i ca. 80% af diagnosticerede tilfælde af cryptosporidiose er der tale om infektioner erhvervet i udlandet. Hos mennesket er infektionen problematisk og i visse tilfælde livstruende hos individer med et svækket immunforsvar (specielt AIDS patienter). Hos voksne raske individer er infektionen derimod selvbegrænsende med en inkubationstid på 2-10 dage samt et sygdomsforløb på op til 2 uger med vandig diarré, mavekramper og let feber. Hos nogle individer ses et symptomløst forløb. C. parvum er en obligat intracellulær parasit, som gennemgår sin ukønnede og kønnede formering inden i tarmslimhindecellerne. Livscyklus, som er skitseret i figur 1, består kort af de følgende faser. De angivne numre og bogstaver i parentes henviser til figuren:
Perioden fra de smitsomme æg optages til nye æg kan findes i det smittede individs fækalier benævnes præpatensperioden og er for C. parvums vedkommende 2-14 dage afhængig af hvilken dyreart eller menneske der er vært for infektionen. Figur 1 C. parvum livscyklus.
Nærmere detaljer af livscyklus er beskrevet i teksten ovenfor. Fra hjemmesiden for: Division of Parasitic Diseases, Center for Disease Control and Prevention, USA [ad2]; http://www.dpd.cdc.gov/dpdx/html/image_library.htm C. parvum har en relativ god overlevelse i miljøet. Overlevelse i vand har vist sig at være op til ca. seks måneder ved temperaturer omkring 4ºC (Fayer et al., 1998; Olsson et al., 1999), hvorimod overlevelsen i urin ifølge svenske undersøgelser er markant kortere, nemlig omkring to måneder ved 4ºC (Höglund og Stenström, 1999). Danske undersøgelser fra 2001 har dog peget på en noget længere overlevelse af æg af C. parvum i lagringstanke til urin fra mennesker, nemlig op til seks måneders overlevelse ved temperaturer under 10ºC (Dalsgaard og Tarnow, 2001). Udover temperatur er koncentrationen af ammoniak også af betydning for C. parvum æggenes overlevelse i miljøet. Således overlever æggene kortere tid ved høj temperatur og ammoniak koncentration i det omgivende miljø. I dette projekt blev mus benyttet til podningsforsøg for med stor sikkerhed at kunne fastlægge at æg af C. parvum som var fundet ikke levende i et farveassay heller ikke var smitsomme. Den anvendte metode til at teste om æggene er smitsomme ved podningsforsøg i museunger er almindelig anerkendt og beskrevet i rapportens metodeafsnit. Det skal dog bemærkes, at man i nær fremtid forventes at kunne udføre testen for ægs smitsomhed med større sikkerhed i celle assays. Assays baseret på forskellige cellelinier bliver i disse år udviklet og vil i vid udstrækning kunne reducere brugen af levende forsøgsdyr. 1.2.4 Valg af måleparametre1.2.4.1 Mikrobiologiske måleparametre
Protozoer af arten Giardia spp. blev ikke undersøgt for deres overlevelse i human urin, idet C. parvum anses for at være repræsentativ for protozoers overlevelse i urin. Tidligere sammenlignende undersøgelser af disse to protozoers overlevelse har vist, at Giardia er langt mere følsom overfor miljøpåvirkninger end Cryptosporidium (Olson et al., 1999). Det må derfor antages, at Cryptosporidium er en bedre indikator end Giardia til fastlæggelse af overlevelsestider for protozoer. 1.2.4.2 Fysisk-kemiske måleparametre
Disse parametre vides at være af betydning for mikroorganismers overlevelse i forskellige medier, inklusiv i urin. I urinlagringstanke vil pH relativt hurtigt stabilisere sig på omkring 9, idet kvælstof bundet i urea frigøres som ammonium-ioner der så igen vil frigøres som ammoniak (NH3). Der etableres derefter hurtigt en ligevægt mellem ammoniak og ammonium (NH4+). Ved at måle ammonium koncentration i urinen får man et indirekte mål på den aktuelle ammoniak-koncentration, som er relativt stabil ved et pH på ca. 9. Det er vist, at C. parvum æg og bakteriers overlevelse i urin ikke alene er bestemt af pH men også af ammoniak koncentrationen (Höglund et al., 1999), samt at den negative effekt af ammoniak på overlevelsen af C. parvum æg er større ved høje temperaturer (Jenkins et al., 1998). 2 Materialer og metoder2.1 Forsøgsdesign2.1.1 Beskrivelse af lokaliteter og tanke for udtagelse af urinLokalitet 1 var en relativ nyetableret økologisk bebyggelse. Alle husstande har installeret urinseparerende toiletter. Der blev til undersøgelserne udtaget urin fra en tank der havde været aflukket i ca. 2 måneder, samt fra en tank der var ved at blive fyldt. Begge tanke var tilsluttet familieboliger. Lokalitet 2 var et alment boligbyggeri, som er repræsentativt for tæt, lavt almennyttigt boligbyggeri i Danmark. Der var i alt 390 lejligheder og 800 beboere. Urinseparerende toiletter var installeret i 9 lejligheder med i alt 16 voksne og 10 børn. Toiletterne var af typen WM ekologen, hvor vandforbruget er ca. 1-3 dl ved urinskyl. Urinen blev opsamlet fra husstandene og tilledt fem tanke på hver 15 m3. Til undersøgelserne blev der udtaget urin fra en tank der havde været aflukket i ca. 1 måned, samt fra en tank der var under opfyldning. Lokalitet 3 og 4 var kolonihaver, hvor der blev udtaget urin fra to husstande med urinseparerende toilet, begge ved ældre ægtepar med børn og børnebørn. I begge husstande var tankene i brug ved udtagelsen af prøverne. De undersøgte kolonihaver repræsenterer lavteknologiske toiletsystemer med kort afstand mellem toilet og opsamlingsbeholder. Der var i alt 100 haver med separationstoiletter og urinen blev typisk opsamlet i 25-liters beholdere. Dog havde to udvalgte haver urinopsamlingsbeholdere på 220 liter. Tabel 1. Projekt 1 - Bakteriologi. Generelle oplysninger om de udtagne urinprøver (urin udtaget 7. og 8. oktober 2002)
a S = sediment i urinlagringstank; Ø = øvrig urin 2.1.2 Udtagelse af prøver på lokaliteterneVed udtagelsen af prøverne blev der benyttet en steril plastiksonde med en indre diameter på 1 cm. Sonden blev fastgjort med plastictape på et plast isolationsrør, således at spidsen af sonden kunne føres helt ned til bunden af de enkelte tanke. Mellem brug af sonde og rør blev disse rengjort grundigt og sonden blev efterfølgende autoklaveret. Til udtagelse af prøver blev en 140-ml engangsplastsprøjte monteret på den ene ende af plastsonden og herigennem blev prøverne fra bunden af tankene ("sediment") udtaget. I alt 1,5 liter sediment blev udtaget og opbevaret i en steril glasflaske på køl indtil forsøget blev igangsat. De såkaldte sedimentprøver var således en blandning af sediment og vand. Dernæst blev der udtaget 15 liter af urinen øverst i tanken ved hjælp af en 10-liters plastikspand. Urinen fra den øvre del af tanken blev opbevaret i 5-liters plastdunke på køl indtil forsøget blev igangsat. Ved udtagelsen af urin måltes pH og temperatur umiddelbart efter udtagelse samt ved hjemkomst til laboratoriet. Ligeledes blev urinens udseende bedømt umiddelbart efter udtagelse. Der blev udtaget prøver til analyse af såvel sediment og urin, idet den højeste koncentration af fækale indikatorer (både bakterielle og parasitære) forventes at være i sedimentprøver fra bunden af tankene. De to prøvetyper blev udtaget idet en egentlig opblanding af sediment med øvrig urin i selve tanken ikke var mulig. 2.1.3 Opsætning af forsøgDen udtagne urin blev opbevaret i 2-L sterile glasflasker og lagret i køleskabe eller varmeskabe ved 4, 10 og 20ºC. Flaskerne var under lagringen omviklet med sorte plasticposer for at forhindre lysgennemtrængning. 2.1.3.1 Valg af temperaturer Med hensyn til protozoen Cryptosporidium, overlever denne længst ved en temperatur på 4ºC, men 10 og 20ºC blev også undersøgt for at kunne relatere parasitternes overlevelse til de faktiske temperaturforhold i nedgravede og ikke-nedgravede urinlagringstanke. 2.1.3.2 Valg af volumen Inden forsøget blev sat op blev der foretaget bakteriologiske målinger på urinen for at vurdere om ekstra tilsætning af fækalier var nødvendig. Der fandtes mellem 101 og 104 cfu/ml af enterokokker og mellem 102 og 106 af kim ved 37ºC. Dette blev vurderet som tilstrækkeligt udgangsmateriale for de videre undersøgelser og der blev derfor ikke tilsat ekstra fækalier til urinen. I parasitologiske undersøgelser af urinen inden igangsætning af forsøget fandtes ingen æg af C. parvum eller æg af rundormeparasitter. 2.1.3.3 Projekt 1 – Bakteriologi Der blev foretaget fysisk-kemiske og bakteriologiske målinger ved lagringens start (T-0) og derefter med ca. 1 måneds interval op til T-6, dvs. efter seks måneders lagring (Tabel 2). Til undersøgelse af mulig eftervækst af enterokokker blev det besluttet at udtage en ekstra prøve efter otte måneders lagring (T-8) fra flasker hvor der havde været positivt fund af enterokokker ved T-6. 2.1.3.4 Projekt 2 – Parasitologi Semipermeable kapsler blev benyttet til de parasitologiske undersøgelser, da det dels var ønskeligt at undgå spredning af de smitsomme parasitæg til hele urinvolumen og kapslerne gjorde det endvidere muligt at opretholde en relativ høj koncentration af æg. Sidstnævnte var nødvendig da der var et begrænset antal parasitæg til rådighed. Kapslerne er beskrevet i detaljer under afsnittet om parasitologiske metoder. Der blev foretaget fysisk-kemiske og parasitologiske målinger ved lagringens start (T-0) og derefter med ca. 1 måneds interval op til T-2 for alle temperaturer. Forsøget blev afsluttet ved T-2 eftersom C. parvum æggene alle var døde og ikke infektive på dette tidspunkt (Tabel 3). For urin lagret ved 20ºC blev der også udtaget prøver efter 14 dages lagring (T-14 dage) idet æg normalt vil dø relativt hurtigt ved denne temperatur. 2.1.4 Tidsplan for udtagelse af prøverDer blev undtaget prøver med 1 måneds tidsintervaller med start tidspunkt angivet som T-0. Tabel 2 Prøveudtagningstidspunkter projekt 1, Bakteriologisk del
X = der blev udtaget prøver til bakteriologisk undersøgelse, samt prøver til pH-måling og ammoniumbestemmelse. Tabel 3 Prøveudtagningstidspunkter projekt 2, parasitologisk del (Cryptosporidium parvum overlevelse i urin)
X = der blev udtaget 2 kapsler fra hver 2-liters beholder og der blev ligeledes udtaget prøver til bakteriologisk undersøgelse, pH-måling og til ammoniumbestemmelse. Y = der blev udtaget 1 kapsel fra hver 2-liters beholder og der blev ligeledes udtaget prøver til bakteriologisk undersøgelse, pH-måling og til ammoniumbestemmelse. PBS = fosfat buffer 2.1.5 MåleprogramI tabel 4 nedenfor er angivet måleprogrammet for de bakteriologiske og parasitologiske undersøgelser sammen med de anvendte metoder. Metoderne er beskrevet i detalje nedenfor. Tabel 4 Måleprogram for projekt 1 (bakteriologisk del) og projekt 2 (parasitologisk del).
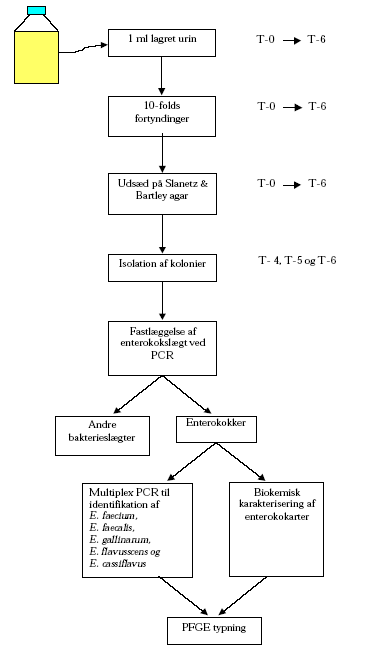
2.2 Metoder2.2.1 Fysisk-kemiske metoder2.2.1.1 Temperatur 2.2.1.2 pH 2.2.1.3 Ammonium koncentration Volumener af ca. 10 ml blev derefter sterilfiltreret igennem et 0,2 m membranfilter og prøverne blev efterfølgende opbevaret ved –20ºC indtil den videre analyse blev foretaget ved Kemisk Institut, KVL. Der blev udført dobbeltbestemmelser på prøverne og et gennemsnit af de to målinger blev beregnet. Analyse for ammonium ved flow-injektionsanalyse og gas diffusion foregik ved at en prøve, tilpas fortyndet med vand, blev ledt ind i en mikrokanal hvor natriumhydroxid blev tilblandet. Dette forårsager at alt ammonium omdannes til gassen ammoniak som derefter kan passere gennem en membran. Koncentrationen af den frigivne ammoniak bestemmes ved hjælp af en indikator og måling af dennes farveintensitet ved en bestemt bølgelængde. 2.2.2 Bakteriologiske metoder2.2.2.1 Enterokokker Figur 2 metodebeskrivelse for udtagelse af prøver fra lagret urin, isolation og typning af enterokokisolater fra Slanetz & Bartley agar.
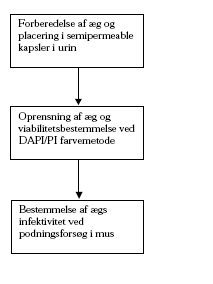
2.2.3 Parasitologiske metoderDetaljerne af de parasitologiske metoder er beskrevet i Bilag B, ligesom principperne i undersøgelserne er vist i figur 3. Fig.3 Metodebeskrivelse for undersøgelse af C. parvum ægs viabilitet (levedygtighed) og infektivitet (smitsomhed)
2.2.4 Statistisk analyse af resultaterFor at fastslå om der var tale om egentlig eftervækst af enterokokker eller om der blot var tale om en stigning der kunne tilskrives variation i kimtal, blev der udført en statistisk analyse af resultater fra flaskerne hvor der fandtes en tilsyneladende forlænget overlevelse og eventuel vækst af enterokokker. Der blev udført en faktoriel variansanalyse (ANOVA) på eventuelt vækst af enterokokker fra T-4 til T-6 (SAS version 8.02) med temperatur og tank som faktorer. 3 Resultater – Projekt 1 Bakteriologi3.1 Fysisk-kemiske målinger3.1.1 TemperaturTemperaturen i de benyttede inkubatorer blev målt 2 gange ugentligt. I løbet af forsøgsperioden varierede temperaturen i inkubatorerne maksimalt med ±1ºC. 3.1.2 pHResultaterne af pH-målinger i urinflaskerne er vist i figur 4, 5 og 6 nedenfor. pH var i alle urinprøverne mellem 8,5 og 9,1 ved starten af forsøget, dog højest i urin fra Lokalitet 3 og 4, hvor tilblanding af vand og dermed fortynding af urinen havde været mindst. De målte pH-værdier var relativt stabile i løbet af den 6 måneder lange undersøgelsesperiode, med det største pH-fald på ca. 0,5 i urin fra Lokalitet 1 (figur 4). Et fald i pH-værdierne skyldes med stor sandsynlighed et udslip af NH3 (ammoniak) dampe ved åbning af flaskerne for hver prøveudtagning. Dette udslip har dog været meget begrænset jf. de lave reduktioner i de målte pH-værdier. Betegnelsenre "lukket" og "åben" i de efterfølgende figurer henviser til om urinopsamlingstankene, hvorfra urinen blev indsamlet, var aflukket for urintilførsel ("lukket") eller om der blev tilført urin på indsamlingstidspunktet ("åben"). Det skal bemærkes, at der for hver undersøgt temperatur blev udført dobbeltbestemmelser ved analyser af urinprøver fra to forskellige beholdere. Figur 4 Ændringer i pH i lagret urin fra Lokalitet 1, tank 2 (lukket) og tank 4 (åben). T-0 til T-6 angiver antal måneders lagring ved de respektive temperaturer. Figur 5 Ændringer i pH i lagret urin fra Lokalitet 2 tank 3 (lukket) og tank 4 (åben). T-0 til T-6 angiver antal måneders lagring ved de respektive temperaturer. Figur 6. Ændringer i pH i lagret urin fra Lokalitet 3 (HFB) og Lokalitet 4 (HFT). T-0 til T-6 angiver antal måneders lagring ved de respektive temperaturer. 3.1.3 AmmoniumkoncentrationResultaterne af ammonium-målinger er vist i figur 7, 8 og 9 nedenfor. Som forventet var ammoniumkoncentrationen højest i urin fra Lokalitet 3 og 4 hvor tilblanding af vand og dermed fortynding af urinen havde været mindst. De målte ammonium-koncentrationer var relativt stabile (ca. 8 ppm for urin fra åben tank og 16-17 ppm for urin fra lukket tank) i løbet af de 6 måneder, med undtagelse af en generel stigning ved T-4 ved alle lokaliteter. Denne stigning kunne skyldes en metodisk fejl ved udtagning af prøverne, da den er af samme størrelse for alle lokaliteter ved netop T-4. Figur 7 Ammoniumkoncentration (ppm – parts per million) ved Lokalitet 1 T-0 til T-6 angiver antal måneders lagring ved de respektive temperaturer Figur 8 Ammoniumkoncentration (ppm) ved Lokalitet 2 T-0 til T-6 angiver antal måneders lagring ved de respektive temperaturer Figur 9 Ammoniumkoncentration (ppm) ved Lokalitet 3 (HFB) og 4 (HFT) T-0 til T-6 angiver antal måneders lagring ved de respektive temperaturer 3.1.4 Sammenhæng mellem pH og ammoniumkoncentrationDer var generelt god overensstemmelse mellem pH og ammonium værdierne idet de højeste pH-værdier blev målt ved Lokalitet 3 og 4, som også havde de højeste koncentrationer af ammonium. Ligeledes blev de laveste pH-værdier målt ved Lokalitet 1, hvor ammonium-koncentrationen også var lavest. Med udganspunkt i de begrænsede variationer i pH og ammoniumkoncentration igennem forsøgsperioden skønnes det ikke at variationer de to parametre medførte en signifikant påvirkning af overlevelsen af testparametrene. 3.2 Bakteriologiske målinger3.2.1 EnterokokkerResultaterne af undersøgelserne for enterokokker i lagret urin fra de tre lokaliteter er vist i figur 10, 11 og 12. Det skal bemærkes, at der for hver undersøgt temperatur blev udført dobbeltbestemmelser ved analyser af urinprøver fra to forskellige beholdere. Som forventet fandtes den højeste startkoncentration af enterokokker i urin fra de åbne tanke, som blev tilledt urin ved prøveindsamlingstidspunktet. Der er således sket en fækal forurening af urinen, som mest sandsynlig skyldes en ikke 100 % separation af urin og fæces. Årsagerne hertil kan være flere, eksempelvis fækal forurening af urin fra personer med diarré eller fra børn som oftest har sværere ved at bruge urinseparerende toiletter korrekt sammenlignet med voksne. Startkoncentration af enterokokker var 1 log-enhed lavere i urin fra Lokalitet 3 og 4. Dette kan skyldes, at denne urin havde mindre vandtilførsel ved toiletskyl og at den koncentrede urin havde en relativt øget reducerende effekt på enterokokantallet. Figur 10 Reduktion i antal enterokokker i lagret urin fra Lokalitet 1 ved 3 forskellige temperaturer. T-0 til T-6 angiver antal måneders lagring ved de respektive temperaturer. I urin fra Lokalitet 1 (figur 10) skete der en 2-3 log reduktion i antallet af enterokokker ved alle tre lagringstemperaturer. Detektionsgrænsen på 1 cfu/ml blev nået hurtigst (efter en måned) for urin fra lukket tank, lagret ved 20ºC. Den langsomste reduktion af antal enterokokker skete i urin fra åben tank, lagret ved 4ºC. Her blev detektionsgrænsen først nået efter fem måneders lagring, hvorefter der blev observeret en svag stigning i antal enterokokker ved prøveanalyse efter seks måneders lagring. Dette fund indikerer en mulig eftervækst ved 4ºC. Der blev udtaget et antal enterokokisolater repræsenterende forskellige kolonityper til videre karakterisering, identifikation og typning. Resultaterne af disse undersøgelser er beskrevet i de efterfølgende afsnit (3.2.1.1). Figur 11 Reduktion i antal enterokokker i lagret urin fra Lokalitet 2 ved 3 forskellige temperaturer. T-0 til T-6 angiver antal måneders lagring ved de respektive temperaturer. I urin fra Lokalitet 2 (figur 11) skete der en 1-3 log reduktion i antal enterokokker ved alle tre lagringstemperaturer i løbet af forsøgsperioden. Detektionsgrænsen på 1 cfu/ml blev nået hurtigst for urin fra lukket tank, lagret ved 4, 10 og 20ºC, samt for urin fra åben tank, lagret ved 20ºC. Dette skete efter 1-2 måneders lagring. Den langsomste reduktion i antal enterokokker skete i urin fra åben tank, lagret ved 4 og 10ºC. Her blev detektionsgrænsen nået efter 4-5 måneders lagring, hvorefter der blev observeret en tilsyneladende svag stigning i antallet efter 5 og 6 måneders lagring for urin fra åben tank, lagret ved 4, 10 og 20ºC, samt en midlertidig stigning i antallet i urin fra lukket tank, lagret ved 4ºC. Denne stigning fandtes at være statistisk signifikant (p<0.05) og tyder på en mulig eftervækst ved flere temperaturer. Der blev udtaget et antal enterokokisolater repræsenterende forskellige kolonityper til videre identifikationsbestemmelse. Resultaterne af disse undersøgelser er beskrevet i de efterfølgende afsnit. Figur 12 Reduktion i antal enterokokker i lagret urin fra Lokalitet 1 (HFB) og 2 (HFT) ved 3 forskellige temperaturer. T-0 til T-6 angiver antal måneders lagring ved de respektive temperaturer. I urin fra Lokalitet 3 og 4 (figur 12) skete der en 1-2 log reduktion i enterokokker ved alle tre lagringstemperaturer i løbet af lagringsperioden. Detektionsgrænsen på 1 cfu/ml blev nået allerede efter 1 måneds lagring ved alle tre temperaturer. Der fandtes ingen eftervækst af enterokokker. 3.2.1.1 Biokemisk og PCR karakterisering af enterokokisolater Der blev udtaget kolonier fra Slanetz & Bartley agar på prøveudtagningstidspunkterne T-4, T-5, T-6 og T-8 fra Lokalitet 1 og 2. Fra Lokalitet 3 og 4 fandtes ingen vækst af kolonier på Slanetz & Bartley agar efter T1. Ofte fandtes der kun en enkelt eller få kolonier på agarpladerne. Resultaterne af den biokemiske karakterisering og PCR bestemmelse af enterokokslægt og art af de ialt 34 udvalgte isolater fra Lokalitet 1 og 2 er vist i tabel 8. Resultaterne af multiplex PCR bestemmelserne er vist i figur 13, hvor DNA båndene for teststammerne er vist sammen med båndene for en række enterokok kontrolstammer. Teststammer og kontrolstammer med samme DNA båndstørrelse tilhører samme art. Isolater kunne kun vokse efter udsæd af urinprøver fra den åbne tank ved Lokalitet 1. Alle 11 isolater blev bestemt til E. faecium. Ved T-4 blev E. faecium isoleret fra urinflasker opbevaret ved såvel 4 og 10ºC; ved T-5 blev der kun isoleret et enkelt E. faecium isolat fra urinflaske opbevaret ved 20ºC; og ved T-6 og T-8 blev E. faecium kun isoleret ved 4ºC. Ved T-4 blev der isoleret et enkelt E. mundtii isolat (tabel 8). Alle E. faecium isolater havde samme kolonitype på Slanetz & Bartley agar med rødbrunt centrum og lyserød randzone og en diameterstørrelse på 1-2 mm. Ialt 22 isolater blev udvalgt til videre karakterisering og typebestemmelse fra prøver fra åben og lukket urintanke ved Lokalitet 2 (tabel 8). Ved T-4 blev 4/5 isolater fra urinprøver opbevaret ved 4 og 10ºC fra den åbne urintank bestemt som E. faecium og et enkelt isolat som E. hirae. Ved T-5 blev 7/8 isolater fra urinflasker opbevaret ved 4 og 20ºC bestemt som E. gallinarum og kun et enkelt isolat som E. faecium. Ved T-6 blev der i urin fra åbne urintanke isoleret E. gallinarum og E. faecium ved såvel 4 og 10ºC. Endelig blev der ved T-8 isoleret E. gallinarum og E. faecium ved 4ºC (tabel 8). Der blev kun ved T-5 isoleret kolonier fra prøver fra lukket urintank. Alle E. gallinarum havde samme kolonitype på Slanetz & Bartley agar med rødbrun farve og en diameterstørrelse på ca. 1 mm. Der var overensstemmelse mellem resultaterne af den biokemiske karakterisering og PCR bestemmelse af slægt og art. Tabel 8 Resultater af biokemisk karakterisering og PCR for slægts- og artsbestemmelse af enterokokisolater fra Slanetz & Bartley agar
a , C: centrum af koloni; R: randzone af koloni 3.2.1.2 PFGE typning af enterokokker (DNA fingeraftryk) Resultaterne af PFGE typningen af enterokokker er vist i tabellerne 9 og 10, ligesom eksempler på PFGE typningen er vist for E. faecium i figur 14 og for E. gallinarum, E. mundtii, og E. hirae i figur 15. Ved sammenligning af PFGE DNA båndtyper vil bakterioisolater med identisk antal og båndstørrelser ofte være af klonal oprindelse, eksempelvis som følge af opformering/eftervækst. Isolater med få bånds forskelle vil ofte også være identiske eller nært beslægtede. Forskelle i båndmønstre skyldes forskelligheder i DNA sekvenser og dermed i genkendelsessteder for det anvendte skæringsenzym SmaI. Tabel 9 Resultater fra PFGE typning af E. faecium
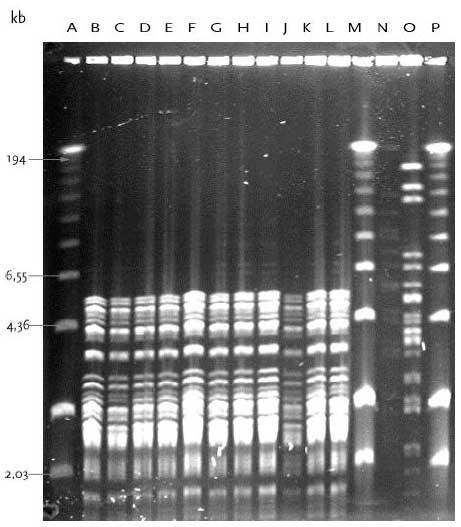
Ved PFGE typning af E. faecium isolater fra Lokalitet 1 fandtes to PFGE typer, A og B, hvor 10/11 isolater havde type A (tabel 9). PFGE type A isolater blev kun fundet i urin fra den åbne tank og ved alle tre undersøgte temperaturer. Type A og B har samme grundmønster, men type B indeholder yderligere 7 DNA bånd af forskellig størrelse (figur 14). Fundet af E. faecium med identisk PFGE type A indikerer at disse isolateret er tæt beslæget, eksempelvis kan isolaterne stamme fra samme person og/eller de er klonalt relateret som følge af multiplikation. Det ser således ud til at en identisk E. faecium stamme udviste øget overlevelse og/eller evne til multiplikation i urinflaskerne ved de tre temperaturer. Tabel 10 Resultater fra PFGE typning af E. gallinarum
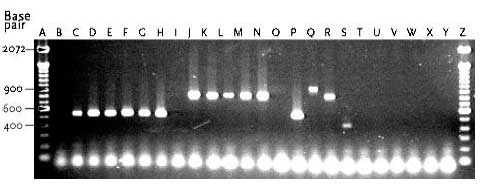
I urin fra Lokalitet 2 blev der identificeret både E. faecium og E. gallinarum. Derudover blev E. hirae identificeret en gang ved T-4 fra en åben tank. De 9 E. faecium isolater havde ialt tre forskellige PFGE typer C, D og E (tabel 9). PFGE type C blev fundet i urin fra en lukket tank som blev opbevaret ved 4ºC. Denne PFGE type fandtes også hos et enkelt isolat fra urin opbevaret ved 4ºC og hos tre isolater opbevaret ved 10ºC. Et isolat isoleret fra en åben tank ved 4ºC havde type D, mens PFGE type E kun blev set hos tre isolater fundet i åbne tanke og opbevaret ved 4ºC. Med fundet af tre forskellige PFGE typer, syntes der således at forekomme flere forskellige E. faecium stammer som udviste øget overlevelse og/eller evne til multiplikation i den åbne urintank ved Lokalitet 2. Figur 13 Multiplex PCR analyse af udvalgte enterokokisolater, samt 10 kontrolstammer.
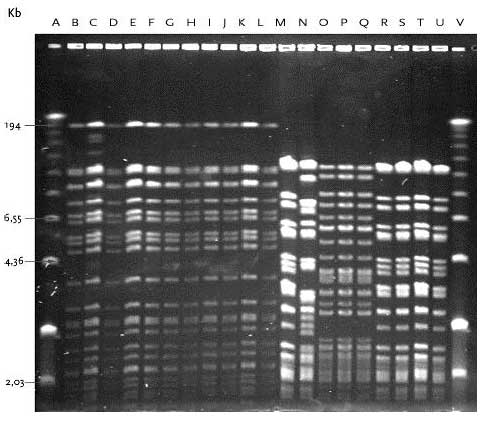
Bane A, 100 bp DNA størrelsesmarkør; Bane B, Urin-1; Bane C, Urin-2; Bane D, Urin-3; Bane E, Urin-4; Bane F, Urin-5; Bane G, Urin-6; Bane H, Urin-7; Bane I, Urin-14; Bane J, Urin-15; Bane K, Urin-17; Bane L, Urin-18; Bane M, Urin-19; Bane N, Urin-20; Bane O, Mix kontrol; Bane P, E. faecium 301; Bane Q, E. faecalis 302; Bane R, E. gallinarum CECT 970; Bane S, E. flavescens CECT 4481; Bane T, E. avium CECT 968; Bane U, E. raffinosus NCTC 12192; Bane V, E. mundtii ATCC 43186; Bane W, E. hirae 9790RF; Bane X, E. dispar CECT 4310; Bane Y, E. durans CCUG 7972; Bane Z, 100 bp DNA størrelsesmarkør. I urin fra Lokalitet 2 havde alle 12 E. gallinarum stammer, som var isoleret fra såvel åben og lukket tank ved de tre undersøgte temperaturer, identisk PFGE type F (figur 15). Det ser således ud til at en identisk E. gallinarum stamme udviste øget overlevelse og/eller evne til multiplikation i urinflaskerne ved de tre temperaturer. Figur 14 PFGE typer af E. faecium med DNA skåret med skæringsenzymet SmaI.
Bane A, Low-range PFGE markør; Bane B, Urin-2; Bane C, Urin-3; Bane D, Urin-29; Bane E, Urin-4; Bane F, Urin-5; Bane G, Urin-6; Bane H, Urin-30; Bane I, Urin-9; Bane J, Urin-10; Bane K, Urin-11; Bane L, Urin-23; Bane M, Urin-16; Bane N, Urin-7; Bane O, Urin-24; Bane P, Urin-25; Bane Q, Urin-31; Bane R, Urin-8; Bane S, Urin-12; Bane T, Urin-13; Bane U, Urin-27; Bane V, Low-range PFGE markør. Forskellen i DNA båndmønstre mellem PFGE typerne fundet hos E. faecium og E. gallinarum var stor. Generelt havde PFGE typen for E. gallinarum mindre fragmenter med det største fragment på ca. 5,5 kb, mens båndmønstre hos E. faecium havde en del større fragmenter. Det var således muligt at differentiere mellem de to arter baseret på deres PFGE type. For E. faecium, E. mundtii og E. hirae var størrelsen og fordelingen af DNA fragmenterne mere jævn og adskilte ikke disse arter tydeligt. Figur 15 PFGE typer af E. gallinarum samt E. mundtii og E. hirae med DNA skåret med skæringsenzymet SmaI.
Bane A, Low-range PFGE markør; Bane B, Urin-15; Bane C, Urin-17; Bane D, Urin-18; Bane E, Urin-32; Bane F, Urin-33; Bane G, Urin-34; Bane H, Urin-19; Bane I, Urin-20; Bane J, Urin-26; Bane K, Urin-21; Bane L, Urin-22; Bane M, Low-range PFGE markør; Bane N, Urin-1; Bane O, Urin-14; Bane P, Low-range PFGE markør. 3.2.1.3 Kimtal ved 37ºC Resultaterne af undersøgelserne for kimtal ved 37ºC i urinprøver fra de fire lokaliteter er vist i figur 16, 17 og 18. Der skal bemærkes, at der for hver undersøgt temperatur blev udført dobbeltbestemmelser ved analyser af urinprøver fra to forskellige beholdere. Urin fra åbne tanke havde samme antal eller svagt højere antal kim ved T-0 sammenlignet med urin indsamlet fra lukkede tanke. Startkoncentration af kim ved 37ºC var som for enterokokker ca. 1 log-enhed lavere i urin indsamlet fra Lokalitet 3 og 4 sammenlignet med urin fra Lokalitet 1 og 2. Figur 16. Reduktion i antal kim ved 37ºC i lagret urin fra lokalitet 1 ved 3 forskellige temperaturer. T-0 til T-6 angiver antal måneders lagring ved de angivne temperaturer. I urin fra Lokalitet 1 skete der generelt en begrænset nettoreduktion i kimtal ved 37ºC i løbet af lagringsperioden (figur 16). I urin fra lukket tank, lagret ved 4 og 10ºC, skete der en 1-2 log-enheders reduktion i kimtallet i løbet af 6 måneders lagring. I urin fra lukket tank, lagret ved 20ºC, skete der ingen kimtalsreduktion, men derimod tilsyneladende en svag stigning i kimtallet i løbet af de 6 måneder. Resultaterne tyder på, at bakteriekim selv efter 6 måneders lagring af urin kan udvise vækst, især ved opbevaring af urinen ved 20ºC. I urin fra åben tank, lagret ved 4 og 10ºC, skete der en gradvis reduktion i kimtal på i alt 2-3 log-enheder i løbet af de 6 måneders lagring. Det skal bemærkes, at selvom der i urin fra åben tank, lagret ved 20ºC, skete en reduktion på 2-3 log-enheder i kimtallet i den ene urinflaske (replikat 1), fandtes der i den anden flaske (replikat 2) en kimtalsstigning på 1 log-enhed fra T-5 til T-6. Figur 17 Reduktion i kimtal ved 37ºC i lagret urin indsamlet fra Lokalitet 2, ved 3 forskellige temperaturer. T-0 til T-6 angiver antal måneders lagring ved de angivne temperaturer. I urin fra Lokalitet 2 skete der ligeledes generelt en begrænset reduktion i kimtal ved 37ºC i løbet af lagringsperioden (figur 17). I urin fra lukket tank, lagret ved 4, 10 og 20ºC, skete der en ringe eller ingen kimtalsreduktion i løbet af de 6 måneders lagring. I urin fra åben tank, lagret ved 20ºC, skete der en reduktion i kimtallet på 3 log-enheder i løbet af de 6 måneder, hvorimod der fandtes en 1-2 log-enheds kimtalsreduktion ved de to lavere temperaturer. Der var ingen tegn på en stigning i kimtallet i urin indsamlet fra Lokalitet 2. Figur 18 Reduktion i antal kimtal ved 37ºC i lagret urin fra Lokalitet 3 og 4 ved 3 forskellige temperaturer T-0 til T-6 angiver antal måneders lagring ved de angivne temperaturer. I urin fra Lokalitet 3 og 4 var der som udgangspunkt en lidt lavere koncentration af kim efter dyrkning ved 37ºC (figur 18) sammenlignet med kimtallene i urin fra de to førnævnte lokaliteter. I løbet af de 6 måneders lagring skete der ingen eller kun ringe kimtalsreduktion ved alle tre undersøgte lagringstemperaturer. Der fandtes således ingen stigning i kimtallet i urin fra Lokalitet 3 og 4. 3.2.2 Suspekte termotolerante coliformeResultaterne for undersøgelserne for suspekte termotolerante coliforme bakterier er vist i Bilag C. Generelt fandtes der lave startkoncentrationer af suspekte termotolerante coliforme bakterier i urin fra alle lokaliteterne, ligesom der kun kunne påvises suspekte termotolerante coliforme i åbne tanke fra Lokalitet 1 og 2. De lave koncentrationer af denne parameter tyder på en lavgradig frisk fækal forurening og/eller en ringe overlevelse af suspekte termotolerante coliforme bakterier i lagret urin. Der fandtes således ikke suspekte termotolerante coliforme i de tanke der havde været aflukkede i cirka 1 måned. Resultaterne viser, at sammenlignet med enterokokker overlever termotolerante coliforme bakterier kun kort tid i lagret urin. 3.3 Delkonklusioner – Projekt 1 Bakteriologi
4 Resultater – Projekt 2 Parasitologi4.1 Fysisk-kemiske målinger4.1.1 TemperaturTemperaturen i de benyttede inkubatorer blev målt 2 gange ugentligt. I løbet af forsøgsperioden varierede temperaturen i inkubatorerne maksimalt med ±1ºC. 4.1.2 pHTabel 11 viser resultaterne af pH-målinger fortaget i løbet af forsøgsperioden. De målte værdier viste lille variation og var sammenlignelige med pH værdierne fra de bakteriologiske undersøgelser (projekt 1). Tabel 11 pH-målinger i urin anvendt til parasitologiske undersøgelser
4.1.3 AmmoniumkoncentrationTabel 12 Ammoniumkoncentrationer i urin og kontrolopløsninger (ppm) efter forskellige prøveudtagningsintervaller.
4.2 Parasitologiske målinger4.2.1 ViabilitetsundersøgelserViabilitet (levedygtighed) i stamopløsningen af æg blev bestemt ved DAPI/PI farvning og var 65,4% og faldt hurtigt ved æggenes lagring i urin (tabel 13). Ved inkubation ved 20ºC var æggenes viabilitet 0% allerede efter 14 dages lagring. Ved inkubation ved 10ºC var viabiliteten 0% efter én måneds lagring. Ved inkubation ved 4ºC var viabiliteten <2% efter én måneds lagring og 0% efter eksponering til urin for den ene lokalitet efter to måneders lagring. Tabel 13 Procent (%) levende (viable) æg efter lagring i urin ved 3 forskellige temperaturer.
4.2.2 PodningsforsøgPodningsforsøgene i mus bekræftede disse fund, idet ingen mus kunne smittes med æg fra urin inkuberet ved 20ºC ved T-14 dage og ved T-1(tabel 14). Resultaterne fra T-1 og T-2 for æg inkuberet i urin ved 4 og 10ºC, stemmer overens med fundene fra viabilitetsundersøgelserne, idet kun én enkelt mus kunne inficeres med æg fra lagret urin fra Lokalitet 2 der havde været inkuberet ved 4ºC i urin ( T-1). Kun i dette ene forsøg var det muligt at inficere mus. Tabel 14 Podningsforsøg med mus. Antal mus positive for Cryptosporidium parvum i hver gruppe bestående af 6 mus.
a = hunmus spiste fire unger fra sit kuld og der foreligger derfor kun resultater fra to museunger i denne gruppe b = 1 oocyst blev fundet i én mus c = stamopløsning d = PBS 4.3 Bakteriologiske målingerResultaterne for analyserne for antal enterokokker, kimtal ved 37ºC, og suspekte termotolerante coliforme bakterier viste generelt lave kimtalsværdier, som var i overensstemmelse med de fundne kimtal fra undersøgelserne af urin fra åben tank i projekt 1. Resultaterne af de bakteriologiske undersøgelser lavet i forbindelse med forsøgene med Cryptosporidium er beskrevet i Bilag D. 4.4 Delkonklusioner – Projekt 2 Parasitologi
5 Diskussion5.1 Projekt 1 BakteriologiNH4 (ammonium) koncentrationen og pH er vigtige faktorer som påvirker mikroorganismers overlevelse i urin. Ammonium og andre kvælstofforbindelser virker giftig på mikroorganismer, som også påvirkes negativt af alkaliske pH forhold (pH i urin er typisk omkring 9). Undersøgelsens resultater viste en positiv korrelation mellem NH4-indhold og pH med de højeste værdier målt i urin fortyndet med ingen eller begrænset mængder vand (Lokalitet 3 og 4; urin fra kolonihaver). Ved anvendelse af de relativt store 2-liters urinbeholdere til laboratorieforsøgene kunne der opretholdes et næsten konstant pH og NH4 indhold i beholderne svarende til de forhold der findes i urinopsamlingstanke. Startkoncentrationen af enterokokker i urin indsamlet fra åbne urinopsamlingstanke var højere (ca. 103 - 104 cfu/ml) sammenlignet med urin fra lukkede opsamlingstanke (ca. 102 cfu/ml). Dette skyldes, at åbne tanke blev tilført urin på prøveudtagningstidspunktet modsat de lukkede tanke som havde været lukket i et tidsrum forud for prøveudtagningstidspunktet. Urin fra åbne tanke var således tilført frisk (fækalt forurenet) urin. Forskellige startkoncentrationer af enterokokker medførte en tilsvarende variation i den hastighed hvormed antallet af enterokokker blev reduceret. Dette indikerer, at der i urin med høje enterokokkoncentrationer som følge af betydelig fækal forurening vil kunne påvises enteriokokker efter relativt længere lagringstid sammenlignet med urin med lave enterokokkoncentrationer. Efter en reduktion af antal enterokokker til under detektionsgræsen på 1 cfu/ml blev der påvist en mindre stigning i antal enterokokker i urin fra Lokalitet 1 og især 2 efter 5-6 måneders opbevaring. Da enkelte andre bakterieslægter end enterokokker kan vokse på Slanetz & Bartley agarplader var det vigtigt at få fastlagt, at de fremvoksede bakteriekolonier virkelig var enterokokker. Det var endvidere også vigtig, at få bestemt enterokokarten da nogle arter kan forekomme naturligt i miljøet, eksempelvis i jord, mens andre næsten udelukkede forekommer i afføring fra mennesker og dyr. Slægt og art af udvalgte bakteriekolonier blev bestemt ved biokemisk karakterisering og PCR. Den videre karakterisering blev således udført for at kunne fastlægge om den registrede bakterielle vækst skyldes enterokokker tilført fra mennekser og ikke fra miljøet omkring urinopsamlingstanke. Efter 4 måneders opbevaring af urin fra Lokalitet 1 blev 11/12 isolater identificeret som E. faecium, som alle havde en identisk DNA fingeraftrykstype (PFGE type A). E. faecium betragtes normalt som en strikt fækal enterokokart der overlever relativt dårligt udenfor mavetarmkanalen af dyr og mennesker. P.g.a. af den observerede stigning i enterokokantallet stammer disse identiske E. faecium isolater med stor sandsynlighed fra den samme bakteriecelle som følge af opformering i urinen. Det ser således ud til at en identisk E. faecium stamme udviste øget overlevelse og evne til multiplikation i urinflaskerne. Urin fra Lokalitet 2 blev opbevaret i 8 måneder i laboratoriet. Karakterisering af ialt 22 bakterieisolater efter 5-8 måneders opbevaring af urinen ved forskellige temperaturer påviste forekomst af E. faecium og E. gallinarum. Typning af en række E. faecium stammer viste tre forskellige PFGE typer, mens alle 12 undersøgte E. gallinarum stammer havde en identisk PFGE type F. Der forekom således flere forskellige E. faecium stammer og en identisk E. gallinarum stamme som kunne overleve længere tids lagring i urin og/eller havde evnen til at kunne multiplicerer. Resultaterne af undersøgelsen stiller store spørgsmålstegn ved anvendeligheden af enterokokker som indikator på hygiejnisk kvalitet af opbevaret urin fra mennesker. En god mikrobiel hygiejneindikator bakterie skal opfylde flere forhold, herunder at reduktionen i dens antal svarer til en antalsreduktion af de smitstoffer (eksempelvis Campylobacter og Salmonella), som den skal indikerer en eventuel tilstedeværelse af. En god indikatorbakterie må normalt heller ikke kunne udvise vækst. Det bør derfor overvejes at anvende andre bakterielle indikatorer end enterokokker til fastlæggelse af den bakteriologiske kvalitet af lagret urin. E. coli har i en tidligere undersøgelse vist korte overlevelsestider i lagret urin svarende til en række vigtige bakterielle smitstoffer (1-2 måneder), herunder Shigella spp (Dalsgaard og Tarnow, 2001). Det bør derfor overvejes nærmere at anvende E. coli som indikator på bakteriologisk kvalitet af opbevaret urin fra mennesker. 5.2 Projekt 2 ParasitologiI dette projekt blev C. parvum benyttet som indikator på protozoers overlevelse i urin fra mennesker. Infektioner med protozoer, hvoraf flere kan smitte fra dyr til mennesker (såkaldte zoonoser), er blevet observeret stadig hyppigere i de seneste år og begrænser sig ikke kun til udviklingslande med ringe sanitære forhold, men forekommer ligeledes i den industrialiserede del af verden, med store udbrud af diarre forårsaget af protozoerne Cryptosporidium, Cyclospora og Giardia (Slifko et al., 2000). I Danmark diagnosticeres infektioner med Giardia hyppigere end infektioner med Cryptosporidium, mens der ikke har været registreret diarrétilfælde forårsaget af Cyclospora. Langt de fleste af disse infektioner er erhvervet i udlandet, men eftersom cryptosporidiose er en relativ almindelig infektion i kvægbruget (Anonymous, 2002) er der en potentiel risiko for infektioner via kvæg. C. parvum er en egnet indikator for protozoers overlevelse i miljøet, herunder eksempelvis i vand eller i urin, da C. parvum er mere resistent overfor miljøpåvirkninger, såsom pH, ammoniak og temperatur end Giardia (Olson et al., 1999). Undersøgelser udført for Miljøstyrelsen i 2001 (Dalsgaard og Tarnow, 2001) viste, at et lille antal fundne æg af C. parvum tilsyneladende kunne overleve adskillige måneder i urinlagringstanke. Dette fund var overraskende, idet svenske undersøgelser har vist, at æg af C. parvum maksimalt overlever 2 måneder i urin fra mennesker, når urinen lagres ved 4ºC (Höglund og Stenström, 1999). Undersøgelserne beskrevet i denne rapport bekræfter de svenske undersøgelser, idet en overlevelse på under 2 måneder blev fundet for æg lagret ved 4ºC i urin fra mennesker. I modsætning til de tidligere svenske undersøgelser blev det endvidere fastlagt at æg med en viabilitet <2% ikke kunne inficerer mus. C. parvum æg lagret i urin i 2 måneder syntes således ikke at være infektive, herunder for mennesker. En mulig forklaring på uoverensstemmelserne i resultater fra de tidligere danske undersøgelser (Dalsgaard og Tarnow, 2001) og resultaterne i denne rapport, kunne være, at der skete en fækal forurening efter de undersøgte urintanke blev lukket. Hvis denne forklaring er korrekt, understreger det vigtigheden af at have et holdbart og tæt urinlagringssystem. Endelig var resultaterne i de tidligere undersøgelser baseret på et meget lille antal æg. Forudsat at der ikke sker en efterfølgende fækal forurening af den lagrede urin viser denne rapports og de svenske resultater, at urin kan anses at være fri for levende og infektive protozoæg efter ca. 2 måneders ved lagringstemperaturer >4ºC. Med hensyn til overlevelse af andre parasitter i urin fra mennesker tyder svenske undersøgelser på en relativ god overlevelse af Ascaris suum æg (Höglund et al., 1998). Ascaris æg bruges ofte som model på parasitægs overlevelse i miljøet, da disse æg udviser en meget stor resistens overfor ydre miljøpåvirkninger. Det vil kræve yderligere undersøgelser at give retningslinier for lagringstid af urin med henblik på drab af Ascaris æg. Ascaris æg er markant større end protozoæg, hvilket medfører at førstnævnte vil udvise en højere grad af sedimentering og derfor primært vil forekomme i urinens sediment. I denne rapport er undersøgelserne foretaget ved tre forskellige lagringstemperaturer; 4, 10 og 20ºC. Adskillige undersøgelser har vist, at Cryptosporidium overlevelse i forskellige medier (ferskvand, saltvand, fækalier og urin) er stærkt temperaturafhængig, idet æggene overlever længst tid ved lavere temperaturer, med 4ºC som optimum temperatur for overlevelse (Robertson et al., 1992; Fayer et al., 1998; Olson et al., 1999, Höglund og Stenström, 1999; Freire-Santos et al., 2000). Således fandtes der også i denne undersøgelse en sammenhæng mellem temperatur og overlevelse af æg i urin fra mennesker, med den længste overlevelse (under 2 måneder) ved 4ºC. pH værdier og ammoniumkoncentrationer i urin udtaget fra de to opsamlingstanke viste sig at være yderst stabile i løbet af forsøgsperioden, hvilket indikerer, at der har været et minimalt udslip af ammoniak ved udtagning af prøver fra glasflaskerne med urin. Det var derfor ikke muligt at lave en egentlig vurdering af pH og ammonium/ammoniaks indflydelse på æggenes overlevelse. Den længere overlevelse af æg i kontrolopløsningen af fosfatbuffer tyder imidlertid på en særlig effekt af urinen på æggenes overlevelse. Ammonium/ammoniak har sandsynligvis en vigtig negativ effekt på protozoægs overlevelse i urin. Dette er beskrevet eller antydet i andre lignende undersøgelser, hvor man fandt at pH alene ikke kunne forklare en øget dødelighed af æg (Jenkins et al., 1998; Höglund og Stenström, 1999). Der fandtes i vore undersøgelser en god korrelation mellem viabilitetsassayet (DAPI/PI cellefarvning) og podningsforsøgene i mus. Resultaterne viste, at når æggene af C. parvum var klassificeret som døde (<2% levende æg) så kunne disse ikke inficerer (smitte) mus. Undersøgelserne viser således, at fastlæggelse af viabilitet var fuldt tilstrækkeligt til fastlæggelse af æggenes infektivitet. Der udvikles endvidere i øjeblikket cellebaserede assays til infektivitetsbestemmelse. Disse cellebaserede assays er ofte mere præcise end musemodellen, idet man i en musemodel altid vil have en vis variation mellem dyrene. Eksempelvis var der i denne rapports undersøgelser enkelte mus i den positive kontrolgruppe der ikke var modtagelige overfor infektion, selvom de er blevet podet med en tilstrækkelig stor dosis af æg. Sådanne variationer er meget begrænsede i celleassays. I vore undersøgelser blev der brugt C. parvum æg fra kvæg, da det ikke er muligt at opformere og skaffe tilstrækkelig antal C. parvum æg fra mennesker. Det kan diskuteres om overlevelse og infektivitetsundersøgelser af æg fra dyr er gode modeller for æg isoleret fra mennesker. Umiddelbart vil æg med forskellig oprindelse forventes at have en sammenlignelig resistens overfor miljøpåvirkninger, hvorimod der i podningsforsøg muligvis kan være forskelle i infektivitet (Fayer et al., 2000). Disse forhold er således endnu et argument for i fremtiden at benytte cellebaserede assays til bestemmelse af infektivitet, især cellelinier fra menneskevæv. Disse forhold ændrer dog ikke den generelle konklusion, at urin kan anses at være fri for levende og infektive protozoæg efter ca. 2 måneders ved lagringstemperaturer >4ºC. Semipermeable kapsler har tidligere været brugt til undersøgelse af C. parvum ægs overlevelse i jord og dyregødning (Jenkins et al., 1999), men så vidt det vides ikke til undersøgelser af overlevelse af C. parvum æg i urin fra mennesker. Kapslerne tillod en tilstrækkelig høj koncentration af æg og det var relativt nemt at oprense æg fra kapslerne. Kapslerne fungerede således på alle måder tilfredsstillende. 6 Konklusion6.1 Projekt 1 – Bakteriologi
6.2 Projekt 2 – Parasitologi
7 LitteraturlisteAnonymous, (2002). Annual Report on Zoonoses in Denmark. Ministry of Food, Agriculture and Fisheries. Anonymous, (2003). Annual Report on Zoonoses in Denmark 2002. Ministry of Food, Agriculture and Fisheries. Armon , R & Y. Kott. (1995). Distribution comparison between coliphages and phages and anaerobic bacteria (Bacteroides fragilis) in water sources, and their reliability as fecal pollution indicators in drinking water. Water Science and Technology 51 (5-6). Carlander, A., Aronsson, P., Allestam, G., Stenström, T.A., and K. Perttu. (2000). Transport and retension of bacteriophages in two types of willow-cropped lysimeters. Journal of Environmental Science and Health A 35(8): 1477-1492. Dalsgaard, A. og Tarnow, I. (2001) Miljøprojekt nr. 18 2001. Vurdering af muligheder og begrænsninger for recirkulering af næringsstoffer fra by til land. Mikrobiologiske undersøgelser af lagret urin fra separationstoiletter. Miljøstyrelsen, København. DS/EN ISO 6222/1:2001 (Totalkim ved 37ºC). DS/EN ISO 9308-1 (E. coli). Dutka-Malen, S., Evers S. and Courvalin P., (1995). Detection of Glycopeptide Resistance Genotypes and Identification to the species Level of Clinically Relevant Enterococci by PCR. Journal of Clinical Microbiology, Jan. 1995, p. 24-27 Eller, G. (1995). Liquid composting of raw wastewater, mixed with biodegradable waste. Persistance of selected pathogens and indicator organisms. Dissertation submitted for diploma in Biotechnology at the Institute for Sanitary Engineering, Technical University of Brunswick, Germany. Enemark, H. L., (2002). Cryptosporidium – Studies of molecular characteristics and pathogenicity. Ph.D. thesis. Facklam, R.R., Carvalho, M.G. & Teixeira, L.M. (2002). History, taxonomy, biochemical characteristics and antibiotic susceptibility testing of enterococci. p. 1-54. In M.S. Gilmore (ed.), The Enterococci: Pathogenesis, Molecular biology and Antibiotic Resistance. ASM Press, Washington, DC. Fayer, R., Morgan U. & Upton S.J. (2000). Epidemiology of Cryptosporidium: transmission, detection and identification. International Journal for Parasitology 30: 1305-1322. Fayer, R., Trout, J. M. & Jenkins, M. C. (1998). Infectivity of Cryptosporidium parvum oocysts stored in water at environmental temperatures. Journal of Parasitology 84 (6): 1165-1169. Freire-Santos, F., Oteiza-López, A. M., Vergara-Castiblanco, C. A. & Ares-Mazás, E. (2000). Study of the combined influence of environmental factors on viability of Cryptosporidium parvum oocysts in water evaluated by fluorogenic vital dyes and excystation techniques. Veterinary Parasitology 89: 253-259. Höglund, C., Stenström, T. A., Jönsson, H. & Sundin, A. (1998). Evaluation of faecal contamination and microbial die-off in urine separating sewage systems. Water Science and Technology 38 (6): 17-25. Höglund, C. E. & Stenström, T. A. B. (1999). Survival of Cryptosporidium parvum in source separated human urine. Canadian Journal of Microbiology 45; 740-746. Hurst, C. J., Knudsen, G.R., McInerney, M.J., Stetzenbach, L.D., and M.V. Walter. (1997). Manual of Environmental Microbiology. American Society for Microbiology, Washington DC. Jenkins, M. B., Bowman, D. D. & Ghiorse, W. C. (1998). Inactivation of Cryptosporidium parvum oocysts by ammonia. Applied and Environmental Microbiology 64 (2): 784-788. Jenkins, M. B., Walker M.J., Bowman, D. D. Anthonony L.C. & Ghiorse, W. C. (1999). Use of a sentinel system for field measurements of Cryptosporidium parvum oocyst inactivation in soil and animal waste. Applied and Environmental Microbiology 65: 1998-2005. Johansson, P.O., Espeby, B., Nilsson, B., and G. Allestam. (1998). Artificial groundwater recharge in Stockholm – II Column test design and tracer tests. In: Peters, J.H. et al. (Eds.) Artificial Recharge of Groundwater, pp. 383-385. Balkema AA., Rotterdam. Jönsson, H., B. Vinnerås, C. Höglund, T.A. Stenström, G. Dalhammer & H. Kirchmann. (2000). Källsorterad humanurin i kretslopp. VA-FORSK RAPPORT, Stockholm. Jönsson, H., Stenström, T. A., Svensson, J., & Sundin, A. (1997). Source separated urine-nutrient and heavy metal content, water saving and faecal contamination. Water Science and Technology 35 (9): 145-152. Ke, D., Picard F.J., Martineau, F., Ménard C., Roy, P.H., Ouellette, M. and Bergeron, M.G. (1999). Development of a PCR assay for rapid detection of Enterococci. Journal of Clinical Microbiology 1999, p. 3497-3503 Lewis, G. D. (1995). F-specific bacteriophage as an indicator of human viruses in natural waters and sewage effluents in Northern New Zealand. Water Science and Technology 31 (5-6): 231-234. Lilleengen, K. (1948). Typing of Salmonella typhimurium by means of a bacteriophage. Ph.D. thesis. The Bacteriological and Hygienical Department of the Royal Veterinary College, Stockholm, Sweden. Mac Kenzie, W.R., Hoxie N.J., Proctor, M.E., et al. (1994). A massive outbreak in Milwaukee of Cryptosporidium infection transmitted through the public water supply. New England Journal of Medicine 331:161-7. Manero, A. and Blanch, A.R., (1999). Identification of Enterococcus spp. with a biochemical key. Applied and Environmental Microbiology 1999, p. 4425-4430 Murray, P. R., E. J. Baron, M. A. Pfaller, F. C, Tenover & R. H.Yolken. (1995). Manual of clinical microbiology. American Society for Microbiology, Washington DC Nordling, J. (1998). Growth of enterococci at optimal and pshychrotrophic temperature conditions related to growth in an urine source separating sewage system. Master thesis in biology, Department of Biology, Stockholm University, Sweden. Norin, E., Stenström, T.A. och A. Albihn. (1996). Stabilisering och hygienisering av svartvatten och organiskt avfall genom våtkompostering. Vatten 52(3): 165-176. Olson, M. E., Goh, J., Phillips, M., Guselle, N. & McAllister, T. A. (1999). Giardia cyst and Cryptosporidium oocyst survival in water, soil and cattle feces. Journal of Environmental Quality 28: 1991-1996. Olsson, A. (1995). Källsorterad humanurin – förekomst och överlevnad av fekala mikroorganismer samt kemisk sammansätning. SMI Rapport 208, Institutionen för lantbruksteknik, Swedish University of Agricultural Sciences, Department of Agricultural Engineering, Uppsala, 41 sider. Robertson, L. J., Campbell, A. T. & Smith, H. V. (1992). Survival of Cryptosporidium parvum oocysts under various environmental pressures. Applied and Environmental Microbiology 58 (11): 3494-3500. Sahlström, L. (2003).A review of survival of pathogenic bacteria in organic waste used in biogas plants. Bioresource Technology 87 (2): 161-166. Schönning, C., Leeming, R., Stenström, T. A. (2002). Faecal contamination of source-seperated human urin based on the content of faecal sterols. Water Research 36 (8): 1965-1972. Slifko, T.R., Smith, H.V. & Rose, J.B. (2000). Emerging parasite zoonoses associated with water and food. International Journal for Parasitology 30: 1379-1393. Stenström, T.A. (1996). Tracing bacteria from the latrine to groundwater in dug wells. In: Drangert, J.O., Swiderski, R., and M. Woodhouse (Eds.). Proceedings from Conference on Safe Water Environments, Kenya 21-23. Sundin, K. A., Leeming, R. L. & Stenström, T. A. B. (1999). Degradation of faecal sterols in urine for assessment of faecal cross-contamination in source-separated human urine and urine storage tank sediment. Water Research 33 (9): 1975-1980. Thaysen, J. H., I. Lorenzen , L. K. Christensen, (1986). Medicinsk Kompendium. Nyt Nordisk Forlag Arnold Busk, København. Tree, J. A, M. R. Adams & D. N. Lees. (1997). Virus inactivation during disinfection of wastewater by chlorination and UV irradiation and the efficacy of F+ bacteriophage as a `viral indicator'. Water Science and Technology 35 (11-12): 227-232. Turabelidze, D., Kotetishvili, M., Kreger A., Morris, J.G. and Sulakvelidze, A. (2000). Improved Pulsed-Field Gel Electroforesis for Typing Vancomycin-Resistant Enterococci. Journal of Clinical Microbiologi, (2000) 38, p. 4242 - 4245 Bilag A
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kontrol teststammer | PCR Ent1+Ent2 | PCR E1+E2 | PCR F1+F2 | PCR vanC1B+vanC1F | PCR vanC23B+vanC23F |
| E. faecium (301) | + | - | + | - | - |
| E. gallinarum (CECT 970) | + | - | - | + | - |
| E. avium (CECT 968) | + | - | - | - | - |
| E. raffinosus (NCTC 12192) | + | - | - | - | - |
| E. flavescens (CECT 4481) | + | - | - | - | + |
| E. mundtii (ATCC 43186) | + | - | - | - | - |
| E. durans (CCUG 7972) | + | - | - | - | - |
| E. hirae (9790RF) | + | - | - | - | - |
| E. dispar (CECT 4310) | + | - | - | - | - |
| E. faecalis (302) | + | + | - | - | - |
1.6 Biokemisk identifikation af enterokokker
En forudsætning for at benytte identifikationsnøglen beskrevet af Manero et Blanch (1999), er at bakterieisolaternes slægt først bestemmes. Enterokokslægt blev fastlagt med PCR med de slægtsspecifikke primere Ent1 og Ent2.
Kulhydratfermentering blev udført i basal mediet Sukkerfri Bouillon, der pr liter indeholder 10 g kødekstrakt (Merck), 10 g pepton (Difco), 3 g natriumklorid (NaCl; Merck), 2 g di-natriumhydrogenphosphat-dodecahydrat (Na2HPO4, 12H2O; Merck), 12 ml 0,2% bromthymolblåt (Merck). Bouillonen steriliseres ved autoklavering og pH indstilles til 7,4 med 0,1 N natriumhydroxid (NaOH; Merck). L(+) arabinose, L(-) sorbose, D(-) ribose, methyl-α-D-glucopyranoside og mannitol blev tilsat i en koncentration på 1% i sukkerfri bouillon. Dette blev opnået ved at opløse 2 g af hver sukkerart i 10 ml destilleret vand, sterilfiltrere dette og tilsætte det til 190 ml sukkerfri bouillon. Der overførtes 4 ml af hver sukkerartsbouillon til sterile rør, som blev inokuleret med 4-5 kolonier af det rendyrkede bakterieisolat. Den inokulerede bouillon blev inkuberes ved 37ºC i varmeskab og aflæst efter 24 og 48 timer. Et testresultat var positivt, når bouillonen var gul.
Pyrrolidonyl aminopeptidase og α-galactosidase aktivitet blev evalueret med diagnostiske kit fra Rosco Diagnostica (Tåstrup, Danmark). Testen udførtes som beskrevet af producenten og inkubation foregik ved 37ºC i varmeskab med aflæsning efter 4 timer.
Arginin dihydrolase testen udførtes i arginin bouillon bestående af 5 g tryptose (Difco), 5 g gærekstrakt (Oxoid), 2 g kaliumdihydrogenphosphat (KH2PO4; Merck), 0,5 g glukose (Merck) og 3 g arginin (Merck) pr. liter. Bouillonen blev steriliseret ved autoklavering og pH indstilt til 7,0 med 0,1 N natriumhydroxid (NaOH; Merck). Arginin bouillonen blev hældt i rør med 4 ml i hver og inokuleret med 4-5 kolonier af det rendyrkede bakterieisolat. Denne test blev udført ved 37ºC med aflæsning efter 48 timer ved tildrypning af phenolrødtindikator. Reaktionen blev aflæst som positiv, når der fandtes farveomskift til rød.
Produktionen af gul pigment blev evalueret ved inokulering af isolaterne på Brain Heart Infusion Agar (BHIA; Oxoid), som blev inkuberet ved 37ºC i 24-48 timer. Et isolat producerede pigment når kolonimassen havde en klar gul farve.
Testene er udført enkeltvis i henhold til identifikationsnøglen i tabel 2 beskrevet af Manero et Blanch (1999). De 10 kontrolstammer vist i tabel 2 blev medtaget i alle testene.
Tabel 2 Identifikationsnøgle til biokemisk bakterieslægtsbestemmelse af enterokokker
(PYRase = pyrrolidonyl aminopeptidase)
| L(+)
Arabi- nose |
Gul
Pig- ment |
L(-) Sorbose |
D(-)
Ribo- se |
PY Rase | Methyl- ∀-D - glucopy- ranoside |
Arginin- dihydro- lase |
Mannitol | ∀- galac- tosi- dase | |
| E. faecium (301) | + | - | - | + | + | - | + | + | + |
| E. gallinarum
(CECT 970) |
+ | - | - | + | + | + | + | + | + |
| E. avium (CECT 968) | + | - | + | + | + | + | - | + | - |
| E. raffinosus
(NCTC 12192) |
+ | - | + | + | + | + | - | + | + |
| E. flavescens
(CECT 4481) |
+ | + | - | - | + | + | + | + | + |
| E. mundtii
(ATCC 43186) |
+ | + | - | + | + | - | + | + | + |
| E. durans (CCUG 7972) | - | - | - | + | + | - | + | - | - |
| E. hirae (9790RF) | - | - | - | + | + | - | + | - | + |
| E. dispar (CECT 4310) | - | - | - | + | + | + | + | - | + |
| E. faecalis (302) | - | - | - | + | + | - | + | + | - |
1.7 Typning af enterokokker ved Pulsed Field Gel Elektroforese (PFGE)
Typning af de isolerede enterokokker ved PFGE blev udført efter metode beskrevet af Turabelidze et al. (2000).
Enterokokisolaterne blev opformeret i BHIB på ryst i 48 timer ved 37ºC. Bakteriecellerne blev vasket og centrifugeret i TE 100:100 (100 mM Tris base (Merck), 100 mM EDTA (Merck)) og genopslemmet i 0,5 ml TE 100:100. Absorbansen måltes derefter ved 595 nm på spektrofotometer (Labsystems Multiskan RC). Cellesuspentionen blev fortyndet så absorbansen lå mellem 0,9 og 1,0 svarende til en bakteriekoncentration på 2,5-3109 cfu/ml.
Til lysering af bakteriecellevæggen anvendtes 0,2 ml cellesuspention, der blandtes med 0,2 ml lysisbuffer (50mM Tris, 50mM EDTA, mutanolysin (1250 U/ml; Sigma), lysozyme (2,5 mg/ml; Sigma) og proteinase K (1,5 mg/ml; Roche); pH 8) og blev inkuberet ved 37ºC i 10 minutter. Derefter blev der tilsat 0,4 ml 1,2% agarose (SeaKem® Gold Agarose, Cambrex) indeholdende 1% SDS (natrium lauryl sulfat, Merck). Dette blandtes forsigtigt inden overførsel til støbeforme (Bio-Rad, Sverige), hvor der blev fremstilles 4-6 blokke af agarose med DNA fra bakterien. Blokkene blev derefter inkuberet i ESP-buffer (0,5 M EDTA, 1% sarcosyl (Sigma), proteinase K (400 μg/ml)) for nedbrydning af proteiner i 2 timer ved 55ºC. Efter dette blev blokkene vasket ved 50ºC, først i destilleret vand og så i TE 10:1 (10 mM Tris, 1 mM EDTA).
Til elektroforese anvendtes 1/8 af en blok, der blev skåret af med en skalpel og overført til et eppendorfrør med buffer og restriktionsenzymet Sma I (30 Unit; New England Biolabs, MA). Denne opløsning blev inkuberet i 2 timer ved 30ºC. Der blev fremstillet en 0,8% agarose gel (SeaKem® Gold Agarose) med 30 brønde, hvor der i hver brønd er plads til en afskåret blok. Elektroforese karret blev fyldt med 2,5 liter 0,5xTBE-buffer (1xTBE buffer er 89mM Tris, 90mM borsyre, 2,5 mM EDTA). De skårne blokke blev påsat agarose gelen og brøndene lukkedes efterfølgende med 1,2% agarose (SeaKem®® Gold Agarose). Der blev desuden påsat en PFGE størrelsesmarkør (New England Biolabs) på hver gel. Der blev anvendt en CHEF DRIII apparat (Bio-Rad, Sverige) til elektroforese.
Elektroforese forholdene var følgende:
| Initial Switch tid (sek) |
Final Switch tid (sek) |
Kørsel tid (timer) |
Volt/cm | Vinkel (0) | |
| Blok 1 | 3,5 | 25 | 12 | 6 | 120 |
| Blok 2 | 1 | 5 | 8 | 6 | 120 |
efter ialt 20 timers elektroforese kørsel blev gelen farvet i ethidium bromid (2 μg/ml; Sigma, St. Louis, Mo), derfter affarvet i destilleret vand, og endelig blev DNA båndene visualiseret og fotograferet under UV-lys ved Gel Doc 2000 (Bio Rad, Sverige).
1.8 Kimtal ved 37ºC
Kimtal ved 37ºC blev bestemt ved tælling af kolonier på Water Plate Count Agar (WPCA) (Oxoid, Hampshire, England) efter inkubering ved 37ºC i 44 4 timer (DS/EN ISO 6222, 2000). Detektionsgrænsen for undersøgelsen var 10 bakterier pr. ml. Urinprøverne (1 ml) blev udtaget sterilt fra glasflaskerne og fortyndet ved 10-folds fortyndinger.
Der blev ikke foretaget nogen videre typning af isolater fra mulig eftervækst sidst i forsøgsperioden, idet kimtal ved 37ºC må forventes at repræsente en meget heterogen bakterioflora. Ud fra projektets begrænsede tidsmæssige og økonomiske ressourcer blev det derfor besluttet at karakterisere og type enterokokisolater fra Slanetz & Bartley agar, idet enterokokker er en vigtigere fækal indikator end kimtal ved 37ºC.
1.9 Suspekte termotolerante coliforme bakterier
Suspekte termotolerante coliforme bakterier blev bestemt ved tælling af typiske gule kolonier på membran lauryl sulfat agar efter inkubering ved 44ºC i 18-24 timer (Mod ISO/DIS 9308-1, 1998). Detektionsgrænsen for undersøgelsen var 10 bakterier per ml. Urinprøverne (1 ml) blev udtaget sterilt fra kapslerne og fortyndet ved 10-folds fortyndinger.
Bilag B
Oprensning og detektion af oocyster i
musetarmsæt
- Hud og bugvæg åbnes forsigtigt. Mavesækken lokaliseres (hvid da den er fyldt med mælk). Duodenum frigøres forsigtigt fra mavesækken ved hjælp af en pincet, milten fjernes og tarmsættes løsnes fra krøset indtil rectum. Så meget som muligt af rectum medtages idet hele tarmsættet udtages.
- Tarmsættet placeres i ca. 20 ml kold PBS-Tween 20 i en plast eller glasbeholder og findeles med en saks
- Der tilsættes yderligere 30 ml og de i alt 50 ml hældes i en lille stomacherpose hvorefter der mixes godt i ca. 1 minut
- De 50 ml filtreres igennem en lille plastsigte (apertur= ) ned i et 50 ml centrifugerør.
- Prøverne centrifugeres nu 10 minutter ved 1540 G/ rpm (hurtig accelleration, medium break) og der suges derefter ned til 5 ml. Vortex IKKE!!
- Prøverne overføres til 15 ml centrifugerør, idet pellet overføres forsigtigt. 50 ml røret vaskes med MQ-vand indtil 15 ml røret er fuldt.
- Prøverne centrifugeres 10 minutter ved 1540 G/ rpm (hurtig accelleration, medium break) og der suges derefter ned til 1 ml.
- Vortex for at resuspendere pellet. Der udtages 60 μl som fordeles på 3 brønde af et objektglas.
- Prøverne tørrer ved stuetemperatur, evt. natten over.
- Der tilsættes 50 μl methanol per brønd for at fiksere prøverne. Disse luftørrer 15-20 minutter i stinkskab.
- Der tilsættes 40 μl FITC-antistof mod Crypto og der inkuberes i et fugtighedskammer i mørke i 1 time.
- Brøndene vaskes forsigtigt 2 gange med 100 l MQ-vand og der tilsættes derefter en dråbe IFA mounting fluid til hver og et dækglas lægges på.
- Antal oocyster tælles i alle brønde ved 400x forstørrelse.
Specielle materialer:
PBS-Tween 20 : PBS indeholdende 0,02% Tween-20
FITC-antistof
IFA mounting fluid
Bilag C
Antal suspekte termotolerante coliforme bakterier
– Projekt 1
| Lokalitet | Urintanktype | Lagrings- temperatur (ºC) |
T-0
(cfu/ml) |
T-1
(cfu/ml) | ||
| Flaske 1 | Flaske 2 | Flaske 1 | Flaske 2 | |||
| 1 | Lukket | 4 | <1cfu/ml a | 1 | <1cfu/ml | <1cfu/ml |
| 1 | Lukket | 10 | <1cfu/ml | <1cfu/ml | <1cfu/ml | <1cfu/ml |
| 1 | Lukket | 20 | <1cfu/ml | 1 | <1cfu/ml | <1cfu/ml |
| 1 | Åben | 4 | 6 | 4 | <1cfu/ml | <1cfu/ml |
| 1 | Åben | 10 | <1cfu/ml | <1cfu/ml | <1cfu/ml | <1cfu/ml |
| 1 | Åben | 20 | 1 | 1 | <1cfu/ml | <1cfu/ml |
| 2 | Lukket | 4 | <1cfu/ml | <1cfu/ml | <1cfu/ml | <1cfu/ml |
| 2 | Lukket | 10 | <1cfu/ml | <1cfu/ml | <1cfu/ml | <1cfu/ml |
| 2 | Lukket | 20 | <1cfu/ml | <1cfu/ml | <1cfu/ml | <1cfu/ml |
| 2 | Åben | 4 | 6<1cfu/ml | 1<1cfu/ml | <1cfu/ml | <1cfu/ml |
| 2 | Åben | 10 | 9 | 1<1cfu/ml | <1cfu/ml | <1cfu/ml |
| 2 | Åben | 20 | 1<1cfu/ml | 1<1cfu/ml | <1cfu/ml | <1cfu/ml |
| 3b | Lukket | 4 | <1cfu/ml | <1cfu/ml | <1cfu/ml | <1cfu/ml |
| 3 | Lukket | 10 | <1cfu/ml | <1cfu/ml | <1cfu/ml | <1cfu/ml |
| 3 | Lukket | 20 | <1cfu/ml | <1cfu/ml | <1cfu/ml | <1cfu/ml |
| 4ºC | Lukket | 4 | <1cfu/ml | <1cfu/ml | <1cfu/ml | <1cfu/ml |
| 4 | Lukket | 10 | <1cfu/ml | <1cfu/ml | <1cfu/ml | <1cfu/ml |
| 4 | Lukket | 20 | <1cfu/ml | <1cfu/ml | <1cfu/ml | <1cfu/ml |
a 1 cfu/ml = ingen gule kolonier på membran lauryl sulfat agar.
b 3 = HFB
c 4 = HFT
Bilag D
Bakteriologiske målinger – Projekt 2
Antal enterokokker i lagret urin ved forskellige inkubationstemperaturer (cfu/ml)
| Lokalitet | Lagrings- temperatur (ºC) |
T-0 | T-14 dage | T-1 | T-2 |
| 1 | 4 | 400 | - | 200 | 80 |
| 1 | 10 | 400 | - | 200 | 20 |
| 1 | 20 | 500 | 40 | 3 | 1 |
| 2 | 4 | 200 | - | 400 | 100 |
| 2 | 10 | 400 | - | 200 | 100 |
| 2 | 20 | 200 | 90 | 100 | 1 |
| Kontrol kapsel, PBS | 4 | 0a | - | 1 | 4 |
| Kontrol kapsel, PBS | 10 | 0 | - | 0 | 1 |
| Kontrol kapsel, PBS | 20 | 0 | 0 | 0 | 0 |
a 0 = ingen rød-brune kolonier; koncentration er < 1 cfu/ml
Kimtal ved 37ºC i urin lagret ved forskellige temperaturer (cfu/ml)
| Lokalitet | Lagrings-temperatur
(ºC) |
T-0 | T-14 dage | T-1 | T-2 |
| 1 | 4 | 5000 | - | 3000 | 700 |
| 1 | 10 | 8000 | - | 2000 | 600 |
| 1 | 20 | 4000 | 500 | 100 | 100 |
| 2 | 4 | 30000 | - | 40000 | 9000 |
| 2 | 10 | 40000 | - | 40000 | 8000 |
| 2 | 20 | 40000 | 20000 | 3000 | 1000 |
| Kontrol kapsel, PBS | 4 | 0 a | - | 70000 | 70000 |
| Kontrol kapsel, PBS | 10 | 0 | - | 120000 | 190000 |
| Kontrol kapsel, PBS | 20 | 0 | 13320 | 160000 | 620000 |
a 0 = ingen vækst, dvs. koncentration er < 1 cfu/ml
Antal suspekte termotolerante coliforme bakterier i urin lagret ved forskellige temperaturer (cfu/ml)
| Lokalitet | Lagrings-temperatur
(ºC) |
T-0 | T-14 dage | T-1 |
| 1 | 4 | 10 | - | 0 a |
| 1 | 10 | 3 | - | 0 |
| 1 | 20 | 1 | 0 | 0 |
| 2 | 4 | 0 | - | 10 |
| 2 | 10 | 0 | - | 0 |
| 2 | 20 | 0 | 4 | 0 |
| Kontrol kapsel, PBS | 4 | 0 | - | 0 |
| Kontrol kapsel, PBS | 10 | 0 | - | 0 |
| Kontrol kapsel, PBS | 20 | 0 | 0 | 0 |
a 0 = ingen gule kolonier; koncentration er < 1 cfu/ml
Version 1.0 Januar 2004 • © Miljøstyrelsen.