Substitution af biocider i bundmaling til skibe med enzymer
10 Vandoptag og Enzymanalyse
Enzymaktivitet kan kun opnås, hvis der er vand til stede. Det forventes endvidere, at enzymer bliver udvasket fra malingssystemet, og at jo mere vand malingssystemet optager, desto hurtigere bliver udvaskningen. Det antages at der findes en optimal vandoptagelse i malingssystemet, hvor enzymet er aktivt, men ikke bliver udvasket alt for hurtigt.
Bestemmelse af vandoptagelse i malingsfilmen er derfor gennemført for et antal malingssystemer med forskellige bindersystemer. Disse målinger er blandt andet anvendt til at udvælge malinger til videre undersøgelse.
Aktiviteten hos enzymet i den tørre malingsfilm ved kontakt med vand er af interesse, da aktiviteten er en forudsætning for, at enzymerne skal virke begroningshæmmende. Derfor er der indarbejdet en metode til bestemmelse af enzymaktivitet. Et enzym består hovedsageligt af protein. Som komplement til enzymaktivitetsmåling kan proteinmængden i en udvaskningsvæske derfor bestemmes. Begge metoder er spektrofotometriske, hvor man måler absorbans på en væskefase ved henholdsvis 425 nm og 595 nm bølgelængde.
10.1 Vandoptagelse
Malingssystemerne er påført glas- eller akrylplader med en lakpåfører med en spalteåbning på 240 µm. Malingens tørretid er ca. 1 døgn, dog op til en uge for nogle enkelte vandbaserede malingstyper. Pladerne vejes før og efter påføring for at kunne registrere mængden af maling (i gram) der er påført en given plade. Bagefter placeres de malede plader i en marin saltopløsning eller i almindeligt vand, og vandoptagelsen registreres hvert døgn til indtil ligevægt eller at en klar tendens kan ses. Saltopløsningen er kunstigt fremstillet havvand, med en saltprocent der efterligner naturligt havvand. Saliniteten ligger i intervallet 31-35 ppt, og pH i intervallet 7,8-8,2. De registrerede resultater visualiseres i form af diagrammer, hvor x - aksen er eksponeringstid i døgn, og y - aksen er vandoptagelse i % malingsvægt.
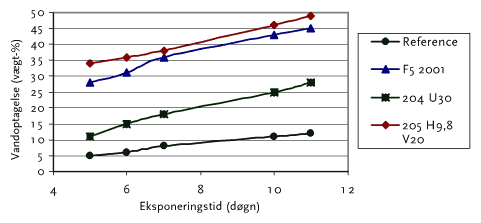
Der er udført en screening med forskellige bindersystemer. Det kan ses i figur 11.1, at der er store forskelle mellem de forskellige testprodukter, samt at referencen har et lavt vandoptag på 10-12 vægt-%. Undersøgelserne er udført uden tilsætning af enzym.
De bindersystemer, der optager de største vandmængder må formodes at give en forholdsvis større udvaskning af enzym fra malingssystemet. Det bør også bemærkes at hvis vandoptagelsen på et tidspunkt når et plateau, hvor der er ligevægt vil malingen indeholde en konstant mængde vand.
Figur 11.1 Vandoptagelse i forskellige bindersystemer
Med denne baggrund er der udført yderligere en test, hvor det opløsningsmiddelbaserede produkt F5 er varieret med hensyn til forholdet mellem harpiks og akryl. Denne test viser, at kombinationen af bindemidler har stor indflydelse på vandoptagelsen, hvorfor der er behov for en optimering af bindersystemet. Se figur 11.2.
Figur 11.2 Vandoptagelse i forskellige F5 typer
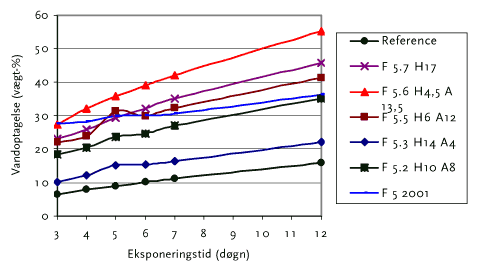
Det interessante ved denne undersøgelse er at F7 H17 med ren harpiks optager meget vand, men det gør F5.5 H6 A12 og F5.6 H4,5 A13,5 også, der indeholder en blanding af harpiks og akryl, hvor der er meget akryl tilstede. Det produkt der klarer sig bedst er faktisk F5.3 H14 A4 som indeholder mest harpiks og en lille mængde akryl. Dette viser at vandoptagelsen er afhængig af at forholdet mellem de to bindemidler. Hvilket indebærer at man faktisk for hver ny kombination burde kontrollere tendensen til optagelse af vand.
10.2 Principper for måling af enzymaktivitet
Enzymet Alcalase nedbryder casein under meget specifikke reaktionsforhold.(temperatur 50°C, pH 9, casein som substrat). Enzymaktiviteten er målt efter reduktionen i casein koncentration som skyldes enzymets nedbrydning af det samme.
Udover det optimale pH og den optimale temperatur bør substratkoncentrationen være meget højere end enzymkoncentrationen for at opnå en maksimal reaktionshastighed. Tilstedeværelse af en relativt høj mængde af casein gør at alle aktive steder på enzymet deltager i reaktionen, og enzymet bliver ”mættet” af substratet. Reaktionshastigheden er nu kun en funktion af enzymkoncentrationen, og er uafhængig af substrat koncentrationen.
Ved udarbejdelse af en reference kurve arbejder man med koncentrationer, som giver en lineær, eller næsten lineær sammenhæng.
For at kunne iagttage ændringer forårsaget af enzymaktivitet anvender man et gult farvestof, som giver en pink farve i kontakt med casein (pH 9), og som ændrer farve fra pink til gul i løbet af enzymreaktionen pga. caseinets hydrolyse (nedbrydning). Jo mørkere væsken er, desto mere enzym er der i opløsningen. Ved analyse af enzymaktivitet anvender man lys til at måle farveændringer som resultater af enzymaktivitet. For at måle enzymets aktivitet måles der ændringer i absorbansværdi (farveændring) med et spektrofotometer ved bølgelængde 425 nm over for en blank prøve uden enzym. En højere absorbansværdi er resultatet af en højere proteolytisk aktivitet.
Det er vigtigt at holde alle de operationelle parametre, som pH, identitet og molaritet af buffersystem, reaktions tid samt temperatur konstant under hvert forsøg. Koncentration af enzymet i anvendte enzymopløsninger, samt substrat mængde bør være nøjagtigt de samme hver gang. På denne måde standardiseres målingernes forhold, sådan at enzymet i samme mængde skal vise reproducerbare resultater fra et forsøg til et andet.
(P.R. Mathewson: Analysis of enzymes activity, I Enzymes, Eagan Press Handbook Series, USA, 1998)
10.3 Bestemmelse af reference kurve
Der fremstilles 5 standardenzymopløsninger ud fra en stamopløsning lavet af et bestemt enzym med kendt aktivitet. Koncentrationerne beregnes og registreres. Der udtages 1,0 ml af hver enzymopløsning til reagensglas, som hver indeholder 1,5 ml buffer, undtagen de blanke prøver, hvor der er 2,5 ml buffer (pH 9). Der laves dobbelt bestemmelse for hver enzymkoncentration, og 4 blanke prøver. Reagensglassene sættes i vandbad ved 50°C. Efter 2 minutter tilsættes der 1 ml casein til den første blanke prøve, der rystes, og tilsættes 250 µl gult farvestof, prøven rystes igen og sættes tilbage på plads i vandbadet. Proceduren gentages 2 minutter efter for den næste prøve, o.s.v. Efter 27 minutter ved 50°C afbrydes reaktionen i den første prøve med 2,5 ml isvand. Derefter afbrydes reaktionen i de øvrige prøver med 2 minutter mellemrum. På denne måde er reaktionstiden for hver prøve ens, og lig med 25 minutter. Farven i reagensglassene ændres i løbet af reaktionen fra pink til gul. Absorbansen skal måles indenfor 1 time efter reaktionens afbrydelse. Absorbansen i prøver med enzymopløsninger måles over for en blank prøve. To blanke prøver bør vise absorbansværdi 0 +/-0,001 over for hinanden.
10.4 Måling af enzymaktivitet
Malingen påføres en engangspipetter ved at dyppe den tykke ende af pipetten i malingen. Hver malingstype påføres på et antal pipetter for at undersøge reproducerbarheden. Malingen tørrer i ca. 1 døgn. Pipetterne vejes før og efter påføring, sådan at malingens vægt i gram er registreret, og enzymmængden i mg kan beregnes ud fra det procentvis indhold af enzym (Alcalase) i malingen. De tørre pipetter bliver herefter dyppet i reagensglas, som indeholder en given mængde (4 ml) buffer med pH 9. Efter 3 døgns udvaskning udtages der 2,5 ml ”udvaskningsbuffer” fra hvert reagensglas og enzymaktiviteten måles spektrofotometrisk .
Absorbansen registreres og omregnes til absorbans per mg enzym for hver prøve for at kunne sammenligne resultaterne.
I tabel 11.1 er resultatet for fire malingsprøver vist. Det kan ses, at det påførte malingslag varierer i vægt. Forskellen i vægt mellem de forskellige prøver skyldes formentlig forskellig viskositet. Endvidere giver manuel påføring altid en vis variation, der blandt andet skyldes at påføringshastigheden næppe er helt ens fra gang til gang. Det betyder, at mængden enzym i prøven varierer. Endvidere varierer antallet prøver mellem 4-6, hvilket skyldes, at nogle malingsprøver er bleven sorteret pipetter fra på grund af uensartet malingsfilm.
Absorbansen målt på udvaskningsbufferen er af samme størrelsesorden, men med varierende standardafvigelse. Til gengæld er variationen ved beregning af absorbans per mg enzym i alle tilfælde acceptabel, da standard afvigelsen varierer fra 0,1-0,4. Det kan også ses i tabel 11.1 at de forskellige forsøgsprodukter giver en indikation på at bindervalget har betydning for udvaskningen og at det opløsningsmiddelbaserede produkt relativt set afgiver mindst enzym.
| Tabel 11.1 Måling af enzymaktivitet i maling som funktion af absorbans | |||||||||
| Prøve | Antal prøver |
Maling (g) | Enzym (mg) | Absorbans ved 425 nm |
Absorbans/mg enzym | ||||
| Gennem-snit | Std.afv. | Gennem-snit | Std afv. | Gennem-snit | Std.afv. | Gennem-snit | Std.afv. | ||
| 118 H1,5 A14 | 6 | 0,265 | 0,009 | 5,296 | 0,178 | 1,376 | 0,084 | 0,260 | 0,014 |
| 119 A15,5 | 5 | 0,228 | 0,031 | 4,562 | 0,620 | 1,292 | 0,076 | 0,287 | 0,039 |
| 120 H4 A11,5 | 6 | 0,253 | 0,019 | 5,060 | 0,385 | 1,328 | 0,038 | 0,264 | 0,021 |
| F5.2 H10 A8 | 4 | 0,367 | 0,030 | 7,337 | 0,608 | 1,281 | 0,015 | 0,175 | 0,015 |
10.5 Bestemmelse af enzym ved måling af protein
Måling af enzymaktivitet er en metode, der registrerer tilstedeværelsen af Alcalase. Metoden tager derfor ikke hensyn til alle de enzymer, der er tilsat malingssystemet. Derfor blev det besluttet, at proteinmængden skal måles som et komplement til enzymaktivitet i forbindelse med udvaskningsforsøg. Metoden er kort beskrevet i de næste afsnit.
10.6 Bestemmelse af protein - Reference kurve
Der fremstilles 3-5 opløsninger med forskellige koncentrationer af et kendt standardprotein (gammaglobulin). Et blåt opløseligt farvestof anvendes som reagens. Der tilsættes 2,5 ml af en farveopløsning til hver proteinprøve. Prøvernes indhold rystes, og inkuberes ved stuetemperatur i mindst 5 minutter. Proteinmålingerne udføres spektrofotometrisk hvor absorbansen måles ved 595 nm indenfor 1 time fra fremstilling af prøven. Blanke prøver (0-prøver) der måles som referencer indeholder ikke protein, kun buffer.
10.7 Måling af protein
Fremgangsmåden ved proteinmåling i ukendte prøver er den samme som for referenceopløsninger. Der anvendes 500 ìl bufferudvask fra alle prøver med ukendt proteinindhold til forsøg.
Proteinkoncentrationens ændring er relateret til absorbans ændringen, som måles ved 595 nm bølgelængde. Protein giver en mere eller mindre intensiv blå farve. Jo mere protein, desto mere intensiv farve, og jo højere absorbansværdi. De ukendte proteinkoncentrationer findes/aflæses ud fra en reference kurve, som er opbygget på baggrund af de kendte proteinkoncentrationer og tilsvarende absorbansværdier.
10.8 Konklusion
Generelt kan det konstateres, at vandoptagelsen kan styres, blandt andet, ved at optimere bindemiddelsystemet. Samtidig kan det konstateres at en opløsningsmiddelbaseret maling normalt vil være tættere end en vandfortyndbar maling alene på grund af måden den danner malingsfilm på. Der er selvfølgelig også en række andre parametre der har indflydelse på vandoptagelsen, for eksempel valg af pigment og fyldstof, pigmentvolumenkoncentration og samlet tørstof.
Det kan også konstateres at det er muligt at bestemme enzymaktivitet som funktion af absorbans ved 425 nm med en rimelig nøjagtighed. Det er dog vanskelig udfra dette begrænsede antal forsøgt at konkludere hvordan forskellige prøvningsparametre har indflydelse på resultatet, men det må konstateres, at prøvningen bør laves minimum som trippel bestemmelse med så ensartede prøvebetingelser som muligt.
Som alternativ til bestemmelse af enzymaktivitet (her Alcalase) kan protein bestemmes som funktion af absorbans ved 595 nm. Denne måling vil være et udtryk for den samlede mængde enzym/protein der bliver udvasket fra malingen.
Version 1.0 April 2004, © Miljøstyrelsen.