Bekæmpelsesmiddelforskning fra Miljøstyrelsen nr. 106, 2006
Bekæmpelsesmiddelforskning fra Miljøstyrelsen, 106 – Mikrobiologiske plantebeskyttelsesmidlers skæbne i mave-tarm kanalen
- Studier af Bacillus thuringiensis
Indholdsfortegnelse
- 2.1 Anvendte Bacillus cereus og Bacillus thuringiensis stammer
- 2.2 Mærkning af bakterier med fluorescens
- 2.3 Dyreforsøg
- 2.4 Undersøgelser af effekter på omkringliggende flora
- 2.5 Enterotoksin assays
- 2.5.1 Immunologisk detektion af HBL
- 2.5.2 Vero-celle assay
- 2.5.3 Bestemmelse af detektionsgrænsen i Vero-celle assay
- 2.5.4 Effekt af vækstbetingelser på Vero-toksiske substanser
- 2.5.5 Betydningen af sterilfiltrering for indholdet af Vero-toksiske substanser
- 2.5.6 Ekstraktion af potentielle Vero-toksiske substanser fra tarmprøver
- 2.5.7 Indflydelse af fæces på genfindelse af Vero-toksiske substanser
- 3.1 Overlevelse og spiring af Bt og B. cereus celler i tarmen
- 3.2 Ændringer af den normale tarmflora
- 3.3 Enterotoksiner i tarmen
- 3.4 Overførsel af DNA mellem to Bt stammer i kimfri rotter
- 4.1 Overlevelse og spiring i tarmen
- 4.2 Påvirkning af den eksisterende bakteriepopulation
- 4.3 Dannelse af enterotoksiner i tarmen
- 4.4 Overførsel af DNA i tarmen
- 5.1 Anbefalinger til Miljøstyrelsen vedr. risikovurdering af Bt midler
- 5.2 Anbefalinger til fremtidig forskningsindsats
- 1.1 Kort over anvendt plasmid
- 1.2 Fremstilling af dosis-kulturer
- 1.3 DNA oprensning fra fæcesprøver
- 1.4 Anvendte primere og DGGE betingelser
- 1.5 DGGE kørsel
- 1.6 Sekventering af bånd fra DGGE geler
- 1.7 DGGE data fra B. cereus forsøget
- 1.8 DGGE data fra Bt subsp. kurstaki forsøget
- 1.9 DGGE data fra Bt subsp. israelensis forsøget
- 1.10 Formidling relateret til projektet
- 1.11 Trykt publikation
Forord
Denne rapport beskriver resultaterne opnået under projektet ’Mikrobiologiske Plantebeskyttelsesmidlers skæbne i mave-tarm kanalen’, som er gennemført i perioden december 2003 til februar 2006. Projektet blev finansieret af Miljøstyrelsens program for bekæmpelsesmiddelforskning og havde til formål at undersøge bakterien Bacillus thuringiensis skæbne og effekt i en rottetarm som model for situationen i en menneskelig mave-tarm kanal.
Resultaterne er fremkommet ved et samarbejde mellem Danmarks Miljøundersøgelser (Bjarne Munk Hansen, Niels Bohse Hendriksen), Arbejdsmiljøinstituttet (Lasse Smidt, Lars Andrup) og Danmarks Fødevareforskning (Andrea Wilcks, Hanne Rosenquist, Tine Rask Licht).
Til projektet har der desuden været tilknyttet en følgegruppe, som takkes for gode råd og interesse gennem projektforløbet. Følgegruppen var sammensat af følgende personer: Jørn Kirkegaard, Anita Fjelsted, Marianne Serritzlev (alle tre Miljøstyrelsen), Jørgen Ejlenberg (Den Kgl. Veterinær- og Landbohøjskole), Thomas Schneider (Arbejdsmiljøinstituttet), Jesper Lund-Larsen (Fagligt Fælles Forbund 3F), Kirsten Friis (Dansk Landbrugsrådgivning), Henrik Sivertsen (Dansk Erhvervsgartnerforening), Jesper Bælum (Odense Universitetshospital), Pia Sjelborg og Annie Enkegaard (begge Danmarks Jordbrugsforskning).
Udkast af rapporten har været gennemlæst af følgende referees: Anita Fjelsted, Gert Bolander, Jesper Bælum, Jesper Lund-Larsen og Jørgen Ejlenberg, som takkes for gode konstruktive kommentarer.
Sammenfatning
Plantebeskyttelsesmidler baseret på bakterien Bacillus thuringiensis (Bt) bruges i Danmark ved produktion af bl.a. tomater, agurker og potteplanter. Bakteriens toksiske effekt overfor insekter skyldes dannelsen af såkaldte d-endotoksiner, som er giftige for visse insekter, men ufarlige for mennesker. Imidlertid producerer bakterien også enterotoksiner, som man kender fra madforgiftningsbakterien Bacillus cereus, og som kan give mennesker diarré.
Produkter baseret på Bt har været anvendt i flere årtier verden over uden at give erkendte problemer. Men da der er et øget krav til at reducere brugen af kemiske midler og da der er en stigende tendens til at spise rå eller let tilberedte grøntsager kan man forestille sig at der vil ske en større eksponering af forbrugerne for Bt, og dermed en øget risiko for eventuelle utilsigtede effekter af Bt.
Plantebeskyttelsesmidler baseret på Bt indeholder bakterien i form af sporer, som er en inaktiv (hvilende) og modstandsdygtig form af bakterien. Sporerne spirer til aktive celler i tarmen på de insekter de skal bekæmpe. Der har været en del diskussion om hvorvidt sporerne også er i stand til at spire i tarmen på pattedyr og mennesker efter indtagelse. Spore spiring og efterfølgende produktion af enterotoksiner vil kunne medføre en risiko for diarré hos forbrugere, der spiser grøntsager behandlet med Bt produkter. Hovedformålet med projektet var at afklare dette spørgsmål i en dyremodel. Dette formål blev undersøgt ved at teste følgende: 1) øger varmebehandling af Bt sporer deres evne til at spire i tarmen, 2) har Bt en effekt på sammensætningen af den omkringliggende tarmflora, 3) kan Bt danne enterotoksiner i tarmen, og 4) kan Bt overføre DNA til andre bakterier i tarmen?
Til at undersøge dette blev der brugt rotter med en tarmflora der ligner menneskers. Der blev lavet forsøg med en B. cereus stamme og to Bt stammer, der ligner de to Bt underarter, subsp. kurstaki og subsp. israelensis, der er tilladt på det danske marked. Endvidere blev der lavet forsøg med rotter uden tarmflora (kimfri rotter), der blev fodret med sporer af en Bt stamme, som fluorescerer grønt når cellerne er i vegetativ vækstfase. Forsøgene viste klart at Bt er i stand til at spire og gro i tarmen på kimfri rotter uden tilstedeværelse af en konkurrerende tarmflora. Også i rotter koloniseret med en menneske-tarmflora blev der observeret spiring og vækst i nogle af dyrene. Varmebehandling af sporer før fodring til rotterne øgede i dette forsøg ikke spiring. Dette indikerer at varmebehandling (f.eks. ved tilberedning) af grøntsager sprøjtet med Bt produkter ikke øger risikoen for at sporerne spirer i tarmen på forbrugerne.
Selvom der blev observeret spiring i rotterne med en menneske-tarmflora var bakterien forsvundet fra de fleste dyr to uger efter sidste fodring med bakterien. Der var dog ét dyr ud af seks doseret med Bt subsp. kurstaki, hvor stammen koloniserede tarmen, og i dette dyr sås også passage over mave-tarm barrieren til milten. Yderligere forskning er nødvendig for at klarlægge hvor stor risikoen er for at Bt invaderer via tarmen, og om dette kan ske hos mennesker.
En eventuel påvirkning af den omkringliggende tarmflora pga. fodring med Bt blev undersøgt både ved traditionel mikrobiologisk tælling på selektive plader og ved en molekylærbiologisk metode (denaturerende gradient gel elektroforese). Denne metode er baseret på analyse af et bestemt område af bakteriers kromosom, som vides at variere fra art til art. Disse variationer kan anvendes til at afgøre hvilke bakteriearter der er til stede. Dermed kan man lave en slags ”fingeraftryk” af bakteriepopulationen, som efterfølgende kan sammenlignes vha. computer analyse. Resultaterne viste, at fodring af rotterne med Bt sporer ikke medførte markante ændringer af tarmfloraen, og at de få ændringer der blev fundet ikke var permanente.
Ved brug af kimfri rotter fodret med sporer af to forskellige Bt stammer, blev der observeret udveksling af DNA mellem Bt stammerne i tarmen. Den ene stamme (donoren) indeholdt et såkaldt konjugativt plasmid, som blev overført til den anden Bt stamme (recipienten). Dette understøtter de førnævnte resultater vedr. spiring af sporer i mave-tarm kanalen. En sådan overførsel af et plasmid kan nemlig ikke ske mellem sporer, men kun mellem vegetative celler.
Udveksling af genetisk materiale mellem arter af B. cereus familien er velkendt i laboratoriet og er også observeret i tarmen på insekter, men det er første gang at en sådan udveksling er observeret i en mave-tarm kanal på et pattedyr. Ved sekventering af et Bt plasmid har man fundet stor lighed med andre plasmider fra B. cereus gruppen, samt plasmider fra andre Gram-positive bakterier, bl.a. bakterier naturligt forekommende i den menneskelige tarm. Denne lighed tyder på at der er sket udveksling af DNA i naturen, og et af miljøerne kunne være tarmen.
Desuden er en stammes evne til at overføre genetisk information til andre bakterier en vigtig faktor ved risikovurderingen af Bt midler. Hvis bakterien f.eks. er resistent overfor antibiotika, er det vigtigt at vide, hvorvidt denne resistens kan spredes til andre bakterier.
Toksinindholdet i prøverne blev målt ved at se på prøvernes evne til at dræbe dyrkede nyreceller fra en abe (Vero-celler). Ved at se på prøver af den væske, som de enkelte bakterier havde vokset i, var det klart at de Bt stammer, som bruges på spiselige afgrøder, producerede mindre toksin end de Bt stammer, der anvendes på potteplanter. Desuden lavede disse stammer en mindre mængde toksiner end en B. cereus stamme, der har været årsag til fødevareforgiftning.
Da de ydre omgivelser kan have stor indflydelse på, hvor meget toksin der produceres, blev toksinindholdet i tarmprøverne også undersøgt. Der kunne kun måles toksiner i et ud af seks kimfri dyr fodret med Bt subsp. israelensis (i lille mængde), mens der i prøver fra rotter med en menneskelig tarmflora fodret med Bt ikke kunne detekteres toksiner overhovedet. I undersøgelsen blev Bt sammenlignet med B. cereus, og heller ikke i dyr fodret med denne bakterie kunne der detekteres Vero-toksiske substanser eller observeres diarré hos rotterne. Forsøg med rotter er i øjeblikket det primære redskab til at teste sikkerheden ved nye biologiske bekæmpelsesmidler både i Danmark og i EU, men vores og andres resultater viser at dyreforsøg ikke altid er den bedste metode til at afsløre sygdomsfremkaldende egenskaber hos bakterier. Man kan ved at basere risikovurderingen på andre metoder dels opnå en bedre forbrugersikkerhed, dels spare nogle dyreliv.
Ved risikovurdering af Bt baserede insekticider fremover anbefales det at man lægger større vægt på undersøgelser af toksicitet i in vitro assays (f.eks. PCR analyser for virulensgener, celle-assays), og mindre vægt på rotteforsøg. Denne undersøgelse viser dog at dyreforsøg er anvendelige til at undersøge bl.a. bakteriens evne til at kolonisere tarmen, påvirkning af den omkringliggende tarmflora og udveksling af DNA med andre bakterier.
Da stammer af samme art kan være helt forskellige, anbefales det at der anvendes en case-by-case vurdering af hver enkelt stamme, og understreges at det er vigtigt at tage hensyn til brugen af det endelige produkt – f.eks. sprøjtning af enten grøntsager eller prydplanter. Denne undersøgelse viste f.eks. at Bt subsp. israelensis har høj cytotoksisk effekt, men da stammen i Danmark kun anvendes i forbindelse med produktion af potteplanter, er det næppe et problem for den almindelige forbruger, men kan være et arbejdsmiljø-problem.
Generelt giver denne undersøgelse ikke grund til øget bekymring omkring de midler, der er på markedet i dag. Selvom Bt subsp. kurstaki (som anvendes på grøntsager) kan spire i tarmen, danner stammen ikke høje koncentrationer af celle-dræbende toksiner. Dog kræver den observerede passage til milten flere studier af netop denne stamme for at klarlægge om en sådan passage også kan ske i mennesker.
Udover at almindelige forbrugere, kan gartneriarbejdere der sprøjter med Bt, også blive ’eksponeret for Bt. Selvom mange af resultaterne selvfølgelig også gælder for de ansatte har vi ikke specifikt kigget på evt. arbejdsmiljøproblemer. Denne problematik har været undersøgt i et tidligere projekt støttet af bl.a. Arbejdstilsynet [Jensen et al., 2001].
Summary
The bacterium Bacillus thuringiensis (Bt) is contained in plant protection products used in Denmark for e.g. the production of tomatoes, cucumbers and pot plants. Bt is toxic to insects due to the production of so-called d-endotoxins that are harmless for humans. However, the bacterium also produces enterotoxins known from the food poisoning bacterium Bacillus cereus, a causative agent of diarrhoea.
Products based on Bt have been used worldwide for decades without resulting in identified problems. However, there is an increasing demand for substituting chemical insecticides with more environmental friendly ones, and at the same time there is an increasing tendency that vegetables are consumed raw or only briefly heat-treated. It is therefore likely that consumers will experience an increased exposure to Bt in the future.
Plant protection products based on Bt contain the spore-form of these bacteria, which is an inactive and very resistant form of the bacterium. The spores germinate to active cells in the gut of the insects, but it is unknown whether the spores also germinate in the human gastrointestinal tract. Germination of spores within the gastrointestinal tract could cause a risk of diarrhoea in consumers eating vegetables treated with Bt products. The main objective of this project was to clarify this question in an animal model. This objective was met by answering the following questions: 1) does heat treatment of Bt spores prior to ingestion increase their ability to germinate in the intestine, 2) can Bt cells effect the composition of the indigenous intestinal microbial population, 3) can Bt cells in the intestine produce enterotoxins, and 4) can Bt cells transfer genetic information to other bacteria in the intestine.
To answer these questions, rats with an intestinal microbiota derived from a human source were used. Animal experiments were performed with one B. cereus strain and two Bt strains, subsp. kurstaki and subsp. israelensis, both used on the Danish market. Additionally experiments were made with rats without an intestinal microflora (germ free rats) that were fed with spores of a Bt strain, which in vegetative phase was green fluorescent. The study showed clearly that spores germinate and grow in the intestine of germ free rats without the presence of an indigenous microbiota. Also in rats with a human microflora germination and growth was observed in some animals. Heat treatment of spores prior to feeding to the rats did not increase their tendency for germination. This may indicate that heat treatment (e.g. by cooking) of vegetables sprayed with Bt does not increase the risk for germination of the bacteria in the gut of the consumer.
Even though germination was observed in the rats with a human microflora, two weeks after last dosing with Bt most of the rats did not harbour any Bt cells in their intestines. However, there was one animal fed with Bt subsp. Kurstaki in which the strain colonised the gastrointestinal tract, and in this animal penetration of the gastrointestinal barrier was observed, and the strain was recovered from the spleen. Further research is needed to clarify the risk for humans of Bt to reach other organs.
A possible effect on the indigenous bacterial population in the gut by Bt was studied using both traditional selective cultivation and a molecular biology method (Denaturing Gradient Gel Electrophoresis, DGGE). DGGE is based on variations in a certain region of the chromosome of bacteria. Those variations can be used to determine which bacteria are present in a population. Specific “fingerprints” can be obtained from each population and compared by computer analysis. The study showed that feeding of rats with Bt spores did not result in major changes in the composition of the microflora, and that the minor effects observed were merely transient.
Transfer of DNA between two isogenic Bt strains was observed using germ free rats fed with spores of the two strains. The donor strain harboured a so-called conjugative plasmid that was transferred to the recipient. This transfer supports the abovementioned results regarding germination of spores in the gastro-intestinal tract, since transfer can occur only between vegetative cells, and not between spores.
Exchange of DNA between members of the B. cereus family is a common phenomenon observed under laboratory conditions and also in the gut of insects. However, this is the first time that such transfer has been studied and observed in a mammalian gastrointestinal tract. The sequence of a Bt plasmid has shown high similarity to other plasmids from the B. cereus group and to plasmids from other Gram-positive bacteria, e.g. bacteria naturally present in a human gastrointestinal tract. This similarity indicates that exchange of DNA has happened in nature, and that one of the environments may be the gut.
Furthermore, the ability of a strain to transfer genetic information is relevant in risk assessment of products based on Bt. When dealing e.g. with a bacterium resistant to an antibiotic, it is important to know whether the resistance is intrinsic and non-transferable or acquired and transferable.
The production of cytotoxic agents (including enterotoxins) was measured by the ability of the samples to kill monkey kidney-cells (Vero cells). By testing the supernatant that the bacteria had grown in, it was clear that Bt subsp. kurstaki used on eatable crops produced less toxin that Bt subsp. israelensis used on pot plants. Furthermore subsp. kurstaki produced less toxin than a B. cereus strain that has been involved in a food poisoning case.
Intestinal samples from the animals fed with either B. cereus or one of the two Bt strains were also tested for the presence of enterotoxins. Enterotoxins were only detected in one animal out of six germ free rats fed spores of Bt subsp. israelensis, and only in small amounts. In the samples from the rats with a human derived microflora no cytotoxic effect could be detected. Not even in the animals fed the B. cereus strain previously involved in an outbreak of food poisoning. Experiments with rats are currently the number one tool when testing the human safety of new biological plant protection agents in Denmark as well as in the EU. However our results (and those of others) show that rat exposure is not the best method to reveal human relevant pathogenic traits in bacteria, and there is currently a debate in the EU for new risk assessment procedures of bacteria. By basing the risk assessment on other methods it is possible to get a better safety for the consumer as well as to spare a number of rats.
In risk assessment of plant protection products based on Bt in the future it is recommended to place more impact on the toxicity of the strains in in vitro assays (e.g. PCR analysis against toxin-genes, cell-assays), and less impact on animal experiments. Nevertheless this study shows that animal experiments are useful when studying e.g. the ability of a strain to colonise the gastrointestinal tract, the effect of a strain on the indigenous microflora, and the capacity of a strain to transfer DNA to other bacteria in the gut.
By risk assessment of Bt based products it is recommended to use a case-by-case approach, since strains of the same species can be very different, and with emphasis on the application of the products into consideration – e.g. whether they are used for vegetables or pot plants. This study showed e.g. that Bt subsp. israelensis had high cytotoxic effects in the Vero-celle assay, however since products based on this strain are only used in Denmark on pot plants, this is not a concern for the consumer – but could however be an occupational health problem.
On the whole, this study does not give rise to increased concern about the products currently on the Danish market. Even though Bt subsp. kurstaki (used on vegetables) can germinate in the gastro-intestinal tract, the strain does not have high cytotoxic effects. However the observed passage to the spleen of this strain warrants further studies of this subspecies.
Besides the consumer, also greenhouse workers spraying with Bt, could be exposed to Bt. Many of the results in this project also applies for those worker, although this project has not specific dealt with occupational health problems. This issue was investigated in an earlier study financed by Arbejdstilsynet [Jensen et al., 2001]
1 Indledning
1.1 Baggrund
Bakterien Bacillus thuringiensis (i det følgende kaldet Bt) er den aktive bakterie i mange produkter til biologisk bekæmpelse af insekter. Bakterien anvendes bl.a. til bekæmpelse af malariamyg og i Danmark i plantebeskyttelsesmidler til produktion af bl.a. tomater, agurker og potteplanter. Bakterien indgår i ca. 50 % af sådanne produkter på det danske marked, og udgør ca. 90% af alle produkter til mikrobiel bekæmpelse af skadedyr på verdensplan [Hansen et al., 1996;Hendriksen and Binnerup, 1997]. Desuden er insekticider baseret på nye underarter af Bt med andre anvendelsesmuligheder under konstant udvikling verden over [Feitelson et al., 1992].
Bt er giftig for visse insektlarver, fordi den danner specifikke, insektdræbende toksiner (såkaldte d-endotoksiner eller krystal-toksiner) [Hofte and Whiteley, 1989], som anses for at være uskadelige for mennesker. Bortset fra denne egenskab er Bt ikke til at skelne fra den fødevarebårne sygdomsfremkaldende bakterie Bacillus cereus. Bakterien B. cereus kan give anledning til fødevareforgiftning ved at bakterien indtages i sporeform med maden og efterfølgende spirer og vokser i tyndtarm, hvor der dannes såkaldte enterotoksiner, som kan give diarre [Granum and Lund, 1997]. Det har vist sig at Bt kan danne de samme enterotoksiner som B. cereus, og dette gælder også for de stammer der anvendes i kommercielle plantebeskyttelsesmidler. Da der ved sygdomstilfælde med B. cereus lignende organismer ikke skelnes mellem Bt og B. cereus kan det således ikke udelukkes at en del af de infektioner der tilskrives B. cereus, kan skyldes Bt.
Tre enterotoksiner er beskrevet i litteraturen: det hæmolytiske enterotoksin hæmolysin BL (HBL), det ikke-hæmolytiske enterotoxin (NHE) og cytolysin K (CytK). De stammer af Bt, som er undersøgt i projektet, har alle generne for disse toksiner, og for HBL og NHE vides det endvidere at de udtrykkes under laboratorieforhold. Ekspressionen af generne (dvs. produktionen af toksin) kan imidlertid være reguleret af mange faktorer i bakteriernes omgivelser, og man ved ikke, om Bt stammerne danner disse toksiner i tarmen hos dyr og mennesker, eller i givet fald hvor store mængder, de er i stand til at lave.
Bakterier i slægten Bacillus danner som et led i deres overlevelsesstrategi sporer, som er inaktive og meget overlevelsesdygtige enheder, der indeholder bakteriens genetiske information, og derudover det minimum af komponenter, som er nødvendigt for at sporen kan spire – dvs. gendanne en ny bakterie. Plantebeskyttelsesmidler der indeholder Bt er baseret på sporer af disse bakterier, der som hovedregel ikke vil spire på plantens overflade, men først udvikle vegetative bakterier i tarmen på de insekter, de skal bekæmpe. Mennesker, der spiser planteafgrøder behandlet med disse midler vil derfor først og fremmest indtage Bt sporer, og ikke vegetative celler. Da det er kendt, at opvarmning inducerer spiring af Bacillus sporer, kan man forestille sig at varmebehandling (under tilberedning) af mad, der indeholder Bt sporer, vil øge sandsynligheden for at sporerne spirer i den humane mave-tarm kanal.
Den naturlige tarmflora hos mennesker spiller en vigtig rolle både i beskyttelsen mod infektioner, og i omsætning af næringsstoffer. Det er derfor af stor vigtighed for en sundhedsmæssig risikovurdering at undersøge, om indtagelsen af Bt sporer påvirker sammensætningen af den øvrige tarmflora. En sandsynlig forudsætning for en sådan påvirkning, og en absolut forudsætning for at Bt kan danne enterotoksiner i menneskets tarm er, at sporerne spirer efter indtagelse. Der er imidlertid modstridende opfattelser af, om dette er tilfældet. Nogle studier indikerer, at B. cereus sporer passerer uændrede gennem mave-tarmkanalen hos mus [Spinosa et al., 2000], medens andre viser, at bestemte underarter af B. cereus undergår både spiring og ny sporulering i tarmindhold fra kyllinger og smågrise [Jadamus et al., 2001].
I fremtiden kan man forestille sig en øget eksponering af befolkningen af Bt da 1) der er et øget krav til at reducere brugen af kemiske midler, 2) markedet for økologiske grøntsager, hvor brugen af Bt tilladt i særlige tilfælde (http://www.plantedir.dk/), er i vækst, 3) import af store mængder frugt og grønt produceret i lande hvor Bt produkter anvendes og 4) der er en stigende tendens til at grøntsager konsumeres rå eller kun let tilberedte. Så selvom Bt midler har en ”long history of safe use” kan man forestille sig at den øgede eksponering øger risikoen for en evt. negativ effekt af netop disse midler. Det er derfor nødvendigt at øge opmærksomheden omkring den sundhedsmæssige effekt af Bt baserede insekticider efter oral indtagelse. Vigtige parametre i vurderingen af den sundhedsmæssige effekt af mikroorganismer, som indtages af mennesker, er organismernes evne til at overleve/kolonisere i mave-tarmkanalen, deres evne til at danne sygdomsfremkaldende toksiner i tarmen og deres eventuelle effekt på den øvrige mikrobielle flora i tarmen.
I projektet har vi valgt at kigge nærmere på to stammer af Bt, som er tilladte på det danske marked. Bt subsp. kurstaki, som er aktiv overfor insekter af slægten Lepidoptera, og bl.a. anvendes til produktion af væksthusafgrøder såsom tomater, agurker og peberfrugter. Bt subsp. israelensis er virksom overfor insekter af slægten Diptera, og er i Danmark kun tilladt til produktion af potteplanter (http://www.mst.dk).
1.2 Formål med projektet
Projektets formål var at eftervise følgende hypoteser, der alle vedrører den sundhedsmæssige effekt ved oral indtagelse af mikrobiologiske plantebeskyttelsesmidler baseret på Bt subsp. israelensis og subsp. kurstaki.
- Sporer af Bt spirer under passagen gennem mave-tarm kanalen, og kan efterfølgende etableres i tarmen
- Varmebehandling af sporerne før indtagelse øger evnen til spiring i tarmen
- Bt celler i tarmen kan påvirke sammensætningen af den omkringliggende mikrobielle tarmpopulation
- Bt celler i tarmen kan producere sygdomsfremkaldende enterotoksiner
- Bt celler kan overføre genetisk information til andre bakterier i tarmen
1.3 Fremgangsmåde
Det er kendetegnende for Bacillus, at der er meget stor variation både mellem arterne, og mellem subspecies (underarter) af den enkelte art. Observationer vedrørende en enkelt underart kan derfor ikke nødvendigvis generaliseres til at gælde for hele arten. De plantebeskyttelsesmidler, der p.t. forhandles på det danske marked er imidlertid baseret på kun to forskellige subspecies af Bacillus thuringiensis. Produkterne VectobacÒ og Bactimos® indeholder Bt subsp. israelensis, medens produktet Dipel® er baseret på Bt subsp. kurstaki. Derfor er det disse to subspecies, vi har valgt at undersøge i projektet. Derudover har vi brugt en B. cereus stamme, der har været årsag til fødevareforgiftning, som ”positiv kontrol” på enterotoksinproduktion.
Som model for den humane tarm har vi valgt human-flora-associerede (HFA) rotter, som er så tæt på forholdene i en menneskelig mavetarmkanal som det er muligt at opnå i en dyremodel [Hirayama and Itoh, 2005]. Ved at bruge denne model har vi undersøgt hvad der sker efter dosering med Bt enten indgivet som (i) ubehandlede sporer, (ii) varme-behandlede sporer og (iii) vegetative celler. Derudover har vi anvendt kimfri rotter, dvs. rotter uden tarmflora, til at undersøge spiring, overførsel af DNA og enterotoksinproduktion. Dette er en ”worst-case” model, hvor det er muligt at undersøge enkelte bakterier i højere koncentration end det ofte er tilfældet i en tarm med en etableret tarmflora.
1.4 Rapportens opbygning
Materiale- og metodeafsnit indeholder en overordnet gennemgang af de anvendte materialer og metoder. En mere udførlig og teknisk gennemgang af materialer og metoder kan findes i bilag A. Resultatafsnittet består af fire afsnit, som på tværs af de anvendte bakteriestammer giver resultaterne af 1) overlevelse og spiring af stammerne i tarmen hos både HFA og kimfri rotter, 2) effekt på øvrig bakterieflora i tarmen, 3) produktion af enterotoksiner, samt et afsnit om 4) overførsel af DNA fra Bt til andre bakterier i tarmen.
Der er blevet udført en del indledende forsøg med optimering af enterotoksin assays. Resultaterne herfra er indgående beskrevet i kapitlet Materialer og Metoder, hvorimod resultater med brug af assayet på bestemte bakteriestammer samt tarmprøver er givet i resultatafsnittet. Ligeledes er selve fremstillingen af en ”grøn” Bt stamme beskrevet i Materialer og Metoder, mens resultater fra dyreforsøget med stammen er refereret i resultatafsnittet.
Til rapporten hører bilag A, som udover de førnævnte bilag (materialer og metoder), indeholder mere udførlige data, samt en liste over formidling relateret til projektet og den ene videnskabelige artikel, der indtil videre er publiceret i projektet.
2 Materialer og metoder
- 2.1 Anvendte Bacillus cereus og Bacillus thuringiensis stammer
- 2.2 Mærkning af bakterier med fluorescens
- 2.3 Dyreforsøg
- 2.4 Undersøgelser af effekter på omkringliggende flora
- 2.5 Enterotoksin assays
- 2.5.1 Immunologisk detektion af HBL
- 2.5.2 Vero-celle assay
- 2.5.3 Bestemmelse af detektionsgrænsen i Vero-celle assay
- 2.5.4 Effekt af vækstbetingelser på Vero-toksiske substanser
- 2.5.5 Betydningen af sterilfiltrering for indholdet af Vero-toksiske substanser
- 2.5.6 Ekstraktion af potentielle Vero-toksiske substanser fra tarmprøver
- 2.5.7 Indflydelse af fæces på genfindelse af Vero-toksiske substanser
I det følgende er der en overordnet gennemgang af de valgte materialer og metoder. En mere udførlig fagteknisk beskrivelse kan findes i bilag A.
2.1 Anvendte Bacillus cereus og Bacillus thuringiensis stammer
Til dyreforsøgene har vi arbejdet med tre forskellige stammer fra Bacillus cereus gruppen, en B. cereus og to Bt stammer, derudover er yderligere tre stammer blevet testet i Vero-celle assay (Tabel 1). B. cereus F4433/73 blev udvalgt som positiv kontrol for enterotoksinproduktion. Denne stamme er isoleret fra et udbrud af fødevareforgiftning [Melling et al., 1976] og producerer enterotoksiner i store mængder [Damgaard, 1995;Granum et al., 1993]. De to Bt stammer er identiske med de kommercielle stammer i produkterne Dipel®, Bactimos®, og Vectobac®. Alle tre produkter er lovlige at bruge i Danmark som plantebeskyttelsesmidler (http://www.mst.dk/). Bt subsp. kurstaki DMU67R er blevet isoleret fra miljøet [Pedersen et al., 1995], og kan ved forskellige molekylære teknikker ikke skelnes fra den Bt subsp. kurstaki HD1 stamme som anvendes i plantebeskyttelsesmidlet Dipel®. Ligeledes er den anvendte Bt subsp. israelensis HD567 identisk med de stammer der findes i de kommercielle produkter Bactimos® og Vectobac®.
Tabel 1. Oversigt over anvendte Bt stammer.
| Stamme | Karakteristika |
| B. cereus F4433/73 | Har været årsag til fødevareforgiftning |
| B. thuringiensis subsp. kurstaki DMU67 | Identisk med HD1, som er til stede i produktet Dipel®. Toksisk overfor insekter af slægten Lepidoptera. |
| B. thuringiensis subsp. Israelensis HD567 | Identisk med de kommercielle stammer i Bactimos® og Vectobac®. Toksisk overfor insekter af slægten Diptera |
| B. thuringiensis subsp. kurstaki HD1 | Kommerciel stamme |
| B. thuringiensis subsp. tenebrionis NB125 | Kommerciel stamme, toksisk overfor insekter af slægten Coleoptera. Ikke tilladt i Danmark |
| B. cereus BCIP 5832 | Probiotisk stamme |
2.1.1 Fremstilling af antibiotika-resistente stammer
For at kunne genfinde de anvendte stammer mellem de øvrige bakterier i tarmen, var det nødvendigt at bruge stammer der var resistente overfor antibiotika. Der blev opnået spontane rifampicin resistente mutanter af B. cereus F4433/73 og Bt subsp. kurstaki DMU67. Rifampicin resistens er sjælden blandt bakterier fra en normal tarmflora og derfor velegnet til at skelne de tilsatte B. cereus og Bt bakterier fra resten af floraen. Det var ikke muligt at gøre Bt subsp. israelensis HD567 stammen resistent overfor rifampicin da dette ødelagde stammens sporuleringsevne, så denne stamme var derfor streptomycin-resistent.
2.2 Mærkning af bakterier med fluorescens
Gener, der koder for fluorescerende proteiner, eksempelvis Green Fluorescent Protein (GFP) fra goblen Aquorea victoria er stærke redskaber til at visualisere bakterier og/eller plasmidoverførsel mellem bakterier [Christensen et al., 1998;Normander et al., 1998].
I projektet har vi udnyttet dette til fremstilling af grøn-fluorescerende bakterier (se Figur 1). Bakterierne blev gjort grønne ved at indsætte et plasmid (et cirkulært stykke DNA), som indeholder et gfp gen. Genet udtrykker GFP proteinet, som bliver konstant udtrykt under vækst, altså når cellerne er vegetative. Derimod vil sporerne ikke lyse, da de er ”i dvale”. To forskellige plasmider (pAD43-25 og pAD44-12) konstrueret af amerikanske forskere [Dunn and Handelsman, 1999] er blevet brugt. Skelettet (plasmid pAD123) af disse to plasmider kan ses i Bilag A og består af to replikons, så plasmidet er i stand til at blive opretholdt i både en Gram-negativ vært (f.eks. Escherichia coli) og en Gram-positiv vært (f.eks. Bacillus). Derudover indeholder plasmidet et gen der giver resistens overfor ampicillin og som virker i E. coli og et gen der giver resistens overfor kloramfenikol, som kan bruges som markør i Bacillus. Endelig indeholder pAD123 genet kodende for GFP, som dog kun bliver udtrykt såfremt der er en promotor foran genet, som det er tilfældet i de to anvendte plasmider pAD43-25 og pAD44-12. De to plasmider blev indsat i både Bt subsp. kurstaki og subsp. israelensis og testet under fluorescens-mikroskopi. Den kombination der gav det bedste signal var Bt subsp. israelensis indeholdende plasmid pAD44-12 (Figur 1), og denne konstruktion blev derfor udvalgt til dyreforsøget med kimfri rotter.
Til detektion af grønne vegetative celler i tarmen på rotterne har vi benyttet flow-cytometri, som er en meget følsom metode til at detektere og tælle fluorescerende bakterier. Flowcytometri af prøverne er blevet udført på Københavns Universitet af phd.-studerende Martin Iain Bahl.
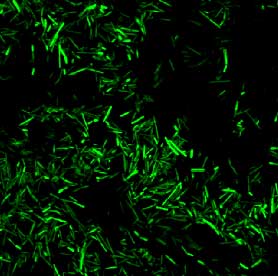
Figur 1. Bt bakterier mærket med GFP (grønfluorescerende protein).
2.3 Dyreforsøg
2.3.1 Kimfri rotter
DFVF har mange års erfaring med avl og håndtering af kimfri rotter, som ikke har en tarmflora. Dyrene købes fra Taconic i USA og holdes i specielle sterile isolatorer, hvor luften der indblæses til dyrene også er steril. Ind- og udslusning af prøver foregår sterilt via en sluse, og dyrene går på steril strøelse og får sterilt foder og vand. Disse dyr er velegnede til at teste enkelte bakterier da det ofte er muligt at kolonisere tarmen på dyrene med høje koncentrationer af den bakterie man vil undersøge.
Ulempen ved at anvende kimfri rotter er at man ikke kan undersøge effekten af og på den omkringliggende flora. Derudover er der andre fysiologiske forskelle mellem kimfri og konventionelle dyr, der kan have en indflydelse på de bakterier man undersøger.
2.3.2 Human Flora Associerede (HFA) rotter
HFA rotter er dyr, som oprindelige er kimfri, og som derefter oralt indgives en opslæmning af human fæces, sådan at de humane tarmbakterier etableres i rotternes tarm. Dyrene holdes i hele forsøgsperioden sterile på samme måde som de kimfri dyr. HFA dyr er det tætteste man kan komme på en menneskelig tarmfloramodel.
2.3.3 Udførte dyreforsøg
Projektet omfatter to større dyreforsøg, kaldet A og B, beskrevet i flowdiagrammerne nedenfor. Forsøg A blev udført som tre delforsøg (A1, A2 og A3) med HFA rotter med en B. cereus stammer og to stammer af Bt. Dyreforsøg B blev udført med kimfri rotter og Bt subsp. israelensis mærket med et grøn-fluorescerende protein.
DYREFORSØG A (2004):
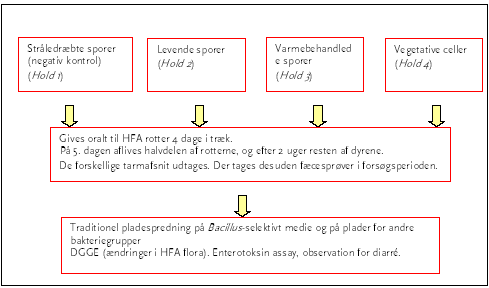
Forsøget blev udført som tre separate forsøg med hver sin stamme A1: B. cereus F4433/73, A2: Bt subsp. kurstaki og A3: Bt subsp. israelensis). Dyrene blev inddelt i fire hold, som blev doseret (dvs. fodret) med henholdsvis: 1) stråledræbte sporer, 2) ubehandlede sporer, 3) varmebehandlede sporer (80°C, 15 min) og 4) vegetative celler (Figur 2). Fremstillingen af de enkelte bakteriesuspensioner kan findes i Bilag A. Formålet med forsøgene var at:
1. undersøge overlevelse og spiring af sporer i tarmen
2. undersøge om der er forskel på ubehandlede og varmebehandlede sporer mht. til overlevelse og spiring
3. undersøge en evt. forskel i overlevelse af sporer og vegetative celler i tarmen
4. undersøge hvorvidt dosering med B. cereus og Bt kan ændre sammensætningen af den omkringliggende tarmflora
5. undersøge hvorvidt der kan detekteres enterotoksiner i tarmen
Figur 2. Dyreforsøg A blev udført som tre separate forsøg med B. cereus, Bt subsp. kurstaki og Bt subsp. Israelensis.
DYREFORSØG B (2005):
Dyreforsøg B blev udført med kimfri rotter, da resultater fra dyreforsøg A viste, at Bt koloniserer tarmen på HFA rotter til et niveau af ca. 106 bakterier pr. gram fæces. Dette lave niveau ville gøre det svært at detektere spirede grøn-fluorescerende bakterier, enterotoksinproduktion og en eventuel genoverførsel fra Bt (donorcelle) til en udvalgt recipientstamme, hvilket var formålet med dette forsøg.
Ved at anvende kimfri dyr opnås følgende fordele:
a) En forventet højere kolonisering af Bt i tarmen med en deraf følgende forventet højere mængde transkonjuganter (recipientceller der har modtaget DNA fra donor cellen) og/eller spirede bakterier som derfor bliver lettere at detektere.
b) Fravær af den omgivende flora vil i sig selv forenkle detektionen og nedsætte detektionsgrænsen, idet kun de bakterier, der er relevante for forsøget, er til stede i prøverne.
Ulempen ved at anvende kimfri dyr i stedet for HFA dyr er, at en eventuel effekt af den omgivende mikrobielle flora på spiring og/eller enterotoksinproduktion og/eller genoverførsel ikke vil fremgå af forsøget.
Dyreforsøg B blev udført som to delforsøg. I delforsøg B1 (Figur 3) anvendte vi den grøn-fluorescerende stamme af Bt subsp. israelensis. Dyrene blev kun doseret med ubehandlede sporer af stammen, da dyreforsøg A viste at varmebehandling af sporerne inden dosering ingen indflydelse har på overlevelse og spiring. I delforsøg B2 (Figur 4) blev dyrene først doseret med en recipientstamme, der er isogen med donor-stammen og som i reagensglas har vist sig at være i stand til at modtage det overførbare plasmid pXO16. Efter en uge blev der doseret med donor-stammen, indeholdende pXO16, som er et naturligt forekommende overførbart plasmid fra Bt subsp. israelensis. For at være i stand til at detektere overførsel af plasmidet til recipient-stammen benyttede vi en variant af pXO16 som var mærket med et tetracyklinresistensgen.
Formålet med forsøget var at:
1. undersøge spiring af sporerne v.h.a. GFP og flow-cytrometri
2. undersøge om eventuelle vegetative celler danner detektbare enterotoksiner
3. undersøge hvorvidt Bt er i stand til at overføre genetisk materiale i tarmen, hvilket i sig selv er en indikation på at sporerne har spiret
Figur 3. Dyreforsøg B1.
Figur 4. Dyreforsøg B2.

2.4 Undersøgelser af effekter på omkringliggende flora
2.4.1 Kimtællinger af fæces- og tarmprøver
Fæces- og tarmprøver fra dyreforsøg A blev fortyndet i fysiologisk saltvand og udpladet på forskellige selektive næringsmedier for at tælle antallet af bakterier i de største bakteriegrupper i den omkringliggende tarmflora, samt de doserede bakterier (B. cereus og Bt), som beskrevet i Tabel 2.
For at kunne skelne de tilsatte B. cereus og Bt fra den omkringliggende flora blev der anvendt et kommercielt Bacillus Cereus Selektivt Agar (Oxoid) tilsat det antibiotikum som stammen er resistent overfor. Forsøg viste at den anvendte humane fæces-flora ikke indeholdt andre B. cereus –lignende bakterier end dem der blev givet til dyrene.
Tabel 2. Medier til tælling af de forskellige undersøgte bakteriegrupper.
| Bakterie gruppe | Medium | Inkubering |
| B. cereus | Bacillus Cereus Selective Agar (BCSA)* (Oxoid) | 30°C, aerobt, 24 timer |
| B. cereus F4433/73 Bt subsp. kurstaki DMU67R |
Do. Indeholdende 50 μmg/ml rifampicin | |
| Bt subsp. israelensis | BCSA + 100 mg/ml streptomycin | |
| Total aerobe bakterier | Reinforced Clostridial Agar (Oxoid) | 37°C, aerobt, 72 timer |
| Total anaerobe bakterier | 37°C, anaerobt, 72 timer | |
| Laktobaciller | Rogosa agar (Oxoid) | |
| Koliforme | MacConkey Agar no. 3 (Oxoid) | 37°C, aerobt, 24 timer |
| Enterokokker | Slanetz & Bartley Medium (Oxoid) | 37°C, aerobt, 48 timer |
*Bacillus Cereus Selective Agar Base tilsat Bacillus Cereus Selective Supplement (Oxoid) og Egg Yolk Emulsion (Oxoid).
2.4.2 Molekylær metode
Da størstedelen af bakterierne i tarmen ikke kan dyrkes konventionelt, har vi anvendt Denaturerende Gradient Gel Elektroforese (DGGE), som er en forholdsvis ny metode til monitorering af ændringer i komplekse, mikrobielle økosystemer uden forudgående dyrkning [Muyzer and Smalla, 1998].
DNA fra fæces/tarmindhold blev oprenset, hvorefter det blev opformeret ved PCR (Polymerase Chain Reaction), en udførlig beskrivelse af metoden kan findes i Bilag A. Primerne til PCR er rettet mod generne for 16S ribosomalt RNA, og man kan vælge enten specifikke PCR-primere, der opformerer en given taksonomisk gruppe af bakterier, eller generelle primere, der opformerer rRNA fra den totale bakterie-population. I projektet er der blevet benyttet både generelle primere og specifikke primerne til at kigge på ændringer i flg. bakteriepopulationer: laktobaciller, bifidobakterier og bacteroides sp. (Bilag A).
PCR produkterne blev separeret på en denaturerende, elektroforetisk gradient gel (Bilag A). Gelen indeholdt en lineært stigende gradient af en blanding af urinstof og formamid. DNA molekyler med forskellige sekvenser vil ”smelte” (dele sig i to strenge) ved forskellige koncentrationer af urinstof og formamid. Idet der er en aftagende elektroforetisk bevægelighed af delvist smeltede DNA molekyler, vil DNA med forskellige sekvenser standse deres vandring ved forskellige positioner i gradient-gelen. Selv ganske små forskelle i sekvens vil give anledning til ændringer på gelen.
Gelmønstret giver en slags ’fingeraftryk’ af bakteriepopulationens sammensætning, som vil ændres, hvis der sker større ændringer i populationen. Mønstrene blev efterfølgende analyseret ved hjælp af specialiseret software (BioNumerics). Endvidere var det muligt at identificere de bakterie-grupper der giver anledning til de forskellige bånd på gradient-gelen ved at skære båndene ud af gelen, oprense DNA herfra, bestemme dets sekvens og sammenligne med kendte sekvenser i forskellige databaser (Bilag A).
2.5 Enterotoksin assays
Bakterier i B. cereus gruppen kan producere det hæmolytiske enterotoksin hæmolysin BL (BHL), det non-hæmolytiske enterotoksin (NHE), cytolysin K (CytK), samt en række andre produkter og enzymer, som alle kan være medvirkende til at fremkalde sygdom hos mennesker. De stammer af Bt, som blev undersøgt i projektet, har generne for disse produkter, og det vides at de udtrykkes under optimale betingelser i laboratoriet. Ekspressionen af generne (dvs. produktionen af toksin) kan imidlertid være reguleret af mange faktorer i bakteriernes omgivelser, og man ved ikke, om Bt stammerne danner disse toksiner i tarmen hos dyr og mennesker, eller i givet fald hvor store mængder, de er i stand til at lave. Produktion af enterotoksin blev undersøgt både vha. et kommercielt kit og vha. celle-assay.
2.5.1 Immunologisk detektion af HBL
Det kommercielle BCET-RPLA kit fra Oxoid blev brugt til at detektere enterotoksin HBL. Kittet detekterer L2 komponenten fra HBL, og har en meget lav detektionsgrænse på 2 ng toksin per ml. Enterotoksinet HBL består, ligesom enterotoksinet NHE, af tre komponenter som alle tre skal udtrykkes for at toksinet er fuldt virulent. Derfor er det ikke nok at benytte dette kit til bestemmelse af en Bt stammes virulens, og af den grund har vi også brugt celle-assay som beskrevet i næste afsnit.
2.5.2 Vero-celle assay
Udover de kendte toksiner, som Bt producerer, er der sandsynligvis også nogle, som vi endnu ikke kender og som kan være giftige for mennesker. Desuden kan man forestille sig at toksiciteten overfor mennesker ikke skyldes enkeltprodukter, men blandinger af forskellige produkter. Til detektion af en eventuel toksisk effekt af sådanne produkter på mennesker er det en fordel at anvende et test-system som ligner de menneskelige forhold så meget som muligt. Her har vi valgt at anvende en såkaldt Vero-cellelinie (dyrkede nyreceller fra grøn afrikansk abe, som vides at være følsomme overfor diverse enterotoksiner) til påvisning af cytotoksisk aktivitet i tarmindhold og/eller fæcesprøver fra HFA rotter, som har indtaget Bt.
Der laves en række fortyndinger af prøverne, som skal undersøges for toksin-indhold, og disse sættes på en Elisa plade, som indeholder de levende Vero-celler. Efter en inkubationsperiode tilsættes et rødt tetrazolium salt, som af levende Vero-celler omdannes til et gult formazan salt. Mængden af gult salt, der dannes over en given periode er derfor et mål for antallet af levende Vero-celler. Jo mere cytotoksisk aktivitet, der er i prøverne, jo færre levende Vero-celler vil der være tilbage og jo mindre gul vil farven i brøndene i Elisa pladen være. Konkret defineres cytotoksiciteten af prøven som den laveste fortyndingsfaktor, der resulterer i mere end 50% overlevelse af Vero-cellerne. Vero-cellernes 50% aktivitet bestemmes ved at inkludere en gradient med et forskelligt antal Vero-celler på alle Elisa pladerne.
2.5.3 Bestemmelse af detektionsgrænsen i Vero-celle assay
Antallet af bakterier i en 6 timers kultur blev bestemt og forskellige fortyndingsrækker blev fremstillet. Detektionsgrænsen blev bestemt som antallet af bakterier i den fortyndingsrække som tillod mere end 50% af Vero-cellerne at overleve. Antallet af B. cereus F4433/73 i en 6 timers kultur, som havde en Vero-toksisk aktivitet på 160 (dvs. kulturen skulle fortyndes 160 gange for at få mere end 50% overlevelse af Vero-cellerne), var 1,8 x 107 bakterier per ml kultur. Da den laveste realistiske fortyndingsfaktor er en 10 gange fortynding, som er 16 gange lavere den observerede fortyndingsfaktor for B. cereus F4433/73, kan detektionsgrænsen for Vero-toksisk aktivitet blive bestemt til 106 bakterier per ml kultur. Dette er dog et groft skøn idet produktionen af Vero-toksiske substanser afhænger af forskellige faktorer såsom alderen af kulturen og vækstraten. Toksiciteten studeret i kultur-alder eksperimentet (se nedenfor) viste at unge kulturer kan producere store mænger af Vero-toksiske substanser.
2.5.4 Effekt af vækstbetingelser på Vero-toksiske substanser
Tidligere undersøgelser har indikeret at bakteriernes vækstbetingelser kan have indflydelse på bakteriens Vero-toksicitet. Aktiviteten af en ung og en gammel kultur var reduceret i forhold til en ”midaldrende” kultur og (vækstmedie volumen/kolbe volumen) ratioen havde også en betydning for Vero-toksiciteten. To vækstbetingelser blev undersøgt for at bestemme effekten af ”volumen ratio”. B. cereus F4433/73R blev dyrket i 20 ml medium enten i 250 ml kolbe eller i 2 ml medium i 14 ml rør.
Når B. cereus F4433/73 blev dyrket i 20 ml BHIG i 250 ml kolbe ved 32°C og 271 rpm (rounds per minute) i seks timer, var Vero-toksiciteten kun 20, mens toksiciteten var 160 når bakterien blev dyrket i 2 ml BHIG i et 14 ml rør (se Figur 5). Alle dyrkninger blev herefter udført i 14 ml rør med 2 ml BHIG.

Figur 5. A: 250 ml kolber med 20 ml BHIG. B: 14 ml rør med 2 ml BHIG.
Ved at tage prøver ud til forskellige tidspunkter viste det sig at B. cereus F4433/73 ikke producerede detekterbare Vero-toksiske substanser i de første 2 timer efter ompodning af en udvokset kultur. Vero-toksiciteten var 80 efter 3, 4 og 5 timers inkubering. Toksiciteten nåede 160 efter 6 timer og dette niveau holdt sig også efter 8 timers inkubering. Baseret på dette, blev alle kulturer herefter høstet efter 6 timer.
2.5.5 Betydningen af sterilfiltrering for indholdet af Vero-toksiske substanser
For at være sikker på at steril-filtrering af fæces- og tarmprøver med ”low protein binding” filtre ikke binder store mængder af enterotoksiner under filtrering blev fortyndinger af B. cereus F4433/73 med og uden sterilfiltrering sammenlignet i et Vero-celle assay. Resultaterne viste at steril-filtrering ikke havde indflydelse på Vero-celle assayet (Figur 6). Forsøget viste endvidere at der ikke skete forurening af Vero-celle assayet selvom prøverne ikke blev sterilfiltreret. Dette betyder at en centrifugering ved 20.000 g var nok til at fjerne mikroorganismer, og at antibiotika tilsat Vero-celle vækstmediet er nok til at hæmme evt. tilbageværende mikroorganismer. Konsekvensen af denne observation, blev at sterilfiltrering kunne udelades i forsøgene, hvilket betød at sensitiviteten blev fordoblet, siden kun 1 ml 0,85% NaCl per gram tarmprøve var nødvendig og tab af ekstrakt under sterilfiltrering blev undgået.
A
B
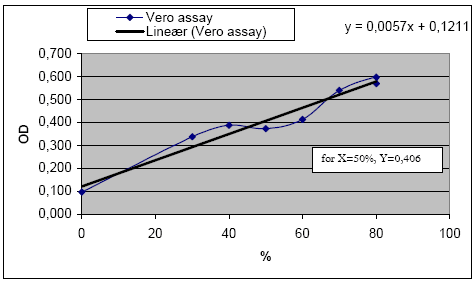
Figur 6. Vero-celle assay til undersøgelse af effekten af sterilfiltrering. A: Datafilen viser OD (optical density) værdien ved 200 min fratrukket værdien ved tiden 0 min. Det røde område indikerer fortyndinger hvor mere end 50% af cellerne er dræbt af B. cereus F4433/73 toksin. B: Udregning af OD værdi svarende til 50% overlevelse af Vero-celler, som i denne plade blev beregnet til 0,406.
2.5.6 Ekstraktion af potentielle Vero-toksiske substanser fra tarmprøver
Siden prøverne fra tarmprøverne skulle analyseres både vha. celle-assay og det immunologiske RPLA-BCET assay, skulle ekstraktionsproceduren være anvendelig til begge protokoller. I RPLA metoden ekstraheres toksinet med 0,85% NaCl opløsning, og denne ekstraktionsmetode blev benyttet. Efter at tarmprøverne blev taget fra dyrene blev de holdt koldt (-80°C) indtil analyse. Der blev tilsat 1 ml 0,85% NaCl per gram tarmprøve, og alle ekstraktionsprocedurer blev udført ved 0-4°C. Tørre fæcesprøver blev rehydreret i 2 timer inden ekstraktion. Alle prøver blev homogeniseret i Eppendorfrør efterfulgt af 10 min centrifugering ved 15.000 x g, og opbevaret ved -80°C inden analyse.
2.5.7 Indflydelse af fæces på genfindelse af Vero-toksiske substanser
Tarmen indeholder en del hydrolytisk aktivitet, som kan inaktivere B. cereus toksinerne. For at undersøge denne aktivitet blev fæces fra kimfri rotter blandet med Vero-toksisk kulturekstrakt. Desuden blev effekten af fæces og 0,85% NaCl på den Vero-toksiske aktivitet testet i ni forskellige kombinationer (Tabel 3). Fæces fra kimfri dyr havde i sig selv ingen toksisk effekt på Vero-celler, og ligeledes havde fæces ingen negativ effekt på detektion af Vero-toksisk effekt af kulturekstrakter fra B. cereus F4433/73.
Tabel 3. Kombinationer af fæces, NaCl, BHIG og kulturekstrakt for at undersøge effekten af forskellige faktorer på den Vero-toksiske aktivitet.
| Kombinationer | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Fæces opløst i 0,85% NaCl | + | + | + | + | |||||
| 0,85% NaCl | + | + | + | + | |||||
| BHIG | + | + | |||||||
| Kulturekstrakt fra B. cereus F4433/73 | + | + | + | ||||||
| Kulturekstrakt fra Bt 407 dPlcR | + | + | + |
3 Resultater
- 3.1 Overlevelse og spiring af Bt og B. cereus celler i tarmen
- 3.2 Ændringer af den normale tarmflora
- 3.3 Enterotoksiner i tarmen
- 3.4 Overførsel af DNA mellem to Bt stammer i kimfri rotter
3.1 Overlevelse og spiring af Bt og B. cereus celler i tarmen
3.1.1 Resultater fra HFA dyr
Kimfri rotter blev først fodret med en human fæces-opslæmning, som fik lov til at etablere sig i rotterne i tre uger, hvorefter dyrene blev fodret med enten B. cereus, Bt subsp. kurstaki eller Bt subsp. israelensis i tre separate forsøg. I hvert forsøg blev dyrene inddelt i fire hold som fik hhv. stråledræbte sporer (Hold 1), ubehandlede sporer (Hold 2), varme-aktiverede sporer (Hold 3) og vegetative celler (Hold 4), se også Figur 2. Dyrene blev fodret med de enkelte bakteriesuspensioner fire dage i træk, halvdelen af dyrene blev aflivet på femtedagen og resten af dyrene to uger efter. Fæces- og tarmprøver blev undersøgt for indholdet af Bt og B. cereus ved at udplade på selektive plader.
3.1.1.1 Genfindelse af Bt og B. cereus i fæces
Som forventet, blev der i ingen af de dyr der blev fodret med stråledræbte sporer (negativ kontrol) detekteret B. cereus lignende bakterier i fæces- eller tarmprøver. I de dyr der fik vegetative celler genfindes ingen eller kun få B. cereus lignende bakterier, dette skyldes formodentlig at de vegetative celler inaktiveres i mavesyren (se afsnit 4.1.2). Nedenstående figurer (Figur 7) viser antallet af de tre undersøgte stammer i fæces i de dyr, der fik levende sporer (Hold 2 og Hold 3). Som det ses af figurerne er der ingen forskel på ubehandlede (Hold 2) og varmebehandlede (Hold 3) sporer mht. genfindelse af stammerne i fæces. Forskellen mellem holdene som ses i de dyr der blev fodret med Bt subsp. israelensis skyldes en forskel i doseringen mellem holdene. Hold 3 blev fodret med ca. 106 varmebehandlede sporer, mens Hold 2 fik ca. 108 ubehandlede sporer. Dyrene i de to andre forsøg (B. cereus og Bt subsp. kurstaki) fik ligeledes ca. 108 bakterier i både Hold 2 og Hold 3. Dyrene blev doseret dag 1-4 (begge dage inkl.) og man ser tydeligt at antallet af B. cereus lignende bakterier er størst i den første uge (ca. 106 cfu/g fæces). Derefter falder antallet, dog med meget stor variation mellem dyrene.
I forsøget med B. cereus F4433/73 er der et dyr hvor bakterien kan genfindes to uger efter sidste dosering, mens det gælder for fem ud af seks dyr i forsøget med Bt subsp. kurstaki, denne forskel kan skyldes forskel i detektionsgrænse mellem de to forsøg (100 hhv. 10 cfu/g fæces) (Figur 7). I et af dyrene fodret med Bt subsp. kurstaki (dyr 15) er koncentrationen af stammen meget højere end de andre dyr i fæces 2 uger efter sidste dosering (Figur 7). I forsøget med Bt subsp. israelensis kunne bakterien ikke detekteres i dyrenes fæces to uger efter sidste dosering.
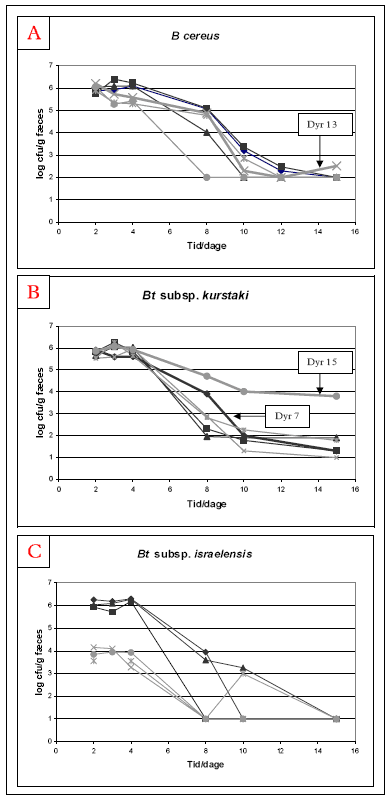
Figur 7. Genfindelse af hhv. B. cereus (A), Bt subsp. kurstaki (B) og Bt subsp. israelensis (C) i fæces fra individuelle dyr doseret dag 1-4 med ubehandlede sporer (sort, Hold 2) og varmebehandlede sporer (grå, Hold 3). Der blev udført tre separate forsøg, et med hver af de tre førnævnte stammer.
3.1.1.2 Genfindelse af stammer i tarmprøver og organer
Halvdelen af dyrene fra hvert hold blev aflivet på femtedagen efter at have fået enten B. cereus, Bt subsp. kurstaki eller Bt subsp. israelensis fire dage i træk. De resterende dyr blev aflivet to uger efter sidste dosering. Prøver blev taget ud fra følgende tarmafsnit: duodenum (øvre tyndtarm), ileum (nedre tyndtarm), caecum (blindtarm) og kolon (tyktarm).
Antallet af genfundne bakterier af de tre stammer fra dyr der blev fodret med ca. 108 ubehandlede sporer (Hold 2) ved den første aflivning kan ses i Figur 8 (se også mere udførlige data i Tabel 4). Antallet af de tre stammer i caecum og kolon er ens, hvorimod der er stor forskel på genfindelse af de tre stammer i tyndtarmsprøverne. Dyrene der blev doseret med sporer af Bt subsp. israelensis skiller sig ud ved at have en langt højere koncentration af bakterier i tyndtarmen. Det samme gælder hvis man kigger på dyr fra Hold 3, fodret med varmebehandlede sporer (Tabel 4). På trods af at dyr fodret med Bt subsp. israelensis blev fodret med 100 gange færre sporer end dyr der fik B. cereus og Bt subsp. kurstaki, havde dyrene en højere koncentration i ileum (Tabel 4).
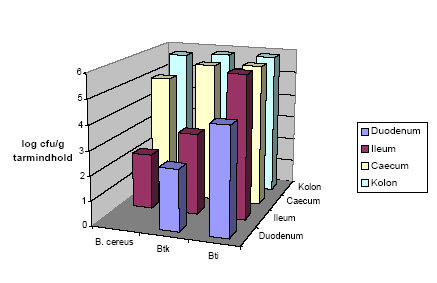
Figur 8. Samlet figur der viser antallet af hhv. B. cereus, Bt subsp. kurstaki (Btk) og Bt subsp. israelensis (Bti) i de tre forsøg. Tallene stammer fra de dyr der blev doseret med ubehandlede sporer (Hold 2). Detektionsgrænsen var 10 cfu/g tarmindhold for B. cereus og Btk, og 10³ cfu/g tarmindhold for Bti.
Ved aflivning af dyr to uger efter sidste dosering genfandtes kun få eller ingen af de tilsatte stammer i tarmprøverne fra dyrene. I dyr fodret med B. cereus fandtes stammen kun i kolon fra et dyr doseret med varmebehandlede sporer og overraskende i de nedre tarmafsnit fra et dyr fodret med vegetative celler (Tabel 5).
I dyr fodret med levende sporer af Bt subsp. kurstaki genfandtes stammen i flere tarmafsnit to uger efter sidste dosering. Og ligesom dyr 15 havde en meget højere koncentration af stammen i fæces (Figur 7B), ligeledes havde dette dyr en meget højere koncentration af Bt subsp. kurstaki end de andre dyr (Figur 9).
Vi fandt ingen Bt subsp. israelensis stammer i de dyr der blev doseret med denne stamme, og dette er i overensstemmelse med resultaterne fra fæcesprøverne.
Tabel 4. Genfindelse af B. cereus og de to anvendte Bt stammer i de forskellige tarmafsnit ved aflivning på Dag 5.
Tabel 5. Antallet af B. cereus og Bt subsp. kurstaki i tarmprøver fra HFA rotter doseret med hhv. ubehandlede sporer, varmebehandlede sporer og vegetative celler ved sidste aflivning (Dag 18).
| Tarmprøve | Koncentration af B. cereus og Bt subsp. kurstaki (log cfu g-1 tarmindhold) | |||||
| B. cereus | Bt subsp. kurstaki | |||||
| Ubehandlede sporer (Hold 2) |
Varme-behandlede sporer (Hold 3) |
Vegetative celler (Hold 4) |
Ubehandlede sporer (Hold 2) |
Varme-behandlede sporer (Hold 3) |
Vegetative celler (Hold 4) |
|
| Duodenum | < | < | < | < | 2,53±1,31 (2/3) | < |
| Ileum | < | < | < | < | 3,39 (1/3) | < |
| Caecum | < | < | 1,36 (1/3) | 1,30 (1/3) | 2,11±1,15 | < |
| Kolon | < | 2,83 (1/3) | 1,85 (1/3) | 1,43±0,38 | 2,64±0,91 (2/3) | < |
*< Indikerer at antallet af celler er under detektionsgrænsen (10 cfu/g tarmindhold)
† Tallet i parentes viser hvor mange dyr der var positive ud af tre.
Figur 9. Antallet af Bt subsp. kurstaki i dyr 15 doseret med varmebehandlede sporer af stammen. Derudover ses effekten af varmebehandling af tarmprøverne på antallet af bakterier. Varmebehandling dræber de vegetative celler, så det der tælles i prøven efter varmebehandling, er antallet af sporer. Hvorimod tælling af prøven uden varmebehandling angiver det totale antal bakterier, både sporer og vegetative celler. Forsøget blev udført to gange.
I forsøgene med de to Bt stammer blev der endvidere udtaget milt og lever fra dyrene og undersøgt for indhold af de tilsatte Bt stammer. Der blev kun fundet en positiv prøve, nemlig dyr 15 fra forsøget med Bt subsp. kurstaki. Dette dyr havde højere koncentration af stammen i både fæces og tarm (se forrige afsnit) og der blev fundet Bt subsp. kurstaki celler i milten.
3.1.1.3 Spirer sporerne i tarmen på HFA rotter?
I enkelte dyr viste udpladninger fra fæces (Figur 7) at sporerne må have spiret i tarmen. F.eks. dyr 13 doseret med varmebehandlede B. cereus sporer viste i slutningen af forsøgsperioden en stigning i antallet af bakterier i dyret, tydende på at der er sket spiring og vækst i mave-tarm kanalen på dette dyr. Et andet meget tydeligt eksempel er dyr 15 (fodret med varmebehandlede Bt subsp. kurstaki sporer), hvor der var en meget højere koncentration af bakterierne i både fæces og tarm end de andre dyr. Desuden viste varmebehandling (som dræber de vegetative celler) af tarmprøver fra dette dyr, at i tyndtarm var ca. 90% af bakterierne i vegetativ fase (Figur 9), mens de længere nede i tarmen igen havde sporuleret og dannet sporer. Dvs. at i dette dyr har Bt subsp. kurstaki haft en hel vækstcyklus fra spiring af sporen til vegetative celler, vækst af vegetative celler og igen sporulering af de vegetative celler til sporer.
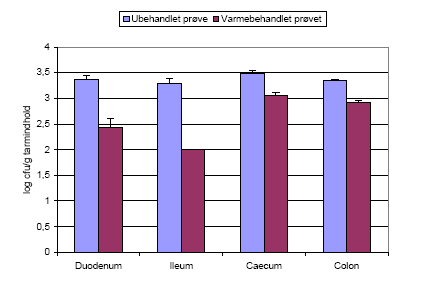
Varmebehandling af tarmprøver fra første aflivning af dyr fodret med ubehandlede sporer af Bt subsp. israelensis viste også at sporerne var spiret i tarmen (Figur 10), da antallet af bakterier bliver reduceret efter varmebehandling, dvs. der er vegetative celler til stede i prøverne, der bliver dræbt under varmebehandlingen.
Figur 10. Tarmprøver fra dyr doseret med Bt subsp. israelensis sporer blev talt både før og efter varmebehandling. Tallet (log cfu/g tarmindhold) før varmebehandling giver det totale antal bakterier, sporer og vegetative celler, mens tallet efter varmebehandling angiver antallet af sporer i prøven, da de vegetative celler bliver dræbt af varmebehandlingen.
3.1.2 Overlevelse af sporer og vegetative celler i simuleret mavevæske
Da forsøgene viste at i dyr doseret med vegetative celler kunne de doserede stammer ikke genfindes, blev der lavet forsøg med overlevelse af bakterierne i simuleret mavevæske (SGF, simulated gastric fluid). Figur 11 viser at de vegetative celler hurtigt bliver inaktiveret i SGF, hvorimod både ubehandlede og varmebehandlede sporer har en god overlevelse. Dette understøtter resultaterne fra dyreforsøget med HFA rotter hvor ingen eller kun få bakterier kunne genfindes efter dosering med vegetative celler.
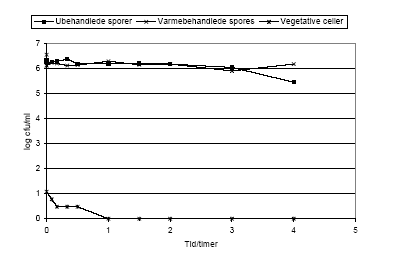
Figur 11. Stabilitet af sporer og vegetative celler af B. cereus F4433/73 i simuleret mavevæske ved pH 1.5.
3.1.3 Bt subsp. israelensis i kimfri dyr
Kimfri dyr blev fodret med en Bt subsp. israelensis stamme, som havde fået indsat et plasmid med et gfp gen, som får bakterien til at lyse grønt i vegetativ fase. Dyrene blev kun doseret med ubehandlede sporer, da de forrige forsøg viste at vegetative celler ikke overlever i mavesyren og der ikke var forskel på ubehandlede og varmebehandlede sporer.
Dyrene blev doseret fire dage i træk med ca. 107 sporer af Bt subsp. israelensis, dagen efter blev halvdelen af dyrene aflivet og de resterende dyr efter to uger.
Bt subsp. israelensis blev opretholdt stabilt i dyrene i hele forsøgsperioden på ca. 106 cfu/g fæces, og der sås ingen nedgang i antallet af bakterier som i forsøgene med HFA dyrene, så Bt klarer sig bedre i kimfri rotter uden en naturlig tarmflora (data ikke vist). Også tarmprøverne (Figur 12) viste at Bt subsp. israelensis har etableret sig i dyrene.
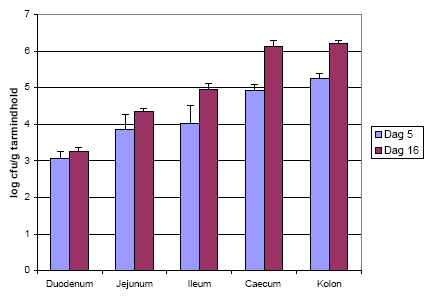
Figur 12. Antallet af Bt subsp. israelensis i tarmen fra kimfri dyr efter aflivning på hhv. dag 5 og dag 16.
3.1.3.1 Spirer sporerne i tarmen på kimfri rotter?
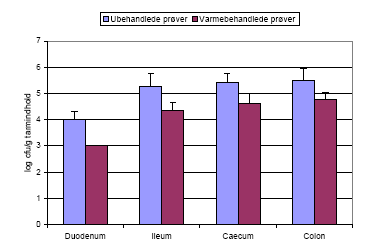
Flowcytometri (KU, phd studerende Martin Bahl) viste at grønne bakterier, dvs. vegetative celler kunne detekteres i alle tarmafsnit ved aflivning på dag 5 (Tabel 6) dvs. at sporerne var spiret og havde dannet aktive vegetative celler. Endvidere viste varmebehandling af prøverne fra tarm og fæces at der kom sporer ud med fæces som havde tabt gfp-plasmidet, dvs. at bakterien havde undergået en hel livscyklus i tarmen: sporerne var spiret til vegetative celler, som så igen havde sporuleret til sporer.
Varmebehandling (80 °C, 15 min) viste endvidere at de indgivne sporer havde spiret i tyndtarmen og selv i fæces fandtes størstedelen af bakterierne som vegetative celler.
Tabel 6. Resultater af flowcytometri og varmebehandling på prøver fra første aflivning af dyr fodret med sporer af Bt subsp. israelensis.
| Dyr | Prøve | Antal grønne bakterier = vegetative celler (log cfu/g tarmindhold) bestemt vha. flowcytometri | Antallet af vegetative celler (log cfu/g tarmindhold) bestemt vha. varmebehandling af tarmprøver |
| 3 | Duodenum | < | i.b. |
| Jejunum | < | i.b. | |
| Ileum | < | 3,07 | |
| Caecum | 3,60 | 4,62 | |
| Kolon | 4,47 | 5,03 | |
| 4 | Duodenum | < | i.b. |
| Jejunum | 2,45 | i.b. | |
| Ileum | 2,45 | i.b. | |
| Caecum | 4,07 | 4,50 | |
| Kolon | 4,46 | 4,77 | |
| 5 | Duodenum | < | i.b. |
| Jejunum | 3,23 | 3,61 | |
| Ileum | 3,23 | 3,48 | |
| Caecum | 4,73 | 4,37 | |
| Kolon | 4,62 | 4,39 |
Endvidere ses ved varmebehandling og udpladning på selektive plader, at der i løbet af forsøget udskilles sporer uden plasmid, og da celler kun taber plasmider ved deling betyder det at sporerne har spiret til vegetative celler, som har groet og så igen sporuleret (Figur 13).
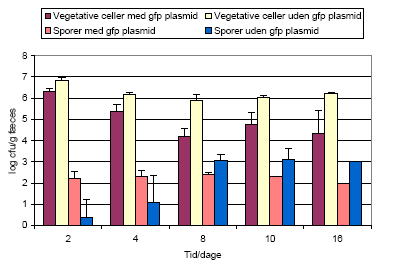
Figur 13. Bt subsp. israelensis i kimfri rotter. Antallet af sporer og vegetative celler udtrykt i cfu/g i fæces med og uden gfp plasmidet pAD44-12.
3.1.4 Opsummering
De tre dyreforsøg med HFA rotter doseret med a) B. cereus F4433/73R, b) Bt subsp. kurstaki og c) Bt subsp. israelensis, viste alle tre at i dyr fodret med vegetative bakterier genfandtes ingen eller kun få bakterier i fæces- og tarmprøver. Forsøg med sporer og vegetative celler af B. cereus og Bt subsp. kurstaki i simuleret mavevæske viste at de vegetative celler hurtig blev dræbt. Dette er i overensstemmelse med et andet studie [Clavel et al., 2004], som viste at under pH 4,5 har vegetative celler af B. cereus og Bt svært ved at overleve. Derfor kan den manglende genfindelse af B. cereus og Bt forklares ved at de vegetative celler ikke overlever passagen gennem mavesækken.
Varmeaktivering af sporerne før dosering havde ingen indflydelse på deres overlevelse og spiring i tarmmiljøet, dvs. at varmebehandling af fødevarer f.eks. ved tilberedning ikke øger risikoen for spiring af Bt i tarmen. Både ubehandlede og varmebehandlede sporer kunne detekteres med den højeste koncentration den første uge med dosering, hvorefter antallet hurtig faldt. Dog kunne vi selv to uger efter sidste dosering genfinde B. cereus og Bt i enkelte dyr.
I forsøget med Bt subsp. israelensis i HFA rotter kunne bakterien ikke detekteres i dyrenes fæces to uger efter sidste dosering, dette skyldes dog formodentlig at bakterien i modsætning til de to andre undersøgte stammer ikke var rifampicin resistent men streptomycin resistent. Streptomycinresistente bakterier er almindelig blandt en normal menneske tarmflora, og disse har formodentlig hindret den resistente subsp. israelensis stamme i at vokse op på de selektive plader. Det kan derfor ikke udelukkes at der ligesom i de to andre forsøg stadig er Bt subsp. israelensis stammer tilbage i dyrene to uger efter dosering.
Der var et enkelt dyr doseret med varme-aktiverede sporer af Bt subsp. kurstaki, som havde en meget højere koncentration af denne stamme i fæces end de andre dyr. Ved aflivning to uger efter dosering blev den samme høje koncentration fundet i alle tarmafsnit og varmeaktivering af tarmprøver fra tyndtarmen, viste at 90% af cellerne her var i den vegetative fase. Dette viser at i dette dyr er der sket spiring og re-sporulering. Desuden blev der i dette dyr fundet Bt subsp. kurstaki celler i milten, dvs. at Bt subsp. kurstaki celler kan passere tarm-barrieren og nå andre organer. Passage af tarm-barrieren blev ikke observeret for Bt subsp. israelensis i hverken HFA eller kimfri dyr.
Forsøgene med Bt subsp. israelensis mærket med et grønt fluorescerende protein og undersøgt i kimfri rotter viste tydeligt at indgivne sporer både spirer og re-sporulerer, dvs. at de har en hel livscyklus i tarmmiljøet. Selv i fæces fandtes bakterierne at være i det vegetative stade. Denne forskel fra resultaterne med HFA dyr skyldtes sandsynligvis fraværet af en omkringliggende tarmflora i de kimfri dyr, hvilket giver Bt meget bedre vækstbetingelser i hele mave-tarm kanalen.
3.2 Ændringer af den normale tarmflora
En eventuel påvirkning af den normale tarmflora efter dosering med B. cereus F4433/73, Bt subsp. kurstaki eller Bt subsp. israelensis blev studeret både ved simple kimtællinger af bestemte bakteriegrupper og ved en molekylærbiologisk metode, som i princippet skulle fange alle bakterier i prøven. Der blev taget fæcesprøver før, under og efter dosering, derudover blev tarmprøver også undersøgt.
3.2.1 Kimtællinger af bakteriegrupper
Som beskrevet i Materialer og Metoder blev følgende bakteriegrupper undersøgt for eventuelle ændringer efter dosering med B. cereus og Bt: Total aerobe, total anaerobe, laktobaciller, koliforme og enterokokker. Disse blev udvalgt da de er dyrkbare og hører til de store grupper af bakterier i tarm.
Ingen store ændringer blev observeret i fæces- og tarmfloraen ved dyrkning af de ovenstående nævnte bakteriegrupper før, under og efter dosering. Der blev fundet enkelte små ændringer som er opsummeret i Tabel 7. Ved aflivning to uger efter sidste dosering blev der ikke observeret forskelle mellem holdene.
Tabel 7. Observerede ændringer af bestemte bakteriegrupper i fæces- og tarmprøver. Ændringer i bakteriesammensætningen i tarmprøverne ses kun ved første aflivning på Dag 5.
| Doseret bakteriestamme | Tarmafsnit | Ændring |
| B. cereus F4433/73 | Ileum | Nedgang i antalllet af laktobaciller i dyr doseret med varmebehandlede sporer |
| Caecum | Nedgang i antallet af koliforme i dyr doseret med levende sporer | |
| Kolon | Nedgang i antallet af totale aerobe og anaerobe bakterier i dyr doseret med varmebehandlede sporer | |
| Bt subsp. kurstaki DMU67 | Caecum og kolon | Nedgang i antallet af aerobe, anaerobe, laktobaciller og koliforme i dyr doseret med ubehandlede sporer |
| Bt subsp. israelensis HD567 | Fæces i doseringsperioden | Øget antal enterokokker i dyr doseret med sporer (både inaktiverede og levende) |
3.2.2 Ændringer af tarmflora studeret vha. DGGE
Da en stor del af bakterierne i tarmen ikke kan dyrkes på næringsmedier i laboratoriet, har vi anvendt en molekylærbiologisk metode, DGGE (denaturerende gradient gel elektroforese) som i princippet fanger alle bakterier, der udgør mere end 1% af populationen.
I projektet har vi undersøgt fæcesprøver fra alle tre forsøg med HFA dyr. Der er blevet taget prøver til DGGE før, under og efter dosering. Prøverne blev i forsøget med B. cereus F4433/73 undersøgt både med generelle primere der detekterer hele bakteriepopulationen og med specifikke primere til at finde ændringer i Bacteroides, laktobaciller og bifidobakterier. Disse tre grupper af bakterier menes at have betydning for menneskers tarmfunktion og immunstatus. I de to forsøg med Bt er prøverne kun analyseret vha. generelle primere, da forsøget med B. cereus ikke viste ændringer i de førnævnte specifikke populationer.
3.2.2.1 B. cereus
Som sagt var der ikke ændringer i de specifikke grupper (Bacteroides, laktobaciller og bifidobakterier) efter dosering med B. cereus F4433/73. Det samme gjaldt for hele bakteriepopulationen i de dyr der blev doseret med inaktiverede (strålesteriliserede) sporer og vegetative celler. Derimod viste PCR-DGGE af prøver fra dyr doseret med levende sporer (enten ubehandlede eller varmebehandlede) en klar gruppering af bakteriepopulationerne i grupper før, under og efter dosering (Figur 14, Bilag A).
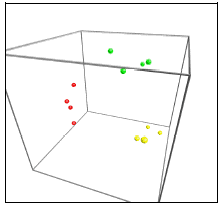
Figur 14. Computeranalyse af tarmfloraen hos rotter med menneske-flora før, under og efter fodring med sporer af B. cereus. Prøver fra før, under og efter fordring er markeret med henholdsvis rødt, grønt og gult. Jo tættere prikkerne ligger på hinanden, des mere ens var floraen i fæcesprøverne.
Disse grupperinger kunne tilskrives ændringer i tilstedeværelsen af bånd eller intensiteten af bånd på DGGE gelen (Figur 15). Kloning, sekventering og sammenligning med kendte sekvenser i databaser viste at bakterierne i de udskårne bånd var identiske med forskellige anaerobe ikke-dyrkbare tarmbakterier.
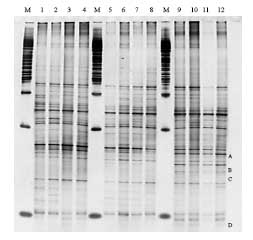
Figur 15. PCR-DGGE profiler genereret fra fæcesprøver af dyr doseret med varmebehandlede sporer af B. cereus F4433/73. Bane 1-4: prøver fra individuelle dyr før dosering; bane 5-8: poolede prøver fra dyr i doseringsugen; bane 9-12: poolede prøver fra dyr efter dosering. M: markør. Båndene blev bestemt til at tilhøre følgende genera af bakterier: Bånd A: Ruminococcus obeum; bånd B: Fusobacterium sp.; bånd C: Clostridiacease familien; bånd D: genus annerella.
3.2.2.2 Bt subsp. kurstaki
I modsætning til forsøget med B. cereus har vi med prøverne fra Bt forsøgene ikke anvendt samlede prøver fra flere dyr, men set på fæcesprøver på enkeltdyr fra før, under og efter dosering med Bt.
PCA-analyse (principal komponent analyse) af DGGE gelerne viser at for de dyr der fik vegetative celler og inaktiverede sporer sker der en ændring i floraen i undersøgelsesperioden, hvor floraen efter dosering adskiller sig fra floraen før og under.
I de rotter der fik levende sporer (både ubehandlede og varmebehandlede) ses i nogle af dyrene en ændring af bakteriesammensætningen under dosering (Bilag A). Dette gælder for dyr 7 fra Hold 2 og dyr 15 fra Hold 3, som begge i perioder har en højere koncentration af Bt subsp. kurstaki i fæces end de andre dyr i holdene (Figur 7B). Som det ses af Bilag A (Figur 1.8.3 og 1.8.6) er der bånd der bliver kraftigere under dosering. Kloning og sekventering af disse bånd viste op til 99% identitet med Faecalibacterium prausnitzii, en dominerende gruppe i en normal human fæcesflora.
3.2.2.3 Bt subsp. israelensis
Også i forsøget med underarten israelensis sås en ændring i bakterie-sammensætning under dosering med sporer af bakterien (Bilag A), men da der også sås en ændring i kontrolgrupperne fodret med hhv. vegetative celler og inaktiverede sporer er det uvist om ændringen skyldes doseringen med stammen.
3.2.3 Opsummering
Der blev kun observeret få og midlertidige ændringer af den omkringliggende bakterieflora, og vi kan konkludere at påvirkningen af den normale tarmflora er minimal. Nogle stammer af B. cereus bliver som sagt brugt som probiotika til mennesker og dyr og et studie med en sådan probiotisk stamme har vist en effekt på E. coli og enterokok populationen [Gedek et al., 1993]. Endvidere har et studie vist en signifikant reduktion i antallet af koliforme bakterier i tarmprøver fra smågrise fodret med en probiotisk B. cereus stamme (Jadamus et al, 2002). Den samme nedgang i antallet af koliforme bakterier har vi observeret i vores forsøg med B. cereus, dog var reduktionen kun midlertidig. Det er usikkert hvorvidt denne påvirkning af den omkringliggende bakterieflora skyldes vegetative celler eller sporer af B. cereus og Bt. Som forsøgene viser er bakterierne i de fleste dyr primært tilstede som sporer, og det er derfor sandsynligt at det er disse der er ansvarlige for ændringerne, evt. ved at binde sig til tarmepitelceller og derved optage plads for andre bakterier.
I to rotter fodret med sporer af Bt subsp. kurstaki sås en ændring af bakteriesammensætningen i fæces under dosering ved DGGE. Dette gælder for dyr 7 fra Hold 2 og dyr 15 fra Hold 3, som begge i perioder har en højere koncentration af Bt subsp. kurstaki i fæces end de andre dyr i holdene. Under dosering er der bånd der bliver kraftigere på DGGE gelen. Kloning og sekventering af disse bånd viste op til 99% identitet med Faecalibacterium prausnitzii, en dominerende gruppe i en normal human fæcesflora. F. prausnitzii er en butyrat-producerende bakterie, som menes at danne energi til tarmepitelceller og har en god indflydelse på sundhedstilstanden i tyktarmen. Da der ses en stigning af denne bakterie i doseringsperioden kunne det tyde på at Bt subsp. kurstaki har en positiv effekt på netop denne bakterie.
PCA-analyse (principal komponent analyse) af DGGE gelerne viser at for de dyr der fik vegetative celler og inaktiverede sporer sker der en ændring i floraen i undersøgelsesperioden, hvor floraen efter dosering adskiller sig fra floraen før og under. Dette er formodentlig en naturlig ændring der sker i tarmfloraen på HFA rotter, en bakteriesammensætning, som i forhold til konventionelle rotter ikke er helt stabil, da den ikke er naturlig for rotter.
3.3 Enterotoksiner i tarmen
Inden der blev kigget efter enterotoksiner i tarmprøver vha. Vero-celle assay og et kommercielt kit fra Oxoid (BCET-RPLA) var det nødvendigt at lave en del indledende forsøg for at optimere forsøgsbetingelserne, bestemme detektionsgrænser m.m. Disse forsøg er ikke beskrevet her, men i afsnittet om Materialer og Metoder, paragraf 3.5.
3.3.1 Vero-toksiciteten af forskellige bakterier
Vero-toksiciteten af forskellige stammer dyrket under optimale betingelser er vist i Tabel 8. Bt subsp. israelensis HD-567 havde den højeste aktivitet, dette kan sandsynligvis tilskrives en celledræbende faktor som produceres samtidig med krystal-toksinet. Ingen af de andre stammer har denne faktor. De to andre kommercielle stammer, subsp. kurstaki og subsp. tenebrionis har lavere aktivitet end det sygdomsfremkaldende isolat B. cereus F4433/73. Endelig har også den probiotiske stamme B. cereus BCIP 5832 lav Vero-toksisk aktivitet.
Tabel 8. Vero-toksicitet af referencestammer og stammer brugt til rotteforsøg. Fortyndingsfaktoren er det antal gange bakteriesuspensionen er blevet fortyndet for at opnå mindst 50% overlevelse af Vero-cellerne. Dvs. jo højere fortyndingsfaktor jo mere toksisk er stammen.
| Stamme | Fortyndingsfaktor |
| B. cereus F4433/73 | 160 |
| B. cereus BCIP 5832 | 20 |
| B. thuringiensis subsp. Kurstaki HD-1 | 80 |
| B. thuringiensis subsp. Kurstaki DMU67R | 80 |
| B. thuringiensis subsp. israelensis HD-567 | 640 |
| B. thuringiensis subsp. tenebrionis NB-125 | 80 |
3.3.2 Detektion af Vero-toksisk aktivitet i tarmprøver fra rotter
I ingen af forsøgene med HFA rotter kunne der detekteres Vero-toksisk aktivitet i prøverne fra tarm og fæces. Hverken i de dyr der var doseret med den sygdomsfremkaldende B. cereus F4433/73 eller i de dyr doseret med de to underarter af Bt (subsp. kurstaki og subsp. israelensis).
I de kimfri rotter doseret med sporer af Bt subsp. israelensis blev komponenten L2 fra HBL detekteret i et enkelt dyr fra tyndtarmsprøve vha. det kommercielle kit BCET-RPLA (Tabel 9).
Tabel 9. Resultat af Vero-assay og Oxoid test af tarmprøver fra mono-associerede rotter. Fortynding: Tarm-prøve ekstrakterne fortyndes 10, 20, 40, 80, 160, 320, 640 og 1280 gange. Den angivne fortynding nedenfor angiver ved hvilken fortynding der er mere end 50% af cellernes aktivitet tilbage. Kun de ekstrakter hvor der enten står et ”-” eller et ”+” er blevet testet i OXOID analysen.
| Dyr | prøve | Fortynding | Oxoid test |
| 1 | J | 40 | - |
| 1 | I | Mindre end 10 | - |
| 1 | Ca | Mindre end 10 | - |
| 3 | J | 40 | - |
| 3 | I | 20 | + |
| 3 | Ca | Mindre end 10 | - |
| 4 | J | 40 | - |
| 4 | I | Mindre end 10 | |
| 4 | Ca | Mindre end 10 | |
| 5 | J | 20 | - |
| 5 | I | Mindre end 10 | |
| 5 | Ca | Mindre end 10 | |
| 6 | J | 80 | - |
| 6 | I | Mindre end 10 | |
| 6 | Ca | Mindre end 10 | |
| 7 | J | 40 | - |
| 7 | I | Mindre end 10 | |
| 7 | Ca | Mindre end 10 | |
| 8 | J | 40 | - |
| 8 | I | Mindre end 10 | - |
| 8 | Ca | Mindre end 10 | - |
| 6 | Kolon | Mindre end 10 | |
| 7 | Kolon | Mindre end 10 | |
| 8 | Kolon | Mindre end 10 |
Desuden sås udslag i Vero-celle assayet i jejunum (midterste del af tyndtarm) i alle dyr, også i kontroldyr 1, som ikke blev doseret med Bt subsp. israelensis (Tabel 9).
3.3.3 Opsummering
Inden prøver fra dyr kunne testes for tilstedeværelsen af enterotoksiner var det nødvendigt at udføre en del indledende forsøg, som beskrevet i Materialer og Metoder. I disse indledende forsøg blev forsøgsbetingelserne optimeret, det blev vist at fæces- og tarmekstrakt ikke influerer på genfindelse af enterotoksiner, at fæcesprøver ikke i sig selv er giftige for cellerne, og at der skal være mindst 106 bakterier per ml til stede for at der kan måles Vero-toksisk aktivitet.
Vero-celle assay på de anvendte stammer viste at den højeste toksin-aktivitet fandtes i Bt subsp. israelensis, formodentlig pga. et nonspecifikt cytolytisk toksin der dannes samtidig med krystaltoksinet. Denne stamme bruges i Danmark kun på prydplanter. De andre kommercielle stammer, subsp. kurstaki og subsp. tenebrionis, som benyttes til spiselige afgrøder, og hvoraf kun subsp. kurstaki er tilladt på det danske marked, havde en lavere aktivitet end det B. cereus isolat der har givet anledning til diarré.
At der ikke kunne detekteres Vero-toksisk aktivitet i HFA dyrene kan skyldes at vegetative former af de tilsatte bakterier ikke fandtes i tilstrækkelig høj densitet i tyndtarmen, hvor produktionen af enterotoksiner menes at ske [Granum and Lund, 1997]. De indledende forsøg viste at der skal være mindst 106 bakterier per ml til stede for at der kan detekteres cytotoksisk effekt på Vero-celler, og i tyndtarmsprøverne detekterede vi højst 104 bakterier per g tarmindhold.
I forsøgene med kimfri rotter associeret med Bt subsp. israelensis sås udslag i Vero-celle assayet i jejunum (midterste del af tyndtarm) i alle dyr, også i kontroldyr 1, som ikke blev doseret med Bt subsp. israelensis (Tabel 9). Derfor er det sandsynligvis ikke bakterien der har en negativ effekt på Vero-celler, men kan måske skyldes galde-salte eller pankreas-enzymer der er blevet udskilt til tyndtarmen. Kun i et dyr ud af seks fra forsøgene med kimfri rotter fandtes cytotoksisk aktivitet i Vero-celle assay, samt positivt respons fra Oxoid kittet som detekterer L2 komponenten fra enterotoksin HBL.
3.4 Overførsel af DNA mellem to Bt stammer i kimfri rotter
3.4.1 Dyreforsøg med kimfri dyr
Bakterierne i B. cereus gruppen er kendt for at indeholde plasmider (cirkulært DNA) hvoraf mange kan overføres fra den ene bakterie til den anden ved en proces der kaldes konjugation. Der findes mange artikler som beskriver denne overførsel i laboratoriet, og det er også blevet vist at der kan ske overførsel vha. konjugation i tarmen på insekter. Det er dog aldrig blevet undersøgt i tarmen hos pattedyr, og det er interessant fra et evolutionært og økologisk synspunkt hvorvidt Bt er i stand til at udveksle DNA i et sådant miljø, og er en vigtig faktor i risikovurderingen af Bt midler. Derudover afspejler det bakteriel aktivitet. En eventuel overførsel viser nemlig at de indgivne sporer må have spiret og dannet vegetative celler, idet kun aktive celler kan overføre DNA.
For at øge muligheden for at detektere en eventuel overførsel mellem to Bt stammer valgte vi at bruge kimfri rotter, som blev doseret med to isogene stammer, dvs. bakterier som er ens bortset fra indholdet af plasmider. Seks dyr blev først doseret med sporer af recipientstammen fire dage i træk, ugen efter fik dyrene så donorstammen som sporer fire dage i træk. Donorstammen indeholdt det konjugative plasmid pXO16, som i laboratoriet overføres med meget høj frekvens til recipientstammen. Halvdelen af dyrene blev aflivet dagen efter sidste dosering med donorstammen og de resterende tre en uge efter.
Der blev detekteret transkonjuganter (dvs. recipienter som har modtaget plasmidet pXO16 fra donoren) i alle dyr ved den første aflivning (Figur 16). Som det ses af figuren (store standardafvigelser) dækker tallene over store individuelle forskelle i specielt antallet af donorer og transkonjuganter i de enkelte dyr. Der blev dog fundet transkonjuganter i alle dyr i alle tarmafsnit, på nær et dyr hvor der ikke kunne detekteres transkonjuganter i den øverste del af tyndtarmen (duodenum). Ved aflivning en uge efter sidste dosering med donorstammen blev der kun fundet få donorceller og ingen transkonjuganter.
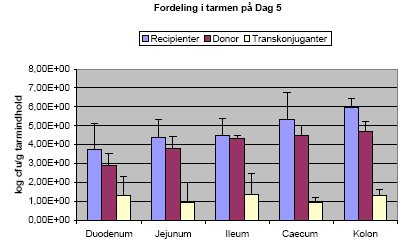
Figur 16. Antallet af recipienter, donorer og transkonjuganter i de forskellige tarmafsnit ved aflivning dagen efter sidste dosering med donorstammen. Gennemsnit af tre dyr.
Transkonjuganterne blev isoleret ved at plade ud på selektive plader, som kun transkonjuganterne kunne vokse på. For at sikre at det var ægte transkonjuganter og ikke spontane mutanter, blev der lavet plasmid-oprensninger som blev undersøgt ved gel-elektroforese. Dette viste at alle transkonjuganter var ægte transkonjuganter indeholdende plasmidet pXO16 (Figur 17).
Figur 17. Gelbillede af transkonjuganter opnået i dyreforsøg med en Bt subsp. israelensis donor med det konjugative plasmid pXO16 og en Bt subsp. israelensis recipient. Bane 1 og 14: vildtypestamme af Bt subsp. israelensis (AND508), Bane 2: recipient, Bane 3: donor, Bane 4-13: transkonjuganter. Det konjugative plasmid pXO16 kan svagt detekteres i donorstammen (rød ring), i den oprindelige vildtypestamme, samt i alle transkonjuganter.
3.4.2 Opsummering
Forsøget med kimfri rotter viste at Bt stammer er i stand til at udveksle plasmider in vivo i en tarm fra pattedyr. Forsøget viste dog også at bakterier indeholdende det konjugative plasmid, pXO16, ikke havde en vækstfordel i tarmmiljøet, da der i slutningen af forsøget primært kunne detekteres recipientstammer i dyrene, kun få donorstammer og ingen transkonjuganter.
4 Diskussion
- 4.1 Overlevelse og spiring i tarmen
- 4.2 Påvirkning af den eksisterende bakteriepopulation
- 4.3 Dannelse af enterotoksiner i tarmen
- 4.4 Overførsel af DNA i tarmen
For at øge vores viden om den sundhedsmæssige effekt af oral indtagelse af mikrobiologiske plantebeskyttelsesmidler baseret på Bt er flg. punkter blevet undersøgt i rotter fodret med Bt: 1) overlevelse og spiring i tarmen, 2) ændring af den eksisterende bakteriesammensætning, 3) enterotoksinproduktion i tarmen og 4) genoverførsel i tarmen. Resultaterne fra de enkelte punkter vil blive diskuteret grundigt i det følgende.
4.1 Overlevelse og spiring i tarmen
Forsøgene viste, at i rotter fodret med vegetative celler af Bt eller den nærtbeslægtede B. cereus genfandtes ingen eller kun få bakterier i fæces og tarm. Forsøg med sporer og vegetative celler af B. cereus og Bt subsp. kurstaki i simuleret mavevæske viste, at de vegetative celler hurtig blev dræbt. Dette er i overensstemmelse med et andet studie [Clavel et al., 2004], som viste at under pH 4,5 har vegetative celler af B. cereus og Bt svært ved at overleve. Derfor kan den manglende genfindelse af B. cereus og Bt forklares ved at de vegetative celler ikke overlever passagen gennem mavesækken. Plantebeskyttelsesmidler baseret på Bt bliver sprøjtet ud som sporer, som viste høj overlevelse i den kunstige mavevæske selv ved pH 1,5.
Overlevelse gennem mavesækken kan dog ændres hvis bakterierne indtages sammen med fødevarer. Eksempelvis vil fedtholdige fødevarer beskytte bakterierne, så også vegetative celler kan overleve. [Clavel et al., 2004] har vist, at B. cereus celler har en bedre overlevelse i mælk ved lav pH end i andre undersøgte medier. Denne bedre overlevelse kan skyldes at bakterierne bliver fanget i hydrofobe fedtmolekyler, der yder beskyttelse gennem maven [Conway et al., 1987]. Mange fødevarer kunne give den samme beskyttelse for vegetative celler som mælk gør. Endvidere har studier vist at tolerance over for lav pH kan induceres ved at dyrke B. cereus ved subletalt pH [Jobin et al., 2002], f.eks. ved tilberedning af mad. Endelig kan pH i maven under visse omstændigheder være højere, f.eks. hos ældre mennesker, i slutningen af et måltid og ved visse sygdomstilstande. Derfor kan det ikke udelukkes at også vegetative celler kan overleve passagen gennem maven og give anledning til effekter i tarmen.
I modsætning til de vegetative celler viste sporerne god overlevelse gennem maven, og i mange tilfælde kunne bakterien detekteres i fæces selv to uger efter sidste dosering. I de kimfri dyr med Bt subsp. israelensis, var der spiring og vækst af de indgivne sporer i alle dyr. I HFA dyrene kan det kun med sikkerhed siges at være sket i ét dyr fodret med sporer af Bt subsp. kurstaki, hvor der fandtes op til 104 CFU/g i alle tarmafsnit og bakterien kunne endvidere detekteres i milten.
I overensstemmelse med vores resultater har også andre vist at Bacillus sporer er i stand til at overleve og nogle gange spire i mave-tarmkanalen. Tre B. cereus stammer er blevet vist at kunne overleve i mave-tarmkanalen på konventionelle mus 18 dage efter sidste dosering [Duc et al., 2004]. Ligeledes viste et andet dyreforsøg med konventionelle mus at antallet af Bacillus subtilis sporer var højere i fæces end det indgivne antal [Hoa et al., 2001]. Ved at anvende et sensitivt revers transkriptase-PCR assay til detektion af vegetative celler i tyndtarmen blev det endvidere vist, at Bacillus subtilis sporer spirer i mave-tarmkanalen på mus [Casula and Cutting, 2002]. Sporer er ligeledes blevet detekteret i smågrise fodret med vegetative celler [Jadamus et al., 2001]. Sammen med resultaterne fra vores undersøgelse indikerer det, at sporer kan spire i den nærings-rige tyndtarm, gro og efterfølgende sporulere i det mere nærings-fattige og barske miljø i tyktarmen, hvor vandaktiviteten er lav.
Genfindelsen af Bt og B. cereus hele to uger efter sidste dosering kan også skyldes bakteriens evne til at hæfte sig til tarm-cellerne. Studier har vist at bakterier af B. cereus gruppen er mere hydrofobe end andre Bacillus grupper [Ronner et al., 1990] og desuden er overfladen dækket af filamenter [Husmark and Ronner, 1992], som gør dem i stand til at binde til tarmcellerne.
Translokationen af Bt subsp. kurstaki fra tarm til milt i ét dyr ud af seks kræver yderligere studies for at klarlægge risikoen for en sådan translokation. I andre studier har man også isoleret Bt fra organer, men forfatterne af sådanne studier påstår at disse fund skyldes efterfølgende kontamination [McClintock et al., 1995]. Dette kan udelukkes i dette studie, bl.a. fordi milt og lever er taget ud af dyrene før tarmene er åbnet. B. cereus gruppen er kendt for at producere forskellige virulensfaktorer, som f.eks. hæmolysiner, fosfolipaser og cytolysiner [Drobniewski, 1993] som kan destruere værtens vævskomponenter og dermed være involveret i invasion af bakterien. B. cereus kan være årsag til andet end mave-tarm infektioner, både lokalt og systemisk i følsomme befolkningsgrupper som f.eks. immunsvækkede patienter, og også Bt har været associeret med to ikke-mavetarm infektioner, en sår- og en øjeninfektion [Drobniewski, 1993].
4.2 Påvirkning af den eksisterende bakteriepopulation
Et aspekt ved risikovurdering af plantebeskyttelsesmidler baseret på Bt kunne være bakteriens evne til at påvirke sammensætningen af den tilstedeværende normale tarmflora. Bakterier i B. cereus gruppen er kendt for at danne forskellige produkter, der kan have en effekt på andre bakterier, og enkelte underarter af B. cereus anvendes som probiotika til dyr og mennesker, hvor de menes at have en gunstig effekt på sammensætningen af bakterier i tarmen.
Der blev kun observeret få og midlertidige ændringer af den omkringliggende bakterieflora, og vi kan konkludere, at påvirkningen af den normale tarmflora er minimal. Nogle stammer af B. cereus bliver som nævnt brugt som probiotika til mennesker og dyr og et studie med en sådan probiotisk stamme har vist en effekt på E. coli og enterokok populationen [Gedek et al., 1993]. Endvidere er der blevet påvist en signifikant reduktion af koliforme bakterier i tarmprøver fra smågrise fodret med en probiotisk B. cereus stamme (Jadamus et al, 2002). Den samme reduktion af koliforme bakterier har vi observeret i vores forsøg med B. cereus, dog var reduktionen kun midlertidig. Det er usikkert hvorvidt denne påvirkning af den eksisterende bakteriepopulation skyldes vegetative celler eller sporer af B. cereus og Bt. Som forsøgene viser, er bakterierne i de fleste dyr primært tilstede som sporer, og det er derfor sandsynligt, at det er disse, der er ansvarlige for ændringerne, evt. ved at binde sig til tarmepitelceller og derved optage plads for andre bakterier.
I to rotter fodret med sporer af Bt subsp. kurstaki sås en ændring af bakteriesammensætningen i fæces under dosering analyseret vha. DGGE. Dette gælder for dyr 7 fra Hold 2 og dyr 15 fra Hold 3, som begge i perioder har en højere koncentration af Bt subsp. kurstaki i fæces end de andre dyr. I prøverne taget under dosering er der bånd der bliver kraftigere på DGGE gelen sammenlignet med prøverne før dosering. Kloning og sekventering af disse bånd viste op til 99% identitet med Faecalibacterium prausnitzii, en dominerende gruppe i normal human fæcesflora. F. prausnitzii er en butyrat-producerende bakterie, som menes at danne energi til tarmepitelceller og som har en god indflydelse på sundhedstilstanden i tyktarmen. Da der ses en stigning af denne bakterie i doseringsperioden kunne det tyde på, at Bt subsp. kurstaki har en positiv effekt på netop denne bakterie og dermed indirekte på tyktarmens sundhedstilstand.
4.3 Dannelse af enterotoksiner i tarmen
Vero-celle assay på de anvendte stammer viste at den højeste toksin-aktivitet fandtes i Bt subsp. israelensis, formodentlig pga. et nonspecifikt cytotoksisk toksin, der dannes samtidig med insekttoksinet. Plantebeskyttelsesmidler der indeholder denne stamme bruges i Danmark kun på prydplanter. De andre kommercielle stammer der indgik i undersøgelsen, Bt subsp. kurstaki og Bt subsp. tenebrionis, som benyttes til plantebeskyttelse på spiselige afgrøder (hvoraf kun Bt subsp. kurstaki er tilladt på det danske marked), havde en lavere toksin-aktivitet end det B. cereus isolat (F4433/73), der også indgik i undersøgelsen, og som har givet anledning til diarré hos mennesker [Granum et al., 1993].
Dannelse af enterotoksiner i tarmen blev kun observeret i et dyr. Dyret stammede fra forsøgene med kimfri rotter fodret med sporer af Bt subsp. israelensis. Enterotoksinproduktion blev fundet i den midterste del af tyndtarmen både vha. Vero-celle assay og det kommercielle kit, som detekterer en komponent af det hæmolytiske BL toksin. At der ikke kunne detekteres Vero-toksisk aktivitet i de resterende dyr kan skyldes, at vegetative former af de tilsatte bakterier ikke fandtes i tilstrækkelig høj koncentration i tyndtarmen, hvor produktionen af enterotoksiner menes at ske [Granum and Lund, 1997]. De indledende forsøg viste, at der skal være mindst 106 bakterier per ml til stede for at der kan detekteres cytotoksisk effekt på Vero-celler, og i tyndtarmsprøverne fandt vi højst 104 bakterier per g tarmindhold.
Desuden er vi usikre på, om pH forholdene i en normal fungerende tarm er optimale for toksinproduktion, idet det er vist, at en B. cereus stamme ikke dannede L2 komponenten af enterotoksin HBL ved pH5 og 6, men ved pH7 blev komponenten dannet [Jobin et al., 2002]. Denne observation understøtter desuden, at i tilfælde af høj pH værdi i mavesækken (og dermed i tarmen) vil dette, udover at give god overlevelse af bakterierne, også være gunstig for dannelse af enterotoksiner i tarmen.
4.4 Overførsel af DNA i tarmen
En vigtig faktor ved risikovurdering af bakterier anvendt som plantebeskyttelsesmidler er deres evne til at overføre genetisk information til andre bakterier. Her tænkes i første omgang især på gener der koder for resistens overfor antibiotika, men også for andre gener, som f.eks. toksin-gener, er det vigtigt at vide hvorvidt de er overførbare.
For Bt vides det at generne for insekttoksinet oftest sidder på plasmider, der kan overføres til andre Bt, hvilket er årsagen til den store diversitet der ses i arten Bt. Arten er nært beslægtet med Bacillus anthracis, hvis virulens skyldes to store plasmider, pXO1 og pXO2, der ligesom insekttoksin-plasmiderne fra Bt kan overføres mellem medlemmer af B. cereus familien. Det nære genetiske slægtskab mellem arterne af B. cereus familien er blevet underbygget ved DNA sekvens-bestemmelse af et Bt plasmid, og denne har vist stor lighed med pXO2 plasmidet fra B. anthracis [Van der Auwera et al., 2005]. Foruden ligheden med pXO2 havde plasmidet også lighed med plasmider fra andre Gram-positive arter, hvilket sandsynliggør, at DNA-udveksling mellem forskellige arter foregår i naturen.
Udveksling af plasmider vha. konjugation blandt B. cereus arterne er blevet observeret i laboratoriet og i tarmen på insekter, men dette studie er det første, der viser at konjugation også kan ske i en pattedyrs tarm. Da forsøget er blevet udført i en worst-case model med høje koncentrationer af donor og recipient er der dog behov for yderligere studier for at konkludere om overførsel af DNA fra Bt også vil ske i tarmen hos mennesker.
Da der er fundet genetisk lighed mellem plasmider fra Bt og andre Gram-positive bakterier, kunne det være interessant at gentage forsøget, hvor tarmbakterier, f.eks. enterokokker, blev brugt som recipienter.
5 Perspektiver
- 5.1 Anbefalinger til Miljøstyrelsen vedr. risikovurdering af Bt midler
- 5.2 Anbefalinger til fremtidig forskningsindsats
5.1 Anbefalinger til Miljøstyrelsen vedr. risikovurdering af Bt midler
Generelt giver denne undersøgelse ikke grund til øget bekymring omkring de Bt midler, der er på det danske marked i dag. Selvom Bt subsp. kurstaki (som anvendes på grøntsager) kan spire i tarmen, danner stammen ikke høje koncentrationer af celle-dræbende toksiner under de anvendte in vitro dyrkningsbetingelser. Dog kræver den observerede passage til milten hos ét af dyrene flere studier af netop denne stamme, og evt. de andre kommercielle stammer på det europæiske marked, for at klarlægge om en sådan passage også kan ske i mennesker.
I ingen af forsøgene blev dyrene påvirket af at blive fodret med bakterierne, endog ikke i det forsøg hvor der blev fodret med en human patogen stamme af B. cereus. Dette viser begrænsningen i at anvende rotter til at vurdere den humane virulens af Bt. Ved fremtidige risikovurderinger af Bt baserede insekticider anbefales det derfor, at man lægger større vægt på undersøgelser af toksicitet i in vitro assays (f.eks. PCR analyser for virulensgener, celle-assays), og mindre vægt på rotteforsøg. Denne undersøgelse viser dog, at dyreforsøg er anvendelige til at undersøge bl.a. bakteriens evne til at kolonisere tarmen, påvirkning af den omkringliggende tarmflora og udveksling af DNA med andre bakterier.
Da stammer af samme art kan være helt forskellige, anbefales det, at der anvendes en case-by-case vurdering af hver enkelt stamme, hvor der også bliver taget hensyn til brugen af det endelige produkt – f.eks. sprøjtning af enten grøntsager eller prydplanter. Eksempelvis viste nærværende undersøgelse at Bt subsp. israelensis har høj cytotoksisk effekt, men da stammen i Danmark kun anvendes i forbindelse med produktion af potteplanter, er det næppe et problem for den almindelige forbruger, men kan være et arbejdsmiljø-problem, hvis ikke der anvendes tilstrækkelige værnemidler.
5.2 Anbefalinger til fremtidig forskningsindsats
Det er uvist hvorvidt fundet i milten hos rotter efter indtagelse af sporer af Bt subsp. kurstaki skyldes en egenskab ved stammen eller om overgangen er individ-afhængig (f.eks. dyrets immunstatus, omkringliggende tarmflora etc.). Dette nødvendiggør yderligere forskning for at teste evnen af de kommercielle stammer til at passere mave-tarm barrieren og nå andre organer.
Metode-indkøring af Vero-celle assayet viste, at enterotoksinproduktionen af de enkelte stammer var meget afhængig af dyrkningsbetingelserne. Dette kræver yderligere studier for at bestemme under hvilke forhold Bt producerer enterotoksiner, specielt hvilke abiotiske og biotiske faktorer i fødevarer og mave-tarm miljøet der stimulerer enterotoksin-produktionen. Endvidere er det relevant at undersøge de forskellige metoder til bestemmelse af enterotoksinproduktion. Herunder er interaktioner mellem bakterier og betydningen af dette for toksindannelse og infektion i den humane tarm stort set ukendt. Den enkelte bakteries evne til at konkurrere i et komplekst mikrobielt miljø kan vise sig at have en signifikant betydning for en risikovurdering.
Som beskrevet i diskussionsafsnittet kan en række forhold bevirke, at de vegetative celler overlever passagen gennem maven, og en undersøgelse af disse forhold kunne også være interessant. Kunne man forestille sig, at når mennesker får diarré forårsaget af B. cereus er det i virkeligheden er de vegetative celler der har vokset i fødevaren og produceret enterotoksiner, der giver problemer i tarmen og ikke sporerne? Der bør derfor foretages studier af betydningen af fødens sammensætning, f.eks. fedtindholdet, for overlevelse af vegetative bakterier under mave-passagen.
Forsøg med rotter er i øjeblikket det primære redskab til at teste sikkerheden ved nye mikrobiologiske bekæmpelsesmidler både i Danmark og i EU, men vores og andres resultater viser at rotteforsøg ikke er den bedste metode til at afsløre sygdomsfremkaldende egenskaber hos bakterier. Der er derfor behov for yderligere forskning i hvilke metoder man skal anvende til at bestemme virulensen af bakterier anvendt som mikrobiologiske bekæmpelsesmidler. Alternative virulensmodeller, som f.eks. nematoden Caenorhapditis elegans bør overvejes.
Udveksling af plasmider vha. konjugation blandt B. cereus arterne er blevet observeret i laboratoriet og i tarmen på insekter, men dette studie er det første, der viser at konjugation også kan ske i en pattedyrstarm. Da forsøget er blevet udført i en worst-case model med høje koncentrationer af donor og recipient er der dog behov for yderligere studier for at konkludere, om overførsel af DNA fra Bt også kan ske i tarmen hos mennesker. Da der er fundet genetisk lighed mellem plasmider fra Bt og andre Gram-positive bakterier, er det endvidere oplagt at udføre et forsøg, hvor tarmbakterier, f.eks. enterokokker, bliver brugt som recipienter.
6 Konklusion
Vores resultater viser, at en del af Bt sporerne, som anvendes i plantebeskyttelsesmidler, uden tvivl spirer og danner vegetative bakterier i rotternes mave-tarmsystem. Varmebehandling øger ikke spiringen og overlevelsen. Tilstedeværelsen af vegetative celler betyder at der er en risiko for at Bt fra plantebeskyttelsesmidler kan give diarré. Heldigvis viste resultaterne også, at der dannes mindre diarré-toksin fra de typer af Bt, som anvendes til bekæmpelse af insektlarver på spiselige afgrøder (subsp. kurstaki), end fra dem, som i Danmark kun bruges på prydplanter (subsp. israelensis). Faktisk var toksinmængden så lav, at den ikke kunne måles i tarmen. Det så heller ikke ud til, at Bt cellerne medførte væsentlige ændringer i sammensætningen af den omgivende tarmflora.
Samlet set betyder disse resultater, at det ikke kan udelukkes at plantebeskyttelsesmidler baseret på Bt kan forårsage diarré hos forbrugerne, og at det er vigtigt at undersøge mængden af toksindannelse, før man godkender nye Bt-baserede midler. Det kan også tages med i en samlet vurdering, at man ved at bruge Bt-midlerne sandsynligvis sparer natur og mennesker for de kemiske pesticider, som udgør alternativet.
I undersøgelserne blev Bt sammenlignet med den nært beslægtede bakterie Bacillus cereus, som ofte er årsag til madforgiftning. Denne bakterie gav ikke diarré hos rotterne, og det var ikke muligt at måle dannelse af diarré-toksin i prøver fra tarmen. Forsøg med rotter er i øjeblikket det primære redskab til at teste sikkerheden ved nye biologiske bekæmpelsesmidler, både i Danmark og i EU. Vores og andres resultater viser imidlertid at rotteforsøg ikke er den bedste metode til at afsløre sygdomsfremkaldende egenskaber hos en bakterie, og der foregår da også pt. overvejelser vedrørende dette i EU’s organ til varetagelse af fødevaresikkerhed (European Food Safety Authority). Man kan ved at basere risikovurderingen på andre metoder dels opnå en bedre forbrugersikkerhed, og dels spare nogle rotteliv.
Referencer
Casula G, Cutting SM (2002) Bacillus probiotics: spore germination in the gastrointestinal tract. Appl Environ Microbiol 68: 2344-2352
Christensen BB, Sternberg C, Andersen JB, Eberl L, Moller S, Givskov M, Molin S (1998) Establishment of new genetic traits in a microbial biofilm community. Appl Environ Microbiol 64: 2247-2255
Clavel T, Carlin F, Lairon D, Nguyen-The C, Schmitt P (2004) Survival of Bacillus cereus spores and vegetative cells in acid media simulating human stomach. J Appl Microbiol 97: 214-219
Conway PL, Gorbach SL, Goldin BR (1987) Survival of lactic acid bacteria in the human stomach and adhesion to intestinal cells. J Dairy Sci 70: 1-12
Damgaard PH (1995) Diarrhoeal enterotoxin production by strains of Bacillus thuringiensis isolated from commercial Bacillus thuringiensis-based insecticides. FEMS Immunol Med Microbiol 12: 245-250
Drobniewski FA (1993) Bacillus cereus and related species. Clin Microbiol Rev 6: 324-338
Duc lH, Hong HA, Barbosa TM, Henriques AO, Cutting SM (2004) Characterization of Bacillus probiotics available for human use. Appl Environ Microbiol 70: 2161-2171
Dunn AK, Handelsman J (1999) A vector for promoter trapping in Bacillus cereus. Gene 226: 297-305
Feitelson JS, Payne J, Kim L (1992) Bacillus thuringiensis: insects and beyond. Biotechnology 10: 271-275
Gedek B, Kirchgessner M, Wiehler S, Bott A, Eidelsburger U, Roth FX (1993) [The nutritive effect of Bacillus cereus as a probiotic in the raising of piglets. 2. Effect and microbial count, composition and resistance determination of gastrointestinal and fecal microflora]. Arch Tierernahr 44: 215-226
Granum PE, Brynestad S, Kramer JM (1993) Analysis of enterotoxin production by Bacillus cereus from dairy products, food poisoning incidents and non-gastrointestinal infections. Int J Food Microbiol 17: 269-279
Granum PE, Lund T (1997) Bacillus cereus and its food poisoning toxins. FEMS Microbiol Lett 157: 223-228
Hansen, B. M, Damgaard, P. H., Eilenberg, J., and Pedersen, J. C. Bacillus thuringiensis. Ecology and environmental effects of its use for pest control. 316. 1996. Danish Environmental Protection Agency. Environmental project.
Ref Type: Report
Hendriksen, N. B. and Binnerup, S. Mikrobiologiske bekæmpelsesmidler i planteproduktionen - muligheder og risici. 14/1997. 1997. Danmarks Miljøundersøgelser. Tema-rapport.
Ref Type: Report
Hirayama K, Itoh K (2005) Human flora-associated (HFA) animals as a model for studying the role of intestinal flora in human health and disease. Curr Issues Intest Microbiol 6: 69-75
Hoa TT, Duc LH, Isticato R, Baccigalupi L, Ricca E, Van PH, Cutting SM (2001) Fate and Dissemination of Bacillus subtilis Spores in a Murine Model. Appl Environ Microbiol 67: 3819-3823
Hofte H, Whiteley HR (1989) Insecticidal crystal proteins of Bacillus thuringiensis. Microbiol Rev 53: 242-255
Husmark U, Ronner U (1992) The influence of hydrophobic, electrostatic and morphologic properties on the adhesion of Bacillus spores. Biofouling 5: 335-344
Jadamus A, Vahjen W, Simon O (2001) Growth behaviour of a spore forming probiotic strain in the gastrointestinal tract of broiler chicken and piglets. Arch Tierernahr 54: 1-17
Jensen, G. B., Andrup, L., Jacobsen, B. L., and Larsen, P. Mikrobiologiske insektbekæmpelsesmidler. 53. 2001. Copenhagen, National Institute of Occupational Health. AMI Rapport.
Ref Type: Report
Jobin MP, Clavel T, Carlin F, Schmitt P (2002) Acid tolerance response is low-pH and late-stationary growth phase inducible in Bacillus cereus TZ415. Int J Food Microbiol 79: 65-73
McClintock JT, Schaffer CR, Sjoblad RD (1995) A comparative review of the mammalian toxicity of Bacillus thuringiensis-based pesticides. Pestic Sci 45: 95-105
Melling J, Capel BJ, Turnbull PC, Gilbert RJ (1976) Identification of a novel enterotoxigenic activity associated with Bacillus cereus. J Clin Pathol 29: 938-940
Muyzer G, Smalla K (1998) Application of denaturing gradient gel electrophoresis (DGGE) and temperature gradient gel electrophoresis (TGGE) in microbial ecology. Antonie Van Leeuwenhoek 73: 127-141
Normander B, Christensen BB, Molin S, Kroer N (1998) Effect of bacterial distribution and activity on conjugal gene transfer on the phylloplane of the bush bean (Phaseolus vulgaris). Appl Environ Microbiol 64: 1902-1909
Pedersen JC, Damgaard PH, Eilenberg J, Hansen BM (1995) Dispersal of Bacillus thuringiensis var. kurstaki in an experimental cabbage field. Can J Microbiol 41: 118-125
Ronner U, Husmark U, Henriksson A (1990) Adhesion of Bacillus spores in relation to hydrophobicity. J Appl Bacteriol 69: 550-556
Spinosa MR, Braccini T, Ricca E, De Felice M, Morelli L, Pozzi G, Oggioni MR (2000) On the fate of ingested Bacillus spores. Res Microbiol 151: 361-368
Van der Auwera GA, Andrup L, Mahillon J (2005) Conjugative plasmid pAW63 brings new insights into the genesis of the Bacillus anthracis virulence plasmid pXO2 and of the Bacillus thuringiensis plasmid pBT9727. BMC Genomics 6: 103.
Bilag A
- 1.1 Kort over anvendt plasmid
- 1.2 Fremstilling af dosis-kulturer
- 1.3 DNA oprensning fra fæcesprøver
- 1.4 Anvendte primere og DGGE betingelser
- 1.5 DGGE kørsel
- 1.6 Sekventering af bånd fra DGGE geler
- 1.7 DGGE data fra B. cereus forsøget
- 1.8 DGGE data fra Bt subsp. kurstaki forsøget
- 1.9 DGGE data fra Bt subsp. israelensis forsøget
- 1.10 Formidling relateret til projektet
- 1.11 Trykt publikation
1.1 Kort over anvendt plasmid

1.2 Fremstilling af dosis-kulturer
Levende sporer (Hold 2):
1. Fra plade podes i 100 ml sporulationsmedium i ½ liter flaske tilsat rifampicin (20 μmg/ml) eller streptomycin (40 μmg/ml).
2. Inkuberer med ryst ved 30 °C i 1 uge, indtil ca. 90% af cellerne har dannet sporer, se fasemikroskopi.
3. Deles ud i 4 store centrifugerør. Centrifugerer ved 2000 g i 20 min ved 4 °C.
4. Supernatanten fjernes og der resuspenderes i koldt 96 % ethanol.
5. Der centrifugeres og supernatanten fjernes. Sporerne resuspenderes i koldt sterilt vand.
6. Herefter renses sporerne yderligere 2 gange ved skiftende centrifugering (2000 g, 20 min, 4 °C) og vask med sterilt vand.
7. Genopløs i 8 ml FKP, og frys ned ved –80 °C.
Stråledræbte sporer ( Hold 1): Sporerne stråledræbes ved 50 kGray
Varmeaktiverede sporer (Hold 3): Sporerne behandles ved 80 °C i 15 min i portioner på 1½ ml på varmeblok
Vegetative celler (Hold 4):
1. Fra plade podes en koloni i 2 x 10 ml LB kultur tilsat rifampicin (50 mg/ml) eller streptomycin (100 μmg/ml).
2. Rørene inkuberes n.o. ved 37°C med ryst.
3. Cellerne centrifugeres ned, vaskes 2 gange i sterilt vand, og genopløses i FKP.
Sporulationsmedie (Kim & Naylor, 1966):
Per liter: Nutrient broth (Oxoid CM1) 8 g
Yeast extract (Oxoid L21) 4 g
MnCl2-4H2O (Merck) 10 mg
Dest. Vand 1000 ml
Ingredienserne blandes, evt. under opvarmning. pH justeres til 7,2. Bouillonen fyldes i flasker som autoklaveres.
1.3 DNA oprensning fra fæcesprøver
a) Homogenisering af fæces og fjernelse af debris
1. 1,5 ml af 10-1 fortyndingen centrifugeres ved 200 x g (2100 rpm) i 2 min.
2. Supernatanten overføres til et nyt rør og centrifugeres ved 12.000 x g (5500 rpm) i 5 min.
3. Supernatanten suges fra og pellet opløses i 1,2 ml TE-buffer (ved at suge væske op og ned med pipetten)
b) Mekanisk homogenisering og SDS behandling
1. Prøven overføres til et 2ml eppendorfrør med Zirconia beads (står på køl i kølerum)
2. 30 μl 10% SDS tilsættes og prøven rystes i 4 min. i bead beater på High speed
3. Prøven centrifugeres ved 1000 x g (4500 rpm) i 20 sek.
c) Oprensning af DNA (Qiagen Mini Stool DNA kit)
1. 1,4 ml (mest muligt) supernatant overføres til et nyt rør
2. Opbevar ved -20°C eller fortsæt direkte oprensningen.
3. Tilsæt 1 InhibitEX tablet til hver prøve og vortex straks i 1min. eller indtil tabletten er fuldstændigt opløst. Inkuber 1 min. ved stuetemperatur for at tillade inhibitorer at absorbere til InhibitEX matrixen.
4. Centrifuger prøven i 3 min. ved 13.000 rpm (20000 x g) for at fælde fæces partikler og inhibitorer bundet til Inhibit EX
5. Overfør straks supernatanten til et 1,5ml eppendorfrør og smid pellet ud. Centrifuger i 3 min. ved 13.000 rpm (20000 x g) for at fjerne resterende partikler/pellet
6. Apipeter 15 μl Proteinase K i et 1,5ml eppendorfrør og tilsæt 200 ml supernatant fra trin 5
7. Tilsæt 200 μl buffer AL og vortex i 15 sek.
8. Inkuber ved 70°C i 10 min. Centrifuger kort for at fjerne dråber fra låget
9. Tilsæt 200 μl 96% ethanol til lysatet og vortex. Centrifuger kort for at fjerne dråber fra låget.
10. Mærk låget af QIAamp kolonnen siddende i et 2 ml opsamlingsrør. Tilsæt forsigtigt lysatet fra trin 9. Luk låget og centrifuger i 1 min. ved 13.000 rpm (20000 x g).
11. Åben forsigtigt QIAamp kolonnen og tilsæt 500 ml AW1. Luk låget og centrifuger i 1 min. ved 13.000 rpm (20000 x g). Placer QIAamp kolonnen i et nyt 2ml opsamlingsrør og smid røret med filtratet ud.
12. Åben kolonnen og tilsæt 500 μl AW2. Luk låget og centrifuger i 3 min. ved 13.000 rpm (20000 x g).
13. Overfør kolonnen til et 1,5 ml eppendorfrør og afpipeter 200 μl AE direkte ned i midten af QIAamp membranen.
14. Inkuber i 3 min. ved stuetemperatur og centrifuger derefter i 1 min. ved 13.000 rpm (20000 x g) for at eluere DNAét. Opbevar DNAét ved -20°C.
1.4 Anvendte primere og DGGE betingelser
| Primere | Sekvens | PCR produkt/bp | DGGE | Målgruppe | Reference: |
| HDA1-GC | GC-clamp*-ACT CCT ACG GGA GGC AGC AGT | 200 | 25-65%, 9% PAAG |
Alle bakterier | Walter et al., 2000 |
| HDA2 | GTA TTA CCG CGG CTG CTG GCA C | ||||
| Bact. 596F | TCA GTT GTG AAA GTT TGC G | 287 | 35-55%, 9% PAAG |
Subgruppe af Bacteroides | Vanhoutte et al., 2004 |
| Bact. 826R-GC | GC-clamp**-GTR TAT CGC MAA CAG CGA | ||||
| Bact-0011 | AGA GTT TGA TYM TGG CTC AG | 716 nested PCR: 200 bp |
25-65%, 9% PAAG |
Lactobacillus group | Heilig et al., 2002 |
| Lab-0677 | CAC CGC TAC ACA TGG AG | ||||
| g-Bifid F | CTC CTG GAA ACG GGT GG | 596 | 40-70% 9% PAAG |
Bifidobacterium | Matsuki et al., 2002; Vanhoutte et al., 2004 |
| g-Bifid R-GC | GC-clamp**-GGT GTT CTT CCC GAT ATC TAC A |
*GC-clamp: CGC CCG GGG CGC GCC CCG GGC GGG GCG GGG GCA CGG GGG G
**GC-clamp: CGC CCG CCG CGC CCC GCG CCC GGC CCG CCG CCC CCG CCC C
Referencer:
Heilig, H.G., Zoetendal, E.G., Vaughan, E.E., Marteau, P., Akkermans, A.D. and de Vos, W.M. 2002. Molecular diversity of Lactobacillus spp. and other lactic acid bacteria in the human intestine as determined by specific amplification of 16S ribosomal DNA. Appl. Environ. Microbiol. 68:114-123.
Matsuki, T., Watanabe, K., Fujimoto, J., Miyamoto, Y., Takada, T., Matsumoto, K., Oyaizu, H. and Tanaka, R. 2002. Development of 16S rRNA-gene-targeted group-specific primers for the detection and identification of predominant bacteria in human feces. Appl. Environ. Microbiol. 68:5445-5451.
Vanhoutte, T., Huys, G., De Brandt, E. and Swings, J. 2004. Temporal stability analysis of the microbiota in human feces by denaturing gradient gel electrophoresis using universal and group-specific 16S rRNA gene primers. FEMS Microbiol. Ecol. 48:437-446.
Walter, J., Tannock, G.W., Tilsala-Timisjarvi, A., Rodtong, S., Loach, D.M., Munro, K. and Alatossava, T. 2000. Detection and identification of gastrointestinal Lactobacillus species by using denaturing gradient gel electrophoresis and species-specific PCR primers. Appl. Environ. Microbiol. 66:297-303.
1.5 DGGE kørsel
Fremstilling af UF (opløsninger til DGGE)
Alle opløsninger fremstilles i stinkskab, da de er meget giftige
9% acrylamid: acrylamidebis 37.5:1
500ml 100% UF:
112,5 ml 40% premix AABIS
10 ml 50 x TAE
210 g urea
200 ml formamid
500ml 0% UF
112,5 ml 40% premix AABIS
10 ml 50 x TAE
377,5 ml milliporevand
De ønskede gradienter (f.eks. 25% og 65%) dannes udfra 0% og 100% opløsningerne.
Fremstilling af acrylamid gel i gradientblander:
- 18 ml gradient
- 190 μl 10% APS, amoniumpersulfat
- 11 μl Temed
Blandes i gradientblander:
Den laveste gradient f.eks (25%) blandes i det venstre rør og luftboblen fjernes ved at åbne for gennemstrømning og derefter suge indholdet i modsatte rør op.
Derefter kommes den stærkeste f.eks (65%) gradient i højre rør og 10 % APS tilsættes hver rør, Der tændes for magnetomrøreren og rørene flyttes så der er optimal omrøring i begge rør.
Til sidst tilsættes Temed til hvert rør. (får gelen til at stivne).
Påsætning af prøver:
Brøndene renses forsigtigt med buffer (1*TAE) ved at bufferen suges op i en engangssprøjte og sprøjtes forsigtigt ud i brønden. Alle brønde skylles 2 gange.
Derefter tilsættes prøverne forsigtigt til brøndene efter et fastlagt skema.
Hver prøve indeholder 16μl .(13μl prøve og 3μl farvemiks).
Markør: Invitogen Cat no: 15628-050. fortyndes 20gange. (På gel ,6μl og 1μl farve)
Start af DGGE apparat:
DGGE apparatets top kommes oven på karret og der tændes for apparatet.
Temperaturen sættes til 60°C
Gelen kører i 16 timer ved 36 V og 28 mA.
Farvning af DGGE gel:
Farvebad fremstilles ved, at ½ l 1 * TAE blandes med 24ml flourecrom farvestof i specielt farvekar. Gelen på glaspladen kommes i farvebadet og farves fra 45 minutter til 1 ½ time.
Foto af gel:
Gelen (på glasplade) løftes forsigtigt op ad vandbadet, og der kommes vand på lyspladen.
Overskydende vand fjernes og billede tages (ved både 302nm UV-B og 254nm UV-C)(invert)
Sikkerhed:
Der bruges handsker under hele arbejdet.
Alle sikkerhedsblade skal læses inden der arbejdes med DGGE, da mange af opløsningerne er meget giftige.
Gelen kasseres til Z-affald.
Div. opløsninger mærkes med faremærker.
1.6 Sekventering af bånd fra DGGE geler
1. Udskæring
2. S1 nuklease behandling
3. PCR+kloning
4. Elektroporation
5. Oprensning af plasmider
6. PCR-DGGE
7. Sekventering
1. Udskæring
- De ønskede bånd udskæres sterilt under UV-lampen – BESKYT ansigt og hænder!
- Placeres i sterile eppendorfrør hvortil der tilsættes 40 ml sterilt vand. DNA’et eluerer ud i vandet ved inkubering natten over ved 4°C
2. S1 nuklease behandling (Tannock et al., 2004)
- 33 ml af vandet (som indeholder DNA’et) behandles med 3 ml S1 nuklease (400 U/ml, Roche) og 4 ml 10x buffer (330 mM NaAc, 500 mM NaCl, 0.3 mM ZnSO4, pH 4.5) i 1 time ved 37 °C
- Reaktionen stoppes ved at varme blandingen ved 95°C i 5 min.
- Prøver opbevares ved -80°C indtil videre brug
3. PCR + kloning (Knarreborg et al., 2002; Walter et al., 2000)
- S1 behandlet DNA bruges i en PCR med HDA1/2 primerne (uden GC-clamp):
HDA-kort: 94°C i 4 min
20 cycler: 94°C i 30 sek
56°C i 30 sek
68°C i 60 sek
68°C i 7 min.
- Til kloning benyttes TOPO TA Cloning Kit for Sequencing (Invitrogen), findes i -20°C fryser (F112).
- Bland 4 μl friskt PCR produkt med 1 μl fortyndet Salt Solution og 1 μl TOPO vector.
- Bland og inkuber 5 min på bordet ved stuetemperatur
- Placer blandingen på is.
4. Elektroporation
- Fremstil LB plader med ampicillin (50 mg/μl)
- Bland 2 μl fra kloningsreaktionen med 1 rør One Shot Electrocompetent E. coli (lille -80°C fryser)
- Overfør forsigtig blanding til kold elektroporationskuvette (Coli-lab)
- Elektroporation på Ec2 (Coli-lab)
- Tilsæt straks 250 μl opvarmet (37°C) S.O.C. medium (følger med kittet).
- Overfør blandingen til et 15 ml centrifugerør og ryst 1 time ved 37°C med løst låg.
- Udplad 20 og 200 μl på selektiv plade (LB +amp) og inkuber natten over ved 37 °C.
5. Plasmidoprensning
- Udvælg 5 kolonier fra hver plade og oprens plasmider v.h.a. Qiagen Mini Spin Prep.
6. PCR-DGGE
- Kør PCR med HDA1-GC/HDA2 primerne på programmet HDA-kort.
- Kør DGGE gel og sammenlign med oprindelig bånd, der blev skåret ud.
- Gem den stamme, som kun indeholder et bånd, og som befinder sig i den korrekte position.
7. Sekventering
- PCR produkt eller plasmid-oprensning sendes til MWG i Tyskland til sekventering. Primerne T3 og T7 kan bruges til sekventering.
Referencer:
Knarreborg, A., Simon, M.A., Engberg, R.M., Jensen, B.B. and Tannock, G.W. 2002. Effects of dietary fat source and subtherapeutic levels of antibiotic on the bacterial community in the ileum of broiler chickens at various ages. Appl. Environ. Microbiol. 68:5918-5924.
Tannock, G.W., Munro, K., Bibiloni, R., Simon, M.A., Hargreaves, P., Gopal, P., Harmsen, H. and Welling, G. 2004. Impact of consumption of oligosaccharide-containing biscuits on the fecal microbiota of humans. Appl. Environ. Microbiol. 70:2129-2136.
Walter, J., Tannock, G.W., Tilsala-Timisjarvi, A., Rodtong, S., Loach, D.M., Munro, K. and Alatossava, T. 2000. Detection and identification of gastrointestinal Lactobacillus species by using denaturing gradient gel electrophoresis and species-specific PCR primers. Appl. Environ. Microbiol. 66:297-303.
1.7 DGGE data fra B. cereus forsøget
Klik her for at se figurer1.8 DGGE data fra Bt subsp. kurstaki forsøget
Figur 1.8.1. DGGE af Dyr 1 fra Hold 1. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
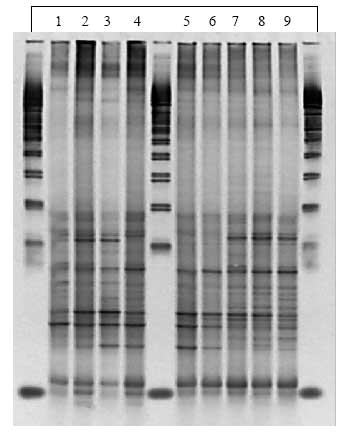
Figur 1.8.2. DGGE af Dyr 2 fra Hold 1. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
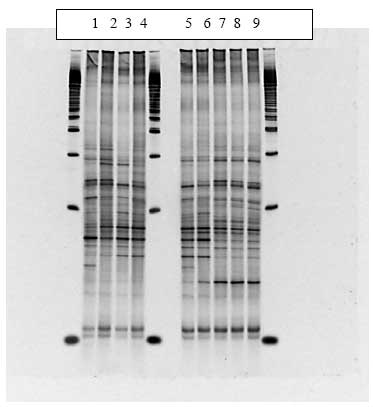
Figur 1.8.3. DGGE af Dyr 7 fra Hold 2. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
Figur 1.8.4. DGGE af Dyr 8 fra Hold 2. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
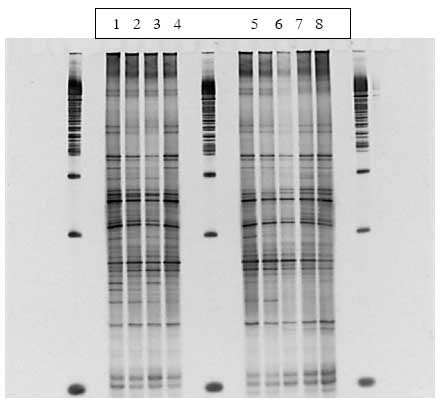
Figur 1.8.5. DGGE af Dyr 14 fra Hold 3. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
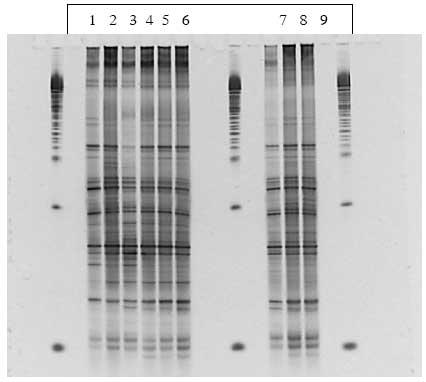
Figur 1.8.6. DGGE af Dyr 15 fra Hold 3. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
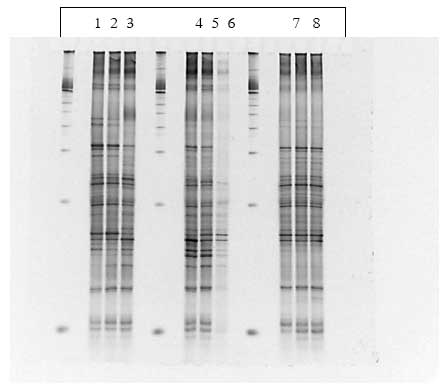
Figur 1.8.7. DGGE af Dyr 20 fra Hold 4. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
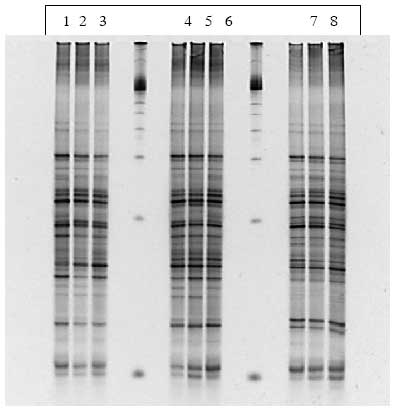
Figur 1.8.8. DGGE af Dyr 21 fra Hold 4. Bane 2-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-8: prøver efter dosering.

1.9 DGGE data fra Bt subsp. israelensis forsøget
Figur 1.9.1. DGGE af Dyr 2 fra Hold 1. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.

Figur 1.9.2. DGGE af Dyr 3 fra Hold 1. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7: prøve efter dosering.
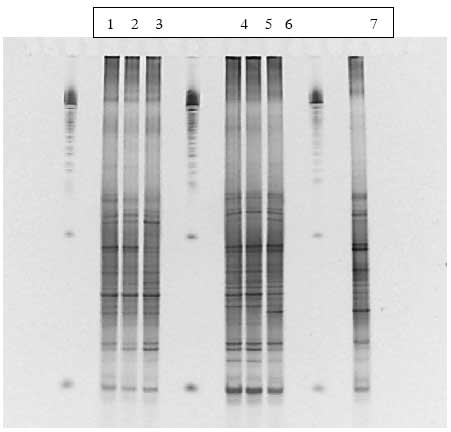
Figur 1.9.3. DGGE af Dyr 8 fra Hold 2. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-8: prøver efter dosering.
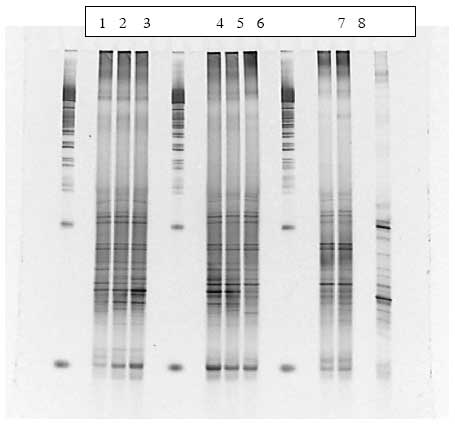
Figur 1.9.4. DGGE af Dyr 9 fra Hold 2. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
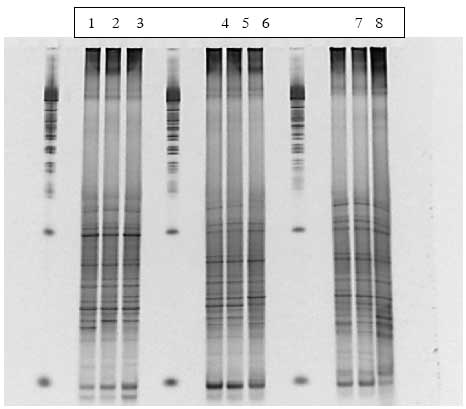
Figur 1.9.5. DGGE af Dyr 13 fra Hold 3. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
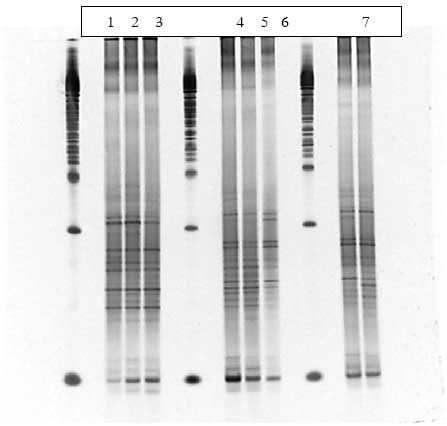
Figur 1.9.6. DGGE af Dyr 15 fra Hold 3. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering
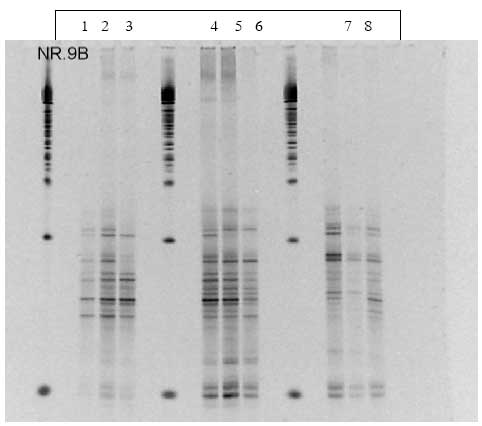
Figur 1.9.7. DGGE af Dyr 20 fra Hold 4. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering
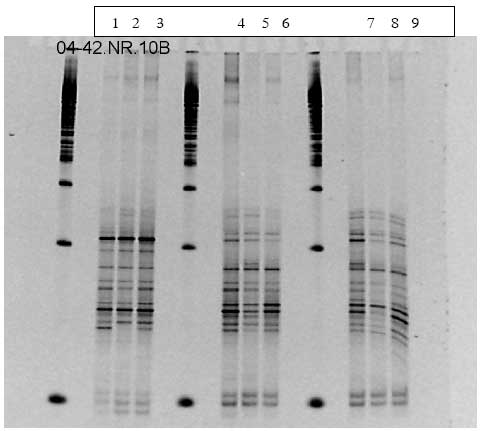
Figur 1.9.8. DGGE af Dyr 21 fra Hold 4. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering
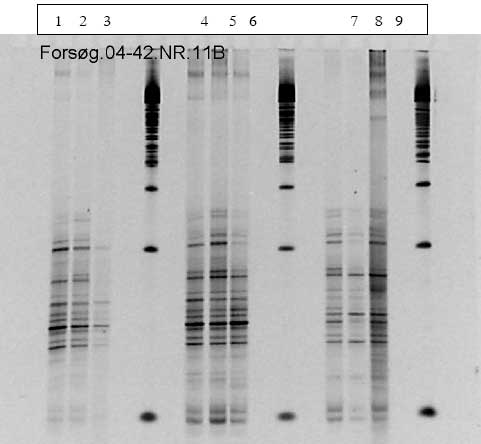
1.10 Formidling relateret til projektet
Trykte publikationer
Wilcks, A., Hansen, B.M., Hendriksen, N.B. and Licht, T.R. 2006. Fate and effect of ingested Bacillus cereus spores and vegetative cells in the intestinal tract of human-flora-associated rats. FEMS Immunol. Med. Microbiol. 46:70-77.
Wilcks, A., Hansen, B.M., Hendriksen, N.B., and Licht, T.R. Persistence of Bacillus thuringiensis in the gut of human-flora-associated rats. FEMS Immunol. Med. Microbiol. (accepteret, september 2006).
Wilcks, A., Smidt, L., Bahl, M.I., Hansen, B.M., Andrup, L., Hendriksen, N.B., and Licht, T.R. Colonization and conjugation of Bacillus thuringiensis subsp. israelensis in the intestine of gnotobiotic rats (foreløbig title). Manuskript under udfærdigelse.
Abstrakts
Wilcks, A., Smidt, L., Bahl, M.I., Hansen, B.M., Andrup, L., Hendriksen, N.B., and Licht, T.R. Germination and conjugation of Bacillus thuringiensis subsp. israelensis in the intestine of gnotobiotic rats. Gut microbiology: research to improve health, immune response and nutrition. Aberdeen, UK, juni 2005.
Licht, T.R., Wilcks, A., Rosenquist, H., Andersen, S.R., Hendriksen, N.B., Hansen, B.M., Smidt, L. and Andrup, L. 2003. Presentation of a future project: The fate of biopesticides in the human gut. Poster ved AMI-seminar om biologiske insekticider. København, november 2003.
Foredrag
Wilcks, A., Smidt, L., Bahl, M.I., Hansen, B.M., Andrup, L., Hendriksen, N.B., and Licht, T.R. Germination and conjugation of Bacillus thuringiensis subsp. israelensis in the intestine of gnotobiotic rats. COST 862 Workshop: Ecology of Bacteria used for Insect Control. Goniadz, Polen, maj 2006.
Wilcks, A., Smidt, L., Bahl, M.I., Hansen, B.M., Andrup, L., Hendriksen, N.B., and Licht, T.R. Germination and conjugation of Bacillus thuringiensis subsp. israelensis in the intestine of gnotobiotic rats. LMC Symposium on Food Microbiology. Gl. Avernæs, maj 2006.
Wilcks, A. 2005. Fate and effect of B. thuringiensis based insecticides in the human gut. COST 862 workshop: Bacterial toxins for insect control. Nitra, Slovakiet, september 2005.
Wilcks, A. 2004. Fate and effect of B. thuringiensis in rats. DMU workshop: Health and environmental risks by the use of organisms for biological control of pests and disease in agriculture. Helsingør, november 2004.
Licht, T.R. 2004. Mikrobiologiske plantebeskyttelsesmidlers skæbne i mave-tarmkanalen. Miljøstyrelsens pesticidforskningsseminar. Kolding, januar 2004.
Publikationer og præsentationer indirekte relateret til projektet
Frederiksen, K., Rosenquist, H., Jørgensen, K., and Wilcks, A. 2006. Occurrence of natural Bacillus thuringiensis contaminants and residues of Bacillus thuringiensis-based insecticides on fresh fruits and vegetables. Appl. Environ. Microbiol. 72:3435-3440.
Rosenquist, H., L. Smidt, S.R. Andersen, G.B. Jensen and A. Wilcks. 2005. Occurrence and significance of Bacillus cereus and Bacillus thuringiensis in ready-to-eat food. FEMS Microbiol. Lett. 250:129-136.
Johansen, J.E., Hu, X., Hansen, B.M., Yuan, Z. and Eilenberg, J. Bioassay with mosquitos for evaluation of transconjugant Bacillus spp. containing the pBtoxis plasmid. Poster ved 37th Annual Meeting of the Society of Invertebrate Pathology & 7th International Conference on Bacillus thuringiensis Helsinki, Finland, August 1-4, 2004.
Licht, T. Biological control – assessment of health risks. Foredrag ved DMU-arrangeret workshop November 2004: ‘Health and environmental risks by the use of organisms for biological control of pests and diseases in agriculture’.
Hansen, B.M. Enterotoxins – a potential risk of using B. thuringiensis products? Foredrag ved DMU-arrangeret workshop November 2004: ‘Health and environmental risks by the use of organisms for biological control of pests and diseases in agriculture’.
Hansen, B.M. and Hendriksen, N.B. 2004. Emetic toxin and enterotoxins – a potential risk of using B. thuringiensis products. Præsentation ved 37th Annual Meeting of the Society of Invertebrate Pathology & 7th International Conference on Bacillus thuringiensis. Helsinki, Finland, August 1-4, 2004.
Hendriksen, N.B. Occurrence of microbial pest control agents in food. Foredrag ved DMU- arrangeret workshop November 2004: ‘Health and environmental risks by the use of organisms for biological control of pests and diseases in agriculture’.
Hendriksen, N.B. and Hansen, B.M. Occurrence of Bacillus cereus and B. thuringiensis in field plots with curly kale (Brassica oleracea acephala). Poster ved 37th Annual Meeting of the Society of Invertebrate Pathology & 7th International Conference on Bacillus thuringiensis Helsinki, Finland, August 1-4, 2004.
Hu, X., Hansen, B.M., Eilenberg, J., Hendriksen,, N.B., Smidt, L., Yuan, Z. and Jensen, G.B. Conjugative transfer, stability and expression of a plasmid encoding a cry1Ac gene in Bacillus cereus group strains. Poster ved 37th Annual Meeting of the Society of Invertebrate Pathology & 7th International Conference on Bacillus thuringiensis Helsinki, Finland, August 1-4, 2004.
Rosenquist, H. The occurrence of B. thuringiensis in food. Foredrag ved DMU-arrangeret workshop November 2004: ‘Health and environmental risks by the use of organisms for biological control of pests and diseases in agriculture’.
1.11 Trykt publikation



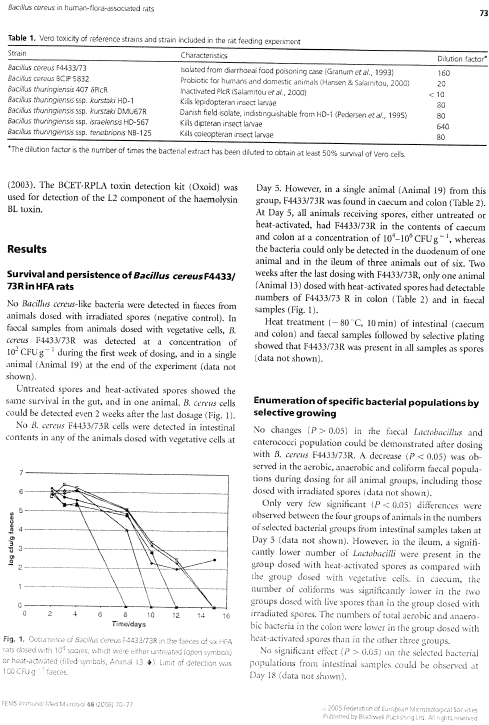
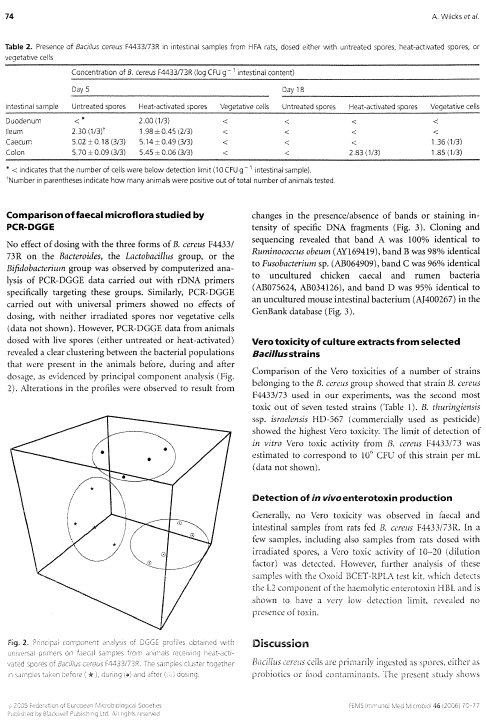
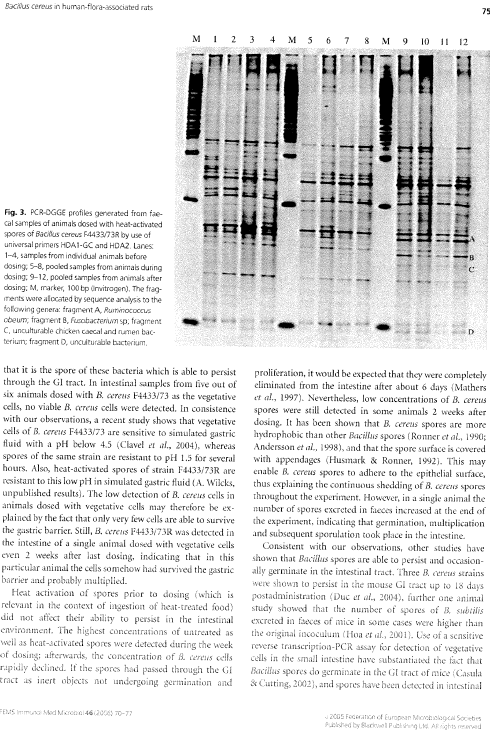


Version 1.0 Januar 2007 • © Miljøstyrelsen.