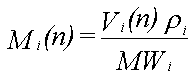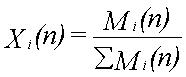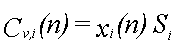Udvikling af metode til testning af udvaskning af organiske stoffer fra jord og restprodukter
2. Opløselighedsstyret udvaskning fra frie faser
2.1 Konceptuel model
I et system med fri fase vil den frie fase altid kontrollere koncentrationen af organiske stoffer i vandfasen og derved også koncentrationen af stof sorberet til jorden samt i en eventuel luftfase. Når der er blevet udvasket så meget stof, at der ikke længere er fri fase tilbage i jorden, er koncentrationen af stof i vandfasen derefter kontrolleret af ligevægt (sorption/desorption) med jorden. Hvis den frie fase indeholder flere stoffer, vil sammensætningen af stofferne i den frie fase ændres i løbet af udvaskningsforløbet, da stofferne med den højeste opløselighed i vand udvaskes hurtigst. Når sammensætningen af den frie fase derfor ændres, vil koncentrationen i vandfasen ændres, hvilket medfører, at koncentrationen på jorden og i luften ligeledes ændres.
2.2 Styrende mekanismer
2.2.1 Opløselighed af enkeltstoffer
Koncentrationen af et stof i vand, som er i ligevægt med en fri fase, bestående udelukkende af dette ene stof, svarer til opløseligheden af stoffet. Opløseligheden af et stof afhænger af temperatur og vandets indhold af andre stoffer, som eksempelvis salte (Miljøstyrelsen 1996). Tabel 2.1 indeholder eksempler på opløseligheden af udvalgte organiske stoffer. Det fremgår tydeligt af tabel 2.1, at opløseligheden varierer meget mellem forskellige stoffer.
Tabel 2.1
Opløseligheden i vand ved 20-25°C af udvalgte stoffer (Miljøstyrelsen 1996).
| Stof | Opløselighed (mg/l) |
| Phenol | 84.000 |
| Benzen | 1760 |
| o-Xylen | 180 |
| Naphthalen | 31 |
| Phenanthren | 1,2 |
| Pyren | 0,14 |
| Benz(a)pyren | 0,0038 |
2.2.2 Opløselighed af stofblandinger
Det er sjældent, at en forurening kun består af ét stof. Når der er flere stoffer i den frie fase, beregnes ligevægtskoncentrationen ud fra Rauolt's lov (f.eks. Miljøstyrelsen 1996):
|
(2.1) |
hvor
Ci er ligevægtskoncentrationen af stof i vand
xi er molfraktionen af stof i den frie fase
Si er opløseligheden af stof i vand.
Molfraktionen er defineret i ligning 2.6.
Opløseligheden, Si, der benyttes i Raoult's lov, er den normale opløselighed for de stoffer, der er væsker ved den aktuelle temperatur. For stoffer, der er faste ved den aktuelle temperatur, men som normalt er en væske ved blanding med andre væsker, benyttes den såkaldte underafkølede opløselighed, der beregnes som (f.eks. Miljøstyrelsen 1996):
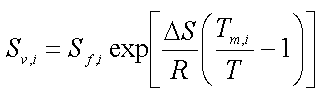 |
(2.2) |
hvor
Sv,i er den beregnede opløselighed for stof i
Sf,i er opløseligheden af det faste stof i i vand
D S er fusionsentropien
R er gaskonstanten
Tm,i er smeltepunktet for stof i (K)
T er den aktuelle temperatur (K).
Forholdet mellem D S og R kan, hvis det ikke kendes, sættes
til 6,8.
I tabel 2.2 er der angivet eksempler på faststofopløseligheder og de dertil svarende underafkølede opløseligheder. Det fremgår af tabellen, at der er stor forskel på de to typer af opløselighed (op til en faktor 40 for benz(a)pyren).
Tabel 2.2
Eksempler på udregning af den underafkølede opløselighed. Faststofopløseligheder
og smeltepunkter er fra Miljøstyrelsen (1996).
| Stof | Faststof- opløselighed (mg/l) |
Smeltepunkt (°C) |
Underafkølet opløselighed ved 20°C (mg/l) |
| Naphthalen | 31 | 81 | 128 |
| Phenanthren | 1,2 | 98 | 7,3 |
| Pyren | 0,14 | 156 | 3,3 |
| Benz(a)pyren | 0,004 | 178 | 0,16 |
Rauolt's lov udtrykt ved ligning 2.1 gælder for blandinger af stoffer af ensartet
karakter. Den simple udgave af Raoult's lov gælder bl.a. for blandinger af klorerede
opløsningsmidler (Broholm og Feenstra 1995) og blanding af octan og methylcyclohexan
(Burris og MacIntyre 1985), hvorimod eksempelvis opløselighederne i blandinger af octan
og naphthalen, methylnaph-thalener eller dimethylnaphthalener ikke kan beregnes eksakt ud
fra dette udtryk (Burris og MacIntyre 1985). Disse afvigelser er imidlertid i de fleste
tilfælde mindre end en faktor 2.
Hvis der er interaktioner mellem stofferne, ændres Rauolt's lov til:
|
(2.3) |
hvor g i er aktivitetskoefficienten for stof i.
Aktivitetskoefficienterne kan estimeres ved hjælp af f.eks. UNIFAC, der er en forkortelse for Universal Quasi Chemical Functional Group Activity Coefficients Method. UNIFAC er en semi-empirisk model baseret på et princip om forskellige kemiske gruppers bidrag til aktivitetskoefficienter i relation til deres struktur. Fordelen ved metoden er, at aktivitetskoefficienterne kan estimeres for et hvilket som helst kemisk stof, hvis blot stoffet består af nogle grupper, som UNIFAC kender konstanterne for. UNIFAC- metoden blev introduceret af Fredenslund (Fredenslund et al. 1977) og er siden blevet udvidet og forbedret (Skjold-Jørgensen et al. 1979; Gmehling et al. 1981). I dag findes UNIFAC som et PC-program.
2.3 Beregning af udvaskningen fra en fri fase
Til illustration af det dynamiske i udvaskningen beregnes udvaskningsforløbet fra 12,2 ml fri fase, der består af benzen (8,2 vol-%), phenol (82,0 vol-%), naphthalen (8,2 vol-%) og phenanthren (1,6 vol-%). Deres opløseligheder er henholdsvis 1760, 84000, 31 og 1,2 mg/l (Miljøstyrelsen 1996). Beregningen foregår trinvist. Det første grundvand, der kommer i ligevægt med den frie fase, indeholder de ved hjælp af Raoult's lov beregnede ligevægtskoncentrationer. Da koncentrationen af phenol er størst, fjernes der mere phenol, end der fjernes af de øvrige stoffer fra den frie fase. Dette medfører, at molfraktionen i den frie fase ændres med tiden. Dette problem kan matematisk ikke løses eksakt, men det er relativt enkelt at beregne koncentrationsændringerne numerisk i et regneark. Det nødvendige ligningssystem er følgende:
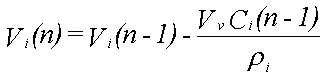 |
(2.4) |
|
(2.5) |
|
(2.6) |
|
(2.7) |
hvor
Vi(n) er volumenet af stof i til beregningstrin n
Ci(n) er væskekoncentrationen af stof i til beregningstrin n
Vv er volumenet af vand i ligevægt med den frie fase
Mi(n) er antallet af mol af stof i til beregningstrin n
xi(n) er molfraktionen af stof i til beregningstrin n
r i er massefylden af stof i
MWi er molvægten af stof i
Si er opløseligheden af stof i.
I ligning 2.4 beregnes de nye volumener af stoffer i den frie fase ud fra informationer om de gamle volumener og ligevægtskoncentrationer. Ud fra de nye volumener omregnes dernæst antallet af mol (ligning 2.5). Herefter beregnes de nye molfraktioner (ligning 2.6) og de nye ligevægtskoncentrationer (ligning 2.7). Til beregningstrin 1 benyttes begyndelsesvolumenet af de enkelte stoffer og begyndelsesligevægtskoncentrationerne, som er beregnet ved hjælp af Raoult's lov.
Volumnet af vand i ligevægt med den frie fase, Vv, er en beregningsstørrelse, hvis størrelse i forhold til volumnet af den frie fase bestemmer, hvor hurtigt beregningerne forløber, og hvor præcise de er. Hvis Vv er lille, bliver beregningerne mere præcise, men til gengæld kræver det flere beregningstrin. Vv svarer til en bestemt tid, som afhænger af grundvandshastigheden og fordelingen af den frie fase i forhold til strømningsretningen.
Figur 2.1 viser resultatet af beregningen for en blanding på i alt 12,2 ml fri fase, der består af benzen (8,2 vol-%), phenol (82,0 vol-%), naphthalen (8,2 vol-%) og phenanthren (1,6 vol-%). Figuren viser tydeligt det dynamiske opløsningsforløb, der er fra en kilde af fri fase, som indeholder flere stoffer. Phenol, som har den højeste opløselighed, opløses hurtigst fra kilden, hvorefter benzen, der er stoffet med den næsthøjeste opløselighed, fjernes næst hurtigst fra kilden. Koncentrationen af phenanthren, der har den laveste opløselighed blandt stofferne i dette eksempel, stiger i løbet af hele forløbet og falder først, når hele kilden af fri fase er opløst.

Figur 2.1
Beregnet udvaskningsforsøg for 12,2 ml fri fase bestående af benzen (8,2 vol-%),
phenol (82,0 vol-%), naphthalen (8,2 vol-%) og phenanthren (1,6 vol-%).
2.4 Kinetik
2.4.1 Batchforsøg
Det er centralt at kende den tidsperiode, der er nødvendig, før der opnås ligevægt i et batchudvaskningsforsøg. I litteraturen findes der afrapporteret to detaljerede undersøgelser, hvor koncentrationen i væskefasen er målt som funktion af tiden. Et af forsøgene omhandlede opløseligheden af BTEX fra benzin i vand med methanol eller MTBE og blev udført i en 60 ml glasflaske med ca. 55 ml vand og ca. 5 ml benzin. Flaskerne blev omrystet ved 10°C i forskellige tidsrum fra 30 min. til 50 timer. Forsøget viste, at 1 time næsten var tilstrækkelig til at opnå konstant koncentration i væskefasen, men kontakttiden blev valgt til 4 timer (Poulsen et al. 1991). Burris og MacIntyre (1985) undersøgte koncentrationen i vand som funktion af tiden i et system med en blanding af 1-methylnaphthalen og methylcyclohexan. Forsøget blev udført i en 500 ml glasflaske med 400 ml vand og 0,5-3 ml organisk fase. Flasken stod på en magnetomrører, der blev indstillet, således at overfladen mellem vandet og den organiske fase ikke blev væsentligt forstyrret. Ligevægt blev opnået i løbet af 24 timer, og mere end 90% af ligevægtskoncentrationerne blev opnået på 12 timer. En kontakttid på 12-24 timer benyttes ofte i opløselighedsforsøg med en eller anden form for omrøring (Eganhouse og Calder 1976; Leinonen og Mackay 1973). I et forsøg uden omrøring til bestemmelse af opløseligheden af trichlorethylen blev ligevægt opnået på mellem 5 og 19 dage i forsøg med 3 ml trichlorethylen og 14 ml vand (Broholm og Feenstra 1995).
Ovenstående kontakttider er anvendt til at opnå ligevægt i systemer uden jord eller andet faststof. Tilstedeværelsen af jord medfører ikke nødvendigvis længere kontakttider, hvis jorden omrøres så kraftigt, at den holdes i suspension. Indgår der derimod større klumper jord eller aggregater, som kan indeholde fri fase, vil dette forøge tiden til ligevægt, da sorptionsligevægt til jorden også skal indtræde.
2.4.2 Kolonneforsøg/naturlige systemer
I naturlige systemer er der sjældent ligevægt. At der ikke er ligevægt skyldes formentlig, at opholdstiden for vandet ikke er tilstrækkelig lang til, at en proces løber til ende. Dette skyldes enten hurtige strømningshastigheder, eller at fordelingen af de frie faser medfører en ringe kontakt mellem vand og den frie organiske fase. Den matematiske beskrivelse af opløsningskinetik er gennemgået i Miljøstyrelsen (1996) og vil derfor ikke blive gennemgået her. I grundvandet er det sandsynligt, at der er ligevægt ved grundvandshastigheder på mindre end 1 m/dag med zoner med frie faser, der har en udbredelse på mere end nogle få centimeter i strømningsretningen (Pankow og Cherry 1996).
2.5 Forudsigelser
Selve det dynamiske udvaskningsforløb ved tilstedeværelse af en fri fase kan let forudsiges ud fra en kendt sammensætning af den frie fase. Ligeledes kan det, hvis koncentrationen i jorden kendes, på basis af fasefordelingsberegninger forudsiges, om der er fri fase i prøven, og hvilken ligevægtskoncentration der vil forekomme i vandet. Det er imidlertid umuligt at forudsige væskekoncentrationen nedstrøms en forurening, fordi det ikke er alt vandet, der kommer i kontakt med den frie fase, og der er ikke nødvendigvis ligevægt. Fasefordelingsberegninger forudsætter et kendskab til egenskaberne af de organiske stoffer og jorden, og det er ikke altid let at fremskaffe sådanne oplysninger. Indholdet af naturligt organisk stof betyder meget for andelen af det stof, der sorberer til jorden. Dette kan medføre, at en jordprøve ud fra kendskab til totalt indhold af forureningsstoffer vurderes ukorrekt med hensyn til tilstedeværelsen af fri fase. Fasefordelingsberegninger og udvaskningsforløb er komplicerede at udføre for blandingsforureninger som diesel og tjære, fordi alle stofferne i blandingen ikke kendes.
2.6 Forhold af betydning for opløselighed/udvaskning
Opløseligheden af et stof afhænger af temperatur og vandets sammensætning. Det sidste har dog kun betydning i saltvand.
I stofblandinger kan ligevægtskoncentrationen i vand forudsiges ved at bruge Raoult's lov. Den simple udgave gælder for ideelle stofblandinger, men hvis den benyttes ved komplekse blandinger, vil fejlen ofte være mindre end en faktor 2.
Udvaskningen fra en kilde med blandingsforureninger kan let beregnes. Stoffet med den højeste opløselighed udvaskes hurtigst, hvorimod koncentrationen af stoffet med den mindste opløselighed vil stige i restfasen, indtil det hele er opløst.
Batchforsøg med forskellige typer af omrøring har vist, at det typisk tager mindre end 24 timer at opnå ligevægt i systemer, hvor der ikke er jord eller andet faststof til stede.
Ved udvaskningsforsøg med jord med fri fase vil koncentrationen i væsken være konstant, så længe der er fri fase til stede. Koncentrationen i væsken vil svare til opløseligheden. Dette vil som regel ikke være gældende for desorptionsstyret udvaskning.
Både batch- og kolonneudvaskningstests kan benyttes i situationer med fri fase. Det mest realistiske udvaskningsforsøg opnås med kolonneforsøg, hvorimod et batchforsøg vil give information om den maksimale udvaskelige mængde/koncentration. Hvis der skal opnås ligevægt i et batchudvaskningsforsøg med fri fase, kræves der formentlig en kontakttid på mindst 24 timer. Denne tid er dog svær at fastsætte præcist, da den afhænger af mængden af fri fase i forhold til vandmængden i udvaskningsforsøget og af agitationen.
Man kan eksperimentelt undersøge, om en jordprøve indeholder fri fase af et organisk stof, ved til en vandig suspension af prøven at tilsætte et farvestof, Sudan IV. Hvis der er en fri fase, vil farvestoffet fordele sig i og synliggøre denne. En indirekte metode er at vurdere koncentration i vandfasen og sammenligne denne med opløseligheden af stoffet eller stofferne.