|
Stimuleret in situ reduktiv deklorering. Vidensopsamling og screening af lokaliteter 3 Stimuleret reduktiv deklorering: Laboratorieforsøg
På basis af den tilgængelige videnskabelige litteratur præsenterer dette kapitel en oversigt over den viden om anaerob reduktiv deklorering, der er tilvejebragt via laboratorieforsøg. Litteraturindsamlingen, der danner basis for følgende afsnit, fremgår af appendiks A.1 Der er i alt udvalgt ca. 43 artikler, der beskriver forskellige laboratorieforsøg vedrørende anaerob reduktiv deklorering. De artikler, der er vurderet som de mest betydningsfulde, er markeret med gult. 3.1 Oversigt over laboratorieforsøgDer er udført en lang række laboratorieforsøg for at undersøge potentialet for at stimulere anaerob deklorering ved at tilsætte forskellige substrater. Ofte har formålet været at sammenligne effektiviteten af forskellige substrater samt at belyse hvilke faktorer, der styrer forskellige substraters egnethed. Laboratorieforsøg kan endvidere belyse, om et substrat udover at fungere som elektrondonor har en toksisk virkning overfor de deklorerende bakterier eller andre bakterier, der deltager i nedbrydningsprocessen. Substrater, der har været testet i laboratorieforsøg, inkluderer let omsættelige organiske stoffer som fx laktat, ethanol og propionat men også mere komplekse organiske stoffer som spiseolie, melasse og kompostekstrakt. Substraterne tilsættes i forsøgene i højere koncentration end det støkiometriske forhold, der er krævet til dekloreringsprocessen. Typiske substratkoncentrationer er i størrelsesordenen 2-5mM (se også afsnit 3.7.2). Tabel 3.1 viser et udsnit af laboratorieforsøg vedrørende reduktiv deklorering beskrevet i den videnskabelige litteratur. Laboratorieforsøgene er ofte udført som batchforsøg, dvs. flaskeforsøg i lukkede, opblandede systemer. Der udtages enten løbende prøver fra en flaske, eller der kan opstilles flere ens flasker, hvor hver flaske svarer til en prøve (høstforsøg) (se afsnit 3.7.2). Enkelte laboratorieforsøg er udført som søjleforsøg, hvilket giver mulighed for at studere nedbrydningsprocesserne i et flow-system. Disse systemer er mere naturtro, men også sværere at kontrollere. Langt de fleste laboratorieforsøg er udført med klorerede ethener, og der er kun lavet enkelte forsøg med 1,1,1-TCA. Mange af laboratorieforsøgene er udført med en bakteriekultur, der er blevet opformeret (dyrket) på PCE eller TCE. Ofte er slam fra anaerobe nedbrydnings-reaktorer på spildevandsrensningsanlæg anvendt som inokulum, eller der er anvendt sediment og grundvand fra PCE eller TCE-forurenede lokaliteter. I mange af disse studier ses fuldstændig deklorering af PCE eller TCE til ethen. I studier, hvor der kun ses nedbrydning til cis-DCE, er det i nogle tilfælde forsøgt at tilsætte opformerede bakteriekulturer med bakterier af typen Dehalococcoides, hvorefter der opnås nedbrydning til ethen. Nogle forsøg er udført med grundvand tilsat næringsmedie, mens andre forsøg er udført med en blanding af sediment og grundvand. Endvidere er der udført en række dyrkningsforsøg med renkulturer med henblik på at kortlægge egenskaber hos specifikke halorespirerende bakterier. I dette afsnit er sådanne studier tillagt mindre vægt, da disse studier ikke er udført med henblik på anvendelse i afværgeteknikker, men mere for at tilvejebringe specifik viden om halorespirerende bakterier. Yderligere er der udført laboratorieforsøg for at undersøge om andre forureningskomponenter som fx klorerede metaner kan have en toksisk virkning på nedbrydningen af klorerede ethener. Langt de fleste laboratorieforsøg er udført med bakteriekulturer i det mesofile temperatur.område (20-37°C), som er klart over danske grundvandstemperaturer (10°C, se afsnit 3.6.1). Tabel 3.1. Deklorering af klorerede ethener observeret i laboratorieforsøg tilsat forskellige elektrondonorer.
B: laboratorie batchforsøg K: kolonne forsøg R: anaerob reaktor Referencer. a: Ellis et al., 2000; b: El Mamouni et al., 2002; c: He et al., 2002; d: Fennel et al., 2001; e: Flynn et al., 2000; f: Richardson et al., 2002; g: Yang & McCarty, 1998; h: Wu et al., 1998; i: Duhamel et al., 2002; j: Yu & Semprini, 2002; k: Bolesch et al., 1997; l: Nielsen & Keasling, 1999. 3.2 Substrater - elektrondonorerI PCETCE-forurenede jord- og grundvandssystemer kan nedbrydning via reduktiv deklorering ofte stimuleres ved tilsætning af elektrondonorer. Stimuleringen kan også ske "naturligt" på lokaliteter, hvor der udover klorerede opløsningsmidler er spildt andre forureningskomponenter, som fx lossepladsperkolat eller olieforbindelser, der kan fungere som elektrondonor for de halorespirerende bakterier (se fx Miljøstyrelsen, 2000; Christensen et al., 2001). De fleste anaerobe halorespirerende bakterier kan anvende hydrogen som elektrondonor. Dehalococcoides ethenogens, der som de eneste kan deklorere PCE/TCE til ethen, anvender udelukkende hydrogen som elektrondonor. Stimulering af anaerob deklorering er derfor ofte forsøgt ved enten at tilsætte hydrogen direkte eller ved at tilsætte substrater, der via fermentering danner hydrogen (se afsnit 3.3). De mest brugte substrater er laktat, metanol, ethanol, butyrat, benzoat, propionat, og acetat. I tabel 3.2 er reaktionsligningerne for omdannelse af de enkelte substrater vist samt energigevinsten ved de forskellige reaktioner under standardbetingelser. Der er dog også udført forsøgt med organiske stoffer med kompleks sammensætning som valle, melasse, spiseolier, avispulp og træflis. Tabel 3.1 viser laboratorieforsøg med stimuleret deklorering af klorerede ethener ved tilsætning af forskellige elektrondonorer. Tilsætning af substrater som laktat og ethanol vil omsættes hurtigt, pga. det relativt høje energiudbytte sammenlignet med andre substrater (se tabel 3.2). Den hurtige fermentering vil medføre dannelse af høje koncentrationer af hydrogen, som kan udnyttes af de deklorerende bakterier. I laboratorieforsøg tilsat TCE sås en mere optimal deklorering ved tilsætning af en blanding af laktat og metanol, end når der tilsattes metanol alene (El Mamouni et al., 2002). For optimal stimulering af anaerob deklorering er den generelle hypotese, at dette opnås bedst ved tilsætning af et substrat, der fermenteres langsomt under dannelse af lave hydrogen niveauer. Under sådanne forhold med en stabil tilførsel af hydrogen vil de deklorerende bakterier være konkurrencedygtige over andre hydrogenforbrugende organismer fx metanogene bakterier (se afsnit 3.4). I laboratorieforsøg udført af Fennel et al. (1997) sås det, at tilsætning af smørsyre (syreformen af butyrat) og propionsyre resulterede i mindre metandannelse end ved tilsætning af ethanol og mælkesyre (syreformen af laktat), som genererede høje H2-nivauer. I korttidsforsøg (48 timer) tilsat ethanol og mælkesyre sås en hurtig og høj produktion af hydrogen, der medførte en hurtig initiel nedbrydning af PCE. Forbruget af hydrogen førte dog til nedsat deklorering, hvilket resulterede i ufuldstændig og langsom omdannelse af PCE. I langtidsforsøg (128 dage) var dekloreringshastigheden dog uafhængig af, om der var tilsat ethanol, mælkesyre, smørsyrer eller propionat, hvilket formentlig skyldtes, at en del af den tilsatte mælkesyre og ethanol omsattes til propionsyre, der langsomt fermenteredes under frigivelse af hydrogen. Yang og McCarty (1998) har sammenlignet nedbrydningen af cis-DCE ved tilsætning af hhv. propionat og benzoat. I forsøg tilsat propionat sås en tre gange højere produktion af ethen ved deklorering af cis-DCE sammenlignet med forsøg tilsat benzoat, hvor der til gengæld sås en tre gange højere produktion af metan. Ved stimulering af reduktiv deklorering ved tilsætning af substrat vil der være et tab pga. konkurrencen om hydrogen til andre ikke deklorerende bakterier. Sewell et al. (1991) har undersøgt nedbrydningen
af PCE i mikrokosmosforsøg med en blandingskultur tilsat toluen som substrat. De fandt, at under 10% af reduktionspotentialet dannet ved fermentering af toluen blev brugt til deklorering. Ballapragada et al.
(1997) fandt tilsvarende resultater i PCE-nedbrydningsforsøg udført i en fluidized-bed-reaktor tilsat en blandingskultur. Reaktoren blev tilsat forskellige fermentering baserede elektrondonorer og man fandt
at 95% af den producerede hydrogen blev brugt til andre porcesser end deklorering. Tabel 3.2. Reaktionsligninger for omsætning af substrater til H2 med angivelse af Gibbs fri energi (kJ pr reaktion) ved standardbetingelser (efter He et al, 2002; og Dolfing, 1988).
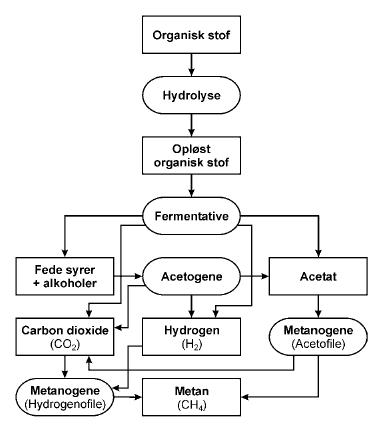
3.3 FermenteringFermentering er en redoxproces, hvor det enkelte substrat fungerer både som elektrondonor og elektronacceptor. Ved fermentering produceres generelt mindre energi per enhed substrat end ved oxidationsprocesser, hvor der indgår en ekstern elektronacceptor som fx ilt, nitrat eller klorerede stoffer. Bakteriel fermentering kan opdeles i to faser: primær og sekundær fermentering. Forløbet for fermentering af organisk stof er illustreret i figur 3.1. Ved primær fermentering vil fermenterende bakterier og svampe først nedbryde komplekst organisk materiale ved hydrolyse til primærsubstrater som sukkerstoffer, aminosyrer, og lipider, der herefter fermenteres til flygtige syrer (laktat, succinat, propionat, butyrat), alkoholer (ethanol, metanol), acetat, hydrogen, og kuldioxid. De fermentative bakterier er en stor heterogen gruppe af anaerobe og fakultative anaerobe bakterier. Tabel 3.3 viser nogle af de betydende reaktioner. Ved sekundær fermentering omdannes produkterne dannet under den primære fermentering af acetogene bakterier til acetat, hydrogen og kuldioxid (se tabel 3.3). De acetogene bakterier hører til gruppen af obligate protonreducerende bakterier, da der ved den sekundære fermentering dannes hydrogen for at balancere oxidationen af kulstofsubstrater. Ved fraværet af andre elektronacceptorer vil der dannes metan, som det sidste led i den anaerobe metabolisme (her optræder kulstof i sin mest reducerede form – oxidationstrin -4). De metanogene bakterier er obligat anaerobe og kræver lave redoxpotentialer. Metandannelse udføres af acetofile bakterier, der omdanner acetat til metan og kuldioxid eller af hydrogenofile bakterier, der omsætter hydrogen og kuldioxid til metan. Andre metanogene bakterier kan omdanne myresyre og metanol til metan. Den sekundære fermentering er kun energimæssig favorabel ved hydrogen koncentrationer under et niveau omkring 10-2 til 10-4 atm eller 8000 til 80nM opløst hydrogen (afhængig af hvilket substrat som fermenteres) (Wiedemeier et al., 1999). Dette betyder, at hvis den dannede hydrogen ikke forbruges af andre bakterier som fx de metanogene bakterier (hydrogenofile bakterier til metandannelse), vil de fede syrer dannet under den primære fermentering akkumuleres, hvilket kan medføre en forsuring af miljøet, og inhibering af de metandannende bakterier (Christensen et al., 1996). Dette samspil mellem de fermenterende bakterier og de hydrogenotrofe bakterier kaldes syntrofi, da begge typer af bakterier får udbytte af hinandens tilstedeværelse – de hydrogenforbrugende bakterier får leveret elektrondonor i form af hydrogen, mens omsætning af denne medfører at de fermentative bakterier kan nedbryde yderligere organisk materiale til vækst.
Figur 3.1. Mikrobiel nedbrydning af organisk materiale under anaerobe forhold (efter Christensen et al., 1996). Tabel 3.3. Anaerobe processer der omsætter organisk stof.
3.4 Mikrobiel konkurrence om hydrogenMange forskellige bakterier kan bruge hydrogen som elektrondonor: denitrificerende bakterier, jern (III)- og sulfatreducerende bakterier, metanogene samt halorespirerende bakterier (se tabel 3.4). Produktion af hydrogen ved fermentering er derfor ikke en garanti for, at hydrogen er til rådighed for de halorespirerende bakterier. For at deklorering kan forløbe, må de deklorerende bakterier konkurrere succesfuldt om den tilgængelige hydrogen med andre mikroorganismer. I litteraturen er anført typiske niveauer for hydrogenkoncentrationer, hvor forskellige redoxprocesser typisk er dominerende (tabel 3.5, se også diskussion i afsnit 4.2.2). Tabel 3.4. Reaktioner hvor H2 bruges som elektrondonor med angivelse af Gibbs fri energi (kcal/mol e-) under standforhold (Wiedemeier et al., 1999).
I laboratorieforsøg tilsat PCE resulterede tilsætning af ekstra metanol for at stimulere anaerob deklorering i vækst af metandannende bakterier frem for deklorerende bakterier (Stover, 1993). Tilsætning af yderligere metanol, ud fra tanken om at kompensere for det øgede forbrug, resulterede i, at dekloreringsprocessen gik helt i stå, fordi de deklorerende bakterier blev udkonkurreret af de metandannende bakterier. Tilsætning af ikke-metandannende substrater som organiske syrer, der kan fermenteres direkte til hydrogen, kan være en måde at undertrykke den direkte konkurrence med metanogene bakterier (Fennell og Gossett, 2003). Hydrogenotrofe deklorerende bakterier har en lavere tærskelværdi for hydrogen (omkring 1nM) end metanogene bakterier (5nM, tabel 3.5), og kan derfor udkonkurrere hydrogenotrofe metanogene bakterier ved lave hydrogen-koncentrationer (Smatlak et al., 1996). Tilsætning af elektrondonor i form af fede syrer (acetat, propionat, butyrat), som kun muligør produktion af hydrogen i lave koncentrationer (jvf. tabel 3.2) kan bruges til at kanalisere hydrogen til deklorering frem for metandannelse (Yang og McCarty, 1998; Fennell, et al, 1997). Konkurrence fra sulfat-reducerende bakterier er et mere komplekst problem. Sulfat-reducerende bakterier består af en divers gruppe af organismer, som kan udnytte mange forskellige organiske forbindelser udover hydrogen. Hydrogen-niveauer på mellem 1-15 nM er fundet i forbindelse med sulfatreduktion i flere laboratoriekulturer og sedimenter (Lovley og Klug, 1983; Mazur og Jones, 2001; Robinson og Tiedje, 1984). Hydrogenniveauet for deklorerende bakterier er lidt lavere men ikke væsentligt lavere end for de sulfat-reducerende bakterier (Ballapragada et al., 1997; Löffler et al., 1999, Smatlak et al., 1996). Fravær af deklorering er observeret i flere tilfælde under sulfat-reducerende forhold. Dette kan skyldes flere forhold: 1) direkte konkurrence om tilsatte organiske elektrondonorer, 2) inhibering af enzymer involveret i deklorering ved tilstedeværelse af sulfat, thiosulfat, sulfit eller sulfidioner, 3) selektiv brug af sulfat, thiosulfat eller sulfit som terminal elektronacceptor i respirationsprocessen i stedet for klorerede stoffer (se afsnit 2.3). I miljøer med højt sulfatindhold kan populationen af deklorerende bakterier være lav i forhold til populationen af sulfatreducerende bakterier. Ved tilsætning af elektrondonor kan H2 produktionen være så høj, at de deklorerende bakterier ikke kan bringe den så langt ned, at energigevinsten for sulfatreduktion falder under tærskelværdien. På trods af, at deklorering og sulfat-reduktion kan ske simultant under sådanne forhold, kan den stimulerende effekt ved tilsætning af donor være for lav til at se en effekt på nedbrydningen af klorerede stoffer. Når sulfat til sidst er opbrugt, vil hydrogenniveauet stige for en periode og stimulere væksten af den deklorerende population, hvilket vil medføre, at hydrogenniveauet falder til tærskelniveauet for de deklorerende bakterier. En startreduktion af sulfatniveauet kan forløbe forholdsvis hurtigt, mens der kan være en lag-periode før deklorering starter. Når sulfat er opbrugt kan visse sulfat-reducerende bakterier have evnen til fermentativ vækst på eksempelvis laktat og altså leve som en syntrofisk partner til de hydrogenotrofe deklorerende bakterier. Konkurrenceforhold mellem dehalogenerende bakterier og nitrat- eller jern(III)-reducerende bakterier er ikke undersøgt i særlig høj grad i systemer med nedbrydning af klorerede stoffer. Ud fra energimæssige betragtninger kan deklorering placeres mellem jern(III)- og nitrat-reduktion baseret på konkurrencen for hydrogen (Löeffler et al., 1999; Yager et al., 1997). Tabel 3.5. Hydrogen interval angivet som opløst hydrogen for en given terminal elektron accepterende proces. (Efter Lovley et al., 1994; Chapelle et al., 1995)
3.5 NedbrydningsraterI følgende afsnit præsenteres nedbrydningsrater for anaerob deklorering af klorerede ethener samt 1,1,1-TCA udført i laboratorieforsøg. Referencer er hentet fra både den grå og den videnskabelige litteratur og dækker primært nedbrydningsforsøg udført med grundvand og sediment. Nedbrydningsraterne samt under hvilke forsøgsbetingelser (forsøgs set-up, tilsat donor, temperatur) disse er fremkommet er vist i tabel 3.6. Nedbrydningsraterne er ikke umiddelbart sammenlignelige, da de opgives i forskellige enheder i forskellige referencer. I mange referencer er nedbrydningsforløbet blot beskrevet i ord og eventuelt vist grafisk, og der er ikke beregnet en specifik nedbrydningsrate. Dette kan ofte skyldes, at nedbrydningsforløbet ikke er velanalyseret (for få målepunkter), og nedbrydningskinetikken derfor ikke kan afgøres. Sådanne referencer er medtaget nederst i tabel 3.6, hvor der i stedet for en specifik rate fx er beskrevet efter hvor lang tid, der sås en vis procentdel nedbrydning eller, hvor tiden for fuldstændig omsætning til ethen er angivet. Nedbrydningsraten afhænger af mange forskellige faktorer som typen af elektrondonor, koncentration af donor, næringsstoffer, koncentration af klorerede stoffer, og temperatur, hvorfor det kan være vanskeligt at sammenligne rater fra forsøg, der er udført under forskellige forhold. Nedbrydningsraten vil også afhænge af, hvor mange bakterier, der er tilstede, hvorfor nedbrydningshastigheden ofte er relateret til biomassen, ofte angivet som gram protein eller gram VSS (volatile suspended solids). Ved sammenligning af nedbrydningsraterne for PCE opgjort per gram biomasse ses en relativ lille variation mellem 0,42 til 1,6 mol/mg protein/t, mens nedbrydningsraten for vinylklorid ligger mellem 0,11 til 3,36 mol/mg protein/t (se tabel 3.6). Disse rater er alle opnået i forsøg tilsat bakteriekulturer, der forinden er opdyrket på klorerede stoffer, og derfor er tilvænnet nedbrydning af disse stoffer. Ofte er biomassen dog ukendt og særligt i systemer, hvor der også indgår sediment, kan det være svært at analysere biomassen, da en del sandsynligvis vil være tilknyttet sedimentet. Endvidere skal man være opmærksom på, at det kun er en mindre del af den totale biomasse, der er direkte involveret i nedbrydningen af de klorerede stoffer, med mindre der er tale om en ren monokultur. Der er udført en del forsøg med sediment og grundvand fra forurenede lokaliteter med det formål at vurdere de naturligt tilstedeværende bakteriers evne til at nedbryde PCE/TCE til ethen. I flere af sådanne forsøg ses kun nedbrydning af TCE til cis-DCE. Endvidere forløber nedbrydningen ofte langsomt og først efter en lag periode. Af tabel 3.6 fremgår det, at nedbrydning af TCE til cis-DCE er observeret indenfor de første 25 til 75 dage. I andre forsøg ses fuldstændig nedbrydning af TCE til ethen, dog er der observeret meget forskellige nedbrydningshastigheder. I forsøg udført af He et al. (2002) sås fuldstændig nedbrydning af PCE og TCE til ethen indenfor 14 dage uafhængig af, hvilken elektrondonor der blev anvendt. Yager et al. (1997) observerede derimod først fuldstændig deklorering af TCE til ethen efter seks måneder. I forsøg, hvor der ikke er opnået fuldstændig deklorering indenfor en vis periode, er tilsat bakterier med formålet at undersøge muligheden for at stimulere processen. Til mange af forsøgene er tilsat bakteriekultur hentet fra en forurenet lokalitet, der efterfølgende er opformeret og dyrket på et næringsmedium tilsat elektrondonor og PCE/TCE. I sådanne forsøg kan man opnå høje nedbrydningsrater afhængig af, hvor god bakteriekulturen er til at nedbryde PCE/TCE, og hvor meget af den der tilsættes. I forsøg tilsat bakteriekulturen KB-1 er observeret fuldstændig nedbrydning af TCE til ethen på mellem 60 til 205 dage (se tabel 3.6). I forsøg tilsat bakteriekulturen Pinella sås fuldstændig nedbrydning af TCE til ethen på mellem 56 til 160 dage (Major et al., 2002). I teorien burde man på baggrund af termodynamiske betragtninger forvente en aftagende nedbrydningsrate med faldende antal kloratomer tilknyttet til ethen. Denne tendens er også observeret i in vitro forsøg, hvor deklorering er forsøgt stimuleret ved tilsætning af metal-holdige cofaktorer (eksempelvis vitamin B12 og coenzym F430), svarende til den mekanisme nogle anaerobe bakterier anvender ved cometabolsk nedbrydning af klorerede ethener (se afsnit 2.1.1). I forsøg med stimulering af halorespirerende bakterier ved tilsætning af elektrondonor tegner sig et mere uensartet billede. Castellanos et al. (2002) observerede i batchforsøg med vand og sediment tilsat bakteriekulturen KB-1 relativ hurtig nedbrydning af TCE, mens nedbrydningen af VC forløb ca. 10 gange langsommere end TCE og 4 gange langsommere end cis-DCE. I laboratorieforsøg med jord fra en TCE-forurenet lokalitet fandt El Mamouni et al., (2002), at omsætningen at cis-DCE til VC og ethen var det hastighedsbegrænsende trin i nedbrydningen af TCE. Davis et al. (2002) så ligeledes en faldende nedbrydningsrate fra PCE til cis-DCE, derimod måltes den højeste nedbrydningshastighed for VC (se tabel 3.6). Andre forsøg indikerer, at TCE omsættes hurtigere end PCE, hvilket bevirker, at der i nedbrydningsforsøg med PCE ikke ses akkumulering af TCE (Tandoi et al., 1994; Yang og McCarty, 2000a). Generelt ses TCE at nedbrydes hurtigere end cis-DCE, hvilket resulterer i akkumulering af cis-DCE (Yager et al., 1997; Yang og McCarty, 2000a; Fiacco et al., 2000; Harkness et al., 1999). Harkness et al. (1999) observerede et skift i de relative nedbrydningsrater for klorerede ethener over tiden i kolonneforsøg inokuleret med bakteriekulturen Pinella. Ved tilførsel af TCE i højere koncentrationer over en periode på 510 dage sås en forøgelse af nedbrydningshastigheden for TCE, mens nedbrydningshastigheden for cis-DCE og VC faldt (se tabel 3.6). Dette skyldes formentlig et skift i sammensætningen af den mikrobielle population, således at bakterier, der kan anvende TCE i høje koncentrationer, favoriseres. Lignende resultater er opnået af Duhamel et al. (2002), hvor subkulturer af bakteriekulturen KB-1 dyrket på henholdsvis TCE, cis-DCE og VC viste sig at omsætte netop de stoffer, som de var dyrket på med størst nedbrydningsrate. Eksempelvis viste det sig, at KB-1 dyrket på VC generelt omsatte højere klorerede ethener med langsommere hastighed, og helt mistede evnen til at nedbryde PCE. Lignende resultater er også er observeret af Flynn et al. (2000). Samlet tyder dette på, at nedbrydningsraten for forskellige klorerede ethener er afhængig af sammensætningen af den specifikke mikrobielle population. Dette betyder desværre, at generelle konklusioner omkring nedbrydningsrater i naturlige systemer ikke kan drages på baggrund af den eksisterende litteratur. Tabel 3.6. Nedbrydningsrater for klorerede ethener fundet i laboratorieforsøg
Forkortelser: B: batch, K: kolonne, S: sediment, GV: grundvand, NM: næringsmedium. Referencer: aCupples et al., 2003; bNielsen og Keasling, 1999; cYang og McCarty, 2000a; dIsalou et al., 1998; eDuhamel et al., 2002; fTandoi et al., 1994; gDavis et al., 2002; hEl Mamouni et al., 2002; iHarkness et al., 1999; JSkubal et al., 2001; kRichardson et al., 2002; lEllis et al., 2000; mFennell et al., 2001; nHe et al., 2002.; oYager et al., 1997.; pMajor et al., 2002.; qCastellanos et al., 2002; rFiacco, et al., 2000; sDick et al., 2001. 3.6 Styrende faktorer3.6.1 NæringsstofferMange af de halorespirerende bakterier er ofte dyrket med gærekstrakt i vækstmediet, men det er endnu usikkert, om de halorespirerende bakteriers vækst er direkte afhængig af specifikke komponenter, der findes i gærekstrakt. Ved tilsætning af gærekstrakt vil denne fermenteres, og den dannede hydrogen kan indirekte stimulere dekloreringsprocessen. Opformering af bakteriestammerne Dehalobacter restrictus PER-K23 og Dehalococcoides ethenogens strain 195 er kun lykkedes ved tilsætning af vomsaft (rumen fluid), fermenteret gærekstrakt eller supernatant fra en anaerob nedbrydningstank til deres vækstmedium. Vækst af Dehalobacter restrictus PER-K23 er yderligere afhængig af tilsætning af vitaminerne thiamin og cyanocobalamin, samt aminosyrerne arginin, histidin og threonin. Dehalococcoides ethenogens strain 195 kræver vitamin B12 samt andre endnu ukendte vækstfaktorer (Maymó-Gatell et al., 1997). Endvidere er det foreslået, at tilstedeværelsen af metanogene bakterier kan være af betydning, da disse producerer vitaminer som B12 samt andre cofaktorer, der er til gavn for de deklorerende bakterier (Mohn og Tiedje, 1992). 3.6.2 pHAnaerobe systemer, hvori der forløber deklorering, fungerer bedst mellem pH 6 og pH 8 (Fennel og Gossett, 2003; Middeldorp et al., 1999). De fleste laboratorieforsøg indikerer da også et ph-optimum for anaerob deklorering omkring neutrale pH-værdier. I en serie forsøg med en beriget bakteriekultur indeholdende Dehalococcoides, forløb deklorering af PCE fire gange langsommere ved pH 6 og to gange langsommere ved pH 8 i forhold til ved pH 7 (Young og Gosset, 1997). Ved fermentering af elektrondonorer dannes fede syrer og kulsyre, som kan føre til en forsuring, hvis systemets egen pH-bufferkapacitet er utilstrækkelig. Forsuring og efterfølgende inhibering af PCE-deklorering blev observeret i et storskalaforsøg udført i en sandbox inokuleret med Dehalospirillum multivator samt en blandet DCE-deklorerende kultur, da pH faldt til 5,5 som følge af omsætning af ethanol. Tilsætning af buffer formindskede i nogen grad denne effekt (Cirpka et al., 1999). Akviferer med pH-værdier lavere end 5 eller højere end 9 er derfor mindre gode kandidater til anvendelse af anaerob deklorering. I akviferer med lav alkalinitet kan det være nødvendig at tilsætte buffer for at undgå forsuring. 3.6.3 TemperaturDe fleste forsøg med anaerob deklorering er udført ved temperaturer indenfor det mesofile område dvs ved temperaturer mellem 20 til 37°C (se tabel 3.6 samt appendiks A.1.). Anaerob deklorerering er også set under thermofile forhold. Kengen et al. (1999) observerede nedbrydning ad PCE til cis-DCE i en opformeret bakteriekultur med temperatur optimum på 65°C. Der er derimod udført langt færre forsøg under lavere temperaturer (<20°C), således at eksperimentelle erfaringer for temperaturer omkring 10°C, som er gældende under danske forhold, er meget begrænsede. Da anaerob deklorering er en mikrobiel medieret proces er det forventeligt at lavere temperaturer vil medføre en lavere nedbrydningshastighed. I laboratorieforsøg tilsat PCE observeredes et signifikant fald i nedbrydningsraten, når forsøget blev kørt ved 12°C sammenlignet med ved 22°C. Endvidere sås kun nedbrydning af PCE til TCE ved 12°C i modsætning til ved 22°C, hvor PCE blev omsat til cis-DCE (Adamson et al., 2003). Ved anvendelse af in situ stimulering af anaerob deklorering i koldere egne med grundvandstemperaturer omkring 10°C eller lavere er en længere oprensningsperiode forventelig pga. den langsommere nedbrydning. 3.6.4 Inhibering på grund af andre forureningskomponenterTilstedeværelsen af andre toksiske organiske forureningskomponenter som fx kloroform, cyanid eller toksiske tungmetaller kan have en inhiberende effekt på de deklorerende bakterier eller på andre aktive bakterier i det mikrobielle samfund. Under reducerende forhold vil dannelsen af sulfider sandsynligvis mindske den toksiske effekt af tungmetaller pga. udfældning med frie metalioner. Modsat kan et fald i pH som følge af fermentering, dannelse af organiske syrer og kulsyre mobilisere tungmetaller i jorden. Flere laboratoriestudier tyder på, at tilstedeværelsen af klorerede metaner har en hæmmende virkning på nedbrydning af klorerede ethener under anaerobe forhold. Adamson og Parkin (2000) har undersøgt indflydelsen af 1,1,1-TCA og tetraklormetan på en PCE-nedbrydende kultur. De fandt, at mens 1,1,1-TCA (<20μM) ingen effekt havde på nedbrydningen af PCE, hæmmede tilsætning af tetraklormetan (10-15μM) både nedbrydningen af PCE samt nedbrydningen af VC. Lignende resultater er fundet af Bagley et al. (2000) som observerede total inhibering af nedbrydningen af PCE ved tilsætning af henholdsvis 19μM tetraklormetan og 4μM kloroform. Kaseros et al. (2000) observerede ligeledes hæmning af nedbrydningen af PCE ved tilsætning af tetraklormetan og kloroform, men hæmningen var kun tilstede i en overgangsfase indtil den PCE-nedbrydende bakteriekultur var akklimatiseret til tetraklormetan og kloroform. Andre organiske forureningskomponenter som fx olieforbindelser eller organiske opløsningsmidler som acetone eller metanol kan i nogle tilfælde stimulere nedbrydning af klorerede stoffer. Nedbrydning af sådanne stoffer kan dels bidrage til at reducere forholdene samtidig med, at nedbrydningsprodukter kan optræde som elektrondonorer og stimulere anaerob deklorering. 3.6.5 Betydning af koncentration og fri fase af opløsningsmidlerHæmning af de halorespirerende bakterier ved høje koncentrationer af klorerede stoffer er af betydning for anvendelsen af stimuleret anaerob deklorering til oprensning i kildeområdet såvel som i forureningsfanen tæt på kilden, hvor de klorerede stoffer kan forventes at være tilstede i høje koncentrationer. Laboratorieforsøg har vist, at høje koncentrationer ikke er inhiberende for visse typer af deklorerende bakterier (Yang og McCarty, 2000a; Nielsen og Keasling, 1999). Faktisk tyder det på, at visse deklorerende bakterier kan trives i nærheden af kildeområdet, og at disse bakterier har en konkurrencemæssig fordel ved høje koncentrationer af klorerede stoffer frem for andre mikroorganismer (Yang og McCarty, 2000a; Cope & Hughes, 2001). Yang og McCarty (2000a) har vist, at høje koncentrationer af PCE og cis-DCE kan have en direkte hæmmende effekt overfor metanogene og homoacetogene bakterier, og konkluderede, at en sådan hæmmende effekt vil være til gavn for de deklorerende bakterier, da konkurrencen for elektrondonor reduceres. Modellering foretaget af (Seagren et al., 1994), forudsiger, at den stimulerede biologiske nedbrydning af ethener vil medføre lavere koncentrationer ved grænsefladen mellem den frie fase af opløsningsmiddel og vandfasen, hvorved koncentrationsgradienten mellem fri fase og vand øges og dermed opløsningshastigheden af den frie fase. Endvidere kan den reduktive nedbrydning af PCE medvirke til yderligere opløsning, da de dannede nedbrydningsprodukter (TCE, cis-DCE og VC) alle har højere opløselighed end PCE. Carr et al. (2000) har vist, at nedbrydning af PCE til cis-DCE ved tilstedeværelse af DNAPL (12% PCE i tridecan) øgede opløsningshastigheden af DNAPL med en faktor 14. Efterfølgende forsøg har vist, at nedbrydning med en deklorerende bakteriekultur forøgede opløsningshastigheden af klorethen-DNAPL med en faktor 5 til 6.5 (Cope og Hughes, 2001). Yang og McCarty (2000a) observerede, at opløselighedshastigheden af en PCE DNAPL i en kontinuert-flow kolonne øgedes med en faktor 5 efter inokulering med en deklorerende bakteriekultur. 3.7 Treatability-testTil vurdering af potentialet for anvendelse af stimuleret reduktiv deklorering på en specifik forurenet lokalitet kan der udføres laboratorieforsøg. Laboratorieforsøgene søger at simulere forholdene i felten og udføres ofte med både sediment og grundvand fra den pågældende lokalitet. Laboratorieforsøgene udføres ofte som batchforsøg dvs. i lukkede, totalt opblandede beholdere, da sådanne forsøg er relative nemme at sætte op og håndtere. Sådanne nedbrydningsforsøg omtales på engelsk ofte som treatability-test. Alternativt kan treatability-tests udføres som søjleforsøg, hvor grundvand ledes gennem en søjle pakket med sediment. Søjleforsøg simulerer på flere måder bedre de naturlige forhold i en akvifer, men er også sværere at kontrollere. Forsøgene er dyrere end flaskeforsøg, og der udføres ofte kun et begrænset antal. Treatabilitytest kan først og fremmest vise, om der på den pågældende lokalitet er bakterier tilstede, der kan deklorere PCE eller TCE fuldstændigt til ethen. På flere forurenede lokaliteter ses akkumulering af nedbrydningsprodukterne cis-DCE og i nogle tilfælde også VC (se diskussion i afsnit 2.1.1). Ved tilsætning af forskellige elektrondonorer undersøges muligheden for at stimulere en eventuel nedbrydning. Treatabilitytest kan endvidere belyse, hvorledes de tilsatte elektrondonorer fermenteres med henblik på at optimere nedbrydningen af de klorerede stoffer. For eksempel kan fermentation af laktat og ethanol føre til høje hydrogen koncentrationer (jvf. tabel 3.2), der kun vil være til rådighed for de deklorerende bakterier i en relativ kort periode pga. konkurrencen fra forskellige hydrogenforbrugende organismer. Under nogle forhold kan laktat og ethanol dog fermenteres til propionat, der selv langsomt fermenteres og resulterer i lave hydrogenkoncentrationer, hvilket betyder at laktat og ethanol kan være gode donorer på nogle lokaliteter. Endvidere kan laboratorieforsøg belyse behovet for tilsætning af næringsstoffer eller buffer. Treatabilitytest kan belyse følgende:
Treatabilitytest kan give information om hvorvidt anaerob deklorering er en egnet afværgestrategi for en helt specifik lokalitet. I tilfælde af, at der på trods af tilsætning af donor ikke ses fuldstændig omsætning til ethen, kan det være nødvendigt at tilsætte bakterier for at opnå den ønskede effekt. Dette er en vigtig information inden et afværgeprojekt igangsættes. I følgende afsnit behandles opsætning og analyse af nedbrydningsforsøg til at undersøge potentialet for at anvende stimuleret anaerob deklorering til oprensning af PCE/TCE-forurenede grunde. Afsnittet er skrevet på baggrund af anbefalinger for treatabilility test skrevet af Morse et al. (1998) og forsøg beskrevet i litteraturen, samt erfaringer gjort ved opsætning af sådanne forsøg på Miljø & Ressourcer DTU. 3.7.1 Sediment- og grundvandsprøvetagningTil nedbrydningsforsøgene anvendes sediment og grundvand fra den forurenede lokalitet. Tilsætning af sediment er af betydning, da oxiderede jern og mangan forbindelser på sedimentet vil bidrage til forbruget af elektrondonor. Yderligere forventes det, at de fleste bakterier er knyttet til sedimentet. Der findes forskellige teknikker til udtagning af sedimentprøver afhængig af de geologiske forhold (Amternes Videncenter for Jordforurening, 2003). Det er vigtigt, at der ved udtagningen undgås kontakt med atmosfærisk luft. Ved udtagning af sedimentkerner kan anvendes rengjorte metalrør, der straks efter optagningen forsegles i enderne, så diffusion af ilt ind i prøvematerialet minimeres. Ved prøvetagning er det endvidere vigtigt at undgå krydskontaminering mellem boringer fx ved anvendelse af samme boreudstyr. I sådanne tilfælde skal boreudstyret rengøres mellem hver boring. Sedimentkernerne opbevares på køl ved 4ºC, indtil opsætning af forsøg kan finde sted. Sedimentkernerne bør opbevares så kort tid som muligt, inden forsøgene sættes op for at minimere ændringer i det mikrobielle samfund. Ved udtagning af grundvandsprøver er det vigtigt, at disse repræsenterer det geokemiske miljø, som er gældende der, hvor sedimentprøverne er udtaget. Grundvandsprøver udtages tæt på, hvor der er udtaget sedimentprøver og i samme dybde. Ved udtagning af vandprøver er det ligeledes vigtig, at der undgås kontakt med atmosfærisk luft. Valget af pumpe vil afhænge af de hydrogeologiske forhold bl.a. hvor dybt prøven skal tages samt vandtilstrømningen til boringen. Det har vist sig, at flere jævnstrømspumper som fx Whalepumper udvikler hydrogen under prøvetagningen, idet vand spaltes ved elektrolyse til hydrogen, som i så fald vil bidrage til elektrondonorpuljen i nedbrydnings-forsøgene (Chapelle et al., 1997; pers. komm. m. Rasmus Jakobsen, M&R DTU). Vandprøverne udtages i rengjorte sterile glasflasker, der fyldes helt op ved overløb og lukkes med et tæt låg med indlæg af Teflon®® for at undgå tab ved sorption. 3.7.2 Opsætning af flaskeforsøgNedbrydningsforsøgene udføres i sterile flasker, der lukkes med gastætte propper (fx butylgummi-propper med Teflon® indlæg og aluminiumskrave). Til flaskerne tilsættes en blanding af sediment og grundvand. Mængden af vand, der tilsættes, bestemmes ud fra antallet af analyser, der ønskes udtaget i løbet af forsøget. Til bestemmelse af vandmængden, bør der derfor laves en forsøgsplan med angivet prøvemængder, der ønskes udtaget, så det sikres, at der er vand nok til hele forsøget. Ønskes der udtaget prøver af sedimentet til analyse eller udføres andre destruktive analyser, kan det være nødvendigt at sætte flere identiske flaskeforsøg op, der så kan prøvetages og kasseres over tiden (såkaldte høstforsøg). Ved opsætning af høstforsøg kan man komme tættere på det naturlige forhold mellem sediment og grundvand. Opsætning af høstforsøg er dog mere omstændelig, idet der ofte skal sættes et større antal forsøg op for at følge udviklingen over tid. Ved opsætning af høstforsøg kræves endvidere en større mængde prøvemateriale, hvilket der skal tages højde for ved prøvetagning. Der vil ved høstforsøg også ofte være en vis variation mellem flaskerne, hvilket kan medføre en større variation på data. Dette kan være særlig udtalt med mikrobielle forsøg, hvor mikroorganismerne fx ikke er homogent distribueret i sedimentmaterialet. Oplukning af sedimentprøver samt den efterfølgende opsætning af forsøg foregår i en anaerob handskeboks, der indeholder en atmosfære af nitrogen samt ofte 1 til 3% hydrogen. Ved udtagning af sedimentkerner fjernes ca. 5cm af kernen i begge ender, da dette kan have været eksponeret til ilt. Ved opsætning af replikater er det vigtigt, at sedimentet homogeniseres for at undgå variation mellem flasker. Alle redskaber, opblandingsbakker og prøvebeholdere steriliseres før start. Efter tilsætning af sediment og grundvand lukkes flaskerne og fjernes fra den anaerobe boks. Flaskerne skylles med nitrogen (evt. 20%CO2/80%N2-blanding) for at fjerne hydrogen stammende fra anaerob boksen. For at sikre optimal tilsætning af bl.a. klorerede stoffer og elektrondonor er det en god ide, at vandprøverne analyseres inden start. Tilsætning af PCE eller TCE vil afhænge af koncentrationen af stofferne i det forurenede grundvand. Ideelt bør startkoncentrationen afspejle koncentrationerne i det forurenede grundvandsmagasin. I praksis vil lave koncentrationer (under 0,5 mg/l) besværliggøre fortolkningen, da der kan være problemer med at sikre en ordentlig analyse af både moderprodukter og nedbrydningsprodukter gennem hele forløbet på grund af de små vandvolumener, der er til rådighed for analyse (se 3.10.3). Startkoncentrationen bør samtidig være lav nok til at hindre toksiske effekter på de mikrobielle processer. I tilfælde af at bufferkapaciteten er lav i systemet, er det foreslået at tilsætte NaHCO3 som buffer for at undgå forsuring i løbet af forsøget (Fennel og Gosset, 2003). Endvidere kan det være en mulighed at tilsætte resazurin som redoxindikator. Resazurin er farveløs ved redoxpotentialer lavere end –110mV, men skifter farve til lyserød ved højere redoxværdier. For at undgå en toksisk virkning tilsættes resazurin i en koncentration lavere end 1mg/L. Valget af elektrondonor vil ofte afhænge af, hvad man i den enkelte situation har påtænkt at tilsætte i felten. Det drejer sig både om en vurdering af det påtænkte injektionssystem og de hydrauliske forhold på lokaliteten (se afsnit 4.4.1) Tilsætning af laktat kan derfor anbefales, idet man med stor sandsynlighed og relativt hurtigt vil se en nedbrydning, såfremt de rette bakterier er tilstede. Endvidere kan det være en god ide at inkludere et par andre substrater som fx butyrat og benzoat, der fermenteres langsommere under dannelse af lave koncentrationer af hydrogen. Hvor mange elektrondonorer man ønsker at inkludere i sit forsøgsset-up afhænger mest af tidsrammen og økonomien. Såfremt man påtænker at tilsætte komplekse substrater, fx et restprodukt, som ikke er undersøgt tidligere, er det vigtigt at disse testes i nedbrydningsforsøg inden tilsætning i felten. Tabel 3.7 viser et eksempel på en forsøgsopsætning. Ved tilsætning af elektrondonor skal der tages højde for et donorforbrug fra andre konkurrerende elektronacceptorer (som fx nitrat, mangan, jern, og sulfat). Beregning af dette kræver dog kendskab til grundvandskemien samt sedimentets oxidationskapacitet med hensyn til jern og mangan. Typiske elektrondonor koncentrationer er på 2-5mM (se tabel 3.1), men det vil afhænge af forsøgsdesignet (fx forholdet mellem sediment og vand), så der bør altid udføres en konkret beregning på baggrund af de støkiometriske forbrug. Eksempler på sådanne beregninger for dimensionering af elektrondonorforbrug under feltforhold ses i tabel 4.2 og Miljøstyrelsen (2003). Udover forsøg med tilsætning af elektrondonor er det vigtigt, at der udføres forskellige kontrolforsøg. Kontrolforsøgene inkluderer abiotiske og biotiske kontrolflasker. De abiotiske kontrolflasker er vigtige, da de kan vise, om der er tab fra flaskerne, der ikke skyldes biologiske processer fx sorption, tab gennem propper mm. Flaskerne kan steriliseres ved autoklavering. I så fald autoklaveres flaskerne tre gange over tre dage før tilsætning af PCE og TCE. En anden metode kan være tilsætning af kviksølvklorid, her bør man dog være opmærksom på at bidraget af klorid herfra vil vanskeliggøre senere analyse og massebalance på klorid. Til de biotiske kontrolforsøg tilsættes ikke elektrondonor, og disse forsøg repræsenterer derfor den mikrobielle baggrundsaktivitet uden stimulering. I tabel 3.7 er foreslået, at der yderligere opsættes forsøg, hvor der tilsættes næringsstoffer i form af gærekstrakt og vitamin B12, men ingen elektrondonor. Disse forsøg vil vise, om de bakterier, der er tilstede under naturlige forhold, er begrænset af næringsstoffer og ikke af mangel på elektrondonor. Flere studier tyder på, at gærekstrakt og vitamin B12 er vigtige næringsstoffer for Dehalococcoides ethenogens, og det kan derfor være en mulighed at medtage flasker, hvor disse stoffer tilsættes. I tabel 3.7 er også inkluderet forsøg med tilsætning af høje koncentrationer af gærekstrakt for at screene et antal forskellige donorers effekt, der ikke kan testes individuelt. Gærekstrakt indeholder en blanding af mange forskellige donorer, og endnu flere kan dannes ved fermentering. Sådanne forsøg kan vise om deklorering er mulig ved tilsætning af andre donorer end dem, der specifikt testes for. Tabel 3.7. Eksempel for opsætning af treatabilitytest til undersøgelse af stimuleret reduktiv deklorering (Fennell og Gosset, 2003)
Såfremt at der ikke ses nedbrydning af de tilsatte stoffer eller, at der kun ses ufuldstændig deklorering fx nedbrydning af PCE/TCE til cis-DCE, kan et andet formål med treatability test være at undersøge, om nedbrydningen kan stimuleres ved tilsætning af en bakteriekultur, der vides at kunne nedbryde klorerede ethener til ethen. Et eksempel på nedbrydningsforsøg med TCE tilsat elektrondonor og bakterier er vist i figur 3.2. Ved tilsætning af anaerobe bakterier er det vigtigt, at der er reducerede forhold i forsøgsflaskerne. Hvor meget bakteriekultur, der skal tilsættes, vil afhænge af celledensiteten i den pågældende bakteriekultur. Beskrivelsen af tilsætning af bakteriekultur er ofte mangelfuld, hvilket sandsynligvis skyldes, at man tit ikke har et særligt godt kendskab til bakteriekulturen, og fx ikke kender celledensiteten. Yderligere angives sjældent, hvor meget bakteriekultur, der er tilsat. Med udgangspunkt i en anaerob bakteriekultur (KB-1, se tabel 2.6) med en relativ høj celledensitet 108 til 109 celler/ml foreslår GeoSyntec/SIREM vejledende, at der tilsættes mellem 100 og 1000μL kultur til et mikrokosmos-forsøg (300 ml flasker, personlig kommunikation Phil Dennis). Såfremt formålet med forsøget blot er at få afgjort, om der er et potentiale for nedbrydning, kan der eventuelt tilsættes en højere bakteriekoncentration for at forkorte forsøgsperioden. Et sådant forsøg vil i mindre grad simulere forholdene ved tilsætning af bakterier under feltforhold, hvor bakteriekoncentrationen formentlig vil være lavere. Figur 3.2. Nedbrydning af TCE i batchforsøg med sediment og grundvand fra Kelly Air Force Base (Texas) tilsat elektrondonor og bakteriekultur KB-1. A: tilsat metanol, B: tilsat laktat, C og D: tilsat metanol og bakteriekultur KB-1. Startkoncentrationen af TCE i forsøgene vist på figur A,B, C var 6M (0,8 mg/l) i vandfasen, mens TCE koncentrationen i forsøgene vist på figur D var 600 M. Datapunkterne i figurerne repræsenterer et gennemsnit af tre nedbrydningsforsøg (Major et al., 2002). 3.7.3 Inkubation og udtag til analyserFlaskerne inkuberes i mørke og vendes forsigtigt med jævne mellemrum for at sikre total opblanding i flaskerne. Flaskerne inkuberes ved den aktuelle grundvandstemperatur målt i felten. Dette er særligt vigtigt i koldere egne med lavere grundvandstemperaturer, da nedbrydningen under sådanne forhold formentlig vil forløbe langsommere. De tilstedeværende bakterier kan endvidere være adapteret til lavere temperaturer, og vil i så fald umiddelbart klare sig dårligere ved højere temperaturer. Forsøgsflaskerne analyseres rutinemæssigt (i starten fx en gang om ugen) for klorerede ethener, tilsatte elektrondonorer, flygtige fede syrer, metan og hydrogen. Prøver til analyse udtages fra gas- eller vandfasen med en kanyle. Flygtige komponenter som de klorerede ethener, metan og hydrogen kan analyseres ved udtag af gasprøver til analyse ved gaskromatografi. Udtag fra gasfasen (0,2-1ml) foretages med en steril gastæt sprøjte udstyret med en ventil, der omhyggeligt lukkes inden prøven trækkes ud af flasken. Væskeprøver til analyse for flygtige fede syrer udtages med sterile en-gangssprøjter (0,5-2ml). Skal prøverne opbevares, skal de filtreres, syrekonserveres (10μL 8N H3PO4 per 0,5ml prøve) og gemmes på køl (4°C). Gentagne udtag af gas- og vandprøver fra samme forsøgsflaske vil med tiden opbygge et undertryk i prøveflaskerne. For at undgå indtrængen af ilt er det vigtigt, at undertrykket løbende udlignes ved tilsætning af nitrogengas. Nitrogen tilsættes med en steril sprøjte, og der holdes regnskab med, hvor meget der er tilsat. Ønskes analyser af sedimentet (sulfid- eller jernudfældninger, mikrobielle karakteriseringer) eller målinger af pH eller Eh, som kræver åbning af flasken, er det nødvendigt, at opsætte flere forsøgsflasker, der kan høstes over tiden. Ved gentagne udtag af prøver med en kanyle er der en risiko for, at flaskerne med tiden bliver utætte. Udtag af prøver bør derfor fordeles jævnt over hele nedbrydningsforløbet. I forsøg, hvor der observeres nedbrydning af cis-DCE til VC, bør forsøgene fortsættes så længe, at man sikrer sig, at VC også omdannes videre til ethen. Litteraturgennemgang viser, at forsøgsperioden kan være meget varierende mellem forskellige studier. I batchforsøg udført med sediment og grundvand er der set fuldstændig nedbrydning af PCE og TCE til ethen indenfor 14 dage, mens andre forsøg har kørt op til seks måneder, før der sås dannelse af ethen (He et al., 2002; Yager et al., 1997) (se afsnit 3.5). Ved tilsætning af bakterier vil forsøgsperiodens længde som tidligere nævnt være meget afhængig af, hvor mange bakterier, der tilsættes, og hvor aktive de er. I tilfældet af, at der er stor usikkerhed omkring nedbrydningshastigheden, kan det være nødvendigt at opsætte et indledende forsøg. 3.7.4 DatabehandlingVed opstilling af massebalance for de klorerede stoffer skal der tages hensyn til stoffernes fordeling i de forskellige faser: vand, sediment, og gas. Yderligere skal koncentrationerne korrigeres for volumenændringer som følge af udtag af vand og gas-prøver. Massebalancen opstilles typisk i totale masser for hele systemet og regnes i mol.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||