|
Stimuleret in situ reduktiv deklorering. Vidensopsamling og screening af lokaliteter 2 Nedbrydning af klorerede ethener samt 1,1,1-triklorethan
Der er flere processer, der har betydning for klorerede stoffers skæbne i naturen, hvor de væsentligste er transport, fordampning, sorption og nedbrydning. Ved de fleste af disse processer overføres stoffet fra en fase til en anden, uden at stoffet bliver mindre skadeligt eller at den absolutte mængde reduceres. Nedbrydning er derimod karakteriseret ved, at stoffet undergår en vis forandring til andre stoffer. Der skelnes mellem fuldstændig nedbrydning eller transformation af et organisk stof. Ved en fuldstændig nedbrydning omdannes det organiske stof til kuldioxid, vand og salte, mens stoffet ved transformation blot omdannes til et nedbrydnings-produkt, som kan være stabilt eller omdannes videre. I de følgende afsnit beskrives mulige nedbrydningsprocesser for klorerede ethener og 1,1,1-TCA, samt under hvilke redoxforhold processerne forløber. Endvidere præsenteres de mikroorganismer, der kan nedbryde klorerede stoffer ved reduktiv deklorering, da denne nedbrydningsproces har vist sig at være en potentiel metode til oprensning af grunde forurenet med klorerede opløsningsmidler. Klorerede ethener samt 1,1,1-triklorethan, er afledt af henholdsvis ethen (H2C=CH2) og ethan (H3C=CH3) ved substitution af hydrogen med klor. I tabel 2.1 er angivet de vigtigste kemiske og fysiske konstanter for de klorerede ethener samt 1,1,1-triklorethan. I tabel 2.1 er endvidere angivet forkortelser for de forskellige stoffer, der vil blive anvendt i resten af rapporten. Generelt er de klorerede ethener og ethaner karakteriseret ved at være flygtige (høj Henry's konstant) og have en relativ høj opløselighed i vand. Stofferne har med undtagelse af vinylklorid alle en densitet, der er højere end vands, og betegnes som DNAPLs (Dense Non-Aquous Phase Liquids), hvilket betyder, at hvis stofferne forekommer i fri fase i jord eller grundvand, vil de synke nedad igennem grundvandsspejlet og ned i grundvandszonen til de når et impermeabelt lag. De klorerede ethener har desuden relativt lave Kow-værdier, hvilket betyder, at stofferne kun i mindre grad tilbageholdes ved sorption til jorden. I grundvandsmagasiner med lavt organisk indhold vil stofferne på grund af deres høje opløselighed og mobilitet spredes med grundvandet, hvorved der kan dannes en forureningsfane. Tabel 2.1. Fysisk-kemiske data for klorerede ethener samt 1,1,1-triklorethan. Alle data er fra Miljøstyrelsen, 1996 og gældende ved 25°C.
I rapporten anvendes typisk μg/l og μmol/l som enhed for koncentration af de klorerede opløsningsmidler. Omregning fra μmol/l til μg/l fremgår af tabel 2.2. Tabel 2.2 Omregning fra μmol/l til μg/l
2.1 NedbrydningsprocesserKlorerede alifatiske hydrocarboner kan nedbrydes eller transformeres under naturlige forhold via kemiske eller biologiske processer. Abiotiske nedbrydningsprocesser Hydrolyse: RX + HOH → ROH + HX Klorerede ethener nedbrydes ikke i væsentlig grad ved hydrolyse (Butler og Barker, 1996). Klorerede metaner og ethaner kan derimod nedbrydes ved hydrolyse, selvom nedbrydningshastighederne generelt er lave. Vogel (1994) rapporterer om halveringstider for abiotisk nedbrydning af monohalogenerede alkaner i en størrelsesorden på dage til måneder, mens halveringstider for polyhalogenerede metaner og ethaner kan være op til flere tusinde år. En undtagelse er dog 1,1,1-triklorethan, der omdannes dels til 1,1-DCE ved elimination og dels til eddikesyre ved hydrolyse samt til klorethan. Klorethan omdannes til ethanol ved hydrolyse (McCarty, 1996). Halveringstiden for abiotisk nedbrydning af 1,1,1-TCA er ca. 1-2 år (Vogel og McCarty, 1987; Jeffers et al., 1989). Andre polyklorerede ethaner som 1,1,2-TCA kan også nedbrydes abiotisk ved dehydrohalogenering til 1,1-DCE, mens tetraklorethan og pentaklorethan kan nedbrydes til henholdsvis TCE og PCE (Jeffers et al., 1989). Abiotisk nedbrydning af klorerede stoffer kan under stærkt reducerede forhold ske ved reduktiv deklorering, hvorved der fraspaltes klorsubstituenter. Visse reaktive metaller kan katalysere nedbrydning af klorerede stoffer. Reaktive metaller kan være tilstede som organiske forbindelser fx komplekserede porphyriner eller som uorganiske forbindelser i jordmatricen. Sådanne processer er kemisk komplekse og ikke velundersøgte. Generelt regnes kemisk omsætning af klorerede ethener i grundvandssystemer for værende af mindre betydning pga. den relativt langsomme nedbrydning sammenlignet med biologiske nedbrydningsprocesser. Biologiske nedbrydningsprocesser
Udover energigivende og koblede redoxreaktioner kan andre enzym-medierede mekanismer som hydrolyse eller hydrogenation også bidrage til nedbrydning af klorerede organiske stoffer. Flere klorerede stoffer kan omsættes ved cometabolisme under både anaerobe og aerobe forhold. Ved cometabolsk nedbrydning reagerer de klorerede stoffer med enzymer involveret i bakteriernes metabolisme. Bakterierne får intet udbytte af reaktionen, og for opretholdelse af vækst kræves tilstedeværelse af et primærsubstrat. I nogle tilfælde kan reaktionen med de klorerede stoffer danne produkter, der er skadelige for bakterierne. Klorerede stoffer, der er svært nedbrydelige, kan ofte nedbrydes cometabolsk. Mikrobielle nedbrydningsprocesser for klorerede ethener og ethaner inkluderer reduktiv deklorering, aerob cometabolsk nedbrydning og direkte oxidation. Under anaerobe forhold kan klorerede stoffer nedbrydes ved reduktiv deklorering enten co-metabolsk eller i en energigivende proces ofte kaldet halorespiration. Direkte oxidation kan forløbe under både anaerobe og aerobe forhold. Tabel 2.3 viser en oversigt over de mulige mikrobielle nedbrydningsmekanismer for udvalgte klorerede ethener og ethaner. Tabel 2.3. Mikrobielle nedbrydningsmekanismer for udvalgte klorerede ethener og ethaner
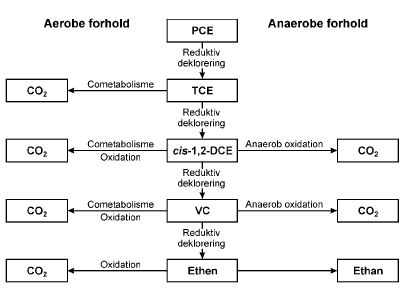
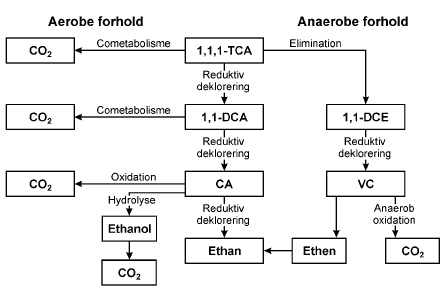
I jord- og grundvandssystemer vil abiotisk omsætning af klorerede stoffer ofte være begrænset og nedbrydningen vil overvejende forløbe via mikrobielle processer. Følgende afsnit giver et overblik over de mulige biologiske nedbrydningsprocesser for klorerede ethener samt 1,1,1-TCA i grundvandsmiljøet. 2.1.1 Reduktiv dekloreringKlorerede stoffer er relativ oxiderede som følge af tilstedeværelsen af de elektronegative kloratomer, hvilket medfører, at de kan agere som elektronacceptorer i redoxprocesser. Ved tilstedeværelsen af en elektrondonor samt en katalysator kan hydrogen substituere klorid ved en proces kaldet reduktiv deklorering. Ved reduktiv deklorering fjernes trinvist et kloratom ad gangen. Figur 2.1 viser nedbrydningsvejen for sekventiel reduktiv deklorering af PCE til ethen. Yderligere kan ethen omdannes til ethan under anaerobe forhold (deBruin et al., 1992). Ved biologisk reduktiv deklorering af TCE dannes hovedsageligt cis-DCE. Tendensen for klorerede ethener til at undergå deklorering mindskes teoretisk set med lavere antal af kloratomer (Vogel et al., 1987). PCE er med fire kloratomer en relativ stærk oxidant og vil derfor let reduktivt dekloreres til TCE under anaerobe forhold. Oxidationstrinnet for kulstofatomerne i PCE er +2, mens oxidationstrinnet for kulstofatomerne i ethen bliver –2 (se også afsnit 3.4). Reduktiv deklorering af TCE til cis-DCE kan foregå under Fe(III)-reducerende forhold samt under mere reducerende forhold. Reduktiv deklorering af cis-DCE til VC kan forløbe under sulfat-reducerende forhold (Vogel et al., 1987; Chapelle, 1996), men forløber hurtigere under metanogene forhold. Vinylklorid er den mest reducerede forbindelse af de klorerede ethener, og som følge heraf er reduktiv deklorering af VC til ethen signifikant langsommere og er kun betydende under stærkt reducerende metanogene forhold (Vogel and McCarty, 1985; DiStefano et al, 1991; Ballapragada et al., 1997; MaymO-Gatell et al., 1999). Reduktiv deklorering er den eneste mulige nedbrydningsvej for PCE. Figur 2.1. Sekventiel reduktiv deklorering af PCE. Reduktiv deklorering kan forløbe ved en metabolsk energiproducerende proces eller ved en cometabolsk proces. Visse bakterier er i stand til at bruge klorerede forbindelser som terminal elektronacceptor og udnytte energien i en proces kaldet halorespiration eller dehalorespiration. Flere halorespirerende bakterier kan deklorere PCE eller TCE til cis-DCE, men der er til dato kun isoleret én bakterie Dehalococcoides ethenogens 195, der reduktivt kan deklorere PCE fuldstændigt til ethen. Anaerob nedbrydning af PCE til ethen er dog observeret i flere laboratorieforsøg med blandingskulturer beriget på enkelte substrater samt ved feltundersøgelser på forurenede lokaliteter (se afsnit 2.3). Udover de klorerede ethener kan 1,1,1-TCA og 1,2-DCA også nedbrydes ved halorespiration (Mayó-Gatell et al., 1999). Nedbrydningen af 1,1,1-TCA forløber over 1,1-DCA til CA (Adamson og Parkin, 2000; Sun et al., 2002) og formentlig til ethan (Dick et al., 2001). Undersøgelse af nedbrydningsvejen for 1,1,1-TCA besværliggøres dog af stoffets hurtige abiotiske nedbrydningshastighed, som gør det vanskeligt at skelne mellem biotisk og abiotisk nedbrydning (Wiedemeier et al., 1999). Visse acetogene og metanogene bakterier kan cometabolsk deklorere PCE. Generelt deklorerer de acetogene bakterier PCE med en højere rate end de metanogene bakterier. Forsøg med metanogene og acetogene bakterier indikerer, at de observerede dekloreringsrater generelt er lave sammenlignet med rater observeret med halorespirerende bakterier (Middeldorp et al., 1999). Endvidere fjernes sædvanligvis kun et halogenatom. Fuldstændig deklorering af PCE til ethen i renkulturer af acetogene og metanogene bakterier er ikke observeret (Middeldorp et al., 1999). Som følge af en faldende tendens til reduktiv deklorering for de lavere klorerede ethener skulle man forvente at se akkumulering af VC på forurenede lokaliteter. På mange lokaliteter ses cis-DCE imidlertid at være tilstede i en højere koncentration end VC, hvilket kan skyldes, at VC transporteres til andre zoner, hvor det nedbrydes ved direkte oxidation enten under anaerobe eller aerobe forhold (se afsnit 2.1.3). Akkumulering af cis-DCE efter nedbrydning af PCE eller TCE kan også skyldes, at de rette halorespirerende bakterier enten ikke er tilstede, er begrænset af ufavorable redoxforhold eller af mangel på elektrondonor (se afsnit 3.2). 2.1.2 Cometabolsk oxidation under aerobe forholdUnder aerobe forhold kan en række klorerede stoffer omsættes ved cometabolsk nedbrydning. Wilson og Wilson (1985) var de første som observerede at metanotrofe bakterier var i stand til at nedbryde TCE til kuldioxid under aerobe forhold. Siden er det vist, at en bred vifte af aerobe bakterier kan oxidere TCE, DCE og VC til kuldioxid. Disse inkluderer metan-, propan-, ethen, aromat-, og ammoniumoxiderende bakterier (Alvarez-Cohen og Speitel, 2001). Også 1,1,1-TCA, 1,2-DCA og 1,1-DCA kan nedbrydes cometabolsk, selvom nedbrydningen af 1,1,1-TCA er mere begrænset og forløber langsommere sammenlignet med TCE (Alvarez-Cohen og Speitel, 2001). Generelt falder nedbrydningshastigheden med stigende antal kloratomer indenfor en serie af klorerede stoffer (ethaner, ethener og metaner). For diklorethenerne har placeringen af kloratomerne i forhold til dobbeltbindingen også en betydning fx nedbrydes 1,1-DCE væsentlig langsommere end cis/trans-DCE (Alvarez-Cohen og Speitel, 2001). Fuldt klorerede stoffer som PCE nedbrydes ikke cometabolsk under aerobe forhold. Nedbrydningsvejen af ethener under aerobe forhold er kun undersøgt for TCE med metanotrofe bakterier. Det første trin er en epoxidering af TCE til TCE-epoxid, der udføres af de metanotrofe bakterier. TCE-epoxidet er meget reaktivt og omdannes hurtigt til forskellige C1- eller C2-forbindelser som organiske syrer, der mineraliseres til kuldioxid af metanotrofe eller heterotrofe bakterier (Uchiyama, 1992; Fox et al., 1990; Little et al., 1988). Nedbrydningen af de øvrige ethener forløber sandsynligvis også via et epoxid. Nedbrydning af 1,1,1-TCA forløber via 2,2,2-triklorethanol (Oldenhuis et al., 1989), som sandsynligvis nedbrydes videre til kuldioxid af heterotrofe bakterier. Generelt er cometabolsk oxidation en relativ hurtig proces. Et fælles karakteristika for de aerobe bakterier, der cometabolsk kan nedbryde klorerede stoffer, er det uspecikke enzym oxygenase, der katalyserer det første trin i nedbrydningen. Ved cometabolsk nedbrydning opnår bakterien hverken energi eller kulstof, og for at opretholde vækst behøver organismen et primærsubstrat som fx metan, toluen, phenol. For at cometabolsk aktivitet skal kunne opretholdes skal primær substratet endvidere være tilstede i en relativ høj koncentration i forhold til de klorerede stoffer, samt at der skal være aerobe forhold. Da disse forhold sjældent er tilstede i forureningskilden eller i størstedelen af en forureningsfane, regnes aerob cometabolisme generelt ikke for at være den primære nedbrydningsvej for klorerede stoffer i forurenede grundvandssystemer. Cometabolsk oxidation er afprøvet som afværgeteknologi i flere tilfælde bl.a. ved tilsætning af metan (Semprini et al., 1990 og 1991; McCarty et al., 1998). 2.1.3 Direkte oxidationVed direkte oxidation optræder det klorerede stof som elektrondonor mens fx oxygen, sulfat, jern(III) eller andre oxiderede forbindelser optræder som elektronacceptorer. Direkte aerob oxidation Under aerobe forhold kan både vinylklorid og cis-DCE mineraliseres til kuldioxid gennem direkte oxidation (Davis og Carpenter, 1990; 1998a, 1998b; Bradley og Chapelle, 2000). Vinylklorid nedbrydes hurtigere end cis-DCE. Vinylklorid kan under aerobe forhold benyttes som primærsubstrat, hvilket betyder, at mikroorganismer kan anvende vinylklorid som kulstofkilde til vækst og stofskifte (Hartmans et al., 1985; Hartmans og deBont, 1992). Generelt er aerob nedbrydning af vinylklorid og DCE en relativ hurtig proces sammenlignet med reduktiv deklorering (Wiedemeier et al., 1999). Af de klorerede ethaner er 1,2-diklorethan nedbrydelig ved direkte oxidation (Stuki et al., 1983; Janssen et al., 1985; McCarty og Semprini, 1994). Stuki et al. (1983) og Janssen et al. (1985) har vist, at 1,2-DCA kan fungere som primærsubstrat under aerobe forhold. I sådanne tilfælde omsættes 1,2-DCA først til klorethanol, som derefter mineraliseredes til kuldioxid. Klorethan nedbrydes hurtigt abiotisk ved hydrolyse, og det er derfor usikkert, om direkte oxidation er en betydelig nedbrydningsmekanisme for klorethan (Wiedemeier, 1999). De højere klorerede stoffer som PCE, TCE, 1,1,1-TCA regnes ikke for at være nedbrydelige via direkte oxidation. Der er til dato ikke fundet mikroorganismer, der kan anvende PCE, TCE, 1,1,1-TCA som primær substrat under aerobe forhold. Interessant er det imidlertid, at ifølge teorien er mængden af energi, der er til rådighed for en organisme ved mineralisering af de højere halogenerede forbindelser som tri- og tetraklorethen med ilt som elektronacceptor tilstrækkelig til at understøtte vækst (Dolfing, 2003). Termodynamisk er der altså ingen forklaring på, hvorfor aerob vækst på disse forbindelser ikke er observeret. Når de højere klorerede stoffer ikke omsættes ved direkte oxidation under aerobe forhold skyldes det måske, at de som oftest er mere oxiderede end størstedelen af det tilstedeværende organiske stof i grundvandssystemer. For TCE og 1,1,1-TCA er kun cometabolsk nedbrydning observeret, mens PCE ikke er bionedbrydelig under aerobe forhold. I langt de fleste forureningstilfælde skyldes tilstedeværelsen af VC og DCE reduktiv deklorering af PCE eller TCE i den anaerobe zone af forureningsfanen. Aerob nedbrydning af klorerede stoffer vil i sådanne tilfælde være begrænset til områder af forureningsfanen, hvor ilten endnu ikke er opbrugt. Direkte anaerob oxidation Bakteriers evne til at oxidere DCE og VC til ikke-toksiske produkter under anaerobe forhold kan være betydende i tilfælde, hvor naturlig nedbrydning påtænkes at anvendes til oprensning eller afgrænsning af udbredelse af en forurening med klorerede opløsningsmidler. Anaerob deklorering af PCE/TCE til DCE og VC i kilden og centrale dele af forureningsfanen efterfulgt af anaerob oxidation i yderzonerne af fanen kan være en mulig nedbrydningsvej for fuldstændig nedbrydning af klorerede stoffer. Figur 2.2 og figur 2.3 viser en oversigt over mulige nedbrydningsveje og nedbrydningsprodukter for PCE og de lavere ethener samt 1,1,1-TCA.
Figur 2.2. Nedbrydning af PCE/TCE ved biologiske processer
Figur 2.3. Nedbrydning af 1,1,1-TCA ved biologiske og abiotiske processer 2.2 Redoxprocesser og nedbrydning af klorerede ethenerBakterier oxiderer organisk stof og mange miljøfremmede organiske stoffer vha. oxidationsmidler, såkaldte terminale elektronacceptorer, hvorved de opnår energi. De mest almindelige elektronacceptorer er O2, NO3-, SO42- og CO2 (metanproduktion), der alle er vandopløselige, samt Fe(III) og Mn(IV), som er knyttet til sedimentet (Christensen et al., 2000). Energiudbyttet ved de forskellige redoxprocesser er meget forskelligt (se tabel 2.4). De bakterier, der får størst energiudbytte ved udførsel af oxidationsprocesserne, vil dominere over de andre bakterier, hvilket medfører, at ilt som regel forbruges først, dernæst nitrat osv. Dette betyder, at der udvikles en sekvens af områder, hvor forskellige redox-processer er dominerende. En sådan redox-sekvens udvikles tydeligst i den mættede zone, hvor der er begrænset tilførsel af ilt i modsætning til den umættede zone, hvor der som regel sker en betydelig ilttilførsel fra atmosfæren. Udvikling af redox-sekvenser er observeret nedstrøms forureninger med betydelige indhold af organisk stof fx lossepladser eller oliespild (Miljøstyrelsen, 2000, Christensen et al., 2000). Her ses de mest reducerede forhold (fx metanogene) tættest på kilden, hvor koncentrationen af organisk stof er høj. Oxiderede forhold (aerobt eller nitratreducerende) findes derimod i udkanten af forureningsfanen, hvor koncentrationen og reaktiviteten af organisk stof er lav på grund af den forudgående nedbrydning og fortynding. Foruden, at organisk stof kan omdannes vha. uorganiske terminale elektronacceptorer, kan en del organisk stof fermenteres (forgæres). Ved fermentering omdannes den organiske forbindelse typisk til en anden, mere reduceret forbindelse ofte samtidig med, at der udskilles CO2. Den organiske forbindelse kan alternativt spaltes i to organiske forbindelser, en mere reduceret og en mere oxideret. Resultatet af fermentative processer er ofte korte fede syrer fx acetat og propionat (se afsnit 3.3). Tabel 2.4. Mikrobielle redox-processer med angivelse af Gibbs fri energi (kcal pr mol) ved pH 7 under standardbetingelser (efter Champ et al., 1979).
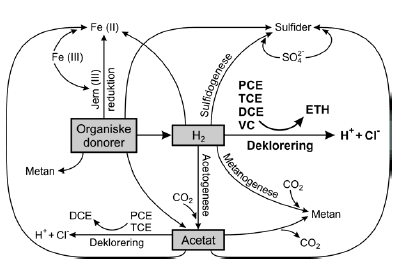
Visse miljøfremmede stoffer nedbrydes imidlertid ikke ved oxidation med en elektronacceptor. Klorerede stoffer kan som nævnt i afsnit 2.11 nedbrydes ved halorespiration under anaerobe forhold, hvor den klorerede forbindelse benyttes som elektronacceptor. For at processen kan forløbe kræves, at der er en elektrondonor fx hydrogen eller format tilstede. Ved denne elektrontransport frigives energi, som bakterierne kan udnytte til vækst. Tilsætning af elektrondonor i form af organisk stof vil imidlertid ikke kun stimulere de deklorerende bakterier, men også aktiviteten af andre bakterier, der kan anvende samme elektrondonor eller produkterne fra nedbrydningen af denne. Dette kan være til gavn for de deklorerende bakterier ved at øge aktiviteten af hydrogenproducerende organismer eller hæmmende ved at øge væksten af metanogene bakterier ved tilsætning af substrater som fx metanol. En simplificeret oversigt af elektrontransporten i komplekse mikrobielle systemer er vist på figur 2.4, med fokus på de deklorerende bakteriers anvendelse af hydrogen til deklorering af klorerede ethener til ethen. Andre bakterier ser ud til at kunne deklorere PCE/TCE til cis-DCE ved anvendelse af acetat som elektrondonor (Krumholz et al., 1996; Krumholz, 1997). Figur 2.4 viser også de elektronacceptorer, der kan være til stede i jord-og grundvandssystemer, undtagen oxygen og nitrat, som er vigtige elektronacceptorer under mere oxiderede forhold. Samlet set kan tilstedeværelse eller tilsætning af elektrondonor altså have flere effekter:
Figur 2.4. Anaerob reduktiv deklorering og samspillet med elektrondonorer og konkurrerende elektronacceptorer i komplekse mikrobielle samfund (modificeret efter Fennell og Gossett, 2003). 2.3 Mikroorganismer og anaerob dekloreringDehalorespirerende bakterier er i stand til reduktivt at deklorere klorerede organiske stoffer i en anaerob respirationsproces ofte kaldet halorespiration. Klorerede stoffer, der kan anvendes af halorespirerende bakterier, inkluderer bl.a. klorphenoler, klorbenzener, trikloracetat og klorerede ethener. I denne rapport omtales kun halorespirerende bakterier, der kan nedbryde klorerede ethener. Det første bevis på eksistensen af bakterier, der kan koble reduktiv deklorering af PCE til vækst under strikt anaerobe forhold blev præsenteret af Holliger et al. (1993). De observerede, at en oprenset og beriget bakteriekultur voksede ved reduktion af PCE til cis-DCE med hydrogen som elektrondonor. Denne bakterie, der kun kan anvende hydrogen som elektrondonor og yderligere kun kan koble vækst til reduktion af PCE eller TCE til cis-DCE fik siden navnet Dehalobacter restrictus. Siden 1993 er flere renkulturer blevet isoleret, som kan anvende klorerede ethener til vækst ved halorespiration. Halorespirerende bakterier er fundet i flere forskellige fylogenetiske grupper, hvoraf mange er genetisk relateret til gram-positive og gram-negative sulfat-reducerende bakterier. I tabel 2.5 er vist de halorespirerende bakterier, der kan deklorere PCE samt deres karakteristika. Mange af de deklorerende bakterier er i stand til at anvende flere forskellige elektrondonorer til reduktion af PCE eller TCE. Ofte anvendte elektrondonorer inkluderer pyruvat, laktat, format og hydrogen. Dehalobacter restrictus og Dehalococcoides ethenogens er begrænset til anvendelsen af hydrogen, mens Desulfuromonas chlorethanica kan anvende acetat, men ikke hydrogen. Andre organiske stoffer, der kan anvendes som elektrondonorer af de halorespirerende bakterier, inkluderer fermenteringsprodukterne ethanol, propionat og butyrat. Hydrogen og format er vigtige elektrondonorer for størstedelen af de halorespirerende bakterier og spiller en vigtig rolle i syntrofiske interaktioner mellem bakterier, der oxiderer fermenteringsprodukter som propionat, butyrat og ethanol og andre bakterier, der anvender disse substrater (se afsnit 3.3). Blandt de PCE-deklorerende halorespirende bakterier er det kun Dehalococcoides ethenogens 195, der reduktivt kan deklorere PCE eller TCE fuldstændigt til ethen. Det sidste trin i dekloreringsfølgen fra vinylklorid til ethen foregår formentlig ved cometabolsk transformation og er ikke kædet sammen med anaerob respiration (Maymó-Gatell et al. 1997). Andre PCE-deklorerende halorespirende bakterier som Desulfitobacterium sp. strain PCE-S og TCE1, Dehalobacter restrictus, Desulfomonas chloroethenica TT4B og Dehalospirillum multivorans kan kun deklorere PCE til cis-DCE. Desulfitobacterium sp. strain PCE1 deklorerer kun PCE til TCE. Denne bakteriestamme kan dog også anvende klorphenol-lignende forbindelser som elektronacceptor - en egenskab man også finder hos den PCE-deklorende Desulfitobacterium sp. strain PCE-S. Tabel 2.5. Halorespirerende bakterier der kan deklorere PCE.
* Dehalogenering uden kobling til vækst Referencer. a: Holliger et al., 1993, b: Holliger et al., 1998; c: Wild et al., 1996; d: Scholz-Muramatsu et al., 1995; e: Neumann et al., 1995; f: Neumann et al., 1994; g: Gerritse et al., 1996b; h: Gerritse et al., 1996a, i: Gerritse et al., 1997; j: Miller et al., 1996; k: Utkin et al., 1995; l: Krumholz, 1996; m: Krumholz 1997; n: Mayó-Gatell et al., 1997. De fleste halorespirerende bakterier er istand til at bruge andre elektronacceptorer end klorerede stoffer. To undtagelser er dog Dehalobacter restrictus og Dehalococcoides ethenogens, hvilket er overraskende, da klorerede ethener sandsynligvis ikke akkumuleres i signifikante mængder til at garantere overlevelse under naturlige forhold. Flere halorespirerende bakterier kan anvende nitrat som elektronacceptor. Sulfu-oxyanioner som sulfit, thiosulfat, og i enkelte tilfælde sulfat anvendes af flere af de halorespirerende bakterier som elektronacceptorer. Inhibering af deklorering er observeret ved tilstedeværelse af konkurrerende elektronacceptorer som nitrat, sulfit, thiosulfat og format (Holliger et al., 2003). Reguleringsmekanismen for hvilken elektronacceptor, der induceres, er endnu ukendt. Forsøg har dog vist, at deklorering kun induceres ved tilstedeværelse af klorerede elektronacceptorer. Ved anvendelse af stimuleret reduktiv deklorering som afværgeteknologi er det afgørende, at der opnås fuldstændig nedbrydning af PCE eller TCE til ethen. På lokaliteter, hvor der ses akkumulering af cis-DCE, kan det skyldes, at halorespirerende bakterier af typen Dehaloccocides ikke er tilstede, og det kan derfor være en mulighed at pode med disse bakterier (bioaugmentation). For optimal vækst af Dehalococoides kræves tilstedeværelse af andre bakterier, der dels kan fermentere elektrondonorer til hydrogen og dels producere kO-faktorer, der er nødvendige for Dehalococoides. Mikrobielle kulturer, der er udviklet til in situ oprensning, består derfor typisk ikke af en enkelt type af Dehalococoides, men indeholder en blanding af forskellige mikroorganismer. Der eksisterer flere blandingskulturer, der er opformeret til at kunne nedbryde PCE eller TCE fuldstændigt til ethen. Flere af disse har været anvendt in situ til oprensning af grunde forurenet med PCE eller TCE. I tabel 2.6 er anført blandede bakteriekulturer, der kan nedbryde PCE til ethen. Endvidere er vist, hvorvidt disse kulturer har været anvendt i afværgeprojekter, og om de er kommercielt tilgængelige (se også afsnit 4.5.1). Tabel 2.6. Blandede bakteriekulturer der kan deklorere PCE eller TCE fuldstændigt til ethen.
2.4 Mikrobielle metoder til undersøgelse af DehalococcoidesUndersøgelse for tilstedeværelse af Dehalococcoides spp. i sediment og grundvandsprøver kræver særlige mikrobielle teknikker. På grund af Dehalococcoides spp. samspil med andre mikroorganismer samt behovet for unikke vækstfaktorer kan konventionelle metoder som pladespredning ikke anvendes. I stedet må der anvendes DNA-baserede metoder. Polymerase kæde-reaktion (PCR: polymerase chain reaction) anvendes for at lave en forstærkning af signalet i begge de hidtil anvendte teknikker. I den ene teknik analyseres PCR-produktet ved en ordinær gelelektroforese (PCR-GE), mens produktet i den anden teknik analyseres ved denaturerende gradient gel-electroforese (denaturing gradient gel-electrophoresis: DGGE) efterfulgt af sekventering. Begge teknikker baserer sig på 16S rDNA-genet, da dette indeholder meget varierede og konserverede sekvenser, som kan bruges til at identificere grupper, arter og stammer af bakterier. Sådanne DNA-fingerprint-metoder eller molekylæranalyser kan anvendes til at spore vækst og transport af bakterier tilsat jord- og grundvandssystemer i forbindelse med biostimulering (Hendrickson et al. 2001; Hristova et al. 2001; Dybas et al. 2002; Major et al. 2002; Lendvay et al. 2003), eller til at undersøge for tilstedeværelsen af specifikke bakterier fx Dehalococcoides med henblik på at vurdere behovet for at pode med bakterier for at opnå fuldstændig nedbrydning af PCE/TCE til ethen. PCR retter sig mod specifikke variable regioner i 16S rDNA ved anvendelse af korte stykker DNA (kaldet oligonukleotider eller PCR primere), som er kemisk syntetiseret og har en kendt sekvens, der binder til den korresponderende komplementære sekvens i 16S rDNA genet. Ved PCR-processen replikeres et specifik stykke med en tilhørende bestemt størrelse af dette gen. Produkterne dannet ved PCR-processen overføres til en gel som påsættes en elektrisk strøm (gel elektrO-phorese). PCR-produkterne har en kendt størrelse og vil vandre et bestemt stykke afhængig af dets molekylære størrelse (som verificeres af en intern række af genfragmenter af kendt størrelse). Såfremt PCR produktet er tilstede, vil det forme et synligt bånd, når det udsættes for ultraviolet lys. Bånd svarende til en bestemt molekylstørrelse indikerer tilstedeværelse af Dehalococcoides, hvorimod fravær af bånd indikerer, at der ikke er Dehalococcoides i den specifikke prøve. I modsætning til PCR efterfulgt af ordinær gelelektroforese anvender man ved DGGE universale primere, som ligeledes vil hæfte sig til 16S rDNA og medføre, at det replikeres. I stedet for at replikere genet for blot een enkelt mikroorganisme replikeres genet for alle mikroorganismer i prøven. Sekvensen af basepar er unik for hver mikroorganisme, hvorfor disse vil denatureres med forskellig hastighed under vandring igennem en gel under eksponering for en stigende koncentration af urinstof. Når PCR produktet er fuldstændig denatureret, vil det stoppe videre vandring i gelen. Resultatet er at der dannes forskellige bånd (i modsætning til PCR-GE hvor der dannes eet bånd), hvor hvert bånd repræsenterer en bakteriestamme eller art. Båndene kan herefter klippes ud af gelen, og det amplificerede 16S rDNA sekventeres for at bestemme rækken af basepar i nukleotiderne. Identifikation sker ved at sammenligne de fundne nukleotid-sekvenser med nukleotid-sekvenser for kendte mikroorganismer via en international database. PCR efterfulgt af ordinær gelelektroforese (PCE-GE) er den mest anvendte af disse metoder, da den er relativ let at anvende og kan justeres til at identificere en bestemt bakterieart eller stamme. Selvom PCR-GE generelt ikke er en kvantitativ metode, er der en korrelation mellem intensiteten af gelbåndet, og mængden af genmateriale ekstraheret fra den oprindelige prøve. Der eksisterer kvantitative PCR-metoder, som kan anvendes til at bestemme antallet af specifikke gener i den oprindelige prøve. Der eksisterer flere teknikker til kvantificering eller semi kvantificering af PCR produkter (Fredslund et al., 2001; Johnsen et al., 1999), men en ny teknik, der er baseret på online målinger af PCR produktet, er REAL-TIME PCR. Der er endnu ikke publiceret nogle kvantitative teknikker for Dehalococoides detektion, men metoderne er i en rivende udvikling.
|