Rensning af arsen i en traditionel vandbehandling vandværker
2 Aspekter af arsens geokemi
I disse år er der internationalt en stor årvågenhed med hensyn til den naturligt betingede forekomst af arsen i ferskvandssystemet, hvilket har resulteret i en betydelig mængde ny faglitteratur om emnet. Det er valgt her at fremhæve aspekter vedrørende arsens geokemi, af særlig relevans for arsens kemiske optræden i sandfiltre i vandbehandlingen. For en uddybende diskussion af arsens geokemi i naturlige systemer kan henvises til Smedley & Kinniburgh (2002), og med hensyn til arsens kemi i vandbehandlinger kan henvises til Hering et al. (1996) og Hering et al. (1997).
2.1 Arsens kemi i vand
I naturlige systemer forekommer arsen i oxidationstrin: As(V), As(III), As(0) og As(-III). Under de redox-forhold som forekommer i grundvand og vandbehandlinger, vil arsen dog sædvanligvis primært forekomme som As(V) og As(III).
Stabilitetsforholdet mellem As(III) og As(V) er blandt andet afhængig af pH og temperatur, men generelt kan man sige, at den forekommer ved et redox-potentiale, hvor der også sker en omsætning mellem Fe(II) og Fe(III), det vil sige ved en pe omkring 0 (Cherry et al., 1979; Appelo & Postma, 1999a).
2.1.1 Komplexdannelse i vandige opløsninger
I rene vandige opløsninger danner As(III) og As(V) komplekser med ilt og brint, og koncentrationen af frie ioner af arsen er ubetydelig. Ved pH forhold, som normalt forekommer i sandfiltre, er de dominerende As(V) komplekser H2ASO4- og HASO42-, mens As(III) forekommer i form af H3AsO3 (Figur 1). Ved pH over 9 er det dominerende As(III) komplex H2AsO3-.
2.1.1.1 Kompleksdannelse med andre komponenter i vand
Arsen danner i naturligt grundvand hovedsageligt inorganiske komplekser (Smedley & Kinniburgh, 2002).
Kompleksdannelser mellem arsen og andre komponenter i naturligt vand er undersøgt især for karbonationer (Kim et al., 2000; Lee & Nriagu, 2003) og for sulfid (Helz et al., 1995; Wilkin et al., 2003).
De væsentligste kompleksdannelser synes at forekomme mellem As(III) og sulfid. Disse kaldes samlet thioarsenitter og indeholder blandt andre komplekserne As(OH)2S-, As(OH)S22- og AsS3H2-.
I forbindelse med undersøgelsesprogrammet er der foretaget modelberegninger med det numeriske grundvandsgeokemiske program PHREEQC (Parkhurst & Appelo, 1999). Disse beregninger er gennemført med anvendelse af ligevægtskonstanter fra Wilkin et al. (2003), og de viser, at mindre end 1 % af As(III) vil forekomme bundet i thioarsenitkompelkser i den vandtype, som forekommer på Fensmarks Vandværk.
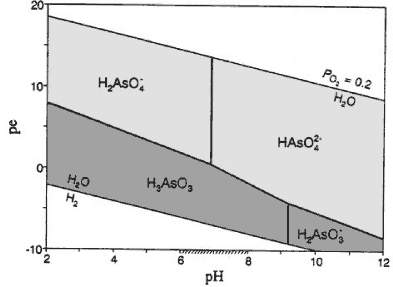
Figur 1. Kompleksdannelser af arsen i rene vandige opløsninger ved naturligt forekommende redoxpotentialer (pe) og pH værdier (ved 25 °C). I det mørkegrå felt findes arsen som As(III) mens det lysegrå område markerer den oxiderede As(V). Det skraverede interval på x-aksen mellem pH 6 og 8 indikerer et normalt interval for pH i grundvand. Modificeret efter Appelo & Postma (1999a).
2.2 Transformation af arsen
Oxidation og reduktion af As(III) og As(V) kan forekomme både abiotisk og biotisk (Meng et al., 2003).
Abiotisk oxidation af As(III) med opløst ilt forløber meget langsomt. Således er en halveringstid på ét år foreslået i litteraturen (jf. Scott & Morgan, 1995). Med de givne opholdstider i sandfiltrene i danske vandværker, må det således formodes, at såfremt der forekommer oxidation af As(III) til As(V), må dette ske ved reduktion af andre forbindelser end ilt. Oxidation af As(III) med ilt kan dog forekomme ved katalyse af andre af systemets komponenter (Hug & Leupin, 2003).
As(III) kan oxideres relativt hurtigere via reaktioner på mineraloverflader. I flere undersøgelser er det således påvist, at As(III) kan oxideres effektivt på
overfladen af manganoxider (Driehaus et al., 1995; Borho & Wilderer, 1996; Scott & Morgan, 1995; Chiu & Hering, 2000; Manning et al., 2002; Tournassat et al., 2002). Ifølge Scott & Morgan (1995) oxideres As(III) af overfladenært lokaliserede Mn(IV) i krystalgitteret, der reduceres til Mn(II). Oxideret arsen returneres efterfølgende som As(V) til vandfasen. En del af det reducerede Mn(II) adsorberes til overfladen indtil adsorptionskapaciteten er nået, og Mn(II) frigives herefter til vandfasen. En fuldstændig oxidation af 500 µg/L As(III) med manganmineralet birnessit (MnO2) er påvist i løbet af ca. 1 time ved pH 7, med en koncentration af birnessit på 0,5 g/L (Driehaus et al., 1995). Manning et al. (2002) observerede fuldstændig oxidation af As(III) (>5000 µg/L) med 0,25 g birnessit/L i løbet af 30 minutter (pH 6,5).
Hurtig oxidation af As(III) til As(V) på overfladen af amorfe jernoxider kan katalyseres af opløst H2O2 (hydrogenperoxid), men i opløsninger uden H2O2 foregår oxidationen langsomt (Voegelin & Hug, 2003). Lignende resultater er opnået af Kim & Nriagu (2000). Produktet As(V) adsorberedes i høj grad til overfalden af jernoxiderne i disse forsøg.
Uden kontakt til mineraloverflade kan As(III) oxideres af Fe(VI). Ved oxidationen af As(III) reduceres Fe(VI) til Fe(III) (Lee et al., 2003). Produktet As(V) kan medudfældes ved udfældningen af Fe(III) som jernoxid. Lee et al. (2003) foreslog anvendelsen af processen til fjernelse af arsen ved vandbehandling.
Af andre reaktioner hvorved As(III) kan oxideres til As(V), kan nævnes oxidation med ilt, katalyseret af opløst Fe(II) (Hug & Leupin, 2003). Såvel mikrobiologisk oxidation (Wilkie & Hering, 1998; Langer et al., 2001) som reduktion (Langner & Inskeep, 2000) af arsen er desuden påvist. Endvidere er reduktion af As(V) med H2S under anaerobe forhold påvist af Rochette et al. (2000).
2.3 Arsens binding til jern- og manganoxider
Arsens evne til at bindes til jern- og manganoxider [1] er blevet særlig grundigt studeret siden slutningen af 1980'erne, og potentialet i at anvende jernoxider eller udfældning af disse i forbindelse med fjernelse af arsen er bredt accepteret. Manganoxider kan ligesom jernoxider binde arsen, men i mindre grad.
I forbindelse med bindingen af arsen til jern- og manganoxider er det væsentligt at skelne mellem adsorption og medudfældning. Ved adsorption bindes arsen til overfladen af oxider. Ved medudfældning indbygges arsen i oxiderne i forbindelse med at disse dannes. En sådan indbygning af arsen i oxiderne kan desuden benævnes absorption. Under ét benævnes binding af arsen ofte blot med ordet sorption.
2.3.1 Amorfe og velkrystallinske jernoxider
Der findes i alt 16 typer af jernoxider, som overordnet kan inddeles i amorfe og mere velkrystallinske former (Cornell & Schwertmann, 1996). I forbindelse med udfældningen af jern som jernoxid dannes først såkaldt amorft jernoxid, som er karakteristisk ved at atomerne i forbindelsen ikke forekommer i et velstruktureret atomgitter. Amorft jernoxid kan med tiden rekrystallisere til de mere velkrystallinske jernoxider, f.eks. magnetit, lepidocrosit, goethit og hematit. Hastigheden hvormed rekrystalliseringen foregår afhænger af forhold som pH og temperatur, og kan påvirkes af tilstedeværelsen af andre stoffer adsorberet til eller indbygget i jernoxiderne. Tidsperspektivet for signifikant rekrystallisering er bredt, i størrelsesorden dage til år.
Et jernoxids kapacitet til at binde arsen ved overfladeadsorption er bl.a. betinget af mineralets overfladeareal, idet der ved større overfladearealer er forholdsvist mange reaktive pladser på overfladerne, hvor arsen kan bindes. Amorfe jernoxider har et stort specifikt overfladeareal på helt op imod 600 m2/g jernoxid (Dzombak & Morel, 1990). Til sammenligning har mere velkrystallinske jernoxider lavere specifikke overfladearealer, typisk omkring 50 m2/g.
Fuller et al. (1993) påviser at gradvist mindre arsen adsorberes til amorft jernoxid, allerede inden for de første 144 timer efter at jernoxiderne er dannet. Denne observation viser, at antallet af sorptionspladser begrænses i forbindelse med rekrystalliseringen og reduktionen i specifikt overfladeareal.
2.3.2 Medudfældning og adsorption af arsen på jernoxider
Sorption af As(III) og As(V) til jernoxider afhænger i høj grad af pH (f.eks. Dixit & Hering, 2003). Da pH i vandbehandlinger er oftest er mellem 6 og 8, er der i den følgende gennemgang af litteraturen konsekvent udvalgt data, som er målt ved pH 7 ± 1, med mindre andet er nævnt.
Udfældning af amorft jernoxid og medudfældning af arsen er tæt forbundne processer. Ved udfældning af amorft jernoxid dannes først meget små kolloider af jernoxid i vandfasen. Disse kolloider aggregerer efterfølgende ved Van der Waals kræfter til amorft jernoxid. Medudfældning af arsen indebærer at arsen adsorberes til kolloiderne og indbygges i den amorfe jernoxid idet kolloiderne aggregerer (Waychunas et al., 1993). Medudfældning af arsen med jern vil automatisk medføre at arsen absorberes til amorft jernoxid, mens adsorption af arsen kan ske til amorft jernoxid såvel som til velkrystallinske jernoxider. Sorption af arsen sker til jernoxidernes (eller jernoxidkolloidernes) overflader, og i særlig grad til anormaliteter på overfladerne (Waychunas et al., 1993).
Flere studier viser, at medudfældning af arsen fører til en mere effektiv fjernelse end adsorption til allerede udfældede jernoxider (Waychunas et al., 1993; Hering et al., 1997). Dette skyldes et relativt større reaktivt specifikt overfladeareal på jernoxidkolloiderne, som dannes i vandfasen ved udfældningen af jernoxider (Waychunas et al., 1993). Desuden er der påvist større sorption af As(V) til jernoxider end As(III) i et stort antal undersøgelser (Bowel, 1994; Wilkie & Hering, 1996; McNeill & Edwards, 1997; Farquhar et al., 2002; Hering et al., 1997).
Sorption af arsen til amorfe jernoxider er studeret af bl.a. Hering et al. (1997). Disse undersøgelser angår bindingen af både As(III) og As(V) ved såvel medudfældning som adsorption til eksisterende amorfe jernoxider. Resultater fra forsøgene fremgår af Figur 2, hvor x-aksen viser ligevægtskoncentrationen af arsen i vandfasen og y-aksen viser koncentrationen af arsen i jernoxiderne, opgivet i enheden µg As/g jernoxid.
Det fremgår af Figur 2, at ved koncentrationer af As(V) over 5 µg/L, vil der ved medudfældning forekomme en koncentration af arsen på omkring 12.500 µg per gram af de nydannede jernoxider. Dette vil forekomme som en ligevægtskoncentration mellem arsen i vandfasen og i jernoxiderne, således at stigende koncentration af arsen i vandfasen medfører stigende koncentration af sorberet arsen i jernoxiderne. Til sammenligning ses af Figur 2, at ved sammenlignelige koncentrationer af As(III), vil der maksimalt kunne forekomme 2.500 µg As per gram jernoxid.
Ved medudfældning af arsen i nydannede jernoxider, kan der således indarbejdes mere As(V) end As(III) i jernoxiderne, hvilket alt andet lige må betyde, at en transformation af As(III) til As(V) vil medføre en mere effektiv fjernelse af arsen.
Ved ligevægtsbetingelser vil der ved adsorption kunne indarbejdes mindre mængder arsen i jernoxiderne end tilfældet er ved medudfældning (Figur 2). Ved adsorption kan der således indarbejdes omkring 2.500 µg arsen per g jernoxid, hvilket kun er omkring 1/5 af den mængde, som kan indarbejdes ved medudfældning. Der indarbejdes mindre As(III) end As(V) ved såvel medudfældning som ved adsorption, idet der ved medudfældning kun kan indarbejdes omkring 1.000 µg As(III) per g jernoxid, mens der adsorberes omkring 500 µg arsen per g jernoxid.
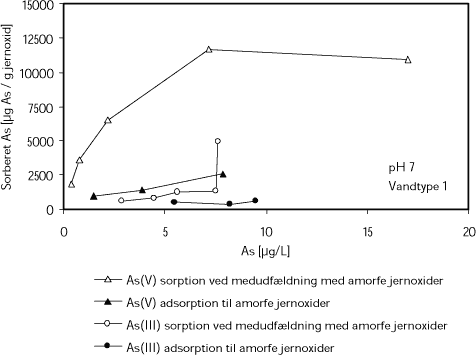
Figur 2. Sorption af As(III) og As(V) ved medudfældning med jern eller adsorption til allerede udfældede amorfe jernoxider. Forsøgene er udført med naturligt vand, Vandtype 1. Vandkemien er vist i Tabel 1 side 26. Figuren er udarbejdet på baggrund af data fra Hering et al. (1997).
De højest målte sorptionsdensiteter i forsøgene af Hering et al. (1997) var omkring 12.500 µg As/g jernoxid. I tilsvarende undersøgelser af Richmond et al. (2004) blev der målt koncentrationer af arsen i jernoxider på op mod 70.000 µg As/g jernoxid ved koncentrationer af arsen i vandfasen på omkring 500 µg/L.
Binding af arsen ved adsorption til velkrystallinske jernoxider, lepidocrocit, goethit og hematit er undersøgt af Bowel (1994). Resultaterne af denne undersøgelse viser, at mængden af arsen som kan indarbejdes i de velkrystallinske jernoxider er betydeligt mindre, end tilfældet er for de amorfe jernoxider. Dette fremgår af Figur 3, hvor koncentrationerne af arsen i de velkrystalinske jernoxider er op til 3 µg arsen per g jernoxider, mens koncentrationerne i de amorfe jernoxider i Figur 2 er op mod 2.500 µg arsen per g jernoxid.
As(V) bindes bedst til de velkrystallinske jernoxider lepidocrocit og goethit, mens bindingen af As(V) til hematit er omtrent halv så stor, eller 1,5 µg arsen per g jernoxid. Der bindes omkring 1,5 µg As(III) per gram til alle de tre undersøgte jernoxider. Disse forsøg er gennemført med en initial koncentration af arsen på 76 µg/L.
2.3.2.1 Maksimal sorption af arsen på jernoxider
Ved meget høje koncentrationer af arsen i vandfasen kan der forekomme en mætning af oxidernes kapacitet til at binde arsen.
Fuller et al. (1993) målte således maksimale koncentrationer ved adsorption af As(V) til jernoxider på 213.000 µg As/g jernoxid. Ved medudfældninger kunne der opbygges koncentrationer af As(V) i jernoxider på op til 597.000 µg As/g jernoxid, hvilket svarer til 0,7 mol arsen per mol jern. Ved et så højt forhold mellem arsen er det tvivlsomt, om der rent faktisk er tale om medudfældning til jernoxid, eller om et eller flere arsenmineraler i stedet dannes.
Dixit & Hering (2003) udførte forsøg med adsorption af As(V) til amorfe jernoxider, og påviste maksimale koncentrationer af arsen på 180.000 µg As(V)/g jernoxid (pH 4). Forsøg med adsorption af As(V) til goethit gav maksimale koncentrationer på 14.000 µg As(V)/g jernoxid. Koncentrationen af As(III) i amorft jernoxid, goethit og magnetit blev målt til hhv. 220.000, 14.000 og 12.000 µg As(III)/g jernoxid.
Generelt kan det siges, at kapaciteten til at binde arsen således er højest for amorft jernoxid, hvor forholdet mellem arsen og jern i udfældninger kan være så store som 105 µg As/g jernoxid. For de velkrystalliserede jernoxider er kapaciteten en størrelsesorden mindre, det vil sige 104 µg As/g jernoxid.
Til sammenligning kan nævnes, at der i denne undersøgelse er påvist koncentrationer af arsen i jernoxider i sandfiltre på mellem 8.000 og 13.000 µg As/g jernoxid
2.3.2.2 Model for fjernelse af arsen i en vandbehandling
McNeill & Edwards (1997) præsenterer en model, der beskriver fjernelsen af As(V) kvantitativt, i procent, som funktion af jernindholdet i råvandet:

hvor CFe er koncentrationen af jern i råvandet og K er en konstant. For CFe i [mg/L] er K i [L/mg]. McNeill & Edwards fandt, at K = 1,45 L/mg gav det bedste fit til observationer fra en række vandværker i USA.
Ifølge modellen sker fjernelsen af arsen ved at arsen bindes til kolloider af jernoxid eller medudfældes i forbindelse med at kolloiderne dannes. Det er en forudsætning at sorptionskapaciteten ikke nås. I filtrene filtreres kolloiderne med sorberet arsen fra vandstrømmen, og arsen medudfældes med evt. restjern.
I Figur 4 er data fra en række vandværker i Storstrøms Amt vist sammen med McNeill & Edwards model. Data for det enkelte vandværk er beregnet på baggrund af gennemsnitsværdien af arsen- og jernkoncentrationerne i boringskontroller i værkets indvindingsboringer samt gennemsnitsværdien af koncentrationerne af arsen i rentvandsanalyser fra værket. Kun vandværker for hvilke koncentrationerne af arsen i indvindingsboringerne i gennemsnit er større end 5 µg/L er inddraget i figuren.
Det ses i Figur 4, at der er god overensstemmelse mellem modellens forudsigelser og data fra vandværkerne.
Figur 4 viser desuden en stærkere afhængighed af arsenfjernelsen med koncentrationen af jern ved lave end ved høje koncentrationer af jern. Fjernelsesprocenten af arsen øges fra 0 til 75 % ved en stigning i koncentrationen af jern fra 0 til 2 mg /L. Ved en stigning i koncentrationen af jern fra 2 til 4 mg/L øges fjernelsesprocenten af arsen kun med yderligere ca. 10 %, fra 75 % til 85 %. Med andre ord indikerer data fra Storstrøms Amt, at råvandets indhold af jern ved koncentrationer under omkring 2 mg/L er en betydelig begrænsende faktor for fjernelsen af arsen.
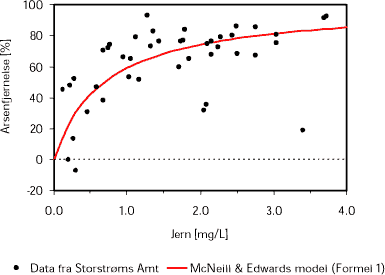
Figur 4. McNeill & Edwards model (fuldtoptrukken rød linie) sammenlignet med data fra vandværker i Storstrøms Amt (punkter). Kun vandværker, hvor gennemsnitsværdien af arsenkoncentrationerne i det enkelte vandværks indvindingsboringer er større end 5 µg/L er inddraget. K = 1,45 er anvendt. Databehandling foretaget af Henrik Andersen, Storstrøms Amt.
2.3.3 Medudfældning og adsorption af arsen på manganoxider
Det er påvist i en række undersøgelser, at manganoxider har en evne til at binde arsen såvel på formen As(III) som As(V). Da manganoxider som tidligere nævnt også kan medvirke til oxidation af As(III) til As(V), vil det imidlertid være sorption af As(V), som kontrollerer koncentrationen af arsen ved ligevægt, i forbindelse med en sorption på manganoxider i et sandfilter.
Driehaus et al. (1995) bestemte adsorptionen af arsen til birnessit (MnO2) ved ligevægtskoncentrationer af arsen på mellem ca. 40 – 400 µg/L i vandfasen (pH 7,5, 10 mM NaNO3). De højeste påviste koncentrationer af arsen i manganoxiderne var omkring 13.000 µg As/g birnessit. Ved en ligevægtskoncentration af arsen på ca. 40 µg/L i vandfasen var indholdet af arsen i manganoxiderne ca. 3.000 µg As/g birnessit.
Manning et al. (2002) bestemte koncentrationer af As(III) og As(V) til hhv. 20.200 og 3.850 µg As/g birnessit (pH 6,5, 0,1 M NaCl). Da adsorberet As(III) i disse forsøg hurtigt vil oxideres til As(V), er den høje koncentration af arsen på 20.200 µg As/g birnessit kun midlertidig, og ved fuldstændig oxidation vil koncentrationen derfor for As(V) være 3.850 µg As/g birnessit.
Sammenfattende kan det siges, at manganoxider har en kapacitet til at binde arsen, men at kapaciteten generelt er mindre end tilfældet er for jernoxider.
2.3.4 Konkurrence fra andre opløste stoffer
I grundvand findes naturligt en lang række stoffer, som kan mindske arsens binding til jernoxider. Da binding af arsen til jernoxider er væsentlig i vandbehandlingen, kan tilstedeværelsen af disse stoffer i vandet føre til en mindsket effektivitet i fjernelsen af arsen.
2.3.4.1 Effekt fra anioner og opløst organisk stof
Undersøgelser i faglitteraturen har i særlig grad fokuseret på hæmmende effekter fra anionerne fosfat, sulfat, bikarbonat og silicium på sorption af arsen til jernoxid (Hering et al., 1996; Wilkie & Hering, 1996; Hering et al., 1997; Meng et al., 2000; Meng et al., 2002; Violante & Pigna, 2002; Waltham & Eick, 2002; Dixit & Hering, 2003; Vaishya & Gupta, 2003). Desuden foreligger undersøgelser af betydningen af organisk stof (Hering et al., 1997; Grafe et al., 2001; Redman et al., 2002) og af chlorid (Vaishya & Gupta, 2003).
Den generelle tendens er, at sorption af arsen hæmmes gradvist mere med stigende koncentrationer af ovennævnte stoffer. Dette skyldes, at stofferne konkurrerer med arsen om sorptionspladser på oxidernes overflade. Med stigende koncentrationer af stofferne optages således et stigende antal af de reaktive sorptionspladser, hvilket bevirker, at færre sorptionspladser er tilgængelige for arsen (Meng et al., 2002; Violante & Pigna, 2002).
Ud fra forsøg med As(V) og As(III), fosfat, silicium og bikarbonat beregner Meng et al. (2002) at stoffernes affinitet for jernoxid falder i rækkefølgen As(V) > PO4 > As(III) > Si > HCO3. Tilsvarende konkluderer Vaishya & Gupta (2003), at affiniteten for jernoxid for stofferne As(III), sulfat, bikarbonat og chlorid falder rækkefølgen As(III) >> SO4 > HCO3 > Cl. Meng et al. (2000) konkluderer, at effekten af sulfat og karbonat på sorption af As(III) og As(V) er ubetydelig, mens effekten af silicium er signifikant. Overordnet set må der derfor kunne foreslås følgende affinitetsrække for anionernes affinitet for jernoxid:

En forudsætning for rækkefølgen af stofferne i ovenstående affinitetsrække er, at stofferne optræder i ens koncentrationer. De ifølge affinitetsrækken relativt lave betydninger af sulfat, bikarbonat og chlorid støttes imidlertid i studier af Meng et al. (2002), Hering et al. (1996) og Hering et al. (1997). Dette til trods for, at disse stoffer typisk optræder i koncentrationer, der er størrelsesordener større end koncentrationerne af fosfat og silicium.
Modsat vil betydningerne af fosfat, særligt for As(III), og silicium ifølge affinitetsrækken være store. I grundvand kan koncentrationen af silicium være 100 til 1000 gange større end koncentrationen af fosfat. Silicium vil derfor reelt kunne have større betydning end fosfat for arsens binding til jernoxider.
Placering af organisk stof i affinitetsrækken vanskeliggøres af, at organisk stofs binding til oxidoverflader muligvis er karaktermæssigt forskellig fra de øvrige anioners (Hering et al., 1997). I afsnit 2.3.4.2 nedenfor, vil en egentlig kvantificering af betydningen af fosfat, silicium og organisk stof blive behandlet.
De indbyrdes positioner af As(V) og As(III) i affinitetsrækken indikerer, at tilstedeværelsen af konkurrerende stoffer påvirker sorption af As(III) betydeligt mere end af As(V). Dette er også konklusionen i flere undersøgelser (Hering et al., 1996; Wilkie & Hering, 1996; Hering et al., 1997; Meng et al., 2002). Dette har stor betydning i vandbehandlingen, hvor man således må forvente, at konkurrencen fra anioner i vandet vil bevirke, at As(V) bindes bedre end As(III).
Det skal her nævnes, at undersøgelser i litteraturen har påvist, at As(III) kan sorberes til jernoxider i samme eller højere grad som As(V) ved neutral pH (Joshi & Chaudhuri, 1996; Manning et al., 1998; Raven et al., 1998; Sun & Doner, 1998; Dixit & Hering, 2003). Dette kan skyldes de forsøgsforhold, hvorunder undersøgelserne har været gennemført. På nær undersøgelsen af Joshi & Chaudhuri (1996), hvori der benyttes grundvand, sorberes As(III) og As(V) i disse undersøgelser til jernoxider i laboratorieforsøg fra rene vandige opløsninger med baggrundselektrolytter af NaOH, NaNO3, HCl og lignende.
2.3.4.2 Kombinerede effekter af kationer og anioner
Betydningen af kationerne calcium og magnesium, som almindeligvis findes i dansk grundvand, er endvidere undersøgt i flere studier (Hering et al., 1996; Wilkie & Hering, 1996; Hering et al., 1997; Meng et al., 2000; Vaishya & Gupta, 2003). Modsat effekten fra anionerne og organisk stof, fremmer calcium og magnesium sorption af arsen. Denne sorptionsfremmende effekt skyldes, at kationerne bevirker en mere positivt ladet oxidoverflade, som derved kan binde relativt flere af de negative ionkomplexer af As(V) (Hering et al., 1996; Wilkie & Hering, 1996). I grundvand findes således både sorptionshæmmende, som sorptionsfremmende stoffer.
Ved en vurdering af effekter fra anioner, bør effekter fra kationer derfor medtages. Således reduceres i forsøg at Hering et al. (1996) sorption af As(V) (20 µg/L) fra 80 % i rene opløsninger til knap 70 % i opløsninger tilsat 75 µg/L fosfat. Ved tilstedeværelsen af 120 mg/L calcium i opløsninger uden fosfat øges sorption derimod fra de 80 % til 95 %. Calcium har i disse forsøg en tydelig sorptionsfremmende effekt. Ved samtidig tilstedeværelse af calcium og fosfat i de nævnte koncentrationer er sorptionen den samme, som med calcium alene, altså 95 %.
Betydelige hæmmende effekter af fosfat på sorption af As(III) og As(V) fra opløsninger uden calcium eller magnesium er desuden målt af Dixit & Hering (2003). Meng et al. (2002) observerer imidlertid, at ved koncentrationer af fosfat under 70 µM (6,7 mg/L) er virkningen med hensyn til sorption af As(V) ubetydelig i opløsninger med 300 µg/L arsen, 100 mg/L calcium, 20 mg/L magnesium, og 400 mg/L chlorid. For As(III) forekommer i samme system en reduktion på op mod 75 %.
Med hensyn til silicium viser Meng et al. (2000), at koncentrationer over 1 mg Si/L hæmmer sorption af As(III) og As(V) på jernoxid. Ved en koncentration af silicium på 5 mg/L blev der således påvist en reduktion på 22 %. Denne reduktion udeblev i opløsninger, hvor der samtidig var calcium og magnesium i koncentrationer på hhv. 18 og 7 mg/L.
For opløst organisk stof er det i forsøg af Hering et al. (1997) påvist, at sorption af As(V) kan hæmmes betydeligt ved koncentrationer af organisk stof på over 2 mg/L, særligt ved medudfældning af arsen med jern. Ved 4 mg/L faldt sorption af As(V) således fra ca. 100 % til 30 %. Ved tilstedeværelsen af calcium (120 mg/L) var sorption af As(V) imidlertid upåvirket af en koncentration af opløst organisk stof på 4 mg/L.
2.3.4.3 Sorption af arsen fra grundvandstyper
Kvantificering af effekterne ved opstilling af modeller er forsøgt for fosfat, calcium og sulfat i kombination af Hering et al. (1996) og Wilkie & Hering (1996) og for silicium alene af Meng et al. (2000). Kvantitativt leverer disse modeller dog ikke gode resultater, om end kvalitativt. Da de kombinerede effekter fra flere stoffer endvidere har vist sig ikke at svare til summen af effekterne fra det enkelte stof, vil en mere empirisk (holistisk) tilgang til en kvantificering af de kombinerede effekter i grundvand i det følgende blive anvendt.
Dette vil ske med baggrund i studiet af Hering et al. (1997). I dette studie undersøges sorption af As(III) og As(V) fra to grundvandstyper. Dette studie leverer derfor som udgangspunkt et sammenligningsgrundlag for nærværende undersøgelse. Sammensætningen af de to vandtyper fremgår af Tabel 1. Det ses, at koncentrationen af fosfat er hhv. 150 µg/L og 60 µg/L i Vandtype 1 og 2. Koncentrationen af opløst organisk stof (NOM) er i begge vandtyper over 2 mg/L, hhv. 8,25 og 6,5 mg/L. Med mindre sorptionsfremmende effekter fra calcium og magnesium er betydelige, vil alene koncentrationerne af fosfat og organisk stof i vandtyperne medføre en markant reduktion i sorption af arsen.
Tabel 1. Vandkemi i naturligt vand anvendt til forsøg af Hering et al. (1997).
| Parameter | Vandtype 1 | Vandtype 2 |
| [mg/L] | [mg/L] | |
| Ca | 22 | 65 |
| Na | 46 | 93 |
| Mg | 11 | 26,5 |
| SO4 | 59 | 234 |
| Cl | 50 | 87 |
| PO4 | 0,15 | 0,06 |
| TOCa | 3,3 | 2,6 |
| NOMb | 8,25 | 6,5 |
| Total alkalinitetc | 1,34 | 2,22 |
| Turbiditetd | 0,71 | 0,93 |
a Total organic carbon.
b Natoral Organic Matter (opløst organisk stof). Beregnet som TOC × 2,5.
c Angivet i enheden meq/L.
d NTU.
Resultater fra forsøgene er angivet i Figur 5. Det ses af figuren, at sorption af As(V) fra Vandtype 1 reduceres med op til 15 %, mens sorption af As(III) reduceres med 45 %. Sorption af arsen fra Vandtype 2 er bedre end fra Vandtype 1, på trods af at Vandtype 2 har et højere indhold af sulfat, chlorid og bikarbonat (alkalinitet). Hering et al. (1997) vurderede, at calcium modvirkede sorptionshæmmende effekter fra de øvrige opløste stoffer.
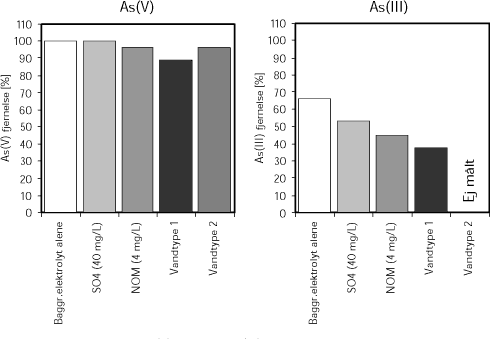
Figur 5. Sorption af 20 µg/L As(V) og 9 µg/L As(III) ved medudfældning med 4,9 mg/L FeCl3 (1,69 mg Fe3+/L) fra opløsninger med baggrundselektrolyt (0,01 M NaNO3, 0,001 M NaHCO3) tilsat SO4 eller naturligt organisk stof (NOM), samt fra Vandtype 1 og 2 (se Tabel 1). Forsøgene er udført ved pH 7. Data fra Hering et al. (1997).
Resultaterne vist i Figur 5 er desuden i overensstemmelse med en lavere følsomhed for vandkemien for As(V) end As(III). Således reduceres sorption af As(III) relativt mere ved tilstedeværelsen af sulfat eller NOM i opløsningen, eller ved sorption fra Vandtype 1.
For tilfældet Fensmark Vandværk er det på baggrund af disse undersøgelser sandsynligt, at tilstedeværelsen af calcium og magnesium i vandet vil bevirke tilsvarende sorptionsfremmende effekter, hvad angår fjernelsen af arsen ved sorption til jernoxider. Koncentrationerne af calcium i vandet til Fensmark Vandværk er mellem 60 og 80 mg/L, og koncentrationer af fosfat i vandbehandlingen er målt til mellem 2 og 26 µg/L. Koncentrationer af opløst organisk stof er ikke bestemt i denne undersøgelse.
Fodnoter
[1] I denne rapport vil termen oxid blive anvendt generelt for jern- og mangan-forbindelser med oxid, hydroxid og oxyhydroxid, med mindre andet fremgår af teksten.
Version 1.0 Juni 2005, © Miljøstyrelsen.