|
Virkningsmekanismer for neurotoksisk effekt af mangan og kombinationseffekt af mangan og chlorpyrifos og maneb 2 Baggrund
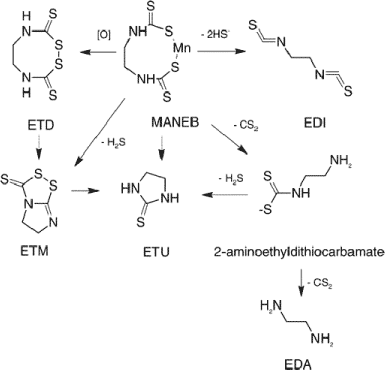
Mange epidemiologiske undersøgelser viser, at der hos landmænd, arbejdere i gartneri og havebrug og hos personer bosat i områder med eksponering for pesticider ses forøget risiko for udvikling af symptomer på Parkinsons sygdom (Schoenberg et al. 1987; Ho et al. 1989; Koller et al. 1990; Semchuk et al. 1992; Gorell et al. 1997; Golbe 1998; Gorell et al. 1998; Engel et al. 2001). Dette er også dokumenteret i en undersøgelse af arbejdere i danske landbrug (Tüchsen & Jensen 2000). Det har ikke været muligt at relatere årsagen til specifikke pesticider. Der har været specielt fokus på pyrethroiderne og de manganholdige pesticider som mulige ætiologiske faktorer. Pyrethroiderne har været under mistanke, fordi de strukturmæssigt ligner 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridin (MPTP), et modelstof som anvendes til eksperimentel udvikling af Parkinsons sygdom (Russel 1992; Bachurin et al. 1991). Organophosphatholdige pesticider påvirker det cholinerge nervesystem og kan således bidrage indirekte til udviklingen af Parkinsons sygdom. Et tidligere meget anvendt organophosphatholdigt pesticid er chlorpyrifos. Udover effekten på det cholinerge system besidder chlorpyrifos også en mere generel neurotoksisk effekt, som ikke nødvendigvis hænger sammen med hæmning af acetylcholinesterase (AChE), men også kan have bertydning for udvikling af Parkinsons sygdom. Dette er specielt belyst i en række undersøgelser af chlorpyrifos’ effekt på hjernens udvikling (Slotkin 2004a,b). Undersøgelser fra metalindustrien viser, at manganeksponering ved inhalation er særdeles neurotoksisk og kan fremkalde Parkinson-lignende symptomer (parkinsonisme, manganisme) (Zayed et al. 1990; Calne et al. 1994; Gorell et al. 1997; Huang et al. 2003). De tilgrundliggende virkningsmekanismer kendes ikke (Veldman 1998), men de menes på flere punkter at være forskellige fra dem, der udløser Parkinsons sygdom (Arlien-Søborg 2001). Disse problemer er også aktuelle i Danmark. Danmarks Fødevareforskning har vurderet faren ved anvendelse af forskellige hjælpestoffer til pesticidpræparater og udarbejdet en farlighedsvurdering af forskellige mangansalte, hvoraf nogle anvendes som hjælpestoffer i pesticidformuleringer (Miljøstyrelsen 2003a). 2.1 EksponeringPesticiderPesticider anvendes i vid udstrækning i moderne landbrug, havebrug og private husholdninger til mange forskellige formål. Til trods for, at der i Danmark er nøje regulering og krav til uddannelse og brug af beskyttelsesmidler ved erhvervsmæssig anvendelse af disse kemikalier, så sker der stadig eksponering i et omfang, der kan give anledning til neurologiske symptomer (Tüchsen & Jensen 2000). Det meste af eksponeringen foregår ved inhalation, hudkontakt og via mavetarmkanalen (Newsome 1976; Newsome 1979; McGeer et al. 1988; Patsakos et al. 1992; Thiruchelvam et al. 2000a,b). ManganMangan er naturlig forekommende i miljøet og et essentielt mikronæringsstof, som indgår i flere livsnødvendige enzymsystemer f.eks. pyruvat decarboxylase, superoxiddismutase og i leverenzymet arginase. Optagelsen af mangan i mave-tarmkanalen reguleres nøje, men undersøgelser i laboratoriedyr viser, at regulering af mangans absorption kan ”overloades” og føre til forøget koncentration i hjernen og ændringer i adfærd og signalstoffers metabolisme (ATSDR 2000). I forbindelse med eksponering for mangan ved inhalation findes derimod en alternativ, ikke regulerbar optagelsesvej gennem lugtenerven og direkte ind i hjernen (Tjalve et al. 1996; Gianutsos et al. 1997; Brenneman et al. 2000; Vitarella et al. 2000). Det antages også, at mangan kan optages fra lungerne. Sådan eksponering er aktuel ved anvendelse af mangansalte som hjælpestof til pesticidpræparater, for arbejdere i metalindustrien og via brugen af tilsætningsstoffet methylcyclopentadienil mangantricarbonyl til blyfri benzin. De højeste mangankoncentrationer efter inhalationseksponering ses i basalganglierne (striatum, nucleus caudatus, globus pallidus og substantia nigra) hos mus, rotte, abe og menneske (Barbeau 1984; Newland et al. 1989; Tjalve et al. 1996; Gianutsos et al. 1997; Brenneman et al. 2000; Vitarella et al. 2000). 2.2 Parkinsons sygdomGenereltParkinsons sygdom er en meget alvorlig, kronisk og fremadskridende lidelse i hjernen. I Danmark rammes cirka 1 ud af 1000 personer, og for indeværende findes 5000-6000 patienter med denne sygdom. Parkinsons sygdom tilhører en gruppe af neurologiske sygdomme (parkinsonisme) karakteriseret ved et fælles symptomkomplex. Symptomerne omfatter tremor (rysten), muskelstivhed, bradykinesi (langsom udførelse af bevægelser), forstyrret balanceevne og koordinering af bevægelser. Alle symptomer behøver ikke at være tilstede hos den enkelte patient. Parkinsons sygdom opstår når neuroner i basalganglierne, specifikt i substantia nigra, degenererer eller dør (Marsden 1994). Disse neuroner anvender dopamin som signalstof. Derved ødelægges nerveforbindelsen mellem substantia nigra og corpus striatum, hvilket medfører at personen bliver ude af stand til at kontrollere sine bevægelser på normal vis. Under neuronernes degeneration dannes fibrillære cytoplasmatiske inklusioner, kendt som Lewy bodies, som indeholder proteinerne ubiquitin og α-synuclein (Gibb & Lees 1988; Marsden 1994; Baba et al. 1998). ÅrsagerÅrsagen til denne destruktive ødelæggelse af nerveceller i substantia nigra kendes ikke med sikkerhed. Der er ingen overbevisende dokumentation for en genetisk basis for idiopatisk Parkinsons sygdom, hvilket har rettet fokus mod kemiske stoffer som udløsende faktorer (Thiruchelvam et al. 2000a,b), specielt pesticider og mangan. Parkinsons sygdom menes at være en multifaktoriel sygdom forårsaget af en kombination af alder, genetik og kemiske stoffer (Veldman et al. 1998; Ball 2001) med enkelte undtagelser: autosomal dominant familiær Parkinsons sygdom med mutationer i α-synuclein- og parkin-genet. Eksperimentelle dyremodeller til undersøgelse af parkinsonismeKemisk-inducerede og genetiske modificerede eksperimentelle dyremodeller bruges i vid udstrækning til studier af Parkinsons sygdom og til udvikling af effektive farmaka til symptombehandling heraf. Både reserpin, der er et tidligere anvendt middel mod skizofreni, 6-hydroxydopamin (6-OHDA), MPTP og methamphetamin har været anvendt i flere forskellige dyrearter. MPTP kan anvendes i mus og minigrise, men virker ikke i rotter. Specielt den unilaterale 6-OHDA model, hvor rotter énsidigt doseres intracerebralt eller intraventrikulært med 6-OHDA, er meget benyttet i medicinalindustrien og til anden forskning. Dosering med 6-OHDA kan replikere de neurokemiske, morfologiske, neurologiske og adfærdsmæssige ændringer, som ses i mennesker (Tolwani et. al. 1999). En meget interessant undersøgelse har vist, at kronisk eksponering for pesticidet rotenon ved kontinuert, intravenøs dosering via en indopereret osmotisk pumpe forårsagede selektiv nigrostrial fremadskridende dopaminerg degeneration. Neuronerne i substantia nigra hos rotenonbehandlede rotter akkumulerede cytoplasmatiske inklusioner, som indeholdt ubiquitin og α-synuclein. Resultaterne viste, at kronisk eksponering af rotter for rotenon kan reproducerede anatomiske, neurokemiske, adfærdsmæssige og neuropatologiske karakteristika for Parkinsons sygdom i rotter (Betarbet et al. 2000). Rotenon-modellen har lovende fremtidsperspektiver, men er for indeværende langt mere teknisk krævende end 6-ODHA modellen. 2.3 Virkningsmekanismer for pesticider og manganOxidativt stress og apoptoseMeget tyder på, at induktion af oxidativt stress er et central for udvikling af parkinsonisme (Lai & Yu 1997; Stokes et al. 1999; Lewen et al. 2000) via mekanismer, hvori også dopamin synes involveret (Cohen & Heikkila 1974; Hastings 1995). Oxidativt stress: Kemikalie-kompromitterede mitochondriale funktioner og oxidation af dopamin (autooxidation, mangan-induceret) (Gavin et al. 1999; Shen & Dryhurst 1998) kan føre til ukontrolleret dannelse af frie radikaler og reaktive oxygen-species (ROS) (Dexter et al. 1989; Betarbet et al. 2000) og derved være tilgrundliggende faktor for nigrale dopaminerge neuroners selektive degeneration (Junn & Mouradian 2001; Panet et al. 2001). Nyere undersøgelser viser, at manganeksponering inducerer oxidativt stress i rottehjernen (Erikson et al. 2004a). Apoptose: De grundlæggende molekylære mekanismer for udvikling af neurodegenerative sygdomme kendes ikke i detaljer, men apoptotiske processer, som kendetegnes ved programmeret celledød, vides at have central betydning (Jellinger & Stadelmann 2000a,b). Dopamin synes også involveret i disse mekanismer (Stokes et al. 1999; Cohen 2000). Apoptose er en essentiel, fysiologisk normal funktion i alle flercellede organismer. Apoptotisk degeneration af neuroner og neurondød er fundamentale, naturlige processer, som dog også er ansvarlige for kliniske manifestationer af flere forskellige neurologiske sygdomme. Sygdommene inkluderer Alzheimers sygdom, Parkinsons sygdom, parkinsonisme og cerebral iskæmi. Ved denne proces aktiveres caspaser, der sker DNA fragmentering og specifikke morfologiske ændringer af cellerne. Oxidative mekanismer, induktion af ROS og oxidativt stress, er centrale elementer for senere induktion af apoptose (Ladefoged et al. 2000; Kannan & Jain 2000; Mattson et al. 2000; Mattson et al. 2001). Ændringer i mitocholdrial respiration via complex-1 i den oxidative phosphorylering, caspase aktivering, DNA fragmentering (Tatton 2000) og morfologiske ændringer forenelige med apoptose er observeret i postmortem hjerner fra Parkinsonpatienter (Jellinger et al. 2000a,b; Hartmann et al. 2001) og det vides, at dopamin kan fremkalde apoptose primært via ROS induktion efterfulgt af caspase aktivering (Junn & Mouradian 2001). Apoptose involverer både neuroner og gliaceller. Neurondegeneration og -død forårsager reaktivitet i gliacellerne, hvorunder der sker forøget aflejring af glial fibrillary acidic protein (GFAP) i disse (Ladefoged et al. 1995). Det er vist, at mangan kan stimulere caspase-3 aktivitet i pherochromocytom-celler (PC12) (Roth et al. 2000) og apoptose-specifik DNA fragmentering (Hirata et al. 1998). Bestemmelse og påvisning af caspase aktivitet (enzym centralt for apoptose) og apoptotisk nedbrudt DNA ved TUNEL-farvning (histopatologiske parametre apoptose) er vigtige parametre for påvisning af apoptose ved parkinsonisme. Mere end en parameter er nødvendig, så udover disse to anvendes også morfologiske parametre vurderet ved klassisk haematoxylin-eosin (HE) farvning (Ladefoged et al. 2000). Virkningsmekanismer for pesticiders neurotoksicitetPesticider og dopamin: Der er flere undersøgelser som viser dopamin optagelsens centrale betydning for pesticiders påvirkning af det dopaminerge nervesystem (Bougria et al. 1995). Både rotenon (Marey-Semper et al. 1993), chlordecon (Desaiah 1985), diethyldithiocarbamater (Di Monte et al. 1989), fungicidet triadimefon og dets metabolit triadimenol (Walker & Mailman 1996) og designerdrug forureningen MPTP (Bougria et al. 1995; Barc et al. 2001) hæmmer således optagelsen af dopamin i dopaminerge neuroner og kan derved danne basis for regional reduceret dopamin koncentration. Maneb (mangan-ethylen-bis-dithiocarbamat) er et manganholdigt fungicid med udbredt anvendelse. I to tilfælde er der beskrevet udvikling af Parkinssons sygdom hos yngre mænd, som har arbejdet med maneb (Meco et al. 1994). Undersøgelser med oralt doseret maneb viser, at stoffet optages hurtigt fra mave-tarm kanalen. I kroppen omsættes det til en række vandopløselige metabolitter, som omfatter ethylenthiourinstof (ETU) og ethylendiamin (EDA) med flere (Figur 1) (Kontou et al. 2004). ETU er påvist i urin hos mennesker, der sprøjtede med maneb (ATSRD 2000).
Figur 1. Foreslåede nedbrydningveje af maneb (som monomer) til ethylenthiourinstof (ETU) og ethylendiamin (EDA) med følgende mulige intermediære nedbrydningsprodukter: ethylenthiuram disulfid (ETD), ethylenthiuram monosulfid (ETM), ethylendiisothiocyanat (EDI) samt 2-aminoethyldithiocarbamat (Kontou et al. 2004) Maneb antages at være i stand til at krydse den barrier der normalt begrænser stoffers passage fra blod til hjerne (blod hjerne barrieren, BBB). I dyreforsøg er det vist, at maneb kan påvirke den motoriske aktivitet og forstærke effekten af MPTP på motoriske aktivitet. Dosering med akutte doser af maneb virker CNS-depressivt (centralnervesystem), antageligt via det dopaminerge system (Uversky 2004) Toksikokinetik og vikningsmekanismer for mangans neurotoksicitetNår mangan er optaget i blodet bindes det til transferrin og plasmaproteiner. Mangan med valens tre bindes til transferrin, hvorimod divalent mangan bindes til albumin og -2-makroglobulin. Bundet mangan vil kunne transporteres til lever og optages i levercellerne. Fra leveren vil mangan enten blive udskilt via galden eller blive transporteret med blod til andre væv, inklusiv hjernen. Mangan kan passere udenom BBB i plexus choroidea og ophobes her. Ved høje mangankoncentrationer i plasma transporteres det videre til cerebrospinalvæsken og optages herfra til hjernevæv (Aschner 2000a,b). Der er foreslået adskillige transportmekanismer for mangan over blod-hjerne barrieren afhængigt af oxidationstrin. Trivalent mangan passerer BBB via en transferrinreceptor medieret endocytose (Arbejdsmiljø-instituttet 2004) og divalent mangan optages enten som fri ion eller via non-specifikke transportmekanismer, hvor det konkurrerer med bl.a. calcium og jern (Aschner 2000a,b). Når mangan er lokaliseret i hjernen, enten via transport i plexus choidea eller ved transport over BBB, ophobes det primært i astrocytterne, fordi disse indeholder glutamin systhetase (Aschner 1999), som er et vigtigt intracellulært bindingsprotein for mangan. Optagelse i neuronerne finder sted via ukendte mekanismer (Malecki et al. 1999). Ved inhalation kan mangan udover absorption i luftvejene også komme ind i hjernen via lugtenerven til olfaktorisk cortex. Undersøgelser hos rotter viser, at inhalation af mangan medfører større akkumulation i centralnervesystemet, end når mangan optages fra mave-tarmkanalen (Aschner 2000a,b). Den mængde som transporteres videre herfra er afhængig af mængden i lugtekolberne (Tjalve & Henriksson 1999). Nyere undersøgelser påviser, at mangan subcellulært opkoncentreres i mitochondrierne (Zhang et al. 2003a,b). Akkumulering af mangan i hjernen er regions-selektiv (Oversigt over undersøgelser af dosering med mangan og efterfølgende mangankoncentration i hjernen) med hovedvægt på basalganglierne (St-Pierre et al. 2001; Erikson et al. 2004b), herunder corpus striatum (Roels et al. 1997; Lai et al. 1999; Montel et al. 2001; Gwiazda et al. 2002; Baek et al. 2003). Magnetic resonance imaging (MRI) af hjerner hos mangan-intoksikerede personer har vist speciel akkumulering i basalganglierne (globus pallidus) (Nelson et al. 1993). Dette bekræftes af forsøg med eksponerede aber (Bird et al. 1984). Hos mennesker forårsager mangan i store doser neurokemiske og neuropatologiske ændringer specielt i globus pallidus, som er en del af basalganglierne, hvilket resulterer i symptomer på parkinsonisme via ikke afklarede mekanismer. Oversigt over undersøgelser af dosering med mangan og efterfølgende mangankoncentration i hjernen Mangan og dopamin: Selektiv effekt af mangan på det dopaminerge system og mangan-induceret mitochondriel dysfunktion er begge vigtige elementer for mangans neurotoksiske effekt (Verity 1999). Dette er vist i både laboratoriedyr og i mennesker (Bird et al. 1984). Der er rapporteret forskellige effekter på dopamin koncentrationen (Oversigt over dosering med mangan og effekt på dopaminkoncentrationen i hjernen). En bemærkelsesværdig effekt i relation til Parkinsons sygdom er reduktion i corpus striatum, hvilket er vist i både mus, rotter og aber (Autissier et al. 1982; Gianutsos & Murray 1982; Bird et al. 1984; Kawata 1990; Komura & Sakamoto 1992; Ingersoll et al. 1995, 1999). I andre undersøgelser er der vist øget koncentration (Chandra et al. 1983; Ali et al. 1985; Desole et al. 1995) og ikke påvirket koncentration (Witholt et al. 2000; Dorman et al. 2000; Gwiazda et al. 2002; Baek et al. 2003; Ali et al. 1995). Data fra tilgængelige undersøgelser viser, at mangandoseringsregimen og manganspeciering er meget centrale for absorption, fordeling og effekt af mangan i hjernen (ATSDR 2000). Med den rette absorption og fordeling i hjernen synes effekten at blive en reduktion i dopaminkoncentrationen (ATSDR 2000). Effekter på dopamin optagelsen i nervevæv fra laboratoriedyr er ikke entydige: in vitro undersøgelser er der påvist både reduceret (Lai et al. 1981; Chandra et al. 1984; Lai et al. 1984; Hussain et al. 1987) og forøget optagelse (Leung et al. 1982). En relevant, nyere dansk undersøgelse med hjerne-scanning af mennesker har derimod vist normalt optagelse af dopamin i striatum hos mangan eksponerede patienter med klinisk dokumenterede symptomer på parkinsonisme (manganisme), hvilket er i modsætning til hvad der ses hos patienter med Parkinsons sygdom (Arlien-Søborg 2001). Oversigt over dosering med mangan og effekt på dopaminkoncentrationen i hjernen Mangan og aminosyrer: En række nyere undersøgelser (Tomas-Camardiel et al. 2002; Erikson & Aschner 2003) samt personlig kontakt (Mikael Aschner 2004) har peget på, at aminosyrer med signalstoffunktion og enzymet glutamat decarboxylase (GAD) kan være vigtige virkningsmekanismer for manganinduceret parkinsonisme. Kombinationseffekter mellem mangan og pesticiderDer er således indikationer for, at nogle af virkningsmekanismerne i forbindelse med mangans og pesticiders neurotoksicitet er forskellige og at der kan være sammenfald i andre. A priori må man forvente, at der er et poteniale for en kombinationseffekt mellem mangan og pesticider via både fælles og forskellige virkningsmekanismer. 2.4 Valg af effektparametreDet er vigtigt at kunne påvise tidlige indikationer for Parkinsons sygdom. I dette afsnit beskrives og begrundes valg af de effektparametre, som anvendes i projektets undersøgelser. Signalstoffer og aminosyrer med signalfunktionParkinsons sygdom er forbundet med neurodegeneration i det dopaminerge system ledsaget af dramatisk fald i hjernens indhold af dopamin, specielt i corpus striatum. I en række undersøgelser i dyremodeller er der påvist mangan-inducerede ændringer i det dopaminerge nervesystem. Det må således forventes, at det er ændringer i det dopaminerge nervesystem, som på sigt vil medføre de neurologiske symptomer, som ses hos Parkinson patienter. Derfor undersøges ændringer i regionale koncentrationer af dopamin. Effekter på andre dele af hjernen hvori der anvendes andre signalstoffer undersøges via de dertil relaterede signalstoffer (noradrenalin, 5-hydroxytryptamin, glutamat, taurin, GABA) (Newland 1999; ATSDR 2000). Nyere undersøgelser samt personlig kontakt (Mikael Aschner 2004), har medført, at projektet integrerer supplerende analyser af aktiviteten af enzymet glutamat decarboxylase (GAD) som mulig virkningsmekanisme for manganinduceret parkinsonisme (Tomas-Camardiel et al. 2002; Erikson & Aschner 2003). CholinesteraserAcetylcholinesterase spalter og inaktiverer signalstoffet acetylcholin (ACh) når dette frigives ved impulsledning i det cholinerge nervesystem. Når dette enzym hæmmes i en organisme, forlænges effekten af ACh, hvilket fører til den neurotoksisk/letale effekt, som er baggrunden for flere pesticiders virkning. Mange pesticider hæmmer aktiviteten af AChE i hjernen (ATSDR 2000). Andre cholinesteraser kan også hæmmes af pesticider, f.eks butyrylcholinesterase (BuChE) (Clegg & van Gemert, 1999a,b). Hertil kommer at case-stories har vist at organofosfater kan bidrage til udvikling af Parkinsons sygdom (Davies et al. 1978). ProlaktinHypofysens sekretion af hormonet prolaktin reguleres (hæmmes) af det dopaminerge system og af mange hormoner. En stigning i plasma prolaktin koncentration kan anvendes som indirekte biomarkør for kemikalieinduceret reduceret dopaminerg hæmning i CNS (Manzo et al. 1996; Mutti & Smargiassi 1998; Smargiassi & Mutti 1999). Det er derfor bemærkelsesværdigt, at prolaktin koncentrationen i plasma netop har vist sig forøget hos arbejdere eksponeret for mangan (Alessio et al. 1989; Mutti et al. 1996; Mutti & Smargiassi 1998; Smargiassi & Mutti 1999; Niu et al. 2001). Der findes ingen relevante undersøgelser vedrørende manganinduceret øget prolaktin koncentration i laboratoriedyr. Der findes flere undersøgelser af pesticiders effekt på plasma prolaktin koncentrationen i forbindelse med studier af pesticiders østrogene effekt. Denne hormonale effekt gør imidlertid ekstrapolation fra effekt induceret af sådanne pesticider på plasma prolaktin koncentrationen til effekt på det dopaminerge system meget kompleks (Ali et al. 1982; Lafuente et al. 2000). Caspase-3 aktivitetSom caspase er valgt caspase-3, fordi denne er en central caspase, som udgør ”point of no return” for apoptose, dvs, når caspase-3 er aktiveret vil cellen undergå apoptotisk celledød (Ladefoged et al. 2000). α-synucleinUnder neuronernes degeneration hos patienter med ideopatisk Parkinssons sygdom dannes fibrillære cytoplasmatiske inklusioner, kendt som Lewy bodies, som blandt andet indeholder proteinet α-synuclein (Gibb & Lees 1988; Marsden 1994; Baba et al. 1998). α-synuclein tilhører en nyopdaget gruppe af proteiner, som mistænkes for at kunne ophobes og aflejres i neuroner (amyloidose) og derved bidrage til udvikling af neurodegenerative sygdomme (Trojanowski et al. 2002). I velkendte modeller for Parkinsons sygdom som f.eks MPTP- og rotenon-modellen har det vist sig, at der kan induceres dannelse af inklusionslegemer, som indeholder α-synuclein (Bohlen & Hallbach 2004). En del af forklaringen på denne ophobning er mangel på autofagi af α-synuclein (Cuerco et al. 2004) Det har også vist sig, at mutation i α-synuclein-genet fører til selektiv akkumulering af dette protein i dopaminerge neuroner i substantia nigra hos parkinsonpatienter (Lee et al. 2001). Meget tyder på, at α-synuclein øger cellernes følsomhed for kemikaliers toksicitet (Kanda et al. 2000; Ball 2001; Lee et al. 2001). Der findes ingen relevante undersøgelser af effekten af pesticider (rotenon dog undtaget) eller mangan på α-synuclein. Koncentrationen af dette protein bestemmes ved kvantitativ western blot og påvises ved immunhistokemiske farvemetoder. SynaptophysinSynaptophysin er det hyppigst forekommende integrerede membranprotein i de små presynaptiske vesikler, som indeholder signalstoffer. Det findes i alle centrale og perifere neuroner samt neuroendokrine celler. Dette protein bruges generelt som en synapsespecifik markør. Synaptophysin koncentrationen anvendes som markør for antallet af synapser (kontaktpunkter mellem neuroner). Koncentrationen bestemmes ved kvantitativ western blot. ActinActin er et af de mest velbevarede proteiner gennem arternes udviklingshistorie og er sammen med myosin det hyppigst forekommende protein i cellestrukturer. Det findes i mange forskellige celletyper og vævstyper, og er involveret i de fleste cellulære processer. På grund af det generelt høje ekspressionsniveau i de fleste vævs- og celletyper bruges dette protein som kontrol og normaliseringsparameter for påsat mængde væv i western blot undersøgelser. GFAPVævsbeskadigelser og beskadigelser i specifikke celletyper i CNS forårsager astrocytreaktivitet. Dette kan følges ved kvalitativ og kvantitativ analyse af det astrocyt specifikke protein gliafibrillært surt protein (GFAP). Ved immunoassay-analyser er det demonstreret, at dette protein kan anvendes som markør for dosis-, tids- og regionsafhængige beskadigelser forårsaget af forskellige neurotoksiske stoffer på både neuroner og gliaceller (O’Callaghan 1993; O’Callaghan et al. 1995). Ændret GFAP ekspression sker både efter massive beskadigelser ledsaget af celletab forårsaget af både apoptose og nekrose, og efter mindre beskadigelser som f. eks. tab af nerveterminaler og specifikke neuroner i en specifik region forårsaget af MPTP (O`Callaghan et al. 1990a,b), pesticider (Deamer et al. 1994), mangan (Zhang et al. 1998; Henriksson & Tjalve 2000) og organiske opløsningsmidler (Lam et al. 2000a,b). GFAP er en uspecifik markør for neurotoksicitet, som ikke siger noget om, hvorvidt det er neuroner eller astrocyter, som påvirkes direkte af neurotoksiner. Immunhistokemisk farvening er en meget velevalueret metode, som anvendes som supplement til traditionelle histopatologiske farvemetoder til dokumentation af skader på nervesystemet. TyrosinhydroxylaseTyrosinhydroxylase (TH) er det hastighedsbestemmende enzym i syntesen af dopamin og noradrenalin og kan således anvendes som markør for effekt på det dopaminerge og noradrenerge nervesystem. Det har bl.a. fundet anvendelse i MPTP dyremodeller for Parkinsons sygdom (Kurosaki et al. 2004). Histopatologiske undersøgelserSom udgangspunkt for undersøgelser af morfologiske og histologiske ændringer i hjernen foretages HE farvninger af snit skåret sagittalt og coronalt eller af specielle tværsnit til brug ved studierne af ændringer i corpus striatum og substantia nigra. Der foretages immunhistokemiske farvninger for GFAP og TH, samt TUNEL-farvning. De de to sidstnævnte anvendes som markør for apoptose. Der foretages også immunohistokemisk farvning for α-synuclein. 2.5 anvendte effektparametre og hvad de er markør forNedenfor ses en oversigt over de effektparametre, som anvendes i projektets undersøgelser. Herudover angives hvad stofinduceret ændring i hver enkelt effektparameter viser effekt på.
2.6 Rotten som modelDer er i neurotoksikologiske undersøgelser et stort behov for at udvikle og evaluere dyremodeller, som kan belyse virkningsmekanismerne for kemikalie-induceret neurotiksicitet. I en velegnet dyremodel til undersøgelser af Parkinsons sygdom skal der udtrykkes og kunne induceres mange neurokemiske, histologiske, kliniske og adfærdsmæssig karakteristika for Parkinsons sygdom. Kan dette ikke opnås i tilfredsstillende grad med en model, må flere komplementere hinanden. Model med 6-hydroxydopamin: Dette er den tidligst anvendte model til studier af årsager til Parkinsons sygdom. Modelstoffet forårsager tab af dopaminerge neuroner i corpus striatum og virkningsmekanismen antages at være dannelse af ROS (Tolwani et. al. 1999). Model med MPTP: Denne model blev introduceret i 1980`erne efter at et antal unge stofmisbrugere udviklede Parkinsons sygdom efter intravenøs injektion af syntetisk heroin forurenet med MPTP. MPTP er ikke toksisk i sig selv men passerer let BBB og omdannes derefter til det aktive toksin MPP+ (1-methyl-4-phenylpyridin-ionen), som selektivt transporteres ind i de dopaminerge neuroner og ophobes i disses mitochondrier, hvor det hæmmer den oxidative fosforylering på complex-1 niveauet og forårsager dannelse af ROS. Modellen er i stand til at inducere de karakteristiske træk ved idiopatisk Parkinsons sygdom (O’Callaghan et al. 1990a,b; Baek et al. 2003). En væsentlig ulæmpe ved denne model er, at MPTP er ekstremt neurotoksisk for mennesker, hvilket frembyder alvorlige tekniske problemer med dosering, opstaldning og håndtering af laboratoriedyr. Model med rotenon: Dette er en nyere model, som er taget i anvendelse og baserer sig på en styret, kontinuert intravenøs injektion af pesticidet rotenon, som er et alment brugt fungicid, der virker som en effektiv hæmmer af compleks-1 og derved fører til dannelse af ROS (Betarbet et al. 2000). Model med paraquat og maneb: Denne model baserer sig på at dosere en kombination af paraquat og maneb (Uversky 2004). Virkningsmekanismen er ikke endeligt klarlagt, men er formentlig en påvirkning af det dopaminerge nervesystem uden nødvendigvis at medføre ændringer i koncentrationen af dopamin i corpus striatum. Det antages, at maneb hæmmer glutamat transporten og ødelægger dopamins optagelse og frigivelse fra neuronerne (Thiruchelvam et al. 2002a,b). En yderligere virkningsmekanisme for maneb kan være, at det modulerer forsvaret mod ROS (Barlow et al. 2005). I litteraturen diskuteres det også om interaktionen kan skyldes en toksikokinetisk (stoffers optagelse, fordeling, omdannelse og udskillelse) ændring af regionale koncentrationer af paraquat forårsaget af dosering med maneb (Barlow et al. 2003; Barlow et al. 2004). Model med mangan: Det har vist sig at doseringsvej, doseringshyppighed og -længde udover specieringen af mangansalte er af afgørende betydning for den fordeling af mangan, der finder sted i hjernen hos rotten og for de neurokemiske ændringer dette medfører (ATSDR 2000). En toksikokinetisk undersøgelse af dosering med MnO2 både intraperitonealt og intratrachealt (doseret direkte i luftrøret) har demonstreret øget indhold af mangan i blod og i forskellige hjerneregioner herunder corpus striatum (Roels et al. 1997). Oral dosering viser, at reguleringen af mangans absorption kan ”overloades” og føre til forøget koncentration i hjernen og ændringer i adfærd og signalstof metabolisme i laboratoriedyr (ATSDR 2000). Ved inhalation og oral dosering af uorganisk mangan er der beskrevet kliniske symptomer både hos mennesker og laboratoriedyr. Ved inhalation, oral dosering og ved dermal applikation ses kliniske symptomer hos mennesker, som også ses ved oral og dermal dosering hos laboratoriedyr (ATSDR 2000). Intraperitonal injektion af mangansalte er en relevant doseringsvej som alternativ til teknisk besværlig inhalationsdosering i relation til effekter på det dopaminerge nervesystem (ATSDR 2000). Rotten er egnet til at undersøge manganinducerede neurokemiske ændringer og til generelt at studere mekanismen for den neurotoksiske effekt af mangan (Newland 1999). Sammenfattende konkluderes, at rotten ved dosering med modelstoffer, mangan og pesticider er i stand til at udtrykke mange af de karakteristika som ses ved Parkinsons sygdom, dette gælder såvel neurokemiske, histologiske, kliniske og adfærdsmæssige. Derudover gælder, at de fleste af de toksikologiske undersøgelser, der anvendes til at vurdere de sundhedsmæssige aspekter ved brug af pesticider traditionelt udføres med rotten som forsøgsdyr. Endelig er rotten den praktisk bedst egnede model, den man har størst erfaring med og mest referencedata fra. Derfor anvendes rotten som dyremodel i dette projekt. Som en kontrol af dens anvendelighed indlægges en delundersøgelse, hvori det kontrolleres, at unilateral intrakranial injektion med 6-OHDA ved corpus striatum medfører signifikant reduceret dopaminkoncentration heri.
|