|
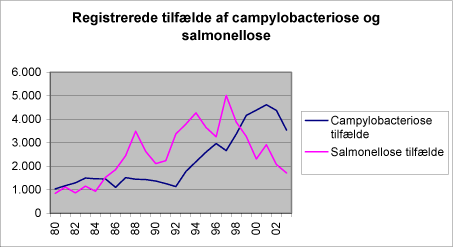
Miljøprojekt nr. 1081, 2006 Indhold2 State of the art campylobacter i vand 5 Konklusion på screeningsundersøgelse Bilag A: Vandkvalitet - Kvalitativ og semikvalitativ påvisning af termotolerante campylobacter ForordCampylobacter regnes i dag for at være en af de vigtigste årsager til diarré hos mennesker. Den er beskrevet i større udbrud efter indtagelse af upasteuriseret mælk, utilstrækkeligt varmebehandlet kød samt fra forurenet drikkevand. Udenlandske og danske undersøgelser har vist, at Campylobacter kan forekomme i overfladevand, herunder badevand, men i hvilke niveauer samt om de forekommende niveauer udgør en risiko for de badende er ikke afklaret. Desuden er forurenet drikkevand og specielt forurenede brønde angivet som en mulig risikofaktor, men der er ikke foretaget nogen screening af niveauet i private brønde. Dette projekt ”Screeningsundersøgelse for Campylobacter i vand” har til formål at undersøge badevand og drikkevand for campylobacter med henblik på at få mere viden om campylobacter i vandmiljøet. Resultaterne skal anvendes til at foretage en risikovurdering af campylobacter. Prøveudtagning og analyser er foretaget af Eurofins Danmark. Projektet er udarbejdet af Vibeke From Jeppesen, Eurofins Danmark Inger Guldbæk Eurofins Danmark Sammenfatning og konklusionerFormålet med projektet har været at undersøge badevand og drikkevand for campylobacter med henblik på at få mere viden om campylobacter i vandmiljøet. Resultaterne skal anvendes til at udarbejde en risikovurdering af campylobacter. Der blev undersøgt 153 badevandsprøver. Termotolerante campylobacter kunne isoleres fra 20,3% af prøverne. I 3,3% af prøverne fandtes termotolerante campylobacter i niveau over 100 per 1000 ml, i 3,3% af prøverne var niveauet mellem 10 og 100 campylobacter per 1000 ml og i 13,7% af prøverne var niveauet mellem 1 og 10 campylobacter per 1000 ml. Der kunne ikke dokumenteres sammenhæng mellem fund af campylobacter i prøverne og de almindelige badevandsparametre (termotolerante coliforme bakterier og total coliforme bakterier). Tilsvarende gælder for feltmålingerne som vandtemperaturen, vindstyrke, sigtdybde og pH. Ud fra de foretagne undersøgelser kan det konkluderes, at de fundne niveauer af campylobacter i badevand kan udgøre en sundhedsmæssig risiko for badende, idet infektiv dosis er meget lav og de fundne niveauer er relativt høje. I screeningsundersøgelsen blev der ligeledes udtaget og analyseret 123 drikkevandsprøver fra enkeltvandsforsyningsanlæg. Der blev kun isoleret campylobacter fra 2 prøver, hvor den ene prøve indeholdt mellem 1 og 10 campylobacter per 1000 ml og den anden mellem 10 og 100 campylobacter per 1000 ml. Begge prøver havde høje kimtal og højt indhold af coliforme bakterier og E. coli. Indhold af E. coli tyder på frisk fækal forurening af prøverne, og dermed er der også risiko for tilstedeværelse af patogene bakterier. I dette projekt er der påvist E.coli i ca. 25% af prøverne og campylobacter i 1,6% af prøverne. Afsluttende kan det konkluderes at campylobacter er almindeligt forekommende i badevand, mens de kun optræder sporadisk i drikkevand i Danmark. Summary and conclusionsThe aim of this screening project was to investigate the content of Campylobacter in bathing water and in drinking water in order to get more knowledge about Campylobacter in aqueous environments. The results obtained in this project will be used as a base for a risk assessment of Campylobacter. 153 samples of bathing water have been analyzed. Thermotolerant campylobacter have been isolated from 20,3% of the samples. In 3,3% of the samples levels above 100 campylobacter per1000 ml have been detected. Another 3,3% of the samples contained levels between 10 and 100 campylobacter per 1000 ml. In 13,7% of the samples the content of Campylobacter was found to be between 1 and 10 campylobacter per 1000 ml. Statistical relations between content of Campylobacter and the other microbiological factors cannot be documented. The same accounts for the field observations water temperature, wind force, visibility in water and pH. It can be concluded that the content, as found in this screening, of Campylobacter in bathing water might pose a risk to bathers due to low infective doses of campylobacter and high content of campylobacter. The screening includes 123 samples of drinking water. Sampling was done in individual water supply systems. Campylobacter has been isolated from two samples. One sample contained between 1 and 10 campylobacter per 1000 ml and the other sample contained between 10 and 100 campylobacter per 1000 ml. Both samples were high in coliforme count, in E. coli as well as in total count. Presence of E. coli in drinking water indicates fresh faecal contamination of the drinking water. And subsequently poses a risk for presence of pathogenic bacteria. In this project about 25% of the samples from drinking water contain E. coli and 1,6% contain campylobacter. Campylobacter is frequently found in bathing water, where as Campylobacter is only sporadic found in drinking water in Denmark. 1. Campylobacter bakterier1.1 BakterienCampylobacter er ikke en ny bakterie, da den har været kendt som dyrepatogen siden 1880. Men det var først i 70'erne, at man fik udviklet metoder til påvisning og isolering af bakterien, hvor der var fokuseret på dens rolle som humanpatogen. 1.1.1 MorfologiOrdet Campylobacter kommer fra det græske ”kampylos” og betyder ”snoet stav” og sådan ser bakterien også ud. Stavene er små og tynde 0,2-0,8 µm brede og 0,5-5 µm lange, snoede, spiral- eller kommaformede (Keener et al 2004). I gamle kulturer kan cellerne være coccoide. Bakteriecellen har polære flageller i den ene eller i begge ender og den bevæger sig med hurtige ofte roterende, proptrækkeragtige bevægelser. Campylobacter er ikke sporedannende. 1.1.2 SystematikFamilien campylobacteriaceae omfatter to slægter: Campylobacter og Arcobacter. Der er 18 typer og undertyper. Af disse anses de følgende 11 for at være human patogene: C jejuni subspecies jejuni, C jejuni subspecies doylei, C coli, C upsaliensis, C lari, C fetus subspecies fetus, C hyointestinalis, C concisus, C sputorum,C curvus, og C rectus. Hyppigst forekommende er Campylobacter jejuni, der tegner sig for ca. 90% af sygdomstilfælde og C. coli, der udgør hovedparten af de resterende 10% . 1.1.3 VækstbetingelserCampylobacter er microaerofile, dvs. de kræver tre til fem procent ilt og mellem to og ti procent kuldioxid for at kunne vokse optimalt. Campylobacter bakterier kan vokse i temperaturområdet 30-42°C og har optimumtemperatur mellem 37 og 42°C. Karakteristisk er det at dens minimumstemperatur er 20°C. Den er således ikke i stand til at opformere sig ved kølerumstemperaturer eller i drikkevand. Bakterierne kan overleve to til fire uger ved 4°C og to til fem måneder ved –20°C (BAM). Campylobacter har en D-værdi (decimal varmereduktionstid) på under eet minut ved 60°C og er således meget varmefølsomme. Campylobacter jejuni og Campylobacter coli er termofile med optimumtemperatur på 37°C. Campylobacter er følsomme for udtørring. Specielt C. jejuni er meget følsom for tørring og opbevaring ved stuetemperatur, hvorimod en større andel overlever flere uger når opbevaring sker ved køletemperaturer og passende fugtighed (BAM). Optimalt pH for vækst af campylobacter er pH området 6,5 til 7,5. Bakterien overlever ikke pH værdier under 4,9, men kan vokse i området pH 4,9 til 9,0. Campylobacter er gram-negative, oxidase positive og katalase positive. Nogle campylobacter fermenterer eller oxyderer kulhydrater. Campylobacter jejuni hydrolyserer hippurat, indoxyl, acetat og reducerer nitrat, men C. jejuni kan ikke fermentere eller oxydere kulhydrater. Campylobacter er skrøbelige og følsomme for stress såsom ilt, udtørring, lavt pH, varme, frysning og længere tids opbevaring. Restituering af beskadigede celler foregår derfor i mindre grad hos campylobacter end hos andre bakterier. Der kræves derfor også selektive medier for at kunne isolere campylobacter bakterier. De fleste campylobacter stammer er modstandsdygtige overfor antibiotikaet cephalothin og mange er også resistente overfor flourquinoloner, en kategori af antibiotika, som anvendes ved bekæmpelse af sygdomme hos dyr og mennesker. 1.2 CampylobacterioseCampylobacter kan give sygdommen campylobacteriose hos mennesker, og bakterien er i dag den hyppigste årsag til fødevarebårne mavetarminfektioner hos mennesker i Danmark og i mange andre lande. 1.2.1 SymptomerSymptomerne er diarré (evt. blodig), kvalme, mavesmerter, feber, hovedpine og muskelsmerter. Infektionerne kan i sjældne tilfælde manifestere sig som meningitis, lungebetændelse og abort, en meget sjælden følgesygdom er en voldsom form af Guillan-Barré Syndrom. De patogene mekanismer bag campylobacteriose er ikke fuldstændig afdækkede, men C. jejuni menes at producere et varmelabilt toksin som forårsager diarré. C jejuni kan også være invasiv, den koloniserer tarmen og forårsager inflammatorisk diarré med feber. De fleste infektioner er selvbegrænsende og behandles ikke med antibiotika. Behandling med erythromycin reducerer den periode, hvori patienterne udskiller campylobacter i faeces. Børn og unge samt personer med undertrykt/svækket immunforsvar er mere modtagelige for campylobacteriose og risikerer længere og sværere sygdomsforløb. 1.2.2 Inkubationstid og varighed af campylobacterioseInkubationstiden er fra to til ti dage, hvorefter sygdommen varer fra syv til ti dage, men tilbagefald er ikke ualmindelige og sygdommen kan vare op til flere uger. 1.2.3 Infektiv dosisDer skal meget få bakterier til for at give sygdom. Infektiv dosis er lav (varierer fra ca. 500 bakterieceller til 10000 bakterieceller), afhængig af campylobacter stammen og af hvor beskadigede bakteriecellerne er som følge af stress fra miljøet. Infektiv dosis er lavere for personer med undertrykt/svækket immunforsvar (BAM). C. jejuni er hovedårsagen til campylobacteriose hos mennesker (ca. 90% af tilfældene), mens C coli tegner sig for hovedparten af de resterende campylobacteriose tilfælde. 1.2.4 Hyppighed af campylobacterioseAntallet af campylobacteriose tilfælde overstiger langt antallet af salmonellose tilfælde. Campylobacterinfektioner hos mennesker har været et tiltagende problem gennem en række år både i Danmark og andre lande. Figur 1 viser udviklingen i campylobacteriose i Danmark (DFVF). Det reelle antal vurderes at være væsentlig højere (10-25 gange). En væsentlig del af tilfældene relateres til smitte i udlandet, såkaldt rejsediarré. Figur 1: Udvikling af registrerede sygdomstilfælde i Danmark (DFVF).
1.2.5 Forekomst og smittevejeCampylobacter er kræsne mikroorganismer og på grund af den høje minimumstemperatur for vækst kan den kun sjældent opformere sig i miljøet på vore breddegrader. Men den er i stand til at overleve mange steder i miljøet og der skal få bakterier til for at blive syg. Den er påvist i vand fra floder, flodmundinger og kystvand i mængder fra 10 til 230 cfu/100 ml. Campylobacter findes og kan opformere sig i tarmkanalen hos mange pattedyr og fugle. Højere kropstemperatur hos fugle end hos pattedyr menes at være årsag til større hyppighed hos fugle. Dyrene kan være raske smittebærere men kan også få campylobacteriose. Man har ikke fundet raske smittebærere blandt mennesker, men campylobacter isoleres ofte fra rask kvæg, kyllinger, fugle, kæledyr og fluer. Der kan påvises en årstidsvariation i forekomst af campylobacter, således er lavest forekomst i de kolde måneder og højst forekomst i de varme måneder. Mange fødevarer er beskrevet som årsag til campylobacteriose hos mennesker. Flere undersøgelser peger på fjerkræ som en af hovedkilderne, men også svine- og oksekød, kød tilberedt på grill, upasteuriseret mælk, forurenet drikkevand og kontakt til kæledyr er beskrevet som årsager til campylobacteriose hos mennesker. C jejuni kan findes i mange animalske levnedsmidler, men oftest er fjerkræ og rå mælk hovedkilden. På svinekød er det C coli der dominerer. I 2001 blev campylobacter påvist i 33% af prøver af dansk kyllingekød, og i 18% af dansk kalkunkød (DFVF). I okse- og svinekød forekommer bakterien i ca. 1% af de undersøgte prøver. De fleste campylobacterinfektioner er sporadiske og omfatter enkelt tilfælde og kilden til smittespredning kan sjældent identificeres. Udbrud af campylobacteriose er sporet til rå mælk, kontamineret vand og kontakt med kæledyr og husdyr. Campylobacter findes i mælk som følge af fækal forurening under malkningen eller en infektion i yveret. Forurenet vand, såvel overfladevand som brøndvand er påvist som kilde til campylobacteriose (SLV rapport nr. 10 2002). 2 State of the art campylobacter i vandInternationalt interesserer man sig meget for forekomst af campylobacter i fjerkræ, men der er også fokus på forekomsten af campylobacter i vand. Der findes en række rapporter om campylobacteriose forårsaget af bl.a. forurenet drikkevand. Det norske Matttilsynet skriver i sin årsrapport 2003, at campylobacteriose i Norge har kunnet spores til forurenet drikkevand, fjerkrækød og grillmad, men smitte kan også ske ved kontakt med husdyr. En landsomfattende undersøgelse fra 2000-2001 viste at 24% af 595 undersøgte hunde og 18% af 332 katte var positive for campylobacter. C upsaliensis var den hyppigst forekommende type med en prevalens på 20% blandt hunde og 13% blandt katte. C jejuni blev isoleret fra 6% af hundene og fra 3% af kattene. C coli kunne påvises fra 1% af kattene. C upsaliensis anses for at være mindre sygdomsfremkaldende for mennesker end C jejuni og C coli. Voksne hunde og katte bliver sjældent syge af bakterien, men diarré kan forekomme hos unge individer. Campylobacter kan også ofte isoleres fra overfladevand. Der blev rapporteret i alt 2270 campylobacteriose tilfælde i Norge i 2003 mod 1539 salmonellose tilfælde. Dette er det samme mønster som i Danmark. I 2003 blev der i Norge rapporteret fire campylobacterioseudbrud, hvoraf to var indenlandske. Det drejede sig om et udbrud omfattende syv rapporterede tilfælde, hvor drikkevand var mistænkt som smittekilde, og et andet udbrud omfattende tre rapporterede tilfælde, hvor kontakt med levende kyllinger i en børnehave var mistænkt som smittekilde. Den svenske zoonoserapport 2003 beskriver, at der i 2003 er rapporteret fem udbrud af campylobacteriose. To af udbrudene var relateret til vand og omfattede mere end 300 mennesker. Derudover var 15 personer involveret i to udbrud af campylobacteriose efter at have indtaget kontamineret kylling. Det femte udbrud omfattede syv personer, som havde deltaget i en picnic. Kilden til sidstnævnte udbrud af campylobacteriose kunne ikke identificeres. I Sverige blev der i 2003 rapporteret 7137 tilfælde af campylobacteriose mod 3994 tilfælde af salmonellose. Der er således samme mønster i forholdet mellem zoonoserne i de skandinaviske lande og samme mønster genfindes for så vidt i alle de industrialiserede lande. Livsmedels Verket i Sverige har i år 2000 gennemført Riksprojekt 1: ”Campylobacter i kött och vatten”. Formålet med projektet var at kortlægge forekomsten af campylobacter i råt kød og i råvand til drikkevand. Campylobacter blev isoleret fra 7% af ca. 600 prøver fra offentlige vandreservoirer (overfladevand) og fra enkelte grundvandsprøver. Ca. halvdelen indeholdt C jejuni og ca. halvdelen indeholdt C coli. Campylobacter blev i mange tilfælde isoleret fra overfladevand, hvor der ikke kunne påvises fækale indikatorbakterier. De grundvandsprøver, der indeholdt campylobacter, var i de fleste tilfælde tydeligt fækalt forurenede. I England, under FDA, blev der i april 2003 iværksat et projekt: ”Environmental and water-borne sources of campylobacter in the north-west England and their influence on seasonal human infection”. Projektet løber frem til marts 2006. Formålet med projektet var at undersøge udbrud af campylobacteriose i nordvest England og vurdere det bidrag, som miljøpåvirkninger, inklusiv vandbårne smittekilder, udgør for forekomsten af campylobacteriose. Kvantificering af forekomsten af campylobacter i miljøet skal anvendes til at belyse eksponering af campylobacter for mennesker og de epidemiologiske sammenhænge mellem udbrud af campylobacteriose og campylobacter typer påvist i vand og dyr. Fra Tyskland (RKI) er der rapporteret om udbrud af campylobacteriose hos børn. Smittekilden blev sporet til at børnene under badning i søvand havde slugt vand. I Danmark kendes mindst eet tilfælde af vandbåren smitte med campylobacter (Zoonose Nyt 1997). Ved en undersøgelse (boring) af grundvand (i Klarup) i 1995 beskadigede man en kloakledning, så kloakvandet blev sendt ud i grundvandet. 2400 personer modtog forurenet drikkevand i en seks ugers periode, resulterende i 110 registrerede tilfælde af campylobacteriose, 13 hospitalsindlæggelser, og eet tilfælde af Guillan-Barré Syndrom (SSI 2003). Der var i det tilfælde tale om Campylobacter jejuni. Campylobacteriose er den hyppigst forekommende zoonose i mange lande og således også i Danmark. Det er væsentlig at få klarlagt forekomst af bakterien, således at der er basis for at foretage en risikovurdering af de sundhedsmæssige aspekter. Der foreligger ikke for indeværende danske undersøgelser over kvantitative forekomster af campylobacter i badevand og drikkevand. 3 BadevandI Miljøstyrelsens projekter ”Hygiejnisk kvalitet af spildevand fra offentlige renseanlæg” og ”Smitstoffer i spildevand” er der påvist campylobacter i størrelsesordenen 100 – 10.000 per 100 ml. Det rensede spildevand udledes til badevandet. Campylobacter findes i badevand, men niveauer og frekvenser er ikke undersøgte. Dette projekt kan således bidrage til at få mere viden om forekomst af campylobacter i vandmiljøet. Det undersøgte badevand er havvand, fordi det udgør langt størstedelen af det danske badevand. Badestederne er valgt således at en generel varierende badevandskvalitet indgår i projektet. 3.1 Materialer og metoder3.1.1 PrøveudtagningScreeningsundersøgelsen omfattede 153 prøver af kystbadevand. Prøverne er udtaget sammen med prøver til den almindelige kontrol af kystbadevand. Prøverne er udtaget i sterile brune flasker, disse er transporteret afskærmet fra lys og under køl til analyselaboratoriet. Prøverne er udtaget i badesæsonen. 3.1.2 AnalyserAnalyserne er udført i henhold til Forslag til Dansk Standard 39180 – Vandundersøgelse – detektion og bestemmelse af termotolerante campylobacter. juni 2004 (bilag A). Princippet i analysemetoden er membranfiltrering af prøverne efterfulgt af preopformering af filtrene i Bolton bouillon og i Preston bouillon. Preinkubation er foretaget mikroaerofilt ved 37,0°C ± 1,0°C i 44 ± 4 timer. Efter inkubation er udstreget fra hver bouillon på overfladen af det selektive substrat mCCDA. Pladerne er inkuberet ved 41,5°C ± 1,0°C i 44 ± 4 timer, hvorefter pladerne er aflæst. Verifikation af suspekte kolonier er foretaget ved undersøgelse for vækst under aerobe og under microaerofile forhold. Isolater uden aerob vækst er mikroskoperet for morfologi og bevægelighed. Alle analyserne er påbegyndt indenfor 24 timer efter prøveudtagning. Indhold af Campylobacter er bestemt semikvantitativt ved analyse af henholdsvis 10 ml, 100 ml og 1000 ml. Kontrolstammer af C. jejuni, C. coli og C. lari er medtaget som positive kontroller alle analysedage. Prøverne er analyseret for de almindelige badevandsparametre – termotolerante coliforme bakterier og coliforme bakterier . Desuden er de almindelige feltmålinger - vandtemperatur, vindstyrke, sigtedybde og pH – medtaget for at undersøge mulige korrelationer til forekomst af campylobacter, fx fortyndingseffekt som følge af vejrliget. 3.2 ResultaterI nedenstående tabel 1 er vist det samlede resultat af campylobacter analyserne. Termofile campylobacter kunne isoleres fra i alt 20,3% af 153 prøver. Tabel 1: Fund af termofile campylobacter i badevand
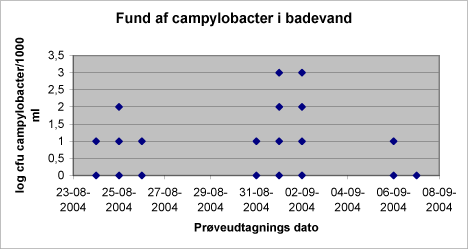
De positive fund fordeler sig som vist i figur 2 hen over prøveudtagningsperioden. Prøverne med indhold af campylobacter > 100 cfu/1000 ml fordeler sig med 2 prøver udtaget 1. september og 3 prøver udtaget 2. september . Figur 2: Indhold af campylobacter i badevand.
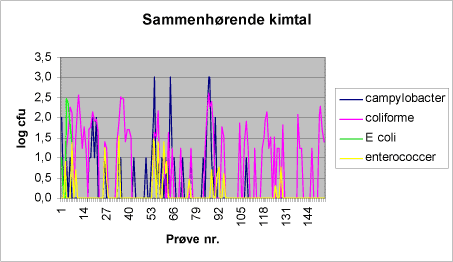
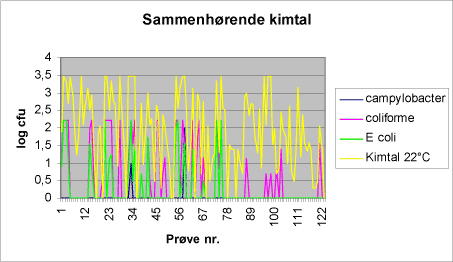
I figur 3 ses sammenhørende resultater af campylobacter analyser og prøvernes indhold af coliforme bakterier, E. coli og enterokokker. Figur 3: Kimtal i badevandsprøverne.
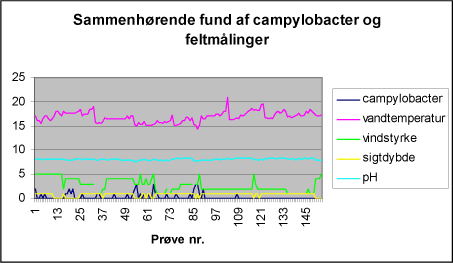
I figur 4 fremgår fund af campylobacter og sammenhørende feltmålinger per prøve. Nogle af målingerne vises for tydelighedens skyld i transformeret form. Figur 4: Indhold af campylobacter og sammenhørende feltmålinger i badevand.
Tabel 2: Oversigt over niveau af de målte mikrobiologiske kvalitetsparametre.
Tabel 2 viser variationerne af de enkelte mikrobiologiske parametre for det undersøgte badevand. 3.3 Diskussion3.3.1 Korrelationer mellem indhold af campylobacter og kvalitetsparametre.For at undersøge om der er sammenhæng mellem badevandskvaliteten og forekomsten af campylobacter er korrelationen mellem forskellige badevandsparametre og campylobacter beregnet. Tabel 3: Parvis sammenligning mellem indhold af campylobacter og de enkelte kvalitetsparametre for badevand.
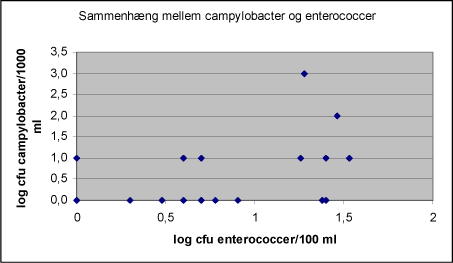
I denne screeningsundersøgelse er der fundet 20,3% prøver positive for campylobacter. Svenske undersøgelse fra 2000 fandt 16% positive prøver fra overfladevand i juni måned og 13% positive prøver fra overfladevand i november måned, mens kun 2% af prøverne fra overfladevand var positive i maj måned. Samme billede fandtes i en tidligere svensk undersøgelse, hvor de højeste fund ligeledes blev gjort i september- november måned. Undersøgelser fra andre lande har vist frekvenser på mellem 2 og 82% (SLV rapport nr. 10, 2002), hvor de højeste frekvenser er fundet i vintermånederne og de laveste om sommeren. Det er almindeligt kendt at køling forlænger overlevelse af sygdomsfremkaldende mikroorganismer i vand, og campylobacter vil således også kunne overleve længe under køling, men termotolerante campylobacter formerer sig ikke ved temperaturer under 20°C. Overlevelsesevnen er forskellig for forskellige typer og stammer. Det er muligt at campylobacter overlever længere end de fækale indikatororganismer. Campylobacter positive prøver forekommer (figur 3) både blandt høje og lave indhold af coliforme bakterier og E coli. Campylobacter negative prøver forekommer også i prøver med høje indhold af coliforme bakterier og høje indhold af E. coli. Der ses en meget svag korrelation mellem enterokokker og campylobacter (Korrelationskoefficient 0,53 jf. tabel 3), samme tendens fremgår af figur 5. Figur 5: Sammenhørende resultater af campylobacter og enterokokker for badevand.
Antallet af sammenhængende målinger af enterokokker og campylobacter er imidlertid relativt lavt, og ikke mindst er antallet af positive campylobacter prøver lavt, og det kan ikke ud fra de foretagne målinger konkluderes at der er sammenhæng mellem parametrene. I den svenske undersøgelse (SLV rapport nr. 10 2002) fandtes heller ingen korrelationer mellem indholdet af campylobacter og de mikrobiologiske kvalitetsparametrene for badevand. Det anføres at der i nogle undersøgelser kan påvises sammenhæng til coliforme og E. coli eller temperatur, mens der i andre undersøgelser ingen korrelationer kan påvises. 3.3.2 Campylobacter og forurening af badevandBadevand kan forurenes med campylobacter fra dyr og tilførsel af afløb fra renset spildevand, drænvand m.v. Der er rapporteret om tilfælde, hvor samme serotype af campylobacter er påvist i græssende kvæg og i de søer, som kvæget drak vand fra. Under badning og leg i vandet er der risiko for at sluge badevand, og dermed blive smittet med campylobacter. I denne screeningsundersøgelse er der i 3,3% af prøverne fundet indhold af campylobacter ≥ 100 cfu/1000 ml, men resultaterne er semikvantitative og det vides ikke hvor store de reelle forekomster er. Da den infektive dosis er lav, fra 500 til 10.000 cfu, kan det ikke udelukkes at badevand kan udgøre en risikofaktor. Specielt skal man være opmærksom på at følsomheden er større for børn og personer med nedsat immunforsvar. 3.4 Konklusion af badevandsanalyserScreeningsundersøgelsen af badevand omfattede 153 prøver udtaget i perioden 24. august 2003 til 6. september 2003. 20,3% af prøverne var positive for campylobacter og 3,3% af prøverne indeholdt campylobacter i niveau ≥ 100 cfu/1000 ml. Baseret på at infektiv dosis er lav for campylobacter, at analyserne er semikvantitative – de faktiske forekomster kendes ikke, at fordelingen af mikroorganismer i vand er meget ujævn og at infektiv dosis er lavere for mennesker med nedsat eller svækket immunforsvar konkluderes det at indhold af campylobacter i det fundne niveau i badevand formodes at kunne udgøre en risko for badende. 4 DrikkevandForurenet drikkevand kan være kilde til campylobacteriose. Miljøstyrelsens projekt ”Undersøgelse for patogener i udvalgte vandværker” viste at der ikke forekom campylobacter i drikkevand (råvand og rent vand). Der er ikke foretaget screening af forekomst af campylobacter i brønde og enkeltvandforsyninger. Dette projekt kan således bidrage til at få mere viden om forekomst af campylobacter i vandmiljøet. 4.1 Materialer og metoder4.1.1 PrøveudtagningScreeningsundersøgelsen omfattede 114 prøver af drikkevand. Prøverne er udtaget sammen med forenklede kontroller fra brønde og enkeltvandforsyninger. Prøverne er udtaget i sterile brune flasker, som er transporteret afskærmet fra lys og under køl til analyselaboratoriet. Prøverne er udtaget i perioden 15. september til 25 november 2004. 4.1.2 AnalyserAnalyserne er udført efter samme metode som nævnt under 1.3.2. Alle analyserne er påbegyndt indenfor 24 timer efter prøveudtagning. indhold af Campylobacter er bestemt semikvantitativt ved analyse af hhv. 10 ml, 100 ml og 1000 ml. Kontrolstammer af C. jejuni, C. coli og C. lari er medtaget som positive kontroller alle analysedage. Alle prøverne er analyseret efter samme analyseprogram som foreskrevet for forenklede kontroller, og efter de foreskrevne analysemetoder. Coliforme bakterier og E. coli er analyseret ifølge DS 2255, kimtal 22°C er analyseret ifølge DS 6222 og Clostridium perfringens ifølge DS 2256. I denne rapport er kun medtaget de mikrobiologiske resultater. 4.2 ResultaterTermofile campylobacter er isoleret fra 2 prøver ud af i alt 123 analyserede prøver, svarende til 1,62,8% positive fund. Niveau af campylobacter fremgår af nedenstående tabel. Tabel 4: Fund af termofile campylobacter i drikkevand.
De to prøver, hvorfra campylobacter kunne isoleres, havde høje kimtal, såvel kimtal 22°C som coliforme bakterier og E. coli. Som det fremgår af figur 6 fandtes samme niveauer af kimtallene i flere af de prøver, der var negative campylobacter. Tabel 5: Mikrobiologiske analyseresultater for de to campylobacter positive drikkevandsprøver.
Tabel 6 oversigt over niveau af de mikrobiologiske kvalitetsparametre
Tabel 6 viser variationerne af de enkelte mikrobiologiske parametre for det undersøgte drikkevand. Figur 6: Mikrobiologiske analyseresultater for drikkevand.
4.3 DiskussionDa der i screeningsundersøgelsen kun er påvist campylobacter i to drikkevandsprøver har det ingen mening at udregne korrelationsværdier. De to positive prøver har begge kimtal ved 22°C i niveau >3000 cfu/ml, men det har mange af de campylobacter negative prøver også jf. tabel 6. Samme indhold af coliforme bakterier og af E coli som i de campylobacter positive prøver findes i andre af de analyserede prøver, men heri er der ikke påvist termotolerante campylobacter. Som følge af det spinkle datamateriale kendes spredningen ikke for indhold af termofile campylobacter i drikkevand. Ved en så sporadisk forekomst af campylobacter er det nødvendig med en mere omfattende prøveudtagning for at dokumentere forekomst af campylobacter. Den infektiv dosis er lav (ca. 500 cfu) og man ved at mikroorganismer er meget ujævnt fordelt, selv i så homogene medier som vand. Det kan derfor ikke udelukkes at blot tilstedeværelse af campylobacter i drikkevand- dvs. få bakterier – kan udgøre en risiko. I de to nævnte tilfælde vil forureningen og dermed risikoen for tilstedeværelse af sygdomsfremkaldende bakterier som campylobacter blive opdaget på grund af højt indhold af indikatororganismerne - coliforme bakterier og E. coli - samt af højt kimtal ved 22°C. I litteraturen findes eksempler på drikkevandsprøver, der er positive for campylobacter , men med fravær af indikatororganismerne (SLV rapport nr. 10/2002). Som tidligere nævnt er det muligt at overlevelsesevnen er forskellig for campylobacter og indikatororganismerne. Det er også muligt at campylobacter overlever specielt godt i koldt (rent) vand, hvor der er meget lidt konkurrence fra andre mikroorganismer. Men den i andre undersøgelser ikke-konstaterede sammenhæng mellem forekomst af indikatororganismer og forekomst af campylobacter kan også skyldes de anvendte analysemetoder. I dette projekt er anvendt analysemetode Forslag til Dansk Standard 39180 – Vandundersøgelse – detektion og bestemmelse af termotolerante campylobacter. juni 2004 (bilag A). Der anvendes to opformeringsmedier hhv. Bolton bouillon og Preston bouillon. 35% af de positive prøver er kun positive med Bolton bouillon som opformeringsmedium og 27% af de positive prøver er kun positive med Preston bouillon som opformeringsmedium. I det svenske riksprojekt (SLV rapport nr. 10, 2002) er der gennemført parallelle analyser med traditionel dyrkningsteknik og PCR analyser. I flere tilfælde findes prøverne positive efter PCR metoden, men negative efter dyrkningsmetoden. Dette rejser spørgsmålet både om egnethed af dyrkningsmetoder og om campylobacter kan overgå til en levende men ikke dyrkbar form, når de befinder sig længe i kolde vandige miljøer. Dette fænomen er almindelig kendt for andre mikroorganismer. Det er ukendt om mikroorganismer i denne form kan udgøre nogen risiko for sundheden. Drikkevand kan forurenes med campylobacter på samme måde, som det kan forurenes med andre mikroorganismer, herunder fækale bakterier som E. coli. Frekvensen af vandbåren smitte med campylobacter er lavere i Danmark end i de øvrige nordiske lande (SLV rapport). Dette skyldes formodentlig, at overfladevand i Danmark kun i få tilfælde anvendes til produktion af drikkevand. 4.4 Konklusion af drikkevandsanalyserScreeningsundersøgelsen af drikkevand omfattede 123 prøver udtaget i perioden 15. september til 15. november 2004. 1,6% af prøverne var positive for campylobacter. 0,9% af prøverne (svarende til én prøve) indeholdt campylobacter i niveau ≥ 1 og <10 cfu/1000 ml og 0,9% af prøverne (svarende til én prøve) indeholdt campylobacter i niveau ≥ 10 og <100 cfu/1000 ml. Grundet de meget få positive prøver kan der ikke konkluderes på sammenhænge til andre kvalitetsparametre. Forekomst af campylobacter i drikkevand er sporadisk, derfor er der brug for væsentlig større undersøgelse for at skaffe tilstrækkeligt datamateriale og dermed større viden om forureningskilder, forureningsniveauer og hvilke risici dette indebærer. Baseret på resultatet af dette projekt, af Miljøstyrelsens projekt ”Undersøgelse for patogener i udvalgte vandværker” og af antallet af registrerede tilfælde af vandbårne campylobacteriose vurderes campylobacter ikke at udgøre et problem i dansk drikkevand. 5 Konklusion på screeningsundersøgelseScreeningsundersøgelsen har vist at termofile campylobacter er almindelig forekommende i badevand. Der er analyseret 153 badevands prøver, heraf indeholdt 20,3% campylobacter og 3,3% af prøverne indeholdt campylobacter i et niveau >100 cfu/1000 ml. Det konkluderes at det fundne niveau kan udgøre en sundhedsmæssig risiko for badende. Screeningen omfattede analyse af 123 drikkevandsprøver, heraf indeholdt 1,6% campylobacter. 0,9% af prøverne (svarende til én prøve) indeholdt campylobacter i niveau ≥ 1 og <10 cfu/1000 ml og 0,9% af prøverne (svarende til én prøve) indeholdt campylobacter i niveau ≥ 10 og <100 cfu/1000 ml. I drikkevand er forekomst af campylobacter sporadisk. Forenklet kontrol af enkeltvandsyninger og brønde foretages hvert 5. år, hvorfor kortvarige forureninger kun i sjældne tilfælde vil blive opdaget. Det vurderes at campylobacter ikke for indeværende udgør et problem i dansk drikkevand. Der er ikke fundet direkte sammenhæng mellem forekomst af indikatorbakterier, såsom E. coli og enterokokker, og forekomst af campylobacter. Sammenhæng mellem vandtemperaturen i badevand og indhold af campylobacter kan heller ikke påvises. Det er sandsynligt at der er sammenhæng mellem årstider og forekomst af campylobacter i badevand med størst frekvens af positive fund på den koldeste årstid. Man skal være forsigtig med at sammenligne og konkludere på tidligere/andre undersøgelser, idet den anvendte analysemetode har stor betydning for såvel frekvens af positive fund som for den fundne mængde af campylobacter. 6 Referencer1. Baserisalehi M., Bahador N., Augustine S.K., Al-Mahdi A.Y., Kapadnis B.P. (2004) Enhanced recovery and isolation of campylobacter spp. from water using a novel device. Journal of Applied Microbiology 2004, 96, 664-670.) 2. Keener K.M., Bashor M.P., Curtis P.A., Sheldon B.W., Kathariou S., 2004. Comprehensive review of campylobacter and poultry processing. Comprehensive reviews in food science and food safety vol 3, 105-106. 3. Livsmedels Verket, 2002 rapport 10: Riksprojekt 1 – 2000 Campylobacter i kött och vatten. 5. (FDA/CFSAN BAM – Campylobacter Bacteriological Analytical Manual Online, March 2001 chapter 7). 6. Miljøprojekt nr. 786, 2003, Miljøstyrelsen Undersøgelse for patogener i udvalgte vandværker. 8. www.dfvf.dk 9. www.food.gov.uk: FDA 10. www.idamiljo.dk : Sundhedsmæssige aspekter af bakteriologisk forurening, Kaare Mølbak SSI, 2003 11. www.sva.se, zoonosrapport 2003 12. www.slv.se 13. www.vetinst.no, zoonoserapport 2003 14. Zoonose Nyt, 1997, 4 udg., nr. 2
Bilag AVandkvalitet – Kvalitativ og semikvantitativ påvisning af termotolerante campylobacter.IntroduktionCampylobacter jejuni subsp. jejuni og Campylobacter coli er hyppigt årsag til tarminfektioner hos mennesker. Campylobacter upsaliensis har muligvis lignende betydning. Campylobacter lari ses sjældnere som årsag til infektioner hos mennesker. Campylobacter overføres oftest fra fødevarer, husdyr, kæledyr eller andre syge personer; men de kan også overføres med overfladevand, hvis dette indtages. ADVARSEL – Denne standard bør kun benyttes af personer, der er fortrolige med almindelig laboratoriepraksis. Det er brugerens ansvar at sørge for passende sikkerheds- og sundhedsregler og at sikre, at gældende regler efterleves. 1 EmneområdeDenne standard angiver en metode til kvalitativ og semikvantitativ påvisning af termotolerante campylobacter. Metoden kan anvendes til alle typer vand, der kan filtreres gennem et membranfilter. BEMÆRK Metoden kan anvendes som en kvalitativ metode for campylobacter i et givet prøvevolumen. BEMÆRK Der kan fås et mere præcist estimat af campylobacter indholdet i prøven ved at analysere efter et MPN design. 2 Normative referencer
3 DefinitionerI denne standard anvendes følgende definitioner: Termotolerante campylobacter opsamles på filtre efter filtrering som angivet i afsnit 8.2, opformeres under den selektive opformering beskrevet i afsnit 8.3, danner typiske kolonier under inkubation i selektivt substrat ved forhøjet temperatur som beskrevet i afsnit 8.4, danner ikke synlige kolonier under inkubering i atmosfærisk luft under betingelser som angivet i afsnit 8.6, er stærkt bevægelige, slanke spiralformede stave og bevæger sig i hurtige ryk eller i proptrækkeragtige drejninger. BEMÆRK Termotolerante campylobacter af betydning for humane infektioner omfatter Campylobacter jejuni subsp. jejuni (herefter omtalt som C. jejuni), C. coli, C. lari og muligvis C. upsaliensis. BEMÆRK Termotolerante campylobacter er gram-negative, oxidase-positive og katalase-positive (nogle C. upsaliensis angives at være katalase-negative eller svagt positive) buede eller spiralformede stave med en karakteristisk hurtig, og ofte roterende, bevægelse. I blot lidt ældre kulturer optræder coccoide former. BEMÆRK Campylobacter kræver næringsrige substrater for optimal vækst. De er meget følsomme for skadelige oxidationsprodukter som peroxider og superoxid anioner, der kan opstå, når substrater udsættes for lys og ilt. De er mikroaerofile og foretrækker en atmosfære med ca. 5 % ilt og ca. 10 % CO2. Nogle campylobacter angives at vokse bedst, når atmosfæren også indeholder brint. BEMÆRK De fleste stammer af C. jejuni, C. coli og C. lari vokser ved temperaturer mellem 32 °C og 45 °C, men nogle stammer vokser ikke under 35 °C, og andre vokser ikke ved temperaturer over 43 °C. BEMÆRK C. upsaliensis kan muligvis ikke påvises ved de i denne standard beskrevne dyrkningsbetingelser. 4 PrincipPrøven filtreres gennem membranfiltre med porestørrelse 0,45 µm. Filtrene overføres til selektive opformeringsbouilloner, der inkuberes i (44 ± 4) timer ved (37 ± 1) °C i modificeret atmosfære. Efter inkubationen udstryges fra hver bouillon på overfladen af et selektivt, fast substrat, mCCDA, der inkuberes i (44 ± 4) timer ved (41,5 ± 1) °C i modificeret atmosfære. Kolonier, der kan være campylobacter, undersøges for vækst under aerobe forhold. Isolater, der ikke vokser aerobt, undersøges ved fasekontrast mikroskopi og evt. ved enkelte, biokemiske reaktioner. Se flow diagram i bilag A. Hvis der findes typiske campylobacter, er der påvist termotolerante campylobacter i prøven. Resultatet angives som et semikvantitativt estimat, se bilag B. BEMÆRK Vand, der ikke lader sig filtrere, kan undersøges ved at pode vandprøven direkte i opformeringsbouillon. Forholdet mellem prøven og opformeringsbouillonen bør højst være 10 %. BEMÆRK Hvis der er et højt indhold af campylobacter i prøven, kan prøvemateriale uden forudgående opformering udstryges på mCCDA agar. 5 Apparatur5.1 Inkubatorer der kan holde (37 ± 1) °C og (41,5 ± 1) °C.5.2 Udstyr til membran filtrering, jævnfør ISO 8199.5.3 MembranfiltreSterile membranfiltre af celluloseester med en diameter på 45 – 50 mm og en porestørrelse på 0,45 µm. Tilsvarende filtre med porestørrelse 0,22 µm til sterilisering af reagenser. 5.4 Udstyr til mikroaerob inkubationTætte beholdere, der kan vedligeholde en modificeret atmosfære under inkubationerne, udstyret med ventiler til udsugning og indblæsning. Vakuum pumpe. Udstyr til at kontrollere atmosfærens sammensætning, ANOXOMAT eller tilsvarende. En passende gasblanding af kvælstof, ilt, kuldioxid og om muligt brint. Alternativt kan anvendes gas-generende pakker, forudsat de kan etablere og vedligeholde en atmosfære med ca. 5 % ilt, ca. 10 % kuldioxid og helst også ca. 10 % brint. 5.5 Fasekontrast-mikroskop5.6 Flasker, 150 - 250 ml, med lufttætte skruelåg5.7 Petriskåle med ribber, sterile, 9 cm5.8 Almindeligt laboratorieudstyr6 Substrater og reagenserAlle ingredienser og kemikalier skal være af anerkendt kvalitet, ”for microbiology” eller bedre. Vand skal være destilleret eller af tilsvarende kvalitet, jævnfør ISO 3696, Grade 3. Følg instruktionerne i bilag C. Der kan med fordel anvendes kommercielt tilgængelige tørsubstrater, forudsat de svarer til ingrediensfortegnelserne i bilag C. De skal fremstilles efter fabrikantens anvisninger. 7 Prøvetagning, transport og opbevaringCampylobacter er meget følsomme for skadelige påvirkninger. Det er derfor vigtigt, at prøverne holdes kolde ((3 ± 2) °C) og beskyttet mod lys, indtil de er blevet filtrerede, og filtrene anbragt i opformeringsbouillonerne. Generelle prøvetagningsbetingelser er omtalt i ISO 19 458. For Campylobacter er det særlig vigtigt at undgå opblanding med luft, ligesom prøver skal filtreres snarest muligt efter prøvetagning. Om nødvendigt kan prøverne opbevares i indtil 30 timer før filtrering. BEMÆRK Campylobacter holder sig godt i rent vand ved (3 ± 2) °C. Ved højere temperaturer og i andre væsker henfalder de hurtigt. 8 Fremgangsmåde8.1 GenereltMedtag altid en positiv kontrolstamme podet i enten prøvemateriale eller i sterilt vand, filtreret, opformeret og udsået parallelt med prøverne, dels for at kunne dokumentere, at alle trin i analysen virker tilfredsstillende, dels for at have frisk referencemateriale til rådighed ved identifikationen af campylobacter (afsnit 8.5 og 8.6). Analyser hver prøve dobbelt, således at der opformeres både i den stærkt selektive Preston bouillon (C.1.1) og i den mindre selektive Bolton bouillon (C.1.2). BEMÆRK Preston bouillon er for selektiv til at tillade fremvækst at alle C. coli. Bolton bouillon er for svagt selektiv til at undertrykke ledsagefloraen i alle typer prøvemateriale. Hvis der ikke er tilstrækkeligt prøvemateriale vælges den bouillon, der vurderes bedst egnet til undersøgelsen. For prøver med en kraftig baggrundsflora er Preston bouillon bedst egnet. For prøver med ringe baggrundsflora er Bolton bouillon bedre egnet. BEMÆRK Mængderne af prøvemateriale, der skal analyseres, afhænger af prøvematerialets sammensætning og undersøgelsens formål. I bilag B er angivet relevante prøvemængder ved analyse af drikkevand og af spildevand. 8.2 MembranfiltreringFiltrer de relevante mængder prøvemateriale (jævnfør bilag B) gennem sterile 0,45 µm membranfiltre (5.3). Tilstræb mindst mulig kontakt med luftens ilt, bl.a. ved at undgå at suge luft gennem filtrene efter at prøven er filtreret. Overfør filtrene til opformeringsbouilloner straks efter filtreringen. Hvis prøven indeholder meget opslemmet materiale, kan det være nødvendigt at anvende to eller flere filtre til de største prøvevolumina. Alle disse filtre overføres til samme portion opformeringsbouillon. Brug af forfilter (”filter aid”) kan også være en hjælp ved filtreringen af sådanne prøver. ”Filter aid” er beskrevet i ISO 8199. 8.3 OpformeringOpvarm opformeringsbouillonerne (C.1.1, C.1.2) til 20 - 30 °C, inden de podes. Overfør filtrene (8.2) til hver sin 100 ml portion opformeringsbouillon straks efter de enkelte filtreringer. Anbring de podede bouilloner med løst låg eller uden låg i beholdere (5.4). Luk beholderne og modificer luften derinde (5.4). Anbring derefter beholderne ved (37 ± 1) °C i (44 ± 4) timer. BEMÆRK Der anvendes 100 ml opformeringsbouillon pr. filter for at opnå tilstrækkelig fortynding af ledsagefloraen til, at denne ikke hæmmer campylobacternes vækst. BEMÆRK Nogle laboratorier har med held opformeret campylobacter uden brug af mikroaerofil atmosfære (5.4). I stedet har de anvendt tæt tillukkede flasker eller rør, der har været omtrent fyldt med bouillon. En sådan procedure vil kræve omhyggelig standardisering for at udelukke falsk negative resultater på grund af suboptimale forhold under opformeringen. BEMÆRK Preston Campylobacter Selektivt Supplement (C1.1.2) indeholder antibiotika som er kendt som relativt giftige over for C. coli og over for subletalt beskadigede C. jejuni (Polymyxin B og Rifampicin). I overensstemmelse hermed har nogle forskere fundet, at præ-inkubering i 4 timer i Preston bouillon uden selektivt supplement kan forbedre påvisning af campylobacter i vand, som kun indeholder få andre mikroorganismer. Bolton bouillon indeholder ingen af de antibiotika, som er kendt for at være toksisk for campylobacter. BEMÆRK Nogle af de termotolerante campylobacter vil uddø eller vokse for langsomt, hvis inkubations-temperaturen ligger under 36 °C. 8.4 Udstrygning på fast, selektivt substratTag flasker med opformering forsigtigt op af beholderne efter inkubering for at undgå at hvirvle bundfald med baggrundsflora op. BEMÆRK Hvis der forventes et stort antal campylobacter, kan der udstryges allerede efter (21 ± 3) timer. Der skal dog i alle tilfælde udstryges efter endt opformering (8.3). Overfør med et sterilt podeøje ca. 10 µl podekultur til overfladen af mCCDA plader (C.2). Udtag podekulturen lige under overfladen af opformeringsbouillonen og udstryg på pladens overflade. Sæt straks efter podning pladerne i beholdere (5.4), med modificeret atmosfære (5.4) ved (41,5 1) °C i (44 4) timer. BEMÆRK Pladerne viser oftest synlig vækst efter (21 ± 3) timers inkubering. Negative plader skal inkuberes yderligere 24 timer i modificeret atmosfære (5.4). BEMÆRK Der er beskrevet teknikker, der udnytter campylobacters store bevægelighed til at befri dem for ledsageflora. En eller flere dråber prøvemateriale anbringes på et 0,45 µm eller 0,65 µm cellulose acetat membranfilter, der er placeret på et fast, nonselektivt substrat (f.eks. basalsubstratet til mCCDA (C.2.1)). Pladen med filter inkuberes ved 37 °C i 0,5 til 24 timer i modificeret atmosfære. Efter at filteret er fjernet, inkuberes substratet i (21 ± 3) timer, således at campylobacter, der har arbejdet sig gennem filteret ned til substratet, danner synlige kolonier. I stedet for prøvemateriale kan der anvendes koncentrat fra centrifugering (5 000 g i 10 minutter) af opformeringer. 8.5 AflæsningAflæs pladerne (8.4) for synlig vækst efter inkubering. Campylobacter danner efter 24 – 48 timers vækst oftest ret små, flade eller konvekse kolonier med skinnende overflade. Kolonierne har en tendens til at sprede sig langs udstrygningslinierne. Veladskilte kolonier minder om små væskedråber. På fugtige plader kan der i stedet ses en tynd film. Skrab i tvivlstilfælde materiale fra pladernes overflade til undersøgelse for typisk udseende (8.6.1), eller fortsæt inkuberingen i endnu et døgn. Kolonimateriale af campylobacter har på podeøjet typisk en flødefarvet til lysebrun farve. Efter fortsat inkubering ændres campylobacter kolonierne til lavt konvekse med et mat skær. Ofte udvikles der tillige metalskær. Koloniernes farve varierer fra farveløs til grålig eller hvidlig. 8.6 Bekræftelse8.6.1 Vækst på non-selektive agar pladerHusk under de efterfølgende undersøgelser, at campylobacter hurtigt kan skades ved udsættelse for lys og luft. Subkultiver campylobacter-lignende kolonier fra mCCDA på overfladen af to næringsrige, non-selektive agarplader (basalsubstratet til mCCDA (C.2.1), nutrient agar med eller uden tilsætning af 5 % blod (C.1.1.4), Mueller-Hinton agar eller anden non-selektiv agar, der er fundet velegnet til at understøtte campylobacters vækst). Den ene af pladerne inkuberes aerobt, den anden i modificeret atmosfære (5.4) ved (41,5 1) °C i (21 3) timer. Campylobacter vokser ikke aerobt. Bekræft tilstedeværelsen af campylobacter i kolonier fra pladen inkuberet i modificeret atmosfære ved fasekontrast mikroskopi (8.6.2). Hvis der ses typiske campylobacter (8.6.2), kan resultatet rapporteres, jævnfør afsnit 10. I tvivlstilfælde fortsættes med de supplerende undersøgelser beskrevet i bilag D. 8.6.2 Bevægelighed og cellemorfologiOpslem kolonimateriale i en næringsrig bouillon som Preston basalsubstrat (C.1.1.1) på et objektglas. Læg et dækglas over og mikroskoper straks under anvendelse af fasekontrast og 1 000 ganges forstørrelse. Campylobacter er stærkt bevægelige, slanke, spiralformede stave. Bevægelserne kan både være pileagtigt hurtige og proptrækkeragtigt roterende. Campylobacter kan gøres ubevægelige ved at opslemme dem i vand i stedet for Preston basalsubstrat. Herved kan deres typiske udseende ofte bedre iagttages. BEMÆRK Alternativt til fasekontrast mikroskopi kan campylobacters cellemorfologi iagttages ved mørkefeltmikroskopi eller efter farvning med 2 % carbolfuchsin i 5 minutter. Gram-farvning af campylobacter giver ofte et utilfredsstillende resultat. 8.7 VerifikationHvis der ønskes yderligere verifikation, sendes isolater til et laboratorium med erfaring i artsbestemmelse og i typebestemmelse ved hjælp af fænotypiske metoder eller molekylære metoder. Da campylobacter let dør ud under skadelige påvirkninger, er det vigtigt ved forsendelser at følge de instruktioner, der kan gives fra det erfarne laboratorium. 9 KvalitetssikringLaboratoriet skal have et velfungerende kvalitetssikringssystem således at det til stadighed kan dokumenteres, at apparatur, substrater, reagenser og fremgangsmåde er optimale for undersøgelsen. Brugen af positive kontrolstammer er en del at dette system. Campylobacter jejuni ATCC 35 918 eller ATCC 35 919 og Campylobacter coli ATCC 33 559 eller 43 133 er egnede som positive kontrolstammer i denne metode. 10 Angivelse af resultaterHvis tilstedeværelsen af typiske campylobacter er bekræftet (8.6), er prøven fundet positiv for termotolerante campylobacter. Termotolerante campylobacter er påvist i et givet testvolumen, hvad enten der påvises campylobacter i den ene eller begge selektive opformeringer fra dette testvolumen. Ud fra resultatet af undersøgelser af forskellige volumina af prøvemateriale, rapporteres et semikvantitativt estimat af prøvens indhold af termotolerante campylobacter, jævnfør bilag B. 11 AnalyserapportAnalyserapporten skal indeholde følgende oplysninger:
Bilag A(informativt)Flow diagram over metodenPrøvevolumina på 2*10 ml, 2*100 ml og 2*1 000 ml Filtrering gennem 0,45 µm filtre
Opformering i 48 timer ved 37 °C fra de seks filtre i hver sin bouillon Overførsel af opformering fra hver flaske til hver sin plade med mCCDA.
Inkubering i modificeret atmosfære i 48 timer ved 41,5 °C Isolation på nonselektivt substrat. Kontrol af, at der ikke ses vækst i atmosfærisk luft.
Undersøgelse af bevægelse og cellemorfologi
Yderligere identifikation og/eller karakterisering, hvis nødvendigt Rapportering af det semikvantitative resultat Bilag B(normativt)PrøvestørrelseDe relevante prøvemængder at undersøge afhænger af det forventede antal campylobacter i vandet. DrikkevandAf drikkevand undersøges følgende mængder: 10 ml, 100 ml and 1 000 ml. Alle tre mængder filtreres dobbelt, således at der er filtre til tre opformeringer i Preston bouillon og tre i Bolton bouillon. I alt 2,22 liter prøvemateriale fordelt på 6 filtreringer. Forudsat at de mindste prøvemængder filtreres først, kan alle filtreringer udføres med samme tragt. Resultatet af drikkevandsanalysen angives pr. 1 000 ml prøve efter nedenstående retningslinier: Tabel 1. Antal campylobacter i 1 000 ml prøve ved de angivne kombinationer af positive resultater.
†: cfu = colony forming units (formeringsdygtige campylobacter) *: Afhængigt af antallet af campylobacter i prøven kan der være op til 10 % sandsynlighed for ved rene tilfældigheder at få et sådant atypisk resultat. **: Dette resultat kan forekomme, når campylobacter i de største prøvemængder hæmmes af et stort antal andre bakterier i prøven. Atypiske kombinationer bør altid foranledige en gennemgang af analysens trin for mulige fejlkilder. Er der udført artsbestemmelse og/eller typebestemmelse(8.7), kan resultaterne angives for en specifik art og/eller type. Ved undersøgelser i forbindelse med udbrud af campylobacter infektioner skal mange kolonier undersøges. SpildevandSpildevand kan undersøges uden membranfiltrering. Følgende prøvemængder undersøges i hver sin 100 ml portion af begge opformeringsbouilloner: 10 ml, 1 ml, 0,1 ml og 0,01 ml. I alt undersøges således 22,22 ml prøve. Resultatet af spildevandsanalysen angives pr. 100 ml prøve efter nedenstående retningslinier: Tabel 2. Antal campylobacter i 100 ml prøve ved de angivne kombinationer af positive resultater.
†: cfu = colony forming units (formeringsdygtige campylobacter) *: Afhængigt af antallet af campylobacter i prøven kan der være op til 10 % sandsynlighed for ved rene tilfældigheder at få et sådant atypisk resultat. **: Dette resultat kan forekomme, når campylobacter i de største prøvemængder hæmmes af et stort antal andre bakterier i prøven. Atypiske kombinationer bør altid foranledige en gennemgang af analysens trin for mulige fejlkilder. Er der udført artsbestemmelse og/eller typebestemmelse(8.7), kan resultaterne angives for en specifik art og/eller type. Ved undersøgelser i forbindelse med udbrud af campylobacter infektioner skal mange kolonier undersøges. Bilag C(normativt)Substrater og reagenserC.1 OpformeringsbouillonerC.1.1 Preston BouillonSammensætning:
1 F.eks. Lab-Lemco kødekstrakt (OXOID), som er et handelsnavn. Oplysningen gives til hjælp for brugere af denne standard. Der er ikke tale om nogen anbefaling af produktet. BEMÆRK Amphotericin B indgår i stedet for cycloheximid B.1.1.1 Preston grundsubstrat
1 F.eks. Lab-Lemco kødekstrakt (OXOID), som er et handelsnavn. Oplysningen gives til hjælp for brugere af denne standard. Der er ikke tale om nogen anbefaling af produktet. Opslem i vand. Fordel som 94 ml portioner i flasker (5.6) med skruelåg. Tag højde for fordampningstab under autoklaveringen. Sterilisér i autoklave ved (121 ± 3) °C i (15 ± 1) minutter. Åbn autoklaven straks efter den er afkølet til en sikker temperatur (f.eks. 70 °C), og drej lågene til for at undgå optagelse af ilt i substratet. Efter sterilisering skal pH være 7,4 ± 0,2 ved 25 °C. Beskyttet mod luft og lys er substratet holdbart i 3 uger ved (5 ± 3) °C. C.1.1.2 Opløsning af Preston Campylobacter Selektivt SupplementEn opløsning indeholdende pr. ml:
C.1.1.3 Opløsning af Preston Campylobacter Vækst SupplementEn opløsning indeholdende pr. ml:
C.1.1.4 Fremstilling af lyseret blodBrug defibrineret eller citratstabiliseret blod fra okse, får eller hest. Blodet kan opbevares 1 måned ved (5 ± 3) °C, forudsat det ikke viser tegn på ændringer. Blodet lyseres ved frysning ved (-20 ± 5) °C natten over. Portioner af lyseret blod kan opbevares nogle få dage ved (5 ± 3) °C, forudsat det beskyttes mod iltning. B.1.1.5 Fremstilling af komplet Preston bouillonGrundsubstrat og supplementer blandes umiddelbart før podning af bouillonen. Vækstsupplementet (C.1.1.3) og det lyserede blod (C.1.1.4) tilsættes sidst. Efter tilsætning skrues låget tæt til for at undgå iltning og indholdet blandes forsigtigt. Preston bouillon fremstilles af følgende ingredienser:
C.1.2 Bolton BouillonSammensætning:
BEMÆRK Amphotericin B indgår i stedet for cycloheximid C.1.2.1 Bolton grundsubstrat
Opløs i vand. Fordel som 95 ml portioner i flasker (5.6) med skruelåg. Tag højde for fordampningstab under autoklaveringen. Sterilisér i autoklave ved (121 ± 3) °C i (15 1) minutter. Åbn autoklaven straks efter at den er afkølet til en sikker temperatur (f.eks. 70 °C) og drej lågene til for at undgå optagelse af ilt i substratet. Efter sterilisering skal pH være 7,4 ± 0,2 ved 25 °C. Beskyttet mod luft og lys er substratet holdbart i 3 uger ved (5 ± 3) °C. B.2.2.2 Opløsning af Bolton Selektivt SupplementEn opløsning indeholdende pr. ml:
C.1.2.3 Fremstilling af brugsklar Bolton bouillonGrundsubstrat og supplementer blandes umiddelbart før podning af bouillonen. Det lyserede blod (C.1.1.4) tilsættes sidst. Efter tilsætning skrues låget tæt til og indholdet blandes forsigtigt, for at undgå iltning. Bolton bouillon fremstilles af følgende ingredienser:
C.2 Modified Charcoal Cephoperazone Desoxycholate Agar (mCCDA)Sammensætning:
2 F.eks. Lab-Lemco kødekstrakt (OXOID), som er et handelsnavn. Oplysningen gives til hjælp for brugere af denne standard. Der er ikke tale om nogen anbefaling af produktet. BEMÆRK Amphotericin B indgår i stedet for cycloheximid C.2.1 mCCDA Grundsubstrat
2 F.eks. Lab-Lemco kødekstrakt (OXOID), som er et handelsnavn. Oplysningen gives til hjælp for brugere af denne standard. Der er ikke tale om nogen anbefaling af produktet. Opslem vand og opvarm til kogning. Sterilisér i autoklave ved (121 ± 3) °C i (15 ± 1) minutter. Efter sterilisation skal pH ved 25 °C være 7,4 ± 0,2 Grundsubstratet er holdbart i op til 3 måneder, hvis det opbevares mørkt og beskyttet mod luftens ilt ved (5 ± 3) °C. C.2.2 mCCDA Selektivt SupplementEn opløsning indeholdende pr. ml:
C.2.3 Fremstilling af brugsklar mCCDAAfkøl smeltet mCCDA Grundsubstrat (C.2.1) til (50 ± 5) °C. Tilsæt aseptisk mCCDA selektivt supplement (C.2.2). Bland omhyggeligt og ophæld den brugsklare agar i sterile petri skåle (5.7). Brug 4 ml mCCDA Selektivt Supplement til 1 000 ml mCCDA Grundsubstrat. Ophældte mCCDA plader kan i ilttæt indpakning opbevares mørkt i en uge ved (5 ± 3) °C. Umiddelbart før brug skal pladerne tørre i få minutter for at undgå problemer med kondensvand. Bilag D(informativt)Supplerende tests til karakterisering af isolaterD.1 Oxidase testD.1.1 FremgangsmådeUdfør testen med frisk kolonimateriale fra den non-selektive plade (8.6) og oxidase reagens (D.1.1). Sammenlign reaktionen med positive og negative kontrolstammers reaktion. Campylobacter er oxidase-positive, men reaktionen kan være forsinket. D.1.2 Oxidase reagensKommercielt tilgængelige oxidase strips kan benyttes til oxidase test. Alternativt bruges en 1 % opløsning i vand af N,N-dimethyl-1,4-phenylen diamin dihydroklorid eller af tetramethyl-p-phenylen diamin dihydroklorid. Disse opløsninger skal være friskt fremstillede, eller opbevaret koldt i kort tid. Kasser farvede opløsninger. D.2 Katalase testD.2.1 FremgangsmådeUdfør testen med frisk kolonimateriale fra den non-selektive plade (8.6) og katalase reagens (D.2.1). Sammenlign reaktionen med positive og negative kontrolstammers reaktion. Campylobacter er katalase-positive. (C. upsaliensis angives at være katalase-negativ eller svagt positiv). BEMÆRK Blodet i blodagar kan give en falsk positiv katalase reaktion, hvis noget af agaren skrabes med på podenålen med kolonimateriale. D.2.2 Katalase reagensBrug en 2 % eller 3 % opløsning af brintperoxyd, H2O2 til katalase test. D.3 Gram typeD.3.1 FremgangsmådeUdfør testen med frisk kolonimateriale fra den non-selektive plade (8.6) og kaliumhydroxyd-opløsning (D.3.1). Campylobacter er gram-negative, d.v.s. trådtrækkende med 3 % kaliumhydroxyd-opløsning. D.3.1 Kaliumhydroxyd opløsningBrug en 3 % opløsning af Kaliumhydroxyd, KOH til at bestemme bakteriers Gramtype. Footnotes [1] Under udarbejdelse [2] Under udarbejdelse
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||