|
Toksiske effekter af pulseksponering af pesticider - akutte og kroniske effekter hos Daphnia magna Bilag 1 Testprotokol - Toksiske effekter af pulseksponering for pesticider - akutte og kroniske effekter hos Daphnia magna
Tina Slothuus, Signe Qualmann og Anders Baun Institut for Miljø & Ressourcer Danmarks Tekniske Universitet Kgs. Lyngby Juni 2005
ForordProtokollen beskriver fremgangsmåderne anvendt til bestemmelse af toksiske effekter af pulseksponeringer for pesticider. Metoderne er inddelt i 1) Kontinuerte eksponeringer, hvor der ses på akutte effekter af eksponeringer for et pesticid, i form af immobilisering og død. Testen udføres efter principperne beskrevet i ISO-6341 (1989a) og ISO-8692 (1989b). 2) Pulstest til bestemmelse af immobilisering efter en kortvarig eksponering (0,5-6t) for et pesticid samt 3) Reproduktionstest til bestemmelse af kroniske effekter efter eksponeringen for en puls af et pesticid. Testen udføres som en modificeret udgave af OECD Guideline nr 211 (1996). 1 ForsøgsorganismerSom forsøgsorganisme benyttes Daphnia magna, indsamlet i Langedammen ved Birkerød i 1978 og dyrket i laboratoriet siden. De dafnier, der anvendes i forsøgene, er <24 timer gamle. Dette sikres ved at oprense mediet senest 24 timer inden, forsøgene sættes i gang og fjerne alle organismer på nær moderdyrene (ISO, 1989a). 1.1 KulturholdDafniestamkulturen dyrkes i klimarum ved en temperatur på 20°C ± 2°C og en 12/12 timers lys/mørke periode (4,84-5,62 μEl*m-2*s-1). Kulturerne holdes i akvarieglas (18x13x18 cm) eller 1 liters bægerglas. Akvarierne fyldes med 1,6 l M7-medie (se afsnit 1.2), og bægerglassene fyldes med 800 ml M7 medie. Der anvendes højst 30 dyr pr. akvarie og højst 20 dyr til bægerglassene. Hvis der tilsættes flere dyr, kan konkurrencen mellem dyrene blive for stor, og produktionen af unger mindskes. Akvarieglassene overdækkes med plexiglas og bægerglas dækkes med urglas. Kulturerne holdes ca. 2 måneder inden de skiftes ud, for at holde produktionen af unger optimal. Dyrene får rent medie 2 gange ugentligt med 2-3 dages mellemrum. Når mediet skal skiftes hældes indholdet fra akvarierne, d.v.s medie og dafnier, over i en plastikbakke. Akvarierne skylles herefter i destilleret vand, så algerester fjernes fra siderne. 800 ml (400 ml for bægerglassene) rent M7 medie fyldes derefter op i de rene akvarier. Mediet med dafnierne filtreres herefter gennem et nylonfilter og 800 ml (400 ml for bægerglassene) af opløsningen hældes ligeledes over i akvarierne. Det nye medie består således af nyfremstillet M7 medie og ”gammelt” M7 medie i forholdet 1:1. Moderdyrene overføres til det nye medie med et nylonnet. Dafnierne får føde i form af grønalgen Pseudokirchneriella subcapitata (dyrkning m.v. beskrevet i afsnit 1.3), der tilføres akvarierne v.h.a. et pumpesystem 3 gange dagligt. Mængden af føde, der tilføres, skal svare til 1-2 mg C /10 dyr i.flg. OECD standarden (OECD, 1996). Hvis det vurderes at være nødvendigt, d.v.s. hvis der ikke produceres tilstrækkeligt med unger, kan der tilsættes en smule tørgær som ekstra foder. Tørgæret (nogle få korn) opløses i en smule M7-medie, inden det kommes i akvariet. 1.2 Fremstilling af M7-medieDet anvendte medium er kunstigt fremstillet ferskvand, såkaldt M7 medie fremstillet efter nedenstående forskrift (Tabel 1 og Tabel 2). De anvendte kemikalieopløsninger, blev fremstillet ved at afveje de angivne stofmængder, overføre disse til en 1-liters målekolbe og tilsætte Milli-Q vand til 1l-mærket. Til fremstillingen af M7 mediet blev der efterfølgende med en pipette udtaget de i Tabel 1 angivne volumener af stamopløsninger. Mediet blev ligeledes fremstillet med Milli-Q vand. Tabel 1: Kemikalier brugt til fremstilling af M7 medie
*Kemikalierne opløses i Milli-Q-vand **Vitaminerne skal opbevares koldt og tilsættes kort tid før anvendelse. Tabel 2. Fremstilling af stamopløsning II (M²)
*Kemikalierne opløses i Milli-Q-vand 1.3 Fremstilling af alge-medieVed dyrkning af alger til foder, overføres ca. 100 ml algesuspension (celletæthed: 4,7-6,1 ·106 celler/ml) til 5 liter nyt fremstillet algemedie fremstillet efter opskriften i tabel 3. Mediet skal have en temperatur på 20°C og pH 8,0 ± 0,2. Kulturen sættes på en magnetomrører, gennembobles med atmosfærisk luft, der først passerer et sterilfilter, inden det bobles gennem mediet, og dyrkes under konstant belysning (38 μEl*m-2*s-1) i 2-3 døgn, indtil algesuspension har en celletæthed på 4,7-6,1 ·106 celler/ml, hvilket afspejles i en mørk, grøn farve. Algekulturen opbevares mørkt ved en temperatur på 4°C, indtil den skal anvendes til foder. Flasken omrystes før brug, da algen bundfælder under opbevaringen. Det er ikke nødvendigt at vente til algesuspensionen opnår en temperatur på 20°C, inden den overføres til det nye algemedie. Algen bruges løbende, men vi vurderer, at den vil kunne holde sig mindst 2-3 uger i kølerum. Fodringen af dafnierne med et koncentreret medie betyder, at der ikke kommer for megen algemedie over i dafniekulturerne. Celletætheden måles på Coulter Counter Multisizer, og kulturens renhed undersøges ved mikroskopering hver 3. uge. Tabel 3: Fremstilling af algemedie
*Autoklaveres i 15 minutter ved 121ºC 2 Apparatur og materialer
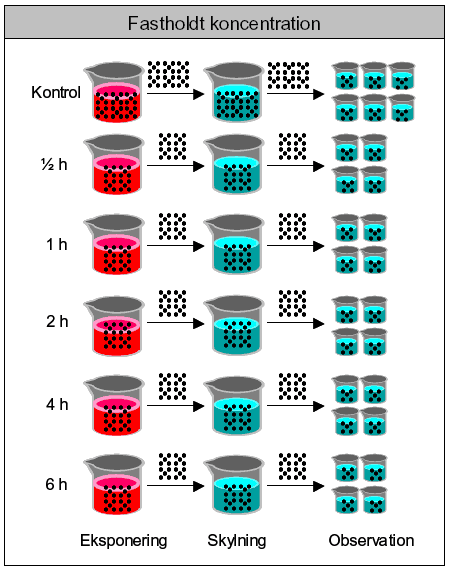
3 Validitietskrav-referencetestStandard ISO testen for immobilisering (ISO, 1989a) udføres med kaliumdikromat (K2Cr2O7) som referencestof. I følge standarden skal IC50,24t ligge i intervallet 0,9-2,4 mg/l. I flg. ISO (1989a) kræves en iltmængde på ≥ 2 mg/l og en pH på 7,8 ± 0,2. Da M7 mediet ikke har en saltsammensætning, der stemmer 100% overens med ISO standarden, kan afvigelser i pH-værdien forventes, værdien bør dog ikke variere mere en 1,5 enhed. 4 Akut toksicitetstest - immobiliseringAlle akutte tests udføres i henhold til ISO(1989a). Der anvendes 4 replikater pr. koncentration og 6 replikater i kontrolgruppen. Hver replikat består af 25 ml testopløsning (M7 tilsat teststof/pesticid) og 5 juvenile Daphnia magna (<24 t). Testen udføres i bægerglas (100 ml), som dækkes med urglas, for at forhindre støv og andre partikler i at komme ned i glassene. Testen forløber i mørke og dyrene eksponeres kontinuert i 48 timer. Der skiftes ikke opløsning i løbet af de 48 timer. Under eksponeringen får dyrene ikke tilført føde i form af alger, da alger i opløsningen kan påvirke den stofmængde, der er tilgængelig til eksponeringen af dyrene. Testen varer kun 48 timer, da immobilisering ellers kan indtræffe p.g.a. fødemangel og ikke nødvendigvis p.g.a. kemikaliet, der testes. Der kontrolleres for immobilisering og dødelighed efter 0, 2, 4, 6, 24 og 48 timers eksponering. Testen er udvidet m.h.t. antallet af aflæsningstider, da disse vil være nyttige, når der skal udføres pulstests. Afvigelser fra ”normal” noteres ligeledes. Definitioner: Immobilitet: Dafnier, som ikke kan opretholde deres position i vandsøjlen (svømme) selv efter en forsigtig stimulering (15 sek.), regnes for immobile. Dafnierne kan have krampeagtige bevægelser. Døde dafnier vil indgå i det samlede antal immobile dafnier, men der skelnes mellem døde og immobile dyr ved observationerne. Dødelighed: Dafnier, der ikke har nogen form for bevægelse, som f.eks. bevægelse af antenner, selv 15 sekunder efter stimuli, regnes for døde (Naddy et al., 2000, OECD Guideline, 1996). I praksis blev dette overført til, at mobile dyr skal svømme i løbet af de 15 sekunder de observeres men ikke nødvendigvis i alle de 15 sekunder. Dette skyldes, at der ofte blev observeret dafnier, der ikke svømmede i en kort tidsperiode (opholdt sig typisk i bunden af glassene) for så pludselig at svømme livligt rundt. Resultaterne bruges til beregning af IC50, 24t og IC50, 48t. 5 Pulseksponering - ImmobiliseringProceduren for pulseksponering er illustreret i Figur 1. Dyrene eksponeres i grupper af 20 individer. Efter endt eksponering indfanges dyrene og overføres til et skyllekar og videre til observationsglas. Dette gøres v.h.a. en engangspipette af plast, som dyrene suges op i. Den overskydende væske sprøjtes derefter forsigtigt ud, indtil dyrene er ved åbningen af pipettespidsen. Herefter overføres dyrene til mediet i skyllekarret. Ved desuden at skifte mediet i skyllekarret hver gang en ny gruppe af dyr overføres, minimeres mængden af pesticid, der kommer over i de endelige observationsglas. Dyrene indfanges i skyllekarret v.h.a. et fintmasket net, hvorfra overskydende væske fjernes ved at lægge det imod en papirsserviet. Herefter fordeles dyrene i 4 grupper pr. eksponeringstid. Hver replikat består således af 5 juvenile Daphnia magna (<24t) (se Tabel 4). Tabel 4: Pulseksponering af Daphnia magna ved fastholdt teststofkoncentration.
Ved hvert forsøg anvendes 5 forskellige eksponeringstider (se Tabel 4) og 2-3 koncentrationer af teststoffet. Eksponeringskoncentrationerne udvælges på baggrund af gennemførte ISO-test for immobilisering, ved at beregne den koncentration, der vil have en effekt på 90% af dyrene, en såkaldt IC90,24t-værdi. Denne værdi er valgt ud fra den antagelse, at dyrene skal udsættes for en højere koncentration under pulstestene end under den kontinuerte eksponering under akuttestene, hvis der skal ses en effekt, da pulstestene er af meget kortere varighed (maks. 6 timer) sammenlignet med akuttestene. Ligeledes er der taget hensyn til dyrenes reaktion overfor pesticidet efter 6 timers eksponering under akuttestene- hvilket vil svare til en 6 timers puls. På baggrund af dette kan koncentrationen sænkes/øges yderligere. Der anvendes en kontrolgruppe bestående af 30 dyr, som fordeles i 6 replikater. Kontrolgruppen håndteres på tilsvarende måde som gruppen, der får en puls af 0,5 time, da det forventes, at der vil være en større stressfaktor hvis dyrene i kontrolgruppen håndteres gentagende gange i korte tidsintervaller. Antallet af immobile og døde dyr registreres 0 timer, 24 timer og 48 timer efter pulsens ophør. I posteksponeringsperioden får dyrene føde i form af algen Pseudokirchneriella subcapitata . Dyrene får en føde mængde svarende til 0,1-0,2 mg C/dag (C = carbon). Føden tilføres umiddelbart efter overførslen af dyrene til rent vand. Resultaterne bruges til beregning af PEt-IT50-værdier (Post Exposure Inhibition Time 50). Værdierne angiver den pulsvarighed, der kræves for at 50% af dyrene er immobile til tiden t (i dette tilfælde t= 0, 24 og 48 timer).
Figur 1: Pulseksponering af dafnier - akutte effekter. 5.1 Beregning af tilsætning af algemængde under postobservationsperiodenTælletal: V (målt på en koncentreret algeopløsning på Culter Counter) Fortyndingsfaktor: x Celler pr. ml algeopløsning er derfor V*x = W celler/ml (NB! Der skal tages højde for den volumen der er målt på. Er der f.eks. målt på 0,5 ml skal der ganges med 2 osv.) Algen Pseudokirchneriella subcapitata har ca. 1*10-8 mg C pr. celle (Halling-Sørensen et al., 1996). Ved at multiplicere de to værdier fås algekoncentrationen i mg C/ml og fodervoluminen kan beregnes: (W celler/ml) * (1*10-8 mg C/ celle) = X mg C/ml OECD sætter mængden af carbon (C), der skal være tilgængelig for hver dafnie pr. dag, til 0,1-0,2 mg C. Der skal derfor tilsættes mellem Y og Z ml/dafnie/dag (0,1 mg C/dag / X mg C/ml ) = Y ml/dag (0,2 mg C/dag / X mg C/ml ) = Z ml/dag EksempelTælletal: 30369 (målt på en koncentreret algeopløsning på Culter Counter) Fortyndingsfaktor: 200 Volumen: 0,5 ml Celler pr. ml algeopløsning er derfor 30369*200*2= 1,2*107 celler/ml D.v.s. (1,2*107 celler/ml) * (1*10^-8 mg C/ celle) = 0,12 mg C/ml Der skal derfor tilsættes 0,83-1,67 ml/dafnie/dag da (0,1mg C/dag / 0,12 mg C/ml ) = 0,83 ml/dag (0,2 mg C/dag / 0,12 mg C/ml ) = 1,67 ml/dag 6 Kronisk toksicitet – ReproduktionAnbefalingerne i OECD (1996) er blevet fulgt, d.v.s. kravet om max. 20 % døde moderdyr blandt de eksponerede dyr, kravet om min. 60 unger pr. moderdyr i kontrolgruppen, en pH-værdi mellem 6 og 9 og som ikke varierer mere end 1,5 enheder, og et O2-niveau over 3 mg/l. Desuden er der lavet visse modifikationer, da OECD guiden er designet som en forlænget akuttest, hvor dyrene går i en fast stofkoncentration. I modsætning hertil er pulstesten for kroniske effekter udført således, at dyrene eksponeres for teststoffet i en given tidsperiode, hvorefter de igen kommer over i rent medie. Kravet om 10 testdyr pr. koncentration er overført til 10 testdyr pr. eksponeringstid ved fastholdt eksponeringskoncentration. De 10 dyr eksponeres i en fælles beholder. Gruppen af dyr, der skal have en puls af 6 timers varighed, eksponeres som den første og 2 timer senere eksponeres gruppen, der skal have en puls af 4 timers varighed o.s.v., indtil alle grupper er blevet eksponeret (på denne måde afsluttes alle grupperne på samme tid efter 21 dage). Dernæst indsamles dyrene v.h.a. en pipette og overføres til et kar med rent M7 medie, der fungerer som skyllekar. Så meget som muligt af den overskydende væske i pipetten fjernes, inden dyrene overføres til karret. Fra skyllekarene overføres dyrene til et observationsglas ved at indfange dem med et fintmasket net, hvorfra vandet kan dryppe af eller nettet duppes mod en papirsserviet. Herved minimeres risikoen for kontaminering af rentvandsglassene, der fungerer som observationglas. I posteksponeringsperioden går dyrene enkeltvis i 100 ml bægerglas. Dyrene, der indgår i kontrolgrupperne, eksponeres for rent M7 medie på samme måde som dyrene, der eksponeres for et kemikalie. D.v.s. de bliver også overført til et nyt medie og ”skyllet”. På denne måde sikres det, at variationer ikke skyldes forskelle i håndteringen af organismerne (jf. anbefalinger af Naddy & Klaine, 2001). Reproduktionen hos Daphnia magna følges efter en pulseksponering (0,5t, 1t; 2t; 4t; og 6t ) og 21 dage frem. I posteksponeringsperioden frem til de 21 dage får dyrene føde tilsat i form af algekulturen Pseudokirchneriella subcapitata. Mængden af føde svarer til ca 0,1-0,2 mg C/ dag (0,1 mg C den første uge siden 0,2 mg C). Dyrene går ved 20 °C ± 2°C og en 12/12 timers lys/mørke periode (4,84-5,62 μEl*m-2*s-1). Der måles ilt og pH ved hvert medieskift. I OECD’s guideline anbefales det, at mediet med kemikalie skiftes tre gange ugentligt for at sikre, at niveauet af kemikalie holdes på et fast niveau (OECD, 1996). Dyrene i pulstesten for kroniske effekter kommer over i et rent medie uden kemikalie efter få timer, og mediet skiftes derfor kun to gange ugentligt på samme måde som beskrevet for stamkulturen med moderdyr (se afsnit 1.1.1). Følgende parametre kontrolleres under testene og ved testenes afslutning:
7 ReferencerHalling-Sørensen, B., Nyholm, N. & Baun, A. (1995) Algal Toxicity tests with volatile and hazardous compounds in air tight test flasks with CO2 enriched headspace. Chemosphere, vol. 8, pp. 1513-1525. ISO (1989a). Water quality- Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea). ISO 6341. International Organization for Standardization, Geneva, Switzerland. ISO (1989b). Water quality- Freshwater algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum. ISO 8692. International Organization for Standardization, Geneva, Switzerland Naddy, R. B., Johnson, K. A., Klaine, S. J. (2000). Response of Daphnia magna to pulsed exposures of chlorpyrifos. Evironmental Toxicology and Chemistry, Vol. 19, No 2, pp. 423-431. Naddy, R. B., Klaine, S. J. (2001). Effect of pulse frequency and interval on the toxicity of chlorpyrifos to Daphnia magna. Chemosphere, Vol. 45, pp. 497-506. OECD Guidelines for testing of chemicals (1996). Proposal for updated guideline 211. Daphnia magna Reproduction test. Organization for Economic Cooperation and Development, Paris, France.
|