Afprøvning af elektrokemisk reaktor til rensning af grundvand indeholdende klorerede opløsningsmidler
2 Teori
- 2.1 Klorerede kulbrinter
- 2.2 Elektrokemisk nedbrydning
- 2.3 Sonoelektrokemisk nedbrydning af organiske
stoffer i vand
2.1 Klorerede kulbrinter
Klorerede kulbrinter (klorerede opløsningsmidler) er organiske stoffer opbygget af enten methan, ethan eller ethylen, hvor en eller flere af brintatomerne er erstattet af klorid. Dette projekt har fokuseret på nedbrydningen af triklorethylen (TCE) og tetraklorethylen (PCE), der er nogle af de mest anvendte klorerede kulbrinter og derfor også typisk de stoffer, som findes i forurenet jord og grundvand. I Figur 2.1 er strukturen af disse stoffer samt deres nedbrydningsprodukter vist og i Tabel 2.1 er angivet deres systematiske navne og trivialnavne samt deres bruttoformel og hyppigt anvendte forkortelse. Tabel 2.2 sammenfatter de fysiske og kemiske egenskaber af de klorerede kulbrinter.
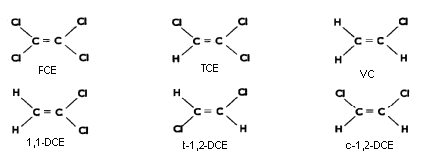
Figur 2.1 Kemisk struktur af klorerede kulbrinter.
Tabel 2.1 Oversigt over udvalgte klorerede kulbrinter med angivelse af deres systematiske navne, hyppigt anvendte forkortelser, bruttoformler og mest almindelige trivialnavne (Fra Broholm 1989).
| Stof | Forkortelse | Bruttoformel | Trivialnavne |
| Tetraklorethylen | PCE | Cl2C=CCl2 | Perklorethylen |
| Triklorethylen | TCE | HClC=CCl2 | |
| Trans-1,2-Diklorethylen | t-1,2-DCE | HClC=CHCl | |
| Cis-1,2-Diklorethylen | c-1,2-DCE | HClC=CHCl | |
| 1,1-Diklorethylen | 1,1-DCE | H2C=CCl2 | Vinyliden-diklorid |
| Klorethylen | VC | H2C=CHCl | Vinylklorid |
Tabel 2.2 Fysiske og kemiske egenskaber for klorerede kulbrinter (Miljøstyrelsen, 1996).
| Stof | Molvægt MW |
Densitet r |
Vandopløselighed CW |
Fordelingskoefficient mellem luft og vand, KH |
| g· mol-1 | kg· l-1 | mg· l-1 | - | |
| Tetraklorethylen | 165,83 | 1,63 | 240 | 0,72 |
| Triklorethylen | 131,39 | 1,47 | 1400 | 0,39 |
| Trans-1,2-Diklorethylen | 96,94 | 1,25 | 6260 | 0,38 |
| Cis-1,2-Diklorethylen | 96,94 | 1,27 | 3500 | 0,17 |
| 1,1-Diklorethylen | 96,94 | 1,22 | 3344 | 1,1 |
| Klorethylen | 62,5 | 0,92 | 2763 | 1,1 |
De klorerede kulbrinter er tidligere bl.a. blevet anvendt til affedtning på fabrikker, til rensning af tøj på renserier, i malings- og lakfjernere, på garverier, som kølemiddel og til industriel fremstilling af eksempelvis pesticider (Broholm, 1989). I dag er der fundet mindre farlige stoffer til erstatning af de klorerede kulbrinter i en del af anvendelserne.
Forurening med klorerede kulbrinter vil for det meste begynde med nedsivning af fri fase fra en utæt kloak, utætte rør og samlinger eller fra spild på jordoverfladen ved uhensigtsmæssig spild ved håndtering af tønder el. lign. Da især de tungere klorerede kulbrinter har en lille opløselighed i vand (se
Tabel 2.2), vil opløsningen af den frie fase være langsom, og forureningsmæssigt vil der derfor ofte være tale om lange tidshorisonter. I den umættede zone vil de klorerede kulbrinter endvidere sprede sig til poreluften, da de er flygtige (Miljøstyrelsen, 1996).
Klorerede kulbrinter har et kompliceret spredningsmønster (se bl.a. Broholm, 1989), hvilket betyder, at det efter et spild er meget svært at lokalisere selve den frie fase, og det er derfor vanskeligt at rydde op efter et spild. Til oprensning af den mættede zone findes der ikke ret mange anvendelige afværgeteknikker. Derfor benyttes ”pump and treat” i stort omfang til afværge og kontrol af forureninger med klorerede kulbrinter. Til rensning af det oppumpede vand benyttes for det meste aktivt kul filtrering.
2.2 Elektrokemisk nedbrydning
2.2.1 Generelt om elektrokemisk nedbrydning
Elektrokemisk nedbrydning er en nyudviklet teknik til nedbrydning af organiske forureningskomponenter i forurenet grundvand. Elektrokemisk nedbrydning foregår ved anvendelse af elektroder, hvorimellem der påføres en strøm.
Elektrokemi er populært sagt en proces, hvor det er muligt elektrisk at styre et kemisk reaktionssystem. Ved elektrokemisk nedbrydning anvendes således et elektrolytisk system med direkte udveksling af elektroner mellem de organiske forureningskomponenter og elektroderne. I forbindelse med nedbrydning af organiske forureningskomponenter har den elektrokemiske proces den fordel, at størrelsen af elektronudvekslingen i systemet kan kontrolleres ved at kontrollere den påførte strøm. Dermed er det muligt at styre den kemiske reaktions retning og hastighed. Ved elektrokemisk nedbrydning kan de organiske forureningskomponenter nedbrydes ved både oxidation og reduktion. Yderligere kan nedbrydningen initieres af reaktive radikaler som f.eks. hydroxyl radikaler (HO•) (Bunce et al., 1997). Hvorvidt der dannes radikaler afhænger af størrelsen af den påførte strøm, og da det ikke nødvendigvis er ønskværdigt, at der dannes frie radikaler, er det en fordel at kunne styre størrelsen af den påførte strøm.
Studier med elektrokemisk nedbrydning har vist, at elektrokemiske reaktorer har et stort potentiale for at nedbryde en lang række af organiske forureningskomponenter (bl.a. Torres et al., 2003; Comninellis, 1994). Sammenlignet med nogle af de etablerede oprensningsmetoder som f.eks. aktivt kul har elektrokemisk nedbrydning den fordel, at det er en såkaldt destruktiv teknik, hvor forureningskomponenterne nedbrydes fuldstændig. En yderligere fordel er, at der ikke anvendes nogle kemikalier, og metoden må dermed betegnes som værende miljøvenlig (Rodgers og Bunce, 2001).
Princippet i elektrokemisk nedbrydning er vist på Figur 2.2.
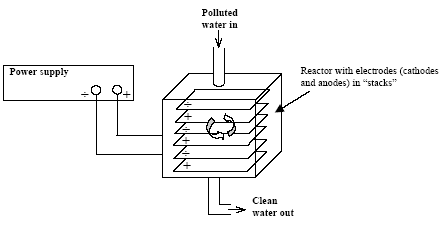
Figur 2.2 Princippet i elektrokemiske reaktorer.
Typen af elektroder, der anvendes i elektrokemiske reaktorer, har stor indflydelse på effektiviteten af den elektrokemiske nedbrydning. Elektroderne kan være lavet af en lang række forskellige materialer som f.eks. Pt, PbO2 eller de såkaldte DSA-elektroder, der består af et tyndt lag (belægning/coatning) af metaller eller metaloxider (Pt, RuO2, IrO2, SnO2, PbO2 etc.) på et basismetal som f.eks. Ti, Zr eller Ta. En nyudviklet type af lovende elektroder er diamantelektroder (Trùster et al., 2002). Diamantelektroder er dog endnu ikke særlig anvendte, hvilket sandsynligvis primært skyldes, at de er meget dyre. Generelt er DSA-elektroder som f.eks. Ti belagt med Pt kendt for at være nogle af de mest effektive elektroder og for at have en lang levetid (bl.a. Bunce et al, 1997). I den elektrokemiske reaktor, der er anvendt i nærværende projekt, er der anvendt Pt-belagte Ti-elektroder.
Udover typen af elektroder er den elektrokemiske nedbrydning styret af stofoverførslen til elektrodeoverfladerne. Reaktionshastigheden er således begrænset af diffusionen af de organiske stoffer fra vandfasen ind til elektrodeoverfladen gennem det såkaldte diffusionslag, der ofte er omkring 0,1 mm tykt (Atkins, 1987). En høj reaktionshastighed kræver derfor et tyndt diffusionslag. Det betyder, at det er meget vigtigt at sikre et minimalt grænselag på elektroderne under drift. Et andet aspekt, der kan have stor indflydelse på stofoverførslen til elektrodeoverfladerne, er renhedsgraden af elektroderne, som vil mindskes betydeligt, hvis der sker udfældninger på elektroderne under drift.
Diffusionsbegrænsning og udfældninger på elektroderne er kendt for at være nogle af de største problemer ved elektrokemiske behandlingsmetoder (Rodgers og Bunce, 2001). I kalkholdigt vand, som meget af det danske grundvand, kan kalkudfældninger på elektroderne være et stort problem. Kalkudfældningerne sker som følge af den dannelse af OH- og dermed pH-stigning, der sker i forbindelse med redox-reaktionerne. Dannelsen af OH- og den resulterende pH-stigning vil ske ved katoden, hvor der er forbrug af elektroner og dermed reducerende forhold (Ox1 + ne- Red1). Udfældninger vil reducere den tilgængelige elektrodeoverflade og dermed omsætningshastigheden. Hvis strømmen vendes med passende intervaller (såkaldt skiftende jævnstrøm), er det stort set muligt at undgå udfældninger på elektroderne (Se Lehmann et al., 2002).
Strømforløbet i hver puls (intervallet mellem vending af strømmen) kan følges ved måling af potentialet. På Figur 2.3 er vist et eksempel på en potentialekurve, der er opnået under et driftforsøg med en pulslængde på 7 minutter. Af figuren fremgår det, at potentialekurven for hver puls kan opdeles i 3 perioder. I den første periode sker der udelukkende en opbygning af potentialet. Den anden periode er en kombination af potentialeopbygning og redox-processer, mens der i den tredje periode udelukkende sker redox-processer. Indikationer af at redox-processerne er i gang, er gasproduktion (primært dannelse af H2 og O2) som følge af vandspaltning og aftagning i potentialekurvens stejlhed efter polarisationsskift. For at formindske antallet af perioder med potentialeopbygning er det vigtigt at have en så lang pulslængde som mulig, da øget pulslængde betyder øget tid til at redox-processerne kan foregå. Det er dog samtidig vigtigt at holde pulslængden nede på et niveau, hvor kalkudfældninger på elektroderne undgås.
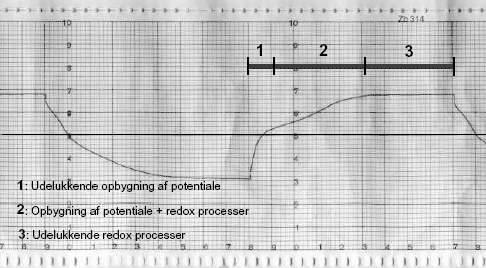
Figur 2.3 Potentialekurve opnået under driftsforsøg
2.2.2 Elektrokemisk nedbrydning af klorerede kulbrinter
Der er flere processer, såvel biotiske som abiotiske, under hvilke klorerede kulbrinter kan nedbrydes. Nedbrydningen kan f.eks. foregå som en reduktiv deklorering af stoffer, med følgende dannelse af deklorerede nedbrydningsprodukter, f.eks. DCE (diklorethylen) ved deklorering af TCE. Dette menes at være en mulig nedbrydningsvej ved elektrokemisk nedbrydning, hvor der sker en direkte elektronoverførsel fra elektroden til stoffet, hvorved kloratomet fjernes og erstattes med brint (H+), som stammer fra vandet. Denne mulige nedbrydningsvej er skitseret nedenfor:
![]()
Da der i den elektrokemiske proces hersker oxiderede forhold ved anoden, hvor der afgives elektroner, og reducerede forhold ved katoden, hvor der optages elektroner, kan nedbrydningen af klorerede kulbrinter teoretisk set foregå ved såvel reduktion (se ovenfor) som oxidation. Den mulige nedbrydning ved oxidation er vist nedenfor:
![]()
Generelt er der kun publiceret meget få studier omhandlende anvendelse af elektrokemi i forbindelse med oprensning af forurenet grundvand. Der findes dog et par studier, der dokumenterer elektrokemisk nedbrydning af klorerede kulbrinter (Nielsen og Lehmann, 2002; Sonoyama et al., 2001). I disse undersøgelser blev der opnået rensningsgrader for de undersøgte klorerede kulbrinter på 98-100%.
2.3 Sonoelektrokemisk nedbrydning af organiske stoffer i vand
2.3.1 Generelt om ultralyd
Almindelig hørbar lyd ligger i frekvensområdet 16 Hz til 16 kHz og alt herover op til 10 MHz kaldes ultralyd. Frekvensområdet lige over høregrænsen kaldes ”power-ultralyd” og dette frekvensområde anvendes blandt andet i ultralydsbade og til homogenisering, mens frekvenser nærved og over 1 MHz bliver brugt til medicinsk diagnosticering, scanninger og andre analytiske formål.
Udsættes væsker for ultralyd opstår bølger af under- og overtryk i væsken. Herved dannes små dampfyldte bobler (cavitation bubbles) i ”svage” områder af væsken, det vil sige på fangede gasbobler og partikeloverflader. Boblerne er af størrelsesordenen 10-200 µm og har en levetid på omkring 10 µs. Disse bobler vokser ved hjælp af trykbølgerne i væsken til en kritisk størrelse, hvor de ikke længere kan holde til trykket og kollapser. Ved denne kollaps opstår en jetstrøm af væske ind i boblens indre, hvorved der opstår ekstreme lokale forhold med temperaturer på op til 5000°K og tryk på 1000 atm. Denne effekt udnyttes i ultralydsbade, hvor de kollapsende bobler renser overflader. Boblernes størrelse kan reguleres med frekvensen af den anvendte ultralyd. Ved rensning af porøse emner anvendes højfrekvens ultralyd, der giver små bobler, der kan komme ind i de porøse overflader, mens der ved rengøring af glatte flader anvendes mere lavfrekvent ultralyd, som giver større bobler, der hver især har større effekt (Birkin et al., 2003; Schiffrin, 2003).
Ud over den rensende effekt medfører ultralyd generelt højere diffusionshastigheder i væsker og sandsynligvis tyndere diffusionslag.
2.3.2 Sonoelektrokemi
I forhold til de elektrokemiske reaktioner, vil de kollapsende bobler på elektrodeoverfladerne sandsynligvis medføre følgende:
- diffusionslaget vil nedbringes, hvilket både vil reducere transportbegrænsningen og mindske udfældningerne.
- bobler, der sidder på elektroderne, vil blive frigjorte. Herved øges det aktive elektrodeareal, og hermed reaktionshastigheden.
- elektroderne vil blive rengjorte og forblive rene, og skulle der opstå udfældninger, vil de blive fjernet med det samme.
En yderligere sandsynlig positiv effekt er, at anvendelsen af ultralyd kan lede til deciderede sonokemiske reaktioner især på grund af dannelse af de meget reaktive hydroxylradikaler ved boblernes kollaps. Disse sonokemiske reaktioner vil kunne bidrage til nedbrydningen af organiske forureningskomponenter i væsken.
I forbindelse med elektrokemi anvendes ultralyd rent forskningsmæssigt til at øge reaktionshastigheden. Ved laboratorieopstillinger med små elektroder i flowkamre kan anvendelsen af ultralyd betyde en forøgelse af reaktionshastigheden med op til en faktor 100 (Daasbjerg, 2003).
Version 1.0 Juli 2007, © Miljøstyrelsen.