Basisk Hydrolyse – Indledende Laboratorieforsøg & Forslag til Demonstration i Pilotskala
3 Laboratorieforsøg
Formålet med laboratorieforsøgene var at skaffe et empirisk grundlag for en indledende vurdering af, om en afværgekoncept baseret på processen ”basisk hydrolyse” vil være egnet i forbindelse med oprensning af Høfde 42-depotet.
I de følgende afsnit beskrives og vurderes de udført forsøg. Forsøgene var baseret på en forsøgsbeskrivelse, se Bilag 1. Analyseresultater ses i Bilag 2.
3.1 Opstilling
Til forsøget blev der opstillet 16 stk. 250 ml Erlenmeyer kolber, benævnt flaske 1-12 samt flaske 0A, 0B, 0C og 0D. Til hver flaske blev der tilsat 50 g forurenet jord og 100 ml vand.
Jordprøven stammer fra undersøgelsesboringer udført i januar 2006 på den gamle fabriksgrund, der er forurenet med en række stoffer, der er sammenlignelige med stofferne ved Høfde 42. Tre prøver blev udvalgt på basis af deres forureningsindhold, der sikrede høje koncentrationer samt en alsidig forureningssammensætning. Følgende prøver blev grundigt homogeniseret til én prøve, hvorfra en 50 g delprøve blev udtaget til de enkelte flasker.
B3 31 m u.t.
B4 8 m u.t.
B5 2,5 m u.t.
Det anvendte vand til flaskerne var Milllipore vand tilsat 1.000 mg/l natriumklorid for at efterligne ionstyrken i grundvand fra Høfde 42. For at belyse, hvornår basisk hydrolyse virker bedst, blev følgende forhold undersøgt:
- ingen behandling (kontrol)
- pH hævet til 10 med natronlud (belyser effekt af en billig foranstaltning)
- pH hævet til 13 med natronlud (belyser effekt af en dyrere foranstaltning)
- pH hævet til 10 med natronlud og 10 ml ethanol tilsat, der erstatter 10 ml vand i flasken (ethanol kan mobilisere færdigvarerne som i metoden flushing)
- 10 g kalk (CaCO3) tilsat i pulverform (kalk er et produkt, der er billigt, kan tilsættes på anden vis end væsker og skaber en stor buffervirkning)
På grund af det begrænset påvirkning af flaskerne med ingen behandling og med tilsætning af kalk, må man formode, at der kan være mikrobiel aktivitet i disse flasker.
Koncentrationen i jord og vand blev undersøgt ved udtagning af prøver. Først blev vandprøven udtaget ved at filtrere vandprøven. Herefter blev jordprøven udtaget ved lægge en delprøve på et stykke filterpapir til afdræning. Endelig blev den pågældende flaske kasseret. Forskellige flasker blev undersøgt med følgende intervaller:
- 3 dage
- 7 dage
- 64 dage
En oversigt over de 16 flasker ses i Figur 3-1.
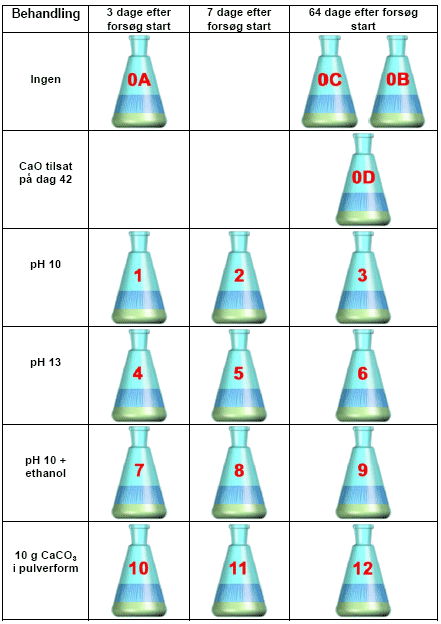
Figur 3-1 Oversigt over de 16 flasker i laboratorieforsøgene
3.2 Forsøgenes drift
Forsøgsbetingelserne omfattede følgende:
- tildækning af flaskerne for at undgå adgang af UV-stråling
- daglig omrystning
- stuetemperatur
- aerobe forhold
Da den tilsatte natronlud blev forbrugt under hydrolysen, faldt pH i takt med at hydrolyse fandt sted. Det var derfor nødvendigt at justere pH i flaskerne med mellemrum. Det bemærkes, at kalkprøverne ikke blev pH-justeret, dog blev der tilsat yderligere 10 g calciumcarbonat på dag 23. Figuren nedenfor viser, samtlige pH-målinger i de flasker, der først blev analyseret efter 64 dage.
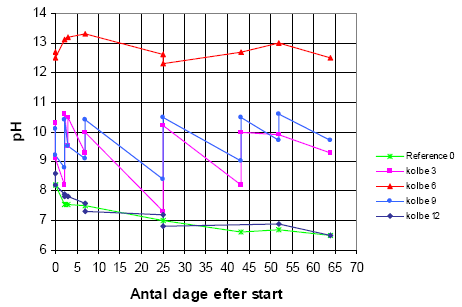
Figur 3-2 Oversigt over pH-forløbet i udvalgte flasker
Som det ses på figuren, er det langt fra lykkedes at holde pH på det ønskede niveau når man tager i betragtning at pH-skalaen er logaritmisk. Årsagen er, at hydrolysereaktionen foregår meget hurtigt og at prøverne indeholder en meget ringe bufferkapacitet. pH falder hurtigt, hvormed hydrolysen må formodes helt eller delvist at gå i stå indtil pH er justeret næste gang.
Der blev anvendt 2 analysemetoder til bestemmelse af forureningsindhold i flaskerne. Jordprøverne blev ekstraheret med isopropylacetat, filtreret gennem en 0,45 µm filter og målt med væskechromatografi (HPCL). Her blev der målt for færdigvarerne EP3 og E-sulfotep samt nedbrydningsproduktet amino-EP3. Vandprøverne blev filtreret gennem en 0,45 µm filter og injiceret direkte ind i en gaschromatograf (GC). Her blev der målt for a lang række færdigvarer og hydrolyse-rester. Alle kemiske analyser blev udført af Cheminova.
3.3 Vurdering af resultater
En tabel over analyseresultater ses i Bilag 1. Disse resultater vises grafisk i Figur 3-2. Figuren viser resultater fra analyse af jordprøver på venstre side af figuren og vandprøver på højre side af figuren. Bemærk at akserne er ikke ens på de forskellige grafer.
Klik her for at se figuren.
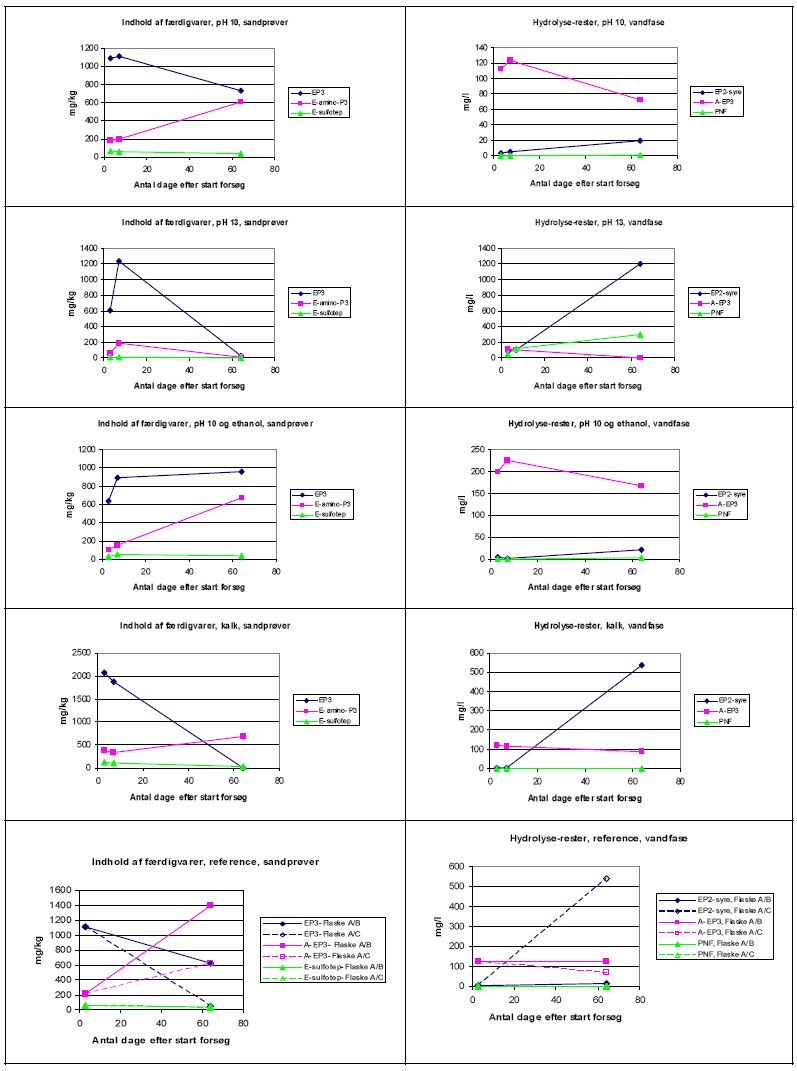
Figur 3-2 Jordprøver og vandprøver.
Figuren viser tydelig, at udgangskoncentrationer (måling efter 3 dage) er meget forskellige for de forskellige flasker. Specielt varierer EP3 i jordprøverne fra ca. 600 til over 2000 mg/kg. Desuden ses flere tilfælde, hvor koncentrationen af færdigvarer stiger med tid. Disse resultater må være fejlagtige. Årsagen er ikke fastlagt, men kan være utilstrækkelig homogenisering af jordprøven fra starten eller prøveforberedelse (håndtering ved udtagning af delprøverne eller ekstraktion) ved udtagning af jordprøverne. Det formodes ikke, at årsagen er problemer med selve målingen på analyseapparaterne.
I det følgende gennemgås de forsøgsforholdene enkeltvis.
Række 1 (pH=10, flasker 1, 2, 3): Jordgrafen viser, at der er sket en omdannelse af EP3 til amino EP3 i jordprøven, men at der total set ikke er sket en hydrolyse af færdigvarerne. Vandgrafen viser, at der ikke er sket nogen større dannelse af hydrolyse-rester. Disse resultater passer dermed sammen, men indikere ikke succes. Som tidligere nævnt, formodes den manglende succes at skyldes, at pH-værdien var betydelig under det ønskede niveau meget af tiden.
Række 2 (pH=13, flasker 4, 5, 6): Jordgrafen viser et meget stort fald i færdigvarernes koncentration (omkring 97 % for EP3). Dette vidner om at hydrolysen er forløbet næsten til ende. Tilsvarende, viser vandgrafen en stor stigning i indholdet af EP2-syre og en mindre stigning af PNF. Begge grafer er som forventet, da det er lykkedes at holde pH-værdien i disse flasker over 12 i hele forsøgsperioden. Det bemærkes, at der blev observeret en gul farve (formentlig det hydrolyse-rest PNF) i disse flasker allerede efter 2 dage.
Række 3 (pH=10 + ethanol, flasker 7, 8, 9): Jordgrafen viser en stigning i amino EP3, dog uden et tilsvarende fald i EP3. Dette bør ikke kunne forekomme og må bero på nogle af de tidligere forklaringer (homogenisering, prøveforberedelse). Vandprøven viser ikke nogen væsentlig stigning i indholdet af hydrolyse-rester. Som tidligere nævnt, formodes dette manglende succes at skyldes, at pH-værdien var betydelig under det ønskede niveau meget af tiden.
Række 4 (tilsætning af kalk, flasker 10, 11, 12): Jordgrafen viser et stort fald i EP3. Det formodes, at dette skyldes hydrolyse, da der kun er tale om en lille stigning i amino EP3. Vandprøverne bekræfter dette billede, da der sker en stor dannelse af EP2-syre. Det vides ikke, hvorfor der ikke ses en stigning i hydrolyseproduktet PNF. Grafen over pH-værdien viser, at pH har generelt ligget i intervallet 6,5 – 7,5 i disse flasker, dvs. ikke højt nok til at forvente en hurtig omdannelse via basisk hydrolyse. De gode resultater for disse flasker kan delvis skyldes mikrobiologisk aktivitet.
Række 5 (reference uden tilsætning, flasker A, B, C): Jordgrafen viser både i flaske B og C at der er sket en stor omdannelse fra EP3 til amino EP3. Vandprøverne viser, at der er sket en stor dannelse af EP2-syre i flaske C, mens der næste ikke er sket dannelse i flaske B. Det kan ikke afvises, at dannelsen af EP2-syre i flaske C skyldes mikrobiologisk aktivitet.
Figur 3-3 viser en massebalance (før og efter basisk hydrolyse). Figuren viser Flaske A som repræsentant for forsøgets start (flaske A er ikke pH-justeret og blev målt 3 dage efter forsøgets start) og flaske 6 som repræsentant for forsøgets slut (flaske 6 er pH-justeret til pH=13 med lud og blev målt 64 dage efter forsøgets start).
Det er ikke helt lige til at lave en korrekt massebalance. Der skal nemlig tages hensyn til støkiometrien af hydrolyse reaktionerne. Støkiometrien af de vigtigste reaktioner ses nedenfor:
1 EP3 → 1 EP2-syre + 1 PNF
1 A-EP3 → 1 EP2-syre + 1 reduceret-PNF
1 E-sulfotep → 2 EP2-syre
Som det ses, danner hvert mol færdigvare 2 mol hydrolyse-rest af den ene eller den anden slags. For at lave en massebalance, skal man således dele de fundne hydrolyserester med 2. Dette er gjort i Figur 3-3, hvor der udelukkende er medtaget de stoffer nævnt i de ovenstående reaktionsligninger. På figuren indikerer blå/lilla farver færdigvarer, mens røde/orange farver indikerer hydrolyse-rester.
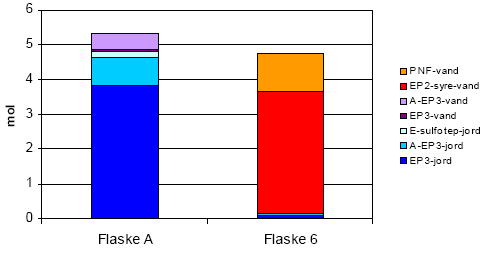
Figur 3-3 Massebalance
Når massebalancen opgøres på denne måde, vurderes den at være acceptabel.
Figur 3-4 viser en væsentligste effekt af tilsætning af alkohol. Figuren afbilder den vandige EP3 koncentration. Med lud alene, (uden alkohol, pH=10, flaske 1, 2, 3) findes EP3 hovedsagelig bundet til jorden. Tilsætning af alkohol (lud + alkohol, pH=10, flaske 7, 8 og 9) vil en større andel af EP3 opløses i vandet ved at den bundne EP3 mobiliseres fra jord til vand.
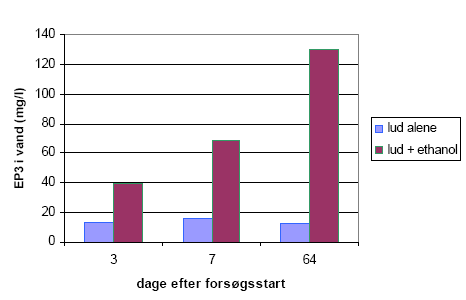
Figur 3-4 Effekt af ethanol på opløsning af EP3.
3.4 Jordens bufferkapacitet
Ud over hydrolyseforsøgene er der også udført et bufferforsøg for at fastlægge jordens modstand mod at pH øges når der tilsættes natronlud. Til forsøget blev 2,4 g jord tilsat 10 g vand og 0,1 g natriumklorid. Prøven blev herefter titreret med 0,1 N natriumhydroxid. Titreringen blev udført over en kort periode (8 minutter), hvormed evt. hydrolyse i perioden er uden betydning. Titreringskurven er vist i Figur 3-5.
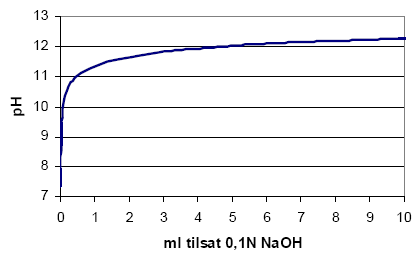
Figur 3-5 Titreringskurve for en jordprøve
Figuren viser, at der blev brugt ca. 0,1, 0,5 og 4,5 ml titreringsvæske til at hæve pH til hhv. 10, 11 og 12. For at hæve pH til 11, kræves 0,8 kg lud pr. ton jord, se nedenstående beregning:
![]()
Hævning af pH til 10 kræver kun ca. 0,17 kg NaOH pr. ton jord.
Denne beregning belyser forurenet jords bufferkapacitet. For at holde pH højt over en periode, skal man udover denne mængde tilsat natronlud også tilsætte ekstra natronlud til at modsvare den mængde syre, der dannes af forurening via hydrolyse. For at give et regneeksempel, antages at der dannes 1200 mg/l EP2-syre i et stærkt forurenet område (denne mængde blev dannet i flaske 6 efter 64 dage). Den nødvendige NaOH beregnes således:
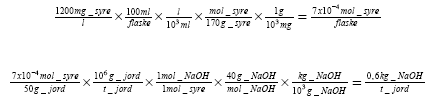
Heraf ses, at jordens buffervirkning og syredannelsen ved hydrolyse kræver ca. lige meget lud, når der er tale om at opretholde en pH på 11. Hvis man sigter efter en pH på 10 (som fx ved nogle af laboratorieforsøgene), er ludbehovet som følge af hydrolyse langt overvejende. Dette forklarer, hvorfor pH-værdien blev ved med at falde i laboratorieforsøgene med pH=10. Omvendt, hvis man sigter efter en pH på 12, er ludbehovet for at modvirke jordens buffervirkning den vigtigste.
Som kontrol af disse beregninger kan man kigge på den aktuelle pH-justering under hydrolyseforsøgene. I flere af flaskerne blev der tilsat i alt fx. 0,2 ml 1N natriumhydroxid. Dette svarer til følgende forbrug af natronlud:
![]()
Dette stemmer overens med, at det tilsatte mængde natriumhydroxid under hydrolyseforsøgene generelt var for lidt for at modvirke virkningen af syredannelse ved hydrolyse.
Hvis man til en evt. pilotskalaforsøg sigter mod en pH på 11, skal der anvendes ca. 0,8 + 0,6 = 1,4 kg NaOH pr. ton jord.
Version 1.0 September 2007, © Miljøstyrelsen.