|
| Forside | | Indhold | | Forrige | | Næste |
Effekt af bekæmpelsesmidler på flora og fauna i vandløb
3 Effekter af pesticider på alger i vandløb
Undersøgelser af enkeltstoffers og komplekse blandingers (f.eks. spildevand) toksiske virkning over for vandlevende organismer udgør sammen med måling eller beregning af stoffernes koncentration i
miljøet et af hovedelementerne i vurderingen af om et givet stof eller spildevand giver anledning til ikke-acceptable påvirkninger i miljøet. Øvrige forhold som indgår i den samlede vurdering omfatter
stoffernes nedbrydelighed, bioakkumulerbarhed og eventuelle carcinogene effekter.
Ved risikovurdering af pesticider (godkendelsesordningen) baseres vurdering af giftigheden på standardiserede undersøgelser udført på ”standardorganismer” holdt i kultur, typisk en planktonalge, en dafnie,
en enkimbladet vandplante (oftest andemad) samt en fisk. Disse organismer repræsenterer arter der lever i stillestående vande. Desuden anvendes der fastlagte eksponeringsperioder til bestemmelse af
toksiciteten. Således angives den akutte toksicitet typisk som EC/LC50 efter 48, 72 eller 96 timer for hhv. krebsdyr, alger og fisk, mens data for kroniske eksponeringer og effekter normalt kun foreligger for
dafnier. Der er således en beskeden information om pesticiders effekt på andre endpoints så som vækst, reproduktion, og endnu mindre forekommer der undersøgelser til bestemmelse af indirekte effekter
på økosystemprocesser. Det er velkendt at forskellige livsstadier af en art kan variere i følsomhed overfor et toksisk stof; oftest er juvenile individer mere følsomme end voksne individer, men om variationen
i følsomhed mellem livsstadier indenfor én art er større eller mindre end forskellen i følsomheder mellem forskellige arter er uklar.
I vandløb vil eksponeringskoncentrationen variere over tid og sted og have karakter af pulsudledninger afhængigt af de sæsonmæssige variationer i pesticidforbrug, behandlingshyppighed, nedbør samt
vandløbets beskaffenhed. Det kan derfor være vanskeligt at anvende toksicitetsværdier opnået i standard tests til at forudsige eventuelle effekter af pesticider i vandløb.
Kun undtagelsesvist eksisterer der toksicitetsdata fra eksponeringer på mindre end en dag – selvom denne type eksponeringer er hyppigt forekommende i mindre vandløb (se Fig. 6), og der er næsten ingen
information om eventuelle eftervirkninger af kortvarige eksponeringer til pesticider på ferskvandsorganismer til trods for, at den tilgængelige litteratur påpeger mulige effekter længe efter eksponeringsophør
(Abel & Garner 1986).
Således var målet med nærværende projekt at tilvejebringe et mere realistisk billede af pesticiders mulige effekt på flora og fauna i vandløb. De mere specifikke formål med projektet var som følger:
- At sammenligne sensitiviteten af almindeligt forekommende vandløbsinvertebrater og mikroflora med standardtest organismer (som f.eks. Daphnia og fytoplankton) og med hinanden, således at:
- identificere artsvariationen overfor pesticideksponering, og
- sammenligne standardorganismers respons overfor pesticider som et brugbart mål for skader på vandløbenes flora og -fauna.
- At kvantificere den relative følsomhed af forskellige livsstadier hos udvalgte invertebrater tilhørende forskellige taksonomiske grupper (f.eks. insekter, amfipoder, isopoder), samt at bestemme
variabiliteten i følsomheden indenfor en art og følsomheden mellem arter udsat for forskellige pesticider.
- At undersøge forskellige økologisk relevante effektparametre og relatere disse respons til effekter på populationsdynamikken for arterne med hensyn til direkte effekter, og indirekte effekter på andre
arter i økosystemet, samt evt. effekter på økosystemprocesser.
3.1 Alger og højere planter
I lysåbne vandløb er undervandsplanter og mikroalger vigtige komponenter i økosystemerne. Undervandsplanterne danner ofte tætte bestande og er vigtige for vandløbenes fysiske miljø, for habitater for
invertebrater og fisk og som tilskud af organisk stof (Baattrup-Pedersen, 2000). Derimod ædes undervandsplanter kun i ringe grad men må gennem en mikrobiologisk nedbrydning før end det organiske stof
kan udnyttes af vandløbsdyrene. I vandløbene er den største trussel for vandløbsplanterne den hyppige grødeskæring, som ændrer artssammensætningen mod robuste typer. Man må derfor forvente, at
denne påvirkning langt vil overstige effekten af pesticider.
3.2 Effekt af pesticider på bentiske mikroalger
På vandløbsbunden og på makrofytternes blade dominerer bentiske mikroalger. Deres variation er bestemt af lysintensiteten og deres betydning vil være stor, hvis undervandsplanterne beskæres hårdt på
lysåbne vandløbsstrækninger og i skovvandløb inden løvspring (Friberg 1998). Mikroalgerne tjener som føde for en lang række vandløbsdyr (Lamberti 1996). De fleste algegrupper som kendes fra
planktonet er repræsenteret blandt de bentiske mikroalger selv om kiselalger generelt dominerer. Der er en omfattende dokumentation for at herbicider i målte koncentrationer kan påvirke
planktonalgesamfund i vandhuller og der er derfor nærliggende at også bentiske mikroalger i vandløb kan påvirkes af pesticider. Undersøgelser er dog relativt få (Jurgensen & Hoagland. 1990, Spawn et al.
1996, Krieger et al. 1988, Cradner & Hoagland 1998, Gruessener & Watzin 1995) og med en enkelt undtagelse (Kreutzweiser et al. 1996, 12 timers eksponering) har eksponeringerne været kontinuerlige
over flere dage. Det er langt fra sikkert, at man kan overføre resultaterne fra forsøg med planktonalger, da eksponeringen i vandløb ofte vil være kortvarig med en højere koncentration end i vandhuller og
søer.
Da de mikrobentiske alger er et vigtigt fødegrundlag for vandløbsdyrene, er det vigtigt at kende effekter af pesticider på denne gruppe. Algerne har korte generationstider og rekoloniserer hurtigt. Men
herbicider kan forårsage forskydninger i arts- og gruppesammensætningen, som kan ændre fødegrundlaget for vandløbenes invertebrater. De traditionelle toksikologiske enkeltartstest inkluderer ikke
sådanne effekter, og endvidere medtager disse forsøg heller ikke den nedbrydning af pesticider, der vil være fra naturligt forekommende heterotrofe organismer. De mikrobentiske alger klæber til substrater
ved hjælp af polysaccharidmatrixer, der i sig selv formentlig virker som barrierer for transporten af toksiske stoffer til algerne, og som pesticiderne i et uvist omfang vil klæbe sig til. Det er derfor vigtigt at
inkludere sådanne faktorer, der kan påvirke omfanget af den toksiske effekt på perifytiske alger i forsøg.
Yderligere fordele ved bentiske mikroalger (sammenlignet med makrofytter) er også at det praktisk er muligt at gennemføre statistisk ”korrekte” forsøg med flere replikater og at der eksisterer
standardmetoder for kvantificering af funktionelle (primærproduktion) og strukturelle (f.eks. algepigmenter, mikroskopi) karakteristika (og end-points) i algesamfund. Tilsvarende forsøg med
undervandsplanter på samfundsniveau er langt sværere at gennemføre.
I dette projekt er en ny type test blevet designet, hvor intakte perifytonsamfund anvendes. I testet indgår der en 2-3 ugers koloniseringsperiode, hvor naturligt perifyton bevokser skiver af glas i et vandløb,
og herefter anvendes de bevoksede skiver i laboratoriet for at undersøge herbiciders og fungiciders effekter på de algernes fotosynteseaktivitet og taksonomiske sammensætning på gruppeniveau. Da
pesticider ofte forekommer i vandløb i pulser ved vinddrift eller efter regnskyl, er der i undersøgelsen lagt vægt på også at indrage korttidseksponering, for at kunne vurdere, om algernes opportunistiske
leveform gør dem i stand til at klare sådanne pulseeksponeringer. Endvidere indgår der i forsøgene en ”recovery-fase”, for at kunne vurdere effekternes varighed, herunder om eksponeringen forårsager
varige effekter, der således vil have indirekte effekter på invertebratfaunaen.
Bentiske mikroalger i vandløbene varierer gennem sæsonen som følge af lystilgængelighed og strømhastighed. Under perioder med stærk strøm kan det finkornede sediment og perifytter skylles væk og i
perioder og områder med stor dækningsgrad af undervandsplanter eller på vandløbsstrækninger med trædække kan perifytter blive udskygget. Derfor vil forårsperioden umiddelbart inden løvspring generelt
være den optimale periode for indsamling. Det er også i denne periode hvor udbringning af herbicider normalt er størst. For at dække sæsonvariationen i artssammensætning blev nogle forsøg udført i
sensommeren.
3.2.1 Metode
Perifyton til forsøg kan indsamles fra vandløbsbunden, fra sten eller på kunstige substrater. De hyppigst anvendte kunstige substrater består af glasskiver (f.eks. Bahls 1993). De vigtigste fordele ved kunstige
substrater er:
- Der kan indsamles uafhængigt af de fysiske forhold i vandløbet (substrat, strømhastighed, dybde)
- Prøverne bliver standardiserede idet ”mikromiljøet” omkring hver glasskive er ens og subjektiviteten i indsamlingsproceduren elimineres.
Den primære ulempe ved kunstige substrater er, at materialet til en vis grad vil favorisere visse algetyper (fastsiddende) fremfor andre (krybende former). Endvidere vil varigheden af eksponeringen i
vandløbet påvirke sammensætningen af perifytsamfundet – hurtige kolonisatorer vil dominere efter kortvarig eksponering, mens længerevarende eksponering vil føre til større variation i samfundene på de
enkelte glas. Indledende forsøg viste dog at der ved en eksponering (kolonisation) på 1-2 uger opnås et diverst samfund og en acceptabel lav variation mellem de enkelte glas.
Der undersøgtes for effekter på en vital funktionel parameter i form af fotosynteseaktivitet og for effekter på biomasseudvikling og biomassens udvikling på gruppeniveau (kiselalger, grønalger, blågrønalger).
Undersøgelsen gennemførtes som”hybrid design” med både replikater (3-4 for hver pesticideksponering og 6 kontroller) og 5 forskellige pesticidkoncentrationer. Dette giver mulighed for at estimere NEC
(no effect concentration) ved regression og teste for forskelle mellem de forskellige eksponeringskoncentrationer ved ANOVA. ”No effect concentration” (NEC) og effekt koncentrationen (EC50) blev
udregnet på basis af fotosyntesemålingerne ved log-lineær interpolation (Petersen & Gustavson 1998). I flere tilfælde kunne NEC ikke bestemmes. Istedet angives den lavest målte effektkoncentration
(LOEC).
Effekter af 5 herbicider og 2 fungicider undersøgtes på naturlige algesamfund fra Esrum Mølleå ca. 2 km nedstrøms udløbet fra Esrom Sø (Tabel 5). Denne vandløbsstrækning løber gennem et udyrket
område og må formodes at være udsat for en meget lav pesticidpåvirkning.
Tabel 5. Oversigt over anvendte pesticider og effektparametre
| Pesticid |
Type |
Fotosyntese |
Biomasse &
sammensætning |
| Isoproturon |
Herbicid |
X |
X |
| Metribuzin |
Herbicid |
X |
X |
| Hexazinon |
Herbicid |
X |
|
| Pendimethalin |
Herbicid |
X |
X |
| Metsulfuron |
Herbicid |
X |
X |
| Azoxystrobin |
Fungicid |
X |
X |
| Fenpropimorph |
Fungicid |
X |
X |
Ved en undersøgelses start udsattes 3 ramper hver indeholdene 170 glasskiver (1 cm i diameter) i vandløbet til etablering af påvækst. Efter indsamling og visuel kontrol for nær ens dækning med algevækst
overførtes 400 glasskiver individuelt til 20 ml glasvials indeholdende filtreret åvand tilsat pesticid i 5 forskellige nominelle koncentrationer (bestemt efter range-finding test) + kontrol. De tungtopløselige
pesticider Pendimethalin og Azoxystrobin blev inden tilsætning opløst i acetone og kontrolforsøgene gennemførtes med samme acetonekoncentration som pesticideksponeringerne Forsøgene gennemførtes
med 3-4 replikater (6 replikater for kontrol). For at undgå næringsbegrænsning blev åvandet tilsat 100 µM NO3, 16 µM PO4 og 50 µM SiO2. Vials blev placeret på rystebord i termorum ved ”naturligt” lysmiljø (120 µE m-2 s-1; 14L:10M).
Der blev udtaget prøver efter 1, 2, 24, 48 timer til bestemmelse for fotosynteseaktivitet og prøver efter 2, 24 og 48 timer til bestemmelse af koncentration og sammensætning af algegrupper ved HPLC
(Schlüter et al. 1999). Ved hvert udtag overføres endvidere et identisk antal glas til rent åvand og inkuberes i reguleret lysmiljø (14 timers lys ved 250 µEm-2 s-1 og 10 timers mørke). Disse blev undersøgt
for ændringer (genetablering) af algesammensætning efter yderlige 48 timer. I forsøget med pendimethalin kunne der ikke iagttages ”recovery” efter 48 timer i rent vand. På den baggrund gennemførtes et
yderligere forsøg, hvor recovery fasen blev forlænget til 192 timer.
Den fotosyntetiske aktivitet blev målt ved at tilsætte 1 µCi 14C til vials med bevoksede glasskiver ved slutningen af inkubationsperioden (1, 2, 24, 48 timer) samt efter 48 timer i rent vand. Glassene blev
inkuberet ved in situ temperatur og lys i én time. Inkubationerne blev stoppet ved at tilsætte eddikesyre indtil pH var 2. Prøverne blev tørret ved 60 °C. Herefter blev 1 ml dimethylsulfoxid tilsat for at frigøre
det inkorporerede 14C, og efter ½ time blev der tilsat scintillationsvæske og prøverne blev talt i scintillationstæller.
Effekt på algernes biomasse og gruppesammensætning blev bestemt ved hjælp af pigmentanalyse på HPLC. Grundet en lavere følsomhed af pigmentindhold sammenlignet med fotosyntese gennemførtes
pigmentforsøgene i flere tilfælde ved højere koncentrationer af pesticider. Indholdet på 3 glasskiver blev frosset i flydende kvælstof indtil analyse på HPLC. Forud for analysen blev prøverne tøet op,
ekstraheret i 100% acetone i 24 timer, refiltreret gennem Teflon® sprøjtefiltre og analyseret på HPLC efter Schlüter et al. (2000). Algegrupper blev identificeret og kvantificeret ud fra diagnostiske pígmenter
(Fucoxanthin = kiselalger, Klorofyl-b = grønalger, Zeaxanthin = blågrønalger).
I modsætning til fotosyntesen bestemtes pigmentkoncentrationer i puljede prøver. For at få et indtryk af variationen mellem replikaterne blev der i 5 tilfælde analyseret på individuelle glasskiver. Disse
analyser viste en variationskoefficient i gennemsnit på 26,0% (variationsbredde: 11-42%) for kisel- og grønalger og på 22,1% for summen af alger (klorofyl a). Til sammenligning var den gennemsnitlige
variationskoefficient i fotosynteseprøverne 16,2%. Da vi ikke kender variationen indenfor den enkelte behandling kan der ikke gennemføres formelle statistiske test for forskelle mellem pesticideksponeringer
og korrensponderende kontroller. Hvis vi antager at variansen er ens i eksponerede alger og kontrolforsøg, vil en gennemsnitlig variationskoefficient på 26% indenfor 3 prøver betyde, at der mindst skal være
en forskel på 38% mellem eksponerede alger og kontrolalger før forskellen kan antages at være signifikant.
3.2.2 Effekt af fotosyntesehæmmere
De undersøgte fotosyntesehæmmere hexazinon, isoproturon og metribuzin havde alle en markant effekt på fotosynteseraten med entydige dosis-respons kurver for især isoproturon og metribuzin (Figur 7 &
8, Tabel 6). Hæmningen var nærmest momentan med tydelig reduktion allerede efter en times eksponering med laveste effektkoncentration mellem 0,24 µg l-1 (24 timer) og 1 µg l-1 (1 time).
Effekten af hexazinon var mindre entydig: ved lave koncentrationer stimuleredes fotosyntesen ved kortvarig eksponering og ved 24 timers eksponering var effektkoncentrationen betydeligt højere
sammenlignet med isoproturon og metribuzin (se Bilag A).
Fotosyntesehæmmernes effekt på biomassen af kiselalger og grønalger afspejlede effekten på fotosyntesen, blot var effektkoncentrationerne højere og effekten forsinket sammenlignet med hæmningen i
fotosyntesen (Fig. 9, Tabel 7).
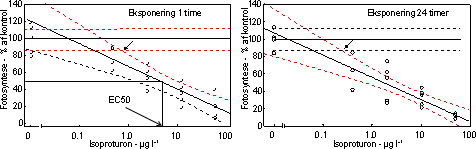
Figur 7. Dosis-respons relation for bentiske mikroalger eksponeret til isoproturon i 1 time (venstre) og 24 timer (højre). Skæringen (angivet med pil) mellem nedre konfidensgrænse for kontrolgruppen og den øvre konfidensgrænse for de eksponerede alger angiver den laveste signifikante effektkoncentration. Pilen nederst angiver den koncentration, som hæmmer fotosyntesen med 50% sammenlignet med kontrollen.
Det var karakteristisk, at effekterne af fotosyntesehæmmerne var forbigående. Efter overførsel til rent vand var både fotosyntesen og biomassen af både kiselalger og grønalger næsten fuldt retableret i løbet
af 48 timer (Fig. 10 & 11, Tabel 6 & 7). Blågrønalgernes koncentration var lav, men forløbet under eksponering og efterfølgende recoveryperiode var parallelt med de øvrige algegrupper (data ikke vist).
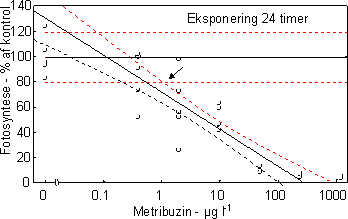
Figur 8. Dosis-respons relation for metribuzin. Skæringen (angivet med pil) mellem nedre konfidens-grænse for kontrolgruppen og den øvre konfidensgrænse for de eksponerede alger angiver den laveste effektkoncentration.
En beregning af vækstraten udfra ændringerne i biomasserne under ophold i rent vand viste værdier mellem 0,05 og 0,6 d-1 med de højeste rater i forsøgene med de højeste pesticidkoncentrationer og hvor
påvirkningen under eksponering havde været størst (Bilag A). Det kan således beregnes, at hvis perioden i rent vand havde været 3 dage i stedet for 2 ville der i alle forsøg havde været fuld recovery.
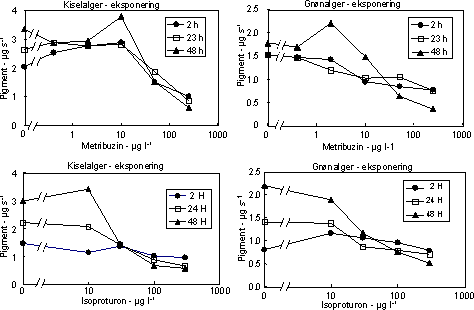
Figur 9. Effekt af fotosyntesehæmmere metribuzin (øverst) og isoproturon (nederst) på biomassen af kiselalger (venstre) og grønalger (højre) ved forskellig eksponeringsvarighed (2, 24 og 48 timer). Værdierne angiver et gennemsnit (µg diagnostisk pigment per glasskive) af 3 replikater. Bemærk at forsøgene med isoproturon ikke er de samme som vist i Figur 7.
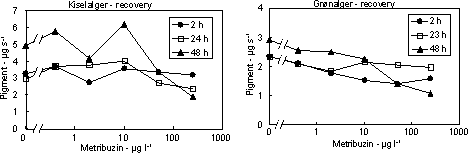
Figur 10. Koncentration af kiselalger (venstre) og grønalger (højre) efter eksponering til metribuzin i 2, 24 og 48 timer og efterfølgende ophold i rent åvand i 48 timer. Værdierne angiver et gennemsnit af 3 replikater.
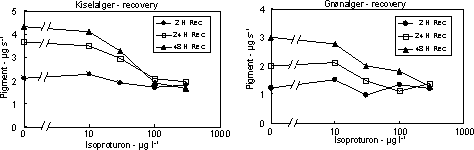
Figur 11. Koncentration af kiselalger (venstre) og grønalger (højre) efter eksponering til isoproturon i 2, 24 og 48 timer og efterfølgende ophold i rent åvand i 48 timer. Værdierne angiver et gennemsnit af 3 replikater.
3.2.3 Effekt af fungicider
Begge fungicider påvirkede fotosynteseraten hos mikroalgerne med reduktioner ved koncentrationer over og omkring 1 mg l-1 (Figur 12 & 13, Tabel 6). Efter overførsel til rent vand var fotosyntesen
generelt reetableret efter 48 timer.
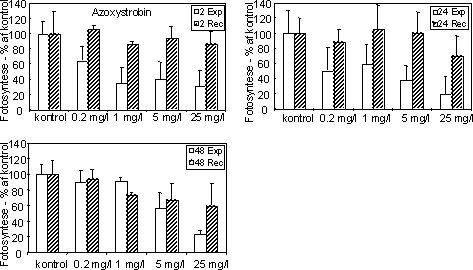
Figur 12. Fotosynteseaktivitet af bentiske mikroalger efter eksponering til azoxystrobin Søjlerne angiver den gennemsnitlige aktivitet (95 % konfidensgrænse) i procent af den korresponderende kontrol efter eksponering (hvide søjler) i 2 (øverst), 24 og 48 (nederst) timer samt efter 48 timers periode i rent vand (skraverede søjler).
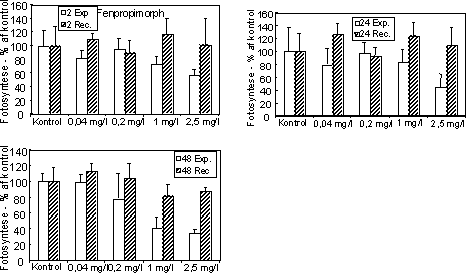
Figur 13. Fotosynteseaktivitet af bentiske mikroalger efter eksponering til azoxystrobin (venstre kolonne) og fenpropimorph (højre kolonne). Søjlerne angiver den gennemsnitlige aktivitet (95 % konfidensgrænse) i procent af den korresponderende kontrol efter eksponering (hvide søjler) i 2 (øverst), 24 og 48 (nederst) timer samt efter 48 timers periode i rent vand (skraverede søjler).
Biomasseudviklingen af især kiselalger reduceredes ved høje koncentrationer af azoxystrobin og fenpropimorph (Fig. 14, Tabel 7). Effekten øgedes med eksponeringsvarigheden og var især tydelig efter 48
timers eksponering.
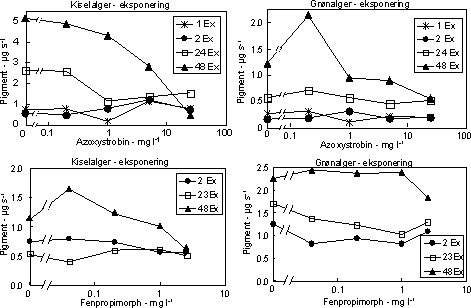
Figur 14. Effekt af azoxystrobin (øverst) og fenpropimorph (nederst) på biomassen af kiselalger (venstre) og grønalger (højre) ved forskellig eksponeringsvarighed (1, 2, 24 og 48 timer). Værdierne angiver et gennemsnit af 3 replikater.
Efter overførsel til rent vand var biomasserne næsten fuldt reetableret i løbet af 48 timer (Fig. 15, Tabel 7). Det skyldes høje vækstrater under recoveryfasen hos de alger, som havde været eksponeret til de
højeste koncentrationer i længst tid (se Bilag A).
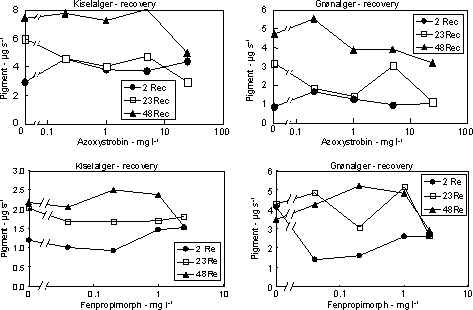
Figur 15. Koncentration af kiselalger (venstre) og grønalger (højre) efter eksponering til azoxystrobin (øverst) og fenpropimorph (nederst) i 2, 24 og 48 timer og efterfølgende ophold i rent åvand i 48 timer. Værdierne angiver et gennemsnit af 3 replikater.
3.2.4 Effekt af celledelingshæmmer
Der blev gennemført 2 forsøgsserier med herbicidet pendimethalin, som virker ved hæmning af celledelingen i planter. Den første forsøgsrække viste en monoton reduktion i fotosynteseaktiviteten i
koncentrationsintervallet 0,06 – 8 mg l-1 og et ufuldstændig recovery selv efter 2 timers eksponering (Fig. 16). Efter eksponering i 48 timer forstærkedes reduktionen i recoveryperioden ved alle undersøgte
koncentrationer. En tilsvarende effekt og tidslig udvikling kunne også ses i biomassen af kiselalger, blågrønalger og især grønalger (se Bilag A).
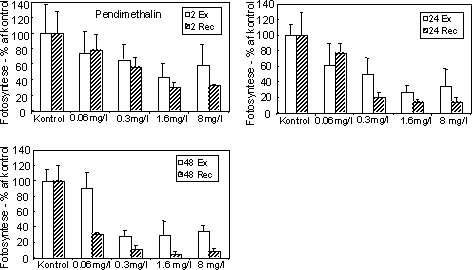
Figur 16. Fotosynteseaktivitet af bentiske mikroalger efter eksponering til pendimethalin Se tekst til Figur 12 for forklaring af symboler.
På grund af mangel på recovery i første forsøg gennemførtes yderlige et forsøg ved lavere koncentrationer (10 – 200 µg l-1) og med en forlænget periode i rent vand (192 timer). For at undgå
næringsbegrænsning blev der skiftet næringsberiget vand hver 2. dag under recoveryperioden.
I eksponeringsperioden (2 – 24 timer) var effekterne på algebiomasserne moderate (Fig. 17), men effekten af pendimethalin på biomasseudviklingen hos grønalger blev tydelig under perioden i rent vand.
Således var der ikke opnået fuld recovery af grønalger efter 192 timer i forsøget med 24 timers eksponering til 10 µg l-1 (Fig. 18, Tabel 7). At kiselalgerne er mindre følsomme end grønlalgerne kan skyldes,
at kiselalgernes cellevæg (ydre skelet) udgør en mere effektiv barriere end grønalgernes ”nøgne” cellevæg. I terrestiske planter sker optagelsen af pendimethalin alene gennem skud og rodspidser, mens
optagelsen gennem blade er negligibel.
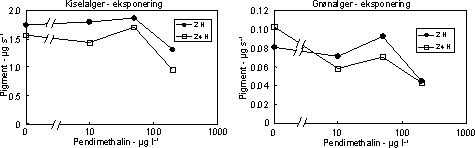
Figur 17. Effekt af pendimethalin på biomassen af kiselalger (venstre) og grønalger (højre) efter eksponering i 2 og 24 timer. Værdierne angiver et gennemsnit af 3 replikater.
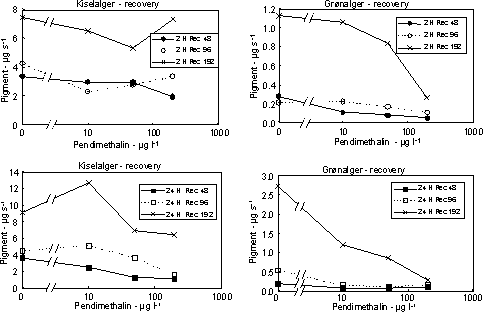
Figur 18. Koncentration af kiselalger (venstre) og grønalger (højre) efter eksponering til pendimethalin i 2 timer (øverst) og 24 timer (nederst) og efterfølgende ophold i rent åvand i 48, 96 og 192 timer. Værdierne angiver et gennemsnit af 3 replikater.
Tabel 6. Effekt af pesticider på fotosynteseaktivitet hos perifytalger efter eksponering til 1 (2), 24 og 48 timer (Eksponering) og efterfølgende ophold i rent vand i 48 timer (Recovery). NEC: ”no effect concentration”; EC50 og 95 % konfidensinterval (i parantes) angivet. - = ikke forskellig fra kontrol, s = stimulering (signifikant højere aktivitet end i kontrol). Alle værdier i µg l-1.
| |
Eksponering |
Recovery |
| NEC |
EC50 |
NEC |
EC50 |
| Isoproturon |
1 time |
0,82 |
5,2 (2,0-9,9) |
- |
- |
| 24 timer |
0,24 |
2,9 (1,0-4,9) |
- |
- |
| Metribuzin |
1 time |
s |
s |
- |
- |
| 24 timer |
1,1 |
5,6 (4,2-10,1) |
- |
s |
| Hexazinon |
1 time |
s |
s |
|
|
| 24 timer |
62 |
48 (18-130) |
- |
- |
| Metsulfuron-Me |
1 time |
s |
s |
|
|
| 24 timer |
13,7 |
368 (162-688) |
- |
- |
| 48 timer |
6,4 |
493 (229-706) |
- |
- |
| Pendimethalin |
2 timer |
227 |
1490 (630-?) |
185 |
841 (529-?) |
| 24 timer |
88 |
408 (224-711) |
82 |
122 (69-230) |
| 48 timer |
97 |
183 (101-314) |
19 |
43 (29-72) |
| Azoxystrobin |
2 timer |
240 |
630 (241-1005) |
- |
- |
| 24 timer |
284 |
875 (263-1116) |
- |
- |
| 48 timer |
2460 |
9600 (4800-15100) |
- |
- |
| Fenpropimorph |
2 timer |
820 |
3300 (1280-?) |
- |
- |
| 24 timer |
1550 |
2440 (1370-?) |
- |
- |
| 48 timer |
680 |
890 (590-1280) |
- |
- |
Tabel 7. Effekt af pesticider på biomasseudvikling hos perifytalger efter eksponering til 1 (2), 24 og 48 timer (Eksponering) og efterfølgende ophold i rent vand i 48 timer (Recovery). LOEC = laveste effektkoncentration bestemt hvis afvigelse fra korresponderende kontrol var større end 38% (se tekst). (K = kiselalger; G = grønalger; B = blågrønalger). Alle værdier i µg l-1.
| |
Eksponering |
Recovery |
| LOEC |
LOEC |
| Isoproturon |
2 time |
100 (K) |
- |
| 24 timer |
30 (K) |
- |
| 48 timer |
30 (K,G) |
100 (K,G) |
| Metribuzin |
2 time |
50 (G) |
- |
| 24 timer |
250 (K,G) |
- |
| 48 timer |
50(K,G,B) |
250 (K,G) |
| Metsulfuron-Me |
2 time |
> 1000 |
- |
| 24 timer |
> 1000 |
- |
| 48 timer |
1000 (G,B) |
- |
| Pendimethalin |
2 timer |
250 (G) |
50 (G) |
| 24 timer |
10 (G)* |
10 (G)* |
| 48 timer |
|
|
| Azoxystrobin |
2 timer |
- |
- |
| 24 timer |
1000 (K) |
3300 (K,G) |
| 48 timer |
6300 (K) |
3300 (K,G) |
| Fenpropimorph |
2 timer |
- |
- |
| 24 timer |
- |
- |
| 48 timer |
2500 (K) |
- |
| * laveste koncentration anvendt |
| Forside | | Indhold | | Forrige | | Næste | | Top |
Version 1.0 Januar 2004, © Miljøstyrelsen.
|