Statistisk analyse og biologisk tolkning af toksicitetsdata
1 Introduktion
For at dokumentere pesticiders biologiske virkning undersøger man deres virkning på levende organismer, levende væv eller lignende. De forsøg man laver kaldes biologiske assays eller bioassays, og deres formål er at måle et givet stofs stimulering eller reduktion af livsytringer i dyr og planter. Det kan være in vivo forsøg med dyr og planter og/eller in vitro forsøg med celler, enzymsystemer mv. Fælles for bioassays er, at de beskriver sammenhængen mellem virkning og dosis (Finney 1978; Hewlett and Plackett 1979). OECD, ISO og andre internationale organisationer og institutioner publicerer løbende dokumenter, som giver retningslinjer for det eksperimentelle design af bioassays, for hvordan toksicitet skal måles og for hvordan kemiske analyser af stoffer anvendt i testene skal udføres (fx ISO 6341 1989;ISO13829 1997;ISO 8692 2004; OECD 208; OECD 227). Derimod er retningslinjerne for de statistiske analyser til kvantificering toksicitet ofte mere uklare.
Godkendelse og brug af pesticider er reguleret af rammer for vurdering af plantebeskyttelsesmidler, som er forankret i EU-direktivet 91/414/EØF. Uanset om et stof er helt nyt på markedet eller om det indgår i et revurderingsprogram er der krav om en lang række humantoksikologiske og økotoksikologiske undersøgelser. Disse anvendes i en risikovurdering af det pågældende stof til at fastslå om stoffet udgør en risiko for sundhed og miljø. Registreringsmyndighederne benytter desuden resultaterne af disse undersøgelser til at fastslå, om et givet stof overholder givne afskæringsværdier for toksicitet og økotoksicitet. Således har resulaterne af bioassay afgørende betydning for godkendelse af pesticider, og da disse bioassays desuden ofte er meget omkostningstunge er det vigtigt at de opnåede resultater udnyttes fuldt ud og i overensstemmelse med god videnskabelig praksis. Grundlaget for nærværende projekt var derfor at kigge nærmere på den statistiske analyse af resultater opnået i gængse standardiserede testtyper. Målgruppen for denne rapport er alle som beskæftiger sig med at fremskaffe og vurdere toksicitets- og økotoksicitetsdata. Projektet gennemgår således flere af de væsentligste problemstillinger, man kommer ud for, når man skal designe, udføre, analysere og vurdere et bioassay.
I princippet er der tre forskellige måder at analysere bioassay-data på:
1. Variansanalyse: Har til formål at analysere forskelle mellem middelværdier af i forvejen fastlagte behandlinger. Her kan man for eksempel undersøge om der er forskelle mellem effekter af udvalgte doseringer set i forhold til effekter i en ubehandlet kontrolgruppe. Man har altså ikke på forhånd en forventning om en bestemt sammenhæng mellem virkning og dosis, og formålet er ikke at interpolere mellem doser. Man forudsætter blot, at der til hver dosis er tilknyttet en parameter, et niveau, som beskriver virkningen af netop den dosis. Man er interesseret i at finde den dosering i en stigende doseringsrække, der netop ikke giver en virkning på testorganismerne. Kriteriet for, at der ikke er virkning er et a priori valgt signifikansniveau. Denne koncentration/dosis kaldes ofte NOEC/NOEL (No Observable Effect Concentration/Level). På tilsvarende vis fastlægges også LOEC (Lowest Oberservable Effect Concentration), der defineres som den dosering i en doseringsrække, der netop har en statistisk signifikant virkning på organismerne. Brug af NOEC og LOEC forudsætter dermed, at der findes en tærskeldosering som netop udløser en virkning på en organisme. Desuden vil NOEC og LOEC kun kunne antage værdier, der modsvarer en af de koncentrationer, der indgår i det eksperimentelle testdesign. Inden for toksikologien taler man ofte om niveauer i stedet for koncentrationer, så i stedet for NOEC, som anvendes i økotoksikologisk sammenhæng, anvender man NOEL (No Observable Effect Level) for human toksikologiske test.
2 Parametrisk dosis-respons model: Denne metode forudsætter, at man enten a priori eller a posteriori har en formodning om, at virkningen af et givet pesticid kan beskrives via en parametrisk funktionel sammenhæng, enten lineær eller ikke-lineær. Når man udfører en toksicitetstest af et pesticid i et passende stor doseringsområde vil data ofte have et ikke-lineært forløb, når responset bliver afbildet som funktion af dosis. Med undtagelse af specielle områder inden for toksikologi og økotoksikologi er der enten tale om monotont stigende eller faldende doseringskurver med asymptotiske, øvre og nedre grænser (Finney 1978). Med andre ord kan vi sige, at ved at bruge regressionsanalyse - ofte ikke-lineær - til at beskrive en dosis-responskurve, antager vi, at der altid er en virkning af et stof uanset hvor lille dosering man benytter. Altså strider definitionen af NOEC og LOEC (at der findes en dosis som ingen virkning har (NOEC) og en dosis som netop har en virkning (LOEC)) mod regressionsanalysens forudsætninger. Hvis man vil definere et nul-effekt niveau (ofte anvendt som en tilnærmelsesvis NOEC eller LOEC) ud fra dosis-responskurver, skal man derfor definere et vist responsniveau, som ud fra et videnskabeligt eller administrativt synspunkt anses for acceptabelt til at beskrive, at der ikke er en effekt.
3 Semi-parametrisk model: Den tredje metode er at benytte semi-parametriske dosis-responsmodeller. Her har man ingen a priori opfattelse af givne parametriske sammenhænge eller kun vage forestillinger om sammenhæng mellem respons og dosis.
Variation i testresultater er en naturlig del af et bioassay. Den systematiske variation, der beskrives af dosis-respons sammenhænge, skyldes virkningen af et stof på en organisme, mens den resterende variation kan skyldes en lang række årsager, for eksempel genetisk variation mellem individer, opvækstvilkår for forsøgsorganismer, variation i forsøgsbetingelserne og sidst, men ikke mindst, målefejl og -unøjagtigheder. Ved hjælp af forsøgsplaner, der skal afbøde uvedkommende systematisk indvirkning på responsen, vil et veltilrettelagt dosis-responseksperiment tage hensyn til en lang række af de faktorer, der giver anledning til variation (Finney, 1978; van Leeuwen & Hermens, 1995). For at minimere den tilfældige variation har nationale og internationale standardiseringsorganisationer, (Dansk Standard, OECD, ISO m.fl.) givet retningslinier for datakrav, og som hovedregel er der krav om, at bioassay til registreringsformål udføres af autoriserede GLP laboratorier (Good Laboratory Practice).
Med højerestående dyr benytter man som regel kun få doseringer (f.eks. 3 doseringer) af såvel økonomiske som dyreetiske årsager. Yderligere har der været en stor indsats for at substituere dyreforsøg med alternative metoder (ECVAM http://ecvam.jrc.it/index.htm European Centre for Valuation of Alternative Methods) ved at benytte surrogatorganismer/dele af organismer, hvis reaktioner på pesticidpåvirkning er højt korreleret med en given dyregruppes påvirkning. For at styrke fortolkningen af resultater fra dyreforsøg, vil man ofte supplere disse med et batteri af cellebaserede og enzymbaserede laboratorietest, der målrettet kan undersøge for forskellige effekter og virkemekanismer. I denne forbindelse kan bl.a. nævnes gentoksiske og hormonlignende effekter (ISO 13829 1997; Soto et al. 1995). For planter og mikroorganismer er det sjældent etiske overvejelser eller prisen på forsøgsindivider, der sætter en grænse for størrelsen af et assay, men derimod pladsmangel. F.eks. antallet af brønde i titerplader, plads i vækstkamre og lysforhold, etc.
Uanset hvad man måler er spørgsmålet om nøjagtighed og præcision afgørende for tolkningen af resultaterne. Da disse to begreber ofte sammenblandes eller ikke bruges konsekvent har vi i Figur 1.1 illustreret hvordan ordene ”nøjagtighed” og ”præcision” vil blive anvendt i denne rapport. Nøjagtighed er således stort set uafhængig af statistik, og drejer sig udelukkende om det er den ”sande værdi” man måler. Det kan være en måleparameter i sig selv eller en værdi afledt af en måleparameter. Viden om den værdi man ønsker at måle er derfor afgørende nødvendig, og kan ikke erstattes af statistiske metoder. Præcision er derimod et mål for variationen af en given måling eller af en værdi afledt heraf. Det er netop præcisionen, der kan forbedres ved at lave et veltilrettelagt bioassay, hvor man tager højde for ydre og indre variationsårsager i selve forsøgsplanen. Figur 1.1 viser, at præcision og nøjagtighed ikke nødvendigvis hænger sammen. Det kan skyldes, at man ikke måler, det man tror man måler. Andre gange er det et bevidst valg, fordi man vælger en respons, der er nem at måle og som formodes at være højt korreleret med den respons, man anser for vigtig.
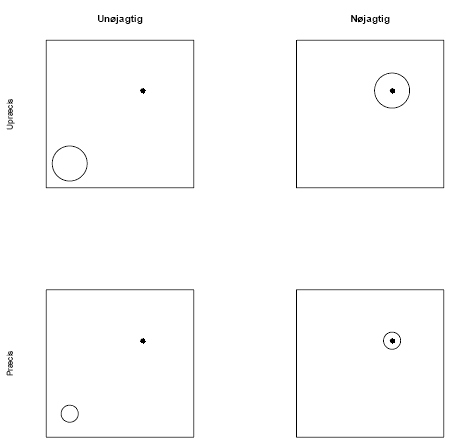
Figur 1.1 Sammenhængen mellem nøjagtighed og præcision. Det sorte punkt illustrerer den sande værdi, som kan være en parameter eller en afledning heraf. Størrelsen af cirklen illustrerer præcisionen som for eksempel kan være givet ved et konfidensinterval.
1.1 Problemstilling og afgrænsning
Dette projekt er målrettet mod at beskrive dosis-respons ved hjælp af parametriske ikke-lineære regressionsmodeller. Projektets formål er at komme med retningslinjer for korrekt og tidssvarende statistiske analyser af toksicitets- og økotoksicitetsdata under anvendelse af allerede eksisterende data fra forsøg udført af projektdeltagerne i forskellige projekter rettet mod kvantificering af både pesticiders og andre biologisk aktive stoffers human- og økotoksikologiske virkninger. Projektets vil hermed kunne give såvel toksikologer/økotoksikologer som administrative brugere af testresultater et indblik i de metoder, der er udviklet i de sidste år indenfor analyser af bioassay.
Rapporten er fokuseret på parametriske regressionsmodeller og de problemstillinger, som projektgruppens medlemmer i praksis har identificeret gennem deres arbejde med bioassays. En del af de problemstillinger, man ofte kommer ud for, når man analyserer bioassays, er nævnt i nedenstående tabel 1.1. Det skal dog understreges, at der ikke er tale om en udtømmende liste og at de nævnte problemstillinger ikke er isolerede, men ofte griber ind i hinanden.
Tabel 1.1. Identificerede problemstillinger ved statistisk analyse af resultater fra bioassays.
| Problemer, der er uafhængige af typen af respons |
| Sammenligning af ED/EC-værdier |
| Design af bioassay:Flere doseringer kontra flere replikater |
| Modelvalgets indflydelse på estimater for EC-værdier |
| Analyse af kontinuert respons |
| Variansheterogenitet |
| Justering for variation fra kurve til kurve |
| Analyse af binomialt respons |
| Analyse af binomialfordelt respons med modeller for kontinuert respons |
| Tests for ”Lack of fit” |
| Semi- og ikke-parametrisk dosis-respons-modellering |
| Forskellige eksempler |
| Øvre og nedre asymptoter |
| Forskellige endpoints |
| Modificerede respons kurver |
| To-generationsreproduktionsforsøg |
Nogle de problemstillinger, som projektet indledningsvist havde identificeret er ikke eksplicit blevet behandlet i nærværende rapport: NOEC/LOEC-problematikken er således ikke behandlet yderligere, men det skal dog nævnes, at netop anvendelsen af variansanalyse og afhængigheden af et godt testdesign, har medført en så udtalt kritik af brugen af NOEC/NOEL og tilsvarende LOEC/LOEL til fortolkning af såvel toksikologiske som økotoksikologiske resultater (f.eks. Laskowski, 1995 og Kooijman, 1996), at vi finder disse parametre uanvendelige set fra et videnskabeligt synspunkt. Det har i løbet af projektet ikke været muligt at fremskaffe data, som var anvendelige til at illustrere variabilitet dosis, som er den uafhængige variabel, selvom denne variabilitet er særdeles vigtig ved analyse af bioassays. Ligeledes har vi i projektet afgrænset os fra at inkludere analyser af tidsserier, da der i projektgruppen ikke var rådighed over data som på passende vis kunne anvendes til at adressere dette problem. Med hensyn til problematikken om øvre og nedre grænse i bl.a. kombinationsforsøg vil vi henvise til (Ritz et al, 2005).
De problemstillinger, der bliver behandlet i denne rapport vil således afspejle gruppens arbejde med bioassays inden for forskellige discipliner. I rapporten har vi valgt først at se på de mere generelle og teoretiske statistiske aspekter af databehandling og fortolkning af bioassays for derefter at give praktiske eksempler, der skal tjene til at illustrere de teoretiske overvejelser.
Version 1.0 Oktober 2008, © Miljøstyrelsen.