Udvikling af analysemetode til bestemmelse af peroxider, tilstede eller frigjort i tandblegeprodukter
3 Udvikling og test af katalase bioassay til bestemmelse af peroxider
- 3.1 Teknisk design af målekammer, elektrode og dataopsamling
- 3.2 Fastlæggelse af optimale betingelser for katalase bioassay
- 3.3 Afprøvning af katalase bioassayet på peroxider i ren form
Der er som et led i projektet blevet konstrueret et målekammer som har gennemgået en serie tests for tæthed og målestabilitet. Dernæst er der blevet gennemført en metodeindkøring, hvor
- den optimale mængde aktiv stof (peroxid) er fastlagt
- den optimale mængde enzym er fastlagt
- den hensigtsmæssige reaktionstid er kortlagt
- den optimale pH er identificeret
På baggrund af denne forsøgsserie foreslås en protokol til måling af peroxid i tandblegeprodukter. Protokollen er efterfølgende blevet afprøvet på forskellige tandblegeprodukter indkøbt i detailhandlen.
3.1 Teknisk design af målekammer, elektrode og dataopsamling
Der er benyttet et iltmåle- og regulatorsystem designet og fremstillet i samarbejde med Loligo Systems, Tjele, Danmark. Systemet består af et reaktionskammer af glas med kendt volumen (103-107,5 ml) og akryllåg med port (18 mm diameter) til en iltelektrode samt 2 små porte (0,92 mm diameter) til injektion af prøvemateriale. I målekammeret findes en glascoatet magnet som ved omrøring (1000 rpm) sikrer en ensartet opblanding af alle komponenterne under reaktionen og iltmålingen.
Figur 1: Opstilling til katalase bioassay.

Iltmålingerne foretages med en galvanisk iltelektrode (MINI-DO, Oxyguard, Birkerød) monteret i glaskammerets låg. Elektroden har en maksimal måleusikkerhed i følge specifikationerne på +/- 1 % af den målte værdi. Data opsamles hvert sekund ved hjælp af datalogger (fra Measurement Computing, MA, USA) og overføres til Windows-baseret software (TracerDAQ) til online måling af iltudviklingen.
Elektrodens specifikationer er vedlagt i Bilag 1 og ordre-oversigt fra Loligo Systems findes i Bilag 2.
3.1.1 Forsøgsopstilling
Ved målingens start fyldes glaskammeret med kvælstof gennemboblet autoklaveret fosfatbuffer (pH = 7), hvorefter akryllåget med ilt-elektroden monteres. Fjernelse af ilten i bufferen ved kvælstof-gennembobling sikrer, at iltudviklingen kan følges uden risiko for bobledannelse p.gr.a. overmætning i kammeret. Bufferen steriliseres ved autoklavering ligesom udstyret steriliseres ved afspritning for at forhindre at biologisk iltforbrug under kørslen påvirker måleresultatet. Enzymet katalase (Sigma-Aldrich, katalognummer C100) tilsættes nu i kendt mængde. I alle forsøgene er det tilsat ca. 5000 units katalase til forsøgskammeret (1 unit nedbryder 1 µmol H2O2 pr. min. ved 25 °C). Umiddelbart inden målingen påbegyndes, tilsættes en kendt mængde peroxid eller tandblegemiddel. Da ilts opløselighed i væske er temperaturafhængig er alle målinger foretaget ved samme temperatur (22 °C) i et airconditioneret rum. Til forsøgene er der anvendt 4 replikate forsøgskamre. Ved de endelige udregninger er der korrigeret for de små variationer i kammervolumen.
3.1.2 Test af elektrodens stabilitet
Forud for et måleforløb foretages der en 2-punkts-kalibrering af elektroden med 0 % iltmætning (opløsning af natriumsulfit) og 100 % luftmætning (buffer gennemboblet med luft) som de to yderpunkter. En sammenligning mellem elektrodens udslag målt i volt (V) ved uafhængige kalibreringer foretaget over 20 dage demonstrerer en stor elektrode-stabilitet, idet afvigelsen er mindre end 1 % af gennemsnitsværdien (Tabel 1).
Tabel 1. Stabilitet af ilt-elektroden testet ved at måle output (Volt) ved 0 og 100 % iltmætning (n = 20).
| Elektrode output | ||
| Iltmætning, % | Gennemsnit (V) | Variationskoefficient (%) |
| 0 | 0,9913 | 0,3026 |
| 100 | 4,9511 | 0,4726 |
3.1.3 Test af reaktionskammerets tæthed
For at forhindre tab af ilt under målingen, og modsvarende forhindre luft i at trænge ind i reaktionskammeret, er det vigtigt at reaktionskammer og elektrode udgør en tætsluttende enhed.
For at demonstrere tætheden af systemet er en række forsøg gennemført, hvor kammeret er samlet med hhv. 75, 22 og 1,5 % luftmættet vand og iltniveauet herefter fulgt i 18-20 timer (Figur 2).
Figur 2: Reaktionskammerets tæthed og egetforbrug af ilt.
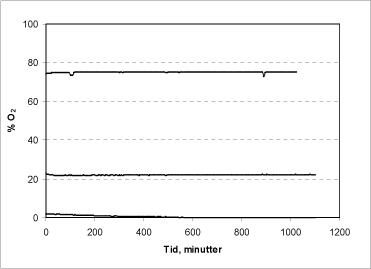
I forsøgene med den lave koncentration (1,5 %) begynder iltniveauet efter ca. 2 timers reaktionstid at falde ret hurtigt, og alt ilt er forbrugt i løbet af 10 timer. Dette skyldes sandsynligvis et mikrobielt forbrug af ilt, da målingen i dette tilfælde ikke blev gennemført under sterile forhold. I de efterfølgende måleserier (22 og 75 %) og i alle efterfølgende målinger er væsken forinden steriliseret og kamrene aftørret med sprit for at minimere denne usikkerhedsfaktor. Ved de høje ilt-koncentrationer opretholdes et helt stabilt niveau igennem hele måletiden, hvilket viser, at kamrene er tætte, og at systemet i øvrigt ikke har noget væsentligt egetforbrug af ilt under målingen.
3.2 Fastlæggelse af optimale betingelser for katalase bioassay
Indkøring af metoden er sket ved anvendelse af enten brintperoxid og ureaperoxid i kendte mængder og i ren form. Disse to stoffer er i dag de hyppigst anvendte peroxider i tandblegemidler. Herudover er metoden afprøvet på yderligere 4 rene stoffer, der også anvendes i tandblegemidler. Det drejer sig om natriumperborat-monohydrat, natriumperborat-tetrahydrat og natriumpercarbonat, der i reaktionsmønster minder om brintperoxid og ureaperoxid, samt calciumperoxid der er lidt anderledes, idet dets reaktion med vand er meget pH-afhængig.
3.2.1 Test af metodens optimale måleområde og nedre detektionsgrænse.
Der er lavet en forsøgsserie med varierende koncentrationer af både brintperoxid (50, 150 og 170 µl af en 1 % opløsning tilsat reaktionskammeret) og ureaperoxid (100, 250 og 500 µl af en 1 % opløsning), for at fastslå metodens optimale måleområde (Figur 3 og 4).
Figur 3: Iltudvikling i reaktionskammeret ved tilsætning af henholdsvis 50, 150 og 170 µl af en 1 % brintperoxidopløsning.
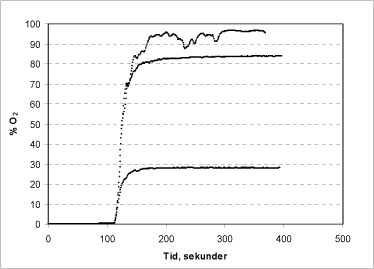
Figur 4: Iltudvikling i reaktionskammeret ved tilsætning af 100, 250 og 500 µl af en 1 % ureaperoxidopløsning.
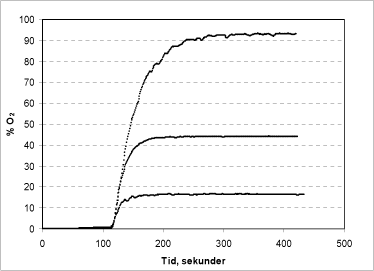
Ved tilsætning af katalase efter 110 sek. ses en meget hurtig iltudvikling på grund af enzymets spaltning af brintperoxid (Figur 3). Ved den pågældende mængde enzym er den tilstedeværende brintperoxid omdannet til ilt og vand på mindre end 1½ minut, hvilket resulterer i en iltmætning på hhv. 28,1 %, 83,9 % og 96,4 % i glaskammeret. Det bemærkes, at tilsætning af 170 µl brintperoxid resulterer i et ustabilt signal, hvilket sandsynligvis skyldes dannelse af bobler omkring elektrodens overflade som forstyrrer målingen. Bobledannelsen skyldes formentlig at ligevægten mellem opløst og frit ilt ikke kan opretholdes under den voldsomme momentane reaktion og iltudvikling. Da målemetoden forudsætter at ilten forbliver opløst i væsken, er det vigtigt at tage højde for dette – for eksempel ved at tilstræbe et forsøgsdesign, hvor den udviklede mængde ilt svarer til mindre end 80 % af iltmætningen. Alternativt kan mindre mængde enzym tilsættes, hvorved reaktionen vil forløbe langsommere.
Tilsætning af ureaperoxid resulterer i en lidt langsommere iltudvikling, formentlig fordi peroxiden her er bundet i et urea-kompleks, hvorfra den løbende frigives under den enzymatiske nedbrydning af den frie peroxid (Figur 4). Det tager således op til 5 minutter at omsætte den tilsatte ureaperoxid, afhængigt af de tilsatte mængder. Det ses også, at problemet med ustabilt signal ved høj iltudvikling er mindre, sandsynligvis fordi iltudviklingen foregår over et længere tidsrum. Som det ses af Fig. 4, er der en direkte proportionalitet mellem tilsat mængde ureaperoxid og iltudvikling.
Ved sammenligning af Figur 3 og 4 ses et generelt lavere signal ved analyse af ureaperoxid (Figur 4). Dette skyldes, at brintperoxid kun udgør ca. 35 % af vægten i ureaperoxid-molekylet. Det vil sige, at der fra en ureaperoxid-opløsning kun kan frigives ca. 35 % af den iltmængde, der kan frigives fra en brintperoxid-opløsning af samme koncentration.
3.2.1.1 Vurdering af den nedre detektionsgrænse for katalase bioassayet.
Ifølge lovgivningen på kosmetikområdet (bekendtgørelse 422 af 4. maj 2006, bilag 3) er den højest tilladte koncentration af brintperoxid i mundplejemidler 0,1 % tilstede eller frigjort.
Katalase bioassayet er meget følsomt, og det er muligt at måle præcist indhold af peroxid i en prøve, når iltudviklingen holdes mellem 1og 80 % af kammerets iltmætning.
På baggrund af de testede tandblegeprodukter (afsnit 4) vides, at der maksimalt vil kunne opløses 10 g produkt i reaktionskammeret (100 ml). Da ureaperoxid indeholder den laveste peroxid-mængde (vægtprocent), benyttes dette stof som baggrund for vurdering af nedre detektionsgrænse.
Som vist på Figur 4 vil tilsætning af 100 µl 1 % ureaperoxid til reaktionskammeret resultere i en iltudvikling svarende til 17,5 % af reaktionskammerets iltmætning. Tilsætning af 100 µl 0,1 % vil derfor resultere i ca. 1,75 % af kammerets iltmætning.
Tilsættes nu i stedet 10 g (~10.000 µl) af et tandblegeprodukt med et indhold på 0,1 % ureaperoxid vil dette resultere i 175 % af kammerets iltmætning. Et nøjagtigt resultat kan imidlertid opnås ned til en iltmætning i reaktionskammeret på 1 %, hvilket vil svare til tilsætning af 10 g af et tandblegeprodukt med et indhold på 0,00057 % ureaperoxid.
For målinger af tandblegeprodukter er den nedre detektionsgrænse for katalase bioassayet således 0,0006 % ureaperoxid svarende til 0,0002 % brintperoxid.
3.2.2 Test af katalasens stabilitet
Enzymets stabilitet, pH-følsomhed og reaktionsevne blev kortlagt gennem en række forsøg. I et første forsøg blev peroxid og katalase gentagne gange tilsat det samme reaktionskammer (Figur 5).
Figur 5: Gentagen tilsætning af H2O2 og ureaperoxid til reaktionskammeret. Pil 1+2 angiver tilsætning af 5000 units katalase. Pil 3 angiver tilsætning af 100 µl 1 % ureaperoxid, mens pil 4 angiver tilsætning af 50 µl 1 % brintperoxid. Ved pil 5 afsluttes forsøget og elektroden overføres til en udgasset phosphat-buffer.
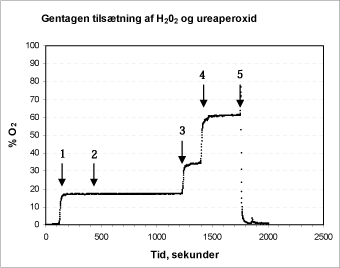
I forsøget er der fra start tilsat 100 µl 1 % ureaperoxid. Ved tilsætning af katalase (pil 1, Figur 5) forløber reaktionen forløber fuldstændig som forventet med stabilisering af signalet indenfor 1 min. Ved yderligere tilsætning af katalase (pil 2) forbliver signalet stabilt. Dette viser, at den første reaktion er forløbet til ende, og at der derfor har været tilstrækkelig mængde aktivt enzym i systemet. Ved tilsætning af 100 µl 1 % ureaperoxid (pil 3 + 4) stiger iltniveauet straks som forventet. Dette demonstrerer, at den tilsatte mængde enzym fortsat er aktivt. Efter 9 min (1750 s) ses et kraftigt udslag i signalet, idet elektroden tages op af testkammeret og overføres til den udgassede buffer-opløsning, hvorefter signalet igen stabiliserer sig på ca. 1,5 % iltmætning.
3.2.2.1 Test af varierende katalase koncentration
Tilsætning af stigende mængder katalase øger hastigheden hvormed peroxiden spaltes til ilt og vand, men har ikke betydning for bestemmelsen af peroxidmængden (Figur 6).
Figur 6: Katalase-koncentrationens betydning for reaktionshastigheden. Der er tilsat henholdsvis 50 (1); 100 (2); 500 (3); 1250 (4); 5000 (5) og 10.000 (6)units katalase.
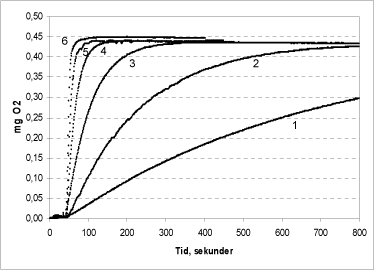
Forsøgene vist i Figur 6 er udført i triplikat ved pH 7. Der er tilsat samme mængde (250 µl) 1 % ureaperoxid i alle forsøg. Ved tilsætning af 10.000 katalase-units sker reaktionen omgående og al peroxid spaltes på mindre end ½ minut. Mindskes katalase-tilsætningen falder hastigheden. Ved tilsætning af 1250 katalase-units spaltes al peroxid indenfor 1½ minut. Selv ved meget lave katalase-koncentrationer i kammeret forløber reaktionen dog til ende inden for 60 minutter og den endelige ilt-produktion er som forventet ens i alle forsøg. Tilsvarende forløb er set for brintperoxid (data ikke vist). Udfra disse data anbefales tilsætning af 5000 units pr. reaktion.
3.2.2.2 Katalasens holdbarhed
Katalase købes i vandig opløsning med en koncentration på omkring 1.379.400 units/ml. Som brugsopløsning anvendes en fortynding på 140.000 units/ml i 50 mM phosphat-buffer. I et forsøg på at undersøge katalasen holdbarhed, blev en brugsopløsningen delt i to, hvoraf den ene halvdel blev opbevaret i køleskab ved 4 °C, mens den anden halvdel blev anbragt ved ca. 20 °C (stuetemperatur). Efter 0, 1, 2, 3, 7, 50 døgn blev opsat standardforsøg ved pH = 7. Til kammeret blev tilsat katalase (5000 units) og 100 µl brintperoxid (1 %) svarende til en teoretisk iltudvikling på 0,5377 mg.
Tabel 2: Katalasens holdbarhed i opløsning ved 4 °C og 20 °C
| Tid døgn |
Opbevaringstemperatur °C |
Produceret O2 mg |
| 0 | 20 | 0,5299 |
| 1 | 4 | 0,5158 |
| 1 | 20 | 0,5255 |
| 2 | 4 | 0,5256 |
| 2 | 20 | 0,5277 |
| 3 | 4 | 0,5212 |
| 7 | 4 | 0,5341 |
| 7 | 20 | 0,5349 |
| 50 | 20 | 0,5350 |
Holdbarheden af brugsopløsningen under opbevaring ved 4 °C og 20 °C er meget lang. Som det fremgår af Tabel 2, var katalase-aktiviteten således efter 50 døgns opbevaring ved 20 °C stadig på samme niveau som umiddelbart efter fremstilling af brugsopløsningen. Selve reaktionshastigheden var heller ikke påvirket af den lange opbevaring (data ikke vist).
3.2.2.3 Katalase-aktivitetens afhængighed af pH i bufferen
Frigivelse af peroxid fra releaseren calciumoxid er pH-afhængig. Det er derfor relevant at teste metodens pH følsomhed. Katalase har et pH optimum på omkring 7, hvilket svarer til fysiologisk pH i de fleste celler. Afvigelser i pH vil medføre ændringer i enzymets konfiguration, hvilket mindsker enzymets aktivitet.
Figur 7: Katalasens effektivitet ved pH 4, 6, 7 og 10.
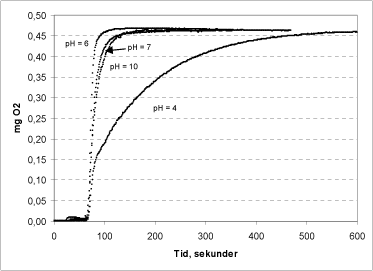
Katalasens pH afhængighed blev undersøgt i en serie forsøg, hvor pH i bufferen i reaktionskammeret varierede fra 4-10 (Figur 7). Alle forsøgene blev udført i triplikat, og pH i kammeret målt både før og efter reaktionen.
Variation i bufferens pH indenfor intervallet 4-10 påvirker reaktions-hastigheden, men ikke det målte iltniveau ved reaktionens afslutning (Figur 7). Reaktionen forløber hurtigst ved pH 6, hvor al peroxid er omdannet til ilt indenfor ½ minut. Ved pH 7 og 10 falder reaktionshastigheden, således at al peroxiden først er omsat efter 1½ min. Sænkes pH til 4 sker der et drastisk fald i enzymaktiviteten, og reaktionen er først løbet til ende efter ca. 10 minutter.
3.3 Afprøvning af katalase bioassayet på peroxider i ren form
Katalase bioassayet blev testet på forskellige peroxider med henblik på at få bekræftet et sammenfald mellem det målte og det forventede peroxidindhold i de anvendte opløsninger. Derudover blev metodens reproducerbarhed testet i en serie uafhængige forsøg som grundlag for en beskrivelse af metodens præcision ved anvendelse på de respektive peroxider.
3.3.1 Brint- og ureaperoxid
Katalase bioassayet er blevet anvendt på en række forskellige koncentrationer af brint- og ureaperoxid i ren form, hvor resultatet enten er sammenlignet med det forventede i henhold til produktspecifikationen (ureaperoxid) eller med mængden fundet ved KMnO4- titrering. Det sidste var nødvendigt med brintperoxid på grund af stoffets ustabilitet ved opbevaring og dermed usikre angivelse af indholdet fra producentens side. Aflæsningerne af elektrodesignalet er ved alle målingerne foretaget efter 300 sekunder (5 minutter) efter tilsætning af katalase.
Figur 8: Sammenhæng imellem den potentielle ilt-frigivelse beregnet på baggrund af en KMnO4 titrering (åbne symboler) og bestemt ved tilsætning af en varieret mængde H2O2 til katalase bioassayet (sorte symboler). På begge akser vises procent af bufferens iltmætning efter reaktionens afslutning.
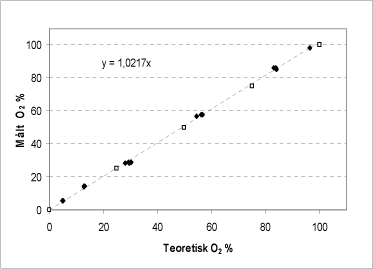
Der er en fuldstændig lineær sammenhæng mellem den forventede iltudvikling beregnet på baggrund af en redoxtitrering og iltudviklingen bestemt ved katalase bioassayet for hele måleområdet (Figur 8). Katalase bioassayet er dermed anvendeligt til brintperoxid-bestemmelse inden for hele det måleinterval som afgrænses af bufferens iltmætning. Ifølge produktoplysningerne var koncentrationen af den indkøbte brintperoxid angivet til 30 %. KMnO4–titrering bestemte koncentrationen til 34,4 % med en standardafvigelse på 0,2 (n=4) mens katalase bioassayet bestemte koncentrationen til 33,6 med en standardafvigelse på 0,7 (n=14).
Figur 9: Sammenhæng imellem den teoretisk mulige ilt-frigivelse beregnet ud fra producentens oplysninger om stoffets renhed (åbne symboler) og bestemt ved tilsætning af en varieret mængde ureaperoxid til katalase bioassayet (sorte symboler). På begge akser vises procent af bufferens iltmætning efter endt reaktion.
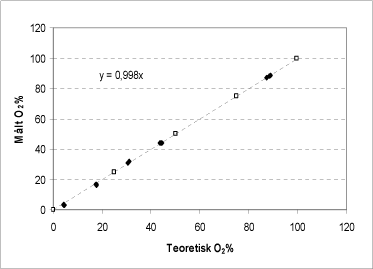
For ureaperoxid ses ligeledes en fuldstændig overensstemmelse mellem den målte og den teoretisk mulige iltudvikling beregnet ud fra tilsat mængde stof (Figur 9). På den baggrund konkluderes, at al den bundne peroxid frigives fra den tilsatte ureaperoxid og spaltes af katalase-enzymet indenfor den pågældende måleperiode. Producenten opgiver koncentrationen af ureaperoxid til 97 % mens katalase bioassayet bestemte koncentrationen til 97,4 % med en standardafvigelse på 0,9 (n=12). På baggrund af KMnO4 og S2O3-titrering blev ureaperoxid indholdet bestemt til henholdsvis 95,83 % med en standardafvigelse på 0,4 (n=3) og 99,17 % med en standardafvigelse på 0,3 (n=3), hvilket afviger noget fra producentens angivelser og bestemmelsen ved hjælp af katalase bioassayet.
3.3.2 Calciumperoxid
Calciumperoxid har ved fysiologisk pH (pH=7) en meget lav opløselighed i vand (<0,01 % v. 20 °C), og calciumperoxid indgår i forskellige reaktioner med vand afhængigt af pH. Opløseligheden af calciumperoxid stiger med faldende pH og under dannelse af frit brintperoxid. Mængden af dannet brintperoxid afhænger helt af pH.
Ved at benytte katalase bioassayet til løbende spaltning af den dannede brintperoxid, sikres en maksimal frigivelse af ilt fra calciumperoxiden, forudsat at assayet udføres inden for det pH-spektrum hvor calciumperoxid afgiver brintperoxid. Selve katalase bioassayet blev tidligere demonstreret i stand til at nedbryde brintperoxid inden for et pH-interval mellem 4-10 (Figur 7).
Med henblik på at fastlægge den optimale pH for analyse af produkter indeholdende calciumperoxid, blev der udført en serie forsøg hvor pH i blev varieret fra 4-10. Til hvert forsøg blev tilsat 1 mg calciumperoxid opslemmet i vand. Calciumperoxid har ifølge producenten (Sigma, MA USA) en renhed på 75 %. Dermed vil 1 mg calciumperoxid maksimalt kunne frigøre 0,16647 mg O2. Genfindingsprocenten er herefter beregnet ud fra formlen:
(mg O2 produceret/ 0,16647 mg) x 100 = genfinding (%)
Iltudviklingen er fundet ved aflæsning af den producerede mængde ilt efter 10 minutter, da signalet endnu ikke var stabiliseret efter 5 minutter. Alle forsøg er udført i 3-6 gentagelser og pH i reaktionskammeret er målt både før og efter forsøget.
Figur 10: Sammenhæng mellem ilt-produktionen (procent af maximalt mulige) fra calciumperoxid som funktion af pH.
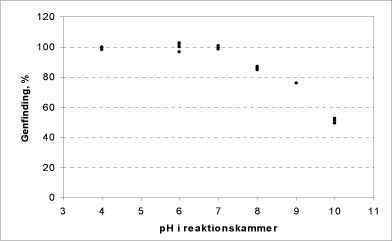
Ved høj pH er iltudviklingen fra calciumperoxid lavere end ved de optimale pH-værdier omkring 6-7 (Figur 10).
Calciumperoxid kræver lav pH (surt miljø) for at kunne bringes på en opløst form. For at undersøge om pH i den calciumperoxid-opløsning der tilsættes reaktionskammeret har betydning for analysens resultat, blev der tilsat 1 mg calciumperoxid opslemmet i vand (pH = 11,2) henholdsvis i en H2SO4 -opløsning med en pH værdi på 2,0. pH i selve målekammeret blev fastholdt på 7,0 ved hjælp af phosphat-bufferen.
Figur 11: Sammenhæng mellem reaktionshastighed og pH i calciumperoxid stamopløsningen.
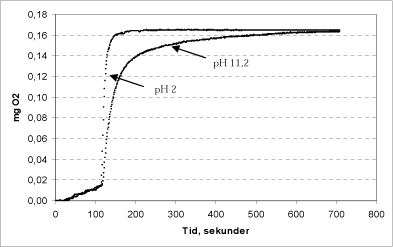
Det ses af Figur 11, at reaktionshastigheden er størst når calciumperoxid tilsættes efter at være opløst i en H2SO4 –opløsning ved pH 2. Her sker iltudviklingen momentant ved tilsætning af katalase, og reaktionen forløber helt til ende indenfor 1 minut. Injiceres i stedet en opslemning af calciumperoxid i vand med pH 11,2, foregår reaktionen noget langsommere, men ender på fuldstændig samme niveau efter 10 minutter. Denne forskel skyldes dels, at calciumperoxid ved den lave pH allerede har frigivet den samlede brintperoxid-pulje, og dels at tilsætningen af calciumperoxid i uopløst form sænker hastigheden for frigivelsen af brintperoxid til væskefasen.
3.3.3 Natriumperborater og natriumpercarbonat
Traditionelt har natriumperborate-monohydrat, NaBO3·H2O (CAS nr. 10332-33-9) og natriumperborate-tetrahydrat, NaBO3·4H2O (CAS nr. 10486-00-7) været brugt som blegemidler i vaskemidler. Indenfor de seneste år, er natriumperborat også taget i brug i tandblegemidler. Modsat produkterne indeholdende brintperoxid og ureaperoxid findes natriumperborater herhjemme kun i produkter der benyttes af tandlæger. Brintperoxid releaseren natriumpercarbonat findes endnu ikke i tandblegeprodukter som anvendes i Danmark (1, 8).
Peroxid-dannelsen og iltudviklingen fra de to natriumperborater og natriumpercarbonat blev testet. De to perborater adskiller sig ved at have en forskellig mængde krystalvand bundet. Natriumperborat-monohydrat kan teoretisk frigive brintperoxid svarende til 34 % af molekylevægten, mens natriumperborat-tetrahydrat afgiver brintperoxid svarende til 22 % af molekylevægten. Natriumpercarbonat kan potentielt frigive en brintperoxid andel svarende til 28 % af stoffets molekylvægt. Disse andele indgår i beregningen af genfindingsprocenten efter iltdannelsen i katalase bioassayet.
Der blev for alle tre stoffer lavet en forsøgsserie med fire gentagelser. pH var justeret til 7, og der blev injiceret 100 – 250 µl af en 1 % opløsning af de tre stoffer. Signalet var i alle tilfælde stabiliseret inden for ca. 2 minutter, resultaterne blev aflæst efter 5 minutter og iltmængden anvendt til beregning af genfindingsprocenterne (se Tabel 3).
Tabel 3: Genfinding – natriumperborater og natriumpercarbonat.
| Kemikalie | Teoretisk O2, mg |
Målt O2, mg |
Genfinding, % |
Gennemsnit | Standard- afvigelse |
n |
| Natriumperborat- monohydrat |
0,400 | 0,408 | 102,00 | 102,56 | 0,8260 | 4 |
| 0,400 | 0,414 | 103,50 | ||||
| 0,400 | 0,407 | 101,75 | ||||
| 0,400 | 0,412 | 103,00 | ||||
| Natriumperborat- tetrahydrat |
0,259 | 0,270 | 104,17 | 104,07 | 1,4564 | 4 |
| 0,259 | 0,275 | 106,10 | ||||
| 0,259 | 0,267 | 103,01 | ||||
| 0,259 | 0,267 | 103,01 | ||||
| Natriumpercarbonat | 0,143 | 0,143 | 100,00 | 100,03 | 0,9207 | 4 |
| 0,359 | 0,361 | 100,70 | ||||
| 0,359 | 0,361 | 100,70 | ||||
| 0,359 | 0,354 | 98,74 |
Som det fremgår af tabellen er der for natriumperborat-monohydrat og natriumperborat-tetrahydrat god overensstemmelse mellem det fundne og det teoretiske peroxid-indhold. Genfindingsprocenterne afviger i alle tilfælde mindre end 1,5 %.
3.3.4 Oversigt over genfindingsprocenter samt præcision på de forskellige peroxider målt i katalase bioassayet
Den udviklede metode er blevet valideret på en række forskellige peroxider i ren form (Tabel 4):
Tabel 4: Genfindingsprocenter for rene peroxid-forbindelser.
| Aktiv stof | Mængde tilsat mg |
Genfinding (%) |
Standard- afvigelse (%) |
n |
| Brintperoxid a) | 0,25-1,0 | 100,18 | 1,5908 | 14 |
| Ureaperoxid | 0,25-2,5 | 100,48 | 0,8915 | 12 |
| Calciumperoxid, pH 7 | 1,0 | 98,79 | 1,8686 | 8 |
| Natriumperborat, 1 H2O | 2,5 | 102,56 | 0,8260 | 4 |
| Natriumperborat, 4 H2O | 2,5 | 104,07 | 1,4564 | 4 |
| Natriumpercarbonat | 1-2,5 | 100,03 | 0,9207 | 4 |
a): Genfinding af brintperoxid er beregnet med udgangspunkt i koncentrationen i stamopløsningen fundet ved KMnO4-titrering.
Valideringen viste, at der for alle de testede stoffer var en meget fin overensstemmelse mellem den teoretiske og den målte iltudvikling. Genfindingsprocenterne afviger i alle tilfælde mindre end 1,9 %, hvilket dermed beskriver metodens usikkerhedsmargin under de valgte analysebetingelser.
Version 1.0 Marts 2009, © Miljøstyrelsen.