|
Forekomst af Legionella i varmvandssystem 7. PCR/Dyrkning
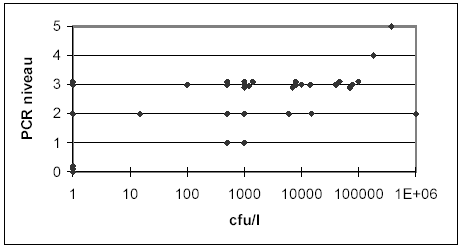
7.1 Legionella pneumophilaResultaterne for de to metoder er herunder præsenteret på to forskellige måder: A) I tabel 7.1.1 hvor PCR resultaterne for Legionella pneumophila er angivet fordelt efter de samme kimtalsintervaller, som er anvendt i figur 4.1.1 og B) i figur 7.1.1 hvor PCR resultater for Legionella pneumophila er angivet som niveauer som funktion af dyrkningsresultaterne. Af de i alt 35 analyserede vandprøver blev der med PCR påvist Legionella pneumophila i de 32, inklusive tre prøver der var negative ved dyrkning. De påviste niveauer fundet ved hhv. dyrkning og PCR var i overensstemmelse for 23 af de 35 vandprøver, idet der var mindre end 10 x forskel på niveauerne, for fem prøver var der ca. 10 x forskel på niveauet, og kun for i alt 7 prøver var der mere end 10 x forskel på niveauerne for de to metoder. Tabel 7.1.1
Figur 7.1.1 7.2 Legionella speciesI tre dyrkningsnegative vandprøver (HY51, HY52 og CH4P) blev der ikke påvist Legionella pneumophila, men i to af disse blev der påvist Legionella spp. (³ 103 genomer/l). Begge prøver var fra samme anlæg (HY- anden prøveudtagning). Ved dyrkning blev der ikke påvist Legionella spp. 7.3 KonklusionVed PCR for Legionella påvises både døde, levende og ikke-dyrkbare men levende bakterier. Alene af den grund kan man ikke forvente, at resultaterne for dyrkning og PCR vil være helt i overensstemmelse. Man kan formode, at det samlede antal af bakterier (døde, levende og ikke dyrkbare) kan være langt højere end det man kan påvise ved dyrkning. Fund af Legionella ved PCR fra dyrkningsnegative prøver er derfor en mulighed. Det kan f.eks. tænkes at Legionella opformeres i rørender eller i returløbet, for derefter at blive dræbt af det varmere vand i varmtvandsbeholderen. Vandet ved tapstederne kan således indeholde et stort antal døde celler. Dette kan måske være forklaringen på forskellen mellem resultaterne for PCR og dyrkning fra anlæg NANA, hvor der ikke blev påvist Legionella pneumophila ved dyrkning men ³ 104 ved PCR (to prøver efter instruks A og B). Returvandstemperaturen var her 46° C (evt. mulighed for vækst af Legionella), mens temperaturen i vand fra varmtvandsbeholder var 54° C (Legionella dør). Temperaturen ved tapstedet var også over 50° C, og anlægget var nyt (1 år). Det kan også formodes, at antallet af døde bakterier kan variere meget efter varierende driftsforhold for et givet anlæg, hvis f.eks. vandtemperaturen i et anlæg hæves til over 50° C eller der påbegyndes behandling med biocider, kan biofilmen nedbrydes, og store mængder af døde bakterier skylles ud fra tapstederne. Sænkes temperaturen igen, eller ophører biocidbehandlingen, kan der ske en reetablering af biofilmen. I denne fase vil man måske hverken påvise døde eller levende bakterier. Der er dog ingen grund til at tro at der er udført biocidbehandling eller temperaturgymnastik på disse anlæg i den periode, hvor prøverne blev udtaget. Et andet forhold, der kan bidrage til forskellige resultater for dyrkning og PCR, er, at man ved dyrkning ikke måler det faktuelle kimtal men derimod kolonidannende enheder (cfu). Det er langtfra sikkert, at hver koloni kun hidrører fra én kim, f.eks. kan en amøbevakuole indeholde over 1000 bakterier. Hvis den ikke ødelægges inden udsæd vil hele indholdet måske kun resulterer i én cfu. Ved PCR ville sådan en enkelt vakuole med bakterier kunne give en meget kraftig reaktion. I den anden retning trækker, at nogle vandprøver indeholder komponenter (f.eks. rust), der er mere eller mindre hæmmende for PCR reaktionen. I denne undersøgelse kunne alle vandprøverne analyseres ved PCR, da ingen af dem hæmmede reaktionen helt. Mindst én prøve (JA3P) var dog delvist hæmmende (bedømt på båndintensiteten for den interne kontrol). Dette var sandsynligvis forklaringen på, at resultatet for PCR med denne prøve var mere end 100 x lavere (103 - 104 genomer/l) i forhold til dyrkning, hvor der blev påvist ³ 4,9 x 106 cfu/liter. PCR-resultaterne kan således være såvel højere som lavere værdier end dyrkningsresultatet. Denne undersøgelse giver ikke noget entydigt svar på spørgsmålet, om PCR er anvendelig til påvisning af Legionella i vandprøver. Undersøgelsen viser dog, at PCR generelt ikke har problemer med at påvise Legionella i vandprøver, men til en bedømmelse af antallet af levende bakterier (og dermed potentielt infektiøse kim) er metoden ikke anvendelig.
|