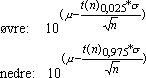|
Afgivelse af organisk stof fra polymere materialer - mikrobiel vækst 3 Udvikling af metodeProjektet tog udgangspunkt i, at fastlægge en metode til bestemmelse af polymere materialers eftervækstpotentiale udtrykt som stigningen i AOC i en vandfase i kontakt med materialet. Nedenfor er principperne for en ordinær AOC-bestemmelse gennemgået tillige med de parametre, der blev overvejet og undersøgt i forbindelse med at fastlægge en metode til at bestemme materialernes eftervækstpotentiale. Kapitlet afsluttes med en gennemgang af den endeligt benyttede metode. De undersøgelser, der blev udført for at afklare de forskellige parameters betydning, er gennemgået i kapitel 4 - 7. I Bilag A er angivet en oversigt over de materialer, der blev anvendt i projektets eksperimentelle arbejde. 3.1 AOC-metodenMetoden til at bestemme Assimilable Organic Carbon (AOC) blev udviklet i starten af 80'erne af hollænderen D. van der Kooij til at bestemme AOC i drikkevand, hvor koncentrationerne måles i mg/L. Metoden har været anvendt i vid udstrækning som uofficiel standard, og van der Kooij udgav i 1995 en detaljeret gennemgang af metoden /van der Kooij et al., 1995/. En variation af metoden er optaget i /Standard Methods, 1998/, men denne udgave skønnes ikke at være hensigtsmæssig i projektets sammenhæng, da den foreslåede arbejdsgang kan introducere større usikkerhed ved den enkelte bestemmelse, idet der anvendes serier af mindre testbeholdere i stedet for en enkelt testbeholder.
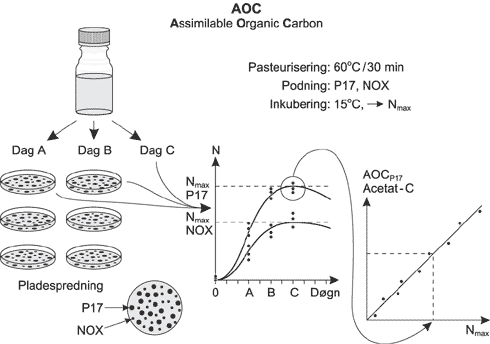
Figur 2: Metoden er et bio-assay, hvor en vandprøves AOC-værdi bestemmes ud fra det antal bakterier, der kan vokse op på de organiske kulstofforbindelser i prøven. Vandprøven tappes i en kulstoffri testflaske, og prøvens naturlige bakteriepopulation inaktiveres ved pasteurisering. Prøven podes efterfølgende med to bakteriestammer, Pseudonomas fluorescens, stamme P17 og Aquaspirillum, stamme NOX (tidligere kaldt Spirilum, NOX), der tilsammen kan omsætte langt størstedelen af de organiske kulstofforbindelser i drikkevand /van der Kooij et al., 1995/. Prøven inkuberes i mørke ved 15° C, og bakterieantallet følges over tid ved at bestemme kimtallet på R2A, et lavsubstrat medie specielt egnet til bestemmelser i næringsfattige miljøer (sammensætningen af R2A-agar er angivet i Bilag B). Vækstkurvernes maksimale bakterieantal omsættes til prøvens AOC-værdi udtrykt i mg acetat-C ækvivalenter/L ved brug af udbyttekonstanter for P17 og NOX på acetat. Udbyttekonstanterne for acetat-koncentrationer på 5-250 mg acetat-C/L er 4,1*106 CFU/m g acetat-C for P17 og 1,2*107 CFU/mg acetat-C for NOX /van der Kooij et al., 1995/. I Bilag C er AOC-metoden gennemgået detaljeret i den udgave, der dannede baggrund for projektarbejdet. I projektet blev der anvendt stammer af P17 og NOX tilsendt fra van der Kooij, KIWA. 3.2 MetodeovervejelserKontakten mellem materiale og vandfase kunne principielt etableres på to måder. Vandet kunne henstå i givne rørlængder, og derefter blive overføres til testflaskerne til AOC-bestemmelse, hvilket ville modsvare virkelige forhold. Alternativt kunne rørstykker henstå i testvand i testflaskerne, hvori AOC-bestemmelsen ville blive udført. Denne fremgangsmåde blev benyttet, da det derved også ville være muligt at anvende testmetoden til at undersøge andre vandforsyningselementer end rør, såsom fittings. Dette begrænser dog samtidig metoden til kun at kunne omfatte rør af samme materiale på inder- og ydreside. Andre væsentlige testforhold var:
3.2.1 TestvandDa de polymere materialer skulle undersøges ved forhold gældende for dansk vandforsyning, skulle testvandet have samme egenskaber som dansk drikkevand. Det enkleste ville således være at anvende frisk produceret drikkevand med et lavt AOC-indhold. Tabel 4:
3.2.2 Mængde af testmaterialeMaterialet, der skulle undersøges, blev udskåret i passende stykker (teststykker), som blev tilsat testflaskerne. For at opnå en størrelse på teststykkerne, der dels var til at arbejde med, og dels ikke ville kræve for store mængder materiale, blev der indledningsvis valgt et S/V-forhold på 0,5 cm-1. Dette svarer til S/V-forholdet i et fyldt rør med en indre rørdiameter på 8 cm. Med et vandvolumen på 200 mL blev der anvendt et totalt overfladeareal (inder- og yderside samt skæreflader) af testmaterialet på 100 cm2. Under det eksperimentelle arbejde blev et bredt spektrum af S/V-forhold afprøvet, hvor fra det blev besluttet af fastholde S/V-forholdet på 0,5 cm-1. 3.2.3 Forbehandling af testmaterialeProceduren til for-vaskning af teststykkerne tog udgangspunkt i migrationsstandarden /DS/EN 852-1, 1997/ med den modifikation, at teststykker blev for-vasket i flasker, mens der i standarden for-vaskes ved opfyldning af rørlængder. Teststykkerne henstod således et døgn i postevand og blev efterfølgende skyllet i postevand 1 time. For at kunne udføre AOC-bestemmelsen med renkulturer måtte den naturlige population på teststykkerne inaktiveres inden testen. Efter skylningen blev teststykkerne derfor desinficeret ved pasteurisering i postevand ved et S/V-forhold svarende til testsituationen (udføres i samme flasker som skylningen med låget skruet helt til). Efter afkøling blev teststykkerne taget op, overhældt med pasteuriseret testvand for at skylle vand fra pasteuriseringen af, og derefter overført til testflaskerne med pasteuriseret testvand. Under det eksperimentelle arbejde blev der til sammenligning afprøvet kloring som desinfektionsmetode. Ud fra de opnåede resultater og af praktiske hensyn blev pasteurisering fastholdt som desinfektionsmetode. 3.2.4 BallastmaterialeTeststykker af materialer med mindre massefylde end vand blev påsat en ballast for at holde teststykkerne under vandoverfladen. I de indledende undersøgelser blev det forsøgt at anvende glaskugler som ballastmateriale, men disse blev senere erstattet af net af rustfrit stål, som blev skåret til i passende stykker. Ballastmaterialet blev påsat hver enkelt teststykke inden forbehandlingen af teststykkerne. 3.2.5 EkstraktionsmetodeIndledningsvis blev materialerne ekstraheret ved 10° C svarende til en gennemsnitlige temperatur i ledningsnettet. Undervejs i udviklingsarbejdet blev testtemperaturen hævet til 20± 2° C, dels for at modsvare andre migrationstest udført af Miljøstyrelsen, og dels for at repræsentere et "worst case" scenario svarende til temperaturen, der i visse situationer kan opnås i dele af distributionsnettet. Ekstraktionstiden blev indledningsvis sat til 20 døgn, som en absolut maksimal opholdstid i ledningsnettet. I det eksperimentelle arbejde blev der afprøvet flere forskellige ekstraktionstider, hvilket førte til en ekstraktionstid på 15 døgn. Ekstraktionen af materialer kunne udføres med eller uden tilstedeværelsen af aktive bakterier. I de indledende undersøgelser blev begge ekstraktionsformer afprøvet både med en naturlig population samt med P17 og NOX. Ud fra de udførte undersøgelser blev det besluttet at udføre ekstraktionen uden tilstedeværelser af aktive bakterier, med efterfølgende AOC-bestemmelse på ekstraktet. Undersøgelserne indikerede, at kun P17 kunne omsætte de stoffer, der blev afgivet fra materialerne, hvorfor AOC-bestemmelser på ekstrakter følgelig blev udført med P17 som eneste testbakterie. 3.3 TestmetodeDe eksperimentelle undersøgelser ledte til nedenstående procedure. Hvor intet andet er anført er de eksperimentelle undersøgelser udført efter samme fremgangsmåde. Metoden kan opsumeres til bestående af to trin:
3.3.1 ArbejdsgangAlt arbejde med åbne prøver og podekulturer foregår i sterilbænk. Testvandet afhentes direkte på vandværket dagen før eller på selve dagen, hvor testen startes. Testvandet udvejes til 200± 2 mL i 250 mL 'red cap'-flasker (PYREX) med 'red cap'-låg med teflonindlæg (SCHOTT DURAN). Vandets naturlige bakteriepopulation inaktiveres ved pasteurisering ved 60° C (med flaskernes låg skruet helt til):
Testvandet afkøles og opbevares på køl indtil påbegyndelse af test. I undersøgelsen indgår kun materiale uden skrift, som ikke har været påsat tape eller lignende, og fra produktionssted til test tages der de nødvendige forholdsregler til at sikre at materialet ikke kontamineres med eksternt organisk stof. Testmaterialer tilsendes direkte fra producenterne indpakket i stanniol eller pap, og på produktionsstedet er rør-emnerne håndteret under brug af engangshandsker. Testmaterialer tilskæres på et underlag af stanniol med renset værktøj reserveret til arbejdet, idet der bæres vinyl-engangshansker under arbejdet. Materialet udskæres (med rørskærer, skalpel eller nedstryger) i teststykker med et totalt overfladeareal på 100 cm2 , svarende til et S/V-forhold i testsituationen på 0,5 cm-1. Hvert enkelt teststykke påsættes en ballast af rustfrit stålnet og forbehandles i flasker ved følgende procedure: For-vask:
Den naturlige population på teststykkerne inaktiveres ved pasteurisering i postevand ved 60° C og et S/V-forhold svarende til testsituationen (med flaskernes låg skruet helt til):
(Flere sæt teststykker af samme materiale kan forbehandles i samme flaske, så længe det korrekte S/V-forhold fastholdes). Efter afkøling tages teststykkerne op med en pincet, skylles ved overhældning med pasteuriseret testvand og overføres til testflaskerne med pasteuriseret testvand. Flaskerne indpakkes i stanniol for at hindre algevækst og fotokemisk nedbrydning. Alle prøver opstilles i triplikat med tilhørende blindprøver med pasteuriseret testvand og ballastmateriale. Teststykkerne ekstraheres i 15 døgn ved 20± 2° C under horisontal omrystning (95 omdrejninger/min - hvilket ikke medfører kontakt imellem låg og vandfase). Efter endt ekstraktion tages teststykkerne op med en pincet, og ekstrakter og blindprøver podes med P17 til en startkoncentration på 200-500 CFU/mL. Ekstrakter og blindprøver inkuberes ved 15° C, hvorunder bakterieantallet følges ved bestemmelse af kimtal dag 0, 3, 4, 5, 7, 10, 15. Såfremt vækstkurverne ikke stagnerer eller er faldet dag 15 bestemmes kimtal endvidere dag 20 og eventuelt dag 25. Kimtal bestemmes ved overfladeudsæd på R2A-agar, hvor pippeteringer foretages med finnpipetter med engangsspidser af polypropylen. Inden prøveudtagning fra en flaske føres denne i kraftige horisontale cirkelbevægelser for at homogenisere prøven. Når fortynding af en prøve er nødvendig, fremstilles en ti-fold fortyndingsrække ved at overføre 100 mL prøve til eppendorf-rør med 900 mL autoklaveret postevand. Der omblandes ved vortex-mixning, og herfra fremstilles den videre fortyndingsrække på samme vis, indtil de ønskede fortyndinger er opnået. Skal den ufortyndede prøve udplades, udtages der i stedet 300 m L prøve til tomt eppendorf-rør, hvorfra udpladning fortages og den videre fortyndingsrække fremstilles. Fra tre fortyndinger udplades 50 mL i triplikater, ialt 9 plader. Kolonier optælles efter 2-3 døgns inkubation ved 25° C, idet plader med over 200 kolonier generelt ikke optælles. 3.3.1.1 Rensningsprocedurer for udstyr De anvendte flasker, låg og finnpipetter anvendes udelukkende til undersøgelse af AOC-afgivelse for at hindre, at anden tidligere anvendelse medfører afgivelse af organisk stof eller stof, der hæmmer bakterievækst. For at fjerne organisk kulstof rengøres testflasker og låg inden brug ved følgende procedure:
Pincetter og værktøj til udskæring af materiale renses for organisk kulstof ved glødning i gasflamme og afkøles inden brug, mens ballastmaterialet glødes ved 220° C i minimum 5 timer. Til desinficering af arbejdsområde og drigalskispatler må der ikke anvendes sprit, da dette vil kontaminere prøverne med organisk stof og resultere i forhøjet P17 koncentrationer. Arbejdsområde aftørres med en 0,05% CTMAK-opløsning (cetyltrimethylammoniumchlorid - giver ikke anledning til forhøjede P17 eller NOX værdier), og stål-drigalskispatler glødes i gasflamme og afkøles inden brug. Pipettespidser renses ikke specielt før brug, men tages direkte fra leveringsposer. Spidser, der skal i direkte kontakt med prøve, pakkes under brug af vinyl-engangshandsker for at begrænse overførelse af organisk materiale. Eppendorf-rør og pipettespidser autoklaveres, og tørres derefter ved 80° C. 3.3.1.2 Podekulturer Separate podekulturer af P17 og NOX fremstilles ved opdyrkning af bakterierne ved 15° C i næringssaltsmedie med 1 mg/L acetat ved 15° C /van der Kooij et al., 1995/. Bakteriernes vækst følges ved overfladeudsæd på R2A-agar, indtil et maksimalt bakterieantal er opnået. Herefter opbevares kulturene i køleskab, hvor de har en holdbarhed på omkring et halvt år. 3.3.2 DatabehandlingKolonital fra alle talte fortyndinger vurderes som et samlet datasæt inden videre behandling. Afvigere identificeres på et 95% signifikantsniveau ved nedenstående procedure:
Såfremt datasættets afvigere skyldes den naturlige variation på bestemmelsen, bør metoden identificere omkring 5% af kolonitallene som afvigere (2,5-7,5% accepteres). Afvigere bør generelt ikke kasseres, men vurderes i hvert enkelt tilfælde, da der ikke kan ses bort fra den naturlige variation. Metoden anvendes således til at vurdere datasættes kvalitet inden videre beregning. /Boe-Hansen, 1998a/ For hver enkelt bestemmelse beregnes kimtallet som et vægtet gennemsnit ud fra den
totale udstrøgne prøvemængde og det totale antal talte kolonier i prøvemængden. Den
observerede spredning (error of mean, E.O.M.) på kimtallet følger en Poisonfordeling og
vil følgelig være
E.O.M.-værdien angiver således ikke hvor stor spredning, der er imellem replika, men angiver en præcision af bestemmelsen, idet et højere antal talte kolonier giver en større præcision på bestemmelsen. De beregnede kimtal omsættes til AOC-værdier ved brug af udbyttekonstanterne angivet i afsnit 3.1 3.3.3 Gennemsnitlig vækstkurveUd fra de beregnede kimtal optegnes vækstkurver for tripikate prøver. Kurverne sammenlignes for at vurdere kvaliteten af de opnåede ekstrakter. Et stærkt afvigende vækstkurveforløb i forhold til de to øvrige prøver indikerer afvigende forhold, som gør at ekstraktet ikke repræsenterer afgivelsen fra materialet. Ligeledes vil en stærkt afvigende høj værdi indikere en forurening med eksternt kulstof. Prøver med sådanne stærkt afvigende vækstkurveforløb ses der bort fra. Ligeledes ses der bort fra en prøve, hvis denne er kontamineret med uønskede bakterier. Ved beregning af det gennemsnitlige vækstkurveforløb ud fra triplikate (duplikate) prøver opnås den bedste bestemmelse af den gennemsnitlige kurves beliggenhed ved at gå tilbage til de oprindelige kolonitællinger. De triplikate prøver betragtes som fortyndingsrækker, og det vægtede gennemsnit bestemmes over triplikaterne:
Når E.O.M. således beregnes på det samlede datamateriale, medregnes ikke variationen imellem de triplikate prøver. Der er i dette projekts arbejde ikke fastlagt variationen imellem vækstkurver, da fastlæggelsen af gennemsnitlige kimtal har været prioriteret højest, og der kun har været 2-3 vækstkurver. Hvis bestemmelsen af variationen imellem et større antal vækstkurver i andre tilfælde prioriteres højere end bestemmelsen af det gennemsnitlige kimtal, kan den gennemsnitlige vækstkurve beliggenhed bestemmes ud fra en logaritmisk normalfordeling: På logaritmisk transformerede kimtal beregnes for hvert sæt triplikate prøver et (aritmetisk) gennemsnit, m , og en spredning, s . Her ud fra bestemmes det gennemsnitlige kimtal ved:
Det tilhørende 95% konfidensinterval vil være skævt fordelt og bestemmes ud fra t-fordelingen som:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||