Mikrobiologiske plantebeskyttelsesmidlers skæbne i mave-tarm kanalen
Bilag A
- 1.1 Kort over anvendt plasmid
- 1.2 Fremstilling af dosis-kulturer
- 1.3 DNA oprensning fra fæcesprøver
- 1.4 Anvendte primere og DGGE betingelser
- 1.5 DGGE kørsel
- 1.6 Sekventering af bånd fra DGGE geler
- 1.7 DGGE data fra B. cereus forsøget
- 1.8 DGGE data fra Bt subsp. kurstaki forsøget
- 1.9 DGGE data fra Bt subsp. israelensis forsøget
- 1.10 Formidling relateret til projektet
- 1.11 Trykt publikation
1.1 Kort over anvendt plasmid

1.2 Fremstilling af dosis-kulturer
Levende sporer (Hold 2):
1. Fra plade podes i 100 ml sporulationsmedium i ½ liter flaske tilsat rifampicin (20 μmg/ml) eller streptomycin (40 μmg/ml).
2. Inkuberer med ryst ved 30 °C i 1 uge, indtil ca. 90% af cellerne har dannet sporer, se fasemikroskopi.
3. Deles ud i 4 store centrifugerør. Centrifugerer ved 2000 g i 20 min ved 4 °C.
4. Supernatanten fjernes og der resuspenderes i koldt 96 % ethanol.
5. Der centrifugeres og supernatanten fjernes. Sporerne resuspenderes i koldt sterilt vand.
6. Herefter renses sporerne yderligere 2 gange ved skiftende centrifugering (2000 g, 20 min, 4 °C) og vask med sterilt vand.
7. Genopløs i 8 ml FKP, og frys ned ved –80 °C.
Stråledræbte sporer ( Hold 1): Sporerne stråledræbes ved 50 kGray
Varmeaktiverede sporer (Hold 3): Sporerne behandles ved 80 °C i 15 min i portioner på 1½ ml på varmeblok
Vegetative celler (Hold 4):
1. Fra plade podes en koloni i 2 x 10 ml LB kultur tilsat rifampicin (50 mg/ml) eller streptomycin (100 μmg/ml).
2. Rørene inkuberes n.o. ved 37°C med ryst.
3. Cellerne centrifugeres ned, vaskes 2 gange i sterilt vand, og genopløses i FKP.
Sporulationsmedie (Kim & Naylor, 1966):
Per liter: Nutrient broth (Oxoid CM1) 8 g
Yeast extract (Oxoid L21) 4 g
MnCl2-4H2O (Merck) 10 mg
Dest. Vand 1000 ml
Ingredienserne blandes, evt. under opvarmning. pH justeres til 7,2. Bouillonen fyldes i flasker som autoklaveres.
1.3 DNA oprensning fra fæcesprøver
a) Homogenisering af fæces og fjernelse af debris
1. 1,5 ml af 10-1 fortyndingen centrifugeres ved 200 x g (2100 rpm) i 2 min.
2. Supernatanten overføres til et nyt rør og centrifugeres ved 12.000 x g (5500 rpm) i 5 min.
3. Supernatanten suges fra og pellet opløses i 1,2 ml TE-buffer (ved at suge væske op og ned med pipetten)
b) Mekanisk homogenisering og SDS behandling
1. Prøven overføres til et 2ml eppendorfrør med Zirconia beads (står på køl i kølerum)
2. 30 μl 10% SDS tilsættes og prøven rystes i 4 min. i bead beater på High speed
3. Prøven centrifugeres ved 1000 x g (4500 rpm) i 20 sek.
c) Oprensning af DNA (Qiagen Mini Stool DNA kit)
1. 1,4 ml (mest muligt) supernatant overføres til et nyt rør
2. Opbevar ved -20°C eller fortsæt direkte oprensningen.
3. Tilsæt 1 InhibitEX tablet til hver prøve og vortex straks i 1min. eller indtil tabletten er fuldstændigt opløst. Inkuber 1 min. ved stuetemperatur for at tillade inhibitorer at absorbere til InhibitEX matrixen.
4. Centrifuger prøven i 3 min. ved 13.000 rpm (20000 x g) for at fælde fæces partikler og inhibitorer bundet til Inhibit EX
5. Overfør straks supernatanten til et 1,5ml eppendorfrør og smid pellet ud. Centrifuger i 3 min. ved 13.000 rpm (20000 x g) for at fjerne resterende partikler/pellet
6. Apipeter 15 μl Proteinase K i et 1,5ml eppendorfrør og tilsæt 200 ml supernatant fra trin 5
7. Tilsæt 200 μl buffer AL og vortex i 15 sek.
8. Inkuber ved 70°C i 10 min. Centrifuger kort for at fjerne dråber fra låget
9. Tilsæt 200 μl 96% ethanol til lysatet og vortex. Centrifuger kort for at fjerne dråber fra låget.
10. Mærk låget af QIAamp kolonnen siddende i et 2 ml opsamlingsrør. Tilsæt forsigtigt lysatet fra trin 9. Luk låget og centrifuger i 1 min. ved 13.000 rpm (20000 x g).
11. Åben forsigtigt QIAamp kolonnen og tilsæt 500 ml AW1. Luk låget og centrifuger i 1 min. ved 13.000 rpm (20000 x g). Placer QIAamp kolonnen i et nyt 2ml opsamlingsrør og smid røret med filtratet ud.
12. Åben kolonnen og tilsæt 500 μl AW2. Luk låget og centrifuger i 3 min. ved 13.000 rpm (20000 x g).
13. Overfør kolonnen til et 1,5 ml eppendorfrør og afpipeter 200 μl AE direkte ned i midten af QIAamp membranen.
14. Inkuber i 3 min. ved stuetemperatur og centrifuger derefter i 1 min. ved 13.000 rpm (20000 x g) for at eluere DNAét. Opbevar DNAét ved -20°C.
1.4 Anvendte primere og DGGE betingelser
| Primere | Sekvens | PCR produkt/bp | DGGE | Målgruppe | Reference: |
| HDA1-GC | GC-clamp*-ACT CCT ACG GGA GGC AGC AGT | 200 | 25-65%, 9% PAAG |
Alle bakterier | Walter et al., 2000 |
| HDA2 | GTA TTA CCG CGG CTG CTG GCA C | ||||
| Bact. 596F | TCA GTT GTG AAA GTT TGC G | 287 | 35-55%, 9% PAAG |
Subgruppe af Bacteroides | Vanhoutte et al., 2004 |
| Bact. 826R-GC | GC-clamp**-GTR TAT CGC MAA CAG CGA | ||||
| Bact-0011 | AGA GTT TGA TYM TGG CTC AG | 716 nested PCR: 200 bp |
25-65%, 9% PAAG |
Lactobacillus group | Heilig et al., 2002 |
| Lab-0677 | CAC CGC TAC ACA TGG AG | ||||
| g-Bifid F | CTC CTG GAA ACG GGT GG | 596 | 40-70% 9% PAAG |
Bifidobacterium | Matsuki et al., 2002; Vanhoutte et al., 2004 |
| g-Bifid R-GC | GC-clamp**-GGT GTT CTT CCC GAT ATC TAC A |
*GC-clamp: CGC CCG GGG CGC GCC CCG GGC GGG GCG GGG GCA CGG GGG G
**GC-clamp: CGC CCG CCG CGC CCC GCG CCC GGC CCG CCG CCC CCG CCC C
Referencer:
Heilig, H.G., Zoetendal, E.G., Vaughan, E.E., Marteau, P., Akkermans, A.D. and de Vos, W.M. 2002. Molecular diversity of Lactobacillus spp. and other lactic acid bacteria in the human intestine as determined by specific amplification of 16S ribosomal DNA. Appl. Environ. Microbiol. 68:114-123.
Matsuki, T., Watanabe, K., Fujimoto, J., Miyamoto, Y., Takada, T., Matsumoto, K., Oyaizu, H. and Tanaka, R. 2002. Development of 16S rRNA-gene-targeted group-specific primers for the detection and identification of predominant bacteria in human feces. Appl. Environ. Microbiol. 68:5445-5451.
Vanhoutte, T., Huys, G., De Brandt, E. and Swings, J. 2004. Temporal stability analysis of the microbiota in human feces by denaturing gradient gel electrophoresis using universal and group-specific 16S rRNA gene primers. FEMS Microbiol. Ecol. 48:437-446.
Walter, J., Tannock, G.W., Tilsala-Timisjarvi, A., Rodtong, S., Loach, D.M., Munro, K. and Alatossava, T. 2000. Detection and identification of gastrointestinal Lactobacillus species by using denaturing gradient gel electrophoresis and species-specific PCR primers. Appl. Environ. Microbiol. 66:297-303.
1.5 DGGE kørsel
Fremstilling af UF (opløsninger til DGGE)
Alle opløsninger fremstilles i stinkskab, da de er meget giftige
9% acrylamid: acrylamidebis 37.5:1
500ml 100% UF:
112,5 ml 40% premix AABIS
10 ml 50 x TAE
210 g urea
200 ml formamid
500ml 0% UF
112,5 ml 40% premix AABIS
10 ml 50 x TAE
377,5 ml milliporevand
De ønskede gradienter (f.eks. 25% og 65%) dannes udfra 0% og 100% opløsningerne.
Fremstilling af acrylamid gel i gradientblander:
- 18 ml gradient
- 190 μl 10% APS, amoniumpersulfat
- 11 μl Temed
Blandes i gradientblander:
Den laveste gradient f.eks (25%) blandes i det venstre rør og luftboblen fjernes ved at åbne for gennemstrømning og derefter suge indholdet i modsatte rør op.
Derefter kommes den stærkeste f.eks (65%) gradient i højre rør og 10 % APS tilsættes hver rør, Der tændes for magnetomrøreren og rørene flyttes så der er optimal omrøring i begge rør.
Til sidst tilsættes Temed til hvert rør. (får gelen til at stivne).
Påsætning af prøver:
Brøndene renses forsigtigt med buffer (1*TAE) ved at bufferen suges op i en engangssprøjte og sprøjtes forsigtigt ud i brønden. Alle brønde skylles 2 gange.
Derefter tilsættes prøverne forsigtigt til brøndene efter et fastlagt skema.
Hver prøve indeholder 16μl .(13μl prøve og 3μl farvemiks).
Markør: Invitogen Cat no: 15628-050. fortyndes 20gange. (På gel ,6μl og 1μl farve)
Start af DGGE apparat:
DGGE apparatets top kommes oven på karret og der tændes for apparatet.
Temperaturen sættes til 60°C
Gelen kører i 16 timer ved 36 V og 28 mA.
Farvning af DGGE gel:
Farvebad fremstilles ved, at ½ l 1 * TAE blandes med 24ml flourecrom farvestof i specielt farvekar. Gelen på glaspladen kommes i farvebadet og farves fra 45 minutter til 1 ½ time.
Foto af gel:
Gelen (på glasplade) løftes forsigtigt op ad vandbadet, og der kommes vand på lyspladen.
Overskydende vand fjernes og billede tages (ved både 302nm UV-B og 254nm UV-C)(invert)
Sikkerhed:
Der bruges handsker under hele arbejdet.
Alle sikkerhedsblade skal læses inden der arbejdes med DGGE, da mange af opløsningerne er meget giftige.
Gelen kasseres til Z-affald.
Div. opløsninger mærkes med faremærker.
1.6 Sekventering af bånd fra DGGE geler
1. Udskæring
2. S1 nuklease behandling
3. PCR+kloning
4. Elektroporation
5. Oprensning af plasmider
6. PCR-DGGE
7. Sekventering
1. Udskæring
- De ønskede bånd udskæres sterilt under UV-lampen – BESKYT ansigt og hænder!
- Placeres i sterile eppendorfrør hvortil der tilsættes 40 ml sterilt vand. DNA’et eluerer ud i vandet ved inkubering natten over ved 4°C
2. S1 nuklease behandling (Tannock et al., 2004)
- 33 ml af vandet (som indeholder DNA’et) behandles med 3 ml S1 nuklease (400 U/ml, Roche) og 4 ml 10x buffer (330 mM NaAc, 500 mM NaCl, 0.3 mM ZnSO4, pH 4.5) i 1 time ved 37 °C
- Reaktionen stoppes ved at varme blandingen ved 95°C i 5 min.
- Prøver opbevares ved -80°C indtil videre brug
3. PCR + kloning (Knarreborg et al., 2002; Walter et al., 2000)
- S1 behandlet DNA bruges i en PCR med HDA1/2 primerne (uden GC-clamp):
HDA-kort: 94°C i 4 min
20 cycler: 94°C i 30 sek
56°C i 30 sek
68°C i 60 sek
68°C i 7 min.
- Til kloning benyttes TOPO TA Cloning Kit for Sequencing (Invitrogen), findes i -20°C fryser (F112).
- Bland 4 μl friskt PCR produkt med 1 μl fortyndet Salt Solution og 1 μl TOPO vector.
- Bland og inkuber 5 min på bordet ved stuetemperatur
- Placer blandingen på is.
4. Elektroporation
- Fremstil LB plader med ampicillin (50 mg/μl)
- Bland 2 μl fra kloningsreaktionen med 1 rør One Shot Electrocompetent E. coli (lille -80°C fryser)
- Overfør forsigtig blanding til kold elektroporationskuvette (Coli-lab)
- Elektroporation på Ec2 (Coli-lab)
- Tilsæt straks 250 μl opvarmet (37°C) S.O.C. medium (følger med kittet).
- Overfør blandingen til et 15 ml centrifugerør og ryst 1 time ved 37°C med løst låg.
- Udplad 20 og 200 μl på selektiv plade (LB +amp) og inkuber natten over ved 37 °C.
5. Plasmidoprensning
- Udvælg 5 kolonier fra hver plade og oprens plasmider v.h.a. Qiagen Mini Spin Prep.
6. PCR-DGGE
- Kør PCR med HDA1-GC/HDA2 primerne på programmet HDA-kort.
- Kør DGGE gel og sammenlign med oprindelig bånd, der blev skåret ud.
- Gem den stamme, som kun indeholder et bånd, og som befinder sig i den korrekte position.
7. Sekventering
- PCR produkt eller plasmid-oprensning sendes til MWG i Tyskland til sekventering. Primerne T3 og T7 kan bruges til sekventering.
Referencer:
Knarreborg, A., Simon, M.A., Engberg, R.M., Jensen, B.B. and Tannock, G.W. 2002. Effects of dietary fat source and subtherapeutic levels of antibiotic on the bacterial community in the ileum of broiler chickens at various ages. Appl. Environ. Microbiol. 68:5918-5924.
Tannock, G.W., Munro, K., Bibiloni, R., Simon, M.A., Hargreaves, P., Gopal, P., Harmsen, H. and Welling, G. 2004. Impact of consumption of oligosaccharide-containing biscuits on the fecal microbiota of humans. Appl. Environ. Microbiol. 70:2129-2136.
Walter, J., Tannock, G.W., Tilsala-Timisjarvi, A., Rodtong, S., Loach, D.M., Munro, K. and Alatossava, T. 2000. Detection and identification of gastrointestinal Lactobacillus species by using denaturing gradient gel electrophoresis and species-specific PCR primers. Appl. Environ. Microbiol. 66:297-303.
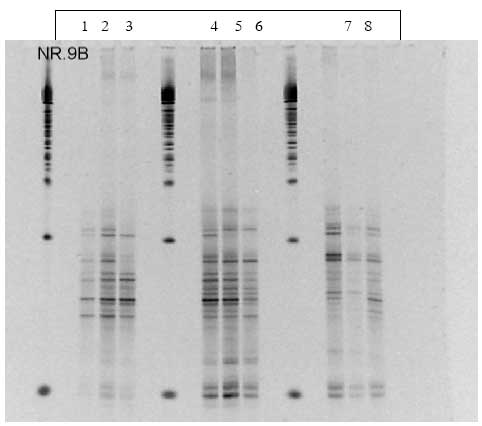
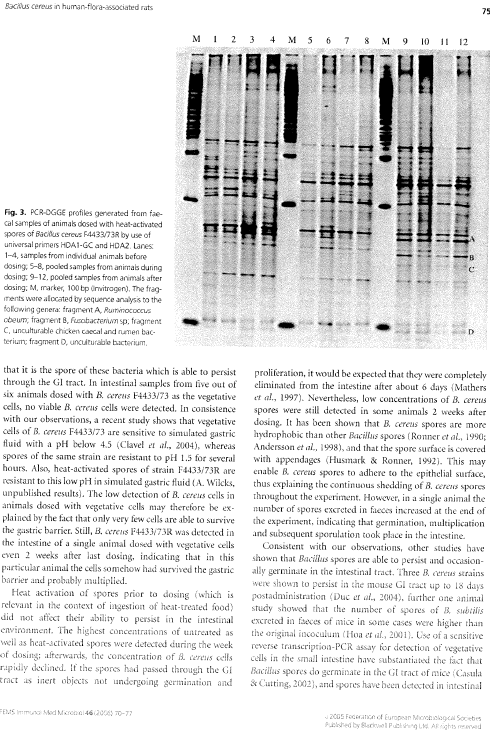
1.7 DGGE data fra B. cereus forsøget
Klik her for at se figurer1.8 DGGE data fra Bt subsp. kurstaki forsøget
Figur 1.8.1. DGGE af Dyr 1 fra Hold 1. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
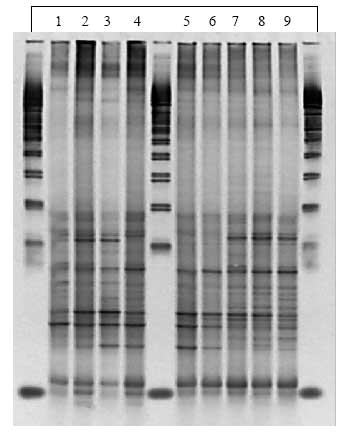
Figur 1.8.2. DGGE af Dyr 2 fra Hold 1. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
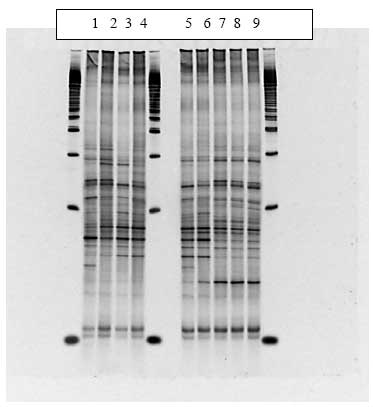
Figur 1.8.3. DGGE af Dyr 7 fra Hold 2. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
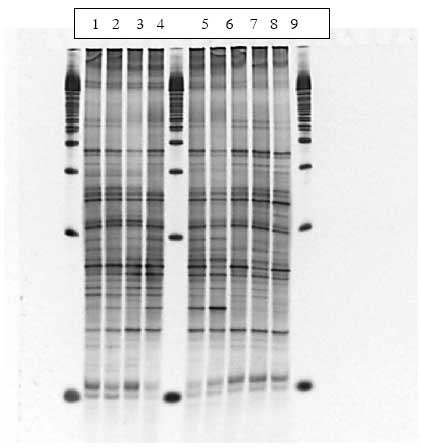
Figur 1.8.4. DGGE af Dyr 8 fra Hold 2. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
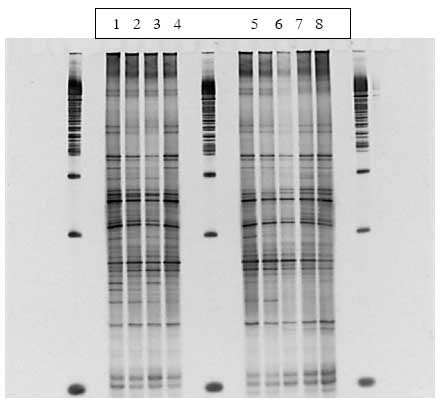
Figur 1.8.5. DGGE af Dyr 14 fra Hold 3. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
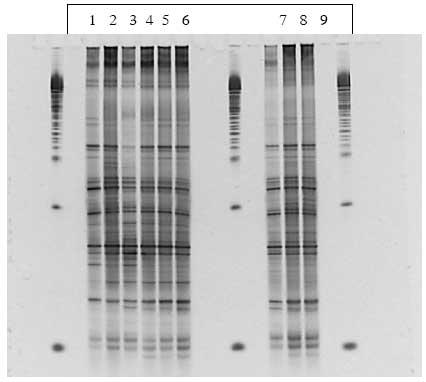
Figur 1.8.6. DGGE af Dyr 15 fra Hold 3. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
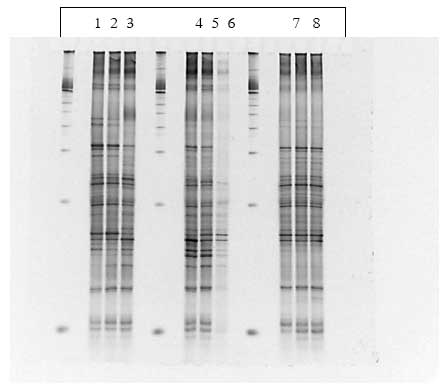
Figur 1.8.7. DGGE af Dyr 20 fra Hold 4. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
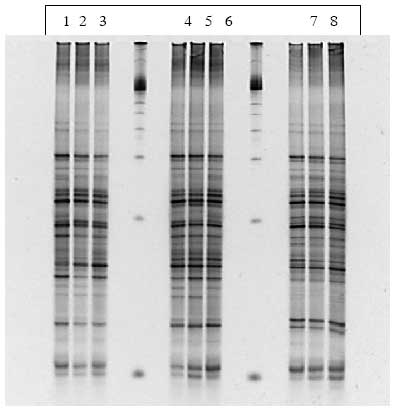
Figur 1.8.8. DGGE af Dyr 21 fra Hold 4. Bane 2-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-8: prøver efter dosering.

1.9 DGGE data fra Bt subsp. israelensis forsøget
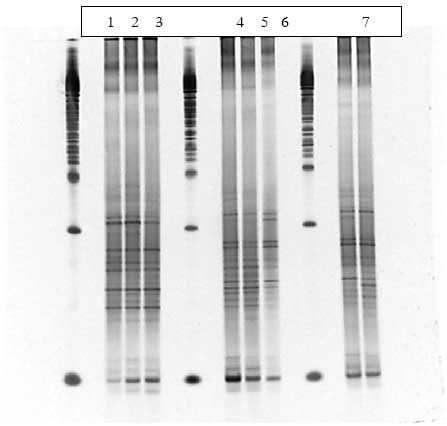
Figur 1.9.1. DGGE af Dyr 2 fra Hold 1. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.

Figur 1.9.2. DGGE af Dyr 3 fra Hold 1. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7: prøve efter dosering.
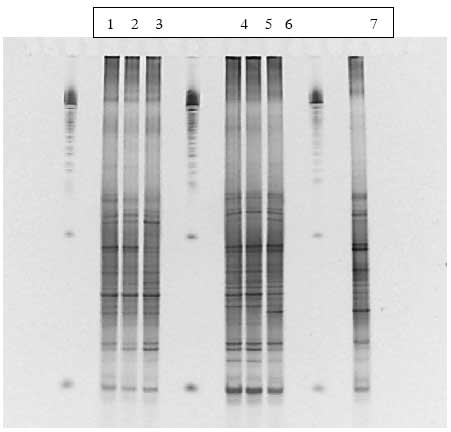
Figur 1.9.3. DGGE af Dyr 8 fra Hold 2. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-8: prøver efter dosering.
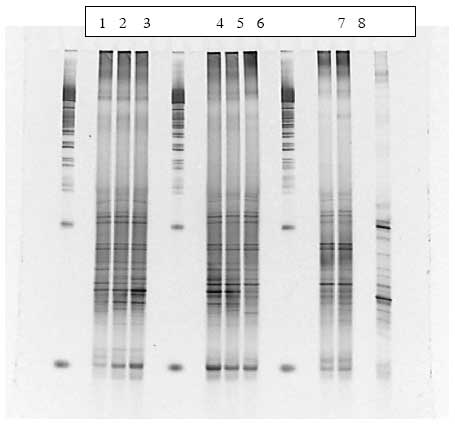
Figur 1.9.4. DGGE af Dyr 9 fra Hold 2. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
Figur 1.9.5. DGGE af Dyr 13 fra Hold 3. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering.
Figur 1.9.6. DGGE af Dyr 15 fra Hold 3. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering
Figur 1.9.7. DGGE af Dyr 20 fra Hold 4. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering
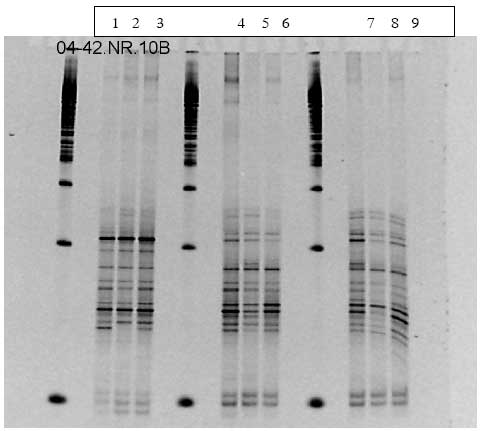
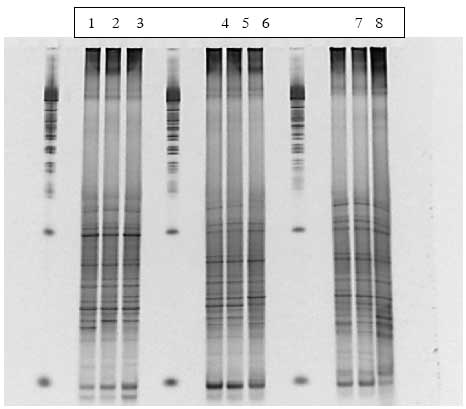
Figur 1.9.8. DGGE af Dyr 21 fra Hold 4. Bane 1-3: prøver fra før dosering; bane 4-6: prøver under dosering; bane 7-9: prøver efter dosering
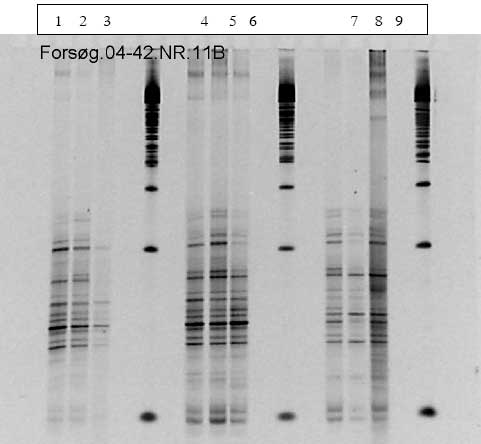
1.10 Formidling relateret til projektet
Trykte publikationer
Wilcks, A., Hansen, B.M., Hendriksen, N.B. and Licht, T.R. 2006. Fate and effect of ingested Bacillus cereus spores and vegetative cells in the intestinal tract of human-flora-associated rats. FEMS Immunol. Med. Microbiol. 46:70-77.
Wilcks, A., Hansen, B.M., Hendriksen, N.B., and Licht, T.R. Persistence of Bacillus thuringiensis in the gut of human-flora-associated rats. FEMS Immunol. Med. Microbiol. (accepteret, september 2006).
Wilcks, A., Smidt, L., Bahl, M.I., Hansen, B.M., Andrup, L., Hendriksen, N.B., and Licht, T.R. Colonization and conjugation of Bacillus thuringiensis subsp. israelensis in the intestine of gnotobiotic rats (foreløbig title). Manuskript under udfærdigelse.
Abstrakts
Wilcks, A., Smidt, L., Bahl, M.I., Hansen, B.M., Andrup, L., Hendriksen, N.B., and Licht, T.R. Germination and conjugation of Bacillus thuringiensis subsp. israelensis in the intestine of gnotobiotic rats. Gut microbiology: research to improve health, immune response and nutrition. Aberdeen, UK, juni 2005.
Licht, T.R., Wilcks, A., Rosenquist, H., Andersen, S.R., Hendriksen, N.B., Hansen, B.M., Smidt, L. and Andrup, L. 2003. Presentation of a future project: The fate of biopesticides in the human gut. Poster ved AMI-seminar om biologiske insekticider. København, november 2003.
Foredrag
Wilcks, A., Smidt, L., Bahl, M.I., Hansen, B.M., Andrup, L., Hendriksen, N.B., and Licht, T.R. Germination and conjugation of Bacillus thuringiensis subsp. israelensis in the intestine of gnotobiotic rats. COST 862 Workshop: Ecology of Bacteria used for Insect Control. Goniadz, Polen, maj 2006.
Wilcks, A., Smidt, L., Bahl, M.I., Hansen, B.M., Andrup, L., Hendriksen, N.B., and Licht, T.R. Germination and conjugation of Bacillus thuringiensis subsp. israelensis in the intestine of gnotobiotic rats. LMC Symposium on Food Microbiology. Gl. Avernæs, maj 2006.
Wilcks, A. 2005. Fate and effect of B. thuringiensis based insecticides in the human gut. COST 862 workshop: Bacterial toxins for insect control. Nitra, Slovakiet, september 2005.
Wilcks, A. 2004. Fate and effect of B. thuringiensis in rats. DMU workshop: Health and environmental risks by the use of organisms for biological control of pests and disease in agriculture. Helsingør, november 2004.
Licht, T.R. 2004. Mikrobiologiske plantebeskyttelsesmidlers skæbne i mave-tarmkanalen. Miljøstyrelsens pesticidforskningsseminar. Kolding, januar 2004.
Publikationer og præsentationer indirekte relateret til projektet
Frederiksen, K., Rosenquist, H., Jørgensen, K., and Wilcks, A. 2006. Occurrence of natural Bacillus thuringiensis contaminants and residues of Bacillus thuringiensis-based insecticides on fresh fruits and vegetables. Appl. Environ. Microbiol. 72:3435-3440.
Rosenquist, H., L. Smidt, S.R. Andersen, G.B. Jensen and A. Wilcks. 2005. Occurrence and significance of Bacillus cereus and Bacillus thuringiensis in ready-to-eat food. FEMS Microbiol. Lett. 250:129-136.
Johansen, J.E., Hu, X., Hansen, B.M., Yuan, Z. and Eilenberg, J. Bioassay with mosquitos for evaluation of transconjugant Bacillus spp. containing the pBtoxis plasmid. Poster ved 37th Annual Meeting of the Society of Invertebrate Pathology & 7th International Conference on Bacillus thuringiensis Helsinki, Finland, August 1-4, 2004.
Licht, T. Biological control – assessment of health risks. Foredrag ved DMU-arrangeret workshop November 2004: ‘Health and environmental risks by the use of organisms for biological control of pests and diseases in agriculture’.
Hansen, B.M. Enterotoxins – a potential risk of using B. thuringiensis products? Foredrag ved DMU-arrangeret workshop November 2004: ‘Health and environmental risks by the use of organisms for biological control of pests and diseases in agriculture’.
Hansen, B.M. and Hendriksen, N.B. 2004. Emetic toxin and enterotoxins – a potential risk of using B. thuringiensis products. Præsentation ved 37th Annual Meeting of the Society of Invertebrate Pathology & 7th International Conference on Bacillus thuringiensis. Helsinki, Finland, August 1-4, 2004.
Hendriksen, N.B. Occurrence of microbial pest control agents in food. Foredrag ved DMU- arrangeret workshop November 2004: ‘Health and environmental risks by the use of organisms for biological control of pests and diseases in agriculture’.
Hendriksen, N.B. and Hansen, B.M. Occurrence of Bacillus cereus and B. thuringiensis in field plots with curly kale (Brassica oleracea acephala). Poster ved 37th Annual Meeting of the Society of Invertebrate Pathology & 7th International Conference on Bacillus thuringiensis Helsinki, Finland, August 1-4, 2004.
Hu, X., Hansen, B.M., Eilenberg, J., Hendriksen,, N.B., Smidt, L., Yuan, Z. and Jensen, G.B. Conjugative transfer, stability and expression of a plasmid encoding a cry1Ac gene in Bacillus cereus group strains. Poster ved 37th Annual Meeting of the Society of Invertebrate Pathology & 7th International Conference on Bacillus thuringiensis Helsinki, Finland, August 1-4, 2004.
Rosenquist, H. The occurrence of B. thuringiensis in food. Foredrag ved DMU-arrangeret workshop November 2004: ‘Health and environmental risks by the use of organisms for biological control of pests and diseases in agriculture’.
1.11 Trykt publikation



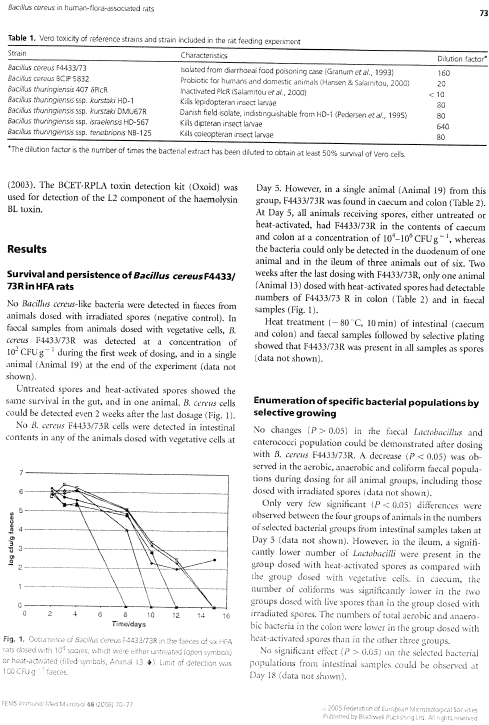
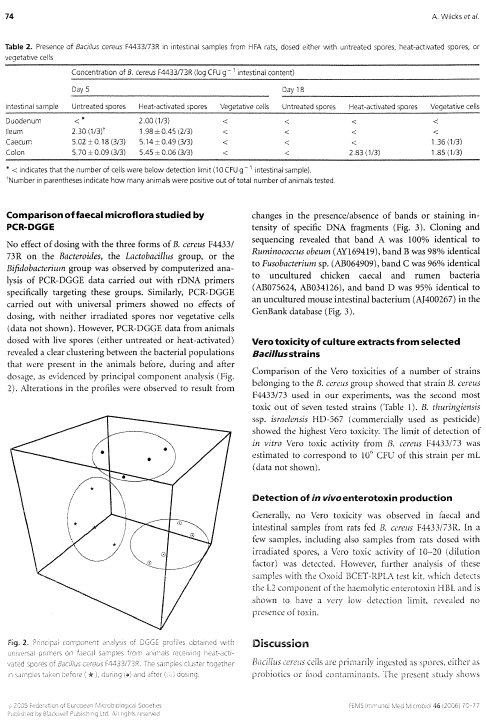


Version 1.0 Januar 2007, © Miljøstyrelsen.