Forebyggelse af jord og grundvandsforurening på industrivirksomheder ved udvalgte aktiviteter
Bilag 2
Princippet i katodisk beskyttelse
Af Ingeniør Ole Bank, Kvalitet + Service.
- Uddrag fra Katodisk beskyttelse af nedgravede brændstofbeholdere 1987
Princippet i katodisk beskyttelse
Jern og stål kan kun katodisk beskyttes, når det er i direkte kontakt med en elektrolyt, det vil i praksis sige med jord eller vand. En elektrolyt leder den elektriske strøm ved hjælp af ioner, der igen er atomer eller molekyler, som har mistet eller optaget elektroner (negativt elektriske ladninger), de er altså negativt eller positivt ladede. Ioner spiller en stor rolle i korrosionsforløbet af jern og stål. Når jern tærer, sker det ved en anodisk jernopløsning i elektrolytten, hvor jernatomerne under frigørelse af elektroner vandrer ud i elektrolytten som positivt ladede jernioner. Ion er græsk, det betyder en vandrer, og jernionerne møder ude i elektrolytten andre vandrende ioner, med hvem jernionerne danner kemiske forbindelser, som efterhånden viser sig synligt i form at rust. På de steder af jernoverfladen, hvor den anodiske jernopløsning finder sted, dannes gruber, som relativt hurtigt kan gå i dybden og forårsage gennemtæringer af olietanke - i ugunstige tilfælde på 2-4 år.
Fig. 1
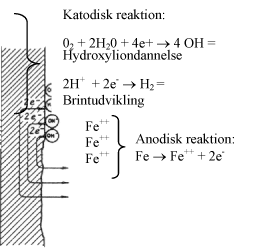
Ved jern-iondannelsen frigøres elektroner. De forbliver inde i jernet og aflades ved de såkaldte katodiske processer på steder af jernoverfladen, hvor der er tilgang af ilt og vand. Samtlige elektroner, der dannes ved den anodiske proces, forbruges igen ved de katodiske processer - for udadtil er korroderet jern elektrisk neutralt.
Fig. 2 Pitting eller grubetæring af jern
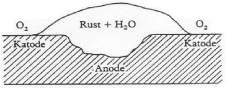
Fig.3 Korrosion af jern og stål
Men det er klart, at jo større tilgang der er af ilt, jo flere elektroner vil der kunne aflades og tilsvarende hastigere vil jernopløsningen foregå.
Når enten den anodiske eller de katodiske reaktioner stoppes, vil jernet ophøre med at korrodere, og princippet i katodisk beskyttelse består netop i at standse den anodiske proces ved hjælp af en elektrisk jævnstrøm. Jernet påtrykkes en negativ elektrisk spænding, og på grund af overskud af negativ elektricitet vil jernatomerne ikke kunne frigøre deres elektroner, fordi negativ elektricitet som bekendt frastødes af negativ elektricitet. Derfor forhindres jern-iondannelsen og dermed korrosionsangrebene.
De katodiske reaktioner stoppes naturligvis ikke, og i et rigtigt dimensioneret anlæg med katodisk beskyttelse anvendes netop så meget jævnstrøm, at al anodisk jernopløsning ophører og erstattes af katodiske processer over hele jernoverfladen. Den spændingsændring, der Emder sted på jernoverfladen, kan måles ved hjælp af et voltmeter og en referencecelle, der anbringes i elektrolytten tæt ved jernoverfladen. Der findes flere forskellige typer af referenceceller, men den mest anvendte i praksis er en kobber/kobbersulfat referencecelle (kemisk betegnelse Cu/CuS04).
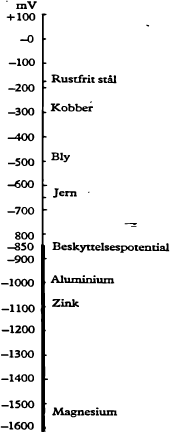
Det, der måles, er simpelthen spændingsforskellen mellem referencecellen og jernet, og denne spændingsforskel kaldes jernets potential. Når jern korroderer frit i jord, er det naturlige korrosionspotential fra -350 til -750 millivolt (forkortes mV, 1 mV = 1/1000 V) målt med Cu/CUS04 cellen. Det naturlige korrosionspotential afhænger af jordens sammensætning og kan derfor variere inden for ret vide grænser. Bemærk, at potentialet angives med negativt fortegn. De forskellige metaller har hvert sit naturlige korrosionspotential, f.eks. har kobber -300 mV, zink -1 100 mV og magnesium -1550 mV, og måles samtlige metallers naturlige korrosionspotentialer, finder man det, der kaldes den galvaniske spændingsrække, som har ret stor praktisk betydning. Kobles to metaller elektrisk sammen, dannes et galvanisk element, og det metal, som har mest negativt potential, vil korrodere og blive anode i elementet og forsøge at katodisk beskytte det metal, som har mindre negativt potential (katoden). Kobler man således jern sammen med kobber, vil jernet tære, men forbindes jernet med zink, vil zinken tære. Man kan derfor katodisk beskytte jern med metaller, der har mere negativt korrosionspotential end jern, og det skal vi senere vende tilbage til.
Når en nedgravet tank påtrykkes jævnstrøm, forskydes tankens potential, og for at opnå fuld korrosionsbeskyttelse skal potentialet forskydes i negativ retning til -850 mV målt med Cu/CuS04 cellen placeret tæt ved tankoverfladen. -850 mV er et internationalt anvendt beskyttelseskriterium. For at fremkalde spændingsfaldet fordres en bestemt strømstyrke. Udtrykt på en anden måde fordres der en bestemt strømtæthed på tankoverfladen, som normalt angives i mA pr. m² (1 miliampere = 1/1000 ampere). Størrelsen af strømtætheden er bestemmende for, hvor hurtigt beskyttelse kan opnås og i sig selv bestemt af elektrolyttens sammensætning og af overfladeisoleringen på tanken. En bar ståloverflade i jord kræver op til 30 MA pr. m² for at blive beskyttet, medens en godt isoleret overflade kun behøver fra 1/2 til 1 mA pr. m² eller endnu mindre.
Fig. 4. Cu/CuS04 referencecelle
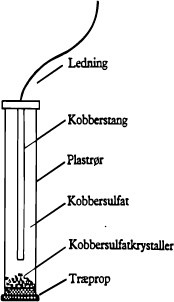
Fig.5. Spændingsrækken i jord i forhold til referencecelle Cu/CuS04
Version 1.0 December 2008, © Miljøstyrelsen.