Udvikling af et biologisk bejdsemiddel til frø
2 Produktion og formulering af Glicladium roseum præparater
2 Produktion og formulering af Gliocladium roseum præparater
2.1 Produktion
2.1.1 Materialer og metoder
2.1.2 Resultater vedrørende produktion
2.2 Formulering
2.2.1 Materialer og metoder
2.2.2 Resultater vedrørende formulering
2.3 Diskussion og konklusion
Biologiske bekæmpelsesmidler kan kun fremstå som et realistisk alternativ til de kemiske midler, såfremt lovende antagonister kan produceres og formuleres på en økonomisk rentabel måde. Antagonisten skal kunne produceres effektivt og billigt, men må også kunne formuleres på en sådan måde, at applikation er mulig i praksis, samtidig med at effektivitet og stabilitet i bekæmpelsen bevares. I rapporten er produktion og formulering opdelt i to underafsnit for at gøre emnet mere overskueligt. Der er dog ofte en klar indbyrdes sammenhæng mellem produktion og formulering, som det også vil fremgå af nedenstående afsnit.
2.1 Produktion
Produktionskrav
En væsentlig forudsætning for en kommerciel udvikling af et biologisk bekæmpelsesmiddel er, at antagonisten kan masseproduceres hurtigt og
billigt i industriel skala. Det betyder reelt, at der både kræves en høj kvantitativ produktion af de(n) strukturer af antagonisten, der er aktive i den biologiske bekæmpelse af patogener samtidig med at disse struktures kvalitet opretholdes på højeste niveau med hensyn til overlevelse og aktivitet (Harman et al., 1991; Lewis, 1991). Der stilles således flere specifikke krav til produktionen, der kan være mere eller mindre modstridende og vanskelige at opfylde. Substratet skal være billigt, samtidig med at en høj produktion skal opnåes på så kort tid som mulig, idet prisen ved fermentering pr dag er en væsentlig produktions-omkostning (Lewis, 1991; Stowell, 1991). Herefter skal antagonisten kunne overleve de forskellige forarbejdsningstrin i processen frem mod et brugbart produkt (såsom høst, nedtørring, formulering, lagring og applikation).
Nedtørringstolerance
Biomasse af svampeantagonister ønskes som oftest distribueret i nedtørret form primært for at mindske risikoen for kontaminering, men også for at få et mere håndterbart produkt. Dette indebærer, at de aktive strukturer nødvendigvis må have en høj nedtørringstolerance, dels for at sikre den optimale økonomi i produktionen, men også fordi død biomasse kan tjene som næring for plantepatogener ved applikationen af produktet, og dermed føre til forøget sygdomsangreb (Harman, et al., 1991; Nigam & Singh, 1994; Jin et al.,1996). Det er en generel erfaring med kun få undtagelser, at ukønnede sporer (konidier) og især klamydosporer (hvilesporer) tåler nedtørring langt bedre end myceliefragmenter (Harman, 1992; Boyette et al., 1991). På trods af svampesporers generelt højere nedtørringstolerance, er overlevelsen efter nedtørring et kardinalpunkt ved fremstilling af biologiske midler. Specielt når produktionen af sporer sker ved flydende fermentering er nedtørringstolerancen meget lav (Harman et al., 1991). Undersøgelser indenfor Trichoderma harzianum har dog vist, at det er muligt at øge tolerance ved at manipulere det osmotiske potentiale i vækstmediet (Harman et al., 1991; Jin et al., 1991; Jin et al., 1996).
Kommerciel produktion
Generelt arbejdes der med to overordnede metoder (principper) til produktion af mikrobiel biomasse af antagonister, nemlig flydende fermentering og fast fermentering. Erfaringerne med kommerciel produktion af antagonistiske svampe til biologiske bekæmpelse af plantepatogener er forholdsvis få, set på verdensplan. På nuværende tidspunkt markedsføres der kun omkring 17 produkter (internetaddresse:
http.//www.barc.usda.gov/psi/bpdl/bioprod.htm). Der er dog en lang tradition for fermentering af svampe, der udnyttes i industrielle processer, såsom vin- og øldyrkning, kompostering, produktion af antibiotika og enzymer etc, hvor der således eksisterer en veletableret teknologi (Stowell, 1991; Nigam & Singh, 1994). Disse erfaringer kan ikke altid med held overføres til produktionen af biologiske midler, idet produktionen af disse adskiller sig fra mange af de konventionelle produktionssystemer ved at slutproduktet skal bestå af den levende biomasse af antagonisten og ikke af biprodukter fra fermenteringen (Stowell, 1991).
Flydende fermentering
Flydende fermentering (FlF) er her anvendt som dansk oversættelse af de engelske termer "liquid fermentation" og "submerged fermentation". FlF kan generelt defineres ved at produktionen foregår i fortyndede opløsninger eller "slurries". I laboratoriet sker fermenteringen typisk i glasflasker (100-1000 ml) i rystekultur, mens den kommercielle fermentering sker i store tanke (fermentorer) på flere tusind liter. Rhodes & Powell (1994) anfører, at de fleste antagonistiske bakterier med lethed produceres ved FlF, der således er standardmetode ved produktion af mikrobiel biomasse til mange industrielle formål i Europa og i Nordamerika, mens metoden synes vanskeligere at benytte til svampe.
Fast fermentering
Fast fermentering er en dansk oversættelse af de engelske termer "solid fermentation " og "semi-solid fermentation". Fast fermentering (FaF) kan generelt set defineres som vækst af mikroorganismer på fast substrat i en proces, der foregår uden (eller næsten uden) adgang til frit vand. Substratet skal dog indeholde nok absorberet vand i den faste matrix til at stimulere fermenteringsprocessen. Substrater anvendt til FaF er vanskeligt opløselige i vand og polymere af natur. De skal i form af carbonhydrater, vitaminer, mineraler, og andre næringsstoffer samt absorberet vand give byggesten til mikroorganismen og grundlag for den mikrobielle vækst. Endelig tjener substratet som forankring for mikroorganismen (Nigam & Singh, 1994). Syntetiske polymerer så som agar og gelatine kan også anvendes, og da de giver et homogent substrat er disse substrater meget velegnede til modelstudier af mikrobiel vækst på fast substrat. Den forholdsvise høje pris for syntetiske substrater gør dem dog sjældent anvendte i kommerciel skala (Nigam & Singh, 1994). I laboratoriet sker fermenteringen ofte i glasflasker eller polypropylenposer (25 g til 5 kg), i kommerciel skala anvendes bakker, trug og tromler med kapacitet fra 50 kg til flere tons. Teknologier til FaF er hovedsagelig udviklet i Japan (Nigam & Singh, 1994).
Fast contra flydende fermentering
Ved sammenligning af de to produktionsformer fremhæves flydende fermentering oftest som den mindst ressourcekrævende i forhold til udbyttet af det ønskede produkt (Stowell, 1991; Boyette et al., 1991). Produktionen af biomasse skal være ensartet fra gang til gang for at sikre en reproducerbar sammensætning af det færdige produkt og i den forbindelse fremhæves det ofte, at der ved FlF lettest opnåes en ensartet og sikker styring af produktionen (Boyette et al., 1991). Nogle svampe-slægter er dog uvillige til at danne sporer i flydende medier (Stowell, 1991). Grunden til, at FlF generelt fremhæves som den bedste fremente-ringsmetode, skal formodentlig også tilskrives, at der hidtil ikke er blevet forsket og investeret intensivt i FaF i hverken Europa eller USA. På grund af hemmeligholdelse af know-how vedrørende produktion af de markedsførte midler, er det ikke muligt at få oplyst hvilken fermenteringsmetode, der konkret anvendes. For et af midlerne nemlig Fusaclean (Fusarium oxysporum) er det dog i brugsvejledningen nævnt, at antagonisten er opformeret på fast substrat.
G. roseum
Erfaringerne omkring opformering af Gliocladium roseum til kommercielle formål er få. En gennemgang af litteraturen viser, at produktion af G. roseum udelukkende er sket ved fast fermentering og som oftest på det syntetiske substrat PDA (Knudsen et al.,1995; James & Sutton, 1996, Burgess et al, 1997). Adskillige faste organiske substrater er dog afprøvet herunder majsmel, hvede-og havreklid (Peng et al., 1992), hvedekerner (James & Sutton, 1996) samt en blanding af vermiculit og hvedeklid (Keinath et al., 1991). Ved nærværende projekts begyndelse blev konidier af G. roseum (IK726) produceret på kartoffeldextroseagar (PDA).
Formål
Det overordnede formål med nærværende forsøg er at undersøge metoder til produktion af G. roseum (IK726) med kommercielle udviklings-muligheder for øje, herunder specielt 1) at undersøge mulighederne for anvendelse af flydende fermentering, 2) at viderudvikle produktionen på fast medie til at omfatte billige og lettilgængelige substrater og 3) at manipulere dyrkningsforholdene for at øge konidiernes kvalitet, herunder nedtørringstolerance.
2.1.1 Materialer og metoder
Såvel flydende som fast fermentering af G. roseum (IK726) er foretaget under sterile forhold og med steriliserede materialer, således at kontaminering undgåes. For at forhindre eventuelle forandringer af isolatet som følge af rekultivering, udføres alle produktionsforsøg med udgangspunkt i agarpropper fra en stamkultur af IK726 på PDA. Stamkulturer opbevares ved -80oC i cryorør med en 10% glycerol opløsning. Alle eksperimenter påbegyndes ved anvendelse af en ny agarprop fra frys, denne overpodes til PDA og inkuberes 1 uge. Herfra overpodes IK726 påny til PDA, inkuberes 1 uge, hvorefter substrater kan podes med agarpropper af denne kultur.
Flydende fermentering
Produktion af G. roseum konidier ved flydende fermentering blev undersøgt ved opformering af IK726 i rystekultur. Kolber (250 ml) med 100 ml Kartoffel Dextrose Broth (PDB) blev podet med en agarprop af IK726 og derefter inkuberet ved stuetemperatur på rystebord (130 rpm) .
Osmotikum
Indflydelsen af osmotika på biomasseproduktion og sporulering blev undersøgt ved tilsætning af glycerol, Polyethylene glycol (PEG) 8000 (60% w/v) og PEG 200 i forskellige koncentrationer. Osmotika blev tilsat efter 24 timers inkubering af IK726 på PDB, idet samtidig tilsætning af IK726 og osmotikum reducerede konidieproduktionen voldsomt.
Biomasse og konidiekonc.
Efter i alt 8 døgns inkubering blev biomassen og konidiekoncentration bestemt på følgende måde: Substratet homogeniseres 1 minut ved fuld hastighed, homogenatet centrifugeres (8000 rpm, 4°C, 10 min.), pellet resuspenderes i sterilt vand og filtreres gennem indvejede glasfiltre (porestørrelse 1.2 µm) ved hjælp af sugekolbe. Filtrene tørres 1 døgn ved 60°C, hvorefter biomassen bestemmes ved vejning. Konidieproduktionen pr. ml substrat bestemmes ved tælling i bakterietællerkammer, da konidierne er relativt små, nemlig 3-4 x 5-7 µm (Domsch et al., 1980).
Fast fermentering
Produktionen af IK726 ved fast fermentering er undersøgt for en række organiske substrater alene og i kombination. Indflydelsen af nær-UV lys, vandindhold og produktionstid på produktionens størrelse og konidiernes nedtørringstolerance som funktion af produktionsmetode er ligeledes undersøgt.
"Starter" inokulum
Som "starter" inokulum anvendes enten agarpropper, som beskrevet ovenfor eller konidiesuspensioner af IK726. Konidiesuspensioner fremstilles efter følgende procedure: Opformering sker i rystekultur på PDB+PEG200 (jfr. afsnit 2.2.1). I 250 ml kolber podes 94 ml kartoffeldextrose broth (PDB) med en agarprop af IK726. Der inkuberes ved stuetemperatur på rystebord (130 rpm). Efter 1 døgn tilsættes 6 ml PEG200. Efter yderligere 7 døgns inkubering høstes konidierne ved homogenisering af inokulum (blending i 1 minut), filtrering gennem 3 lag gaze, centrifugering (8000g, 4o, 10 min.) efterfulgt af resuspension af pellet i vand og indstilling af konidiekoncentrationen ved fortynding. Konidiekoncentrationen bestemmes ved hjælp af tællekanner.
Substrater og metode
Majs eller havregryn (20 g/250 ml kolbe) tilsat 100 ml konidiesuspension af IK726 (2 x 107 konidier/ml) inkuberes 5 døgn på rystebord (125 rpm) ved stuetemperatur. Substratet filtreres gennem 4 lag gaze, filtratet udbredes i et 0.5 cm lag, dækkes med plast og inkuberes i 5 eller 12 døgn. Klid (50 g/1 l pyrexflaske) tilsættes 50 ml vand, autoklaveres og tilføres efter afkøling 50 ml konidiesuspension af IK726 (1 x 107 konidier/ml), der inkuberes 3 døgn med løsnet skruelåg (omrystes dagligt). Inokulum udbredes i et 0.5 cm lag, dækkes med plast og inkuberes i henholdsvis 5 og 10 døgn. Ved produktion på majs, havregryn og klid er indflydelsen af nær-UV-belysning i inkubations-perioden endvidere undersøgt.
Sphagnum blandes med ionbyttet vand i forholdet 2:3 (w/w). Sphagnum og klid blandes i forholdet 37,5: 62,5 og blandes herefter med ionbyttet vand svarende til 59% (w/w). Sphagnum, klid, majs og ionbyttet vand blandes i forholdet 17:22:7:54 (w/w). Substraterne (39g/250 ml kolbe) autoklaveres 2 x 67 minutter i to på hinanden følgende dage og inokuleres efter afkøling. Der inokuleres med 2 agarpropper (0.5 cm) per kolbe eller med 5 ml konidiesuspension af IK726. I eksperiment P1, P2 og P3 inokuleres kun med 1 ml suspension (se endvidere tabel 2.1)
Vandindhold og produktionstid
Til undersøgelser af vandindholdets indflydelse på opformeringen af
IK726, holdes vægtforholdet mellem sphagnum og klid konstant og vandindholdet reguleres ved tilsætning af ionbyttet vand eller konidiesuspensioner af IK726. Vandindholdet beregnes således på basis af vægt af vand i forhold til vægten af tørt substrat. Undersøgelser vedrørende produktionstidens indflydelse på opformeringen af IK726 omfatter intervallet fra 8 til 28 dage og er hovedsagelig udført for sphagnum/klid substratet.
Nedtørring
For alle inokulumtyper er der benyttet en standardmetode til nedtørring. Substratet udbredes på sterilt filtrerpapir og tørres i 2 døgn ved stuetemperatur i sterilbænk. Herefter mortes eller blendes det tørrede inokulum. Til bestemmelse af produktionens størrelse og kvalitet anvendes den tørrede findelte biomasse. Endelig foretages pakning og lagring til senere bestemmelser af overlevelse (ase Kap. 3 og Kap.8) og biologisk bekæmpelsesaktivitet (se Kap. 4-9).
Produktion (cfu/g)
Produktionens størrelse bestemmes ved en fastlagt pladespredningspro- cedure. Der udtages inokulumprøver á ca. 0.05 g, der tilsættes 10 ml vand og whirlmixes 1 minut. En fortyndingsrække fremstilles og efter fastlæggelse af konidiekoncentrationen ved hjælp af tællekammer pladespredes 3 x 100 ml for hver af tre relevante fortyndinger på PDA. Pladerne inkuberes ved stuetemperatur og aflæses 2, 3 og 4 dage efter inokulering. Antallet af kolonidannende enheder pr gram inokulum (cfu/g) bestemmes.
Konidiespiring
Suspensioner af inokulum (ca 1 x 106 konidier/ml) udsprøjtes på vandagar og inkuberes i mørke ved 20oC. Efter 24 timer bestemmes den procentvise spiring under mikroskop idet 3 x 100 konidier fra tilfældigt udvalgte synsfelter per behandling bedømmes for spiring/ikke spiring.
I tabel 2.1 er der angivet en detaljeret beskrivelse for eksperimenter med fast fermentering med hensyn til substratvalg, inkubationstider, vandindhold, samt form og koncentration af "starter" inokulum
2.1.2 Resultater vedrørende produktion
Flydende fermentering
IK726 kan uden problemer opformeres på flydende substrat i rystekultur og IK726 danner villigt konidier i størrelsesordenen 5 x 107 konidier/ml (Tabel 2.2 og 2.3). Tilsætning af osmotikum efter 1 døgns inkubation influerer ikke signifikant på koncentrationen af konidier pr ml, men giver en højere koncentration af konidier pr. g biomassen: 2.5 x 1010 konidier/g biomasse ved tilsætning af PEG 200 mod 1.3 -1.7 x 1010 konidier/g uden tilsætning af PEG. Overlevelsen i nedtørret pellet, der hovedsagelig indeholder konidier og små myceliestykker, blev estimeret til 15-60%.
Tabel 2.1. Detaljeret beskrivelse af produktionsforsøg med fast fermentering Substrat, starter inokulum, vandindhold og inkubationstid er angivet.
Table 2.1. Detailed description of production experiments using solid fermentation. Substrates, starter inoculum, water content and period of incubation is shown.
|
Eksp. |
Substrat |
|
Vandindhold (w/w)2) |
Inkubation Døgn |
|
L2 |
majs3) |
2 x 107 |
-4) |
10, 17 |
|
havregryn3) |
2 x 107 |
- |
10, 17 | |
|
L3 |
klid3) |
prop, 1 x 107 |
66%, |
8, 13 |
|
sphagnum/klid |
prop, 1 x 107 |
60%, 72% |
13 | |
|
L4 |
sphagnum/klid |
prop, 1 x 107 |
60%, 65% |
14 |
|
L5 |
sphagnum |
prop, 1 x 107 |
60%, 65% |
15 |
|
sphagnum/klid |
prop, 1 x 107 |
60%, 65% |
15,18 | |
|
sphagnum/klid/majs |
prop, 1 x 107 |
54%, 60% |
15 | |
|
L6 |
sphagnum/klid |
prop, 1 x 107 |
60%, 65% |
14 |
|
L7 |
sphagnum/klid |
prop, 1 x 107 |
60%, 65% |
14 |
|
L10 |
sphagnum/klid |
prop, 1 x 107 |
60%, 65% |
14 |
|
P1 |
sphagnum/klid |
2 x 107 |
30-70% |
15 |
|
P2 |
sphagnum/klid |
2 x 107 |
30-70% |
15 |
|
P3 |
sphagnum/klid |
2 x 107 |
60% |
14-28 |
|
P4 |
sphagnum/klid |
Agarprop |
60% |
12-20 |
1) Angiver konidiekoncentrationen i starter konidiesuspensionen.
2) Vandindholdet er angivet som vægtprocent vand i forhold til vægten
af tørt substrat.
3) Inkuberet med og uden nær-UV lys
4) Vandindhold ikke bestemt.
Osmotikum
Tabel 2.2. Konidie- og biomasseproduktion af G. roseum (IK726) efter 8 døgns fermentering i rystekultur ved 20°C i PDB tilsat forskellige osmotika (Forsøg 1).
Table 2.2. Production of conidia and biomass of G. roseum (IK726) after 8 days of incubation in liquid cultures with addition of osmotica (Experiment 1).
|
Behandling |
Konidier/ml |
Biomasse (g)1) |
|
100 ml PDB |
3.2 x 107 |
0.24 |
|
89 ml PDB+ 11 ml glycerol |
4.2 x 107 |
0.18 |
|
50 ml PDB+ 50 ml PEG 8000 |
4.3 x 107 |
0.15 |
1) Den gennemsnitlige tørvægt af biomasse per 100 ml substrat
Tabel 2.3. Konidie- og biomasseproduktion af G. roseum (IK726) efter 8 døgns fermentering i rystekultur ved 20°C i PDB tilsat forskellige osmotika (Forsøg 2).
Table 2.3. Production of conidia and biomass of G. roseum (IK726) after 8 days of incubation in liquid cultures with addition of osmotica (Experiment 2).
|
Behandling |
Konidier/ml |
|
|
|
100 ml PDB |
5.1 x 107 |
7.70±0.05 |
0.29 |
|
89 ml PDB+ 11 ml glycerol |
3.4 x 107 |
7.52±0.10 |
0.15 |
|
50 ml PDB+ 50 ml PEG 8000 |
4.9 x 107 |
7.68±0.06 |
0.22 |
|
94 ml PDB+ 6 ml PEG 200 |
6.0 x 107 |
7.77±0.13 |
0.24 |
1) Angiver gennemsnitlige log10- værdier for konidier
per ml ± spredning (SD)
2) Den gennemsnitlige tørvægt af biomasse per 100 ml substrat
Fast fermentering
Substrater
Adskillige substrater er undersøgt med henblik på at optimere produktionen af IK726 ved fast fermentering. Ved sammenligning af de enkelte substrater fremgår det, at klid alene giver den højeste produktion af cfu per g tørt præparat (Tabel 2.4 og 2.5). Således er produktionen på klid ca 30 gange større end på eksempelvis sphagnum og havregryn. Imidlertid giver en blanding af sphagnum og klid en produktion, der er ca. 7 gange størrer end på klid alene (Tabel 2.4).
Nær-UV lys
Mange svampeslægter udviser forøget sporulering ved inkubation under nær-UV lys (Neergaard, 1977). For G. roseum synes nær-UV belysning ikke at fremme hverken den totale konidiemængde eller sporulerings-hastigheden (Tabel 2.6). Der synes heller ikke at være nogen vekselvirkning mellem substrat og nær-UV lys.
Tabel 2.4. Produktion af G. roseum på faste substrater inkuberet ved stuetemperatur efterfulgt af 2 døgns nedtørrings.
Table 2.4. Production of G. roseum on solid substrates incubated at room temperature followed by 48 hours of drying.
|
Substrat |
Inkubationtid Døgn |
cfu per g præparat |
log10 cfu ± SD1) |
|
Majsmel |
12 |
3.3 x 107 |
7.52±0.03 |
|
Havregryn |
12 |
2.0 x 106 |
6.29±0.10 |
|
Klid |
13 |
7.0 x 107 |
7.84±0.23 |
|
Sphagnum/klid |
13 |
5.3 x 108 |
8.63±0.12 |
1) Angiver gennemsnitlige log10-værdier for cfu/g præparat ± standardafvigelsen (SD)
Tabel 2.5. Produktion af G. roseum på faste substrater inkuberet 15 døgn ved stuetemperatur efterfulgt af 2 døgns tørring.
Table 2.5. Production of G. roseum on solid substrates incubated for 15 days at room temperature followed by 48 hours of drying.
|
Substrat |
Cfu/g inokulum |
log10 cfu ±SD1) |
|
Sphagnum |
1.3 x 107 |
7.06±0.34 |
|
Sphagnum/klid |
3.0 x 108 |
8.47±0.08 |
|
Sphagnum/klid/majsmel |
1.1 x 108 |
8.12±0.09 |
1) Angiver gennemsnitlige log10-værdier for cfu/g præparat ± standardafvigelsen (SD)
Tabel 2.6. Effekten af nær-UV belysning på produktion af G. roseum som funktion af substrat og produktionstid.
Table 2.6. The effect of near-UV light on the production of G. roseum in relation to substrate and incubation period.
|
Behandling |
cfu/g tørt præparat | |
|
Substrat og produktionstid |
nær-UV |
Dagslys |
|
Majsmel 5 døgn |
4.6 x 106 |
1.9 x 107 |
|
Havregryn 5 døgn |
9.1 x 106 |
3.5 x 106 |
|
Majsmel 12 døgn |
3.0 x 107 |
3.6 x 107 |
|
Klid 8 døgn |
5.9 x 104 |
4.0 x 105 |
|
Klid 13 døgn |
1.9 x 108 |
1.5 x 108 |
Vandindhold
Af tabel 2.7 fremgår det, hvorledes vandindholdet i sphagnum/klid substrater påvirker dels den totale produktion af G. roseum og dels konidienes nedtørringstolerance. Produktionen af cfu per g tørret inokulum synes upåvirket af et vandindhold i substratet, der spænder fra 40 % og op til 70%. Dog er der en tendens til at konidiernes nedtørringstolerance, det vil sige andelen af spiringsdygtige konidier efter nedtørring, er mest stabil ved et vandindhold under 60%.
Produktionstid
I figur 2.1 er produktionstidens indflydelse på produktionens størrelse i sphagnum/klid med 60% vandindhold afbilledet for eksperimenterne L5, P3 og P4. Ved at udstrække produktionstiden fra 14 og op til 28 døgn fåes ingen signifikant forøgelse af produktionen, tværtimod er der tendens til reduktion efter 26 døgn (P3). En reduktion af produktionstiden til 12 døgn påvirker ikke produktionen signifikant, dog er produktionen lavest ved 12 døgn (P4). Når man slår resultaterne sammen for de tre eksperimenter ses det, at der opnåes en stabil produktion på 6-8 x 108 cfu/g inokulum ved produktionstider mellem 14 og 20 døgn.
Tabel 2.7. Effekten af vandindhold i sphagnum/klid substrat på produktionen af konidier G. roseum og på konidiernes spiringsevne efter nedtørring af præparaterne.
Table 2.7. The effect of water content in peat/bran substrate on the production of Gliocladium roseum conidia and their ability to germinate following drying of the biomass.
|
Vandindhold
|
Efter 2 døgn tørring |
|||
|
log cfu/g inokulum |
Spirede konidier (%) | |||
|
Exp. 1 |
Exp. 2 |
Exp. 1 |
Exp. 2 |
|
|
40 |
8.9 |
8.7 |
54 a1) |
62 b |
|
45 |
8.9 |
8.9 |
60 a |
45 c |
|
50 |
8.8 |
8.8 |
58 a |
41 c |
|
55 |
8.8 |
8.7 |
49 ab |
45 c |
|
60 |
8.9 |
9.0 |
54 a |
69 a |
|
65 |
8.6 |
8.9 |
35 bc |
51 b |
|
70 |
8.5 |
8.9 |
22 c |
44 c |
1. Indenfor søjler er gennemsnitsværdier efterfulgt af samme bogstav ikke signifikant forskellige på 5%-niveauet (Duncan-test)
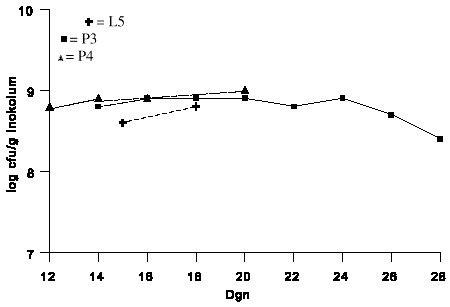
Figur 2.1. Produktionstidens indflydelse på opformeringen af kolonidannende enheder (cfu) af G.roseum (IK726) i sphagnum/klid inokulum efter 2 døgns nedtørring. L5, P3 og P4 refererer til produktionsforsøg jfr. tabel 2.1.
Figure 2.1. The effect of incubation time on the production of colony forming units (cfu) of Gliocladium roseum (IK726) in peat/bran inoculum following 48 hours of drying. L5,P3, and P4 refers to production experiments se table 2.1.
2.2 Formulering
Formulering kan defineres som den forarbejdning af fermentorbiomasse i våd eller nedtørret form, der resulterer i et produkt, der er anvendeligt i praksis. Fermentorbiomassen betegner den blanding af vækstmedie og antagonist, der opnåes ved fast eller flydende fermentering som beskrevet i afsnit 2.1. Den simpleste form for formulering fåes ved direkte anvendelse af fermentormasse; i frisk eller nedtørret tilstand som eksempelvis nedtørret sphagnum/klid inokulum eller homogeniseret fermentorbiomasse fra flydende fermentering, som beskrevet i afsnit 2.1. En mere sofistikeret formulering er ofte påkrævet i bestræbelserne på at udvikle en antagonist til et kommercielt produkt. Formulering kan være nødvendig dels ud fra praktiske/tekniske grunde, og dels for at forbedre nedtørringstolerance, shelf-life (overlevelse under lagring) og den biologiske bekæmpelsesaktivitet. Generelt kræver FaF ikke yderligere formulering før brug, idet fermentorbiomassen tørres og formales (Lewis, 1991). Fra FlF skal biomassen separeres fra det flydende substrat ved eksempelvis filtrering eller centrifugering (Lewis, 1991). Herefter kan den våde biomasse indarbejdes i piller eller inerte bærestoffer, som eksempelvis lermineraler og vermiculit, efterfulgt af nedtørring.
Alginatpiller
Ved formulering i piller immobiliseres antagonisten i en fast matrix eksempelvis alginat (algeextract). Når piller tilføres til jorden, vil de afhængig af matrixens sammensætningen blive mere eller mindre hurtigt opløst som følge af vandoptagelse, og andre mikroorganismers nedbrydning (Fravel et al., 1985). Pillematrixen kan tilføres nærings-kilder, der kan stimulere antagonistens vækst, men som på grund af den rumlige adskillelse ikke umiddelbart kan udnyttes af patogenet. Derved gives antagonisten optimale forhold i de første timer efter udbringelse og dermed god mulighed for etablering i vækstmediet (Lumsden & Locke, 1989; Harman, 1991). Formulering af en alginat-hvedeklid pille af Gliocladium virens har resulteret i et registreret og markedsført produkt (Soilgard) med tilstrækkelig shelf-life, bekæmpelseseffektivitet og stabilitet (Walter & Lumsden, 1997).
Delivery system
Formulering af biologiske præparater vil være afhængig af hvilket "delivery system", der benyttes, dvs. hvorledes applikering af antagonisten skal foregå. Til frøbehandling (bejdsning) vil pulverformulering eller flydende formulering være at foretrække. (Biologisk formulering af frø er nærmere beskrevet i afsnit 5 og 8.1). Applikation til vækstmediet ved iblanding bliver derimod bedre og mere sikker at håndtere, hvis antagonisten er formuleret i piller eller diverse granulattyper. Specielle formuleringer kan også være nødvendige for at produktet kan tilpasses til de eksisterende udbringningssystemer, såsom industrielle bejdseanlæg, såmaskiner, gødningsspredere etc.
Formål
Formålet med nærværende undersøgelser er at undersøge hvilke typer af formulering, der er kompatible med IK726 herunder specielt (1) at afprøve og udvikle forskellige formuleringsmetoder med udgangspunkt i både fast og flydende fermentorbiomasse af IK726 og (2) at opkoncen-trere og stabilisere den aktive ingrediens (konidier) i tørre præparater.
2.2.1 Materialer og metoder
Alginat piller
Alginatpiller blev fremstillet med udgangspunkt i homogeniseret fermentorbiomasse fra flydende fermentering af G. roseum i PDB+PEG200 (se afsnit 2.1). Der fremstilles opløsninger af PEG8000 (480g/l) og Na-alginat medium viscosity (23g/l). Fermentormasse, PEG8000 og Na-alginat blendes sammen i 30 sek. Opløsningen omrøres konstant og dryppes ved hjælp af pipette ned i en 0.25 M CaCl2 opløsning. De dannede piller (ca 3 mm i diameter) henstår 10 min i CaCl2-opløsning, hvorefter de filtreres fra og tørres 1 døgn ved stuetemperatur.
Frysetørring
Novo Nordisk A/S fremstillede et pulverpræparat af IK726, ved at frysetørre fermentormasse fra FlF af isolatet på PDB i skummetmælks-pulver.
Moler og Chemosorb
Der er anvendt produkter af moler, der er den geologiske betegnelse på en naturblanding af diatomeer (kiselalger) og ler, der bla. findes på Fur. De anvendte produkter er venligst stillet til rådighed af Damolin, Dansk Moler Industri. GM-typer er ovntørret moler, dvs at vandet er fjernet, men moleret har bevaret sin struktur. KM-typer er kalcinerede, hvor en forbrændingsprocess har omdannet lerpartiklerne således at kemisk bundet vand er fjernet. Nedenfor er vigtige tekniske data angivet for anvendte typer. Chemosorb er et lermineral produkt, der er stillet til rådighed af Claude Alabouvette, INRA, Frankrig.
|
Produktbeskrivelse |
GM-2 |
KM-U |
KM-W |
|
pH (10% vandig opl.) |
4.5 |
5.5 |
5.5 |
|
rumvægt (g/l) |
220-250 |
250-310 |
220-260 |
|
H2O |
3-6% |
0.5-3% |
0.5-3% |
|
Absorptionsevne vand (v/v) |
160-180% |
135-165% |
130-175% |
|
Sigteanalyse: Sigtetest ved | |||
|
45 my |
max. 12%1) |
max. 35% |
max. 20% |
|
63 my |
max. 8% |
max. 28% |
max. 15% |
|
90 my |
max. 4% |
max. 23% |
max. 8% |
|
250 my |
max. 1% |
max.10% |
max. 1% |
1) Angiver den procentdel der tilbageholdes ved sigtetesten
Fast fermentering
Konidier fra fast fermentering på sphagnum/klid (se afsnit 2.1.1) separeres ved filtrering og centrifugering. Hver kolbe tilsættes 200 ml vand omrystes kraftigt i 30 sek, blendes 1 minut i husholdningsblender ved fuld hastighed og filtreres gennem polyestervæv (38µm). Filtratet centrifugeres (8000g, 4°C, 10 min). Supernatanten hældes fra og den våde pellet, der overvejende indeholder konidier, vejes og blandes med molerprodukter og Chemosorb i forholdene 1:1 og !:2 (w/w). Blandingen udbredes i petriskåle i et lag på max. 0.5 cm og tørrer 18 timer i sterilbænk ved stuetemperatur.
Flydende fermentering
Konidier fra flydende fermentering af IK726 på PDB+PEG produceres som beskrevet i afsnit 2.1. Fermentorbiomassen blendes 1 minut ved fuld hastighed, filtreres gennem polyestervæv og centrifugeres. Formuleringen med moler foregår som beskrevet ovenfor.
Filtrering
Tørret sphagnum/klid inokulum filtreres under kraftig rystning, men uden brug af væske gennem et filter (polyestervæv, 38µm). Antallet af cfu/g i filtratet bestemmes.
2.2.2 Resultater vedrørende formulering
I tabel 2.8 ses den etablerede mængde cfu/g i forskellige formuleringer. Inkuberet på PDA vokser G. roseum velvilligt ud fra alginatpiller formuleret med klid eller PEG. Isolatet overlever også frysetørring i skummetmælkspulver. Begge metoder er dog ikke blevet optimeret yderligere.
Filtrering
En simpel filtrering af sphagnum/klid præparat har betydet en ca. femdobling af kolonidannende enheder pr. g i præparatet (3 x 109 cfu/g). Samtidig er der opnået en mere ensartet partikelsammensætning (< 38 µm) i forhold til det ufiltrerede præparat.
I tabel 2.9 ses resultater for formulering af konidier fra henholdsvis fast og flydende fermentering med inerte lermineraler. Indholdet af cfu i de forskellige formuleringer svinger fra 1.6 x 109 cfu/g for chemosorb (L9) og op til 7.5 x 109 cfu/g konidier fra flydende fermentering i GM-2 (L15). Indenfor samme "batch", synes der ikke at være forskel på hvilket lermineral, der indgår i formuleringen, uanset om konidierne er produceret ved fast fermentering (L9) eller ved flydende fermentering (L16). Der er dog en tendens til et højere antal cfu/g ved formulering af pellet fra flydende fermentering end når pellet fra fast fermentering formuleres på tilsvarende vis (L13 og L15)
Tabel 2.8. Kolonidannende enheder (cfu) i tre typer af formuleringer af G. roseum (IK726).
Table 2.8. Colony forming units (cfu) of G. roseum in three types of formulation.
|
Forsøg. |
Behandling |
Cfu/g |
± SD |
|
1 |
Frysetørret IK726 |
3 x 107 |
- |
|
2 |
PEG8000-Alginat |
9 x 106 |
- |
|
3 |
Sphagnum/klid filtrat |
3.1 x 109 |
4.7 x 108 |
|
Sphagnum/klid, ufiltreret |
6.5 x 108 |
- |
Tabel 2.9. Formulering af Gliocladium roseum (G.r.) konidier af isolatet IK726 produceret ved henholdsvis fast og flydende fermentering.
Table 2.9. Formulation of conidia of Gliocladium roseum (G.r.), isolate IK726, produced by solid fermentation or liquid fermentation.
|
Eks. (batch) |
Fermenterings metode |
Behandling |
cfu/g |
log cfu ± SD |
|
L9 |
Fast |
G.r.+GM-2 (1:1)1 |
2.3 x 109 |
9.31 ± 0.08 |
|
Fast |
G.r.+KM-w (1:1) |
4.4 x 109 |
9.64 ± 0.39 | |
|
Fast |
|
|
| |
|
L11 |
Fast |
G.r.+KM-u (2:1) |
3.5 x 109 |
9.53 ± 0.11 |
|
L13 |
Fast |
G.r+KM-w (1:1) |
4.3 x 109 |
9.57 ± 0.13 |
|
Flydende |
G.r+KM-w (1:1) |
5.5 x 109 |
9.74 ± 0.45 | |
|
L14 |
Flydende |
G.r.+GM-2 (1:1) |
2.1 x 109 |
9.29 ± 0.18 |
|
L15 |
Fast |
G.r.+GM-2 (1:1) |
3.4 x 109 |
9.53 ± 0.05 |
|
Flydende |
G.r.+GM-2 (1:1) |
6.5 x 109 |
9.79 ± 0.16 | |
|
L16 |
Flydende |
G.r.+GM-2 (1:2) |
2.0 x 109 |
9.27± 0.27 |
|
Flydende |
G.r.+KM-w (1:2) |
2.2 x 109 |
9.33 ± 0.14 |
Forholdet mellem våd pellet af G. roseum og molersproduktet (w/w)
2.3 Diskussion og konklusion
Flydende fermentering
De indledende produktionsforsøg med flydende fermentering viser, at G. roseum (IK726) sporulerer velvilligt i flydende medie (Tabel 2.2 og 2.3). Stowell (1991) anfører, at når et produktionssystem først er udviklet ved hjælp af kolber i rystekultur, så kan metoden med få ændringer ofte opskaleres til kommerciel produktion i fermentorer. For IK726 gav 8 døgns opformering ved 20°C 1-2 x 1010 konidier/g biomasse. Efter nedtørring blev procentdelen af spiredygtige konidier estimeret til at være >15%. Harman et al. (1991) fandt til sammenligning ca 2 x 106 konidier/ml og 6 x 108 konidier per g biomasse (tørvægt) efter 4 døgns inkubation af T. harzianum på PDB ved 25°C, hvoraf kun knap 3% var spiredygtige efter nedtørring.
Fast fermentering med direkte tørring
Ved opformering af IK726 på sphagnum/klid med en samlet produktionstid på 16-17 døgn (inklusiv 2 døgns nedtørring) opnåes en reproducerbar produktion af IK726 på 3-8 x 108 cfu per g inokulum. En længere produktionstid giver ingen væsentlig forøgelse af udbyttet (Fig 2.1). Vækst og sporulering af IK726 i sphagnum/klid substrater er ikke særlig følsom overfor vandindholdet i substratet, idet samme produktionen af cfu per g tørret præparat opnåes med et vandindhold fra 30% til 70% (w/w). Dog er der en tendens til, at konidiernes nedtørringstolerance, det vil sig andelen af spiringsdygtige konidier efter tørring er mest stabil ved et vandindhold under eller omkring 60% (Tabel 2.7). Sammenlignes produktionen af IK726 ved fast fermentering med opnåede resultater fra andre undersøgelser af G. roseum's opformering på fast substrat ser det ud til, at der med isolatet IK726 hurtigt opnås en meget høj produktion. Opformering af isolatet PG-A-Fr-88-710 gav efter 18 døgns inkubation ved 20-23°C ca. 8.2 x 107 cfu/g på majsmel og 1.4 x 107 cfu/g på hvedeklid (Peng et al., 1992). Til sammenligning producerer IK726 3.6 x 107 cfu/g på majsmel ved 12 dage inkubation og 1 x 108 på klid inkuberet i 13 døgn. James & Sutton (1996) har opnået den største produktion ved fermentering af G. roseum (isolat 710) på opfugtede hvedekerner, nemlig 1-5 x 109 cfu/g. Processen varede dog ca. 35 døgn ved en temperatur på 20-23°C.
Formulering
Ved formulering af konidier fra fast fermentering i molersprodukter opnåes der med en samlet produktionstid på 15 døgn, 2.1-6 x 109 cfu/g præparat af IK726. Ved en tilsvarende formulering af konidier fra flydende fermentering i molersprodukter, opnåes der med en samlet produktionstid på 9 døgn 2.0-6.5 x 109 cfu/g præparat (Tabel 2.9). Ved formulering af G. roseum i lermineral (talkum) og majsmel opnåede Peng et al (1992) 5 x 108 cfu/g inokulum med en samlet produktionstid på 17-23 døgn. Det markedsførte Trichoderma harzianum produkt "Supresivit", der af producenten bla. anbefales til frøbejdsning har et garanteret indhold på 7 x 109 cfu/g produkt (pulverform). Det kan konkluderes, at der kan opnåes et lignende niveau for IK726 ved formulering i moler.
Økonomiske betragtninger vedrørende produktion
Ved økonomiske beregninger for flydende fermentering af biologiske herbicider kalkuleres der med, at der maksimalt må tilføres 2.5 l fermenterings broth per ha for at kommerciel produktion er profitabel. Ved simpel opformering af IK726 i rystekultur fåes stabilt 4 x 107 konidier/ml svarende til ca 1 x 1011/2.5 liter fermenterings broth (PDB). Når produktet anvendes til bejdsning af korn, kan man ud fra det nuværende kendskab til den effektive dosis på 1 x 104 cfu/frø (se afsnit 5.2.6) beregne, at der skal anvendes 3.6 x 1010 cfu per ha (1 x 104 cfu/frø x (160000 g udsæd per ha/0.045 g per kerne). Ved formulering i moler af biomasse fra flydende fermentering, blev der fra 2.5 l fermentorbiomasse opnået ca. 10 g molersformulering á 6 x 109 cfu/g dvs. i alt 6 x 1010 cfu per 2.5 ml PDB. Der produceres altså 2.8 gange så mange cfu på 2.5 l PDB, når disse ikke nedtørres; og 1.7 gange så mange cfu ved en tørret molersformulering, som der skal anvendes til bejdsning af udsæd til 1 ha. Med udgangspunkt i 1 kg sphagnum/klid substrat (60% vandindhold, w/w) opnåes ca 350 g sphagnum/klid inokulum svarende til ialt ca. 2.1 x 1011 cfu. Ved formulering af konidier fra fast fermentering af 1 kg sphagnum/klid substrat opnåes ca. 24 g molersformulering af IK726 svarende til 8 x 1010 cfu. Der produceres altså 5.8 gange så mange cfu i nedtørret form ud fra 1 kg sphagnum/klid substrat, og 2.2 gange så mange cfu ved en tørret molersformulering af konidier fra 1 kg sphagnum/klid substrat, som der skal anvendes til bejdsning af udsæd af 1 ha korn. Selv om sådanne simple beregninger ikke tager hensyn til tab af cfu ved en nedtørring eller under bejdseprocessen, viser de dog at flydende fermentering af IK726 er en potentielt anvendelig produktionsmetode.
Konklusion
G. roseum (IK726) kan produceres både ved fast og flydende fermentering. Ved formulering af konidier fra henholdsvis flydende og fast fermentering kan der opnåes 2-6 x 109 cfu per g præparat.