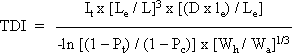|
Principper for sundhedsmæssig vurdering af kemiske stoffer med henblik på fastsættelse af kvalitetskriterier for luft, jord og vand 5 Fastlæggelse af TDI for genotoksiske carcinogener5.1 Kvantitativ vurderinger For langt de fleste typer af effekter findes der en tærskel, det vil sige en grænse (koncentration eller dosis), hvorunder der ikke ses effekt(er). Sådan forholder det sig antageligt for non-genotoksiske carcinogener, hvor den tilgrundliggende mekanisme for stoffets indflydelse på udvikling af tumorer er epigenetisk, det vil sige ikke via en beskadigelse af arvematerialet. I disse tilfælde fastlægges TDI med udgangspunkt i et nul-effektniveau (NO(A)EL) eller det laveste effektniveau (LO(A)EL) for de(n) kritiske effekt(er) under anvendelse af en usikkerhedsfaktor (UF). Principperne herfor er beskrevet nærmere kapitel 4. For visse typer af effekter findes der muligvis ikke en tærskel. Sådan forholder det sig antageligt for genotoksiske carcinogener, hvor den tilgrundliggende mekanisme for udvikling af tumorer er en beskadigelse af arvematerialet. Dette betyder i teorien, at en hvilken som helst eksponering , hvor lav den end måtte være, vil medføre en risiko for udvikling af tumorer, der er større end nul. Det skal dog understreges, at man internationalt i de senere år har diskuteret og fortsat diskuterer, hvorvidt der foreligger er tærskel for genotoksiske effekter eller ej. Under antagelse af at der for genotoksiske carcinogener ikke findes en tærskel, kan der således ikke anvendes et NO(A)EL eller LO(A)EL som udgangspunkt for estimering af TDI. I stedet foretages en kvantitativ risikovurdering. Principperne for den kvantitative risikovurdering uddybes i dette kapitel. I 5.3 er gennemgået fire forskellige kvantitative risikovurderingsmetoder/-modeller. Ved estimering af TDI for genotoksiske carcinogener er der flere forhold, der skal afklares, inden selve beregningen kan foretages: 1) kvalitativ vurdering (se 3.6), 2) kvantitativ vurdering (se 5.1 og 5.3), og 3) tolerabel risiko (se 5.2). Den administrative praksis i Danmark er baseret på, at man i videst muligt omfang skal undgå eksponering for genotoksiske carcinogener, og at disse stoffer bør erstattes med andre mindre farlige stoffer. I de tilfælde, hvor det ikke er muligt at finde alternativer kan det være nødvendigt at foretage en risikoberegning. (MST 1990). I relation til fastsættelse af kvalitetskriterier for genotoksiske carcinogener i luft, jord og drikkevand anvender Miljøstyrelsen den såkaldte one-hit model ved den kvantitative risikovurdering til beregning af TDI (afsnit 5.3.1). 5.1 Kvantitativ vurderingerVed den kvantitative vurdering (potensvurderingen) af genotoksiske carcinogener tages stilling til spørgsmålet: Hvor stor en dosis skal der til, for at det medfører en vis hyppighed af kræfttilfælde? Dyreforsøg med carcinogener har vist, at der kan være endog meget store forskelle mellem forskellige stoffer med hensyn til de doser, der skal til for at inducere tumorer i forsøgsdyr, det vil sige, at potensen med hensyn til carcinogen effekt hos forsøgsdyr varierer meget fra stof til stof. Der er ingen grund til at tro, at det skulle forholde sig anderledes for mennesker i den henseende. Med henblik på en kvantitativ risikovurdering af humane genotoksiske carcinogener foretrækkes velgennemførte og valide epidemiologiske undersøgelser. Såfremt sådanne foreligger for et givent stof, for eksempel epidemiologiske data vedrørende påvirkning af mennesker i arbejdsmiljøet, kan disse anvendes kvantitativt til at omregne fra arbejdstidseksponering til livstidseksponering. Det må imidlertid erkendes, at det er yderst sjældent, at sådanne epidemiologiske undersøgelser findes, blandt andet mangler der ofte præcise oplysninger om eksponeringsniveauer, der kan associeres med en forhøjet hyppighed af tumorer hos arbejderne. Derfor bygger potensvurderingen oftest på resultater fra langtidsdyreforsøg. Ligesom ved beregning af TDI for effekter, hvor det antages, at der findes en tærskelværdi, er der ved den kvantitative vurdering i relation til kræftfremkaldende effekter for genotoksiske carcinogener en række faktorer, som gør, at det kan være meget vanskeligt at fastlægge en bestemt værdi. Når et genotoksisk carcinogen gives i forskellige doser til grupper af forsøgsdyr, vil der typisk ved de laveste doser ses ingen eller kun en lille stigning i hyppigheden af tumorer, mens hyppigheden stiger med stigende dosis. Der vil altid være en vis hyppighed af tumorer, selv om dyrene ikke er blevet eksponeret for teststoffet, det vil sige forekomst af spontane tumorer. Lige meget hvor mange dyr der indgår i et enkelt studie for derved at gøre studiet mere robust overfor forekomsten af spontane tumorer og for at øge studiets følsomhed, kan det således rent principielt aldrig udelukkes, at stoffet kan være carcinogent. Optegnes dosis-responssammenhængen (for f.eks. hyppigheden af tumorer i %) i et diagram med logaritmen til dosis ud ad x-aksen og respons (hyppighed af tumorer) op ad y-aksen, fås for de fleste genotoksiske carcinogener en S-formet kurve (figur 3.1.1.). For at udtrykke graden af det kræftfremkaldende respons (potensen) benyttes en dosisdeskriptor, for eksempel TD5, der defineres som den dosis/koncentration der er associeret med en 5% forekomst (incidens) af tumorer i forsøgsdyr eller i epidemiologiske studier. Dosisdeskriptoren anvendes som udgangspunkt for estimering af forholdet mellem eksponering og potens (engelsk: Exposure/ Potency Indeks EPI), det vil sige, den estimerede daglige eksponering hos mennesker divideret med TD5. Et EPI på 10-6 repræsenterer således en forskel på 106 mellem den humane eksponering og den eksponering på den nedre del af dosis-responskurven, hvorpå potensestimatet er baseret. Værdien på 5% er arbitrært valgt, og valg af en anden værdi vil ikke påvirke de relative potenser for en række stoffer. Dosisdeskriptoren TD5 anvendes af de canadiske myndigheder i relation til vurdering af prioriterede stoffer i henhold til den canadiske miljøbeskyttelseslov. Dosisdeskriptoren TD50 er blevet valgt som det
mest praktiske kvantitative estimat for potensen af genotoksiske carcinogener af den britiske Committee on Carcinogenicity of Chemicals in Food, Consumer Products and the Environment. I EU sammenhæng er dosisdeskriptoren TD25 blevet foreslået som en parameter til potensvurdering med henblik på fastsættelse af specifikke koncentrationsgrænser for indhold af kræftfremkaldende stoffer i præparater og produkter i henhold til klassifikation og mærkning af præparater (se 5.3.4). US-EPA anvender dosisdeskriptoren LED10 (se 5.3.3). Der kan anvendes forskellige statistiske modeller til at beskrive sammenhængen mellem dosis og respons og forskellige fordelinger til at beskrive tilfældige udfald. Fælles for disse modeller og fordelinger er, at de forudsætter kendskab til en række parametre, der indgår i beskrivelsen af den enkelte model. Men som ofte kendes disse parametre ikke eksakt på baggrund af det foreliggende datamateriale, hvorfor kurveforløbene derfor bedst muligt må tilpasses efter de aktuelle måledata. En række modeller er blevet udviklet med henblik på at ekstrapolere fra tumorhyppigheden observeret ved de relativt høje doser anvendt i forsøgsdyr til de som regel meget lavere niveauer, der er relevante i relation til befolkningens eksponering for kemiske stoffer via miljøet (engelsk: low-dose risk extrapolation). Eksempler på udvalgte modellers anvendelse er nærmere beskrevet i 5.3. Miljøstyrelsen har siden 1990 ved estimering af en TDI for genotoksiske carcinogener anvendt den såkaldte one-hit model (se 5.3.1), med mindre der er specifikke forhold, som taler for en anvendelse af andre modeller. En hidtil meget anvendt matematiske model er den såkaldte lineære multistadiemodel (engelsk: Linearised Multi-Stage (LMS) model - se 5.3.2), som blandt andet har været anvendt af US-EPA gennem mange år og af WHO (1996) i relation til guidelines for drikkevandskvalitet. Andre metoder/modeller til kvantitativ risikovurdering er blevet foreslået i de seneste år. For eksempel har US-EPA (1996) fremsat forslag til nye retningslinier for kvantitativ risikovurdering af genotoksiske carcinogener og anbefalet som standard at anvende lineær ekstrapolation fra en benchmark dose (afsnit 3.2.2) med udgangspunkt i dosisdeskriptoren LED10 (afsnit 5.3.3). Inden for EU har der været fremsat forslag om at anvende en mere simplificeret metode baseret på dosisdeskriptoren T25 fra dyreforsøg som basis for den kvantitative risikovurdering (afsnit 5.3.4). 5.2 Tolerabel risikoVed vurdering af tolerabel risiko tages stilling til spørgsmålet: Hvilken statistisk risiko kan anses for tolerabel eller acceptabel? Der findes hverken nationalt eller internationalt faste regler for, hvilken livstidsrisiko der kan tolereres eller accepteres, da dette i høj grad er et politisk/administrativt spørgsmål. Den tolerable livstidsrisiko kan derfor være forskellig hos forskellige myndigheder og i relation til forskellige befolkningsgrupper (den generelle befolkning eller arbejdere). En livstidsrisiko på én ud af en million (10-6) blev først indført som basis for grænseværdier i 1979 som del af amerikansk lovgivning om forurening af fødevarer. En livstidsrisiko for at udvikle tumorer på 10-6 betyder, at livslang eksponering for den pågældende dosis eller koncentration kan medføre, at én ud af en million eksponerede individer i princippet kan udvikle én tumor, men ikke at det nødvendigvis sker. En livstidsrisiko på mellem 10-6 og 10-7 anses for at være tolerabel, og en livstidsrisiko, der er mindre end 10-7, anses for at være acceptabel. Miljøstyrelsens hidtidige administrative praksis i relation til fastsættelse af kvalitetskriterier for luft, jord og drikkevand har været en livstidsrisiko på 10-6 (MST 1990). Tilsvarende tages der inden for EU udgangspunkt i en dosis svarende til en 10-6 livstidsrisiko, når der fastsættes drikkevandskvalitetskrav eller grænseværdier for udeluft for genotoksiske carcinogener (MST 2002). WHO (1996) opererer i relation til guidelines for drikkevandskvalitet med en livstidsrisiko på 10-5. Dog anføres i de enkelte stofmonografier også de koncentrationer, der er associeret med livstidsrisici på 10-4 og 10-6 med den begrundelse, at det er op til det enkelte land selv at vælge hvilken livstidsrisiko, der anses for at være tolerabel. I relation til guidelines for luftkvalitet har WHO (2000) valgt at beregne det risikoestimat (engelsk: incremental unit risk estimate), som er den risiko, der er associeret med livstidseksponering for en given koncentration (1 µg/m³) af et genotoksisk carcinogen i luften. I de enkelte stofmonografier anføres endvidere de koncentrationer, der er associeret med livstidsrisici på 10-4, 10-5 og 10-6 med samme begrundelse, som anført for drikkevand, se ovenfor. US-EPA (1998) anvender i forbindelse med fastsættelse af 'Maximum Contaminant Level Goals' (MCLG) i henhold til 'Safe Drinking Water Act' for kræftfremkaldende stoffer placeret i gruppe C (se 3.6.2) en livstidsrisiko på 10-6 til 10-5. For stoffer placeret i gruppe A eller B fastsættes MCLG til nul. For disse stoffer fastsættes derudover 'Maximum Contaminant Levels' (MCL) med udgangspunkt i en livstidsrisiko på 10-6 til 10-4. MCLG er udelukkende fastsat på baggrund af sundhedsmæssige betragtninger, mens der ved fastsættelse af MCL også tages hensyn til økonomiske og teknologiske elementer. I US-EPA's database IRIS anføres for carcinogene stoffer et risikoestimat (engelsk: unit risk) for inhalation af luft og for indtagelse via drikkevand. Endvidere anføres de koncentrationer i luft henholdsvis drikkevand, der er associeret med livstidsrisici på 10-4, 10-5 og 10-6. (IRIS 2002). 5.3 Kvantitativ risikovurdering, eksempler på metoder/modellerDer er udviklet forskellige modeller til beregning af, hvor stor en risiko for udvikling af tumorer en given eksponering for et genotoksisk carcinogen udgør. I alle modeller anvendes en eller anden form for statistisk ekstrapolation fra dosisniveauer med kendte eksperimentelle værdier til de som regel meget lavere dosisniveauer, der oftest er relevante i relation til den generelle befolknings eksponering for kemiske stoffer i miljøet. Modellerne beskriver relationen mellem den administrerede daglige dosis (eller koncentration) og den resulterende tumorhyppighed. I de fleste dyreforsøg, herunder OECD- og EU guidelineforsøg for carcinogen effekt, anvendes som regel kun få dosisniveauer (oftest 2 eller 3). I de fleste dyreforsøg vælges doserne således, at responset vil ligge mellem 10 og 90%, men de få doser betyder, at der kun er nogle få punkter til beregning af dosis-responskurven, og derfor vil de fleste datasæt inden for dette interval (10-90% respons) stort set passe lige godt ind i forskellige matematiske modeller. Det er således som oftest ikke muligt at skelne mellem forskellige modellers anvendelighed ud fra de givne dyreeksperimentelle data. Problemerne opstår imidlertid, når der skal ekstrapoleres ned til lavdosisområdet, hvor der ikke findes dyreeksperimentelle data til at beregne dosis-responskurven. Det har således vist sig, at modellerne ikke nødvendigvis giver samme resultat i lavdosisområdet, hvorfor risikoestimaterne kan variere meget afhængigt af den valgte model og i nogle tilfælde op til flere størrelsesordener. Det er derfor af stor betydning, hvilken model der vælges, når risici og tolerable grænser for genotoksiske carcinogener skal beregnes. I relation til fastsættelse af kvalitetskriterier for luft, jord og drikkevand kan anvendelse af forskellige modeller ved ekstrapolering fra de doser, der resulterer i en målelig hyppighed af tumorer hos forsøgsdyr (for eksempel 10 dyr med tumorer per 100 dyr, eller 10-1) til doser, der vurderes at være tolerable (10-6), medføre store forskelle i den beregnede tolerable dosis og dermed i det beregnede kvalitetskriterium. Der er udviklet en række matematiske modeller, der er egnede til at ekstrapolere virkningen af genotoksiske carcinogener, det vil sige stoffer, der udøver deres virkning gennem et eller flere `hit' (kritiske, genotoksiske skader). Til denne gruppe hører one-hit modellen (afsnit 5.3.1), som Miljøstyrelsen hidtil har anvendt i relation til fastsættelse af kvalitetskriterier for luft, jord og drikkevand. Også den hidtil mest anvendte matematiske model, den såkaldte lineære multistadiemodel (engelsk: Linearised MultiStage (LMS) model) (afsnit 5.3.2), hører til denne gruppe af modeller og har blandt andet været anvendt af US-EPA gennem mange år og af WHO (1996) i relation til guidelines for drikkevandskvalitet. Andre metoder/modeller til kvantitativ risikovurdering er blevet foreslået i de seneste år. For eksempel har US-EPA i 1996 fremsat nye retningslinier for kvantitativ risikovurdering af genotoksiske carcinogener og anbefalet som standard at anvende lineær ekstrapolation fra en benchmark dose (afsnit 3.2.2) med udgangspunkt i dosisdeskriptoren LED10 (afsnit 5.3.3). Inden for EU har der været fremsat forslag om at anvende en mere simplificeret metode baseret på dosisdeskriptoren T25 fra dyreforsøg som basis for den kvantitative risikovurdering (afsnit 5.3.4). Også anvendelse af såkaldt biologisk baseret modellering (engelsk: biologically-based modelling) er blevet introduceret. Disse modellerne forsøger at inkorporere biologiske fænomener, der betragtes som værende essentielle i udvikling af tumorer ved eksponering for genotoksiske carcinogener, for eksempel cellekinetik og mutationsrater. Det ligger implicit i disse modeller, at der kræves data vedrørende disse forskellige biologiske parametre, og sådanne data er svære at kvantificere og findes kun yderst sjældent. Således kan disse modeller på nuværende tidspunkt ikke anvendes i den kvantitative risikovurdering i reguleringsmæssigt øjemed, og modellerne vil derfor ikke blive omtalt yderligere i denne rapport. 5.3.1 One-hit modellenI relation til fastsættelse af kvalitetskriterier for luft, jord og drikkevand anvender Miljøstyrelsen one-hit modellen, med mindre der er specifikke forhold, som taler for at anvende andre modeller. Begrundelsen for at benytte one-hit modellen er: 1) Modellen undervurderer i mindre grad end de andre modeller risikoen ved lavere koncentrationer, og 2) den er let at anvende (MST 1990). Nedenstående gennemgang er primært baseret på følgende referencer: MST (1990), MST (1992), LST (1990). Hit-modeller er egnede til at ekstrapolere virkningen af genotoksiske carcinogener, der udøver deres virkning gennem et eller flere 'hit', det vil sige kritiske, genotoksiske skader. Dette betyder, at et bestemt antal 'hit' skal ramme en celle, før denne bliver til en malign celle (kræftcelle). Det ligger implicit i hit-modellerne, at alle 'hit' sker i én bestemt celle, der først begynder at dele sig og udvikle sig til en tumor, når den har opnået det nødvendige antal 'hit'. Dette er imidlertid i dårlig overensstemmelse med eksperimentelle data, der viser, at proliferation af de celler, der har fået det første 'hit' (de initierede celler), til præneoplastiske læsioner væsentligt forøger risikoen for, at andet 'hit' netop rammer en initieret celle. One-hit modellen forudsætter, at kun et enkelt 'hit' skal ramme en celle, for at den kan udvikles til en malign celle. Således oversimplificerer one-hit modellen processen, mens de højere hit-modeller lægger en stram restriktion på muligheden for, at mere end én kritisk skade rammer samme celle. Den simple lineære one-hit model har vist sig at give omtrent samme resultater som den lineære multistadiemodel (afsnit 5.3.2) i lavdosisområdet. Inden for de generelle usikkerheder på beregningerne, gør det således ikke den store forskel, hvilken af de to modeller der anvendes i den kvantitative risikoberegning. Beregninger ved brug af one-hit modellen, som det praktiseres i relation til fastsættelse af kvalitetskriterier i luft, jord og drikkevand, er dog betydeligt simplere end ved brug af den lineære multistadiemodel, da sidstnævnte model kun kan anvendes med computerbaserede beregningsprogrammer. Ved benyttelse af one-hit modellen til beregning af TDI i relation til udvikling af systemiske tumorer med udgangspunkt i data fra dyreforsøg med oral administration eller dermal applikation af stoffet kan nedenstående formel (figur 5.3.1.1) anvendes. Ved denne beregning af TDI foretages korrektion af dosis (sidste led i nævneren) for forskelle i kropsstørrelse mellem dyr og mennesker på basis af overfladearealet (se 4.4.1.2). Dosis D skal angives i enheden mg/kg legemsvægt per dag. Hvis eksponeringen i et givent studie er udtrykt som en koncentration af stoffet i for eksempel foder, drikkevand eller luft, foretages der en omregning til enheden mg/kg legemsvægt per dag under anvendelse af standardforudsætningerne (se 6.2). Figur 5.3.1.1 Beregning af TDI i relation til udvikling af systemiske tumorer med udgangspunkt i et studie med oral administration eller dermal applikation af et stof
Ved beregning af TDI (enhed: mg/kg legemsvægt per dag) eller den tolerable koncentration (TK) (enhed: mg/m³) for genotoksiske carcinogener med udgangspunkt i data fra dyreforsøg, hvor dyrene er eksponeret for stoffet via inhalation bør one-hit modellen modificeres på følgende måde: Sidste led i nævneren i formlen i figur 5.3.1.1 bør udgå, idet der ikke bør foretages korrektion af dosis for forskelle i kropsstørrelse mellem dyr og mennesker, da mennesker og dyrs indåndingsvolumen over tid er relateret til behovet for ilt og dermed også til det enkelte individs kaloriebehov, hvorfor der implicit er taget højde for forskelle i metabolisk kapacitet mellem dyr og mennesker (se 4.4.1.2). Ved beregningen af TDI (enhed: mg/kg legemsvægt per dag) skal dosis D angives i enheden mg/kg legemsvægt per dag, hvorfor der foretages en omregning af koncentrationen i indåndingsluften (enhed mg/m³) til dosis D (enhed mg/kg legemsvægt per dag) under anvendelse af standardforudsætningerne (se 6.2). Ved beregning af TK er dosis D lig med koncentrationen i indåndingsluften (enhed mg/m³). De øvrige parametre er de samme, som angivet under figur 5.3.1.1. Den modificerede one-hit model kan også anvendes i forbindelse med genotoksiske carcinogener, der fremkalder lokale tumorer i luftvejene, idet man her antager, at det er stoffets koncentration i luften, der er af betydning for udviklingen af tumorer. Når one-hit modellen anvendes på inhalationsdata skal det i de konkrete tilfælde vurderes, om eksponeringen af dyrene har medført nedsættelse af deres indåndingsfrekvens, da dette i givet fald vil betyde, at dyrene har været udsat for lavere koncentrationer end den nominelle koncentration i inhalationskammeret. Endvidere skal der i de konkrete beregninger også tages hensyn til, om retentionen af stoffet ved de forholdsvis høje eksponeringsniveauer ved inhalationsforsøg er sammenlignelig med retentionen ved de miljømæssigt betydeligt lavere niveauer. En række forudsætninger skal være opfyldt for at one-hit modellen kan benyttes med tilstrækkelig sikkerhed (MST 1990, 1992):
5.3.2 Den lineære multistadiemodelDen lineære multistadiemodel (engelsk: Linearised MultiStage (LMS) model) har gennem mange år været US-EPA's foretrukne matematiske model til kvantitativ risikovurdering af genotoksiske carcinogener og har også været anvendt af WHO (1996) i relation til guidelines for drikkevandskvalitet. Nedenstående gennemgang er blandt andet baseret på følgende referencer: LST (1990), Lovell & Thomas (1996), Grandjean (1997). I relation til kemiske stoffer vurderes en multi-hit model at give bedre mening rent biologisk end one-hit modellen, idet den vurderes som værende i bedre overensstemmelse med den eksisterende viden om genotoksiske carcinogeners virkningsmekanisme(r). En multi-hit model forudsætter, at mindst to reaktioner er nødvendige for at fremkalde tumorer, og at sandsynligheden for hver af dem beskrives ved en Poisson fordeling. Det ligger implicit i hit-modellerne, at alle 'hit' sker i én bestemt celle, der først begynder at dele sig og udvikle sig til en tumor, når den har opnået det nødvendige antal 'hit'. Dette er imidlertid i dårlig overensstemmelse med eksperimentelle data, der viser, at proliferation af de celler, der har fået det første 'hit' (de initierede celler), til præneoplastiske læsioner væsentligt forøger risikoen for at andet 'hit' netop rammer en initieret celle. Således lægger hit-modellerne en stram restriktion på muligheden for, at mere end én kritisk skade rammer samme celle. Blandt andet for at tage højde for disse problemer med hit-modellerne blev de såkaldte multistadiemodeller udviklet. Den originale Armitage-Doll multistage model (publiceret i 1954) antog, at en normal celle skal igennem en serie irreversible, genetiske ændringer eller stadier, mutationer, i en bestemt rækkefølge, før den bliver til en malign celle og fortsætter med at udvikle sig til en tumor. Rent matematisk antog modellen, at et genotoksisk carcinogen påvirker mindst ét af disse stadier. Multistagemodellen blev valgt til regulatoriske formål, fordi modellen syntes at have paralleller til den biologiske forklaring af genotoksiske carcinogeners virkningsmekanisme. Implicit i modellen ligger, at der kræves data vedrørende biologiske fænomener, der betragtes som værende essentielle i kræftprocessen, som for eksempel cellekinetik og mutationsrater. Sådanne parametre bestemmes ikke i de gængse guideline-forsøg, og det har derfor været nødvendigt at simplificere modellen med henblik på anvendelse til regulatoriske formål. Den lineære multistadiemodel (LMS) blev udviklet fra den originale multistagemodel ved at tilpasse et polynomium til de observerede tumorhyppigheder. LMS forudsætter, at alle typer af cancer forårsaget af genotoksiske carcinogener har en fælles mekanisme, og at et hvilket som helst genotoksisk carcinogen påvirker denne del af kræftprocessen. LMS er praktisk taget lineær i lavdosisområdet, og denne lineære del benyttes til ekstrapolation mod nul. Som udgangspunkt i den kvantitative beregning anvendes data fra et langtidsstudie i gnavere. En `best fit' kurve tilpasses data fra studiet ved at anvende et computerbaseret kurvefitningsprogram (der er indtil flere forskellige muligheder). Ud fra `best fit' kurven estimeres forskellige parametre (kaldet Maximum Likelihood Estimates - MLE) baseret på den statistiske procedure, der er anvendt ved tilpasning af kurven. Disse estimater vurderes som værende `best fit estimates' og anvendes som udgangspunkt ved ekstrapolation til lavdosisområdet. En af MLE-parametrene (den såkaldte lineære parameter q1 i LMS) er i lavdosisområdet stort set ækvivalent med hældningen på kurven for sammenhængen mellem dosis og tumorhyppighed. Den øvre 95% konfidensgrænse for estimatet af q1 kaldes q1* og er central i US-EPA's anvendelse af LMS i den kvantitative risikovurdering, idet q1* repræsenterer en øvre grænse eller `worst case' estimat for dosisresponssammenhængen ved lave doser. Parameteren q1* benævnes også `unit carcinogenic risk' eller `carcinogenic potency factor'. Estimaterne af parametrene q1 og q1* anvendes til at estimere enten den risiko, der er associeret med en specifik dosis, eller den dosis der er associeret med en specifik forøgelse i risiko. Den dosis, der er associeret med en 10-6 livstidsrisiko, kaldes af US-EPA for `virtually safe dose' (VSD). Multistadiemodellerne har forskellige forudsætninger, og det er ikke muligt at afgøre, hvorvidt disse er opfyldt. For eksempel har det vist sig, at nogle af de forudsætninger, der ligger implicit i LMS, ikke længere er biologisk realistiske. Som eksempler herpå kan nævnes, at forløbet gennem de forskellige stadier ikke nødvendigvis er irreversibelt, at rækkefølgen for de forskellige processer kan variere, at `ventetiden' i de forskellige stadier sandsynligvis ikke er statistisk uafhængig, at cellerne muligvis ikke går gennem de forskellige stadier uafhængigt af hinanden, og at blandt andet celledeling kan påvirke forløbet. Endvidere kan de kinetiske forhold ved lave doser være anderledes end ved de højere doser, der normalt anvendes i dyreforsøg. US-EPA anvendte oprindeligt one-hit modellen, men valgte siden hen LMS, fordi LMS med dens flere variable parametre giver en bedre kurvefitning. I praksis har det imidlertid vist sig, at LMS giver omtrent samme resultater som den mere simple lineære one-hit model i lavdosisområdet, dog tenderer one-hit modellen til at være en anelse mere konservativ end LMS. Inden for de generelle usikkerheder på beregningerne giver det ofte således ikke den store forskel, hvilken af de to modeller der anvendes i den kvantitative risikoberegning. Ligesom ved one-hit modellen har US-EPA ved anvendelse af LMS anvendt dosiskorrektion for forskelle i kropsstørrelse mellem dyr og mennesker baseret på overfladeareal, når der blev taget udgangspunkt i studier med oral administration af stoffet. 5.3.3 Kvantitativ risikovurdering baseret på dosisdeskriptoren LED10I 1996 fremsatte US-EPA (1996) forslag til nye retningslinier for kvantitativ risikovurdering af kræftfremkaldende stoffer. Et revideret forslag til retningslinier er publiceret i 1999 (US-EPA 1999), og denne udgave er gældende, indtil de endeligt reviderede retningslinier publiceres, hvilket forventes af finde sted i løbet af 2002 US-EPA 2001). Nedenstående gennemgang er blandt andet baseret på følgende reference: US-EPA (1998), US-EPA (1999), Dragsted (1997). En af ændringerne i forhold til de tidligere retningslinier er, at LMS ikke længere anbefales som standard ved den kvantitative risikovurdering af genotoksiske carcinogener, men i stedet anbefales det i de tilfælde, hvor der ikke er noget bevis for nonlinearitet i dosis-responssammenhængen, som standard at anvende lineær ekstrapolation fra en benchmark dose (afsnit 3.2.2) med udgangspunkt i dosisdeskriptoren LED10. En anden ændring er, at der ikke længere kun tages udgangspunkt i den observerede hyppighed af tumorer i det valgte dyreforsøg, men også andre effekter relateret til cancer. En tredje ændring er, at korrektion af orale doser for forskelle i kropstørrelse mellem dyr og mennesker nu anbefales på basis af stofskiftet frem for på basis af overfladeareal (afsnit 4.4.1.2). I de nye retningslinier fremføres det, at respons i et dyreforsøg kan inkludere tumorer eller andre effekter relateret til cancer. Eksempler på sidstnævnte, som sammenfattes under begrebet `precursor data' er ændringer i DNA, chromosomer, andre essentielle makromolekyler, effekter på `growth signal transduction', inducering af fysiologiske eller hormonelle ændringer, effekter på celleproliferation, eller andre effekter som spiller en rolle i kræftprocessen. Det første kvantitative trin er en vurdering af dosis-responssammenhængen inden for det dosisområde, der er anvendt i det valgte dyreforsøg. Der er skitseret to muligheder: 1) udvikling af en biologisk baseret eller en case-specifik model, og 2) kurvefitning af tumor- eller `precursor' data. Den biologisk baserede model anbefales som `first choice', men det erkendes også, at der kun for et fåtal af stoffer vil være tilstrækkelige data til at udvikle denne type af modeller. Derfor foretages vurdering af dosis-responssammenhængen oftest på baggrund af kurvefitning af tumor- eller `precursor' data. Som standard udgangspunkt (engelsk: point of departure) anbefales at anvende den nedre 95% konfidensgrænse for den dosis, der er associeret med 10% ekstra risiko, benævnt LED10. Denne metode er faktisk identisk med 'benchmark dose' metoden (afsnit 3.2.2), det vil sige, at LED10 er identisk med BMD10. Der anvendes et computerbaseret kurvefitningsprogram til beregning af LED10. Rationalet for valget af 10% responset er, at et 10% respons er lige omkring grænsen for følsomheden med henblik på at kunne opnå statistisk signifikante forskelle i de fleste langtidsstudier i gnavere. Rationalet for valget af den nedre 95% konfidensgrænse er, at der hermed tages højde for den eksperimentelle usikkerhed. Sådanne usikkerheder inkluderer blandt andet faktorer som antal doser i studiet, afstand mellem de anvendte dosisniveauer, antal dyr per dosisgruppe, nøjagtighed af dosisbestemmelser (engelsk: precision and accuracy), nøjagtighed (engelsk: accuracy) for de patologiske fund, samt valg af lavdosisekstrapolation. Det næste kvantitative trin er ekstrapolation til lavdosisområdet. Der kan anvendes forskellige ekstrapolationsmetoder. I henhold til de nye retningslinier afhænger valget af ekstrapolationsmetode af det pågældende stofs virkningsmåde (engelsk: mode of action) og er således kædet sammen med konklusionerne i farlighedsvurderingen. Også i dette trin anbefales de biologisk baserede modeller som `first choice', men i erkendelse af at der kun yderst sjældent vil være et tilstrækkeligt datagrundlag for anvendelse af sådanne modeller anbefales derfor 3 forskellige fremgangsmåder (engelsk: default extrapolation approaches): 1) `default linear extrapolation approach', 2) `default non-linear approach', eller 3) `both linear and non-linear approaches'. Den sidstnævnte fremgangsmåde anvendes i de tilfælde, hvor der er tale om mere end en enkelt virkningsmåde for udvikling af tumorer i forskellige væv og organer. De 2 andre fremgangsmåder beskrives nærmere i det efterfølgende. `Default linear extrapolation approach', som i realiteten er en erstatning for LMS, anvendes i følgende tilfælde: 1) stoffer som er genotoksiske via en reaktion med DNA; 2) stoffer hvor der er evidens som understøtter en anden virkningsmåde end reaktion med DNA, og hvor der kan antages at være linearitet i lavdosisområdet; og 3) stoffer hvor der mangler information vedrørende virkningsmåde. Sammenfattende betyder ovenstående, at `default linear extrapolation approach' anvendes i alle de tilfælde, hvor der ikke er data, der direkte understøtter anvendelsen af `default `non-linear approach', se senere. `Default linear extrapolation approach' vurderes generelt af US-EPA som værende et konservativt `approach'. Ved selve ekstrapolationen til lavdosisområdet tages der udgangspunkt i LED10, som er estimeret ved kurvefitning af de observerede data i det valgte dyreforsøg. Er stoffet givet via oral administration eller dermal applikation, foretages der en dosiskorrektion for forskelle i kropsstørrelse mellem dyr og mennesker ved at omregne LED10 bestemt i dyreforsøget til den tilsvarende humane LED10 ved allometrisk skalering på basis af stofskiftet (afsnit 4.4.1.2) på følgende måde: Human LED10 = (LED10) [(BWdyr) / (BWhuman)]0,25 hvor BW er legemsvægten. Der foretages også en dosiskorrektion, hvis eksponeringsperioden (le) har været kortere end forsøgets varighed (Le) ved at gange dosis med forholdet mellem le og Le. En tilsvarende korrektion foretages også, hvis dyrene er blevet doseret færre dage per uge, for eksempel kun i 5 af ugens 7 dage. Selve ekstrapolationen foretages ved at tegne en ret linie mellem den korrigerede humane LED10 og nul (enten nul dosis eller nul respons). Dette udtrykkes matematisk ved ligningen y = mx, hvor y er respons eller incidens, m er liniens hældning (også kaldet `cancer potency factor'), og x er dosis. Hældningen `m' beregnes udfra ligningen m = 0,10 / LED10. Dernæst beregnes den risikospecifikke dosis RSD for en specifik livstidsrisiko for cancer udfra ligningen RSD = livstidsrisiko / m. Livstidsrisikoen for cancer ligger i henhold til US-EPA's retningslinier i intervallet mellem 10-4 og 10-6. `Default non-linear approach' anvendes i de tilfælde, hvor der er tilstrækkelig evidens til at understøtte en antagelse om, at kurveforløbet er nonlineært i lavdosisområdet, for eksempel hvor responset falder meget hurtigt i forhold til dosis. Denne metode anvendes også for kræftfremkaldende stoffer, hvor den tilgrundliggende mekanisme for udvikling af tumorer er non-genotoksisk, det vil sige, i de tilfælde hvor der er en tærskel for udvikling af tumorer. Med udgangspunkt i `point of departure', som kan være LED10, NOAEL eller LOAEL, foretages en `Margen of Exposure' (MoE) analyse ved at sammenligne `point of departure' med det humane eksponeringsniveau. Andre faktorer som `nature of the response', interindividuel variation, speciesforskelle og biopersistens vurderes også i MoE analysen, og der kompenseres for diverse typer af usikkerhed ved at inddrage en sikkerhedsfaktor. Det vil i praksis sige, at den nonlineære metode er lig den benchmarkmetode, som US-EPA anvender for de toksiske effekter, hvor der findes en tærskelværdi. 5.3.4 Kvantitativ risikovurdering baseret på dosisdeskriptoren T25Inden for EU har der været fremsat forslag om at anvende en mere simplificeret metode baseret på dosisdeskriptoren T25 som basis for den kvantitative risikovurdering. T25-metoden kræver ikke anvendelse af computerbaserede beregningsprogrammer. Nedenstående gennemgang er blandt andet baseret på følgende reference: Dybing et al. (1997), Sanner et al. (2001), Roberts et al. (2001). T25 defineres som den kroniske dosis (enhed: mg/kg legemsvægt per dag), som vil give 25% af forsøgsdyrene tumorer i et specifikt væv, efter korrektion for den spontane hyppighed, indenfor den standardiserede levetid for det pågældende species. T25 beregnes med udgangspunkt i et langtidscancerstudie. Den laveste dosis, der giver en signifikant forøgelse af forsøgsdyr med tumorer i et specifikt væv, anvendes i reglen ved beregningen af T25. Men hvis der er en højere hyppighed ved en højere dosis, der giver en lavere T25, anvendes sidstnævnte, med mindre der er særlige begrundelser for ikke at tage udgangspunkt i denne. Hvis der er flere data sæt, beregnes T25 for det mest relevante data sæt. Hvis forskellige data sæt giver T25-værdier, som ligger inden for et relativt snævert interval, anvendes gennemsnittet af disse T25-værdier. Hvis sidstnævnte procedure ikke anvendes, skal rationalet for anvendelse af en anden procedure begrundes nøje. T25 kan enten opnås direkte fra et studie, hvor en given dosis netop resulterer i, at 25% af forsøgsdyrene har fået tumorer. Beregning af T25 udfra andre sammenhænge af tumorhyppighed og dosis foretages ved at gange dosis med faktoren 25/p, hvor p er den aktuelle tumorhyppighed. Hvis eksponeringsvarigheden er kortere end standardlevetiden for det pågældende species, hvis studiet afsluttes inden standardlevetiden, og hvis eksponeringen ikke er kontinuert (24 timer per døgn, 7 dage per uge), foretages dosiskorrektion. Er stoffet givet via oral administration eller dermal applikation, foretages der en dosiskorrektion for forskelle i kropsstørrelse mellem dyr og mennesker ved at omregne T25 til den tilsvarende humane dosis HT25 (i mg/kg lgv./dag) ved allometrisk skalering på basis af stofskiftet (afsnit 4.4.1.2), idet HT25 = T25 / W0,25, hvor W0,25 er skaleringsfaktoren med henblik på korrektion af dosis for forskelle i kropsstørrelse mellem dyr og mennesker baseret på stofskiftet, se tabel 4.4.1.2. Den daglige livstidsdosis for udvikling af tumorer kan beregnes for en specifik livstidsrisiko ved at gange livstidsrisikoen med faktoren HT25/0,25. Eller den specifikke livstidsrisiko for udvikling af tumorer kan beregnes for en specifik daglig livstidsdosis ved at dividere dosis med faktoren HT25/0,25. Endelig foretages en overordnet evaluering af, hvorvidt de tilgængelige data indikerer, at den aktuelle risiko må vurderes at være forskellig fra den beregnede risiko. Der indgår 6 forskellige elementer i denne overordnede evaluering: 1) det tilgængelige datamateriale, 2) epidemiologiske studier, 3) dosis-responssammenhæng, 4) tumorsite, species, stamme, køn, 5) mekanistisk relevans for mennesker, og 6) toksikokinetik. På baggrund af denne overordnede evaluering udarbejdes et `commentary statement'. T25-metoden er blevet evalueret ved at sammenligne resultater opnået ved denne metode med resultater opnået ved anvendelse af LMS og LED10 (Sanner et al. 2001). Ved sammenligningerne blev der taget højde for de forskellige forudsætninger, som de enkelte metoder bygger på. Sammenligningen med LMS viste en god korrelation mellem de 2 metoder (korrelationskoefficient på 0,85 i et log-log plot) baseret på data for 33 stoffer. Forholdet (ratio) mellem T25 og LMS (for 10-5 livstidsrisikoen) lå inden for området fra 0,5 til 2,0 for 30 ud af de 33 stoffer. Fordelingen af de beregnede ratio for alle 33 stoffer blev plottet og de følgende parametre for fordelingen blev estimeret: Middelværdi og medianen 1,21; 5 percentil 0,50; 95 percentilen 1,87; minimum 0,45; og maksimum 2,31. For 24 stoffer gav T25 et højere resultat end LMS og for de resterende 9 stoffer et lavere resultat. Sammenligningen med LED10 viste en god korrelation mellem de 2 metoder (korrelationskoefficient på 0,94 i et log-log plot) baseret på data for 68 stoffer. Forholdet (ratio) mellem T1 og LED1 (ratio er uafhængig af hvilken livstidsrisiko, der anvendes i beregningerne) lå inden for området fra 0,5 til 2,0 for 63 ud af de 68 stoffer. Fordelingen af de beregnede ratio for 65 ud af de 68 stoffer blev plottet, og følgende parametre for fordelingen blev estimeret: Middelværdi og median lig med 1,25; 5 percentil lig med 0,54; 95 percentil lig med 1,98; minimum lig med 0,5; og maksimum lig med 2,3. For 44 stoffer gav T25 et højere resultat end LED og for 21 stoffer et lavere resultat. Anvendelsen af T25-metoden ved kvantitativ risikovurdering af genotoksiske carcinogener har for nyligt (november 2000) været til diskussion på en ECETOC workshop (Robert et al. 2001). Det blev konkluderet, at anvendelse af T25-metoden i relation til risikovurdering er problematisk og begrundet i de usikkerheder, der skyldes en falsk forudsætning vedrørende præcision og linearitet af dosis-responskurver for udvikling af tumorer. Dette er imidlertid ikke et argument, rigtigt eller forkert, der kun kan bruges imod T25-metoden, men kan også bruges mod anvendelse af de 3 andre kvantitative risikovurderingsmetoder (one-hit modellen, LMS og LED10) beskrevet i dette kapitel, da alle disse metoder anvender lineær ekstrapolation fra de relativt høje doser, der anvendes i dyreforsøg til lavdosisområdet, der repræsenterer de eksponeringsniveauer, som den generelle befolkning sædvanligvis udsættes for via miljøet. 5.3.5 WHO's retningslinier for kvantitativ risikovurderingVed kvantitativ risikovurdering af genotoksiske carcinogener har WHO (1996) i relation til guidelines for drikkevandskvalitet som standard anvendt den lineære multistadiemodel (LMS). Men andre modeller har også været anvendt i enkelte tilfælde. Ved estimering af TDI med udgangspunkt i dyreeksperimentelle studier med oral administration eller dermal applikation af det givne stof blev der ikke foretaget korrektion af dosis for forskelle i kropsstørrelse mellem dyr og mennesker. Begrundelsen herfor var, at dette medfører et yderst konservativt estimat for TDI. WHO (2000) har i relation til guidelines for luftkvalitet som standard anvendt en kvantitativ risikovurdering for de stoffer, som er placeret i IARC's gruppe 1 eller 2A (se 3.6.3), mens TDI for stoffer placeret i IARC's gruppe 2B, 3 eller 4 estimeres med udgangspunkt i tærskelværdiprincippet (kapitel 4). Det er dog anført, at der i tilfælde af tilstrækkelig evidens kan afviges fra standardreglen. For eksempel kan TDI for stoffer i IARC's gruppe 1 eller 2A estimeres med udgangspunkt i tærskelværdiprincippet, hvis der er tilstrækkelig evidens for, at et givent stof ikke er genotoksisk. Omvendt kan der for stoffer i IARC's gruppe 2B foretages kvantitativ risikovurdering, hvis der er tilstrækkelig evidens for, at et givent stof er genotoksisk. Ved kvantitativ risikovurdering af genotoksiske carcinogener med udgangspunkt i dyreeksperimentelle studier har den lineære multistadiemodel (LMS) været anvendt som standard til beregning af 'unit risk' (UR), det vil sige det risikoestimat, som er associeret med livstidseksponering for en given koncentration (1 µg/m³) af det givne stof i luften. Men andre modeller har også været anvendt i enkelte tilfælde. Ved kvantitativ risikovurdering af stoffer med udgangspunkt i humane data har den såkaldte 'average relative risk method' været anvendt til beregning af 'unit risk' (UR) som følger:
5.4 SammenfatningFor visse typer af effekter findes der muligvis ikke en tærskel. Sådan forholder det sig antageligt for genotoksiske carcinogener, hvor den tilgrundliggende mekanisme for udvikling af tumorer er en beskadigelse af arvematerialet. Dette betyder i teorien, at en hvilken som helst eksponering, hvor lav den end måtte være, vil medføre en risiko for udvikling af tumorer, der er større end nul. Det skal dog understreges, at man internationalt i de senere år har diskuteret og fortsat diskuterer, hvorvidt der foreligger er tærskel for genotoksiske effekter eller ej. Under antagelse af at der for genotoksiske carcinogener ikke findes en tærskel, kan tærskelværdiprincippet (se kapitel 4) således ikke anvendes med henblik på estimering af TDI for sådanne stoffer. I stedet estimeres TDI ved en kvantitativ risikovurdering, og principperne herfor er uddybet i dette kapitel. Ligeledes er fire forskellige kvantitative risikovurderingsmetoder/-modeller beskrevet (se 5.3). I relation til fastsættelse af kvalitetskriterier i luft, jord og drikkevand har Miljøstyrelsen siden 1990 ved estimering af en TDI for genotoksiske carcinogener anvendt den såkaldte one-hit model (se 5.3.1), med mindre der er specifikke forhold, som taler for en anvendelse af andre modeller. Den lineære multistadiemodel (engelsk: Linearised MultiStage (LMS) model – se 5.3.2) har gennem mange år været US-EPA's foretrukne matematiske model til kvantitativ risikovurdering af genotoksiske carcinogener og har også været anvendt af WHO (1996) i relation til guidelines for drikkevandskvalitet. Den simple lineære one-hit model har vist sig at give omtrent samme resultater som LMS i lavdosisområdet. Inden for de generelle usikkerheder på beregningerne, giver det ofte således ikke den store forskel, hvilken af de to modeller der anvendes i den kvantitative risikoberegning. Andre metoder/modeller til kvantitativ risikovurdering af genotoksiske carcinogener er blevet foreslået i de seneste år. For eksempel har US-EPA (1996) fremsat nye retningslinier og anbefaler nu som standard at anvende lineær ekstrapolation fra en benchmark dose (afsnit 3.2.2) med udgangspunkt i dosisdeskriptoren LED10 (den nedre 95% konfidensgrænse for den dosis, der er associeret med 10% ekstra risiko, oftest beregnet ved kurvefitning af tumor- og/eller 'precursor' data) (afsnit 5.3.3) i stedet for den lineære multistadiemodel (LMS). Ulempen ved LED10-metoden er, såvel som ved LMS, at denne kræver anvendelse af computerbaserede programmer, for at beregningerne kan udføres. Inden for EU har der været fremsat forslag om at anvende en mere simplificeret metode baseret på dosisdeskriptoren T25 som basis for den kvantitative risikovurdering (afsnit 5.3.4). T25-metoden kræver således ikke anvendelse af computerbaserede beregningsprogrammer. T25 defineres som den kroniske dosis (enhed: mg/kg legemsvægt per dag), som vil give 25% af forsøgsdyrene tumorer i et specifikt væv, efter korrektion for den spontane hyppighed, indenfor den standardiserede levetid for det pågældende species. T25-metoden er blevet evalueret ved at sammenligne resultater opnået ved denne metode med resultater opnået ved anvendelse af LMS og LED10. Ved sammenligningerne blev der taget højde for de forskellige forudsætninger, som de enkelte metoder bygger på. Sammenligningen med både LMS (for 33 stoffer) og med LED10 (for 68 stoffer) viste en god korrelation mellem de 2 metoder indbyrdes. Dog har T25-metoden en tendens til at give et højere resultat end LMS og LED10, det vil sige, at T25-metoden ikke er ligeså konservativ som LMS og LED10. Oprindeligt er T25-metoden blevet foreslået som en parameter til potensvurdering med henblik på fastsættelse af specifikke koncentrationsgrænser for indhold af kræftfremkaldende stoffer i præparater og produkter i henhold til klassifikation og mærkning af præparater inden for EU. Metoden er siden hen også blevet foreslået anvendt i relation til kvantitativ risikovurdering af genotoksiske carcinogener inden for EU's risikovurderingsprogram for eksisterende stoffer og ventes at blive den anbefalede metode fremover i henhold til den reviderede Technical Guidance Document (TGD) (se 1.2.1). I relation til fastsættelse af kvalitetskriterier for luft, jord og drikkevand anbefales det enten at anvende one-hit modellen i den kvantitative risikovurdering til beregning af TDI eller TK eller alternativt T25-metoden. En af disse to metoder anbefales frem for LED10-metoden, idet begge metoder vurderes at give resultater, der er sammenlignelige med LED10-metoden, men beregningerne er mere simple og gennemskuelige og kan udføres uden anvendelse af computerbaserede beregningsprogrammer. Et forhold, der taler for anvendelse af T25-metoden frem for one-hit modellen, er, at denne metode er accepteret i relation til kvantitativ risikovurdering af genotoksiske carcinogener inden for EU's risikovurderingsprogram for eksisterende stoffer. Når den kvantitative risikovurdering foretages med udgangspunkt i dyreeksperimentelle studier, hvor teststoffet er givet ved oral administration eller dermal applikation, anbefales det at foretage dosiskorrektion for forskelle i kropsstørrelse mellem dyr og mennesker på basis af stofskiftet (afsnit 4.4.1.2). Dosiskorrektion er ikke relevant i de tilfælde, hvor teststoffer er administreret via inhalation. Der findes hverken nationalt eller internationalt faste regler for, hvilken livstidsrisiko der kan tolereres eller accepteres, da dette i høj grad er et politisk/administrativt spørgsmål. Den tolerable livstidsrisiko kan derfor være forskellig hos forskellige myndigheder. En livstidsrisiko for at udvikle tumorer på 10-6 betyder, at livslang eksponering for den pågældende dosis eller koncentration kan medføre, at én ud af en million eksponerede individer i princippet kan udvikle én tumor, men ikke at det nødvendigvis sker. En livstidsrisiko på mellem 10-6 og 10-7 anses for at være tolerabel, og en livstidsrisiko. Miljøstyrelsens hidtidige administrative praksis i relation til fastsættelse af kvalitetskriterier for luft, jord og drikkevand har været en livstidsrisiko på 10-6. Inden for EU anvendes et 10-6 livstidsrisikoestimat som udgangspunkt, når der fastsættes drikkevandskvalitetskrav eller grænseværdier for udeluft for genotoksiske carcinogener. WHO angiver i relation til vejledende grænseværdier for drikkevand og luft de koncentrationer, der er associeret med livstidsrisici på 10-4, 10-5 og 10-6, således at den enkelte myndighed selv kan vælge den koncentration, der svarer til den pågældende myndigheds tolerable livstidsrisiko. I US-EPA's database IRIS anføres for carcinogene stoffer et risikoestimat (engelsk: unit risk) for inhalation af luft og for indtagelse via drikkevand. Endvidere anføres de koncentrationer i luft henholdsvis drikkevand, der er associeret med livstidsrisici på 10-4, 10-5 og 10-6. 5.5 ReferencerDragsted LO (1997). Cancer risk assessment and the EPA guidelines. Hum Ecol Risk Assess 3, 501-505. Dybing E, Sanner T, Roelfzema H, Kroese K and Tennant RW (1997). T25: A simplified carcinogenic potency index: Description of the system and study of correlations between carcinogenic potency and species/site specificity and mutagenicity. Pharmacol Toxicol 80, 272-279. Grandjean P (1997). Farlig forurening. Fra risikovurdering til forebyggelse. Sundhedsstyrelsen. Nyt Nordisk Forlag Arnold Busck, København. IARC (1987): Overall evaluations of carcinogenicity: An updating of IARC monographs volumes 1 to 41, Supplement 7. IARC monographs on the evaluation of carcinogenic risks to humans. World Health Organization, International Agency for Research on Cancer. IRIS (2002). http://www.epa.gov/iris/intro.htm. Lovell DP and Thomas G (1996). Quantitative risk assessment and the limitations of the linearized multistage model. Hum Exp Toxicol 15, 87-104. LST (1990). Kvantitativ risikovurdering af kræftfremkaldende stoffer. Levnedsmiddelstyrelsen, Sundhedsministeriet. MEM (1997). Bekendtgørelse om klassificering, emballering, mærkning, salg og opbevaring af kemiske stoffer og produkter. Miljø- og Energiministeriets bekendtgørelse nr. 801 af 23. oktober 1997. MST (2002). Personlig meddelelse. MST (1992). Sundhedsmæssig vurdering af kemiske stoffer i drikkevand. Vejledning fra Miljøstyrelsen Nr. 1 1992. Miljøministeriet, Miljøstyrelsen. MST (1990). Begrænsning af luftforurening fra virksomheder. Vejledning fra Miljøstyrelsen Nr. 6 1990. Miljøministeriet, Miljøstyrelsen. Roberts RA, Crump KS, Lutz WK, Wiegand H-J, Williams GM, Harrison PTC and Purchase IFH (2001). Scientific analysis of the proposed uses of the T25 dose descriptor in chemical carcinogen regulation. An ECETOC Workshop overview. Arch Toxicol 75, 507-512. Sanner T, Dybing E, Willems MI and Kroese ED (2001). A simple method for quantitative risk assessment of non-threshold carcinogens based on the dose descriptor T25. Pharmacol Toxicol 88, 331-341. US-EPA (2001). Cancer risk assessment guidelines. FR notice (November 2001). http://www.epa.gov/NCEA/raf/pdfs/cancer_gls.pdf. US-EPA (1999). Guidelines for carcinogen risk assessment. NCEA-F-0644, July 1999, Reviewed Draft. http://www.epa.gov/NCEA/raf/cancer.htm. US-EPA (1998). Ambient water quality criteria derivation for the protection of human health – Technical Support Document. Final draft. United States Environmental Protection Agency, Office of Water 4304, EPA-822-B-98-005. US-EPA (1996). Proposed guidelines for carcinogen risk assessment (April 23, 1996). Federal Register 61(79):17960-18011. http://www.epa.gov/NCEA/raf/pdfs/propcra_1996.pdf. WHO (2000). Criteria for carcinogenic endpoint. In: Air quality guidelines for Europe, second edition. World Health Organization, Regional Office for Europe, Copenhagen, 20-29. WHO (1999). Principles for the assessment of risks to human health from exposure to chemicals. Environmental Health Criteria 210, International Programme on Chemical Safety, World Health Organization, Geneva. WHO (1996). 12. Chemical and physical aspects: introduction. In: Guidelines for drinking-water quality, second edition. Volume 2 Health criteria and other supporting information. World Health Organization, Geneva, 121-131.
|