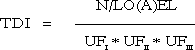|
Principper for sundhedsmæssig vurdering af kemiske stoffer med henblik på fastsættelse af kvalitetskriterier for luft, jord og vand 4 Fastlæggelse af TDI for stoffer med en tærskelværdi for effekter4.1 Tolerabel daglig indtagelse (TDI) Farlighedsvurderingen munder ud i en identifikation af de(n) kritiske effekt(er) for stoffet, det vil sige hvilke(n) effekt(er), der anses for at være mest væsentlig(e) i relation til fastsættelse af kvalitetskriterier for luft, jord og/eller drikkevand. Det næste skridt i fastsættelse af kvalitetskriterierne er fastlæggelse af den såkaldte tolerable daglige indtagelse (TDI). Ved beregning af TDI skelnes der mellem, hvorvidt der antages at findes en tærskel (engelsk: threshold) for stoffets kritiske effekt(er) eller ej. For langt de fleste typer effekter findes der en tærskel, det vil sige en grænse (koncentration eller dosis), hvorunder der ikke ses effekt(er). Sådan forholder det sig også for carcinogener, som ikke er genotoksiske, det vil sige hvor den tilgrundliggende mekanisme for stoffets indflydelse på udvikling af tumorer ikke er en beskadigelse af arvematerialet. I disse tilfælde fastlægges TDI med udgangspunkt i et nul-effektniveau (NO(A)EL) eller det laveste effektniveau (LO(A)EL) for de(n) kritiske effekt(er) under anvendelse af en usikkerhedsfaktor (UF) (engelsk: Uncertainty Factor). Principperne herfor er beskrevet nærmere i dette kapitel. For nogle typer af effekter findes der muligvis ikke en tærskel. Dette antager man for eksempel for genotoksiske carcinogener, hvor den tilgrundliggende mekanisme for udvikling af tumorer er en beskadigelse af arvematerialet. I disse tilfælde fastlægges TDI på baggrund af en kvantitativ risikovurdering, principperne herfor er beskrevet nærmere i kapitel 5. 4.1 Tolerabel daglig indtagelse (TDI)Den tolerable daglige indtagelse (TDI) er en beregnet størrelse (koncentration eller dosis), som mennesker vurderes at kunne udsættes for (tolerere) gennem et helt livsforløb, uden at der optræder sundhedsskadelige effekter. TDI angives sædvanligvis i enheden mg/kg legemsvægt per dag. Termen TDI anvendes almindeligvis også i de tilfælde, hvor eksponering for stoffet sker via inhalation af luft indeholdende stoffet eller ved hudkontakt, selvom der strengt taget ikke er tale om indtagelse af stoffet i disse tilfælde. Analogt til TDI kan termen tolerabel koncentration (TK) defineres som den koncentration af et stof i luft, jord, eller drikkevand som mennesker vurderes at kunne udsættes for (tolerere) gennem et helt livsforløb uden at der optræder sundhedsskadelige effekter. TK angives i enheden mg/m³ (luft), mg/l (drikkevand), eller i mg/kg (jord). For nogle stoffer fastsættes i stedet for TDI en foreløbig (provisorisk) tolerabel ugentlig indtagelse (engelsk: Provisional Tolerable Weekly Intake – PTWI). PTWI benyttes sædvanligvis i relation til stoffer, hvor eksponeringen kan variere fra dag til dag, og hvor der kan opstå kroniske effekter, som for eksempler visse metaller (bly, cadmium og kviksølv). Derudover anvendes bredt et par andre termer, der er analoge til TDI: 1) den acceptable daglige indtagelse (engelsk: Acceptable Daily Intake - ADI), som anvendes ved vurdering af for eksempel tilsætningsstoffer, pesticidrester samt rester af veterinære lægemidler i levnedsmidler; samt 2) Reference Dose (RfD), som anvendes bredt af den amerikanske miljøstyrelse (US-EPA). De overordnede principper for fastsættelse af ADI og RfD er sammenlignelige med de principper, der beskrives i dette kapitel for fastlæggelse af TDI, mens det for beregningerne tilgrundliggende datamateriale ofte er betydeligt bedre end det datamateriale, der oftest er tilgængeligt i relation til fastsættelse af kvalitetskriterier for luft, jord og drikkevand. For stoffer, hvor den akutte toksicitet vurderes som værende den kritiske effekt med henblik på fastsættelse af kvalitetskriterier i luft, jord og drikkevand, er det meningsløst er fastsætte en TDI. For sådanne stoffer fastlægges i stedet den maksimale tolerable dosis/koncentration (MTD/K) som udgangspunkt for fastsættelse af kvalitetskriterierne. 4.2 TærskelværdiFor langt de fleste typer af effekter findes der en tærskel, det vil sige en grænse (koncentration eller dosis), hvorunder der ikke ses effekt. Det diskuteres dog fortsat, hvorvidt der eksisterer sådanne tærskler. I teorien kunne man forestille sig, at et enkelt molekyle er tilstrækkeligt til at udløse en toksisk effekt, og den opfattelse er stadig fremherskende med hensyn til mutagene effekter. Men organismen har flere muligheder for at modvirke eventuelle toksiske effekter som for eksempel nedbrydning af stoffet, reparation af en skadelig påvirkning i en celle, udskiftning af skadede celler, eller kompensation på anden vis for en given påvirkning. Tærskelværdien defineres som den koncentration eller dosis hvorunder der ikke observeres effekter. Tærskelværdiens størrelse afhænger af det enkelte stofs potens såvel som af det eksponerede individ. For eksempel vil allergikere reagere på udsættelse for allergifremkaldende stoffer ved langt lavere koncentrationer end ikke-allergikere, det vil sige, at allergikere har en lavere tærskelværdi for sådanne stoffer end ikke-allergikere. Men ved udsættelse for ikke-allergifremkaldende stoffer vil tærskelværdien for en given effekttype (for eksempel nyreskader) alt andet lige ikke nødvendigvis være anderledes hos allergikere sammenlignet med ikke-allergikere. 4.3 Kritisk effekt og nul-effektniveauSom tidligere nævnt, munder farlighedsvurderingen (kapitel 3) ud i en identifikation af de(n) kritiske effekt(er) (se 3.4) for stoffet, det vil sig en udpegning af de(n) effekt(er), der anses for at være mest væsentlig(e) i relation til fastsættelse af kvalitetskriterier for luft, jord og/eller drikkevand. Ved identifikationen af de(n) kritiske effekt(er) sammenholdes og vurderes alle de informationer, der er samlet under vurderingerne af de enkelte studier. Principperne for den samlede vurdering af alle stoffets effekter med henblik på identifikation af de(n) kritiske effekt(er) er de samme, som beskrevet for vurdering af det enkelte studie (se 3.1). Det næste skridt i fastsættelsen af kvalitetskriterier er i teorien en fastlæggelse af tærskelværdien for de(n) kritiske effekt(er). I praksis tager man udgangspunkt i et observeret nul-effektniveau (NO(A)EL), det vil sige den højeste koncentration eller dosis, hvorved de(n) kritiske effekt(er) ikke er blevet observeret og vurderet ud fra alle de informationer, der er samlet sammen. En lang række stoffer er imidlertid ikke undersøgt tilstrækkeligt til, at det er muligt at fastlægge et observeret nul-effektniveau. I disse tilfælde fastlægges det laveste effektniveau (LO(A)EL), hvorved de(n) kritiske effekt(er) er blevet observeret. Principperne for fastlæggelse af nul-effektniveau eller det laveste observerede effektniveau for de(n) kritiske effekt(er) er de samme, som beskrevet for fastlæggelse af nul-effektniveau eller det laveste observerede effektniveau i det enkelte studie (se 3.2). I længerevarende inhalationsstudier med gentagen dosering udsættes forsøgsdyrene oftest for stoffet i et begrænset tidsrum, for eksempel 6 timer om dagen, 5 dage per uge i et antal uger. For mange typer af systemiske effekter anses det i højere grad at være den samlede dosis og ikke stoffets koncentration i luften, der er af betydning for udvikling af disse effekter. Ved fastsættelse af kvalitetskriterier i disse tilfælde foretages en omregning af det fastlagte nul-effektniveau (eller det laveste effektniveau) til et gennemsnitligt døgnniveau (kontinuert eksponering) eller døgndosis ud fra de i studiets aktuelle eksponeringsbetingelser. For lokale effekter (effekter, der optræder lokalt i luftvejene samt direkte effekter på hud og øjne) anses det sædvanligvis at være stoffets koncentration i luften og ikke den samlede dosis som sådan, der er af betydning for udvikling af disse effekter, hvorfor der i disse tilfælde ikke omregnes til en kontinuert eksponering. 4.4 Usikkerhedsfaktorer (UF)Begreberne usikkerhedsfaktor (engelsk: Uncertainty Factor - UF), sikkerhedsfaktor (engelsk: Safety Factor - SF), korrektionsfaktor (engelsk: Adjustment Factor - AF), ekstrapolationsfaktor (engelsk: Extrapolation Factor - EF) samt konverteringsfaktor (engelsk: Conversion Factor - CF) finder anvendelse i relation til fastsættelse af TDI i forskellige sammenhænge. I erkendelse af at faktoren har til formål at afspejle de usikkerheder, der blandt andet kan skyldes mangler i den eksisterende viden, frem for at udtrykke en sikkerhedsmargen, er man internationalt mere og mere gået over til at anvende begrebet usikkerhedsfaktor. Dette begreb vil blive anvendt fremover i rapporten, med mindre der specifikt relateres til et af de andre begreber. Som nævnt tidligere beregnes TDI for stoffer, hvor der er en tærskelværdi for de(n) kritiske effekt(er), med udgangspunkt i det observerede nul-effektniveau (NO(A)EL) eller det laveste observerede effektniveau (LO(A)EL) for de(n) kritiske effekt(er) under anvendelse af en usikkerhedsfaktor (UF). Formålet med usikkerhedsfaktoren er at tage højde for eventuelle mangler i den eksisterende viden og datagrundlaget. I relation til anvendelsen af usikkerhedsfaktoren har der hidtil i en lang række reguleringsmæssige sammenhænge næsten udelukkende været fokuseret på at tage højde for artsforskelle (engelsk: interspecies variation) samt for variationer i menneskers individuelle følsomhed/sårbarhed (engelsk: intraspecies variation, interindividual variation). Traditionelt har der siden midten af 1950'erne været anvendt en samlet sikkerhedsfaktor på 100, når der tages udgangspunkt i data fra forsøgsdyr. Denne procedure blev foreslået i 1954 af Lehman & Fitzhugh til vurdering af `et sikkert niveau' for tilsætningsstoffer eller kontaminanter i levnedsmidler og blev i 1961 adopteret af `the Joint FAO/WHO Expert Committee on Food Additives' (JECFA) og af `the Joint Meeting of Experts on Pesticides Residues' (JMPR) i en lidt modificeret form. Denne 100 faktor var ikke begrundet i kvantitative forhold, men et arbitrært valg og rationalet for størrelsesordenen på 100 kendes ikke. Ifølge Lehman & Fitzhugh (1954) blev 100-faktoren valgt med henblik på at omfatte følgende usikkerheder: 1) intra (human) species variabilitet; 2) inter (dyr til menneske) species variabilitet; 3) tage højde for mere følsomme individer i den humane population som følge af sygdom ved sammenligningen med sunde forsøgsdyr; og 4) mulige synergistiske virkninger af de mange tilsætningsstoffer eller kontaminanter. I de tilfælde, hvor der tages udgangspunkt i velgennemførte undersøgelser i mennesker, har der traditionelt været anvendt en samlet sikkerhedsfaktor på 10, det vil sige, at den traditionelle faktor på 100 i princippet er opdelt i to faktorer på 10 hver til at kompensere for henholdsvis interspecies variation og interindividuel variation. I nyere tid er man internationalt mere og mere gået over til at opdele usikkerhedsfaktoren i flere kategorier, herunder en underopdeling af den enkelte kategori, og i visse tilfælde at anvende en samlet faktor på mere end 100, for eksempel når der tages udgangspunkt i et begrænset datamateriale, ved fravær af et nul-effektniveau, eller ved mangel af kroniske studier (se også 4.4.3). Ved estimering af Reference Dose (RfD) vurderer US-EPA 5 forskellige kategorier af usikkerhed: 1) interindividuel variation (UFH), 2) interspeciesvariation (UFA), 3) subkronisk til kronisk varighed (UFS), 4) LOAEL til NOAEL (UFL) og , 5) datasættes kvalitet og relevans (UFD). Standardværdien for den enkelte kategori er 10, men en samlet usikkerhedsfaktor på over 3000 anvendes generelt ikke. (US-EPA 1998). I relation til fastsættelse af kvalitetskriterier for luft, jord og drikkevand har sikkerhedsfaktoren (SF) hidtil været opdelt i tre hovedkategorier (MST 1990):
Som nævnt tidligere vil betegnelsen usikkerhedsfaktorer blive anvendt fremover, idet denne term i højere grad svarer til rationalet for at anvende faktorerne. Ved anvendelse af betegnelsen sikkerhedsfaktor kan man fejlagtigt få den opfattelse, at hvis der er anvendt en stor sikkerhedsfaktor for et stof, så er den opnåede beskyttelse (sikkerhed) større for dette stof end for et andet stof, hvor der er anvendt en lavere sikkerhedsfaktor. I det efterfølgende gøres der nærmere rede for de tre usikkerhedsfaktorer, herunder de elementer, der indgår i den enkelte faktor samt rationalet for valg af en arbitrær/pragmatisk standardværdi (engelsk: default value) for de enkelte faktorer. 4.4.1 Usikkerhedsfaktor I (”interspeciesvariation”)4.4.1.1 Biologisk variationRent biologisk og biokemisk minder mennesker om andre pattedyr, også med hensyn til udvikling af forskellige typer af toksiske effekter. I en nylig publiceret undersøgelse (Olson et al. 2000) er overensstemmelsen mellem effekter observeret i dyreforsøg og hos mennesker vurderet for 150 lægemidler med 221 forskellige humane end-points. Resultaterne viste overensstemmelse mellem effekter observeret i mennesker og forsøgsdyr (både gnavere og ikke-gnavere) for 71% af effekterne, det vil sige samme type effekter i samme organsystem. Den største grad af overensstemmelse blev observeret for hæmatologiske, gastrointestinale samt kardio-vaskulære end-points, mens den mindste grad af overensstemmelse blev observeret for dermale effekter. Men selv om testning af stoffer i forsøgsdyr i høj grad vil være prædiktiv for tilsvarende effekter i mennesker, kan mennesker være mere eller mindre følsomme end andre pattedyr over for toksiske stoffer, ligesom der kan være endog store forskelle i de forskellige dyrearters følsomhed. Forskellene i følsomhed afspejler dels forskelle i toksikokinetik (absorption, fordeling, metabolisme samt udskillelse), og dels forskelle i toksikodynamik (interaktionen mellem et toksisk stof og virkningsstedet samt de efterfølgende reaktioner, som leder til udvikling af en toksisk effekt). Den generelle opfattelse er, at det især er forskelle i metabolismen af fremmedstoffer, der spiller den største rolle for interspeciesvariationen (Davidson et al. 1986, Calabrese et al. 1992, Voisin et al. 1990). Hertil kommer, at der findes forskellige former for organer og væv de enkelte arter imellem (for eksempel har gnavere organer og væv, som mennesker ikke har), forskellige former for fordøjelse, samt anderledes struktur af de øvre luftveje. Dette betyder, at visse effekter som udvikles i forsøgsdyr ikke nødvendigvis vil være af relevans for mennesker (se også 3.5). Ekstrapolation af data fra dyr til mennesker kan opfattes som omhandlende to forskellige aspekter: 1) korrektion af dosis for forskelle i kropsstørrelse mellem forsøgsdyr og mennesker (se 4.4.1.2), og 2) andre former for forskelle mellem forsøgsdyr og mennesker, som ikke nødvendigvis afspejles i forskellene i kropsstørrelse (se 4.4.1.3). 4.4.1.2 Korrektion for forskelle i kropsstørrelse mellem dyr og menneskerVed ekstrapolation af data fra dyr til mennesker indgår korrektion af doser anvendt i dyreforsøg for forskelle i kropsstørrelse mellem forsøgsdyr og mennesker, såkaldt allometrisk skalering. Rationalet for skalering er funderet på ligheder i anatomisk henseende samt den universelle karakter i fysiologiske funktioner og i biokemiske reaktioner på tværs af arterne på trods af den store forskel i størrelse, facon og form mellem forskellige arter (Davidson et al. 1986). Hvorvidt dosis bør korrigeres for forskelle i kropsstørrelse ved allometrisk skalering, afhænger af eksponeringsvejen anvendt i dyreforsøget. Dosiskorrektion ved allometrisk skalering anvendes ved udgangspunkt i studier med oral administration og dermal applikation, men ikke med inhalation (se 4.4.1.2.4). Almindeligvis anvendes legemsvægten som et udtryk for kropsstørrelsen, da denne parameter er den letteste at opnå korrekte måleresultater for (Davidson et al. 1986). Korrektion for forskelle i kropsstørrelse mellem dyr og mennesker på basis af legemsvægt bygger på en antagelse om, at legemsvægten er et godt relativt mål for de faktorer, der er bestemmende for koncentrationen af et givent stof i blodet (Vermeire et al. 1999). I dyreforsøg angives den daglige eksponering ofte i enheden mg/kg legemsvægt per dag (mg/kg lgv./dag), og den ækvivalente humane dosis, udtrykt i mg/kg lgv./dag, vil således være identisk med dosis i dyreforsøget. Denne form for dosiskorrektion, hvor der korrigeres forholdsmæssigt med hensyn til kropsvægten på individniveau, vurderes i en vis grad at tage hensyn til forskelle i kropsstørrelse mellem forskellige species (for eksempel dyr og mennesker), men er også blevet kritiseret som værende utilstrækkelig. Mere end 100 forskellige biologiske parametre (morfologiske, fysiologiske, biokemiske, farmakologiske og toksikologiske) har vist sig at kunne udtrykkes som en matematisk funktion af legemsvægten, den såkaldte allometriske ligning, og denne sammenhæng synes at være konsistent på tværs af en lang række species (Davidson et al.1986, Voisin et al. 1990, Calabrese et al. 1992):
For parametrene legemsoverfladeareal (engelsk: body surface area – i det efterfølgende benævnt overfladeareal) samt stofskifte (engelsk: metabolic rate eller caloric requirement/demand) er der fundet en proportional sammenhæng med legemsvægten med eksponenten n lig med 0,67 for overfladeareal og lig med 0,75 for stofskiftet (Davidson et al.1986, Vermeire et al. 1999, Feron et al. 1990). Anvendelse af disse 2 parametre som udgangspunkt for dosiskorrektion for forskelle i kropsstørrelse mellem dyr og mennesker beskrives nærmere i 4.4.1.2.2 (overfladeareal) og 4.4.1.2.3 (stofskifte). Hvorvidt dosis bør korrigeres for forskelle i kropsstørrelse ved allometrisk skalering, afhænger, som tidligere nævnt, af eksponeringsvejen anvendt i dyreforsøget. Således anvendes dosiskorrektion ved allometrisk skalering ved udgangspunkt i studier med oral administration og dermal applikation, men ikke med inhalation. 4.4.1.2.1 Dosiskorrektion på basis af legemsvægt Når korrektion for forskelle i kropsstørrelse mellem dyr og mennesker foretages på basis af legemsvægten (W), er eksponenten n i den allometriske ligning lig med 1, og den ækvivalente humane dosis (Hdosis - udtrykt i samme enhed som Adosis) kan beregnes ud fra dosis i et dyreforsøg (Adosis - udtrykt i f.eks. enheden mg) i henhold til følgende ligning:
Der ligger implicit i dette udtryk, at når dosis i dyreforsøget er udtrykt i enheden mg/kg legemsvægt, er den ækvivalente dosis for mennesker (udtrykt i mg/kg legemsvægt) lig med dosis i dyreforsøget, det vil sige, at der ikke anvendes en skaleringsfaktor, da denne er lig med 1. Dermed kan sammenhængen beskrives som følger:
Dosiskorrektion på basis af legemsvægt illustreres i det følgende eksempel: NOAEL er vurderet til 1 mg i et studie med rotter (vægt 250 g), svarende til 4 mg/kg legemsvægt. Den ækvivalente dosis for mennesket (vægt 70 kg) beregnes til 280 mg (1 mg x [70 kg / 0,25 kg]), svarende til 4 mg/kg legemsvægt (280 mg / 70 kg). 4.4.1.2.2 Dosiskorrektion på basis af overfladeareal Som tidligere nævnt er det blevet kritiseret, hvorvidt anvendelse af legemsvægten som udgangspunkt ved korrektion af dosis for forskelle i kropsstørrelse mellem dyr og mennesker i tilstrækkelig grad tager højde for disse forskelle i kropsstørrelse. De hyppigst anvendte forsøgsdyr er små gnavere, og deres stofskifte (engelsk: metabolic rate), karakteriseret ved iltforbrug og varmeproduktion, er en del anderledes end menneskers, i hvert fald kvantitativt. Små individer har i forhold til legemsvægten et højere iltforbrug end større individer, hvilket betyder, at stofskiftet (udtrykt per kg legemsvægt) stiger i takt med faldende legemsvægt. Derimod har det vist sig, at når stofskiftet udtrykkes per enhed overfladeareal, så er der en direkte proportional sammenhæng mellem forskellige dyrearter og mennesker. (Davidson et al. 1986). Tilbage i 1966 analyserede Freireich et al. (citeret i Davidson et al.1986, Calabrese et al. 1992, Grönlund 1992) interspeciesforskelle i følsomhed for toksiske effekter med udgangspunkt i korrektion af dosis for forskelle i kropsstørrelse mellem individer baseret på legemsvægt (W1,0 i den allometriske ligning) eller på overfladeareal (W0,67 i den allometriske ligning). Standardiseringen blev foretaget for 18 forskellige cancerkemoterapeutika givet til mus, rotte, hamster, hund, abe, og mennesker. Resultaterne af disse analyser ledte til den konklusion, at de toksiske effekter af et givent stof var sammenlignelig på tværs af species, når dosis blev korrigeret på basis af overfladearealet. Dourson & Stara (1983) analyserede anvendelsen af overfladearealet frem for legemsvægten som basis for dosiskorrektion for forskelle i kropsstørrelsen og fandt, at dosiskorrektion på basis af overfladeareal mere præcist afspejlede forskelle i en række biologiske parametre mellem dyrearter sammenlignet med dosiskorrektion på basis af legemsvægt. Når dosis udtrykt på basis af overfladeareal blev omregnet til en tilsvarende dosis udtrykt i mg/kg legemsvægt, så syntes species med høj legemsvægt (f.eks. mennesket) at være mere følsomme for toksiske effekter end species med lavere legemsvægte (f.eks. gnavere). Forskellen i følsomhed var op til en faktor 15 med mennesker i den ene ende af skalaen og mus i den anden ende. Renwick (1999a) har vurderet, at de fleste fysiologiske og mange biokemiske processer korrelerer bedre med overfladearealet end med legemsvægten. For eksempel er der for stoffer, som metaboliseres eller hvor udskillelse (clearance) primært er afhængig af blodgennemstrømningen til eliminationsorganerne, en væsentlig forskel mellem dosis udtrykt på basis af overfladearealet og dosis udtrykt på basis af legemsvægten, når der sammenlignes mellem gnavere og mennesker. Dosiskorrektionen er således tæt relateret til speciesforskelle i basalstofskiftet og blodgennemstrømningen til organerne mellem mennesker og disse species. Med henblik på konvertering af en dosis udtrykt på basis af legemsvægt til en dosis på basis af overfladeareal, bør der ifølge forfatteren anvendes en faktor på 3-4 for rotter og 8-10 for mus. Calabrese et al. (1992) har vurderet, at dosiskorrektion på basis af overfladearealet er en mere konservativ tilgang end dosiskorrektion på basis af legemsvægt. Det er endvidere anført, at jo mere en dyreart nærmer sig de menneskelige dimensioner i relation til legemsvægt og overfladeareal, jo mindre forskel er der mellem dosiskorrektion på basis af overfladeareal og dosiskorrektion på basis af legemsvægt. Ifølge forfatterne synes dosiskorrektion på basis af overfladearealet at tage højde for visse kinetiske forskelle som for eksempel interspeciesforskelle i blodgennemstrømning af organer eller til enzymatiske parametre som Km og Vmax for stoffer, som metaboliseres. Derimod synes det ifølge forfatterne klart, at dosiskorrektion på basis af overfladeareal ikke tager højde for alle forskelle i kinetiske og dynamiske processer. For eksempel tager denne form for dosiskorrektion ikke højde for interspeciesvariation som følge af forskelle i absorptionseffektivitet, tykkelse af epidermis, antal hår per kvadratcentimeter på huden, tilstedeværelse og mængde af tarmflora, den relative dominans af oxidative og conjugative metaboliseringsveje, eller hastigheden af den biliære udskillelse. Vigtigheden af disse faktorer er forskellige fra stof til stof og varierer fra at være stort set ligegyldig til at være kritisk. Ovenstående vurderinger taler således for en anvendelse af overfladeareal (W0,67) som udgangspunkt ved korrektion af dosis for forskelle i kropsstørrelsen i stedet for legemsvægten. US-EPA har tidligere taget udgangspunkt i overfladearealet ved dosiskorrektion, men er nu gået over til at tage udgangspunkt i stofskiftet (W0,75), se nedenfor. Den allometriske ligning der relaterer overfladearealet til legemsvægten kan udtrykkes ved SA = bW0,67, hvor SA er overfladeareal, b er en species-specifik konstant, og W er legemsvægten. Når dosiskorrektion for forskelle i kropsstørrelse mellem dyr og mennesker foretages på basis af overfladearealet, er eksponenten n i den allometriske ligning lig med 0,67, og den ækvivalente humane dosis (Hdosis - udtrykt i samme enhed som Adosis) kan beregnes ud fra dosis i et dyreforsøg (Adosis - udtrykt i f.eks. mg) ud fra følgende ligning:
Er dosis i dyreforsøget (Adosis) udtrykt i enheden mg/kg legemsvægt, beregnes Hdosis (udtrykt i samme enhed som Adosis) ud fra følgende ligning:
Af ligning 2 følger, at når en dosis i et dyreforsøg er udtrykt i enheden mg/kg legemsvægt, er den ækvivalente dosis (udtrykt i mg/kg legemsvægt) for mennesket (vægt 70 kg) lig med dosis i dyreforsøget divideret med en skaleringsfaktor. Skaleringsfaktorerne er således afhængige af legemsvægten for det pågældende species anvendt i et givent dyreforsøg såvel som af legemsvægten sat for mennesket. I forhold til rotter (vægt 250 g) er skaleringsfaktoren [WH / WA]0,33 6,4; mens faktoren for mus (vægt 35 g) tilsvarende er 12,3. Dosiskorrektion på basis af overfladeareal illustreres i det følgende eksempel: Baseret på ligning 1: NOAEL er vurderet til 1 mg (Adosis) i et studie med rotter (vægt 250 g), svarende til 4 mg/kg legemsvægt. Den ækvivalente dosis for mennesket (Hdosis) (vægt 70 kg) beregnes til 43,6 mg (1 mg x [70 kg / 0,25 kg]0,67), svarende til 0,62 mg/kg legemsvægt (43,6 mg / 70 kg). Skaleringsfaktoren er således 6,4 (4 mg/kg legemsvægt / 0,6 mg/kg legemsvægt). Baseret på ligning 2: Den ækvivalente dosis for mennesket (Hdosis) (vægt 70 kg) beregnes til 0,62 mg/kg legemsvægt) (4 mg/kg legemsvægt / [70 kg / 0,25 kg]0,33). Faktoren i den firkantede parentes er lig med skaleringsfaktoren, i dette tilfælde 6,4. 4.4.1.2.3 Dosiskorrektion på basis af stofskifte Feron et al. (1990) har ved korrektion af orale doser for forskelle i kropsstørrelse mellem dyr og mennesker for metaboliserbare stoffer anbefalet at tage udgangspunkt i stofskiftet (W0,75 i den allometriske ligning), da dette blev vurderet at være en mere meningsfuld basis for dosiskorrektionen. Også US-EPA har for nyligt vurderet stofskiftet som værende en mere relevant parameter som udgangspunkt for dosiskorrektion end legemsvægt og overfladeareal, og er gået over til at anvende denne som basis for dosiskorrektion i de seneste år. Ligeledes har Vermeire et al. (1999) vurderet på baggrund af den nuværende viden samt egne analyser, at skalering på basis af stofskiftet med henblik på dosiskorrektion af orale doser for forskelle i kropsstørrelse mellem dyr og er mere korrekt sammenlignet med korrektion på basis af legemsvægt. Når dosiskorrektion for forskelle i kropsstørrelse mellem dyr og mennesker foretages på basis af stofskiftet, er eksponenten n i den allometriske ligning lig med 0,75, og den ækvivalente humane dosis (Hdosis - udtrykt i samme enhed som Adosis) kan beregnes ud fra dosis i et dyreforsøg (Adosis - udtrykt i f.eks. mg) ud fra følgende ligning:
Er dosis i dyreforsøget (Adosis) udtrykt i enheden mg/kg legemsvægt, beregnes Hdosis (udtrykt i samme enhed som Adosis) ud fra følgende ligning:
Af ligning 2 følger, at når en dosis i et dyreforsøg er udtrykt i enheden mg/kg legemsvægt, er den ækvivalente dosis (udtrykt i mg/kg legemsvægt) for mennesket (vægt 70 kg) lig med dosis i dyreforsøget divideret med en skaleringsfaktor. Skaleringsfaktorerne er således afhængige af legemsvægten for det pågældende species anvendt i et givent dyreforsøg såvel som af legemsvægten sat for mennesket. For forskellige species med forskellige legemsvægte kan der således beregnes forskellige skaleringsfaktorer med henblik på korrektion af dosis for forskelle i kropsstørrelse mellem dyr og mennesker baseret på stofskiftet, se tabel 4.4.1.2.3. Det fremgår således, at den ækvivalente dosis for mennesker (udtrykt i mg/kg legemsvægt, gennemsnitlig legemsvægt på 70 kg), bliver ca. 4 gange mindre end dosis for rotter og 6-7 gange mindre end dosis for mus, når doser i dyreforsøg er udtrykt i mg/kg legemsvægt. Dosiskorrektion på basis af stofskiftet illustreres i det følgende eksempel: Baseret på ligning 1: NOAEL er vurderet til 1 mg (Adosis) i et studie med rotter (vægt 250 g), svarende til 4 mg/kg legemsvægt. Den ækvivalente dosis for mennesket (Hdosis) (vægt 70 kg) beregnes til 68,4 mg (1 mg x [70 kg / 0,25 kg]0,75), svarende til 0,98 mg/kg legemsvægt (68,4 mg / 70 kg). Skaleringsfaktoren er således 4,0 (4 mg/kg legemsvægt / 0,98 mg/kg legemsvægt). Baseret på ligning 2: Den ækvivalente dosis for mennesket (Hdosis) (vægt 70 kg) beregnes til 0,98 mg/kg legemsvægt) (4 mg/kg legemsvægt / [70 kg / 0,25 kg]0,25). Faktoren i den firkantede parentes er lig med skaleringsfaktoren, i dette tilfælde 4,0. Tabel 4.4.1.2.3: Skaleringsfaktorer for forskellige dyrearter baseret på stofskiftet som udtryk for kropsstørrelsen. Når dosis for en given species er udtrykt i mg/kg legemsvægt divideres med den pågældende skaleringsfaktor for at få den ækvivalente humane dosis (udtrykt i mg/kg legemsvægt), gennemsnitlig legemsvægt for mennesket sat til 70 kg.
4.4.1.2.4 Dosiskorrektion i inhalationsstudier Ved eksponering via inhalation er forudsætningerne for korrektion af doser i dyreforsøg til ækvivalente doser i mennesker anderledes end ved eksponering via oral administration og dermal applikation. Endvidere er forudsætningerne også anderledes afhængigt af, om der er tale om systemiske og/eller lokale effekter som følge af eksponeringen. For mennesker og dyr er indåndingsvolumen over tid relateret til behovet for ilt og dermed også til det enkelte individs kaloriebehov og dermed stofskiftet. Dette betyder, at et individ automatisk eksponeres for et givent stof i indåndingsluften afhængigt af kaloriebehovet. I praksis betyder dette, at ved eksponering for stoffer, der via inhalation udløser systemiske effekter, er det ikke nødvendigt at foretage en dosiskorrektion for forskelle i kropsstørrelse mellem dyr og mennesker. (Vermeire et al. 1999, Feron et al. 1990, van Genderen 1988). For eksempel vil dosis ved en koncentration på 50 ppm af et stof i indåndingsluften for rotter, mus eller hunde være ækvivalent for mennesker, hvis dosis beregnes i forhold til stofskiftet. 4.4.1.2.4.1 Øvrige forhold, inhalation For stoffer, der udløser lokale effekter i luftvejene (f.eks. irritanter), kan der, på grund af de anatomiske og fysiologiske forskelle i luftvejene mellem dyr og mennesker, ikke siges noget generelt med hensyn til anvendelse af en skaleringsfaktor ved korrektion for forskelle i kropsstørrelse mellem dyr og mennesker. Det skal dog understreges her, at det for lokale effekter sædvanligvis anses at være stoffets koncentration i luften og ikke den samlede dosis som sådan, der er af betydning for udvikling af disse effekter, hvorfor det i disse tilfælde sædvanligvis ikke vil være relevant at korrigere for forskelle i kropsstørrelse. Ved ekstrapolation af doser i inhalationsstudier er der også andre forskelle mellem forsøgsdyr og mennesker, der skal tages i betragtning ved vurdering af resultaterne. Inhalation af luft sker primært gennem næsen, men mennesker og visse dyrearter (hunde og nogle højere aber) kan også trække vejret gennem munden. De øvre luftveje har følgende funktioner: 1) filtrerer, befugter og varmer luften; 2) fjerner uopløselige partikler ved hjælp af den såkaldte mucociliære elevator; 3) har en betragtelig metabolisk kapacitet; og 4) detekterer duftstoffer, sensoriske irritanter og immunogener via lugtesansen, trigeminalsystemet og immunsystemet respektivt. Hos mennesker kan luftvejene betragtes som bestående af fire afsnit. Hvert af disse afsnit har særlige epithelceller, interstitium og forsvarsmekanismer. Nasopharynx (området fra næseborene til stemmebåndene). Trachea og bronchier fører luft til og fra alveolerne. Overfladen er omkring 0,25 til 0,5 m². Tilsammen benævnes disse to første afsnit de konduktive luftveje. Lungeparenkymet indeholder det respiratoriske afsnit og har et overfladeareal på ca. 100 m². Blodgennemstrømningen i lungerne er ca. 5 gange større end i andre væv. Pleurarummet udgør i sig selv et toksikologisk kompartment. Sammenlignet med andre pattedyr har mennesket en relativ simpelt konstrueret næse. Menneskets næse har 3 næsemuslinger (engelsk: nasal turbinates), som er relativt simple i formen sammenlignet med næsemuslingerne i de fleste ikke-primater, hvor disse har komplekse foldninger og forgreninger. Grunden til denne meget komplekse opbygning af næsemuslingerne hos mange dyrearter skyldes, at lugtesansen hos dyr er meget højere udviklet end hos mennesket. Disse forskelle i luftvejene mellem dyr og mennesker betragtes som værende forskelle på detailplan mellem basalt identiske systemer. Endelig har gnavere også evnen til at nedsætte indåndingsfrekvensen og gør det i stor udstrækning ved eksponering for blandt andet irritative og lugtpotente stoffer, hvilket kan medføre en betydelig reduktion i indåndet dosis. Alt i alt bidrager forskellene mellem luftvejene hos dyr og mennesker alle til, at den resulterende eksponeringen af forsøgsdyrene kan være væsentligt forskellig fra en tilsvarende eksponering hos mennesker, selvom dyr og mennesker udsættes for den sammen koncentration af et givent stof i indåndingsluften. Betydningen af disse forskelle skal således tages i betragtning ved vurdering af resultaterne af inhalationsstudier i forsøgsdyr. 4.4.1.2.5 PBPK / PBTK modeller Det overordnede formål med udvikling af disse modeller er at modellere sammenhængen mellem eksponeringen og koncentrationen af det aktive stof (eller den aktive metabolit) i målorganet hos mennesker ud fra data fra dyreforsøg. Hvis der er tale om væsentlige kinetiske forskelle (absorption, fordeling, metabolisme og udskillelse), mellem de enkelte arter, inklusive mennesket, vil det være mest hensigtsmæssigt at gennemføre mere sofistikerede beregninger for at sammenligne de konkrete eksponeringsniveauer. I disse tilfælde kan der anvendes de såkaldte fysiologisk baserede kinetiske modeller (engelsk: Physiologically Based PharmacoKinetic/ToxicoKinetic – PBPK / PBTK). Modellerne opstilles med udgangspunkt i blandt andet tidsmæssige ændringer i stoffets koncentration i blod og urin og indhold af stoffet og dets metabolitter i forskellige organer på forskellige tidspunkter. Disse data kan benyttes til matematiske beregninger (compartment analyser) af den relative fordeling af stoffet og dets metabolitter i kroppen og de dertil knyttede biologiske halveringstider i såkaldte 'compartments'. Fordelen ved denne metode er, at den kan give oplysninger om den interne dosis af et stof i et målorgan, ligesom modellen kan videreudvikles til også at inkludere bestemte reaktioner i cellerne. Blandt ulemperne kan nævnes, at der for de færreste stoffer er tilstrækkelige data til udvikling af modellerne, modellerne tager lang tid at udvikle, modellerne er ikke bedre end deres forudsætninger, det er vanskeligt at beregne betydningen af forskellige usikkerheder, og de fleste tager ikke hensyn til individforskelle. 4.4.1.2.6 Sammenfatning, dosiskorrektion for forskelle i kropsstørrelse Ved ekstrapolation af data fra dyr til mennesker indgår korrektion af doser anvendt i dyreforsøg for forskelle i kropsstørrelse mellem forsøgsdyr og mennesker, såkaldt allometrisk skalering. Rationalet for skalering er funderet på ligheder i anatomisk henseende samt den universelle karakter i fysiologiske funktioner og i biokemiske reaktioner på tværs af arterne på trods af den store forskel i størrelse, facon og form mellem forskellige arter. Hvorvidt korrektion af dosis for forskelle i kropsstørrelse ved allometrisk skalering bør foretages eller ej afhænger af eksponeringsvejen anvendt i dyreforsøget. Dosiskorrektion ved allometrisk skalering anvendes således ved udgangspunkt i studier med oral administration og dermal applikation, men ikke med inhalation. Almindeligvis anvendes legemsvægten (W) som et udtryk for kropsstørrelsen, og korrektion for forskelle i kropsstørrelse mellem dyr og mennesker foretages sædvanligvis på basis af legemsvægt (W1,0). Denne form for dosiskorrektion vurderes i en vis grad at tage hensyn til forskelle i kropsstørrelse mellem dyr og mennesker, men er også blevet kritiseret som værende utilstrækkelig. Dosiskorrektion for forskelle i kropsstørrelse på basis af overfladeareal eller på basis af stofskiftet er blevet vurderet som værende et bedre grundlag end på basis af legemsvægten. På baggrund af den nuværende viden kan det imidlertid ikke afklares, hvorvidt dosiskorrektion på basis af overfladeareal eller på basis af stofskiftet vil være den mest korrekte tilgang. Men internationalt hælder man efterhånden mest til dosiskorrektion på basis af stofskiftet (W0,75) frem for overfladearealet (W0,67), idet det vurderes, at denne parameter tilsyneladende bedre beskriver interindividuelle relationer. Således er US-EPA i de seneste år gået over til at anvende stofskiftet som basis for dosiskorrektion (US-EPA 1998). Skaleringsfaktorer er angivet i 4.4.1.2.2 og 4.4.1.2.3. 4.4.1.3 Rationale for (u)sikkerhedsfaktor ILangt de fleste data vedrørende et stofs toksiske effekter stammer fra dyreforsøg, som oftest er udført med gnavere. Datagrundlaget for et givent stof giver således sjældent kendskab til, hvorvidt mennesker er mere eller mindre følsomme for det pågældende stof end de(t) anvendte forsøgsdyr. Derfor har det internationalt i risikovurderingssammenhænge været accepteret at antage, at mennesker kan være mere følsomme end forsøgsdyr og at kompensere herfor ved anvendelse af en (u)sikkerhedsfaktor, som regel af størrelsesordenen 10. Rationalet for denne størrelsesorden kendes ikke (se indledningen til 4.4). Også i relation til fastsættelse af kvalitetskriterier for luft, jord og vand har denne del (SFI) af den samlede sikkerhedsfaktor historisk været sat til 10. Men såfremt der har foreligget veldokumenteret viden om menneskets følsomhed i forhold til forsøgsdyr, har denne faktor dog kunnet sættes højere eller lavere end standardværdien på 10. (MST 1990). Som nævnt afspejler interspeciesvariationer dels forskelle i toksikokinetik og dels forskelle i toksikodynamik. På baggrund heraf har en yderligere opdeling af den traditionelle 10-faktor været foreslået (Renwick 1993) med henblik på at kunne modificere denne faktor ved at inddrage specifikke toksikokinetiske og/eller toksikodynamiske data. Renwick's analyser af de tilgængelige data vedrørende forskelle i toksikokinetik og toksikodynamik mellem mennesker og de mest anvendte forsøgsdyr (rotte, mus, hund) indikerede, at der tilsyneladende er større forskelle i toksikokinetik end i toksikodynamik. Renwick anbefalede derfor en opdeling af 10-faktoren i en standardværdi på 4 for toksikokinetiske forskelle og en standardværdi på 2.5 for toksikodynamiske forskelle. Denne opdeling af usikkerhedsfaktoren, som har været anvendt i nogle vurderinger og blandt andet er blevet foreslået af WHO (1994), har endnu ikke fundet bred anvendelse, men forventes mere udbredt i fremtiden i takt med den stigende mængde data til belysning heraf. Med henblik på fastsættelse af ADI analyserede Dourson & Stara (1983) den traditionelle 10-faktor og fandt, at 10-faktoren synes at give en rimelig sikkerhedsmargen for interspeciesvariation under forudsætning af, at en antagelse af dosisækvivalens mellem species i forhold til overfladeareal er korrekt. Som beskrevet tidligere (4.4.1.2.2), fandt Dourson & Stara ved en analyse af anvendelsen af overfladearealet ved dosiskorrektion for kropsstørrelsen, at når en dosis udtrykt i en enhed for overfladeareal konverteres til den korresponderende dosis udtrykt i mg/kg legemsvægt, så synes species med høj legemsvægt (f.eks. mennesket) at være mere følsomme for toksiske effekter end species med lavere legemsvægte (f.eks. gnavere). Forskellen i følsomhed var op til en faktor 15 med mennesker i den ene ende og mus i den anden ende. Det blev endvidere konkluderet, at den daværende viden om interspeciesforskelle synes at understøtte en standardværdi på 10 ved ekstrapolation fra dyr til mennesker på baggrund af legemsvægten. Grönlund (1992) undersøgte metoder anvendt ved kvantitativ risikovurdering af ikke genotoksiske stoffer med særlig fokus på valg af usikkerhedsfaktorer. Resultaterne tydede på, at mennesket i de allerfleste tilfælde er mere følsomme end forsøgsdyr, og at den traditionelle 10-faktor for interspeciesvariation i visse tilfælde er for lav til at tage højde for denne variabilitet. Det blev konkluderet, at der ikke var belæg for en standardværdi for interspeciesvariation, som kunne tage højde for alle typer af stoffer og alle forskellige forsøgsdyr. Ligegyldigt hvilken standardværdi der vælges, så vil den altid vise sig at være utilstrækkelig i visse tilfælde. WHO (1994, 1996) anbefalede generelt en standardværdi på 10 for interspeciesvariation, eventuelt opdelt i en kinetisk og en dynamisk delfaktor på henholdsvis 4 og 2,5, som foreslået af Renwick (1993). Det blev endvidere fremhævet, at i de situationer, hvor der foreligger veldokumenteret viden om toksikokinetiske og/eller toksikodynamiske forskelle mellem det givne forsøgsdyr og mennesker, bør der anvendes en dataspecifik faktor i stedet for standardværdi på 10. US-EPA (1998) anvender en usikkerhedsfaktor for interspeciesvariation (UFA) på 1, 3 eller 10, når der ved estimering af RfD tages udgangspunkt i valide resultater fra et langtidsstudie i forsøgsdyr. Standardværdien er 10. Valget af værdien for UFA foretages case-by-case ved en ekspertvurdering. Feron et al. (1990) har konkluderet, at menneskers følsomhed for eksponering for kemiske stoffer sandsynligvis ikke er særligt meget forskellig fra forskellige forsøgsdyrs følsomhed. Forfatterne anførte endvidere, at ekstrapolation af dosis fra dyr til mennesker på basis af legemsvægt giver anledning til en systematisk fejl og anbefalede at foretage dosiskorrektion på baggrund af kaloriebehovet, det vil sige legemsvægt0,75, og en samtidig reduktion af den traditionelle 10-faktor for interspeciesvariation. ECETOC (1995) har ligeledes konkluderet, at interspeciesvariationen kan beskrives udelukkende ved at anvende en dosiskorrektion baseret på kaloriebehovet (legemsvægt0,75) for doser angivet i mg/kg legemsvægt (se afsnit 4.4.1.2.3) og at den arbitrære ekstrapolationsfaktor for interspeciesvariation i konsekvens heraf kan sættes til mindre end 10. Med udgangspunkt i data for rotter vil ekstrapolationsfaktoren således være omkring 4 (se tabel 4.4.1.2.3). Calabrese et al. (1992) har imidlertid påpeget, at dosiskorrektion baseret på overfladeareal (legemsvægt0,67) ikke tager højde for alle former for interspeciesforskelle og derfor bør vurderes selvstændigt og ikke umiddelbart træde i stedet for usikkerhedsfaktoren for interspeciesvariation. Tilsvarende betragtninger gør sig sandsynligvis gældende for dosiskorrektion baseret på kaloriebehovet. Renwick (1999) konkluderede på baggrund af den nuværende viden, at det er naivt at forvente, at en enkel 10-faktor vil kunne tage højde for alle forskellene mellem forskellige forsøgsdyr og mennesker. Som et argument herfor har Renwick anført, at 10-faktoren anvendes ved vurderinger foretaget med udgangspunkt i dyreeksperimentelle studier, hvor korrektion af dosis for forskelle i kropsstørrelse mellem dyr og mennesker er foretaget på basis af legemsvægt, og dosis er dermed udtrykt i mg/kg legemsvægt, mens de fleste fysiologiske og mange biokemiske processer korrelerer bedre med overfladearealet. Ifølge Vermeire et al. (1999) kan interspeciesvariationen opdeles i metaboliske forskelle og i øvrige forskelle. Med henblik på at tage højde for metaboliske forskelle korrigeres dosis (ved oral og dermal applikation af det givne stof) for forskelle i kropsstørrelse mellem forsøgsdyr og mennesker (allometrisk skalering, se 4.4.1.2). Med henblik på at tage højde for øvrige interspeciesforskelle anvendes ofte en usikkerhedsfaktor af en given standardværdi. Forfatterne har analyseret den del af interspeciesvariationen, der vurderes ikke at være relateret til allometrisk skalering. Analysen blev foretaget med udgangspunkt i data for 184 stoffer undersøgt i forskellige species (mus, rotter og hunde) og via forskellige administrationsveje (oral og inhalation). Nul-effektniveauer blev udvalgt fra studier, hvor de tre species var eksponeret for samme stof, via samme administrationsvej, og med samme eksponeringsvarighed. To forskellige eksponeringsvarigheder blev endvidere analyseret, subakut og subkronisk. For orale nul-effektniveauer blev der foretaget dosiskorrektion på basis af stofskiftet og følgende ratios blev beregnet: NOAELmus/NOAELrotte, NOAELmus/NOAELhund og NOAELrotte/NOAELhund. For inhalationsdata blev følgende ratio beregnet: NOAELmus/NOAELrotte. Disse ratios blev vurderet med udgangspunkt i deres fordelinger. Af tabel 4.4.1.3 fremgår antallet af ratios, de geometriske gennemsnit og geometriske standardafvigelse, samt 90 og 95 percentilerne for fordelingerne af de enkelte ratios. I relation til dermal applikation var datagrundlaget for spinkelt til at kunne indgå i analysen. De analyserede data tyder på, at fordelingerne for disse ratios kan beskrives som værende log-normalfordelte. Hvis interspeciesvariationen udelukkende er afhængig af metaboliske forskelle, og hvis NOAELs er perfekte estimater af det sande nul-effektniveau (hvilket som bekendt ikke er tilfældet), er det geometriske gennemsnit og den geometriske standardafvigelse for fordelingen af de enkelte ratios lig med 1. Resultaterne af analyserne viste, at det geometriske gennemsnit for fordelingen for ratio NOAELmus/NOAELrotte og ratio NOAELmus/NOAELhund, men ikke for ratio NOAELrotte/NOAELhund, var tættere på 1, når der var foretaget dosiskorrektion på basis af stofskiftet sammenlignet med det geometriske gennemsnit for fordelingen for de tilsvarende ratios, når der ikke var foretaget dosiskorrektion på basis af stofskiftet (se tabel 4.4.1.3). Disse observationer støtter således i nogen grad det synspunkt, at interspeciesvariationen langt hen ad vejen skyldes metaboliske forskelle. Med henblik på at tilnærme de øvrige interspeciesforskelle (de forskelle der ikke skyldes metaboliske forskelle) ved ekstrapolation fra dyr til mennesker, blev gennemsnittet af fordelingsparametrene anvendt, det vil sige et geometrisk gennemsnit på omkring 1 og en geometrisk standardafvigelse på 6 (se tabel 4.4.1.3). Baseret på disse analyser, kan usikkerhedsfaktoren til korrektion for de interspeciesforskelle, der ikke skyldes metaboliske forskelle, karakteriseres som værende tilnærmelsesvis lognormal fordelt med et geometrisk gennemsnit på omkring 1 og en geometrisk standardafvigelse på 6. Baseret på denne fordeling blev værdier for denne usikkerhedsfaktor beregnet til 10, 19 og 65 for 90, 95 og 99 percentilerne respektivt. Disse resultater tyder således på, at den del af interspeciesvariationen, der ikke er relateret til metaboliske forskelle, i en række tilfælde ikke ligger inden for den traditionelle 10-faktor for interspeciesvariationen. Tabel 4.4.1.3. Fordelingsparametre for ratio mellem forskellige NOAELs, se tekst ovenfor. Modificeret fra Vermeire et al. (1999).
4.4.1.4 Sammenfatning (u)sikkerhedsfaktor IRent biologisk og biokemisk minder mennesker om andre pattedyr, også med hensyn til udvikling af forskellige typer af toksiske effekter. Men selv om testning af stoffer i forsøgsdyr i høj grad vil være prædiktiv for tilsvarende effekter i mennesker, kan mennesker være mere eller mindre følsomme end andre pattedyr over for toksiske stoffer. Forskellene i følsomhed afspejler dels forskelle i toksikokinetik og dels forskelle i toksikodynamik. Den generelle opfattelse er, at det især er forskelle i metabolismen af fremmedstoffer, der spiller den største rolle for interspeciesvariationen. Hertil kommer, at der findes forskellige former for organer og væv de enkelte species imellem (for eksempel har gnavere organer og væv, som mennesker ikke har), forskellige former for fordøjelse, samt anderledes struktur af de øvre luftveje, hvilket betyder, at visse effekter som udvikles i forsøgsdyr ikke nødvendigvis vil være relevante for mennesker. Langt de fleste data vedrørende et stofs toksiske effekter stammer fra dyreforsøg, og er som oftest udført med gnavere. Datagrundlaget for et givent stof giver således sjældent kendskab til, hvorvidt mennesker er mere eller mindre følsomme for det pågældende stof end de(t) anvendte forsøgsdyr. Derfor har det internationalt i risikovurderingssammenhænge været accepteret at antage, at mennesker kan være mere følsomme end forsøgsdyr og at kompensere herfor ved anvendelse af en (u)sikkerhedsfaktor, som regel af størrelsesordenen 10. Rationalet for denne størrelsesorden kendes ikke. Ekstrapolation af data fra dyr til mennesker kan opfattes som omhandlende to forskellige aspekter: 1) korrektion af dosis for forskelle i kropsstørrelse mellem forsøgsdyr og mennesker, såkaldt allometrisk skalering, og 2) andre former for forskelle mellem forsøgsdyr og mennesker, som ikke nødvendigvis afspejles i forskellene i kropsstørrelse. Hvorvidt dosis bør korrigeres for forskelle i kropsstørrelse ved allometrisk skalering afhænger af eksponeringsvejen anvendt i dyreforsøget. Dosiskorrektion ved allometrisk skalering anvendes således ved udgangspunkt i studier med oral administration og dermal applikation, men ikke med inhalation. Almindeligvis anvendes legemsvægten (W) som et udtryk for kropsstørrelsen, og korrektion for forskelle i kropsstørrelse mellem dyr og mennesker foretages sædvanligvis på basis af legemsvægt. Denne form for dosiskorrektion vurderes i en vis grad at tage hensyn til forskelle i kropsstørrelse mellem dyr og mennesker, men er også blevet kritiseret som værende utilstrækkelig. Dosiskorrektion for forskelle i kropsstørrelse på basis af overfladeareal (W0,67) eller på basis af stofskiftet (W0,75) er blevet vurderet som værende et bedre grundlag end på basis af legemsvægten. På baggrund af den nuværende viden kan det imidlertid ikke afklares, hvorvidt dosiskorrektion på basis af overfladeareal eller på basis af stofskiftet vil være den mest korrekte tilgang. Men internationalt hælder man efterhånden mest til dosiskorrektion på basis af stofskiftet frem for overfladearealet, idet det vurderes, at denne parameter tilsyneladende bedre beskriver interindividuelle relationer. Ved ekstrapolation af doser fra dyr til mennesker på basis af stofskiftet tages der i en vis grad hensyn til forskelle i forskellige arters stofskifte og dermed metaboliske omsætning og iltforbrug. I konsekvens heraf har der været fremført holdninger om at kompensere for interspeciesvariation udelukkende ved at korrigere dosis for forskelle i kropsstørrelse mellem det anvendte forsøgsdyr og mennesker på basis af stofskiftet. Således har ECETOC (1995) anbefalet, at den arbitrære ekstrapolationsfaktor for interspeciesvariation kan sættes til mindre end 10. Feron et al. (1990) har vurderet, at menneskers følsomhed for kemiske stoffer sandsynligvis ikke er særligt meget forskellig fra forskellige forsøgsdyrs følsomhed og har ligeledes anbefalet at foretage dosiskorrektion på basis af stofskiftet og en samtidig reduktion af den traditionelle 10-faktor for interspeciesvariation. Calabrese et al. (1992) har imidlertid sat spørgsmålstegn ved en generel anvendelse af overfladearealet til korrektion af dosis for forskelle i kropsstørrelse mellem dyr og mennesker og har påpeget, at dosiskorrektion på basis af overfladeareal ikke tager højde for alle de mest relevante faktorer i relation til interspeciesvariation. Forfatterne anbefalede således, at dosiskorrektion på basis af overfladeareal derfor bør vurderes selvstændigt og ikke umiddelbart træde i stedet for en anvendelse af usikkerhedsfaktoren for interspeciesvariation. Tilsvarende betragtninger vurderes sandsynligvis at gøre sig gældende for dosiskorrektion baseret på kaloriebehovet. Ifølge Vermeire et al. (1999) kan interspeciesvariationen opdeles i metaboliske forskelle og i øvrige forskelle. Forfatterne har analyseret den del af interspeciesvariationen, der ikke vurderes som værende relateret til metaboliske forskelle, og resultaterne af disse analyser tyder på, at denne del af interspeciesvariationen i en række tilfælde ikke ligger inden for den traditionelle 10-faktor for interspeciesvariation. Sammenfattende understøtter de tilgængelige data, at der anvendes en standardværdi på 10 for interspeciesvariation ved udgangspunkt i dyreeksperimentelle studier, hvor korrektion af dosis for forskelle i kropsstørrelse mellem dyr og mennesker foretages på basis af legemsvægt. Men det ligger også klart, at denne 10-faktor ikke vil kunne tage højde for alle typer af stoffer, effekter og forsøgsdyr. Data indikerer endvidere, at korrektion af orale og dermale doser i dyreeksperimentelle studier for forskelle i kropstørrelse på basis af stofskiftet (legemsvægt0,75) giver et mere korrekt dosisestimat hos mennesker end ved korrektion foretaget på basis af legemsvægt. Denne procedure vurderes at finde bredere anvendelse internationalt i fremtiden. I relation til fastsættelse af kvalitetskriterier for luft, jord og vand anbefales det fortsat at foretage dosiskorrektion på basis af legemsvægt og i konsekvens heraf en standardværdi på 10 for interspeciesvariation (UFI), eventuelt opdelt i en kinetisk og en dynamisk delfaktor, som foreslået af Renwick (1993) og af WHO (1994). Såfremt der foreligger veldokumenteret viden om toksikokinetiske og/eller toksikodynamiske forskelle mellem det givne forsøgsdyr og mennesker, anbefales det at tage udgangspunkt i denne viden med henblik på fastsættelse af en dataspecifik faktor i stedet for anvendelse af en standardværdi på 10. Anbefalingerne skal ses i lyset af, at der er data, der tyder på, 1) at kompensation for interspeciesvariation udelukkende ved allometrisk skalering på basis af stofskiftet muligvis ikke tager højde for alle relevante faktorer i relation til interspeciesvariation, samt 2) at den del af interspeciesvariationen, der ikke omfattes af allometrisk skalering, i en række tilfælde ikke ligger inden for den traditionelle 10-faktor for interspeciesvariation. Det vurderes, at usikkerhederne i den anbefalede procedure sandsynligvis vil være relativt lav i forhold til øvrige usikkerheder i risikovurderingsproceduren. Det skal dog understreges, at det for visse stoffer og effekter samt for visse forsøgsdyr vurderes, at der sandsynligvis vil være større forskelle i følsomheden mellem forsøgsdyr og mennesker, og som dermed falder uden for denne 10-faktor. Omvendt vurderes det også, at for visse stoffer og effekter samt for visse forsøgsdyr vil der sandsynligvis være mindre forskelle i følsomheden mellem forsøgsdyr og mennesker, således at den traditionelle 10-faktor giver anledning til en mere konservativ vurdering. 4.4.2 Usikkerhedsfaktor II (”intraspecies- / interindividuel variation”)4.4.2.1 Biologisk variationPå baggrund af den biologiske variation, der findes mellem mennesker, er der også forskelle mellem enkelte individers følsomhed for et givent stof. Faktorer som alder, køn, graviditet, genotype, helbred, og livsstil kan være medvirkende til en øget biologisk følsomhed, som afspejler dels forskelle i toksikokinetik og dels i toksikodynamik. Den interindividuelle variation i biologisk følsomhed er nærmere belyst i Beltoft et al. (2001). Data viser, at der kan være interindividuelle forskelle både i enzymniveau og i enzymaktivitet, hvilket kan føre til interindividuelle forskelle i metabolisering af et givent stof. Hertil kommer, at der findes genetiske polymorfismer for en række enzymer, der er involveret i omsætning af fremmede stoffer, for eksempel for enzymer der tilhører cytochrom P450-familien, glutathion-S-transferase, paraoxonase, og acetylcholinesterase. Genetisk polymorfisme er arveligt betinget, og begrebet anvendes, hvor et enzym forekommer i flere former, som ikke nødvendigvis har samme kapacitet med hensyn til at omsætte et givent substrat. Den sundhedsmæssige betydning af variationer i enzymniveau og enzymaktivitet samt genetisk polymorfiske enzymer kendes ikke i detaljer. (Beltoft et al. 2001, Grandjean 1997). Det ufødte barn samt spædbørn har vist sig at være mere følsomme overfor en række kemiske stoffer end voksne generelt. I denne aldersgruppe er hurtig vækst af organer og væv en vigtig faktor for den øgede følsomhed. Nogle organer, som for eksempel hjernen, udvikler sig langt op i barneårene og vil således have en øget sårbarhed overfor toksiske stoffer. Også udviklingen af reproduktionssystemet og immunforsvaret fortsætter i barnealderen og kan således medvirke til en øget sårbarhed hos denne aldersgruppe. Endvidere er receptorer og andre former for 'molekylære mål' også under udvikling hos spædbørn, hvilket kan medføre aldersrelaterede forskelle i resultatet af receptor-stof-interaktioner, herunder direkte modsatte effekter af et givent stof hos spædbørn og voksne. De toksikokinetiske forskelle gør sig primært gældende hos spædbørn. I relation til legemsvægten er det nyfødte barns overfladeareal næsten tre gange så stort som hos voksne. Da stofskiftet
tilnærmelsesvist er proportionalt med overfladearealet, har det nyfødte barn relativt et meget højere stofskifte og respiration, hvilket kan medføre øget optagelse ved eksponering for luftbårne stoffer. Også
den relative optagelse gennem tarmen er øget på grund af tarmepithelets øgede permeabilitet samt et højere pH i mavesækken. Både lever og nyrer er umodne på fødselstidspunktet, hvilket spiller en rolle for
metabolisering samt udskillelse af toksiske stoffer. Dette sidste aspekt kan både være en fordel og en ulempe afhængigt af, om det givne stof i sig selv udløser en toksisk effekt, eller om der skal ske en
omdannelse før udløsning af effekt. Hos ældre personer kan der forekomme et øget respons i visse væv og organer på grund af en mindre 'reservekapacitet' (engelsk: functional capacity in reserve) eller ændret receptorfølsomhed. Hvis en tidlig eksponering for fremmede stoffer har medført skader på sådanne væv og organer, kan disse skader afdækkes ved, at der med alderen ikke længere er nok kapacitet til at kompensere for dem. En sådan mekanisme spiller muligvis en rolle for visse degenerative sygdomme i nervesystemet som for eksempel parkinsonisme og amyotrof lateral sclerose. Et andet eksempel er lungefunktionen, som ganske langsomt mindskes med alderen, hvilket kan medføre en øget følsomhed for stoffer, som påvirker lungerne. Også evnen til at reparere inducerede skader kan være nedsat med alderen. For eksempel har nogle ældre vist sig at have en ringere modstandskraft mod peroxidation, fordi det antioxidative forsvar mindskes. Endvidere kan toksikokinetiske aspekter spille en rolle for ældres øgede følsomhed. Hos ældre ses blandt andet ændringer i P450-enzymsystemets evne til at omsætte toksiske stoffer. Også evnen til at
nedbryde og udskille toksiske stoffer kan være nedsat på grund af nedsat funktion af lever og nyrer. Det skal bemærkes, at et øget respons som følge af ændringer i receptorfølsomhed, reparationsmekanismer og reservekapacitet også kan være sygdomsinducerede. Interindividuelle forskelle mellem de to køn er også rapporteret. Som eksempel kan nævnes forskelle i enzymniveauer og enzymaktiviteter. For stoffer der ophobes i knoglevævet (bly og cadmium), kan der, som følge af det knogletab der ses efter overgangsalderen, måles en øget koncentration i blodet ved frigørelse af disse stoffer fra knoglerne. (Beltoft et al. 2001, Grandjean 1997). Kronisk syge og svækkede personer vil i mange tilfælde udvise større følsomhed overfor fremmede stoffer end den gennemsnitlige befolkning. Personer, der er sensibiliserede overfor et bestemt stof, har som reglen antistoffer i blodet mod dette stof og vil oftest reagere ved en efterfølgende eksponering for det samme stof ved lavere koncentration end den gennemsnitlige befolkning. Et andet eksempel er, at leversygdom kan føre til øget følsomhed, idet leverens kapacitet til at metabolisere fremmede stoffer vil være nedsat. Der har også været rapporteret en ændret receptorfølsomhed for visse stoffer i relation til udvikling af levercirrhose. Ligeledes kan nyreskader resultere i øget følsomhed, idet nyrernes evne til at udskille fremmedstoffer i så fald vil være nedsat. Endelig kan eksponering for fremmede stoffer tænkes at mindske organismens styrke til at modstå andre skadelige påvirkninger udefra. Måske vil der ikke umiddelbart opstå en påviselig skade, men den mindskede modstandskraft vil kunne komme til udtryk i form af øget følsomhed ved en efterfølgende eksponering. (Grandjean 1997, Beltoft et al. 2001). Der er også påvist markante forskelle i følsomhed i forbindelse med luftforureningens sundhedsskadelige effekter. Personer med kroniske luftvejslidelser og personer med hjerte-karlidelser er fundet at være særligt følsomme, idet øget sygelighed og dødelighed som følge af luftforureningen er særligt udtalt i disse grupper. Endvidere påvirkes småbørn og ældre i relativt større omfang end den øvrige normalbefolkning af luftforureningen. (Larsen et al. 1997, Nielsen et al. 2001). I de senere år har begrebet 'Multiple Chemical Sensitivity' (MCS) været diskuteret bredt i videnskabelige kredse. Begrebet omfatter et syndrom med nedsat tolerance og særlig følsomhed ved udsættelse for kemiske stoffer, således at en lang række effekter ses ved meget lave eksponeringer, som ellers ikke anses for problematiske. Syndromet MCS anføres at kunne opstå i tilslutning til en initial, massiv kemisk eksponering og er efterfølgende karakteriseret ved, at der opstår anfaldsvise gener fra flere organer i forbindelse med eksponering for kemiske lugte i lav koncentration. Lugte fra flere, ikke-beslægtede kemiske stoffer kan udløse generne, som forsvinder efter ophør med lugteksponering, men som kan fremkaldes ved fornyet eksponering. (MST 2001). 4.4.2.2 Rationale for (u)sikkerhedsfaktor IILangt de fleste data vedrørende et stofs toksiske effekter stammer som bekendt fra dyreforsøg. Datagrundlaget for et givent stof giver således sjældent kendskab til, hvorvidt det enkelte individ er mere eller mindre følsomt for det pågældende stof end den gennemsnitlige befolkning. Derfor har det internationalt i risikovurderingssammenhænge været accepteret at kompensere for interindividuel variation ved anvendelse af en (u)sikkerhedsfaktor, som regel af størrelsesordenen 10. Rationalet for denne størrelsesorden kendes ikke (se indledningen til 4.4). Også i relation til fastsættelse af kvalitetskriterier for luft, jord og vand har denne del (SFII) af den samlede sikkerhedsfaktor oftest været sat til 10. Men såfremt der har foreligget veldokumenteret viden om en specifik gruppes særlige følsomhed i forhold til den gennemsnitlige befolkning, har denne faktor dog kunnet sættes højere eller lavere end standardværdien på 10. (MST 1990). Som nævnt tidligere (4.4.2.1) afspejler interindividuelle variationer dels forskelle i toksikokinetik og dels forskelle i toksikodynamik. På baggrund heraf har en yderligere opdeling af den traditionelle 10-faktor været foreslået (Renwick 1993) med henblik på at kunne modificere denne 10-faktor ved inddragelse af specifikke toksikokinetiske og/eller toksikodynamiske data. Renwick's analyser af de tilgængelige data vedrørende forskelle i toksikokinetik og toksikodynamik mellem mennesker indikerede, at der ikke er belæg for den skæve opsplitning af 10-faktoren, som det er tilfældet ved interspeciesvariation (se 4.4.1.3). Renwick anbefalede derfor en opdeling af 10-faktoren i to standardværdier på 3,16 (100,5) for dels toksikokinetiske forskelle såvel som for toksikodynamiske forskelle. Denne opdeling af (u)sikkerhedsfaktoren, som blandt andet er blevet foreslået af WHO (1994), har endnu ikke fundet bred anvendelse i den internationale verden. Den interindividuelle variation mellem mennesker og mellem forsøgsdyr er nærmere belyst i Beltoft et al. (2001) med henblik på at vurdere størrelsesordenen af usikkerhedsfaktor II. De centrale studier summeres kort i det efterfølgende. Calabrese (1985) har undersøgt variationer i humant respons indenfor 1) metabolisme af fremmedstoffer, 2) binding af toksiske stoffer til for eksempel hæmoglobin og DNA, 3) aktiviteten af udvalgte enzymer, og 4) risiko for udvikling af sygdomme i den humane population. Resultaterne af disse undersøgelser indikerede, at den interindividuelle variation for 80 til 95% af populationen lå inden for en faktor 10, mens variationen for den resterende del af populationen var højere end en faktor 10 og i nogle tilfælde op til flere størrelsesordener højere. Hattis et al. (1987) vurderede den humane variabilitet for tre centrale farmakokinetiske parametre (halveringstiden for elimination (T½), arealet under plasmakoncentrationskurven (AUC), samt den maksimale koncentrationen i blodet (Cmax)). Vurderingerne blev foretaget med baggrund i 101 datasæt for 49 specifikke stoffer, hovedsageligt lægemidler, indsamlet i perioden 1979 til 1985. Analyserne viste, at en 10-folds forskel i disse parametre ville svare til 7-9 standardafvigelser, eller mere end 99,99% i en normalfordelt population. For kun et af de undersøgte stoffer (et lipofilt stof) var der en større variation i AUC og Cmax, hvor en 10-folds forskel ville svare til 2,5 standardafvigelser for disse parametre i den humane population, eller 98% i en normalfordelt population. På baggrund heraf blev det konkluderet, at den traditionelle 10-faktor for interindividuel variation er en ret konservativ standardværdi. Renwick og Lazarus (1998) analyserede den traditionelle 10-faktor med henblik på en evaluering af den tidligere foreslåede opdeling af 10-faktoren i en kinetisk og dynamisk delfaktor på 3,16 (Renwick 1993) såvel som tilstrækkeligheden (engelsk: adequacy) af denne 10-faktor. Data vedrørende kinetik og dynamik blev tabuleret, og gennemsnitlige variationskoefficienter blev bestemt for forskellige studier, som relaterede til et generelt (engelsk: common) end-point eller for multiple doser, som relaterede til det samme (engelsk: same) end-point. Data blev også analyseret med udgangspunkt i den rapporterede standardafvigelse og den beregnede geometriske standardafvigelse for hver parameter med henblik på at definere en såkaldt 'Z-score' og dermed at estimere den del af en normalfordelt eller log-normalfordelt population, som ville være omfattet af delfaktoren på 3,16. For vurdering af variationer i kinetikken blev data for 60 stoffer analyseret. Disse 60 stoffer repræsenterede en række forskellige metaboliseringsveje eller clearance. Den gennemsnitlige variationskoefficient for de kinetiske parametre var 38% med et minimum på 9% og et maksimum på 114%. I relation til variationer i dynamikken blev der analyseret koncentrations-effekt data (primært in vivo plasmakoncentrations-respons data fra behandling af patienter i klinikken) for 49 stofrelaterede effekter (primært ændringer i kardio-vaskulære eller centralnervesystemiske parametre). Den gennemsnitlige variationskoefficient for de dynamiske parametre var 51% med et minimum på 8% og et maksimum på 137%. Ifølge forfatterne støttede resultaterne af denne analyse således en opdeling af 10-faktoren med lige vægtning til kinetik og dynamik med en delfaktor på 3,16 (100,5) for kinetiske såvel som for dynamiske variationer. Data blev også analyseret med henblik på at vurdere, hvor stor en del af en population der ikke blev beskyttet af en delfaktor på 3,16 for kinetik henholdsvis dynamik. Antallet af individer per million i en population, der ikke var omfattet af en delfaktor på 3,16, var direkte proportional med standardafvigelsen på estimatet. For kinetikken var det gennemsnitlige antal af individer, der ikke var omfattet af en faktor på 3,16 fra gennemsnitsestimatet, 685 af en million (ca. 0,07%) ved normalfordeling og 8564 (ca. 0,9%) ved log-normalfordeling. For dynamikken var tallene 2930 af en million (ca. 0,3%) ved normalfordeling og 18896 (ca. 2%) ved log-normalfordeling. Sandsynligheden for at det samme individ falder udenfor både med hensyn til kinetik og til dynamik blev også analyseret under antagelse af, at kinetiske og dynamiske 'risikofaktorer' er uafhængige variable. Gennemsnitlig 2 individer af en million ville ikke være omfattet af den kombinerede faktor på 10 (3,16 gange 3,16) ved normalfordeling og 162 af en million ved log-normalfordeling. På baggrund af disse resultater konkluderede forfatterne, at den traditionelle 10-faktor er et hensigtsmæssig valg som standardværdi for de undersøgte stoffer og biologiske effekter, idet 10-faktoren vil dække mere end 99,9% af populationen uafhængigt af valg af fordeling (normalfordeling versus log-normalfordeling). Endvidere blev de ovenfor beskrevne analyser også foretaget med henblik på at undersøge, hvorvidt visse specifikke undergrupper af den samlede population ikke ville være omfattet, hvis delfaktoren på 3,16 blev anvendt på gennemsnittet for hovedparten af den samlede population. Følgende sammenligninger blev foretaget: 1) Undergruppen børn i forhold til voksne; 2) etniske forskelle; og 3) forskelle i metabolisme som følge af polymorfiske enzymer. Da størstedelen af de relevante data omhandlede kinetiske forhold for lægemidler hos kaukasiske voksne, blev denne gruppe anvendt som referencegruppe ved analyserne, og analyserne blev således kun foretaget i relation til de kinetiske aspekter af den interindividuelle variation. For undergruppen børn konkluderede forfatterne, at børn omfattes i tilstrækkelig grad af delfaktoren på 3,16 for kinetik anvendt på gennemsnittet for voksne og begrundede det med, at børn med hensyn til variationer inden for kinetik ikke generelt udgør en speciel gruppe. Forskellige etniske grupper kan udvise forskelle i både kinetik og dynamik, som følge af genetiske forskelle eller miljømæssige faktorer. I følge forfatterne er en delfaktor på 3,16 tilstrækkelig til at dække de fleste etniske grupper i den samlede population. Dog kan der være forskelle mellem forskellige etniske grupper på grund af forskelle i metabolisme som følge af polymorfiske enzymer, se efterfølgende. Genetisk polymorfisme inden for enzymer, der er involveret i metabolisering af fremmedstoffer, har stor betydning for den interindividuelle variation, og for eksempel personer med en meget langsom metabolisering af et givent stof vil ikke nødvendigvis være dækket af en delfaktor på 3,16 for forskelle i kinetik og dermed heller ikke nødvendigvis af den samlede faktor på 10 for interindividuel variation. På baggrund af alle de foretagne analyser konkluderede forfatterne, at en faktor 10 for interindividuel variation synes at være et hensigtsmæssig valg som standardværdi, idet denne 10-faktor vil dække mere end 99,9% af populationen. Men det er også understreget, at der er identificeret en række tilfælde, hvor denne 10-faktor er utilstrækkelig, for eksempel i relation til genetisk polymorfisme inden for enzymer, der er involveret i metabolisering af fremmedstoffer. I et forsøg på at give et videnskabeligt rationale for den traditionelle 10-faktor for interindividuelle forskelle med henblik på fastsættelse af ADI, analyserede Dourson og Stara (1983) data for akut toksicitet samlet af Weil (1972) for 490 kemikalier indgivet som enkeltdosis til rotter. For 92% af kemikalierne var en faktor på 10 tilstrækkelig til at dække tre standardafvigelser og dermed omfatte 99,9% af populationen. Forfatterne konkluderede, at analysen var en indirekte støtte til 10-faktoren for interindividuel variation. Støtten blev vurderet som værende indirekte, fordi effekterne (dødelighed versus nul-effektniveau) ikke er direkte sammenlignelige. Endvidere var analysen baseret på data fra rotter, og forsøgsdyr er generelt en mere homogen gruppe end den humane population. Grönlund (1992) undersøgte metoder anvendt ved kvantitativ risikovurdering af ikke genotoksiske stoffer med særlig fokus på valg af usikkerhedsfaktorer og konkluderede, at de humane data indikerede, at en 10-faktor for interindividuel variation omfattede størstedelen af populationen, men ikke alle. WHO (1994, 1996) har foreslået en standardværdi på 10 for interindividuel variation, eventuelt opdelt i en kinetisk og en dynamisk delfaktor på 3,16 til hver, som foreslået af Renwick (1993). Men WHO understregede også, at denne faktor ikke for alle stoffer vil yde en tilstrækkelig grad af beskyttelse og nævnte specifikt eksemplet med polymorfiske enzymer. Endvidere blev det anbefalet, at i de tilfælde, hvor der foreligger veldokumenteret viden om den interindividuelle variabilitet i toksikokinetik og i toksikodynamik, bør den traditionelle 10-faktor erstattes med en dataspecifik faktor. I nogle tilfælde kan denne faktor sættes til 1, hvis de tilgængelige data for et givent stof belyser følsomheden for alle identificerede følsomme undergrupper af populationen. US-EPA (1998) anvender en usikkerhedsfaktor for interindividuel variation (UFH) på 1, 3 eller 10, når der ved estimering af RfD tages udgangspunkt i valide data fra studier af gennemsnitsbefolkningen ved langtidseksponering. Standardværdien er 10. Valget af værdien for UFH foretages case-by-case ved en ekspertvurdering. Ifølge ECETOC (1995), må den interindividuelle variation blandt mennesker forventes at være større end inden for en given dyreart, og at en faktor mellem 1 og 10 vil være tilstrækkelig til at tage højde herfor. ECETOC's vurdering var derimod, at der ikke er noget videnskabeligt grundlag med henblik på en bestemt numerisk standardværdi og anbefalede en standardværdi på 3 (det geometriske gennemsnit af 1 og 10). Dourson et al. (1996) vurderede, at en standardværdi på 10 for interindividuel variation tilsyneladende er tilstrækkelig, når udgangspunktet for vurderingen er et observeret nul-effektniveau (NOAEL), der antages at dække den gennemsnitlige populationen. Hvis NOAEL estimeres for en kendt, følsom undergruppe, bør 10-faktoren justeres i henhold til denne viden. Kalberlah & Schneider (1998 - citeret i Vermeire et al. 1999) har på baggrund af de tilgængelige humane data foreslået en standardværdi på 25 for interindividuel variation inden for den almene humane population, bestående af en delfaktor på 8 til at tage højde for toksikokinetiske variationer og enzympolymorfier og en delfaktor på 3 til at tage højde for toksikodynamiske variationer. Burin & Saunders (1999) konkluderede med baggrund i undersøgelser af den humane variabilitet i respons (kliniske undersøgelser af lægemidler), at en faktor mellem 1 og 10 vil være tilstrækkelig til at beskytte mere end 99% af den humane population, herunder forskellige undergrupper i populationen, inklusive børn. Dette betyder ifølge forfatterne, at 10-faktoren kan reduceres, hvis intentionen er at beskytte op til 99% af populationen. Vermeire et al. (1999) konkluderede, at det for nuværende ikke er muligt at foreslå en databaseret fordeling for usikkerhedsfaktor II, som det er blevet foreslået for usikkerhedsfaktor I (se afsnit 4.4.1.3). Forfatterne foreslog derfor indtil videre at fastholde den traditionelle 10-faktor og antog, at denne faktor vil yde beskyttelse for hovedparten af den generelle befolkning. 4.4.2.3 Sammenfatning (u)sikkerhedsfaktor IIPå baggrund af den biologiske variation, der findes mellem mennesker, er der også forskelle mellem enkelte individers følsomhed for et givent stof. Faktorer som alder, køn, graviditet, genotype, helbred, og livsstil kan være medvirkende til en øget biologisk følsomhed, som afspejler dels forskelle i toksikokinetik og dels i toksikodynamik. For eksempel har det ufødte barn samt spædbørn vist sig at være mere følsomme overfor en række kemiske stoffer end voksne generelt, men der er også enkelte eksempler på, at det modsatte kan være tilfældet. I denne aldersgruppe er hurtig vækst af organer og væv en vigtig faktor for den øgede følsomhed. For nogle organer, som for eksempel hjernen, reproduktionssystemet og immunforsvaret, fortsætter udviklingen i barnealderen og kan således medvirke til en øget sårbarhed hos denne aldersgruppe. De toksikokinetiske forskelle gør sig primært gældende hos spædbørn og kan resultere i enten øget eller nedsat følsomhed i forhold til voksne. Hos ældre personer kan der forekomme et øget respons i visse væv og organer på grund af en mindre reservekapacitet eller ændret receptorfølsomhed. Også evnen til at reparere inducerede skader kan være nedsat med alderen. Endvidere kan toksikokinetiske aspekter også spille en rolle for ældres øgede følsomhed, for eksempel en nedsat evne til at nedbryde og udskille toksiske stoffer. Interindividuelle forskelle mellem de to køn er også rapporteret, som for eksempel forskelle i enzymniveauer og enzymaktiviteter. Kronisk syge og svækkede personer vil i mange tilfælde også udvise større følsomhed overfor fremmede stoffer end den gennemsnitlige befolkning. For eksempel vil sensibiliserede personer oftest reagere ved eksponering for det sensibiliserende stof ved lavere koncentration end den gennemsnitlige befolkning. Et andet eksempel er, at leversygdom kan føre til øget følsomhed, idet leverens kapacitet til at metabolisere fremmede stoffer vil være nedsat. Ligeledes kan nyreskader resultere i øget følsomhed, idet nyrernes evne til at udskille fremmedstoffer i så fald vil være nedsat. Der er også påvist markante forskelle i følsomhed i forbindelse med luftforureningens sundhedsskadelige effekter, hvor personer med kroniske luftvejslidelser og personer med hjerte-karlidelser er fundet at være særligt følsomme. Endvidere påvirkes småbørn og ældre i relativt større omfang end den øvrige normalbefolkning af luftforureningen. Langt de fleste data vedrørende et stofs toksiske effekter stammer som bekendt fra dyreforsøg. Datagrundlaget for et givent stof giver således sjældent kendskab til, hvorvidt det enkelte individ er mere eller mindre følsomt for det pågældende stof end den gennemsnitlige befolkning. Derfor har det internationalt i risikovurderingssammenhænge været accepteret at kompensere for interindividuel variation ved anvendelse af en (u)sikkerhedsfaktor, som regel af størrelsesordenen 10. Rationalet for denne størrelsesorden kendes ikke. Der er publiceret en række analyser med henblik på at belyse den interindividuelle variation mellem mennesker og dermed en vurdering af størrelsesordenen af usikkerhedsfaktor II. Sammenfattende understøtter disse analyser en standardværdi på 10 for interindividuel variation, idet denne 10-faktor vurderes at tage højde for den interindividuelle variation inden for størstedelen (mere end 99%) af den humane population. Men det skal bemærkes, at der i disse analyser er identificeret tilfælde, hvor den interindividuelle variation ligger udenfor 10-faktoren. I relation til fastsættelse af kvalitetskriterier for luft, jord og vand anbefales det fortsat at anvende en standardværdi på 10 for interindividuel variation (UFII), eventuelt opdelt i en kinetisk og en dynamisk delfaktor, som foreslået af Renwick (1993) og af WHO (1994). Såfremt der foreligger veldokumenteret viden om en specifik gruppes særlige følsomhed i forhold til den gennemsnitlige befolkning, anbefales det at tage udgangspunkt i denne viden med henblik på fastsættelse af en dataspecifik faktor i stedet for anvendelse af en standardværdi på 10. Det skal dog understreges, at det for visse stoffer og effekter samt for visse undergrupper eller enkelte individer i populationen vurderes, at der vil være større forskelle i den interindividuelle variation, og som dermed falder uden for denne 10-faktor. 4.4.3 Usikkerhedsfaktor III – (overordnet vurdering af datagrundlaget)I relation til anvendelsen af en (u)sikkerhedsfaktor ved estimering af den tolerable daglige indtagelse (TDI) med udgangspunkt i et nul-effektniveau for de(n) kritiske effekt(er) har der oprindeligt i de fleste reguleringsmæssige sammenhænge næsten udelukkende været fokuseret på at kompensere for interspeciesvariation samt for interindividuel variation. Ved udgangspunkt i velgennemførte humane studier har der traditionelt været anvendt en samlet sikkerhedsfaktor på 10 med henblik på at tage højde for den interindividuelle variation (se 4.4.2). Ved udgangspunkt i velgennemførte studier i forsøgsdyr har der traditionelt været anvendt en samlet sikkerhedsfaktor på 100, det vil sige i princippet en opdeling af 100-faktor i to delfaktorer på hver 10 til at kompensere for henholdsvis interspeciesvariation (se 4.4.1) og interindividuel variation. Der har endvidere i enkelte tilfælde været anvendt en samlet sikkerhedsfaktor på mere end 100, hvor det eksisterende datagrundlag har været vurderet som værende ikke helt tilstrækkelig til en sikker estimering af TDI. Som eksempler herpå kan nævnes estimering af TDI med udgangspunkt i et datasæt, hvor kvaliteten ikke er fuldt tilstrækkelig med deraf følgende usikkerhed omkring fastlæggelsen af nul-effektniveauet (se 4.4.3.1), hvor den anvendte administrationsvej ikke er relevant (“route-to-route” ekstrapolation - se 4.4.3.2), hvor der ikke kan fastlægges et nul-effektniveau for de(n) kritiske effekt(er) (“LOAEL-to-NOAEL” ekstrapolation - se 4.4.3.3), hvor der ikke er kroniske studier (“duration of exposure” - se 4.4.3.4), eller hvor de observerede effekter skønnes som særligt alvorlige (“nature and severity of toxicity” - se 4.4.3.5). Det skal dog understreges, at datagrundlaget kan være så ringe, at det ikke giver mening at estimere en TDI på det foreliggende grundlag. I relation til fastsættelse af kvalitetskriterier for luft, jord og vand har denne del (SFIII) af den samlede sikkerhedsfaktor typisk varieret fra 1 til 100 afhængigt af datagrundlaget for det pågældende stof. (MST 1990). 4.4.3.1 Vurdering af kvaliteten af datasætEn del af usikkerhedsfaktor III skal søge at tage højde for, hvis kvaliteten af de foreliggende undersøgelser og omfanget af datasættet ikke lever op til det, som vurderes at være nødvendigt for at kunne foretage en tilstrækkelig sikker estimering af TDI. Eksempler herpå kan være mangel på visse typer undersøgelser, dyreforsøg hvor et stof kun er blevet undersøgt i få forsøgsdyr, ved et enkelt eller kun få dosisniveauer, eller hvor der er store afstande mellem dosisniveauerne med deraf følgende usikkerhed omkring fastlæggelsen af nul-effektniveauet. WHO (1994) har anført, at kvaliteten samt fuldstændigheden af datasæt er meget varierende, og dermed vil en (u)sikkerhedsfaktor til at tage højde herfor også variere. For eksempel anbefales det at inddrage en faktor på 1 ved datasæt, som vurderes at være tilstrækkeligt for det givne stof, mens en faktor op til 100 kan inddrages afhængigt af graden af datasættets kvalitet. Hvis der er tale om mindre mangler, anbefales en faktor af størrelsesorden 3-5, mens en ekstra faktor på 10 anbefales ved større mangler, som for eksempel manglende reproduktionsstudier og/eller cancerstudier. WHO (1996) har i relation til guidelines for drikkevandskvalitet anført, at mangler i studier eller i det samlede datasæt har medført, at der ikke kunne fastlægges et NOAEL, og at studierne var af kortere eksponeringstid end ønskeligt. Til at tage højde for disse usikkerheder har der været anvendt en usikkerhedsfaktor af størrelsesorden op til 10. I denne rapport er disse delelementer af usikkerhedsfaktor III beskrevet i 4.4.3.3 (”LOAEL-to-NOAEL”) og 4.4.3.4 (”duration of exposure”). US-EPA (1998) anvender en usikkerhedsfaktor (UFD) på 1, 3 eller 10, når der ved estimering af RfD tages udgangspunkt i et datasæt, som vurderes som værende ikke komplet. Denne usikkerhedsfaktor skal tage højde for, at et enkelt studie ikke vil kunne afsløre alle mulige former for skadelige effekter. Et komplet datasæt inkluderer 2 velgennemførte langtidsstudier i pattedyr med den relevante eksponeringsvej i forskellige species, hvoraf det ene studie skal være udført med en gnaver. Derudover skal der være et velgennemført multigenerationsreproduktionsstudie i pattedyr med en relevant eksponeringsvej samt 2 velgennemførte studier til undersøgelse af påvirkninger under fosterudviklingen (engelsk: developmental toxicity) i forskellige pattedyr og med en relevant eksponeringsvej. Ved estimering af RfD skal der som minimum foreligge et velgennemført 90-dages studie i et pattedyr og med den relevante eksponeringsvej. Valget af værdien for UFD foretages case-by-case ved en ekspertvurdering. Standardværdien er 10. En faktor på 3 kan anvendes, hvis der ikke er større mangler i datasættet. Ifølge Vermeire et al. (1999) bør justeringsfaktoren ligge højere end 1 i de tilfælde, hvor kvaliteten af selve datasættet vurderes som værende utilstrækkelig, og denne faktor kan være helt op til 100. Denne justeringsfaktor kan ifølge forfatterne kun fastlægges på baggrund af en ekspertvurdering. I praksis anvendes dosis-responskurven sjældent som udgangspunkt for estimering af nul-effektniveauet for de(n) kritiske effekt(er), da datagrundlaget som oftest er utilstrækkeligt hertil. I stedet tages der som regel udgangspunkt i et observeret nul-effektniveau (NO(A)EL), det vil sige den højeste koncentration eller dosis, hvorved de(n) kritiske effekt(er) ikke er blevet observeret og vurderet ud fra alle de informationer, der er samlet sammen. Dette er beskrevet mere detaljeret i 4.3. Dourson et al. (1996) har anført, at hvis der kun foreligger data fra et enkelt kronisk studie til fastlæggelse af nul-effektniveau, vil der være en risiko for at yderligere undersøgelser vil afsløre et lavere nul-effektniveau. Usikkerhederne heri bør derfor afspejles i en (u)sikkerhedsfaktor, og forfatterne har foreslået en 3- eller 10-faktor med baggrund i en antagelse om, at den kritiske effekt af et givent stof vil blive afsløret ved testning i et forholdsvis lille antal forskellige toksicitetsstudier. WHO (1994) har anført, at man alternativt til anvendelse af en (u)sikkerhedsfaktor til at kompensere for usikkerheder ved fastlæggelse af et NO(A)EL kan estimere en benchmark dose ved en matematisk modellering af dosis-responsdata (se 3.2.2). Fordelene ved denne fremgangsmåde er, at man udnytter alle eksperimentelle data og tager højde for dosis-responskurvens form, og at benchmark dose, i modsætning til NO(A)EL, ikke afhænger af de valgte forsøgsdesign. Imidlertid giver det klassiske guideline-forsøgsdesign med 3 doserede grupper og en vehikelkontrolgruppe ikke ideelle data til udarbejdelse af gode dosis-responskurver. Så i praksis vil denne metode kun kunne anvendes i begrænset omfang. Ifølge Vermeire et al. (1999) er der ikke noget videnskabeligt belæg for en bestemt standardværdi til at tage højde for usikkerhederne ved estimering af et nul-effektniveau i et givent studie. 4.4.3.2 ”Route-to-route” ekstrapolationDet er af og til tilfældet i reguleringsmæssige sammenhænge, at der mangler data for den relevante eksponeringsvej for mennesker. Der kan være tale om, at datasættet omfatter forsøg, hvor dyrene er blevet eksponeret for et stof på en for mennesker usædvanlig måde, for eksempel ved injektion i bughulen eller via en administrationsvej, der ikke er relevant for det medie, for hvilket kvalitetskriteriet skal fastsættes, som for eksempel hvis der som grundlag for fastsættelse af et luftkvalitetskriterium kun findes orale studier. I disse tilfælde er det nødvendigt at vurdere, om der kan foretages en ”route-to-route” ekstrapolation. ECETOC (1995) vurderede på baggrund af akutte toksicitets data, at ”route-to-route” ekstrapolation fra orale data (LD50-værdier) til inhalation (LC50-værdier) er utroligt svært, idet de tilgængelige data har vist en meget stor variation. Det blev derfor anbefalet, at denne form for ekstrapolationer ikke bør foretages. For hudkontakt er det anført, at absorption via denne eksponeringsvej ofte vil være lavere end ved oral administration af et givent stof på grund af hudens barrierefunktion. Ved ekstrapolation af orale data foreslås således at antage en hudabsorptionsfraktion på mellem 10 og 50%, men at vurderingerne skal foretages case-by-case. Også i relation til ”route-to-route” ekstrapolation på baggrund af data fra kroniske studier vurderede ECETOC, at der ikke i de tilgængelige data er belæg for en bestemt standardværdi og anbefalede derfor en vurdering heraf case-by-case. En hollandsk undersøgelse (Wilschut et al. 1998 - citeret i Vermeire et al. 1999) har analyseret ekstrapolation af NOAEL fra orale data til en korresponderende værdi for inhalation eller for dermal eksponering. For hvert stof blev der beregnet en ekstrapolationsfaktor (defineret som den faktor, der anvendes ved ”route-to-route” ekstrapolation for at tage højde for forskelle i systemisk toksicitet afhængigt af eksponeringsvej) på basis af data for absorption og akut toksicitet. Denne faktor blev anvendt til estimering af et såkaldt ”ekstrapoleret nul-effektniveau”. For ekstrapolation fra oralt NOAEL til NAEC efter inhalation (n = 28) viste analyserne, at den ekstrapolerede værdi (NAEC) ofte var højere end den observerede værdi efter inhalation (NOAEC), således at stoffet blev vurderet som værende mindre toksisk efter ekstrapolation ved sammenligning med den eksperimentelt fundne værdi. Fordelingen for forholdene (ratios) mellem ekstrapoleret nul-effektniveau og observeret nul-effektniveau kan beskrives som værende log-normalfordelt. Med baggrund i 95 percentilen i denne log-normalfordeling blev der fundet usikkerhedsfaktorer fra 75 til 201 for de forskellige ekstrapolationsmetodikker. For ekstrapolation fra oralt NOAEL til NAEL efter hudkontakt (n = 25) viste analyserne, at den ekstrapolerede værdi (NAEL) ofte var lavere end den observerede værdi ved hudkontakt (NOAEL), således at stoffet blev vurderet som værende mere toksisk efter ekstrapolation ved sammenligning med den eksperimentelt fundne værdi. Med baggrund i 95 percentilen i log-normalfordelingen for forholdene (ratios) mellem ekstrapoleret nul-effektniveau og observeret nul-effektniveau blev der fundet usikkerhedsfaktorer fra 2.7 til 35 for de forskellige ekstrapolationsmetodikker. Forfatterne konkluderede, at udvikling af videnskabeligt baserede principper for ”route-to-route” ekstrapolationer er en meget svær opgave, da det tilgrundliggende datamateriale ikke findes. Endvidere blev det konkluderet, at der ikke er noget videnskabeligt belæg for at foretage ”route-to-route” ekstrapolationer. Ifølge Vermeire et al. (1999) er der for nuværende to forskellige tilgange med henblik på vurdering af ”route-to-route” ekstrapolation: 1) Anvendelse af usikkerhedsfaktorer, eller 2) igangsættelse af studier med relevant eksponeringsvej indtil validerede ”route-to-route” ekstrapolationsmetodikker er tilgængelige. Endvidere er det anført, at valget mellem disse to tilgange er et regulatorisk spørgsmål, og at ”route-to-route” ekstrapolation udelukkende må bero på en ekspertvurdering. 4.4.3.3 “LO(A)EL to NO(A)EL” ekstrapolationI en række tilfælde kan der med baggrund i et givent datasæt ikke fastlægges et nul-effektniveau NO(A)EL, selvom det antages, at et sådant findes. I disse tilfælde tages der ved estimering af TDI udgangspunkt i det laveste observerede effektniveau (LO(A)EL) (se 3.2), og der inddrages ofte en (u)sikkerhedsfaktor til at kompensere herfor. Forholdet mellem NOAEL og LOAEL er afhængigt af hældningen på dosis-responskurven, antallet af individer i den enkelte dosisgruppe samt af intervallet mellem doser i det givne studie (ECETOC 1995). Ved ekstrapolation fra LOAEL til NOAEL har faktorer af størrelsesorden 1 til 10 været anvendt (ECETOC 1995, Dourson & Stara 1983) afhængigt af alvorligheden (engelsk: severity) af den effekt, hvorpå LOAEL baseres (Dourson & Stara 1983). For eksempel har der været anvendt en faktor på 10 for LOAEL fastlagt på baggrund af levercellenekrose, mens en faktor på 3 har været anvendt for LOAEL fastlagt på baggrund af ”fatty infiltration” i leveren (Dourson & Stara 1983). Dourson & Stara (1983) analyserede forholdet mellem LOAEL og NOAEL for subkronisk (n = 27) og kronisk (n = 25) eksponering. Resultaterne for subkronisk eksponering viste, at NOAEL var maksimalt 5 gange lavere end det korresponderende LOAEL og med størstedelen af værdierne liggende på 2 til 3. For kronisk eksponering var LOAEL maksimalt 10 gange højere end det korresponderende NOAEL i 2 af tilfældene, mens resten af LOAELs var maksimalt 5 gange højere end de korresponderende NOAELs. Sammenholdt var NOAELs i alle sammenligninger højst 10 gange lavere end de korresponderende LOAELs og i 96% af tilfældene højst 5 gange lavere. Forfatterne konkluderede på baggrund heraf, at en faktor på mellem 1 og 10 synes at tage højde for ekstrapolation fra LOAEL til NOAEL. WHO (1994) har anbefalet, at i de tilfælde, hvor der ikke kan fastlægges et nul-effektniveau, kan der foretages en ekstrapolation fra det laveste observerede effekt niveau under anvendelse af en passende sikkerhedsfaktor, såfremt datagrundlaget vurderes at være af en tilstrækkelig kvalitet. Det er endvidere anført, at usikkerhedsfaktorer af størrelsesorden 3, 5 eller 10 har været anvendt ved ekstrapolation fra et LOAEL til et NOAEL afhængigt af, hvilke(n) effekt)er) der har været tale om samt dosis-responsrelationen. ECETOC (1995) har anført, at hvis intervallet mellem doser er stort (for eksempel 10), og hvis de effekter der observeres ved LOAEL vurderes som værende af minimal karakter (dvs. at NOAEL ligger tæt på LOAEL), så kan det i vurderingen være mere relevant at tage udgangspunkt i LOAEL i stedet for NOAEL under inddragelse af en (u)sikkerhedsfaktor på 3 (standardværdi). ECETOC konkluderede, at på trods af det begrænsede datagrundlag til vurdering af denne problemstilling, så synes en faktor på 2-3 at være i overensstemmelse med det tilgængelige grundlag. En faktor på 3 blev anbefalet som standardværdi og bør anvendes i størsteparten af tilfældene. En faktor på 2 kan dog anvendes i de tilfælde, hvor den relevante effekt vurderes som værende af mindre betydning. Dourson et al. (1996) har på baggrund af den tilgængelige viden konkluderet, at en faktor på 10 eller mindre synes at tage højde for de usikkerheder, der ligger i at ekstrapolere fra LOAEL til NOAEL. Størrelsen af usikkerhedsfaktoren bør i følge forfatterne generelt afhænge af alvorligheden (engelsk: severity) af den effekt, der ligger til grund for fastlæggelsen af LOAEL, således at ved mere alvorlige effekt bør faktoren være højere, idet NOAEL i disse tilfælde formodes at ligge længere væk fra LOAEL. Og modsat, ved mindre alvorlige effekter behøves en mindre faktor, idet LOAEL formodes at ligge tættere på NOAEL Pieters et al. (1998) beregnede forholdet mellem LOAEL og NOAEL (ratio) fra subakutte, subkroniske og kroniske studier og foretog statistiske analyser af fordelingen for disse ratio. Ifølge forfatterne er størrelsen af ratio udelukkende afhængig af afstanden mellem doserne i de for analyserne tilgrundliggende studier. Under antagelse af log-normalfordelte fordelinger for ratio blev det geometriske gennemsnit, den geometriske standardafvigelse, 95 percentilen samt 95% konfidensintervallet beregnet. Resultaterne af analyserne af subakutte studier (95 ratio) viste, at det geometriske gennemsnit for fordelingen af ratio var 3,5 med en geometrisk standardafvigelse på 1,8 og en 95 percentil på 9 med et 95% konfidensinterval på 8-11. Resultaterne af analyserne af subkroniske studier (226 ratio) viste, at det geometriske gennemsnit for fordelingen af ratio var 4,3 med en geometrisk standardafvigelse på 2,2 og en 95 percentil på 16 med et 95% konfidensinterval på 14-19. Resultaterne af analyserne af kroniske studier (175 ratio) viste, at det geometriske gennemsnit for fordelingen af ratio var 4,5 med en geometrisk standardafvigelse på 1,7 og en 95 percentil på 11 med et 95% konfidensinterval på 10-12. Forfatterne konkluderede, at selv om resultaterne kunne tolkes som støtte for en usikkerhedsfaktor på 10, er der ikke belæg for anvendelsen af sådan en faktor. I stedet anbefalede forfatterne at anvende dosis-respons modellering, hvilket unødvendiggør anvendelsen af en usikkerhedsfaktor for ekstrapolation fra LOAEL til NOAEL. Vermeire et al. (1999) har konkluderet, at sådan som de fleste dyreforsøg er designet, er der på ingen måde belæg for at ekstrapolere fra et LOAEL til et NOAEL. Forfatterne anbefalede derfor, at korrektion herfor foretages ved ekspertvurdering baseret på dosis-responskurvens form samt typen og alvorligheden af den observerede effekt ved det givne LOAEL. US-EPA (1998) anvender en usikkerhedsfaktor (UFL) på 1, 3 eller 10, når der ved estimering af RfD tages udgangspunkt i LOAEL i stedet for NOAEL. Standardværdien er 10. Valget af værdien for UFL foretages case-by-case ved en ekspertvurdering. 4.4.3.4 Fravær af langtidsundersøgelser (”duration of exposure”)For stoffer, hvor der kun findes subakutte eller subkroniske studier, er det ikke muligt at estimere et nul-effektniveau for livstidseksponering. I subakutte studier er der som regel færre forsøgsdyr i eksponeringsgrupperne end i subkroniske studier, hvor der ligeledes er færre forsøgsdyr end i kroniske studier. På baggrund heraf kan det forventes, at et nul-effektniveau estimeret i et subakut studie er højere end et nul-effektniveau estimeret i et subkronisk studie, som igen kan forventes at være højere end et nul-effektniveau estimeret i et kronisk studie. McNamara (1976 – citeret fra ECETOC 1995, Dourson & Stara 1983, Grönlund 1992) undersøgte forholdet mellem NOAELs fra subkroniske studier og kroniske studier (NOAELsubkronisk / NOAELkronisk) for 41 forskellige stoffer (pesticider, tilsætningsstoffer, lægemidler). Data stammede primært fra studier i rotter og hunde, men udført forskellige steder under anvendelse af forskellige eksponeringstider og teknikker. Resultaterne viste, at forholdene var 1 eller mindre for 34 ud af 41 stoffer; forholdene for de resterende stoffer var alle mindre end 3. Ifølge Dourson & Stara (1983) indikerer disse McNamara's undersøgelser, at en dosisreduktion på 3 eller derunder vil være tilstrækkelig med henblik på at estimere NOAEL for kronisk eksponering ud fra et korresponderende NOAEL for subkronisk eksponering. Dourson & Stara (1983) analyserede forholdet (ratio) mellem subkronisk og kronisk eksponeringsvarighed for enten NOAELs (n = 30), LOAELs (n = 22), eller kombinationen heraf (n = 52) med udgangspunkt i studier i rotter og hunde. Eksponeringsvarigheden i subkroniske studier varierede fra 30 til 210 dage, og de kroniske studier var alle af 2 års varighed. Disse ratio kan ifølge forfatterne tolkes som den reduktion i subkroniske NO(A)ELs eller LOAELs, der skal til for at ekstrapolere til tilsvarende kroniske NO(A)ELs eller LOAELs. Resultaterne viste, at ratio mellem subkronisk og kronisk eksponeringsvarighed (ratiosubkronisk/kronisk) i omkring 96% af tilfældene var mindre end 10, og at forholdene var 2 eller mindre i omkring 50% af tilfældene. Forfatterne konkluderede på baggrund heraf, at en faktor på 10 synes at tage højde for usikkerhederne ved at estimere en ADI fra et subkronisk effektniveau i mangel af et kronisk effektniveau. Woutersen et al. (1984 – citeret fra ECETOC 1995) sammenlignede nul-effektniveauer for 82 kemikalier, som var testet i korttidsstudier og i subkroniske studier under samme omstændigheder. Resultaterne viste, at ratio var lig med eller mindre end 10 i alle tilfældene, en faktor på 4 dækkede 80% af tilfældene, og en faktor på 1 blev fundet i 56% af tilfældene. Lewis (1993 – citeret fra Dourson et al. 1996) analyserede ratio mellem subkroniske og kroniske NOAELs med baggrund i peer-reviewed litteratur samt data fra U.S. National Toxicology Program. For 14 af 18 kemikalier var forholdet 3,5 eller mindre, og for 3 af de resterende kemikalier var forholdet 10 eller mindre. Ifølge ECETOC (1995) er datagrundlaget for vurderinger af ekstrapolation af nul-effektniveauer fra korttidsstudier til længerevarende studier meget begrænset. Det er anført, at faktoren for ekstrapolation af NOAEL fra subkronisk til kronisk varighed afhænger af det givne stof. Faktoren kan sættes til 1 for stoffer, som ikke udløser kumulative effekter eller akkumuleres i kroppen, mens en højere faktor kan inddrages for stoffer, der udviser sådanne egenskaber. Det er endvidere anført, at yderligere ekstrapolation kan være nødvendig, hvis varigheden af de tilgængelige korttidsstudier ligger i området fra 14 til 28 dage, da det, ifølge ECETOC, er generelt accepteret, at nul-effektniveauer fra subakutte studier ikke kan erstatte nul-effektniveauer fra subkroniske studier. ECETOC konkluderede på baggrund af de tilgængelige videnskabelige data, at en provisorisk standardværdi af størrelsesorden 2-3 synes hensigtsmæssig ved ekstrapolation af NOAEL fra subkronisk til kronisk varighed. Dourson et al. (1996) anførte, at de tilgængelige analyser af ratio mellem subkroniske og kroniske NOAELs og LOAELs generelt udviser et værdi mellem 2 og 3, og at kun en lille del af de undersøgte kemikalier udviser forskelle på mere end en faktor 10. På baggrund heraf har forfatterne anbefalet, at den traditionelle 10-faktor for ekstrapolation af NOAEL/LOAEL fra subkronisk til kronisk varighed bør vurderes grundigt og sandsynligvis kun i sjældne tilfælde bør sættes så højt som 10. Kramer et al. (1996) analyserede anvendelsen af en konverteringsfaktor (CF) med henblik på at estimere et NOAEL for kronisk varighed ud fra toksicitetsdata i korttidsstudier. Fordelingerne af ratio mellem (sub)akutte og kroniske toksicitetsdata blev evalueret for 332 stoffer. CF blev defineret som den øvre 95% konfidensgrænse for 95 percentilen for den relevant fordeling af ratio. Med udgangspunkt i NOAELsubakut blev en CF på 87 estimeret (baseret på 87 ratio), og med udgangspunkt i LD50-værdier en CF på 17000 (baseret på 244 ratio). Pieters et al. (1998) foretog en statistisk analyse af NOAELsubkronisk / NOAELkronisk for 149 ratio fra orale studier. Resultaterne viste, at det geometriske gennemsnit for fordelingen af ratio var 1,7 med en geometrisk standardafvigelse på 5,6 og en 95 percentil på 29 med et 95% konfidensinterval på 20-46. Forfatterne konkluderede, at der med baggrund i disse resultater ikke er belæg for at reducere den traditionelt anvendte 10-faktor. Ifølge Vermeire et al. (1999) anvendes i mangel af kroniske studier en ekstra justeringsfaktor på sædvanligvis 10 med henblik på at ekstrapolerere et subakut eller subkronisk nul-effektniveau til et kronisk nul-effektniveau. Forfatterne har analyseret fordelingsfunktionen for justeringsfaktoren i en række orale studier, det vil sige forholdet mellem orale nul-effektniveauer fra subakutte/subkroniske studier og kroniske studier. Resultaterne viste, at justeringsfaktoren for at ekstrapolere fra subkronisk til kronisk er tilnærmelsesvis log-normalfordelt med et geometrisk gennemsnit på omkring 2 og en geometrisk standardafvigelse på omkring 4. Baseret på denne fordeling blev standardværdier for 90, 95 og 99 percentilerne beregnet til 12, 20 og 50 respektivt; en 10-faktor svarede til 88 percentilen. Det geometriske gennemsnit var signifikant højere (4) for at ekstrapolere fra subakut til kronisk end for at ekstrapolere fra subkronisk til kronisk med en geometrisk standardafvigelse på omkring 4. Baseret på denne fordeling blev standardværdier for 90, 95 og 99 percentilerne beregnet til 24, 39 og 101 respektivt. US-EPA (1998) anvender en usikkerhedsfaktor (UFS) på 1, 3 eller 10, når der ved estimering af RfD tages udgangspunkt i dyreeksperimentelle studier med kortere eksponeringstid (ikke kroniske studier). Standardværdien er 10. En værdi på 3 i stedet for 10 kan for eksempel anvendes, når der tages udgangspunkt i et 1-års studie i rotter, idet NOAELs fra 1-årige studier vurderes at ligge tættere på NOAELs for kroniske studier end NOAELs fra 90-dages studier. Valget af værdien for UFS foretages case-by-case ved en ekspertvurdering. 4.4.3.5 Type og alvorlighed af effekter (“nature and severity of toxicity”)Det har været fremført, at der også bør tages højde for typen samt alvorligheden af de observerede effekter (for eksempel cancer, mutagenicitet/genotoksicitet, reproduktionsskader og sensibilisering) ved at inddrage dette element i usikkerhedsfaktor III. WHO (1994) har fremført, at vurdering af typen af effekter allerede indgår som et element i fastlæggelsen af NO(A)EL og/eller LO(A)EL, og at der således til en vis grad er taget højde herfor ved fastlæggelse af disse. En række internationale instanser, blandt andet JECFA og JMPR, har inddraget en ekstra usikkerhedsfaktor af størrelsesorden op til 10 i de tilfælde, hvor nul-effektniveauet fastlægges for en kritisk effekt, der betragtes som værende af alvorlig grad samt irreversibel. Som eksempler nævnes teratogenicitet og carcinogenicitet, hvor den tilgrundliggende mekanisme for stoffets indflydelse på udvikling af tumorer ikke er en beskadigelse af arvematerialet. Den ekstra faktor anvendes især i de tilfælde, hvor der er observeret en flad dosis-responskurve. (WHO 1994). WHO (1996) har i relation til guidelines for drikkevandskvalitet anført, at det i nogle situationer har været nødvendigt at anvende en ekstra usikkerhedsfaktor som følge af ”nature and severity of effect”. Som eksempler nævnes studier, hvor end-point var fostermisdannelser eller forekomst at tumorer, hvor 'guideline value' i sidstnævnte tilfælde blev fastlagt på baggrund af tærskelværdiprincippet. Til at tage højde for disse usikkerheder har en usikkerhedsfaktor af størrelsesorden op til 10 været anvendt. Renwick (1995) har evalueret brugen af en (u)sikkerhedsfaktor rettet specifikt mod typen af toksisk effekt. Baggrunden for anvendelsen af denne faktor var at tage højde for non-genotoksiske carcinogener og teratogener. I enkelte tilfælde er faktoren blevet inddraget specifikt på NOAEL for denne type af effekter. Men i langt de fleste tilfælde er faktoren blevet anvendt, hvor udgangspunktet har været et NOAEL for en helt anden type effekt og somme tider også for et andet species. Forfatteren konkluderede, at såfremt der skal inddrages en (u)sikkerhedsfaktor for typen af toksisk effekt, så skal den anvendes på NOAEL for den givne type af effekt, og ikke på NOAEL for en helt anden type effekt. Vermeire et al. (1999) har konkluderet, at det som udgangspunkt kan antages, at det ikke er nødvendigt at foretage yderligere korrektion for type og alvorlighed af effekter, men at en eventuel korrektion herfor må bero på en ekspertvurdering. 4.4.3.6 Sammenfatning for usikkerhedsfaktor IIII tilfælde af at det ved estimering af TDI er nødvendigt at tage udgangspunkt i et datasæt, der vurderes som værende ikke fuldt ud tilstrækkeligt til en sikker estimering af TDI, er det blevet mere og mere udbredt internationalt at anvende en samlet usikkerhedsfaktor, der af størrelsesorden er højere end den traditionelle 100-faktor, der kompenserer for interspecies og interindividuel variation. I denne del (UFIII) af den samlede usikkerhedsfaktor indgår elementer som for eksempler kvaliteten af datasættet, route-to-route” ekstrapolation, “LOAEL-to-NOAEL” ekstrapolation , “duration of exposure”, og “nature and severity of toxicity”. Det skal dog understreges, at ved omfattende mangler kan datagrundlaget være så ringe, at det ikke giver mening at estimere en TDI på det foreliggende grundlag. De enkelte delelementer af usikkerhedsfaktor III er beskrevet nedenfor med henblik på at vurdere, hvorvidt de tilgængelige data giver belæg for at pege på en specifik størrelsesorden af en standardværdi for det enkelte delelement af usikkerhedsfaktor III. En del af usikkerhedsfaktor III skal søge at tage højde for, hvis kvaliteten af de foreliggende undersøgelser ikke lever op til det, som vurderes at være nødvendigt for at kunne foretage en tilstrækkelig sikker estimering af TDI (se 4.4.3.1). De tilgængelige data giver intet belæg for at pege på en specifik størrelsesorden for standardværdi til at kompensere for usikkerheder som følge af kvaliteten af undersøgelserne. For eksempel har det været anbefalet at anvende en faktor på 1 ved datasæt, som vurderes at være fuldt tilstrækkeligt for det givne stof, mens der ved mindre eller større mangler har været anbefalet en faktor af størrelsesorden 3-5 eller 10 respektivt. Det har også været anført, at det måske i nogle tilfælde kan være relevant at anvende faktorer på helt op til 100. En vurdering heraf må således bero på en ekspertvurdering og foretages case-by-case. Vedrørende vurdering af usikkerheden ved fastlæggelse af NO(A)EL (se 4.4.3.1) kan der heller ikke peges på en konkret størrelsesorden for en standardværdi til at kompensere herfor, og denne vurdering må ligeledes bero på en ekspertvurdering og foretages case-by-case. Alternativt er det blevet anbefalet at estimere en benchmark dose ved en matematisk modellering af dosis-responsdata, hvorved usikkerheden ved fastlæggelse af NO(A)EL minimeres. Fordelene herved er, at alle eksperimentelle data udnyttes og tager højde for dosis-responskurvens form, og at benchmark dose, i modsætning til NO(A)EL, ikke afhænger af de valgte forsøgsdesign. Imidlertid giver det klassiske guideline-forsøgsdesign ikke ideelle data til dosis-responskurver. Så i praksis vil denne metode næppe finde udbredt anvendelse foreløbig. Ved mangel af data for den relevante eksponeringsvej (se 4.4.3.2) kan det blive nødvendigt at foretage en “route-to-route” ekstrapolation. Data indikerer, at ved ekstrapolation fra oralt NOAEL til NOAEC efter inhalation vil en ekstrapoleret værdi ofte være højere end en observeret værdi, mens ved ekstrapolation fra oralt NOAEL til NOAEL efter hudkontakt vil en ekstrapoleret værdi ofte være lavere end en observeret værdi. Med baggrund i de tilgængelige data er der intet belæg for at pege på en bestemt størrelsesorden for standardværdi til at kompensere for de usikkerheder, der ligger i at foretage en “route-to-route” ekstrapolation. Det er således blevet konkluderet, at der ikke er noget videnskabeligt belæg for at foretage ”route-to-route” ekstrapolationer og anbefalet, at “route-to-route” ekstrapolation må bero på en ekspertvurdering og foretages case-by-case. I en række tilfælde kan der med baggrund i et givent datasæt ikke fastlægges et NO(A)EL, selvom det antages, at et sådant findes. I disse tilfælde tages der ved estimering af TDI udgangspunkt i LO(A)EL, og en faktor af størrelsesorden 1 til 10 (afhængigt af den effekt hvorpå LOAEL baseres) har været anvendt med henblik på at tage højde for eventuelle usikkerheder ved at ekstrapolere fra LOAEL til NOAEL (se 4.4.3.3). Der er i de sidste 20-25 år foretaget flere analyser af forholdet mellem NOAEL og LOAEL, herunder også under hensyntagen til eksponeringsvarigheden. Analyserne tenderer til at blive mere sofistikerede med tiden, og de senere analyser vurderes i højere grad at tage højde for diverse usikkerheder i analyserne og dermed sandsynligvis at være mere pålidelige end de tidlige analyser. Med baggrund i analyserne synes der at være belæg for en standardværdi af størrelsesorden 10. Det skal dog nævnes, at de to nyeste referencer har anbefalet enten at anvende dosis-respons modellering, hvorfor der så ikke skulle være grund til at anvende en (u)sikkerhedsfaktor (Pieters et al. 1998), eller at basere korrektionen for ekstrapolation fra LOAEL til NOAEL ved en ekspertvurdering af dosis-responskurvens form samt typen og alvorligheden af den effekt, der ligger til grund for fastlæggelsen af LOAEL (Vermeire et al. 1999). For stoffer, hvor der kun findes subakutte eller subkroniske studier, er det ikke muligt at estimere et NOAEL for livstidseksponering, og det er blevet anført, at NOAEL i et subakut eller subkronisk studie kan forventes at være højere end et nul-effektniveau estimeret i et kronisk studie. Ved fravær af kroniske studier har der været anvendt en (u)sikkerhedsfaktor på sædvanligvis 10 med henblik på at tage højde herfor (se 4.4.3.4). Ligeledes har der er i de sidste 20-25 år været foretaget flere analyser af forholdet mellem NOAELs og LOAELs opnået i studier af forskellige eksponeringsvarigheder. Som nævnt ovenfor tenderer analyserne til at blive mere sofistikerede med tiden, og de senere analyser vurderes i højere grad at tage højde for diverse usikkerheder i analyserne og dermed sandsynligvis at være mere pålidelige end de tidlige analyser. Med baggrund i analyserne synes der at være belæg for en standardværdi af størrelsesorden minimum 10. Den nyeste analyse (Vermeire et al. 1999) viste, at en standardværdi på 10 dækkede i 88% af tilfældene, når der var tale om ekstrapolation fra subkroniske data. Ved ekstrapolation fra subakutte data var 90 percentilen 24. Det har været fremført, at typen samt alvorligheden af en given effekt (engelsk: nature and severity of toxicity - se 4.4.3.5) også er et delelement af usikkerhedsfaktor III. For eksempel har blandt andet JECFA og JMPR anvendt en faktor af størrelsesorden op til 10 i tilfælde af, at NOAEL fastlægges for en kritisk effekt, som vurderes at være af alvorlig grad samt irreversibel (f.eks. teratogenicitet og non-genotoksisk carcinogenicitet med ”shallow” dosis-responsrelation). Andre har konkluderet, at det som udgangspunkt kan antages, at det ikke er nødvendigt at foretage yderligere korrektion herfor, idet der allerede skulle være taget højde for dette delelement ved fastlæggelse af NOAEL og/eller LOAEL for den kritiske effekt. Det har også været fremført, at hvis der skal foretages korrektion for type af effekt, så skal korrektionen foretages på NOAEL for den givne effekt, og ikke på NOAEL for et helt anden type effekt eller en anden species. Det er således ikke muligt på baggrund af den nuværende viden at give en generel anbefaling om, hvorvidt der bør foretages yderligere korrektion for type og alvorlighed af en given effekt, ej heller at pege på en specifik størrelsesorden for standardværdi til at kompensere for eventuelle usikkerheder herfor. En vurdering heraf må således bero på en ekspertvurdering og foretages case-by-case. Sammenfattende kan det konkluderes, at det på baggrund af de tilgængelige data ikke er muligt at pege på en specifik størrelsesorden for en standardværdi, hverken for de enkelte delelementer af usikkerhedsfaktor III eller for usikkerhedsfaktor III som sådan. I relation til fastsættelse af kvalitetskriterier for luft, jord og vand anbefales det derfor fortsat at fastlægge usikkerhedsfaktor III på baggrund af en ekspertvurdering og case-by-case under hensyntagen til det givne stofs samlede datasæt. Baggrunden for vurderingen af de enkelt delelementer i usikkerhedsfaktor III bør være så transparent som overhovedet mulig. 4.4.4 Samlet usikkerhedsfaktorI praksis vurderes de enkelte elementer (UFI, UFII og UFIII) i den samlede usikkerhedsfaktor hver for sig, som beskrevet ovenfor, hvorefter den samlede usikkerhedsfaktor beregnes som produktet af hver af de enkelte usikkerhedsfaktorer. Ved denne procedure kan man imidlertid let opnå en meget høj samlet usikkerhedsfaktor, og jo flere delelementer, der indgår i den samlede usikkerhedsfaktor, jo mere konservativ bliver den estimerede TDI. Især vil de enkelte delelementer i usikkerhedsfaktor III bidrage til en høj samlet usikkerhedsfaktor. Derfor skal der foretages endnu en vurdering af den samlede usikkerhedsfaktor med henblik på rimeligheden af denne faktor i forhold til det givne datasæt. I de fleste tilfælde vurderes det, at en samlet usikkerhedsfaktor med en værdi på højere end 10.000 ikke vil være rimelig, selvom produktet af de enkelte usikkerhedsfaktorer har en højere værdi. Gaylor et al. (1999) har for alvorlige, irreversible effekter foreslået en standardværdi for en samlet usikkerhedsfaktor af størrelsesorden 10.000 ved udgangspunkt i data fra dyreforsøg. For reversible, biologiske effekter blev foreslået en standardværdi på 1000. Ved estimering af Reference Dose (RfD) vurderer US-EPA 5 forskellige kategorier af usikkerhed: 1) interindividuel variation (UFH), 2) interspeciesvariation (UFA), 3) subkronisk til kronisk varighed (UFS), 4) LOAEL til NOAEL (UFL) og , 5) datasættes kvalitet og relevans (UFD). Standardværdien for den enkelte kategori er 10, men værdier på 1 eller 3 kan også vælges for den enkelte kategori. Valget af værdien foretages case-by-case ved en ekspertvurdering. Den samlede usikkerhedsfaktor er afhængig af værdierne for de enkelte kategorier. Ved usikkerheder i en, to eller tre af kategorierne anvendes generelt en samlet usikkerhedsfaktor på 10, 100, eller 1000 respektivt. Ved usikkerheder i fire kategorier er den samlede usikkerhedsfaktor sjældent over 3000, da man har den holdning, at hvis det tilgrundliggende datasæt er så ringe, at den samlede usikkerhedsfaktor bliver højere end 3000, så er datagrundlaget for ringe med henblik på estimering af en RfD. Også den samlede usikkerhedsfaktor vurderes case-by-case ved en ekspertvurdering, og det er understreget, at denne skal være så fleksibel, at den tager højde for usikkerhederne i de 5 enkelte kategorier og datagrundlaget som sådan. Udover usikkerhedsfaktorerne anvender US-EPA også en såkaldt modificerende faktor (engelsk: Modifying Factor MF). MF anvendes til at tage højde for eventuelle usikkerheder, som ikke vurderes i
relation til den samlede usikkerhedsfaktor UF. Som eksempel er nævnt, at jo færre antal dyr i dosisgrupperne jo større er sandsynligheden for, at der ikke observeres en given skadelige effekt ved en
specifik dosis, men som ville blive afsløret i en større population. Et andet eksempel er, at MF kan anvendes, hvis et givent stof kun er undersøgt i en enkelt species. Værdien for MF er større end nul og
mindre end lig med 10, og standardværdien er 1. WHO (1996) har i relation til guidelines for drikkevandskvalitet anført, at den samlede usikkerhedsfaktor ikke bør være højere end 10.000, idet den resulterende TDI i så fald vil være så upræcis, at den er meningsløs. Hvis vurderingen af den samlede usikkerhedsfaktor resulterer i en meget høj værdi (f.eks. over 10.000), bør datagrundlaget vurderes som værende af så ringe kvalitet, at det ikke giver mening at estimere en TDI på det foreliggende grundlag, og dermed heller ikke et kvalitetskriterie for jord, vand eller luft. Omvendt vil det i mange situationer med kontaminanter i miljøet være nødvendigt at foretage en eller anden form for regulering baseret på en sundhedsmæssig vurdering, hvorfor det er vigtigt at foretage en så objektiv vurdering af den samlede usikkerhedsfaktor som muligt på baggrund af det foreliggende datagrundlag. Ender man op med at være nødt til at fastlægge TDI med baggrund i en meget høj samlet usikkerhedsfaktor, bør usikkerheden ved estimatet nøje understreges, og der bør tages hensyn hertil i det videre forløb ved fastsættelse af kvalitetskriterier. 4.5 Fastlæggelse af TDIDen tolerable daglige indtagelse (TDI) er en beregnet størrelse (koncentration eller dosis), som mennesker vurderes at kunne udsættes for (tolerere) gennem et helt livsforløb, uden at der forventes sundhedsskadelige effekter (se 4.1). TDI estimeres med udgangspunkt i et NO(A)EL eller LO(A)EL for de(n) kritiske effekt(er) (se 4.3) under anvendelse af en samlet usikkerhedsfaktor UF (se 4.4). TDI beregnes, som angivet i nedenstående ligning og angives sædvanligvis i enheden mg/kg legemsvægt per dag. 4.6 ReferencerBeltoft V, Nielsen E, Meyer O and Ladefoged O (2001). Individual variations in biological susceptibility to xenobiotics: a review of the current knowledge. Rapport udarbejdet for MST, marts 2001. Burin GJ and Saunders DR (1999). Addressing human variability in risk assessment – the robustness of the intraspecies uncertainty factor. Regul Toxicol Pharmacol 30, 209-216. Calabrese EJ (1985). Uncertainty factors and interindividual variation. Regul Toxicol Pharmacol 5, 190-196. Calabrese EJ, Beck BD and Chappell WR (1992). Does the animal-to-human uncertainty factor incorporate interspecies differences in surface areas? Regul Toxicol Pharmacol 15, 172-179. Davidson IWF, Parker JC and Beliles RP (1986). Biological basis for extrapolation across mammalian species. Regul Toxicol Pharmacol 6, 211-237. Dourson ML and Stara JF (1983). Regulatory history and experimental support of uncertainty (safety) factors. Regul Toxicol Pharmacol 3, 238-244. Dourson ML, Pelter SP and Robinson D (1996). Evolution of science-based uncertainty factors in noncancer risk assessment. Regul Toxicol Pharmacol 24, 108-120. ECETOC (1995). Assessment factors in human health risk assessment. Technical Report No. 68. European Centre for Ecotoxicology and Toxicology of Chemicals, Brussels August 1995. Feron VJ, van Bladeren PJ and Hermus RJJ (1990). A viewpoint on the extrapolation of toxicological data from animals to man. Fd Chem Toxicol 28, 783-788. Gaylor DW, Kodell RL, Chen JJ and Krewski D (1999). A unified approach to risk assessment for cancer and noncancer endpoints based on benchmark doses and uncertainty/safety factors. Regul Toxicol Pharmacol 29, 151-157. Grandjean P (1997). Farlig forurening. Fra risikovurdering til forebyggelse. Sundhedsstyrelsen. Nyt Nordisk Forlag Arnold Busck, København. Grönlund MH (1992). Kvantitativ riskbedömning av icke-genotoxiska substanser – en metodikstudie. IMM-rapport 4/92. Institutet för miljömedicin. Karolinska instituttet (in Swedish). Hattis D, Erdreich L and Ballew M (1987). Human variability in susceptibility to toxic chemicals – a preliminary analysis of pharmacokinetic data from normal volunteers. Risk Anal 7, 415-426. Kramer HJ, van den Ham WA, Slob W and Pieters MN (1996). Conversion factors estimating indicative chronic no-observed-adverse-effect levels from short-term toxicity data. Regul Toxicol Pharmacol 23, 249-255. Larsen PB, Larsen JC, Fenger, J og Jensen SS (1997). Sundhedsmæssig vurdering af luftforurening fra vejtrafik. Miljøprojekt nr. 352. Miljø- og Energiministeriet, Miljøstyrelsen. Lehman AJ and Fitzhugh OG (1954). 100-fold margin of safety. Assoc Food Drug Off U.S.Q. Bull 18, 33-35. MST (2001). Personlig meddelelse. MST (1990). Begrænsning af luftforurening fra virksomheder. Vejledning fra Miljøstyrelsen Nr. 6 1990. Miljøministeriet, Miljøstyrelsen. Nielsen E, Thorup I, Schnipper A, Hass U, Meyer O, Ladefoged O, Larsen JC, Østergaard G, Sørensen TL and Larsen PB (2001). Children and the unborn child. Exposure and susceptibility to chemical substances – an evaluation. Environmental Project No. 589. Miljøstyrelsen, Miljø- og Energiministeriet. Pieters MN, Kramer HJ and Slob W (1998). Evaluation of the uncertainty factor for subchronic-to-chronic extrapolation: Statistical analysis of toxicity data. Regul Toxicol Pharmacol 27, 108-111. Renwick AG (1999). Data-derived safety factors for the evaluation of food additives and environmental contaminants. Food Addit Contam 10, 275-305. Renwick AG (1999a). Subdivision of uncertainty factors to allow for toxicokinetics and toxicodynamics. Hum Ecol Risk Assess 5, 1035-1050. Renwick AG (1995). The use of an additional safety or uncertainty factor for nature of toxicity in the estimation of acceptable daily intake and tolerable daily intake values. Regul Toxicol Pharmacol 27, 3-20. Renwick AG and Lazarus NR (1998). Human variability and noncancer risk assessment – an analysis of the default uncertainty factor. Regul Toxicol Pharmacol 27, 3-20. US-EPA (1998). Ambient water quality criteria derivation for the protection of human health – Technical Support Document. Final draft. United States Environmental Protection Agency, Office of Water 4304, EPA-822-B-98-005. Van Genderen H (1988). General conclusions of the chairman (presented at the workshop May 2-3, 1988 at the National Institute of Public Health and Environmental Protection, Ba Bilthoven, The Netherlands). Regul Toxicol Pharmacol 8, 431-436. Vermeire T, Stevenson H, Pieters MN, Rennen M, Slob W and Hakkert BC (1999). Assessment factors for human health risk assessment: a discussion paper. Crit Rev Toxicol 29 (439-490). Voisin EM, Ruthsatz M, Collins JM and Hoyle PC (1990). Extrapolation of animal toxicity to humans: interspecies comparisons in drug development. Regul Toxicol Pharmacol 12, 107-116. Weil CS (1972). Statistics vs safety factors and scientific judgement in the evaluation of safety for man. Toxicol Appl Pharmacol 21, 454-463. WHO (1996). 12. Chemical and physical aspects: introduction. In: Guidelines for drinking-water quality, second edition. Volume 2 Health criteria and other supporting information. World Health Organization, Geneva, 121-131. WHO (1994). Assessing human health risks of chemicals: Derivation of guidance values for health-based exposure limits. Environmental Health Criteria 170, World Health Organization, Geneva.
|