|
| Forside | | Indhold | | Forrige | | Næste |
Bakterievækst og tilsætningsstoffer
6 Undersøgelse af mikrobiel vækst med udvalgte tilsætningsstoffer som kulstofkilder
Tilsætningsstoffer kan potentielt fungere som kilder for det organiske kulstof, som kræves for vækst af mikroorganismer. For at afklare, i hvor høj grad de giver anledning til bakterievækst, blev der udført en
række vækstforsøg.
6.1 Undersøgte tilsætningsstoffer
6.1.1 Bentonite
Der blev undersøgt det kommercielle bentonite-produkt Wyoming bentonite API, Mercantas varekode VA 218. Produktets sammensætning fremgår af Tabel 6, Kapitel 5. Bentonite indgår i flere
tilsætningsstoffer, som alle anvendes i store mængder, hvorfor selv små koncentrationer af organisk C kunne udgøre et betydeligt C-bidrag. Derfor blev det besluttet at undersøge bentonite for dets
eftervækstpotentiale. På grund af produktets formodede lave C-indhold blev det besluttet at undersøge koncentrationer, der er betydelig højere end koncentrationer for CMC. Der blev undersøgt 50 og
5000 g bentonite/L vand.
6.1.2 CMC
Der blev også undersøgt to kommercielle produkter, der indeholder CMC i forskellige renhedsgrader. Det ene produkt Gabrosa P 300 G (Mercantas A/S) markedsføres til drikkevandsboringer, mens det
andet produkt Akucell AF 1985 (Akzo Nobel n.v.) markedsføres som tilsætningsstof til fødevarer.
For dette projekt er den vigtigste forskel mellem de 2 CMC-prøver, at den tekniske kvalitet (Gabrosa P 300 G) har et betydeligt indhold af acetat i form af natriumhydroxyacetat (jf. Tabel 8), og Akucell
AF 1985 har et meget lavt indhold af acetat (< 0,24 %, jf. Tabel 9).
Der blev valgt at undersøge CMC ved 10 og 1000 g/L vand. Disse koncentrationer er valgt, så de omtrent svarer til hhv. biostabilt vand (AOC under 10 µg acetat-C ækvivalenter/L) og så vand med
tilstrækkeligt kulstof til at understøtte rigelig vækst, hvis CMC-molekylet kan omsættes.
Tabel 8. CMC – Gabrosa P 300 G: kemisk sammensætning ifølge produktets sikkerhedsdatablad (Mercantas 2004)
| Forbindelse |
% af total vægt |
| Natriumcarboxymethylcellulose |
50 – 80 |
| Natriumchlorid |
5 – 40 |
| Natriumhydroxyacetat |
5 – 20 |
Tabel 9. CMC - Akucell AF 1985: kemisk sammensætning ifølge
produktets analysecertifikat (Akzo Nobel 2004)
| Forbindelse |
% af total vægt |
| Natriumcarboxymethylcellulose |
99,7 |
| Natriumchlorid |
0,06 |
6.2
Metoder
Hvert teststof blev undersøgt med to metoder: AOC-metoden og måling af eftervækstpotentiale. Alle bestemmelser blev udført i triplikat.
6.2.1 Assimilerbart Organisk Carbon (AOC)
AOC-metoden er baseret på måling af tilvækst af to bakterier, der tilsættes som renkulturer. Pasteuriseret drikkevand (70ºC i 45 min) tilsættes teststoffet, og der podes med to renkulturer: Pseudomonas
fluorescence (P17) og Aquaspirillum sp. (NOX), hvis tilvækst følges under inkubering ved 15ºC. Bakterieantallet bestemmes ved pladespredning (HPCR2A, 25ºC, 3 døgn) på dag 0, 3, 7 og 14, idet de
to bakterier har forskellig kolonimorfologi og derfor kan skelnes fra hinanden på samme agarplade. Det maksimale bakterieantal omsættes til acetat-ækvivalenter ved hjælp af en standardkurve for acetat for
hver af de to bakterier. Figur 2 viser en principskitse af metoden.
AOC-metoden er en standardiseret metode og resultater opnået med denne metode vil således kunne sammenlignes med eksisterende målinger på råvand og drikkevand. Selvom de to bakterier tilsammen
kan nedbryde et bredt spektrum af organiske stoffer, kan det ikke udelukkes, at en bredere bakteriesammensætning, som forekommer i drikkevand vil kunne nedbryde en større andel. Som
tommelfingerregel giver vand med et AOC-indhold lavere end 10 µg acetat-C ækvivalenter/L ikke anledning til betydelig bakterietilvækst (van der Kooij, 1992)
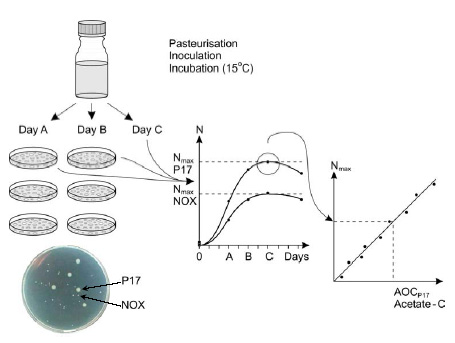
Figur 2: Skematisk gennemgang af AOC-metoden. De to bakterier (P17 og NOX) har forskellig kolonimorfologi og kan derfor tælles på samme agarplade.
6.2.2 Eftervækstpotentiale
Eftervækstpotentiale angiver den maksimale bakterietilvækst, som tilsætningsstoffet tilsat drikkevand kan give anledning til. For at sikre en bred bakteriesammensætning podes med bakterier udrystet fra
filtersand (20 g udrystet i 200 mL drikkevand over et døgn, podet til 1% af totalvolumen). Disse bakterier vokser bl.a. på det organiske materiale, der er i råvandet, og derved modelleres en situation, hvor
tilsætningsstoffer i en ny boring forurener råvandet. Bakterietilvæksten måles under inkubering ved 15ºC ved pladespredning på R2A og ved måling af Adenosine TriPhosphate (ATP) på dag 0, 3, 7 og 14.
6.2.2.1 Pladespredning (HPC)
Pladespredningerne (heterotrophic plate count – HPC) udføres på R2A, som er en agar specielt udviklet til bestemmelser i næringsfattige miljøer såsom drikkevand (Reasoner, 1985). Pladerne inkuberes
ved 20ºC i 14 dage.
Når bakterieantal bestemmes ved pladespredninger, og der ikke er tale om en renkultur, vil antallet af bakterier som danner synlige kolonier (og derved bliver talt) afhænge af den agar der anvendes,
inkuberingstemperaturen og inkuberingstiden. Således kan resultaterne fra eftervækstpotentiale-målinger ikke direkte sammenlignes med værdier målt ved standardmetoderne (gær ekstrakt agar ved 22ºC
eller 37ºC). Jo tættere substratkoncentrationen og inkuberingstemperaturen modsvarer forholdene i prøven, desto større et antal bakterier vil danne kolonier. Således opnås der for drikkevandsprøver flere
kolonier på den næringsfattige R2A agar end på gærekstrakt agar, hvilket giver et mere nuanceret billede af væksten (f.eks. Jørgensen et al. 2002).
6.2.2.2 Adenosin TriPhosphat (ATP)
ATP er energibærende molekyle i alle levende celler, og kan bruges som et mål for bakteriedensitet inklusiv eventuel forekomst af andre mikroorganismer. Ved reaktion med en luceferin/luciferase blanding
danner ATP lys, som kan måles i et luminometer. Lysudsendelsen vil være proportional med mængden af ATP og omsættes til en ATP-koncentration ved hjælp af en ATP-standardkurve (analysevejledning i
Bilag D).
ATP er en ikke-selektiv metode, der måler alle bakterier (også dem som ikke vokser på R2A), men resultaterne kan ikke direkte omsættes til et bakterieantal.
6.3 Forsøgsopsætning
Undersøgelserne blev udført i 250 mL PYREX flasker med 'red caps' med teflon indlæg. Før brug blev flasker og låg vasket i opvaskemaskine på program med afsluttende syrevask. Flaskerne blev
efterfølgende brændt ved 550ºC og lågene tør-steriliseret ved 170ºC i 6 timer.
Der blev anvendt drikkevand og filtersand hentet direkte fra Lyngby vandværk, da dette vand erfaringsmæssigt giver lave baggrundsværdier. For at sikre, at AOC var den eneste begrænsende vækstfaktor,
blev vandet tilsat N og P. Vandet blev udvejet i flaskerne til at give en totalvolumen efter tilsætning af teststof-stamopløsninger (Bilag E), næringssaltopløsninger (Bilag E) og podning på 200±1 mL. For både
AOC-metoden og måling af eftervækstpotentiale blev der opstillet kontroller uden teststof. Alle bestemmelser blev udført i triplikat.
6.4 Resultater
På de følgende figurer betegnes det tekniske CMC-produkt (Gabrosa P 300 G) som "CMC", og produktet Akucell AF 1985 betegnes "CMC-KR" (CMC, kemisk rent).
I de testede koncentration gav tilsætningsstofferne ikke anledning til uklarhed i vandfasen.
6.4.1 AOC
I alle prøverne var antallet af NOX højere end antallet af P17 (eksempler på vækstkurver i Figur3).
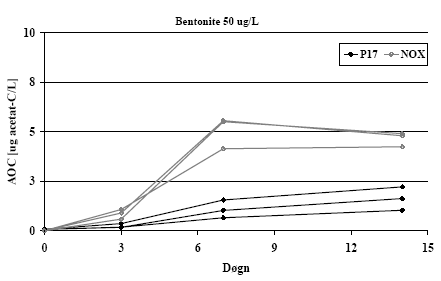
Figur 3: Eksempler på vækstkurver (triplikat) for P17 og NOX ved AOC-bestemmelse, her for 50 µg/L Bentonite.
AOC i kontrolprøverne var i gennemsnit 4,7±0,8 µg acetat-C ækvivalenter/L (gennemsnit ± standardafvigelsen). Gennemsnittet for de øvrige prøver var højere (Figur 4), men under 10 µg acetat-C
ækvivalenter/L på nær for 1000 ug/L CMC (15,4±0,6 µg acetat-C ækvivalenter/L). Med de opnåede standardafvigelser var kun 1000 µg/L CMC signifikant forskellig fra kontrollen (rådata i Bilag B). Ud
fra AOC-resultaterne skulle de testede tilsætningsstoffer således ikke give anledning til nævneværdig bakterietilvækst.
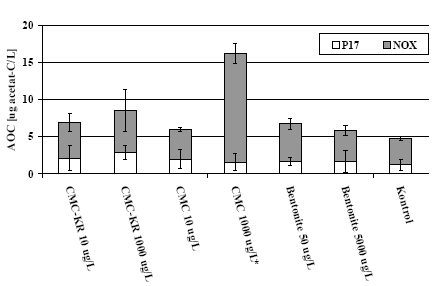
Figur 4: AOC værdier for tre tilsætningsstoffer i to koncentrationer samt for kontrol. * Afvigende høj værdi for P17 for en af triplikaterne sorteret fra (se Bilag B). Fejllinier angiver standardafvigelse imellem
triplikater.
6.4.2 Eftervækstpotentiale
Eftervækstpotentialet målt som HPC er vist i Figur 5 (rådata i Bilag C) og målt som ATP i Figur 6 (rådata i Bilag D). For begge parametre var værdierne i prøver med teststof på niveau med kontrollerne.
HPC-værdierne var generelt lavere end 4×104 CFU/mL, mens ATP-værdierne var lavere end 9 pg ATP/mL. Med de opnåede standardafvigelser indikerede ingen af parametrene, at de testede
tilsætningsstoffer skulle give anledning til øget bakterietilvækst. Resultaterne fra måling af eftervækstpotentiale bekræftede således resultaterne fra AOC-målingerne.
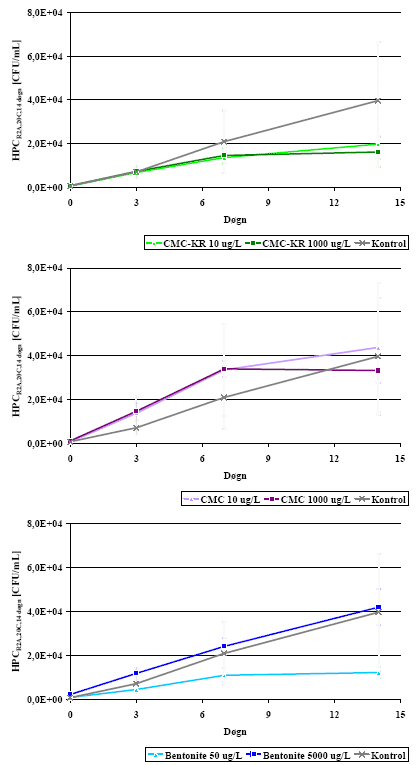
Figur 5: Eftervækstpotentiale for tilsætningsstoffer og kontrol målt som HPC. Fejllinier angiver standardafvigelse imellem triplikater.
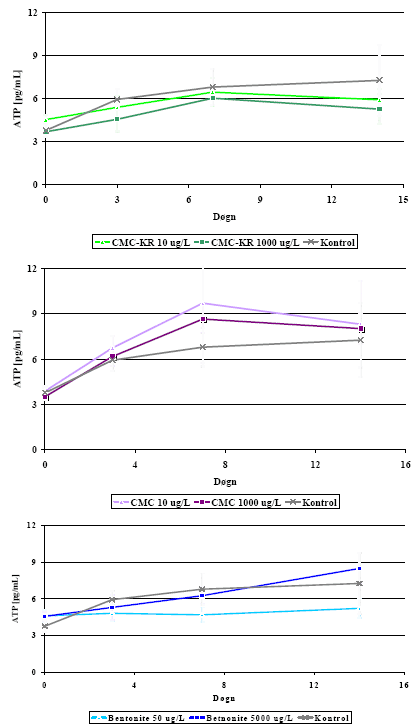
Figur 6: Eftervækstpotentiale for tilsætningsstoffer og kontrol målt som ATP. Fejllinier angiver standardafvigelse imellem triplikater.
6.5 Diskussion
Undersøgelserne blev udført med frisk produceret drikkevand som testvand (Lyngby vandværk). Dette blev valgt frem for grundvand, da der eksisterer et bredt erfaringsgrundlag med dette vand på E&R
DTU. Vandet giver lave baggrundsværdier for alle tre analyseparametre, og sikre således en høj analysefølsomhed. For at simulere situationen i råvand blev der i eftervækstundersøgelserne podet med
bakterier udrystet fra vandværksfiltre.
Det manglende vækstrespons i undersøgelserne skal ikke tilskrives for lille følsomhed på analyserne. AOC-metoden har i tidligere undersøgelser givet klare respons på selv små mængder substrat, f.eks. ved
analyse af sterile ekstrakter af plastrør (Corfitzen et al. 2002). Eftervækst-målingerne har ligeledes resulteret i tydelig forhøjet vækst i forbindelse med undersøgelser af plastrør (f.eks. van der Koiij et al.
2004; Corfitzen, 2004).
Den højere AOC-værdi for 1000 µg/L af det tekniske CMC (Gabrosa P 300 G) skal formentlig tilskrives indholdet af natriumhydroxyacetat og eventuelle andre urenheder i produktet. Et respons på
10,7±1,0 g acetat-C/L for 1000 µg/L CMC (opnåede AOC-værdi fratrukket blindværdien) svarer til et natriumhydroxyacetat indhold på 4,4±0,4%, hvilket modsvarer den lavere grænse angivet i Tabel 5.
| Forside | | Indhold | | Forrige | | Næste | | Top |
Version 1.0 Marts 2005, © Miljøstyrelsen.
|