|
Virkningsmekanismer for neurotoksisk effekt af mangan og kombinationseffekt af mangan og chlorpyrifos og maneb 4 Materialer og metoder
I dette kapitel beskrives detaljerede forhold vedrørende laboratoriedyr, udtagning og præparation af prøver samt analyser heraf. 4.1 Laboratoriedyr og dyreholdI en enkelt indledende undersøgelse med mangandosering anvendtes Wistar hanrotter. I alle andre undersøgelser anvendtes 6 uger gamle Sprague Dawley hanrotter (Tac:SPRD N@Mol outbred rat, SPF) fra M&B A/S, DK-8680 Ry, Danmark. Straks efter ankomst til dyrestald blev dyrenes sundhedstilstand kontrolleret, de blev randomiseret og fordelt i hold med samme gennemsnitlige legemsvægt. Før doseringsstart blev dyrene akklimatiseret mindst en uge. De gik 2 per bur (Macrolon) i dyrerum med reguleret, konstant klima. Rumtemperaturen var 22±1°C, den relative luftfugtighed 55%±5% og der var en 12 timers lys:mørke cyklus. Rotterne blev fodret med standardfoder (Altromin No. 1324) og citronsyresyrnet vand (pH 3,5 for at hindre vækst af mikroorganismer) begge ad libitum. Dyrene blev tilset 2 gange dagligt af staldpersonalet. Kliniske observationer blev straks rapporteret og tilset af dyrlæge. 4.2 Dyreetik og antal anvendte dyrAlle anvendte dyr blev doseret og behandlet i henhold til gældende lovgivning på området. Af dyreetiske hensyn anvendes i alle undersøgelser det minimale antal rotter skønnet tilstrækkeligt til at tillade solid statistisk analyse. Dette skøn var baseret på årelang erfaring med dyreeksperimentelt arbejde. 4.3 Aflivning, udtagning og præparation af blod, hjernevæv og andre organerAflivningRotter blev decapiteret i CO2/O2 narkose. Ved decapiteringen blev der opsamlet så meget blod som muligt. Heparin anvendtes som antikoagulans. Efter forsigtig blanding henstod blodet i isbad indtil plasmapræparation. Præparation af plasmaEfter forsigtig blanding blev blod centrifugeret ved 1000 g ved 0-4°C i 10 minutter, hvorefter plasma nøje blev dekanteret fra. Plasma henstod ved –80°C indtil analyser for mangan, AChE, BuChE eller prolaktin. RandomiseringerVed alle projektets undersøgelser blev der skiftevis aflivet dyr fra hver enkelt gruppe, aldrig flere/alle dyr fra samme gruppe samtidigt. Mangananalyser, neurokemiske analyser og histopatologiske vurderinger blev foretaget randomiseret, det vil sige, prøverne var blindet for laborant og andet personale. Mikrodissketion af små hjerneskriverI forbindelse med en indledende undersøgelse blev der udviklet metoder til reproducerbar isolation af små, cirkulære vævsskiver (micropunch) fra hjernens corpus striatum og substantia nigra. Hertil blev isafkølet hjerne placeret i formstøbt, isafkølet metalblokmatrice med 1 mm skæreriller vinkelret på hjernens længdeakse. Svarende til lokalisation af corpus striatum og substantia nigra blev der udskåret 1 mm tykke skiver af hjernevæv vinkelret på længdeaksen. Disse skiver blev lagt på en isafkølet metalblok. Herefter blev der med ”propbor” udstanset en cirkulær skive med en diameter på 2 mm (corpus striatum) eller 1 mm (substantia nigra). Disse vævsprøver var for små til at blive vejet uden kompromitterende tekniske problemer (afdampning, vejning tog for lang tid forhold til dopamin’s stabilitet). I stedet overførtes skiverne umiddelbart efter udstansning til 0,2 M HClO4 for at stabilisere signalstofferne. Dette blev straks herefter ultrasonikeret, centrifugeret ved 10000 g i 10 minutter og delt i supernatant og sediment. Supernatanten blev anvendt til dopamin analyse, sedimentet til protein analyse efter opløsning i 0,1 M NaOH. Prøverne henstod ved –80°C indtil disse analyser. Regional dissektion af corpus striatum og resthjerneHjerner og hjernedele, her specifikt corpus striatum, blev udtaget og isoleret som beskrevet af Glowinski & Iversen (1966) og efter vejledning fra NeuroSearch. Ved isolation af corpus striatum udtoges først højre halvdel som blev vejet i iskold 0,32 M sukroseopløsning, derefter venstre halvdel som overførtes til samme glas, som derefter blev vejet. Derved kunne vægt af højre, venstre og poolet corpus striatum udregnes seperat. Herefter blev det fremstillet homogenat af således poolet corpus striatum. Kun fra dyr doseret med 6-OHDA udtoges, vejedes, homogeniseredes og analyseredes højre og venstre halvdel af corpus striatum separat. Dette skyldtes, at doseringen skete ensidigt ved højre corpus striatum. Resthjernen overførtes til afvejet glas med iskold 0,32 M sukrose, hvorefter der blev vejet igen. Heraf fremstilledes sukrosehomogenat. Det var meget vigtigt for efterfølgende analysers kvalitet, at alle disse procedurer skete så hurtigt som overhovedet muligt, og at kølekæden aldrig blev brudt. Homogenisering af hjernevævSukroseopløsning, 0,32 M, med vævsprøver blev hurtigst muligt homogeniseret ved ultrasonikering (Microscan ™) under anvendelse af iskappe. På sektionsstuen blev sukrosehomogenatet hurtigst muligt fordelt til de enkelte analyser og prøvematerialet blev hurtigst muligt præpareret til efterfølgende neurokemiske og kemiske analyser. Dette specificeres nedenfor for hver analyse. Præparation af blindprøver af homogenater til mangananalyserHver dag, der på sektionsstuen blev udtaget hjernevæv til mangananalyser, blev der homogeniseret blindprøver af 0,32 M sukroseopløsning uden corpus striatum og resthjerne. Herved sikredes udover en blindværdi også løbende kontrol af eventuel kontaminering med mangan fra anvendte metalutensilier. Udtagning af andre organerI dose-range undersøgelserne for chlorpyrifos og maneb og i kombinationsundersøgelsen blev der udtaget og vejet lever, nyrer, binyrer, milt, thymus og testikler. 4.4 Kemiske analyserMangananalyserAnalyseprincip og apparatur: Mangan bestemtes i plasma og i udvalgte hjernedele ved mikrobølge-assisteret oplukning i koncentreret salpetersyre efterfulgt af induktivt koblet plasma massespektroskopi (ICP-MS). Dertil benyttedes et særligt ICP-MS instrument med dynamisk reaktionscelle, der eliminerede interferenser i målingen (Sloth & Larsen 2000). Prøvepræparation før analyse: Inden analyse blev der gennemført vådforaskning af hjernehomogenater og af plasma. Prøverne blev forasket med ultraren koncentreret salpetersyre i mikrobølgeovn. Analysekontrol: Til kontrol af nøjagtigheden blev der parallelt med prøverne foretaget genfinding af mangan-standard tilsat prøverne inden foraskning. Kalibrering blev gennemført med en intern standard på 3 koncentrationsniveauer. 4.5 Neurokemiske analyserDe biogene aminer noradrenalin, dopamin og 5-hydroxytryptaminUmiddelbart efter homogenisering tilsattes 1 mL sukrosehomogenat 2 mL 0,5 M HClO4. Dette blev blandet grundigt og opbevaret ved –80°C indtil analyse. Ved analysen blev prøverne tøet op, blandet grundigt og centrifugeret ved 10.000 g i 10 minutter. Supernatanten blev derefter dekanteret fra og anvendt som prøvemateriale. En aliquot tilsattes en opløsning af dihydroxybenzylamin (DHBA) og N--met-5-hydroxytryptamin (N-ω-met-5-HT) til passende response for analytter og interne standarder. DHBA fungerede som intern standard for noradrenalin og dopamin, N-ω-met-5-HT var intern standard for 5-hydroxytryptamin. Koncentrationen af noradrenalin, dopamin og 5-hydroxytryptamin blev målt ved HPLC med elektrokemisk detektion (Lam et al. 1992). 5-hydroxytryptamin blev kvantificeret i uoprenset prøve, noradrenalin og dopamin efter aluminiumoxid oprensning. Analysen foregik ved stuetemperatur på en Hewlett-Packard 1100 HPLC monteret en ESA MD-150 kolonne (3 mm ID x 15 cm, C-18, 5 µm partikelstørrelse)(ID: indre diameter) og en ESA Model 5200A Coulochem II elektrokemisk detektor. Elueringsbufferen havde sammensætningen 75 mM NaH2PO4 , 1,7 mM octansulfonat, 100 µL triethylamin/L, 25 µM EDTA (ethylendiamintetraeddikesyre), 5% acetonitril og var indstillet til pH=3,0 med H3PO4. Flowrate var 0,8 mL/minut. Detektorens ”guard cell” potentiale var +350 mV, og potentialet for elektrode E1 var –150 mV og +220 mV for den analytiske elektrode E2. Der blev kromatograferet i 30 minutter for hver injektion. Denne metode er udviklet og detaljeret bekrevet af Lam et al. 1992. Aminosyrerne glutamat, taurin og GABAUmiddelbart efter homogenisering tilsattes 1 mL sukrosehomogenat 2 mL 0,5 M HClO4. Dette blev blandet grundigt og opbevaret ved –80°C indtil analyse. Her blev prøverne tøet op, blandet grundigt og centrifugeret ved 10.000 g i 10 minutter. Supernatanten blev dekanteret fra og anvendt til aminosyreanalyser. Dette var en HPLC metode, hvorved bl.a. aminosyrer automatisk blev derivatiseret med ortophthalaldehyd on-line umiddelbart før injektion på kolonnen. Derivaterne fluorescerer kraftigt. De blev adskilt på en RP-18 (ESA) søjle, som blev elueret med 0,1 M phosphatbuffer med 25% metanol. Flowrate var 1 mL/minut. Excitations- og emissionsbølge-længderne var henholdsvis 230 nm og 455 nm. Denne metode er udviklet til projektet og endnu ikke publiceret i detaljer. Protein bestemmelseUmiddelbart efter homogenisering blev 100 µL sukrosehomogenat tilsat 1900 µL 0,05 M NaOH. Dette blev blandet grundigt og opbevaret ved –80°C indtil proteinanalyse efter en metode oprindeligt beskrevet af Lowry (1951) og modificeret af Hartree (1972) under anvendelse af bovin albumin fraktion V som standard. Aktivitet af AChE og BuChEUmiddelbart efter homogenisering tilsattes 500 µL sukrosehomogenat 500 µL 2% (v/v) Triton X-100. Dette blev blandet grundigt og opbevaret ved –80°C indtil analyse. Ved analyse blev prøverne tøet op, blandet grundigt hvorefter de henstod ved stuetemperatur i 60 minutter for opløsning af protein- og lipidstrukturer og frigivelse af AChE og BuChE. Derefter centrifugeredes ved 10.000 g i 10 minutter. Supernatanten anvendtes til analyse. AChE aktivitet: Analysen var en modifikation af en oprindelige metode beskrevet af Ellman et al. (1961). Analysen foregik ved 37°C på analyserobot (Cobas Mira). 400 µL buffer med chromogen [Na-phosphatbuffer: 52 mM; 5,5’dithio-bis(2-nitrobenzoic acid) 0,26 mM; pH 7,2] tilsattes 20 µL prøve. Derefter tilsattes 14 µL substratblanding (vandig opløsning af acetylthiocholin iodid, 156 mM). Farveudviklingen ved 405 nm blev registreret som funktion af tid og omregnet til aktivitet (U/L) ved anvendelse af CFAS (Calibrator for Automated Systems®, Roche) som kalibrator. BuChE aktivitet: Analysen var en modifikation af den oprindelige metode beskrevet af Ellman et al. (1961). Analysen foretoges analogt med analysen for AChE, blot var substratet i denne analyse butyrylthiocholin iodid i en koncentration på 218 mM Aktivitet af glutamat decarboxylase (GAD)Der anvendtes sukrosehomogenat til aktivitetsbestemmelse efter en inkubationsmetode, hvorved dannelseshastigheden for GABA udfra glutamat som substrat blev bestemt ved 37°C efter inkubation i 60 minutter (Holdiness 1983; Rossetti et al. 1996). GABA blev kvantificeret ved samme HPLC metode som blev anvendt til aminosyrerne. Aktivitet af caspase-3 aktivitetUmiddelbart efter homogenisering tilsattes 500 µL sukrosehomogenat 500 µL buffer (50 mM HEPES, 1 mM dithiotreitol, 0,1 mM Na2EDTA, 10% glycerol, 0,1% CHAPS, 1% Triton X-100, pH 7,4) tilsat en cocktail af proteasehæmmere (CalbioChem Cat. No. 53134). Dette blev blandet grundigt og opbevaret ved –80°C indtil caspase-3 analyse. Aktiviteten blev målt efter en meget specifik og følsom metode (Dalgaard et al. 2001; Ladefoged et al. 2004). Kort beskrevet foregik det således: Optøet, modificeret sukrosehomogenat blev blandet og centrifugeret ved 30.000 g i 10 minutter ved 4°C. Supernatanten blev dekanteret fra. Efterfølgende pipetteringer og inkubationer ved 37°C skete med analyserobot (RoSys, Plato) som 3-dobbelt bestemmelse. Der anvendtes mikrotiterbakker med 96-brønde. Assay buffer (100 mM NaCl; 50 mM HEPES; 10 mM DTT; 1 mM EDTA; 10% glycerol; 0,1% CHAPS, pH 7,4) blev blandet med prøve og inkuberet med (3 inkubationer) og uden specifik (3 andre inkubationer) caspase-3 hæmmer (Ac-DEVD-CHO, Calbiochem Cat. No. 235420) i 10 minutter. Derefter blev reaktionen startet ved tilsætning af kolorimetrisk substrat (Ac-DEVD-pNA, Calbiochem Cat. No. 235400), hvorfra caspase-3 fraspalter 4-nitroanilin (4-NA), hvilket gav anledning til absorption ved 405 nm. Der blev inkuberet i 60 minutter, hvorefter reaktionen blev stoppet ved tilsætning af stopreagens (0,1 M HClO4) indeholdende den interne standard 3-nitroanilin (3-NA). 4-NA blev kvantiteret på HPLC med 3-NA som intern standard. Analysen foregik ved stuetemperatur på en Hewlett-Packard 1100 HPLC monteret med diode-array detektor, hvor absorptionen blev registreret ved 380 nm. Søjlen var en Merck kolonne (3 mm ID x 25 cm, C-18, 7 µm partikelstørrelse). Kolonnetemperaturen var 22-24°C og elueringsmidlet var en 30% vandig acetonitril opløsning med flowrate på 1 mL/minut. Kvantitativ western blot af α-synuclein, synaptophysin og actinForbehandling af prøver: Sukrosehomogenat blev tøet på isbad og efterfølgende behandlet med ultralyd. Derefter blev homogenat fortyndet på basis af de tidligere proteinanalyser til en ønsket proteinkoncentration ved tilsætning af sample buffer (Bio-Rad Cat. No. 161-0791 og 161-0792) og proteasehæmmer cocktail (Calbiochem Cat. No. 539134). Dette blev kogt 5 minutter på vandbad og centrifugeret (Laemmli et al. 1970). Påsætning på geler: Centrifugerede prøver blev sat på forstøbte geler (Criterion XT 12 % Bis-Tris med 26 brønde, Bio-Rad Cat. No. 345-0119) sammen med proteinmarkører(molekylevægtsstandard) (Bio-Rad Cat. No. 161-0373 og 161-0363). På hver 26 brønds gel blev sat 2 proteinmarkører, 3 standardprøver (fra kontrolhold) af forskellig proteinkoncentration og 21 prøver fordelt på de enkelte hold. Elektroforese, blotning og blokering: Elektroforesen forløb i 2 timer ved et potentiale på 200 V med et Criterion XT-MOPS buffer system (Bio-Rad Cat. No 161-0788) (Laemmli et al. 1970). Efterfølgende overførtes proteiner fra gel til immobiliserende polyvinylidindifluorid membran (PVDF) ved hjælp af en ”semidry”elektroblotter med grafitelektroder (Bio-Rad). Der blev anvendt en transferbuffer indeholdende: 50 mM Tris-base, 40 mM glycin, 0.037 % natrtiumdodecylsulfat og 20% Metanol. Overførslen foregik ved et potentiale på 15 V i 35 minutter. PVDF membranen blev blokeret med 5 % skummetmælk pulver opløst i vaske buffer: 25 mM Tris-HCl, 137 mM NaCl, 0.15 % tween 20 (pH 7.4). Blokeringen foregik natten over ved 4°C (Towbin et al. 1979). Analyse af de enkelte proteiner: Efter blokering blev membranen klippet i to stykker, et som indeholdt α-synuclein og og et som indeholdt synaptophysin. Det første membranstykke blev inkuberet med primært antistof for α-synuclein [polyklonalt aα-synuclein (kanin) fra Lundbeck] i 2 timer, behandlet med sekundært antistof og kvantificeret som beskrevet nedenfor. Det andet membranstykke blev inkuberet i 2 timer med primært antistof for synaptophysin [monoklonalt synaptophysin (mus) fra Neomarkers Cat. No. MS-1227P], med sekundært antistof og kvantificeret (se nedenfor). Herefter blev det strippet, inkuberet i 2 timer med primært antistof for actin [monoklonalt actin (mus) fra SIGMA Cat. No A5441], med sekundært antistof og kvantificeret (se nedenfor). Behandling med sekundært antistof: Efter behandling med primært antistof blev membranen vasket i 3x10 minutter i vaskebuffer, hvorefter der blev inkuberet i 2 timer med det sekundære antistof (kanin anti-mus fra DAKO Cat. No. P0260; ged anti-kanin fra Zymed Cat. No. 81-6120), som var HRP-enzymkoblet (horse radish peroxidase). Derefter blev membranen vasket i 3x10 minutter i vaskebuffer. Kvantificering: Membranen blev herefter inkuberet i 5 minutter med et chemiluminescens substrat kit (Bio-Rad Cat. No. 170-5040), hvorefter luminescensen blev kvantificeret via et imaging system (ChemiDoc Imaging system fra Bio-Rad), så der blev opnået talmæssig beskrivelse af udsendt lys, som i det anvendte koncentrationsområde var ligefrem proportional med proteinmængden i båndet. Kontrol af proteinernes identitet: Molekylvægten på proteiner i bånd fra homogenatprøverne blev kontrolleret udfra proteinmarkøren så det sikredes, at molekylvægten var i overensstemmelse med molekylvægten på de undersøgte proteiner: α-synuclein (17 kDa), synaptophysin (38 kDa) og actin (42 kDa). Reproducerbarhed: Gentagne analyser af samme prøve udført både på samme gel og på forskellige geler viste procentvise standardafvigelser på mindre end 15% for begges vedkommende, hvilket vurderes som tilfredsstillende. Koncentration af prolaktin i plasmaAnalyse for prolaktin i plasma foregik ved hjælp af et kommercielt tilgængeligt enzymimmunoassay kit (Biotrak™) specielt udviklet til analyse af rotteplasma. 4.6 Histologiske og immunhistokemiske undersøgelserDer anvendtes klassisk histokemisk HE farvning til påvisning af histologiske ændringer samt immunhistokemiske farvemetoder til påvisning af GFAP og DNA fragmentering, TUNEL, TH og α-synuclein. Hjernen blev udtaget fra kraniet og overført til formalin. Efter 24 timer blev hjernen gennemskåret med to tværsnit: et ud for corpus striatum og et ud for substantia nigra. Alle farvninger blev udført på 3 tykke snit af formalin fikseret, paraffinindstøbt hjernevæv. Dette blev afparaffineret og rehydreret inden farvningen ved behandling med petroleum i 2x10 minutter, alkohol med faldende koncentrationer fra 99%-70% hvert 5. minut for til sidst at henstå i rindende vand inden farvningen.
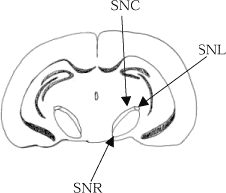
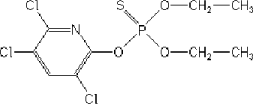
Figur 2. Tværsnit af hjernen ud for området indeholdende substantia nigra. SNC: Substantia nigra compacta, SNL: Substantia nigra lateralis, SNR: Substantia nigra reticularis. Klassisk histokemisk haematoxylin-eosin farvningSnittene blev kernefarvet med Mayers haematoxylin (LAB00254 Bie & Berntsen) i 10 minutter efterfulgt af blåning i rindende vand i 10 minutter. Snittene overførtes til bad med eosin i 2 minutter og de blev derefter skyllet kort i rindende vand og dehydreret i alkohol med stigende koncentration fra 70%-99%. Til sidst blev snittene monteret med Eukitt. Immunhistokemisk GFAP farvningDer anvendtes en modificeret metode oprindeligt beskrevet af Ladefoged et al. 2000. Farvningen foregik således: Snittene blev demaskeret i mikrobølgeovn i 0,01 M natriumcitrat-buffer pH 6,0 i 2x5 minutter og derefter afkølet i 20 minutter i bufferen. Snittene blev skyllet i 5 minutter i PBS-buffer. Der blev blokeret for endogen peroxidaseaktivitet med 3% H2O2 i 10 minutter, hvorefter der blev skyllet i skylle-buffer i 3x5 minutter. Uspecifik baggrundsfarvning blev blokeret med 5% svineserum/PBS i 20 minutter. Det primære antistof for GFAP blev fortyndet 1:200 i 5% svineserum/PBS og snittene blev inkuberet hermed natten over ved 4°C. Snittene blev så skyllet i 3x5 minutter i skylle-buffer og inkuberet med EnVision+ polyklonalt antistof i 30 minutter ved stuetemperatur. Der blev skyllet igen i 3x5 minutter i skylle-buffer og derefter fremkaldt i DAB+ (3,3-diaminobenzidine) i 15 minutter Overskydende DAB+ blev fjernes i rindende vand og snittene blev kernefarvet med Mayers hæmatoxylin i 1 minut efterfulgt af blåning i rindende vand i 5 minutter. Snittene blev så dehydreret i alkohol med stigende koncentration fra 70%-99% for til sidst at blive monteret med Eukitt. Immunhistokemisk tyrosin hydroxylase farvningDer anvendtes en ikke publiceret metode udviklet i samarbejde med medicinalfirmaet NeuroSearch. Farvningen foregik således: Snittene blev skyllet i 5 minutter i PBS-buffer. Der blev derefter blokeret for endogen peroxidase aktivitet med 3% H2O2 i 10 minutter, hvorefter der blev skyllet i skylle-buffer i 3x5 minutter. Uspecifik baggrundsfarvning blev blokeret med 1% bovint serum albumin BSA/PBS i 20 minutter Det primære TH antistof blev fortyndet 1:8000 i 1% BSA/PBS og snittene blev inkuberet hermed natten over ved 4 C. Snittene blev så skyllet i 3x5 minutter i skylle-buffer og inkuberet med EnVision+™ polyklonalt i 30 minutter ved stuetemperatur. Der blev hertefter skyllet igen i 3x5 minutter i skylle-buffer og fremkaldet i DAB+ (3,3-diaminobenzidine) i 15 minutter Overskydende DAB+ blev fjernet i rindende vand og snittene blev kernefarvet med Mayers hæmatoxylin i 1 minut efterfulgt af blåning i rindende vand i 5 minutter. Til sidst blev snittene dehydreret i alkohol med stigende koncentration fra 70%-99% og monteret med Eukitt. Immunhistokemisk TUNEL farvningDer anvendtes en modificeret metode oprindeligt beskrevet af Dalgaard et al. 2001. Farvningen foregik således: Snittene blev skyllet i 5 minutter i PBS-buffer, forbehandlet med 0,001% Proteinase K/PBS i 10 minutter og skyllet i PBS-buffer 2x2 minutter. Endogen peroxidase aktivitet blev blokeret med 3% H2O2 i 5 minutter, hvorefter der blev skyllet i skylle-buffer i 2x5 minutter. Snittene blev så inkuberet med equilibration-buffer i 30 minutter ved stuetemperatur. Overskydende buffer blev tørret af glassene og snittene inkuberedes med TdT (terminal-deoxynucleotidyl-transferase)-enzym opløsning i 1 time ved 37°C. Snittene blev så skyllet grundigt i stop-buffer i 15 sekunder og henstod derefter yderligere i bufferen 10 minutter. Der blev skyllet i skylle-buffer 3x1 minut og inkuberet med anti-digoxigenin peroxidase konjugat i 30 minutter ved stuetemperatur. Der blev skyllet i 4x2 minutter i skylle-buffer og derefter fremkaldt i DAB+ (3,3-diaminobenzidine) i 15 minutter. Overskydende DAB+ blev fjernet i rindende vand, hvorefter snittene blev kernefarvet med Mayers hæmatoxylin i 1 minut efterfulgt af blåning i rindende vand i 5 minutter. Efter dehydrering i alkohol med stigende koncentration fra 70%-99% blev snittene monteret med Eukitt. Immunhistokemisk α-synuclein farvningDer anvendtes en ikke publiceret metode udviklet i samarbejde med medicinalfirmaet Lundbeck. Farvningen foregik således: Snittene blev demaskeret i mikrobølgeovn i 0,01 M natriumcitrat-buffer pH 6,0 i 2x5 minutter og afkølet i 20 minutter i bufferen. Snittene blev så skyllet i 5 minutter i PBS-buffer og der blev blokeret for endogen peroxidase aktivitet med 3% H2O2 i 10 minutter og skyllet i skylle-buffer i 3x5 minutter. Uspecifik baggrundsfarvning blev blokeret med 1% bovint serum albumin (BSA)/PBS i 20 minutter. Det primære α-synuclein antistof blev fortyndet 1:2000 i 1% BSA/PBS og snittene inkuberedes heri natten over ved 4°C. Snittene blev så skyllet i 3x5 minutter i skylle-buffer og inkuberet med EnVision+™ polyklonalt i 30 minutter ved stuetemperatur. Derefter blev der skyllet igen i 3x5 minutter i skylle-buffer og fremkaldt i DAB+ (3,3-diaminobenzidine) i 15 minutter Overskydende DAB+ blev fjernet i rindende vand og snittene blev kernefarvet med Mayers hæmatoxylin i 1 minut efterfulgt af blåning i rindende vand i 5 minutter. Til sidst blev snittene dehydreret i alkohol med stigende koncentration fra 70%-99% og monteret med Eukitt. 4.7 Anvendte kemikalier til doseringManganDer blev brugt to forskellige mangansalte til mangandosering: Manganklorid: Der anvendtes manganklorid-tetrahydrat, MnCl2 x 4H2O (Sigma, M 3634) med renhed: >99%. Molvægten var 197,9 g/mol ogCAS No. er 13446-34-9. Mangandioxid, MnO2: Dette har molvægten 86,94 g/mol og CAS No. 1313-13-9. Til de indledende doseringer anvendtes en kommercielt tilgængelig, grovkornet præparation (Sigma M3138). Til specieringsundersøgelsen anvendtes en fintkornet præparation doneret af Sedema-division of Sadacem S.A., Belgien. Dette produkt havde en gennemsnitlige partikelstørrelse på 4,791±4,523µm med en median størrelse på 3,583µm. Renheden var >99%. 6-hydroxydopaminModelstoffet 6-hydroxydopamin (6-OHDA) var hjemkøbt og doseret af NeuroSearch. Renheden var ≥99% og CAS No. er 5720-26-3 PesticiderChlorpyrifos. Der blev anvendt et ultrarent product for at sikre, at effekter skyldtes chlorpyrifos per se. Stoffet blev leveret af ChemService Inc., katalognummer PS-674. Renheden var 99,5%. Chlorpyrifos’ bruttoformel er C9H11Cl3NO3PS. Molvægten er 350,59 g/mol og CAS No. er 2921-88-2. Nedenfor ses chlorpyrifos’ strukturformel:
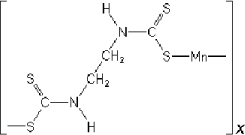
Maneb. Der blev anvendt et produkt så rent som muligt for at sikre, at effekter skyldtes maneb per se. Stoffet blev leveret af ChemService Inc., katalognummer PS-22. Renheden var 95%. Maneb, [1,2-ethylendiylbis[carbamodithioato](2)]mangan, har den monomere bruttoformel C4H6MnN2S4 med molvægten på 265,3 g/mol og CAS No. 12427-38-2 Nedenfor ses manebs strukturformel som polymer, hvor X angiver antallet af monomere.
4.8 Statistiske analyserAlle statistiske analyser blev foretaget med SAS version 6.12 (SAS Institute Inc. Cary, NC). Som generelt niveau for statistisk signifikans anvendtes P < 0,05. Der angives generelt ikke specifikke P-værdier i rapporten. Data undersøgtes for varianshomogenitet og normalfordeling. Var dette opfyldt, udførtes GLM, hvilket ikke specificeres i rapporten. Var der ikke varianshomogenitet eller normalfordeling udførtes Kruskal-Wallis test, hvilket bliver specificeret under pågældende tabel eller figur.
|