Statistisk analyse og biologisk tolkning af toksicitetsdata
9 Eksempler på dosis-respons problemstillinger
Dette afsnit giver nogle eksempler på analyser af dosis-responseksperimenter, der indeholder en række af de problemstillinger, som er nævnt i kapitel 4-8. Som tidligere nævnt kan valget af regressionsmodel bygge på kendskab til, hvorledes virkningsmekanismen er for pågældende stof, men ofte er det erfaringerne fra tidligere eksperimenter, der bestemmer regressionsmodellens form og beliggenhed. Problemstillingerne i forhold til dataanalyse er ofte affødt af, hvilket testsystem og hvilken organisme man benytter, og sidst men ikke mindst hvilken responsvariabel man vælger at måle. Inden for en og samme organisme kan valg af responsvariabel have særdeles stor betydning for, hvilken dosis-responsmodel der bør benyttes.
9.1 Øvre og nedre asymptoter
9.1.1 Problemstilling
For de fleste responsvariable ligger grænseværdierne for øvre og nedre grænse i et givet interval, som er afgrænset nedad af dosis 0 og opad af en passende høj dosering. Mens respons ved dosis 0 antager en ”naturlig” grænse, der kan være maksimum eller minimum afhængig af valget af respons, er det straks vanskeligere at vurdere asymptotiske grænser, når dosis går mod uendelig. Årsagerne kan være mange, f.eks. at det valgte doseringsinterval ikke er tilstrækkeligt til at beskrive hele kurveforløbet fra ingen virkning ved små doseringer til stor virkning ved store doseringer. Der kan også være problemer med opløselighed af teststoffet. Forskellen på øvre og nedre grænse kan ligeledes være meget påvirket af, hvor lang tid der går fra organismen bliver eksponeret for stoffet, og indtil man måler virkningen. Det er faktisk en problemstilling, som kun kan løses ved at kende hastigheden for udvikling af symptomer og påvirkning af det målte respons.
Manglende værdier især ved store doseringer for en monotont aftagende funktion kan medføre, at der ikke er nogen veldefineret nedre grænse, og at man derfor kan få urealistiske, negative nedre grænser for den estimerede dosis-responskurven.
9.1.2 Datakilde 1 (bioassay med blandet bakteriekulturer)
Nedenstående data stammer fra et større blandingsforsøg, hvor effekter af antibiotika undersøges overfor en blandet bakteriekultur af aktiv-slambakterier (Christensen et al, 2006). Forsøget er udført således, at der for hvert dosis-responsforløb er syv koncentrationer uden gentagelser og otte gentagelser for den ubehandlede kontrol. Vi betragter dosis-responsforløbet, hvor dosis er erytromycin (mg/L), og endpoint er den relative vækstrate (h-1) af biomasse i forhold til den ubehandlede kontrolgruppe, målt 4 timer efter eksponering vha. turbiditet med et spektrofotometer ved 530nm. Forsøget er udført efter ISO 15222 (ISO 15522 1999).
Som det fremgår af Figur 9.1, er der ikke data til at beskrive den nedre grænse ved høje doseringer. Ud fra biologiske betragtninger vil man forvente, at vækstraten vil falde til omkring 0 ved meget høje doseringer. Imidlertid viser en tilpasning af den log-logistiske model med såvel fri øvre som nedre grænse en anelse mere præcis beskrivelse af data end en model med en fastsat nedre grænse på 0 (vurderet ud fra Figur 9.1). Parametrene er vist i Tabel 9.1.
Tabel 9.1. Parameterestimater for den log-logistiske model med fire og tre parametre (Ligning (2.1a) og (2.1b)).
| Parameter | Estimat | Standardfejl |
| Fire-parameter- model | ||
| b | 0,937 | 0,068 |
| c | 0,223 | 0,020 |
| d | 0,650 | 0,003 |
| ED50 | 11,600 | 1,610 |
| Tre-parameter-model | ||
| b | 0,631 | 0,035 |
| d | 0,652 | 0,005 |
| ED50 | 43,896 | 3,762 |
Som det fremgår af Tabel 9.1 og Figur 9.1 er der (ikke overraskende!) store forskelle på ED50, alt efter om man benytter en model med såvel fri øvre som nedre grænse eller kun med fri øvre grænse (fire eller tre parametre i den log-logistiske model). I Tabel 9.1 kan man tydeligt se, at ED50 falder med omkring en faktor 3 ved at gå fra en fire-parameter-model til en tre-parameter-model.
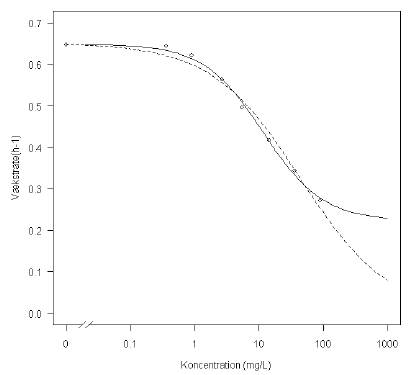
Figur 9.1. Sammenligning mellem en fire-parameter log-logistisk model (fuldt optrukken linje) og en tre-parameter log-logistisk model (stiplet linje).
Som nævnt tidligere er der ingen biologiske belæg for at der skulle være en nedre grænse på kurven som er forskellig fra nul. Der biologisk set gode grunde til at tilpasse med en tre-parameter log-logistisk model, da der i forsøg med andre stoffer er fundet fuld hæmning. I nærværende forsøg har det ikke været muligt at teste højere koncentration af stoffet pga. stoffests opløselighed. Lack-of-fit-testet beskrevet i afsnit 7 vil dog i det her tilfælde bekræfte, at tre-parameter-modellen er acceptabel, så denne model vil være den simpleste biologisk og statistisk acceptable model.
9.1.3 Datakilde 2 (pesticider og brystcancerceller)
Det næste eksempel er fra et forsøg med flere dosis-responskurver og fokuserer på, hvorledes man kan slå parametre for nedre og øvre grænse sammen. Pesticiderne DDT, endosulfan (Endo) og fenarimol (Fen) er undersøgt for østrogene effekter in vitro i humane brystcancerceller (Vinggaard, 2003). Forsøgets formål var at undersøge toksiciteten af de tre pesticider, og derfor er den relative styrke mellem dem et godt mål for deres rangorden rent toksikologisk. Proliferation af cellerne er helt afhængig af tilstedeværelsen af østrogener. Cellerne ’udsultes’ for østrogener, hvorefter et teststof tilsættes og det undersøges om celleproliferationen øges med koncentrationen af teststoffet. Endpoint er en absorbansmåling (IRPE), der indirekte er et udtryk for antal celler i brøndene. Biomassen er normaliseret vha. kontrolgruppen.
Tabel 9.2 og Figur 9.2 viser simultan tilpasning af en fire-parameter log-logistisk model til data. Det ses, at stofferne har forskellig maksimaleffekt (forskellig nedre grænse). Som det fremgår visuelt af Figur 9.2 har de tre stoffer fælles øvre grænse, fordi de allerede er skaleret mod kontrollen. Lack-of-fit-testet for modellen er ikke-signifikant.
Tabel 9.2. Parameterestimater baseret på en simultan tilpasning af en fire-parameter log-logistisk model til data (Ligning 2.1a). De tre kurver antages at have samme øvre grænse, men forskellige nedre grænser.
| Parameter | Estimat | Standardfejl |
| b DDT | 1,645 | 0,099 |
| b Endo | 2,685 | 0,251 |
| b Fen | 3,084 | 0,384 |
| c DDT | 11,631 | 1,489 |
| c Endo | 22,106 | 2,369 |
| c Fen | 41,915 | 2,901 |
| d | 99,853 | 0,462 |
| ED50 DDT | 1,298 | 0,052 |
| ED50 Endo | 5,387 | 0,186 |
| ED50 Fen | 7,486 | 0,393 |
Umiddelbart ser det ikke ud til i Figur 9.2, at den nedre grænse for Endo og Fen er veldefineret ud fra data. Modellen, hvor det antages, at der er fælles øvre og nedre grænse for de tre pesticider, giver imidlertid en signifikant dårligere beskrivelse af data. Og i Figur 9.2 (røde linjer) kan man se hvorfor: Der er systematiske afvigelser mellem de estimerede kurver under den model og så data for DDT og især Endo.
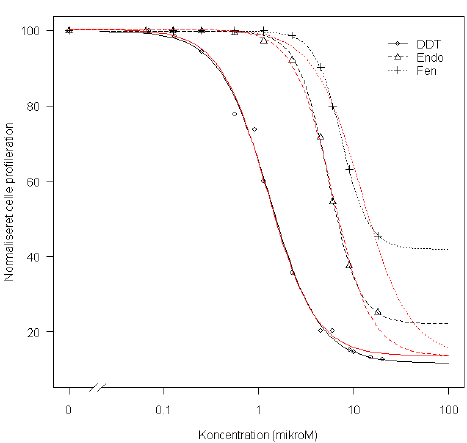
Figur 9.2. Estimeret fire-parameter log-logistisk dosis-responskurve for brystcancercellers proliferation for tre forskellige pesticider. De sorte linjer svarer til en model med fælles øvre grænse og pesticid-specifik nedre grænse. De røde linjer er for en model med fælles øvre og nedre grænse for de tre pesticider.
9.1.4 Afsluttende bemærkninger
Som det fremgår af de eksempler, er spørgsmålet om øvre og nedre grænser for kurver særdeles relevant, fordi de alt andet lige har stor indflydelse på de estimerede ED-værdier. Der er i tidens løb lavet mange beregninger, for at undgå netop problemet med forskellige øvre og nedre grænser (et eksempel er at relativere responsen til et kontrolniveau). Derfor er det vigtig at overveje, om der er biologiske argumenter, der taler for at fastsætte den nedre eller øvre grænse. Desuden kunne man overveje om ED-værdier skal sammenlignes på et absolut eller relativt (eventuelt indskrænket) responsniveau (Ritz et al., 2006).
9.2 Forskellige endpoints
9.2.1 Problemstilling
Ofte vil man a priori have defineret et eller flere endpoints, som skal danne baggrund for en vurdering af toksiciteten. Et givet stof kan have virkninger på mere end en stofskifteproces i en plante eller et dyr. Selv om man kender virkningsstedet for et stof, kan afledte effekter være af stor betydning for at vurdere stoffers toksicitet på en organisme. Ofte vil man derfor i dosis-responsforsøg være interesseret i at finde det endpoint, som er mest følsomt, og derfor vil man gerne måle mere end et endpoint.
9.2.2 Datakilde 3
Formålet med dette dosis-responsforsøg var at bestemme det endpoint, der er mest følsomt over for et fungicid, som mistænkes for at have hormonforstyrrende virkning. I dosis-responsforsøg med fungicidet vinclozolin i kastrerede testosteron-behandlede rotter, blev der målt 2 endpoints: 1) prostatavægt og 2) koncentration af luteiniserende hormon (LH) i serum. Begge endpoints giver udslag ved ’antiandrogene effekter’ og desuden er de to endpoints målt på de samme dyr. Testosteron er nødvendigt for vækst af prostata, og et antiandrogent stof som vinclozolin blokerer for testosterons effekt på prostata, idet stoffet virker som antagonist for androgen-receptoren i prostata. Sekretionen af LH fra hypofysen regulerer testosteronproduktionen i testiklerne og under fysiologiske forhold er der en negativ feedback, således at LH sekretionen øges ved for lav koncentration af testosteron og omvendt ved for højt testosteronniveau. Et antiandrogen som vinclozolin blokerer androgen receptoren i hypofysen og blokerer dermed for den negative feedback. Derved forøges LH niveauet i serum (Hass et al, 2006)
I Figur 9.3 og Tabel 9.3 er der henholdsvis en illustration af den estimerede log-logistiske dosis-responsmodel sammen med gennemsnit af de oprindelige data (per dosering) og et sammendrag af parameterestimaterne for de to estimerede dosis-responskurver baseret på 2 separate analyser, en for hvert endpoint. Det var kun nødvendigt at benytte en Box-Cox-transformation til at opnå varianshomogenitet i forbindelse med LH serum responset. Lack-of-fit-testet var ikke-signifikant for begge endpoints, så den log-logistiske model giver en tilfredsstillende beskrivelse af data for de 2 endpoints.
Tabel 9.3. Sammendrag af anvendte log-logistiske regressionsmodeller for de to endpoints, prostatavægt (Ligning 2.1b) og LH serum (Ligning 2.1a).
| Parameter | Estimat | Standardfejl |
| Prostatavægt | ||
| b | 0,979 | 0,108 |
| d | 0,101 | 0,004 |
| ED50 | 52,155 | 6,389 |
| LH-serum | ||
| b | -3,843 | 3,714 |
| c | 2,481 | 1,351 |
| d | 12,306 | 1,673 |
| ED50 | 20,417 | 6,944 |
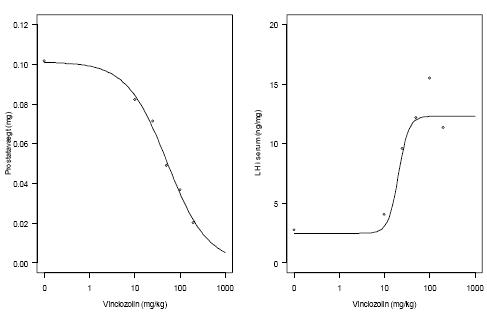
Figur 9.3. Estimerede log-logistiske dosis-responsmodeller for hver af de 2 endpoints, prostatavægt og koncentration af LH-serum.
Som det fremgår af Tabel 9.3 er ED50 for LH-serum på 20,4 mg pr kg således knap det halve af ED-værdien for prostatavægten. Det mest følsomme endpoint er således LH-serum på ED50-niveau.
9.2.3 Datakilde 4
I et andet forøg med bygplanter i vandkultur, målte man forskellige endpoints med stigende koncentrationer af pendimethalin i klimakammerforsøg (Cedergreen, 2008). I dosis-responsforsøget indgik i alt 16 koncentrationer i µg/L, som er usædvanlig mange koncentrationer for den type forsøg.
Tabel 9.4 og Figur 9.4 viser estimerede dosis-responskurver baseret på en tre-parameter log-logistisk model anvendt på hvert endpoint separat. En Box-Cox-transformation for at stabilisere variansen var kun i et tilfælde nødvendig.
Tabel 9.4. Sammendrag af dosis-responsanalyser (ligning 2.1b) for forskellige endpoints i forsøg med byg i vandkultur med stigende koncentrationer af pendimethalin (µg/L). For strålængde var det nødvendigt at bruge en Box-Cox-transformation (λ =0,6), fordi der var tydelig variansheterogenitet.
| Parameter | Estimat | Standardfejl |
| Bladlængde | ||
| b | 0,708 | 0,074 |
| d | 70,818 | 1,361 |
| ED50 | 105,415 | 13,970 |
| Strålængde | ||
| b | 0,659 | 0,084 |
| d | 13,948 | 0,365 |
| ED50 | 80,273 | 15,480 |
| Tørvægt | ||
| b | 0,769 | 0,114 |
| d | 0,217 | 0,007 |
| ED50 | 53,819 | 11,027 |
| Relativ vækstrate | ||
| b | 0,888 | 0,132 |
| d | 0,152 | 0,003 |
| ED50 | 116,046 | 18,365 |
Tabel 9.4 viser parameterestimater for de enkelte dosis-responsmodeller. Bladlængde og relativ vækstrate havde nogenlunde samme ED50, mens strålængde og tørvægt havde noget mindre ED50 værdier. Den følsomste responsvariable var tørvægt, som lå på ca. det halve af ED50 for bladlængde og vækstrate.
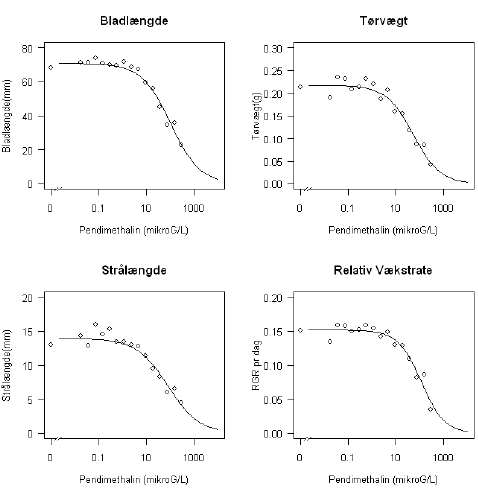
Figur 9.4. Estimerede dosis-responskurver for den tre-parameter log-logistiske model anvendt på fire endpoints.
9.2.4 Afsluttende bemærkninger
Fra et biologisk synspunkt viser især det sidste eksempel, hvor vigtigt det er at bruge biologisk viden til at reducere antallet af parametre for at få et toksicitetsestimat med en rimelig præcision.
9.3 Modificerede respons kurver
Forudsætningen for at benytte de dosis-responsmodeller, der er blevet brugt indtil nu, har været, at responsen enten er monotont aftagende eller stigende, I visse situationer kan man komme ud for, at denne forudsætning ikke er opfyldt (Figur 9.5). Der kan være flere grunde til dette, hvoraf nogle kan forklares ud fra samspillet mellem forskellige organismer, som påvirker hinanden i selve forsøget, eller det kan skyldes, at teststoffet ved meget lave doseringer påvirker organismen med andre virkningsmekanismer end den primære. Uanset årsagen kan man konstatere en stimulering, og ved meget små doseringer kan denne stimulering ikke umiddelbart forklares ud fra stoffets kendte virkning. Fænomenet har været kendt længe og kaldes hormesis eller et to-faset forløb, hvor kurverne har såvel en stigende som en faldende fase (Pestemer and Günther 1993; Cedergreen et al., 2005).
Klassiske eksempler kan findes indenfor herbicider. Herbicider er fra producentens side designet til at bekæmpe uønsket plantevækst, og herbicidernes selektive brug i afgrøder er derfor et spørgsmål om dosis.
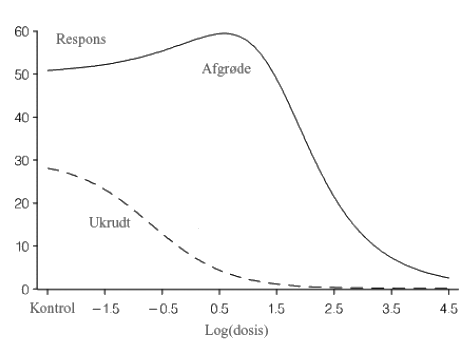
Figur 9.5. Dosis-respons for afgrøde og ukrudt som vokser sammen under påvirkning af voksende koncentrationer af et herbicid.
Stigningen i afgrøden i Figur 9.5 behøver ikke nødvendigvis at skyldes herbicidets virkning på afgrøden, Årsagen er snarere, at ukrudtet er mere følsomt overfor herbicidet end afgrøden er, hvorved konkurrencetrykket fra ukrudtet på afgrødeplanten mindskes med stigende dosis indtil også afgrødeplantens vækst påvirkes ved høje doseringer,
Mens sammenhængen i Figur 9.5 beskriver den ønskede virkning af et herbicid på afgrøde og ukrudt og derfor fra et bekæmpelsesmæssigt synspunkt er indlysende, så er der andre eksempler, der er knapt så lette at tolke. I et dosis-responsforsøg med regnorme fik man en tydelig hormesis-virkning ved stigende doser af et xenobiotika uden at kunne forklare det umiddelbart. Det viste sig efterfølgende, at en parasit i regnormen var mere følsom over for det pågældende xenobiotika end selve regnormen, Dermed fik regnormen en fordel ved små doser af det pågældende xenobiotika (Cedergreen 2007, personlig kommunikation). Et andet eksempel (med en binomialfordelt respons) stødte vi allerede på i afsnit 6.
Uanset om man har en forklaring på fænomenet eller ej vil en ikke-monoton faldende eller stigende dosis-responskurve kræve passende dosis-responssmodeller, der kan beskrive et sådant forløb. Der findes en række hormesis-modeller, som man kan bruge i disse tilfælde: Brain & Cousens, 1989; Schabenberger & Birch 2001 samt Cedergreen et al., 2005. I Figur 9.6 har vi sammenlignet forskellige modeller til at ”fange” hormesis. Det er tydeligt, at der er store forskelle på, hvorledes de enkelte kurver beskriver hormesis.
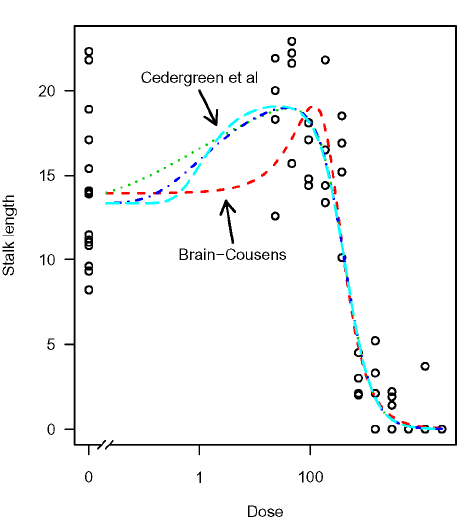
Figur 9.6. Illustration af hormesis for strålængde i byg ved doseringer af metsulfuron-methyl. Kurverne er forskellige modifikationer af den log-logistisk model (Brain-Cousens-modellen samt modellerne baseret på Ligning (2.4) og (2.5) med a lig 0,25 og 0,50).
9.3.1 Datakilde 5
I et dosis-responsforsøg med byg og metsulfuron-methyl hvor det ikke var strålængden, men den relative vækstrate af byg, der var respons, observerede man også hormesis (Figur 9.7 og Tabel 9.5). Som det fremgår af Figur 9.5 (øverst til venstre) er den fire-parameter log-logistiske model ikke så god til at beskrive data. Det ses også i Tabel 9.5, hvor der er et signifikant lack-of-fit-test. Yderligere kan man i Figur 9.7 se, at det tilhørende residualplot (nederst til venstre) viser systematisk afvigelse ved lave doseringer: den log-logistiske kurve underestimere responsen ved lave doseringer Ved at betragte en af de 3 modeller, bliver lack-of-fit-testet stadig signifikant for de 2 første hormesis-modeller, men ikke for den sidste (Tabel 9.5). I Figur 9.7 ses det tydeligt på fordeling af residualer, at fordelingen er lidt bedre end f.eks. for den log-logistiske kurve. Forskellen på de tre hormesis-modeller er, at α er fastholdt på tre forskellige værdier (nemlig 0,25; 0,50 og 1), som erfaringsmæssig giver biologisk mening, Dette gøres, fordi der sjældent er data nok på den stigende del af kurven til at kunne estimere denne parameter statistisk.
Tabel 9,5, Sammendrag af anvendte dosis-responsmodeller for den relative vækstrate (RGR) med den log-logistiske model (Ligning (2.1)) og tre forskellige modifikationer af en hormesis model (Ligning (2.5) med α lig 0,25, 0,50 og 1) for den relative vækstrate af byg ved stigende koncentrationer af metsulfuron-methyl Box-Cox transformation blev benyttet (λ=0,3).
| Parameter | Estimat | Stand. Fejl |
| Fire-parameter log-logistisk | ||
| b | 0,797 | 0,179 |
| c | 0,071 | 0,007 |
| d | 0,151 | 0,003 |
| ED50 | 18,651 | 8,382 |
| Lack-of-fit-test: p= 0,0225 | ||
| Hormesis med α=0,25 | ||
| b | 0,828 | 0,220 |
| c | 0,068 | 0,009 |
| d | 0,152 | 0,003 |
| e | 38,090 | 40,869 |
| f | -0,016 | 0,019 |
| Lack-of-fit-test: p = 0,0174 | ||
| Hormesis med α=0,50 | ||
| b | 0,768 | 0,137 |
| c | 0,074 | 0,006 |
| d | 0,149 | 0,004 |
| e | 4,784 | 5,524 |
| f | 0,067 | 0,079 |
| Lack-of-fit-test p= 0,0213 | ||
| Hormesis med α=1 | ||
| b | 0,534 | 0,087 |
| c | 0,066 | 0,008 |
| d | 0,142 | 0,004 |
| e | 1,413 | 0,983 |
| f | 0,216 | 0,083 |
| Lack-of-fit-test: p= 0,2521 |
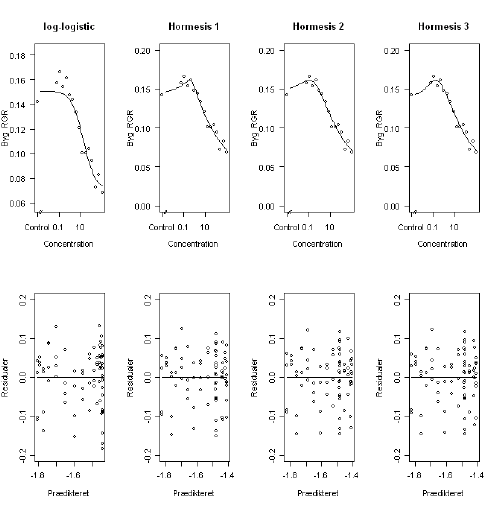
Figur 9.7. Estimerede dosis-responskurver for den relative vækstrate (RGR) og residualplot fra forskellige modeller i Tabel 2.1.
9.3.2 Afsluttende bemærkninger
Som det fremgår af ovenstående er det ikke altid, man kan forvente monotont stigende eller faldende dosis-responskurver. I sådanne tilfælde er det nødvendigt at bruge mere specialiserede dosis-responsmodeller, som kan tage hensyn til det to-fasede kurveforløb.
Version 1.0 Oktober 2008, © Miljøstyrelsen.