[Forside] [Indhold] [Forrige] [Næste]
Blågrønalgetoksiner i bade- og drikkevand
1. Litteraturgennemgang af blågrønalgetoksiner
1 Litteraturgennemgang af blågrønalgetoksiner
1.1 Effekter af blågrønalgetoksiner
1.2 Hvilke toksiner producerer blågrønalger?
1.2.1 Levertoksiner
1.2.2 Nervetoksiner
1.2.3 Cyto og endotoksiner
1.3 Nedbrydning af blågrønalgetoksiner
1.3.1 Kemisk stabilitet
1.3.2 Biologisk nedbrydning
1.3.3 Fjernelse af blågrønalger og toksiner ved
vandrensning
1.4 Detektion af blågrønalgetoksiner
1.4.1 Bioassays
1.4.2 ELISA og enzyminhiberingsassays
1.4.3 Kromatografi
Siden Francis (1878) gav den første beskrivelse af toksiske effekter
af en blågrønalgeopblomstring, er der kommet talrige rapporter om forgiftninger af
mennesker, husdyr og vilde dyr, som har drukket af vand med store koncentrationer af
blågrønalger (se f.eks. Schwimmer & Schwimmer 1968). Dette har i kombination med
stigende behov for udnyttelse af vandressourcer medført øget opmærksomhed omkring
forekomsten af og toksinproduktionen hos blågrønalger. I en række lande er der
foretaget undersøgelser, som viser, at blågrønalgeopblomstringer meget hyppigt
producerer toksiner (figur 1-1, bilag 1-1). Den her beskrevne undersøgelse bekræfter, at
dette også er tilfældet i Danmark.
USA |
Japan |
Holland |
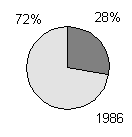 |
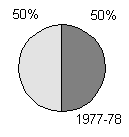 |
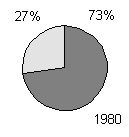 |
England |
Tyskland |
Norge/Sverige/Finland |
 |
 |
 |
England |
Sverige |
Kina |
 |
 |
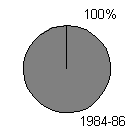 |
Danmark |
||
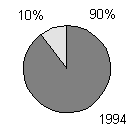 |
Figur 1-1
Undersøgelser af forekomst af toksiske blågrønalger. Mørk grå: andelen af undersøgte lokaliteter, hvor der forekom toksiske blågrønalger. Lys grå: andelen af lokaliteter uden toksiske blågrønalger. Resultaterne fra Danmark stammer fra den her beskrevne undersøgelse.
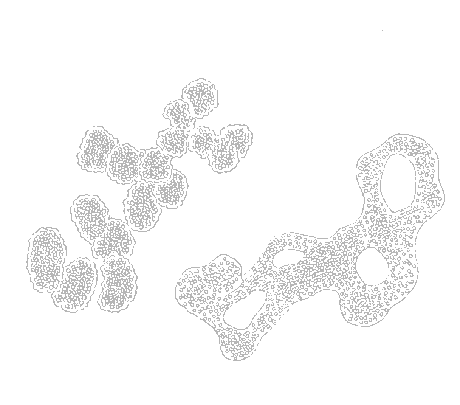
Antallet af blågrønalger, som vides at kunne producere toksiner, stiger hvert år. I 1993 sammenstillede Skulberg et al. (1993) den daværende viden, og listede 42 potentielt toksinproducerende arter (se bilag 1-2). Af de 42 er 10 encellede organismer, der oftest er samlet i kolonier holdt sammen af gelé (figur 1-2, a), mens de resterende er flercellede tråde (figur 1-2, b).
(a)
(b)

Figur 1-2
Microcystis arter (a) og Anabaena arter (b). Microcystis og Anabaena er to af de
almindeligst forekommende toksinproducerende blågrønalgeslægter i danske søer.
1.1 Effekter af blågrønalgetoksiner
Forgiftningstilfælde som følge af blågrønalger er kendt i hele verden, og
forgiftninger af mennesker og kvæg er beskrevet allerede i forrige århundrede (Farre
1844 i Schwimmer & Schwimmer 1968, Francis 1878). I Danmark er der gennem de sidste 15
år jævnligt observeret ildebefindende hos kvæg (krampe og kalvekastning) og dødsfald
hos hunde samt fisk og fugle, der har drukket søvand med opblomstringer af blågrønalger
(Damsø et al. 1994).
I modsætning til f.eks. Norge og Sverige har vi i Danmark endnu ikke veldokumenterede
rapporter om effekter af blågrønalger på mennesker. En væsentlig årsag til dette kan
være manglende opmærksomhed og manglende viden. Koblingen mellem sygdomssymptomer og
blågrønalger må oftest ske indirekte ved at kombinere viden om forekomst af
blågrønalger, forekomst af toksiner, effekt af toksiner og sygdomsbillede. Hyppigt
inddrages blågrønalger først som en mulig årsag, når alle andre forklaringer er
udelukket.
Badevand
Rødme og udslet
Hudinflammationer (rødme og udslet) hos mennesker, der har badet i søer med
blågrønalgeopblomstringer, er almindelig kendt i udlandet (Annadotter 1993, Carmichael
et al. 1985, Codd & Bell 1985). I Sverige er der i en række tilfælde observeret
høfebersymptomer som snue, rindende øjne og astma hos badende, der har været i kontakt
med blågrønalgeopblomstringer (Heise 1949, Heise 1951, Annadotter 1993). Det er
usikkert, om der er tale om en direkte toksisk effekt, eller om inflammationerne og
høfeberen skyldes allergi mod algerne.
Tabel 1-1
Typiske symptomer ved kontakt med/indtagelse af patogene blågrønalger |
|
hudirritationer |
rødme, kløe |
lunge inflammation |
snue, rindende øjne, astma |
badfeber |
feber (ligner influenza) |
mavetarmkatar |
mavesmerter/krampe, diarré, opkastning, feber, hovedpine |
hepatitis |
appetitløshed, mavesmerter, hovedpine, feber, øm og forstørret lever |
cancer |
øget risiko for levercancer |
Mavetarmkatar
Normalt vil mennesker ikke, som f.eks. kvæg og hunde, indtage så store mængder
søvand, at det får lethale effekter. Der er imidlertid flere eksempler på, at mennesker
er blevet dårlige efter at have drukket mindre mængder søvand med blågrønalger. I
Canada blev 11 børn og et par voksne syge efter trods advarsler i aviser og TV at have
badet i søer med kraftige algeopblomstringer (Dillenberg 1960). Symptomerne var
mavesmerter, diarré, opkastninger, feber og hovedpine. I faeces fra de syge blev der
fundet celler af blågrønalger, mens der ikke var spor af patogene bakterier eller virus.
I 1989 blev engelske rekrutter sendt på øvelse på en sø med opblomstring af
blågrønalgen Microcystis aeruginosa, og 10 af rekrutterne, der drak søvand, fik
bagefter pneumonia (lungeinflammation) foruden feber, mavekrampe, opkastning m.m. (Turner
et al. 1990). Heller ikke i dette tilfælde blev der fundet patogene bakterier eller
virus, der kunne forklare sygdomsudbrudene.
Lungeinflammation
I Danmark er kraftige blågrønalgeopblomstringer almindelige om sommeren i mange af
vore badevandssøer, som f.eks. søerne i Mølleåsystemet og Gudenåsystemet, og
advarsler mod badning forhindrer normalt ikke folk i at bade i søerne. Når der ikke er
rapporteret patogene effekter skyldes det sandsynligvis, at symptomerne ligner almindelig
bakterie/virus infektion, samt at de normalt forsvinder hurtigt (indenfor 1-2 dage) og kun
rammer særligt følsomme personer. I mange tilfælde vil folk derfor ikke søge læge, og
hvis de gør, vil lægen ikke sætte symptomerne i forbindelse med forekomst af
blågrønalger.
Drikkevand
En hyppig årsag til blågrønalgeforgiftninger er indtagelse af toksiner med
drikkevandet. I Danmark bruger vi kun i begrænset omfang overfladevand fra søer til
drikkevand. Således udgør søvand på årsbasis ca. 4-18% af drikkevandet. Indvindingen
foregår hovedsageligt i hovedstadsområdet, og overfladevandet opblandes med grundvand,
så det aldrig udgør over 50%. Til sammenligning kommer 75% af den svenske vandforsyning
fra søer (Annadotter 1993), og i Finland er andelen 48% (Lepistö et al. 1994).
Sandsynligheden for toksiske effekter på mennesker er derfor langt mindre i Danmark.
I lande, hvor drikkevandet er baseret på ferskvandsindvinding, kan der opstår epidemier,
hvor større befolkningsgrupper rammes (se tabel 1-2). I Australien oplevede man i 1991
den hidtil største blågrønalge"katastrofe" i verden. Blågrønalgen Anabaena
circinalis dannede en kraftig opblomstring over en mere end 225 km lang strækning af
Darling flodsystemet, der bruges til drikkevand. Algen producerede både lever og
nervetoksiner, og indtagelse af algeholdigt vand medførte at folk blev syge, og kvæg,
får og hunde døde. Området omkring floden blev erklæret for katastrofeområde, og
militæret blev indsat for at bringe rent vand ud.
På Palm Island blev 148 mennesker syge efter at have drukket vand, der stammede fra et
vandreservoir domineret af Cylindrospermopsis raciborskii. Der var få dage forinden
blevet tilsat kobbersulfat til søen for at regulere en kraftig algeopblomstring. Ved
tilsætning af kobbersulfat dør algerne, og eventuelle toksiner frigives (Hawkins et al.
1995).
Mavetarm katar /Barcoo fever
En almindelig følge af blågrønalgeforgiftning efter indtagelse af forurenet
drikkevand er mavetarmkatar (Annadotter 1993, Tabel 1-2). I Australien er der desuden
konstateret sygdomstilfælde med effekter på leveren hos mennesker, der får drikkevand
fra damme/søer med masseopblomstringer af blågrønalger (Bourke et al. 1983, Falconer et
al. 1983a). Ligeledes fra Australien er det foreslået, at en sygdom beskrevet som
"Barcoo fever" kan skyldes indtagelse af blågrønalgetoksiner (Hayman 1992).
Sygdommen er karakteriseret ved feber, hovedpine, kvalme, opkastninger og kraftig diarré;
symptomer som hyppigt er rapporteret i forbindelse med indtagelse af vand med
blågrønalger (Schwimmer & Schwimmer 1968, Billings 1981, Turner et al. 1990,
Annadotter 1993, Saadi & Cameron 1993).
Tabel 1-2
Sygdomstilfælde forårsaget af blågrønalger i drikkevand forskellige steder i verden
| Sygdomstilfælde forårsaget af blågrønalger i drikkevand forskellige steder i verden | ||||
| Sygdom | Antal sygdomstilfælde | Blågrønalge involveret | Årstal | Sted |
| Mavetarmkatar | ? | Uidentificeret | 1930 | Washington D.C. |
| (Bourke & Hawes 1983) | ||||
| Mavetarmkatar | 8000-10000 | Uidentificeret | 1930 | Charleston,Vest Virginia |
| (Bourke & Hawes 1983) | ||||
| Mavetarmkatar | ? | Anabaena, Microcystis, Aphanizomenon | 1960 | Saskatchewan, Canada |
| (Dillenberg & Dehnel 1960) | ||||
| Mavetarmkatar | ? | Microcystis aeruginosa | 1966 | Harare, Zimbabwe |
| (Zilberg 1966) | ||||
| Mavetarmkatar | 5000-6000 | Uidentificeret | 1940-1941 | Militærbase, Philippinerne |
| 1963-1969 | (Dean & Jones 1972) | |||
| Mavetarmkatar | ? | Schizothrix calcicola | 1975 | Sewickley, Pennsylvania |
| (Bourke & Hawes 1983) | ||||
| Hepatitis | 148 | Cylindrospermopsis raciborskii | 1979 | Palm Islands, Australien |
| (Hawkins et al. 1985) | ||||
| Mavetarmkatar | 102 | Anabaena, Aphanizomenon, | 1991-1992 | Murray River, Australien |
| Dermatitis | 82 | Planktothrix | (Elsaadi et al. 1995) | |
| Mavetarmkatar | 121 | Planktothrix agardii | 1994 | Vombsjön, Sverige |
| (Annadotter, pers. comm. 1995) | ||||
Badfeber
Den såkaldte badfeber er et andet sygdomsbillede, som menes at skyldes
blågrønalgetoksiner i hanevand. De ramte personer får influenzalignende symptomer med
feber få timer efter, at de har været i bad. I Sverige og Finland er der gennem de
sidste 20 år konstateret flere epidemier af badfeber (Annadotter 1993). Rylander et al.
(1989) konkluderer, at epidemierne skyldes indånding af endotoksiner, og at disse
toksiner stammer fra blågrønalger, fordi der er en tæt sammenhæng mellem forekomsten
af epidemier og opblomstringer af disse alger.
Dødsfald
I enkelte tilælde har blågrønalgetoksiner haft markante lethale effekter på
mennesker. I foråret 1996 døde 55 patienter efter at have været i dialyse på et
dialysecenter i Caruarce, Brasilien. 44 af disse patienter døde af
leverproblemer/leverblødning. Der kunne detekteres microcystiner i serum fra patienter i
live samt i levervæv fra de afdøde patienter. Dialysecentret modtog vand fra et
reservoir, hvor der var opblomstring af blågrønalger, og i centrets aktive kulfiltre til
vandrensning måltes høje koncentrationer af micrycystiner (µgmg pr. gram
filtermateriale) (Carmichael 1996).
Cancer
Nye forskningsresultater indikerer, at levertoksiner fra blågrønalger fremmer
cancer (Nishiwaki-Matsushima et al. 1992, Falconer & Humpage 1996), og nogle toksiner
er direkte carcinogene (Ohta et al. 1994). NishiwakiMatsushima et al. (1992) foreslår, at
et markant højere antal tilfælde af levercancer hos befolkningsgrupper i Kina, som får
drikkevand fra smådamme, i forhold til grupper som får drikkevand fra brønde (Yu 1989),
kan skyldes tilstedeværelsen af microcystinproducerende Microcystis i dammene. En
efterfølgende undersøgelse (Ueno et al. 1996) viste, at vandprøver fra damme eller
floder oftere indeholdt levertoksiner end vand fra brønde. Desuden var
toksinkoncentrationen højere i vand fra damme og floder. Også andre typer af
blågrønalgetoksiner har cancerfremmende effekter. Den marine art Lyngbya majuscula
producerer aplysiatoxin og lyngbyatoxin-A, som udover at give irritation af hud og
slimhinder i mund og tarmsystem, kan fremme dannelsen af hudtumor.
Blågrønalgetoksiner har således ikke kun akutte effekter. Samlet giver de konstaterede
sygdomstilfælde med forbindelse til blågrønalgeopblomstringer grund til stor
forsigtighed, både når blågrønalgeholdigt vand anvendes til drikkevand og til
rekreative formål.
1.2 Hvilke toksiner producerer blågrønalger?
Levertoksiner |
For at undersøge om blågrønalgers toksiner er årsag til sygdomstilfældene, er det
nødvendigt at vide, hvilke toksiner blågrønalger kan danne, hvordan de skal detekteres,
og hvilke effekter de har. Siden 1972, hvor den kemiske struktur af det første
blågrønalgetoksin blev bestemt, er der beskrevet over 50 toksiner, som er særegne for
blågrønalger (Carmichael 1994). Dertil kommer en række toksiner, som også findes i
andre organismegrupper.
Blågrønalger i ferskvand producerer 4 forskellige typer toksiner: levertoksiner,
nervetoksiner, endotoksiner og cytotoksiner, og i det følgende gives en nærmere
beskrivelse af de 4 typer.
1.2.1 Levertoksiner
Levertoksiner hos |
Levertoksiner er de hyppigst rapporterede toksiner hos blågrønalger. I dag kendes 3
forskellige typer levertoksiner: microcystiner, nodulariner og cylindrospermopsin (tabel
1-4).
Effekter
Hos pattedyr er målorganet for levertoksiner (microcystiner og nodulariner) først
og fremmest leveren. Toksinerne bliver sandsynligvis optaget af cellerne via de samme
transportveje som galdesyre (Falconer 1993), og intracellulært medfører de på grund af
deres specifikke hæmning af proteinfosfataserne 1 og 2A, at cytoskelettet ændres og
cellerne deformeres (Eriksson et al. 1990). Deformering af levercellerne medfører
blodtab, og ved kraftig forgiftning kan dette medføre dødsfald i løbet af få timer.
Målorganet for disse toksiner er dog ikke leveren hos alle dyregrupper. Forsøg med
vagtler har vist, at milten hos fugle, som fik injiceret microcystin-RR, forstørredes til
ca. dobbelt størrelse, mens leveren ikke blev påvirket (Takahashi & Kaya 1993).
Udover eventuelle akutte forgiftninger forårsaget af levertoksiner, vækker den hyppige
forekomst af disse toksiner i stigende grad bekymring, da det har vist sig, at de kan
fremme tumordannelse. Øget vækst af levertumorer ved injektion af microcystin-LR er
således vist hos rotter, hvor tumordannelsen var initieret ved injektion af
diethylnitrosamin (Nishiwaki-Matsushima et al. 1992). Tilsvarende resultater er fundet for
nodularin, hvor det desuden blev vist, at dette toksin er et carcinogen (Ohta et al.
1994). Tilsyneladende initierer microcystinerne ikke i sig selv levertumor (Carmichael
1994).
I langtidsforsøg (op til 1 år) med mus, hvis drikkevand bestod af forskellige sublethale
koncentrationer af ekstrakt af toksisk Microcystis aeruginosa, øgedes dødeligheden samt
antallet af leverskader i gruppen, som fik den højeste dosering (Falconer et al. 1988).
Andre forsøg med mus viste, at såfremt tumordannelse initieredes med
dimethylbenzanthracene, fremmede tilsætning af microcystinholdigt Microcystis ekstrakt
til dyrenes drikkevand signifikant væksten af tumorerne (Falconer 1991). Årsagen til den
cancerfremmende virkning af levertoksiner menes at være hæmningen af
proteinfosfataserne, idet disse er vigtige i kontrollen af celledelinger.
Det mest almindeligt forekommende levertoksin, microcystin-LR, kan forårsage DNA-skader i
leveren hos forsøgsdyr (mus) samt i cellekulturer in vitro (Lakshmana Rao &
Bhattacharya 1996).
Microcystiner
Inden den kemiske struktur af de almindeligste levertoksiner, microcystinerne, blev
beskrevet, blev de benævnt:
- "fast death factor" (Bishop et al. 1959)
- microcystin (Konst et al. 1965)
- cyanoginosin (afledt af cyanobacteria og Microcystis aeruginosa) (Boteset al. 1984)
- cyanoviridin (afledt af cyanobacteria og Microcystis viridis) (Kusumi etal. 1987)
- cyanogenosin (forkert stavning af cyanoginosin) (Painuly et al. 1988)
- Microcystistoxin (Runnegar & Falconer 1986).
- Oscillatoriatoxin (Eriksson et al. 1989)
Bishop et al. (1959) angav, at "fast death factor" hos Microcystis aeruginosa
var et peptid, men først i 1984 lykkedes det Botes et al. (1984) at beskrive den kemiske
struktur af cyanoginosin-LA (= microcystin-LA). Stoffet var, ligesom tre andre toksiner
isoleret fra Microcystis aeruginosa (Botes et al. 1982), et cyklisk peptid bestående af
syv aminosyrer. Det viste sig, at forskellen imellem de fire toksiner lå i to
L-aminosyrer, de såkaldt variable aminosyrer. Betegnelsen-LA angiver, at dette toksin
indeholder leucin og alanin som de to variable aminosyrer.
Struktur
I 1988 blev en generel nomenklatur for de levertoksiske heptapeptider fra
blågrønalger foreslået (Carmichael et al. 1988a). Toksinerne er siden blevet betegnet
microcystin efterfulgt af to bogstaver, som angiver de variable aminosyrer. I figur 1-3 er
vist strukturformlen for en række microcystiner. En række forskellige kombinationer af
de variable aminosyrer i microcystin er fundet i såvel naturlige opblomstringer som i
kulturer af blågrønalger. Desuden kendes et stort antal microcystiner, hvor en eller
flere af de øvrige fem aminosyrer er delvist modificeret. Der er således nu beskrevet
over 50 derivater af microcystin (Sivonen 1996).
Toksicitet
Toksiciteten af de forskellige microcystin derivater varierer fra 50 til > 1200
µg pr. kg (udtrykt som LD-50 ved intraperitoneal injektion i mus, hvor LD50 er den dosis,
der slår 50% af forsøgsdyrene ihjel) afhængig af variationerne i aminosyrerne.
Variationer i aminosyrerne 2 og 4 (Fig. 1-3) giver kun mindre ændringer i toksiciteten,
mens ændringer i glutaminsyreenheden samt nogle ændringer i Adda enheden medfører en
meget kraftig reduktion af toksiciteten (Rinehart et al. 1994).
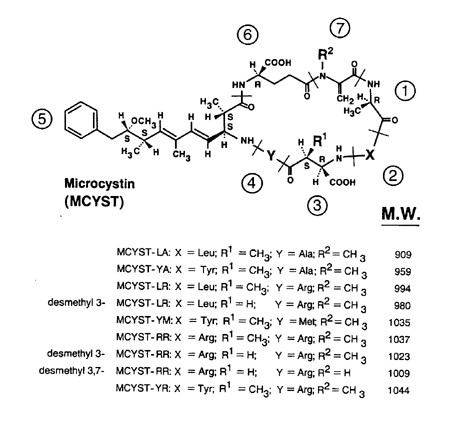
Figur 1-3
Struktur af microcystiner med angivelse af molekylevægten af nogle af de mest
almindelige varianter (fra Carmichael & Falconer 1993).
Arter
Microcystiner er blevet påvist hos mange arter af blågrønalger (tabel 1-3 og bilag
1-3). De fleste rapporter omhandler Microcystis aeruginosa, og microcystiner er fundet hos
denne art i de fleste områder af verden. Slægten Anabaena, som oftest forbindes med
nervetoksiner (f.eks. anatoxin-a) har også vist sig at producere microcystiner.
Tilsvarende findes mange rapporter fra Norden om microcystiner hos Planktothrix agardhii
(= Oscillatoria agardhii).
Nodularier
Cylindrospermopsin
De øvrige levertoksiner, hvis kemiske struktur er kendt (nodulariner og
cylindrospermopsin, er kun fundet hos hhv. brakvandsarten Nodularia spumigena og den
subtropiske art Cylindrospermopsis raciborskii.
Nodularia spumigena forekommer tilbagevendende i Østersøen i sensommeren og danner ofte
toksiske opblomstringer (Sivonen et al. 1989, Kononen et al. 1993). Disse opblomstringer
har ved flere lejligheder forårsaget dødsfald af hunde, kalve og ænder (Nehring 1993).
Tabel 1-3
| Blågrønalger, hvor microcystinproduktion er påvista) | |
| Microcystis aeruginosa | Norge, Finland, Rusland, Sydafrika, Kina, Japan, Portugal, USA, Australien, Canada, England/Skotland, Ægypten, Brasilien, Thailand, Danmark |
| Microcystis viridis | Japan |
| Microcystis botrys | Danmark |
| Oscillatoria agardhii (= Planktothrix agardhii) | Norge, Finland, Danmark |
| Oscillatoria agardhii var. isothrix (= Planktothrix mougeotii) | Norge, Danmark |
| Anabaena flosaquae/lemmermannii | Norge, Canada, Skotland, Danmark |
| Anabaena circinalis | Frankrig |
| Nostoc sp. | Finland |
| Hapalosiphon hibernicus | USA (Hawaii) Bentiske Oscillatoriales Schweiz |
a) Nærmere oplysninger om fund og referencer i bilag 1-3.
Grænseværdier
Internationale grænseværdier for forekomst af levertoksiner i drikke og badevand
eksisterer endnu ikke. I Australien er det foreslået, at der maksimalt må være 1 µg
microcystin pr. liter i drikkevand (Falconer et al. 1994). Undersøgelser i Kina af
forekomsten af levercancer i områder, hvor drikkevandet indeholder microcystiner,
indikerer, at grænseværdien børe være lavere, og 13 ng pr. liter foreslås (Ueno et
al. 1996).
1.2.2 Nervetoksiner
Nervetoksiner hos |
Nervetoksiner virker hurtigere end levertoksiner, og da de bl.a. rammer
åndedrætsorganerne, kan selv små doser være lethale. Der er fundet en række
forskellige nervetoksiner hos blågrønalger (tabel 1-4), hvoraf anatoxin-a er det mest
udbredte (tabel 1-5, bilag 1-4).
Anatoxin-a er fundet hos en del arter af blågrønalger, mens de øvrige nervetoksiner
endnu kun er påvist hos et fåtal af arter (tabel 1-5). Specielt slægten Anabaena
indeholder mange arter, der kan producere nervetoksiner. Sammenlignes tabel 1-3 og 1-5 ses
det, at en art kan producere flere forskellige typer af toksiner.
Virkemåder
Fælles for nervetoksinerne er, at de påvirker overførslen af impulser fra
nerveceller til muskelceller og medfører kramper i musklerne. På cellulært niveau har
det dog vist sig, at toksinerne har forskellige virkemåder.
Anatoxin-a virker postsynaptisk depolariserende ved den motoriske endeplade (Carmichael
& Falconer 1993). Virkningen af toksinet svarer til virkningen af transmitterstoffet
acetylcholin, men stimuleringen af musklen er vedvarende, idet acetylcholinesterase ikke
kan nedbryde anatoxin-a.
Tabel 1-4
Lever og nervetoksiner med kendt kemisk struktur.
Lever og nervetoksiner med kendt kemisk struktur.
Toksin |
Toksintype |
Kemisk beskrivelse |
LD50 (µg/kg) a) |
Virkemåde |
Reference |
Microcystiner |
levertoksiner |
heptapeptider |
50->1200 |
hæmmer proteinfos |
Rinehart et al. 1994 |
Nodulariner |
levertoksiner |
pentapeptider |
50->2000 |
hæmmer proteinfos |
Namikoshi et al. 1994, Rinehart et al. 1994, |
Cylindrospermopsin |
levertoksin |
alkaloid |
2100/200 b) |
hæmmer proteinsyntese |
Othani et al. 1992, |
Anatoxin-a |
nervetoksin |
sekundær amin alkaloid |
250 |
postsynaptisk depolariserende |
Devlin et al. 1977 |
Homoanatoxin-a |
nervetoksin |
sekundær amin alkaloid |
250 |
blokerer neuromuskulært (tilsyneladende somanatoxin-a) |
Skulberg et al. 1992 |
Anatoxin-a(S) |
nervetoksin |
organophosphat |
20 |
hæmmer acetylcholinesterase |
Matsunaga et al. 1989 |
Saxitoxin |
nervetoksin |
alkaloid |
10 |
blokerer natrium kanaler i nerver |
Gorham & Carmichael 1988 |
Neosaxitoxin |
nervetoksin |
alkaloid |
10 |
blokerer natrium kanaler i nerver |
Gorham & Carmichael 1988 |
Gonyantoxin |
nervetoksin |
alkaloid |
10-100 |
blokerer natrium kanaler i nerver |
Humpage et al. 1994, |
C-toxin |
nervetoksin |
alkaloid |
>>10 |
blokerer natrium kanaler i nerver |
Humpage et al. 1994, |
a) LD50 bestemt ved intraperitoneal injektion i mus.
b) LD50angivet som 2,1 mg/kg efter 24 timer og 0,2 mg/kg efter 5-6 dage.
Anatoxin-a(s) virker som anatoxin-a ved den motoriske endeplade, men den toksiske effekt
skyldes her, at anatoxin-a(s) hæmmer acetylcholinesterase (Mahmood & Carmichael
1986). Betegnelsen anatoxin-a(s) skyldes, at dette toksin hos forsøgsdyr bevirker kraftig
spytafsondring (salivation). Hos rotter giver det desuden blodlignende tårer (Carmichael
& Falconer 1993).
PSP står for "paralytic shellfish poisoning". PSP-toksinerne blokerer
natriumkanalerne i nerverne og forhindrer udbredelsen af nerveimpulser (Adelman et al.
1982). Der kendes i dag 18 forskellige PSP-toksiner, og de er alle bygget over det samme
skelet (tetrahydropurin) med variationer i 4 radikaler (figur 1-4). Toksinerne tilhører 3
kemiske grupper: carbamatetoksiner, decarbamoyltoksiner og N-sulfocarbamoyltoksiner
(Oshima et al. 1989), hvor de første er de mest og de sidste de mindst toksiske (Sullivan
& Wekell 1986). De mest toksiske forbindelser er saxitoksin (STX) og gonyautoksin 3
(GTX3) (figur 1-4). Toksinerne kan omdannes til hinanden, som vist i figur 1-5.
PSP-toksinerne er de kraftigst virkende nervetoksiner og var indtil for få år siden kun
fundet hos arten Aphanizomenon flosaquae i USA (Mahmood & Carmichael 1986), men inden
for de seneste år er de ligeledes detekteret i Anabaena circinalis og Lyngbya wolleii
(tabel 1-5, bilag 5). PSP-toksiner forbindes normalt med det marine miljø, hvor flere
dinoflagellater er kendt for at producere PSP. Toksinerne opkoncentreres i muslinger og
medfører forgiftningstilfælde og dødsfald hos mennesker, der spiser de marine
muslinger. Australien oplevede i 1991 en stor opblomstring af Anabaena circinalis,
(Humpage et al. 1994, Negri & Jones 1995), men så vidt vi ved, er der hverken her
eller andre steder observeret forgiftningstilfælde eller dødsfald hos mennesker, som kan
forbindes med PSP-producerende blågrønalger. I Danmark er der detekteret PSP-toksiner i
flere søer (denne undersøgelse).
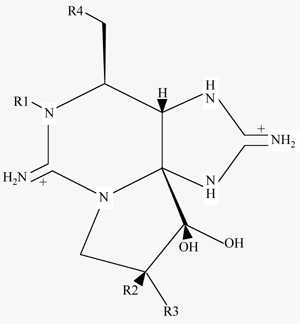
carbamat toksiner |
decarbamoyl toksiner |
N-sulfo carbamyol toksiner |
radikaler |
|||
| R1 | R2 | R3 | R4 | |||
OONH2 |
OONHSO3- |
OH |
||||
STX |
dc-STX |
GTX5 |
H | H | H | |
neo-STX |
dc-neoSTX |
GTX6 |
OH | H | H | |
| GTX1 | dc-GTX1 | C3 | OH | H | OSO3- | |
| GTX2 | dc-GTX2 | C1 | H | H | OSO3- | |
| GTX3 | dc-GTX3 | C2 | H | OSO3- | H | |
| GTX4 | dc-GTX4 | C4 | OH | OSO3- | H |
Toksicitet af de vigtigste PSP-toksiner angivet relativt til saxitoxin: |
||||||||||
| STX | GTX3 | GTX1 | dcGTX3 | neo | GTX2 | GTX4 | dcGTX2 | GTX5 | C2 | GTX6 |
| 1.00 | 1.09 | 0.80 | 0.48 | 0.51 | 0.39 | 0.33 | 0.26 | 0.17 | 0.14 | 0.09 |
Figur 1-4
Kembisk opygning af PSP-toksiner. Kemisk struktur: modificeret efter Sullivan
& Wekell (1986). C2 er identisk med GTX8. GTX5-6 kaldes også B1-2. STX = saxitoxin,
GTX = gonyantoxin. Relativ toksicitet fra Humpage et al. (1994) og for C2 Shimizu (1987).
Anatoxin-a(s)
Anatoxin-a(s) hæmmer acetylcholinesterase. Der er kun få rapporter om forekomsten
af dette toksin, og alle stammer fra Nordamerika. Under opblomstringer af Anabaena
lemmermannii i Knud Sø ved Ry i somrene 1993 og 1994 blev der fundet døde fugle langs
søbredderne. Ved obduktion fandtes mange Anabaena celler i maverne, og algemateriale
indsamlet i søen på det pågældende tidspunkt var meget kraftigt nervetoksisk ved
musetest. Hverken anatoxin-a eller PSP-toksiner kunne spores i algematerialet. Symptomerne
ved musetesten, hvor musene fik injiceret høje doser algemateriale (> 0,8 mg pr. mus),
viste heller ikke tegn på anatoxin-a(s). Ved lavere doser fik nogle af musene tårer i
øjnene og spyt omkring munden (se kapitel 2), hvilket er karakteristisk for toksiner, der
hæmmer cholinesterase (f.eks anatoxin-a(s)). En nærmere undersøgelse af toksinet i
dette materiale bekræftede tilstedeværelsen af anatoxin-a(s) (Henriksen et al. 1997,
Onodera et al. 1997).
Grænseværdier
Der er ikke fastlagt grænseværdier for nervetoksiner i bade og drikkevand. Den
internationale grænseværdi for koncentrationen af PSP-toksiner i muslinger og lign., der
sælges som konsum, er 80 µg STX pr. 100 g muslingekød (svarende til 444 museenheder, se
senere).
Tabel 1-5
| Blågrønalger, hvor produktion af nervetoksin er vista) | |
| ANATOXIN-A | hvor |
| Anabaena flosaquae | Canada, Finland, USA, Japan |
| Anabaena mendotae | Finland |
| Anabaena planctonica | Italien, Japan |
| Anabaena circinalis | Finland |
| Anabaena spiroides | Japan |
| Anabaena macrospora | Japan |
| Aphanizomenon flosaquae | Finland |
| Cylindrospermum sp. | Finland |
| Oscillatoria agardhii | Finland |
| Microcystis aeruginosa | Japan |
| Homoanatoxin-A | |
| Oscillatoria formosa (= Phormidium formosum) | Norge |
| ANATOXIN-A(S) | |
| Anabaena flosaquae | Canada, USA |
| Anabaena lemmermannii | Danmark |
| PSP-TOXINER | |
| Aphanizomenon flosaquae | USA |
| Anabaena circinalis | Australien |
| Lyngbya wolleii | USA |
| UKENDT NERVETOXIN | |
| Trichodesmium sp. | USA (Skt. Thomas) |
| Oscillatoria agardhii | Finland |
| Anabaena cf. cylindrica | Danmark |
a) Nærmere oplysninger om fund og referencer i bilag 1-4 og 1-5.
1.2.3 Cyto- og endotoksiner
Cytotoksiner
Cytotoksiner ødelægger celler og kan slå encellede organismer som alger, bakterier
og virus ihjel, men er ikke dødelige for flercellede organismer. Blågrønalger
producerer en lang række af cytotoksiner (Carmichael 1994).
Endotoksiner
Endotoksinerne er lipopolysaccharider (forkortes LPS), og disse toksiner dannes af
alle gramnegative bakterier. Som nævnt (i forordet) er blågrønalger en type bakterier
og hører til den gruppe, der kaldes gramnegative. Lipopolysaccharider hos blågrønalger
og deres eventuelle toksicitet er endnu kun lidt undersøgt, men de mistænkes for at
kunne give hudirritationer hos mennesker, som bader i vand med algeopblomstringer (NRA
1990) samt at give mavetarm problemer og badfeber (Annadotter 1993, NRA 1990, Rylander et
al. 1989). En undersøgelse af lipopolysaccharider fra Microcystis aeruginosa har vist, at
de ved injektion i mus i doser på 1,0-1,2 mg pr. kg slog musene ihjel (Raziuddin et al.
1983). Det bør derfor undersøges, om lipopolysaccharider kan være årsagen til, at man
i musetest ofte ser, at musene dør i løbet af ca. 1 døgn uden tegn på beskadigelse af
de indre organer. Denne type respons i musetesten er blevet betegnet
"protracted" (langtrukken) toksicitet (Skulberg et al. 1994), og blev i
forbindelse med en undersøgelse af toksiske blågrønalgeopblomstringer i Norge fundet i
35 ud af i alt 64 prøver (Skulberg et al. 1994).
LPS-endotoksiner hos blågrønalger er beskrevet af f.eks. Weckesser et al. (1979), Keleti
& Sykora (1982) og Raziuddin et al. (1983).
fortsættes på næste side