Blågrønalgetoksiner i bade- og drikkevand
5. Materialer og metoder
5 Materialer og metoder
5.1 Screening og badevandsundersøgelse
5.2 Toksiner i drikkevand
5.3 HPLC-analyser af microcystiner
5.4 HPLC-analyser af anatoxin-a
5.5 HPLC-analyser af PSP-toksiner
5.6 Musetests
5.7 Økologiske undersøgelse
5.1 Screening og badevandsundersøgelse
Til screening for blågrønalgetoksiner blev der i sommeren 1994 indsamlet 102
plankton-algeprøver fra 96 lokaliteter på Sjælland, Fyn og i Jylland. Lokaliteter og
datoer fremgår af bilag 2-1, 2-2 og 2-3. Prøverne blev indsamlet med et 20 µm
planktonnet. Til supplering af undersøgelserne for PSP-toksiner blev der i 1995 indsamlet
yderligere kvalitative samt kvantitative prøver fra Agersø, Esrum Å, Søndersø og
Bastrup Sø. Desuden blev der indsamlet supplerende kvalitative prøver til musetest fra 2
lokaliteter i Knud Sø henholdsvis den 10. og 13. juli.
Fra alle indsamlede prøver blev en lille delprøve fikseret i sur lugol, og senere brugt
til bestemmelse af artssammensætningen ved lysmikroskopi.
Til beskrivelse af årstidsvariationen i toksinforekomst indsamledes 6 gange i 1995
net-prøver af planktonalger i Bryrup Langsø (ved Bryrup) og Ravn Sø (ved Ry). Parallelt
med net-prøverne indsamledes kvantitative prøver til bestemmelse af artssammensætning.
Prøverne blev udtaget og oparbejdet som beskrevet i Århus Amt (1992a, b).
Alle prøver til toksinanalyse blev ved hjemkomst frysetørret. Algematerialet i de
kvantitative PSP-prøver blev først filtreret ned på GF/F-filtre og derefter
frysetørret. Testen for toksicitet omfattede musetest (afsnit 5.6), og HPLC-analyser for
microcystiner (afsnit 5.3), anatoxin-a (afsnit 5.4) og PSP-toksiner (afsnit 5.5).
5.2 Toksiner i drikkevand
Til undersøgelse af blågrønalgetoksiner i drikkevand blev der indsamlet prøver fra
Regnemark og Sjælsø vandværker og fra de 3 søer, der bruges som drikkevandsreservoirer
for vandværkerne (henholdsvis Haraldsted Sø, Gyrstinge Sø og Sjælsø). I Haraldsted
Sø og Gyrstinge Sø indsamledes planktonprøver med et 20 µm net fra juni 1994 til
oktober 1995. Fra Sjælsø indsamledes netprøver i sommeren 1995. Som for
badevandssøerne blev artssammensætningen bestemt, og forekomsten af microcystiner og
anatoxin-a blev analyseret (se afsnit 5.1, 5.3, 5.4).
Da toksiner kan lække fra algerne til søvandet, specielt i den afsluttende fase af en
algeopblomstring, blev toksinforekomsten i vandet i søen samt efter hvert rensningstrin i
vandværkerne analyseret. For hvert trin blev der indsamlet 10 l vand.
I Regnemark rensningsanlæg løber vandet først igennem en mikrositromle med maskevidder
på 64 og 40 µm. Derefter renses vandet ved en flokkuleringsproces, der binder det
organiske materiale, hvorefter det flokkulerede materiale bundfældes i et
sedimentationsbassin. Det rensede vand steriliseres med klor (18 mg klor/l). Herefter
fjernes kloret igen, og efter en række finfiltre og behandling med monokloraminer (MCA)
sendes vandet ud til forbrugerne. Vand blev indsamlet i overfladen af søen, før
mikrosien, efter mikrosien, efter sedimentation af det flokkulerede materiale samt fra det
færdigbehandlede vand.
I Sjælsø Vandværk består rensningsprocessen af sandfiltrering, flokkulering,
sedimentering og ozonbehandling efterfulgt af granulære biologisk aktive kulfiltre samt
dosering med MCA. Vand blev indsamlet umiddelbart efter, det var kommet ind på
vandværket, efter sedimentering, efter ozonbehandling og efter kulfiltrene.
Da toksinkoncentrationen i vandet normalt er meget lavere end i algerne, blev
vandprøverne forbehandlet inden HPLC-analyse. Dette skete ved at filtrere vandet gennem
GF/C-filtre (Whatman), så alt partikulært materiale blev fjernet, og herefter
opkoncentrere eventuelle toksiner i vandet på Isolute C18-kolonner som beskrevet i tabel
5-1. Ved analyse for anatoxin-a blev pH hævet til 9,5-10 med NaOH før opkoncentrering
på Isolute C-18-kolonner. Kolonnerne blev efter opkoncentreringen behandlet som beskrevet
i afsnit 5.3 og 5.4. Til microcystin-analyserne blev der taget 3 x 2 l vand og til
anatoxin-a-analyserne 3 x 1 l . GF/C-filtrene blev opbevaret ved -20oC og
senere analyseret for toksiner i det partikulære materiale.
På et pilotanlæg på Sjælsø Vandværk blev effektiviteten af vandrensningsprocessen
under en simuleret blågrønalgeopblomstring undersøgt. 15 g frysetørret
microcystin-holdigt algemateriale (7,5 g fra Bryrup Langsø og 7,5 g fra Birkerød Sø)
blev blandet med 2 l vand og udsat for ultralyd (120W) i 30 min afbrudt af kraftig
omrystning efter 15 min. Homogenatet fik lov at stå natten over i køleskab for at
ekstrahere toksinerne fra cellerne, hvorefter det blev blandet op i 50 l søvand og sendt
gennem pilotanlægget. Efter hvert trin i rensningsprocessen aftappedes 6 l vand, der blev
GF/C-filteret. Filtrene blev behandlet som beskrevet ovenfor. Det GF/C-filtrerede vand
(triplikate 2 l prøver) blev opkoncentreret, som beskrevet i tabel 5-1.
5.3 HPLC-analyser af microcystiner
Analyseudstyr og kemikalier
HPLC-analyser af microcystiner blev foretaget med følgende udstyr:
- Waters 600E pumpe
- Waters 717 plus autoinjector
- Waters 996 Photo Diode Array detector
- Waters Millennium 2.0 software til dataopsamling og -bearbejdning
Standarder af microcystin-LR og -YR stammede fra Calbiochem. Alle solventer var af
HPLC-kvalitet og kemikalier af analytisk kvalitet. I alle tilfælde, hvor der blev
benyttet vand (vandige buffere, ekstraktion osv.), var dette vand renset på Kinetico
Reverse Osmosis Drinking Water System (model # 518), Kinetico, Newbury, USA.
Betingelserne ved analyse af microcystiner er angivet i tabel 5-1. GF/C-filtre fra
drikkevands-undersøgelsen (se afsnit 5.2) blev ekstraheret tre gange i 20 ml methanol i
60 min. De 60 ml methanol blev fortyndet med vand til 300 ml og derefter opkoncentreret og
analyseret som anført i tabel 5-1. Kvantificering af toksinerne skete på baggrund af
arealerne af toksintoppene i kromatogrammer ved 239 nm. Kvantificeringen blev foretaget
mod kalibreringskurver for microcystin-LR (ekstern standard).
Tabel 5-1
HPLC-betingelserne ved analyse af microcystiner.
Materiale |
ca. 15 mg frysetørret algemateriale afvejet |
Ekstraktionsmiddel |
1 ml vand efterfulgt af 1 ml methanol |
Ekstraktion |
ultralyd (120W) i 10 min - afbrudt af kraftig omrystning efter 5 min |
Opkoncentrering |
efter centrifugering fortyndes supernatanten så
methanol-koncentration <20% suges gennem aktiveret C18-kolonne Æ vaskes med 5 ml
20%-methanol Æ elueres med 5 ml methanol Æ inddampning under svag luftstrøm Æ
opbevaring i køleskab |
C18-kolonne |
Isolute C18 (Endcapped, 500 mg/6 ml), aktiveret med 5 ml methanol
efterfulgt af 5 ml vand |
Injektion |
25 µl af inddampede materiale opløst i 400 µl 20% acetonitril og filtreret gennem 0,2 µm (13 mm) membranfilter |
Solventer 1994 |
A: 0,05% trifluoroeddikesyre (TFA) |
Gradient 1994 |
tid (min) 0 10 20 22 25 |
Solventer 1995 |
A: 10 mM ammoniumacetat (pH 5,0) |
Gradient 1995 |
tid (min) 0 25.5 32 36 |
Kolonne |
Symmetry C18 (150 x 3.9mm) (Waters) |
Flow |
1 ml pr. min |
Detektion |
UV (photo diode array) |
Identifikation |
spektrum og absorptionstop (239 nm) sammenholdt med standard |
Inden proceduren for analyserne blev fastlagt, blev de optimale betingelser for ekstraktion og genfindsprocenten for toksin i frysetørret materiale undersøgt.
Ekstraktionsmetode
For at optimere ekstraktionsprocessen for microcystiner fra frysetørret algemateriale blev toksiske algeprøver fra seks lokaliteter behandlet som beskrevet i tabel 5-2.
Forsøg
Fælles for begge ekstraktionsmetoder var, at algematerialet blev afvejet i hhv. centrifugeglas eller Eppendorf rør, hvorefter ekstraktionsmidlet blev tilsat.
Efter kraftig omrystning placeredes centrifugeglasset/Eppendorfrøret i ultra-lyd. Efter endt ultralyd blev prøverne centrifugeret i 10 min og supernatanten opsamlet. Ekstraktionsproceduren blev gentaget med det tilbageblevne algemateriale. I de tilfælde, hvor der som ekstraktionsmiddel er angivet f.eks. "vand - efterfulgt af methanol" betyder det, at den første ekstraktion blev foretaget med vand og den efterfølgende med methanol.
Efter den anden ekstraktion blev supernatanterne samlet og suget igennem aktiverede Isolute C18 (End-Capped, 500 mg/6 ml) solid-phase extraction kolonner (International Sorbent Technology, Mid Glamorgan, England). Aktivering af kolonnerne skete med 5 ml methanol efterfulgt af 5 ml vand. Prøver ekstraheret i methanol, eller vand efterfulgt af methanol, blev inden opkoncentreringen på Isolute C18 kolonnerne fortyndet med vand til methanol koncentrationen var < 20%.
Efter supernatanterne var suget igennem kolonnerne (flow: 1-2 ml/-min) blev disse skyllet med 5 ml 20% methanol. Toksinerne blev herefter elueret med 5 ml methanol og opsamlet i centrifugeglas.
Indholdet i centrifugeglassene blev inddampet under en svag luftstrøm, og glassene blev placeret i køleskab. Inden HPLC-analyse blev det inddampede materiale genopløst i 400 µl 20% acetonitril og filtreret gennem 0,2 µm (13 mm diameter) filtre.
Tabel 5-2
Ekstraktionsmetoder benyttet til microcystin-analyser.
Metode 1 |
Metode 2 |
|
Algeprøver |
Akervatn (Norge) 22/10 1984 |
Langesø 25/7 1994 |
Mængde algemateriale |
25 mg |
15 mg |
Ekstraktionsmidler |
Vand |
Vand - efterfulgt af butanol:-methanol: vand (kun Langesø og Bryrup
La-ngsø) Vand - efterfulgt af methanol |
Mængde ekstraktionsmiddel |
10 ml |
1 ml |
Ultralyd 120W |
30 min - afbrudt af kraftig om-rystning efter 15 min |
30 min - afbrudt af kraftig omrystning |
Ultralyd 90W |
10 min - afbrudt af kraftig omrystning efter 5 min |
Prøverne blev analyseret på en NovaPak C18 (Waters) kolonne med følgende solventer og
gradient:
Solvent A: 0,05% Trifluoroeddikesyre (TFA)
Solvent B: Acetonitril (indeholdende 0,05% TFA)
Tid (min) |
0 |
5 |
15 |
17 |
20 |
Solvent A (%) |
70 |
65 |
50 |
50 |
70 |
Solvent B (%) |
30 |
35 |
50 |
50 |
30 |
Resultat
De seks algeprøver, som blev benyttet til ekstraktionsforsøgene, havde alle vist
tilstedeværelse af levertoksiner ved musetest eller ved HPLC-analyser. Microcystiner i
prøverne blev genkendt udfra absorptionsspektrene i de enkelte toppe i kromatogrammerne
(figur 5-1).
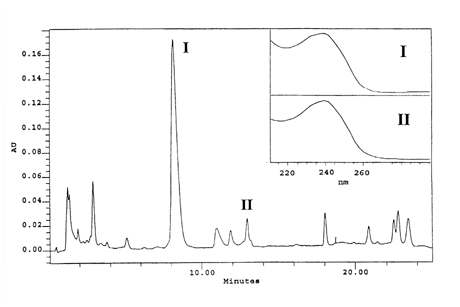
Figur 5-1
Kromatogram (239 nm) fra Halle Sø den 27. juli 1994. To toppe (I og II) har
typiske microcystin absorptionsspektre.
Resultatet af forsøg med forskellige ekstraktionsmidler er afbildet i figur 5-2 og 5-3.
Det ses, at det optimale ekstraktionsmiddel varierede for de forskellige algeprøver. Det
var karakteristisk, at ekstraktion udelukkende i methanol ofte gav en markant lavere
toksinmængde end de øvrige ekstraktionsmidler (figur 5-2 b, d og figur 5-3 a, b).
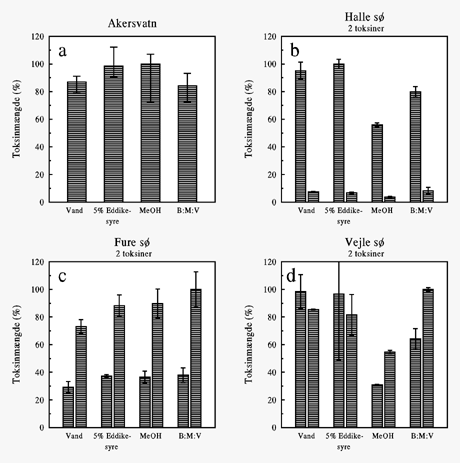
Figur 5-2
Ekstraktion af microcystiner fra fire algeprøver med forskellige
ekstraktionsmidler. Akersvatn indeholdt ét toksin, mens de øvrige indeholdt to.
Toksinmængden er beregnet udfra arealet af toksintoppene, således at det maksimale areal
fundet i hver algeprøve er sat til 100%. Søjlerne angiver gennemsnit og desuden er
angivet minimum og maksimum af tre ekstraktioner. MeOH = methanol, B:-M:V =
butanol:methanol:vand (1:4:15 - vol/vol).
Kombinationen butanol:methanol:vand ekstraherede ofte en stor toksinmængde, men for Vejle
Sø (figur 5-2 d) gav dette (samt methanol) et omvendt forhold mellem mængderne af de to
toksiner i forhold til de vandige ekstrationmidler. På baggrund af dette, samt den gode
toksinekstraktion ved anvendelsen af vand efterfulgt af ren methanol, blev
ekstraktionsproceduren videre optimeret udfra anvendelsen af vand efterfulgt af methanol.
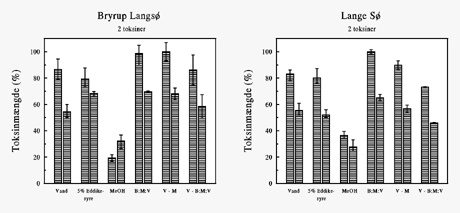
Figur 5-3
Ekstraktion af microcystiner fra to algeprøver med forskellige
ekstraktionsmidler. Som 5-2. V-M = vand efterfulgt af methanol, V-B:M:V = vand efterfulgt
af B:M:V.
Figur 5-4 viser resultatet af sammenligning af ekstraktion med vand efterfulgt af ren
methanol og af butanol:methanol:vand (1:4:15). Den største mængde toksin fandtes ved
ekstrahering af 25 mg algemateriale i 10 ml vand, efterfulgt af methanol, i 30 min
ultralyd (120W). Kortere ultralyd (5 min) gav ca. 5% mindre toksin (ikke vist), hvilket
svarede til udbyttet ved ekstraktion i 1 ml vand, efterfulgt af methanol, i 10 min
ultralyd (120W). Ved metoden med ekstraktion i 1 ml var det karakteristisk, at længere
tids ultralyd (30 min) gav et lavere toksinudbytte ligesom anvendelsen af svagere ultralyd
(90W).
Ekstraktion af 15 mg algemateriale i 1 ml vand efterfulgt af 1 ml methanol i 10 min
ultralyd (120 W) blev valgt til de efterfølgende analyser af blågrønalgeprøver fra
danske søer på grund af anvendelsen af mindre mængder algemateriale og
ekstraktionsmiddel samt kort prøveforberedelse.

Figur 5-4
Forskellige ekstraktionsmetoders betydning for analyse af microcystinindholdet i
frysetørret algemateriale fra Lange Sø den 25. juli 1994. Materialet indeholdt to
toksiner. Toksinmængden pr. mg algemateriale er beregnet udfra arealet af toksintoppene,
og den maksimale mængde fundet er sat til 100%. Søjlerne angiver gennemsnit og desuden
er angivet minimum og maksimum af tre ekstraktioner.
Genfinding af toksin
For at undersøge genfindingsprocenten af microcystin blev en ikke-toksisk
blågrønalgeprøve fra Peblinge Sø 24. august 1994 ekstraheret som beskrevet i metode 2
(i vand - efterfulgt af methanol, 10 min ultralyd (120W)) og tilsat 400 ng microcystin-LR
samt 400 ng microcystin-YR, inden den blev suget igennem Isolute C18 kolonne.
Toksinindholdet i den færdigt behandlede prøve blev kvantificeret mod kalibreringskurver
for microcystin-LR og -YR. Som en test af genfindingen af opløst microcystin i vandfasen
blev 0,125 µg microcystin-LR sat til 500 ml søvand, og proceduren fra opkoncentrering
på Isolute C18-kolonner (tabel 5-1) udført.
Tilsætning af microcystin-LR og -YR standarder til en ikke toksisk algeprøve inden
toksin opkoncentrering på C18 kolonne gav følgende genfinding af toksinerne:
| Genfunden toksinmængde (%) | |||
| Toksin | Gennemsnit (n = 3) | Minimum | Maksimum |
| Microcystin-LR | 94 | 89 | 97 |
| Microcystin-YR | 89 | 86 | 92 |
Samtlige kvantificeringer af microcystinindholdet i algemateriale fra søer i 1994 samt
søer anvendt til badning i 1995 er baseret på en genfinding af 94% af microcystinerne
ved opkoncentrering på C18 kolonner.
Tilsætning af 0,125 µg microcystin-LR standard til 500 ml vand fra Sjælsø (der ikke i
forvejen indeholdt toksiner) inden toksin opkoncentrering på C18 kolonner gav følgende
genfinding af opløst microcystin i søvand:
| Genfunden toksinmængde (%) | |||
| Toksin | Gennemsnit (n = 4) | Minimum | Maksimum |
| Microcystin-LR | 94 | 88 | 104 |
Samtlige kvantificeringer af det opløste microcystinindhold er baseret på denne
genfinding (94%).
5.4 HPLC-analyser af anatoxin-a
Analyser af anatoxin-a blev foretaget med følgende udstyr:
- Shimadzu LC-6A pumpe
- Shimadzu SIL-9A autoinjector
- Photo Diode Array detector Shimadzu SPD-M6A
- Shimadzu class-M10A software
Anatoxin-a-standard blev indkøbt hos Calciochem. Alle solventer var af HPLC-kvalitet og
kemikalierne af analytisk kvalitet. Det brugte vand var renset med MilliQ Plus 185.
Anatoxin-a blev ekstraheret fra 10 mg frysetørret algemateriale med 10 ml vand i
centrifugeglas placeret i ultralyd i 10 min. Både før og midt i ultralydsbehandlingen
blev prøven kraftigt omrystet (hvirvelmixer). Efter centrifugering (10 min, 2000 rpm)
blev supernatanten taget fra og ekstraktionen gentaget med det resterende materiale. De
samlede supernatanter blev tilsat 1-2 dråber NaOH for at hæve pH til 9-10 og umiddelbart
derefter suget igennem en aktiveret (5 ml methanol efterfulgt af 5 ml vand) Isolute C18
kolonne (500 mg/6 ml). Toksinet blev elueret med 5 ml methanol indeholdende 0,01%
trifloureddikesyre (TFA), og eluatet tørret under luftstrøm. På dette trin kan prøven
opbevares forudsat, at den ikke udsættes for sollys.
Inden HPLC-analyse blev prøven opløst i 500 µl 10% methanol. Analyserne blev foretaget
på en Develosil C18-5 (150 x 4,6 mm) kolonne (Nomura Chemicals, Japan) med methanol-0.01
M ammoniumklorid (pH justeret til 4 med HCl) (1:9) og flow 1 ml/min. Absorbancen i
intervallet 200-250 nm blev registreret til undersøgelse af absorptionsspektre af toppe
med retentionstider nær anatoxin-a standarden. For identiske absorptionsspektre
(prøvestandard) blev toksinindholdet beregnet ud fra arealet af anatoxin-a-standarden
kørt i samme kørsel.
5.5 HPLC-analyser af PSP-toksiner
Analyser af PSP-toksiner blev foretaget med følgende udstyr:
- 3 Shimadzu LC-6A pumper
- Shimadzu FCV-3AL solvent selector
- SIL-6B autoinjector
- Haake D1 and G waterbath
- Haake F3 and W19 waterbath
- Shimadzu Fluorescense HPLC Monitor RF-551
- Shimadzu C-R4A Chromatopac integrator
Standarder af 8 PSP-toksiner (saxitoxin (STX), neo-saxitoxin (neo-STX), dc-saxitoxin
(dc-STX), gonyautoxinerne (GTX) 1-5) blev anvendt i projektet. Standarderne var
fremstillede af Dr. Y. Oshima, Tohoku University, Japan, og venligt stillet til rådighed
for projektet af Dr. Helle Ravn, Danmarks Miljøundersøgelser.
Alle solventer var af HPLC-kvalitet og kemikalierne af analytisk kvalitet. Det brugte vand
var renset med MilliQ Plus 185.
Betingelserne ved analyse af PSP-toksiner er angivet i tabel 5-3. HPLC-metoder for
PSP-toksiner er tidligere undersøgt i Hav90-projektet "Giftige alger i danske
farvande" (Larsen et al. 1993, Ravn et al. 1995), og den valgte metode følger
anbefalingerne fra dette projekt. Standarder blev analyseret i starten og slutningen af
hver kørsel og til tider midt i en kørsel. Kvantificering skete udfra arealet af toppe
med samme retentionstid og maksimumbølgelængde (390 nm), som standarderne (±5%). STX-
og GTX-toksinerne blev detekteret i separate analyser.
5.6 Musetests
Frysetørrede algeprøver indsamlet fra en række danske søer i 1994 blev screenet for
forekomst af toksiner med musetest. Frysetørret materiale blev opslemmet i 1 ml 0,9% NaCl
og injiceret intraperitonealt i hvide mus med en vægt på 19-21 g. To mus fik injiceret
ekstrakt af hhv. 50 og 25 mg algemateriale for hver lokalitet. For nogle af lokaliteterne
benyttedes tre koncentrationer, hhv. 25 og 12,5 og 5 mg algemateriale pr. ml. I enkelte
tilfælde rakte mængden af algemateriale kun til én mus, som så injiceredes med den
størst mulige dosis.
Efter injektion af algemateriale blev musene observeret i 3-4 timer. Mus, som døde
indenfor denne periode, blev registreret og obducerede for at undersøge forandringer i
leverens udseende. Efter ca. 24 timer noteredes hvilke mus, der var døde efter
observationsperioden, og overlevende mus blev aflivet.
Musetestene blev udført på Scantox, Lille Skensved.
Tabel 5-3
HPLC-betingelser for detektion af PSP-toksiner ved modificeret Oshimametode (efter
Larsen et al. 1993 og Ravn et al. 1995).
| Materiale | ca. 10 mg frysetørret algemateriale afvejet |
| Ekstraktionsmiddel | 2 ml 0,03 N eddikesyre |
| Ekstraktion | frysning efterfulgt af optøning 3 gange, afsluttende med ultralyd i 2 min og centrifugering 5 min ved 3000 rpm; supernatanten filtreres gennem microfilter MFS-13 |
| Injection | 30 µl af ekstrakt, injektionskammer tempereret til 3oC |
| Solventer | GTX-toksiner: |
| 450 ml destilleret vand tilsat 10,00 ml 100 mM 1-heptannatriumsulfonat og 10,00 ml 500 mM fosforsyrestamopløsning, og justeret til pH = 7,1 med 1 N ammoniumhydroxidopløsning, hvorefter efterfyldes med destilleret vand til 500 ml (højst holdbar 7 dage). | |
| STX-toksiner: | |
| 450 ml destilleret vand tilsat 10,00 ml 100 mM 1-heptannatriumsulfonat og 30,00 ml 500 mM fosforsyrestamopløsning, og justeret til pH = 7,1 med 1 N ammoniumhydroxidopløsning, hvorefter efterfyldes med destilleret vand til 500 ml. Derefter tilsættes 30,00 | |
| Kolonner | forkolonne : LiChroCart RP-18,5, 5 µm |
| kolonne : Develosil C8-5 (150 x 4,6) | |
| Postkolonne-system | pumpe som tilsætter oxidationreagens |
| teflonslange, hvori reaktion sker, i varmebad*) | |
| pumpe som tilsætter stopreagens efter vandbad | |
| *) temperaturer: GTX-toksiner 65oC, STX-toksiner 50oC | |
| Oxidationsreagens | til 150 ml destilleret vand tilsættes 5,00 ml 350 mM perjodsyre og 50,00 ml 250 mM dinatriumhydrogenfosfat, og pH indstilles til 9,00 ved titrering med 1 N natriumhydroxidopløsning. Derefter tilsættes destilleret vand til 250 ml (højst holdbar 1 dag). |
| Stopreagens | 0,5 N eddikesyre (højst holdbar 7 dage) |
| Flow | solvent: 0,8 ml pr. min |
| oxidationsmiddel og stopreagens 0,4 ml pr. min | |
| Detektion | fluorescensdetektor, hvor excitationsbølgelængden er 330 nm og emissionsbølgelængden 390 nm. |
5.7 Økologiske undersøgelse
Datagrundlag
Analyserne i afsnit 4 er foretaget på grundlag af en række datasæt fra DMU’s
forskellige sødatabaser (alle Rdb-databaser på DMU, afd. for Sø- og
Fjordøkologi’s VAX-anlæg):
- Data indsamlet i forbindelse med NPO-forskningsprogrammet og her fra specielt datasæt
med semikvantitative vurderinger af planteplankton kombineret med kemiske og morfometriske
data for søerne. En nærmere beskrivelse af disse data fra mere end 300 søer, 1200
prøvetagninger og 20000 observationer findes i Kristensen et al. (1990b) og Jensen et al.
(1994).
- Data fra de 37 søer, der indgår i Vandmiljøplanens overvågningsprogram. Datasæt,
der udover kvantitative planteplanktonundersøgelser, omfatter morfometriske data,
belastningsdata, fysiske og kemiske undersøgelser af søvandet samt
dyreplanktonundersøgelser. De primære data er indsamlet med en årsfrekvens på 17
prøver, og prøvetagningen startede i 1989. For en nærmere beskrivelse se bilag 5-1,
Miljøstyrelsen (1993) og Jensen & Søndergaard (1994). Metodikken for
planteplanktonundersøgelserne følger anvisningerne i Olrik (1991) og Jensen &
Søndergaard (1994).
- Øvrige kvantitative planteplanktonundersøgelser indsamlet i forbindelse med DMU's Afd.
for Sø- og Fjordøkologi’s forsknings- og udredningsprojekter samt fra amtskommunale
tilsynsundersøgelser. De specifikke data for planteplankton er om muligt kombineret med
morfometriske, vandkemiske og -fysiske data. Metodikken for planteplanktonundersøgelserne
følger anvisningerne i Olrik (1991) og Jensen & Søndergaard (1994).
- Herudover er benyttet data for vind- og lysforhold samt nedbør fra DMU’s Afd. for
Sø- og Fjordøkologi’s klimadatabase. De tilgængelige data har været
døgnmiddelværdier på et geografisk detaljeringsniveau svarende til kommuneniveau.
Data for pkt. 3 - Øvrige kvantitative planteplanktonundersøgelser - er udvidet i
forbindelse med nærværende projekt. I slutningen af 1994 blev der rettet kontakt til
amtskommunerne, som i de fleste tilfælde stillede relevante data til rådighed eller
henviste til konsulentfirmaer. Det samlede omfang af databasen med data fra kvantitative
planteplanktonundersøgelser er nu 127 søer, 371 søår og 5861 prøvetagningsdatoer
(bilag 5-2).
Databehandling og øvrige metoder
Analysen af data er koncentreret om to niveauer: dels et overordnet niveau omfattende
toksiske blågrønalger, og dels et mere detaljeret niveau omfattende toksiske slægter og
arter af blågrønalger. I analysen er potentielt toksiske arter defineret ud fra
litteraturoplysninger om toksiske arter af blågrønalger (Skulberg 1988; Bjergskov et al.
1990; for at analyserne skulle give mening, er slægter og arter med et fuldt datasæt
(inkl. kemi og morfometri) og med mere end 15 observationer i den produktive periode (1.
maj -1. oktober) valgt ud. Slægten Oscillatoria følger den gamle systematik, det vil
sige Oscillatotria er ikke opdelt i de nye slægter: Oscillatoria, Limnothrix,
Planktothrix, Pseudanabaena, m.v. Den endelige liste med potentielt toksiske arter, der
indgik i analysen, fremgår af tabel 5-4.
Disse potentielt toksiske arter dækker langt hovedparten af blågrønalgeobservationerne
registreret i det hele taget; den eneste hyppigt forekommende slægt i databasen, der ikke
er med, er Aphanothece (herunder specielt arten: Aphanothece clathrata W. & G.S.
West).
Dataanalysen er gennemført parallelt for blågrønalger totalt og for gruppen af
potentielt toksiske blågrønalger (tabel 5-4). Resultaterne var ikke forskellige for de
to grupper - ikke overraskende, da de potentielt toksiske arter udgør hovedparten af
samtlige blågrønalgeobservationer - hvorfor der er vist resultater med henvisning til
"blågrønalger" gældende for begge grupperinger.
Tabel 5-4
Potentielt toksiske blågrønalgearter er defineret som følgende slægter, alle
hyppigt forekommende i danske søer.
Herunder specielt arten:
| Herunder specielt arten: | |
| Coelosphaerium | C. kutzingianum Näg. |
| Gomphoshaeria | G. lacustris Chod. (= Snowella lacustris (Chod.) Kom. et Hind.) |
| G. naegeliana (Ung.) Lemm. (= Woronichinia naegeliana (Ung.) Elenk.) | |
| Microcystis | M. aeruginosa (Kütz.) Kütz. |
| M. incerta (Lemm.) Lemm. | |
| M. viridis (A. Braun.) Lemm. | |
| M. wesenbergii (Kom.) Starm. | |
| Anabaeana | A. circinalis Rab. |
| A. flosaquae (Lyngb.) Breb. | |
| A. lemmermannii P. Richter | |
| A. solitaria Kleb. | |
| A. spiroides Kleb. | |
| Aphanizomenon | A. flosaquae (L.) Ralfs |
| Oscillatoria | O. agardii Gom. (= Planktothrix agardhii (Gom.) Anag. et Kom.) |
| O. rubescens De Candolle (= Planktothrix rubescens (De Candolle) Anag. et Kom.) |
Statistiske metoder
Forud for de statistiske analyser blev data (bortset fra pH) logaritmetransformeret
for at sikre normalfordeling samt varianshomogenititet. De vigtigste værktøjer ved
datapræsentation og analyse har været programpakken SAS (SAS Institute 1989) til almene
statistiske og grafiske analyser samt programmet CANOCO (ter Braak, 1988; ter Braak, 1990)
ved multivariate analyser samt tilhørende "joint plot".
For at fremme forståelsen af afsnit 4 skal de to begreber: "weighted averaging"
og "canonical correspondence analysis" introduceres ganske kortfattet.
Weighted averaging (WA)
Det kan i mange tilfælde være svært eller umuligt at forklare, hvorfor en bestemt
planteplanktonart forekommer i en sø i stedet for en anden, men jo større forståelse
man har af de enkelte arters økologi (= autøkologi), jo større chance er der for at
finde forklaringen(erne). En given planteplanktonart har visse krav til omgivelserne, hvis
den skal kunne forekomme og naturligvis i højere grad, hvis den skal kunne dominere i
forhold til de øvrige arter og opnå en høj biomasse. En given art har således en
flerdimensionel niche bestemt af mange såvel fysisk-kemiske som biologiske faktorer.
Eller anderledes sagt: en arts niche udgøres af det "rum", der afgrænses af
alle disse faktorer. Dette betyder, at beskrivelse af en arts samlede krav til det
omgivende miljø for henholdsvis at kunne forekomme, og kunne dominere, er en utrolig
kompliceret om ikke umulig opgave. Dog vil der for en given art ofte være faktorer, der
er mere afgørende end andre. Derfor kan en beskrivelse af en planktonarts forekomst i
forhold til en enkelt eller få faktorer give væsentlige informationer om den eventuelle
betydning af disse faktorer for arten.
-
Ved analyserne er anvendt biomassevægtningsteknikken, dvs. at ved beregningen af
gennemsnittet for en arts forekomst tæller forekomster proportionalt til den biomasse,
som den har haft ved den givne observation:
u*(p)=(b1p1+b2p2+.....+bnpn)/(b1+b2+.....+bn)
hvor u*(p) er det biomassevægtede gennemsnit i forhold til en given variabel (p), b1,b2,.....,bn
er biomassen for den givne art for sø 1 til n, og p1,p2,.....,pn
er værdien for variablen p i sø 1 til n. Som et mål for variationen omkring det
beregnede gennemsnit er spredningen angivet. Således udnyttes ikke kun den information,
der findes i registreringen af en given art ved en værdi af en faktor, men også
informationen fra biomasseopgørelserne udnyttes. Gennemsnitsværdien kan betragtes som et
groft mål for optimumsværdien for arten i forhold til den givne parameter, mens
spredningen kan betragtes som et estimat for tolerancen i forhold til parameteren.
WA-teknikken er blevet ganske udbredt efterhånden specielt på grund af dels et forbedret
teoretisk grundlag (f.eks. ter Braak, 1987) og dels praktisk anvendelse ved især
palæolimnologiske undersøgelser (f.eks. Patrick & Anderson, 1995).
Overgangen fra "weigted averaging"-teknikken til CCA-teknikken er egentlig
ganske nærliggende. WA-teknikken giver kun en empirisk beskrivelse af arternes
udbredelsesforhold, mens CCA-analysen giver en egentlig statistisk analyse af arternes
udbredelse relateret til en række omgivelsesparametre.
Canonical correspondence analysis (CCA)
Notationen er hentet fra Jongman et al. (1987): Data analysis in community and
landscape ecology, og ord i parentes er notation herfra. Følgende notation bruges:
Artsvariable (species): Y1,...,Ym som hver har en koordinat for hver
sø. Artsscores: u1,...,um. Omgivelsesvariable (environmental): Z1,...,Zm
som ligeledes er observeret i hver sø.
Akserne
Ordinationsakserne i diagrammet er konstrueret som lineære kombinationer af de
forskellige omgivelsesvariable, dvs. X=c0+c1Z1+…+cqZq,
hvor den i’te søkoordinat i X kaldes for xi. Førsteaksen er den lineære
kombination, som forklarer mest af variationen i arternes score, dvs. den kombination der
har den største egenværdi. Andenaksen er kombinationen, som forklarer næstmest
artsvariation, og er ukorreleret med førsteaksen. Fortolkningen af en ordinationsakse er
uafhængig af en fortolkning af en anden ordinationsakse.
Afbildning af omgivelsesvariable
c’erne (canonical coefficients) i X=c0+c1Z1+…+cqZq
er koordinater for den pågældende omgivelsesvariabel, og de afsættes som pile i
diagrammet. Jo længere en omgivelsesvariabel peger ud af aksen jo tættere er
sammenhængen, så det optimale med hensyn til en enkelt fortolkning er, at en
omgivelsesvariabel er sammenfaldende med aksen, dvs. c er 1 (eller -1) og resten af
c’erne er nul.
Artskoordinater
En arts aksekoordinat beregnes som et vægtet gennemsnit med hensyn til aksen, og
koordinaten er identisk med artsscoren i canonical correspondence analysis. Kaldes
artsobservationen i sø nr. i for yi, beregnes koordinaten som u=![]() yixi/
yixi/![]() yi.
u’erne afsættes som punkter i diagrammet, og fortolkningen er indirekte gennem
omgivelsespilene.
yi.
u’erne afsættes som punkter i diagrammet, og fortolkningen er indirekte gennem
omgivelsespilene.
Sammenhængen mellem arter og omgivelsesvariable
En omgivelsesvariabel afsættes som en pil og angiver en retning i diagrammet.
Artspunkterne skal fortolkes ved ortogonal projektion på en omgivelsespil. Rækkefølgen
af projektionen af artspunkter svarer til rækkefølgen af de vægtede gennemsnit af
arterne med hensyn til den pågældende omgivelsesvariabel. I figuren har art 1 større
betydningsscore end artsvariabel 2.
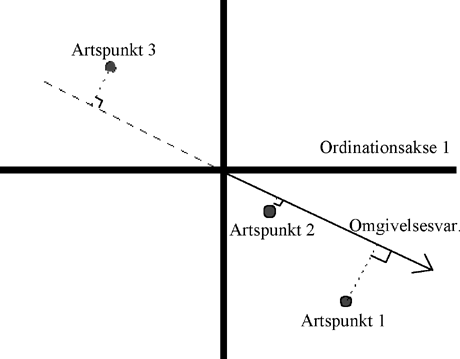
En art ved centrum af diagrammet er enten unimodal med optima ved centrum eller ikke
relateret til ordinationsakserne. Dette spørgsmål kan afklares via en Monte Carlo
permutations test i CANOCO. En art med negativ koordinat til en omgivelsesvariabel
behøver ikke at være negativ korreleret til denne variabel, men kan have relativ mindre
optimum.