|
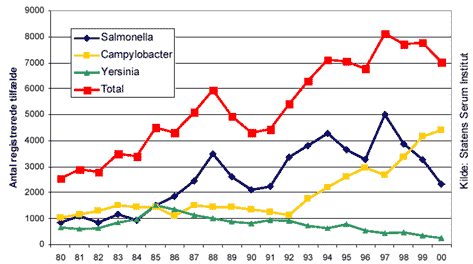
Risikovurdering ved anvendelse af vandingskanoner til udspredning af gylle fortyndet med vand 2. Beskrivelse og forekomst af smittefremkaldende agens i gylle Indholdet af agens i gylle stammer fortrinsvis fra fæces og urin. Yderligere indeholder gylle sekreter og dermed agens fra næse, svælg, vagina, blod, hud, yver, moderkage, ufordøjede eller delvist fordøjede foderstoffer samt strøelse og støv. Indholdet af smitstoffer og andre skadelige substanser i gylle afspejler derved husdyrholdets sundhedsstatus, produktionsforhold, samt den behandling (lagring) gyllen har gennemgået inden den spredes på jorden. Frisk gylle indeholder i størrelsesordenen 1 milliard (109) bakterier pr. ml. Der tilføres kontinuerligt næringsstoffer og nye mikroorganismer og derved udgør en gylletank et kompleks økosystem under konstant forandring. Antallet af agens vil variere med lagringstid, infektionsstatus i husdyrholdet, årstid, temperatur, pH, partikelindhold, mikrobielt indhold og oxidations/reduktions potentiale. De fleste bakterier er normale tarmbakterier, mens de sygdomsfremkaldende bakterier kommer fra syge dyr og raske smittebærere. Smitstofnedbrydningen går meget langsommere ved lave temperaturer, endvidere vil de anaerobe forhold i gylletanke, i modsætning til de aerobe forhold i møddinger, ikke befordre varmedannelse og derfor ikke den samme betydelige inaktivering af smitstoffer. I de følgende afsnit beskrives de bakterier, virus og parasitter, der vurderes at være relevante under danske forhold. Der er ikke i beskrivelsen vurderet forskellige infektive mikrosvampe, f.eks. ringorm (Trichophyton spp., Microsporum ssp.), gærsvampe (Candida spp., Cryptococcus spp.) og skimmelsvampe (Aspergillus ssp.). 2.1 Beskrivelse af bakterierI dette afsnit gives en gennemgang af de mest relevante bakterielle zoonoser, som kan forekomme i gylle fra danske husdyrbesætninger. Det bør dog bemærkes, at der eksisterer en lang række af andre humanpatogene bakterier som ligeledes kan forekomme i gylle (Tabel 2). Afsnittet indeholder også en kort beskrivelse af antibiotikaresistente bakterier. 2.1.1 SalmonellaMennesker smittes sædvanligvis peroralt via kontaminerede fødevarer eller vand, og i sjældnere tilfælde ved person-til-person smitte. Den infektive dosis varierer afhængig af Salmonella typens virulens, levnedsmidlets (eller vehiklets) beskaffenhed, samt personens alder og almene helbredstilstand. For ikke værtsadapterede Salmonella serotyper som f.eks. S. Typhimurium, er der evidens for, at konceptet om en infektionsdosis på 105 til 107 bakterier, som bestemt ved frivillige infektionsforsøg, ikke længere holder. I forbindelse med udbrud har det vist sig at 10 bakterier har været i stand til at fremkalde sygdom (D’Aoust, 1989). Blaser og Newman (1982) rapporterer udbrudsdata med infektive doser fra 1 til 1011 bakterier med en median på 102. Desuden tyder udbrudsdata på at infektionsdosen er lavere i fedtholdige levnedsmidler, da fedtet antageligt beskytter bakterierne imod den nedbrydende effekt af mavesyren (Kapperud et al., 1990; Hedberg et al., 1992; Hennessy et al., 1996). Det har ikke været muligt at finde litteratur om aerogen smitte af mennesker, herunder data vedr. den infektive dosis. Men det skal bemærkes, at andre infektioner end de normalt luftbårne kan spredes ad denne vej, og at den infektive dosis ved aerogen smitte ofte vil være lavere end ved peroral indtagelse. For Salmonellas vedkommende angives den infektive dosis hos får og kalve ved inhalation til at være en fjerdedel eller mindre af hvad der kræves for etablering af en peroral infektion (Pritulin 1959). Ved forsøg med mus og primater iagttoges infektive inhalationsdoser, der var ca. 1000 gange mindre end ved de orale doser (Crozier og Woodward 1962, Ivanott et al., 1979). Det vurderes derfor, at smitte af mennesker via luftvejene på det foreliggende grundlag ikke kan udelukkes. Inkubationstiden for salmonellose er oftest 1-3 døgn, men kan variere fra 6 timer op til 10 døgn. Symptomerne er typisk karakteriseret ved gastroenteritis, dvs. diarré, mavesmerter, feber, hovedpine, muskelsmerter, kvalme og opkast. Symptomerne aftager sædvanligvis efter 3-4 dage, men kan vare op til 10 dage. I få procent af tilfældene ses følgelidelser som blodforgiftning, hjertebetændelse, led- og knoglebetændelse, samt lokale betændelsestilstande i forskellige organer. I sjældne tilfælde ses dødsfald (D’Aoust, 1989; Miller et al., 1995). Som for en række af de øvrige zoonotiske tarminfektioner, regnes børn og ældre for at have en større risiko for at få en Salmonella infektion end en gennemsnitlig voksen person (D’Aoust, 1989). Det er ligeledes generelt accepteret, at personer med et svækket immunforsvar, som lider af en underliggende sygdom, som f.eks. kræft, AIDS eller ved kroniske lidelser i mave eller tarm, er mere modtagelige for infektion end personer med et almindeligt godt helbred (D’Aoust, 1989; Berends et al., 1998). Salmonellose er den næsthyppigste bakterielle zoonose i Danmark. I 2000 blev der registreret 2.344 tilfælde hos mennesker (Figur 1). Alle slagtesvinebesætninger undersøges rutinemæssigt for forekomst af Salmonella antistoffer, og andelen af højprævalente besætninger, dvs. besætninger placeret i niveau 2 og 3, lå ved udgangen af 1999 på ca. 3,1% (Anonym, 2000a). Der foregår ingen rutinemæssig overvågning af kvægbesætninger for Salmonella, men som led i den løbende resistensovervågning (DANMAP 99, 2000) undersøges en stikprøve af besætninger ved prøveudtagning af ét dyr pr. besætning i forbindelse med slagtning. Følsomheden af denne overvågning er derfor noget begrænset, og der blev ikke påvist Salmonella i nogle af de 230 undersøgte fæcesprøver fra kvæg i 1999 (Anonym, 2000a). En mere omfattende undersøgelse, hvor der blev udtaget 10 prøver pr. besætning, blev gennemført ved en screening i 1998. Af 265 kvægbesætninger og 2.328 svinebesætninger blev hhv. 15 (5,6%) og 266 (11,4%) besætninger fundet positive (Anonym, 1998).
Figur 1 2.1.2 CampylobacterMennesker smittes sædvanligvis peroralt (gennem munden) via kontaminerede fødevarer eller vand, og i sjældnere tilfælde ved person-til-person smitte. Den laveste infektive dosis for Campylobacter er ved forsøg med frivillige personer blevet bestemt til 500-800 bakterier, men vil under naturlige forhold antageligt variere betydeligt afhængig af værts- og patogenspecifikke faktorer, herunder de udsatte personers alder og almene helbredstilstand (Blaser, 1995; Altekruse et al., 1999). Inkubationstiden er normalt fra 1-3 døgn, men kan være op til 10 døgn. Oftest ses et akut sygdomsforløb med diarré evt. blodig, mavesmerter, opkast og feber. Sygdommen kan vare fra 1 døgn og op til flere uger. Følgesygdomme efter en Campylobacter infektion omfatter nervelidelsen Guillan Barré syndrom, som i USA menes at ramme 1 ud af hvert 1000 tilfælde. Også Reiter syndrom karakteriseret ved ledbetændelse m.v. (reaktiv arthritis) er sat i forbindelse med forudgående Campylobacter infektion (Patienter med Reiter syndrom bærer ofte vævstypen HLA B27) (Altekruse et al., 1999). I Danmark blev der i 2000 registreret 4.402 tilfælde af human campylobacteriose, og Campylobacter er dermed den hyppigst forekommende bakterielle zoonose hos mennesker (Figur 1). C. jejuni er den hyppigst forekommende type hos mennesker og udgør omkring 90% af det totale antal infektioner, mens C. coli udgør omkring 10%. Der foregår ingen rutinemæssig overvågning af kvæg- og svinebesætninger for Campylobacter, men som led i den løbende resistensovervågning blev der i 1999 fundet Campylobacter i hhv. 50% og 53,5% af undersøgte fæcesprøver fra kvæg- og svinebesætninger (Anonym, 2000a). De fleste infektioner hos kvæg skyldes C. jejuni, mens C. coli er langt den dominerende hos svin (ca. 90% af isolater). 2.1.3 Yersinia enterocoliticaMavetarmkanalen er i de fleste tilfælde indgangsporten for en Yersinia infektion. Den infektive dosis for Y. enterocolitica kendes ikke, men menes at være omkring 105 - 106 bakterier, men i lighed med hvad der er kendt fra andre tarmpatogene zoonoser, må der regnes med en betydelig variation afhængig af de udsatte personers immunologiske og sundhedsmæssige tilstand. Inkubationstiden varierer normalt fra 3 til 7 døgn, hvorefter de første symptomer optræder. Yersiniose manifesterer sig typisk som gastroenteritis. Sygdomsforløb og symptomer kan variere betydeligt fra et let maveonde til et svært og langvarigt forløb. Undertiden medfører sygdommen stærke smerter i nederste højre maveregion (fossa iliaca), således at symptomerne kan forveksles med blindtarmsbetændelse. Infektionen kan desuden være lokaliseret til andre organer end tarmen, og i enkelte tilfælde ses blodforgiftning. Hos nogle patienter opstår et sekundært sygdomskompleks der er præget af reaktioner fra især hud og bindevæv, herunder reaktiv arthritis. Som ved campylobacteriose er det karakteristisk, at det især er personer med vævstypen HLA-B27, der er udsat for disse følgelidelser (Kapperud, 1991; Butler, 1995). Antallet af Yersinia enterocolitica tilfælde i Danmark har været for nedadgående siden midten af 1980’erne (Figur 1). I 2000 blev der registreret 266 tilfælde, hvoraf hovedparten tilhørte serotype O:3. Størstedelen af danske svinebesætninger anses for inficerede med denne type (Anonym, 2000a). I en undersøgelse fra 1996 blev Y. enterocolitica O:3 isoleret fra 78% af 67 undersøgte svinebesætninger (Nielsen et al., 1996). Resultater fra resistensovervågningen i 1999 fandt imidlertid kun 16,4% positive besætninger ud af 193 undersøgte (Anonym, 2000a). Forskellen skyldes formentlig, at følsomheden af sidstnævnte overvågning er begrænset af, at der kun undersøges ét dyr pr. besætning. 2.1.4 Verotoksinproducerende E. coli (VTEC)Mennesker smittes sædvanligvis peroralt via kontaminerede fødevarer eller vand, og i sjældnere tilfælde ved person-til-person smitte. VTEC er en gruppe af E. coli bakterier, som producerer et toksin der er ansvarlig for en stor del af symptombilledet. Flere serotyper kan medføre infektion, men E. coli O157:H7 er en af de hyppigst forekommende. Denne serotype er specielt associeret med drøvtyggere. Der skal kun et lille antal E. coli O157:H7 til for at give sygdom. Den infektive dosis er angivet til mindre end 100 bakterier (Riemann and Cliver, 1998). Inkubationstiden er 3 til 9 dage, hvorefter der opstår symptomer varierende fra mild diarré til alvorlig blodig tyktarmsbetændelse (hæmorrhagisk colitis). Normalt medfører sygdommen ingen eller kun let feber, og går for det meste over i løbet af 5 til 10 dage. I sjældnere tilfælde og oftest hos børn under 5 år og ældre kan der opstå komplikationer i form af skade på nyrer evt. med akut nyresvigt (Hæmolytisk Uræmisk Syndrom). Også skader på centralnervesystem eller nedsat blod koagulationsevne (Trombotisk Trombocytopenisk Purpura) kan ses i forbindelse med VTEC infektioner (Mead and Griffin, 1998). Der blev i 2000 registreret 60 humane VTEC infektioner, hvoraf 18 tilfælde var forårsaget af E. coli O157. Sammenlignet med andre lande er forekomsten af zoonotiske E. coli infektioner i Danmark lav. Forekomsten af E. coli O157 undersøges i forbindelse med den løbende resistensovervågning. I 1999 blev denne serotype isoleret fra 7 (3,3%) af 227 undersøgte fæcesprøver fra kvæg. Derudover blev der i efteråret 1999 foretaget en screening af 60 kvægbesætninger i Kongeåområdet. E. coli O157 blev isoleret fra 10 (17%) af disse besætninger. I de positive besætninger udskilte i gennemsnit 20,8% af kreaturerne E. coli O157 med fæces (Anonym, 2000a). 2.1.5 Antibiotikaresistente bakterierMange bakterier, som forekommer i tarmen hos dyr og mennesker, herunder de ovennævnte humanpatogene bakterier, kan være resistente overfor et eller flere antibiotika. De gener, som koder for antibiotikaresistens kan sidde på bakteriens kromosom eller på ekstrakromosomalt DNA, som f.eks. plasmider og bakteriofager. Plasmider kan ved konjugation overføres mellem bakterier, mens bakteriofag medieret resistensoverførsel sker ved transduktion. Overførslen er mest effektiv mellem bakterier af samme art, men kan også ske på tværs af arter. Overførsel af bakterier fra det animalske reservoir til mennesker via f.eks. fødevarer, vand eller gylle, vil derfor også kunne medføre overførsel af antibiotikaresistente bakterier. Disse kan i sig selv være sygdomsfremkaldende for mennesker (f.eks. S. Typhimurium DT104), men muligheden for overførsel af resistensgener til patogener i det humane reservoir foreligger også. Enterokokker er en gruppe af bakterier, som forekommer naturligt i tarmen hos varmblodede dyr inklusiv mennesker, og deres tilstedeværelse i f.eks. fødevarer kan indikere, at disse har været udsat for fækal forurening. I langt de fleste tilfælde er enterokokker apatogene for mennesker, men sygdom kan forekomme specielt i hospitalsmiljøer, hvor enterokokkerne ofte er resistente (Low et al., 1994; Linden et al., 1999). Danske undersøgelser tyder desuden på, at enterokokker kan spille en rolle i overførslen af resistensgener fra det animalske reservoir til mennesker (Wegener et al., 1999). Infektioner med antibiotikaresistente bakterier hos mennesker er uønskede, da det kan føre til behandlingssvigt (se f.eks. Mølbak et al., 1999). Desuden er der indikationer for, at risikoen for infektioner med resistente bakterier er forøget hos personer, som i forvejen er i antibiotisk behandling for en anden infektion (Glynn et al., 1998). Forekomsten af antibiotikaresistente bakterier (zoonoser, specifikke dyrepatogene og indikator bakterier) i produktionsdyr, levnedsmidler af animalsk oprindelse og mennesker i Danmark er beskrevet i DANMAP 99 (2000). 2.2 Beskrivelse af parasitterParasitære infektioner kan overordnet deles i protozoer og orme, hvor protozoerne indeholder de encellede organismer og ormene (cestoder, nematoder og trematoder) de flercellede. De fleste parasitære tarminfektioner diagnosticeres hos hjemvendte rejsende. 2.2.1 Cryptosporidium parvumC. parvum er en encellet parasit, dvs. en protozo og en betydningsfuld årsag til gastroenteritis hos både dyr og mennesker. Indtil for nylig er C. parvum blevet anset som den eneste art af Cryptosporidium. Da denne art forekommer hos såvel dyr og mennesker, blev C. parvum desuden regnet for at være zoonotisk. Nyere undersøgelser har imidlertid vist, at C. parvum omfatter mindst to genotyper (Caccio et al., 2000). Medens genotype 1 ser ud til at være specifik for mennesker, har genotype 2 et bredt værtsspektrum (zoonose) og forekommer hos både mennesker og adskillige pattedyrarter. Der foreligger kun få referencer vedr. fordelingen af de to genotyper hos mennesker, men i Europa tyder det på, at omkring 40-50% af human cryptosporidiose skyldes genotype 1; de resterende genotype 2. I en stor engelsk undersøgelse publiceret i 2000, blev genotype 2 isoleret fra 61,5% af 1.705 fæcesprøver fra mennesker med cryptosporidiose, mens genotype 1 blev isoleret fra 37,8% af prøverne. I fæcesprøver fra husdyr tilhørte samtlige isolater genotype 2 (McLauchlin et al., 2000). Cryptosporidiers livscyklus starter ved, at et menneske eller dyr indtager det infektive stadie, oocysten. Efter indtagelse frigiver oocysten de såkaldte sporozoiter, som efterfølgende invaderer epitelcellerne i tarmen hvori der sker en intracellulær, ekstracytoplasmatisk udvikling bestående af flere ukønnede (schizogeni) og en kønnet (gametogeni) formering. Livscyklus afsluttes med frigivelse af oocyster til tarmlumen. Oocysterne er infektive umiddelbart efter udskillelse med fæces, og overførsel af smitte kan ske fra person til person, fra dyr til person, ved indtagelse af fækalt forurenede fødevarer eller vand, eller ved kontakt med fækalt kontaminerede overflader såsom marker eller græsarealer. Flere udbrud i udlandet, opstået efter badning i kontaminerede vandløb eller indtagelse af forurenet vand er beskrevet (McAnulty et al., 1994; Kramer et al., 1998; Willocks et al., 1998; Barwick et al., 2000; Anonymous, 2000b; McLauchlin et al., 2000; Slifko et al., 2000). Oocysterne kan desuden overleve udenfor en vært i op til 6 måneder i koldt og fugtigt klima (Miller and Paige, 1998). Infektionsdosis er lille, normalt 10 - 100 oocyster. Cryptosporidiose giver typisk vandig diarré med mavesmerter, som hos børn kan indledes med madlede og opkast. Hos voksne ses kun sjældent feber, kvalme, madlede og opkast. Inkubationsperioden varierer fra 1 til 12 dage med et gennemsnit på 7 dage. Varigheden er normalt 1-2 uger. Alvorlige og livstruende infektioner, som bl.a. kan involvere ekstraintestinale organer som f.eks. lunger, kan forekomme hos immunsvækkede personer. Human cryptosporidiose er ikke anmeldepligtig i Danmark, dog er praktiserende læger og hospitaler forpligtiget til at indrapportere alle sygdomstilfælde som mistænkes for at være fødevarebårne. Der diagnosticeres årligt omkring 180 tilfælde af cryptosporidiose, hvoraf hovedparten (ca. 80%) antages at være rejserelaterede. Der foregår ingen rutineovervågning af C. parvum i husdyr, og der foreligger p.t. ingen tal for fordelingen af genotyper hos mennesker og dyr. Antallet af diagnosticerede tilfælde af C. parvum hos husdyr i 1997 er angivet i Tabel1 . Tabel 1
Kilde: Heidi Larsen Enemark, Statens Veterinære Serumlaboratorium. 2.2.2 Giardia intestinalis (~duodenalis)Giardiasis forårsages af protozoen Giardia intestinalis. Selvom parasitten, som isoleres fra husdyr (katte, hunde og kvæg) og vilde dyr (bævere og bjørne) er identisk med den, som findes hos mennesker, regnes mennesket for at være hovedreservoiret. Det animalske reservoir udgør dog en potentiel smittekilde. Smitten sker som regel ved indtagelse af vand, sjældnere fødevarer, der er fækalt kontaminerede med cyster fra inficerede personer. Cysterne kan overleve i vand i op til 2 måneder. Infektionsdosen er meget lav, under 100 cyster, og man regner med at én cyste kan være sygdomsfremkaldende (Acha og Szyfres, 1987). Ved Giardia infektion beskrives afføringen ofte som voluminøs, grønlig, skummende og der kan være op til 10 til 12 diarréer dagligt eventuelt ledsaget af kvalme og mavesmerter. Inkubationstiden er normalt 7-10 dage, men kan variere fra 3 – 25 døgn. Sædvanligvis varer sygdommen 1-2 uger, men kroniske tilfælde med en varighed på måneder eller år forekommer også. I Danmark blev der i 1997 diagnosticeret omkring 1.500 human infektioner. Det anslås at omkring 80% af disse var erhvervet i udlandet. Der er ikke foretaget nogle større epidemiologiske undersøgelser til belysning af forekomsten hos husdyr. 2.2.3 AscarisA. lumbricoides har mennesket som hovedvært, mens A. suum primært findes hos svin. Stort set alle rapporterede tilfælde af human ascariasis i Danmark skyldes A. lumbricoides, og hovedparten er importerede. Smitten sker normalt ved indtagelse af fækalt forurenet vand eller grøntsager, eller ved direkte kontakt med forurenet jord eller andet materiale hvortil æggene klæber sig fast. Infektionsvejen er oftest peroral (gennem munden), men der er indikationer på at inhalation af æg også kan medføre infektion (Acha og Szyfres, 1987). Efter at have slugt Ascaris æg, klækkes disse og larverne trænger ind i mave-tarm slimhinden og vandrer til lungerne. Larverne bevæger sig derefter ud i luftvejene, hvor de hostes op og sluges. I tyndtarmen udvikles de til voksne orm, der kan blive 10 - 15 cm lange. Vævsfasen er ofte asymptomatisk, men ved en massiv infektion kan ses lungesymptomer som hoste. Efter udskillelse af æggene i fæces går der 2 eller flere uger før disse har udviklet sig til deres infektive stadie. Æggene er ekstremt resistente overfor såvel fysiske som kemiske forhold, og kan overleve flere år i jord (Barriga, 1982). Mennesker kan også inficeres med A. suum, om end disse infektioner antages at være sjældent forekommende. A. suum larver kan hos mennesker gennemføre vandringer gennem lever og lunge, men de kan ikke opnå kønsmodenhed i tarmen. A. suum er en af de hyppigst forekommende ormeinfektioner i svinebesætninger i Danmark. 2.3 Beskrivelse af virusI modsætning til de fleste ovennævnte bakterier og parasitter er de humane gastrointestinale vira, som f.eks. Norwalk-lignende virus og Hepatitis A, ikke zoonotiske. Fødevarebårne virusinfektioner skyldes derfor altid levnedsmidler eller vand forurenet med humane fækalier eller opkast (Myrmel, 1994). Omvendt er zoonotiske vira som f.eks. rabies, hantavirus og herpesvirus ikke fødevarebårne, men smitter ved direkte kontakt med det animalske reservoir via aerosoler eller ved introduktion direkte i blodbanen. Visse zoonotiske vira er insektbårne f.eks. West Nile fever. Under danske forhold kendes der p.t. ingen praktisk relevante humanpatogene vira, som kan tænkes at blive spredt med gylle fra danske husdyrbesætninger. Derimod er der en række betydningsfulde virusinfektioner hos husdyr, der kan spredes med gylle, og som har store økonomiske konsekvenser for såvel den enkelte landmand som den danske landsbrugseksport. Gylle kan naturligvis indeholde virus som findes i mave-tarmkanalen og udskilles gennem fæces, men da gyllen imidlertid også tilføres sekreter fra f.eks. øjne og luftveje vil virus udskilt i sådanne sekreter ligeledes kunne findes i den ubehandlede gylle. Der er derfor en potentiel risiko for at mange forskellige virus kan forekomme i gylle, heriblandt virus som giver anledning til ondartede smitsomme husdyrsygdomme. Forekomsten af forskellige virus i fæces, sekreter og blod er beskrevet af Sellers (1980)
Massiv forekomst i fæces |
Virus der ikke udskilles i fæces |
2.4 Forekomst af bakterier i gylleDette afsnit beskriver de bakterier der forekommer i gylle under danske forhold. I Tabel 2 er beskrevet patogene agens, der kan forekomme i husdyrgødning. Tabel 2
* Munch et al 1987 (undersøgelse af 1230 gylleprøver fra 322 danske husdyrbesætninger med eller uden forud diagnosticeret klinisk salmonellose) Tabel 3
* VET-BIO-2 Det bør bemærkes at undersøgelser af gylle fra danske besætninger uden kliniske symptomer viste, at Salmonella i perioden 1976-86 kunne påvises i ca. 12 % af kvægbesætningerne (34/282) og i ca. 28% af svinebesætningerne (9/32). I samme undersøgelse påvistes Mycobacterium paratuberculosis i 13% af kvæggylleprøverne (16/125). I forbindelse med den veterinære miljøforskning på SVS (Sengeløv, 2000) har man talt totalkim (cfu/ml) i gylle på henholdsvis LB- og blodplader, samt talt antallet af tetracyclin og streptomycin resistente kim (cfu/ml). Gennemsnittet på LB var 3,8 107 cfu/ml og på blod 3,8 107 cfu/ml. Andelen af tetracyclin resistente varierede fra 2% til 82% . Der blev i forbindelse med tema 3 under Aktionsplanen til fremme af økologisk byfornyelse og spildevandsrensning udtaget gylleprøver fra 5 tilfældigt udvalgte svinebesætninger og 5 tilfældigt udvalgte kvægbesætninger. Disse gylleprøver blev analyseret for antal total kim, coliforme, enterokokker, Campylobacter samt Salmonella pr. ml. Resultatet er angivet i Tabel 5.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. | Arten (species) af den pågældende mikroorganisme |
| 2. | Begyndelsekimtallet (jo større initialkoncentration desto længere overleven) |
| 3. | Omgivelsernes temperatur (længere overlevelse ved lave temperaturer end ved høje) |
| 4. | Vandaktivitet (længere overlevelse ved lav vandaktivitet end ved høj, forudsat der ikke er opformeringsmulighed) |
| 5. | Tørstofindhold (længere overlevelse ved høj tørstofprocent end lav) |
| 6. | pH (længere overlevelse ved pH 6-8 end ved lavere og højere værdier) |
| 7. | Redoxpotentiale (Eh), (længere overlevelse under anaerobe forhold end under aerobe forhold) |
| 8. | Biocider (bakteriedræbende) stoffer |
| 9. | Mikrobielle antagonister |
| 10. | Ultraviolet lys. |
I Tabel 6 er angivet decimeringstider for udvalgte bakterier
Tabel 6
Aerobe decimeringstider (T90 for gennemsnit) for patogene bakterier og
indikatorbakterier i gylle, efter Larsen og Munch (1981) , Olsen et al (1985) og Olsen et
al 1985(2)).
Bakterier |
T90 (uger) ved 18-21° C |
T90 (uger) ved 6-15° C |
Salmonella Typhimurium |
2,0 |
5,9 |
Escherichia coli |
2,0 |
8,8 |
Clostridium perfringens type C |
Ingen reduktion |
Ingen reduktion |
Staphylococcus aureus |
0,9 |
7,1 |
Coliforme bakterier |
2,1 |
9,3 |
Gruppe D-streptokokker |
5,7 |
21,4 |
Bacillus cereus |
Ingen reduktion ved 53° C |
|
Det bemærkes at der ikke er nogen reduktion i sporulerende bakterier.
Amerikanske undersøgelser (Himathongkham 1999) af overlevelse af E. coli O157:H7 og S. Typhimurium i kvæg-mødding og kvæg-gylle fandt decimeringstider fra 2 dage (37 °C) til 5 uger (4 °C).
Undersøgelser af decimeringstider for bakterier fra gylle spredt på græsmark
Tabel 7
T90 værdier (døgn) for bakteriehenfald i gylle spredt på græsmark
(forsøgsperiode aug-nov. 1980, (Schlundt 1982))
|
Græszone |
|||
|
Nederst (0-8 cm) |
Midte (8-16 cm) |
Øverst >16 cm |
Gennemsnit |
Salmonella Typhimurium |
24 |
19 |
18 |
20 |
Escherichia coli |
19 |
13 |
9 |
14 |
Streptoccoccus faecalis |
20 |
20 |
13 |
17 |
Den veterinære miljøforskning på SVS genfinder Salmonella i op til 15 dage efter
gyllespredning på marker (Boloda, 2000).
2.5 Forekomst af virus i gylle
Der er ikke foretaget mange analyser af antallet af virus partikler i gylle. Derbyshire og Brown (1978) undersøgte 32 svinegylleprøver og 18 kvæggylleprøver, samt prøver fra miljøet efter gyllespredning. Titrering af 3 prøver gav 104,7 , 105,0 og 105,5 TCID50 pr. liter gylle (median tissue culture infectious dose).
Inaktivering i gylle af udvalgte vira er beskrevet i Tabel 8.
Tabel 8
Inaktiveringstider for animalske vira i gylle ved forskellige opbevaringstemperaturer
(Bøttner 1990)
Virus |
Gødningstype |
5°
C |
20° C |
Svine-influenza |
Svinegylle |
9 |
2 uger |
Porcint parvovirus |
Svinegylle |
> 40 |
> 40 uger |
Bovin virusdiarrhoe |
Kvæggylle |
3 |
3 dage |
IBR hos kvæg |
Kvæggylle |
> 4 |
2 dage |
Aujeszky’s sygdom |
Svinegylle |
15 |
2 uger |
Mund- og klovsyge Svin |
Svinegylle |
> 14 |
2 uger |
Mund- og klovsyge Kvæg |
Kvæggylle |
i.u. |
5 uger |
Klassisk svinepest |
Svinegylle |
> 6 |
2 uger |
TGE hos svin |
Svinegylle |
> 8 |
2 uger |
2.6 Forekomst af parasitter i gylle
Parasitter er organismer, der er afhængige af en vært for at kunne reproducere sig og de har ofte betydelig værtsspecificitet.
Der blev i forbindelse med tema 3 under Aktionsplanen til fremme af økologisk byfornyelse og spildevandsrensning udtaget gylleprøver fra 5 tilfældigt udvalgte svinebesætninger og 5 tilfældigt udvalgte kvægbesætninger. Disse gylleprøver blev analyseret for en række parasitter, resultatet er angivet i Tabel 9.
Tabel 9
Undersøgelse af gylle prøver fra 5 tilfældigt udvalgte svinebesætninger og 5
tilfældigt udvalgte kvægbesætninger (IP=Ikke Påvist) (MST 2000)
|
Svin |
Svin |
Kvæg |
Svin |
Svin |
Svin |
Kvæg |
Kvæg |
Kvæg |
Kvæg |
Cryptospo- |
200 |
0 |
0 |
100 |
0 |
100 |
100 |
0 |
100 |
0 |
Giardia |
300 |
100 |
0 |
100 |
0 |
100 |
100 |
100 |
100 |
0 |
Eimeria |
IP |
IP |
30 æg/gr |
IP |
IP |
IP |
5 æg/gr |
IP |
30 æg/gr |
IP |
Ascaris æg |
IP |
IP |
IP |
15 æg/gr |
10 æg/gr |
IP |
IP |
15 æg/gr |
IP |
IP |
Trådorm |
IP |
IP |
IP |
IP |
IP |
5 æg/gr |
IP |
IP |
IP |
IP |
Toxocara |
IP |
IP |
IP |
IP |
IP |
IP |
IP |
IP |
IP |
IP |
Strongylide- |
IP |
IP |
IP |
IP |
IP |
IP |
IP |
IP |
5 æg/gr |
IP |
Piskeorm |
IP |
IP |
IP |
IP |
IP |
IP |
IP |
IP |
5 |
IP |
Giardia ikke artsbestemt, De fleste vil nok være G. intestinalis, men da der ikke
er blevet lavet nogle større epidemiologiske undersøgelser i DK over forekomsten af
Giardia hos husdyr, er det kun en formodning. Cryptosporidium er alle C. parvum (H.
Enemark personlig meddelelse).
Æg, larver, og cyster overlever generelt længe udenfor en vært. I Tabel 10 er angivet overlevelsestider for en række parasitter.
Tabel 10
Overlevelse af parasitter i gylle (ref LRC 1994, efter Olsen et al (1985))
|
100 % drab, antal uger |
||
|
Fast gødning |
Gylle (anaerob) |
|
Parasitter (æg eller larver) |
(aerob) 50° C |
8° C |
18° C |
Løbetarmsspongolider |
1 |
9 |
4 |
Lungeorm (D.viv.) |
2 |
6 |
3 |
Leverikte (F.hep.) |
2 |
11 |
8 |
Ascaris/Spoleorm(A.suum) |
3 |
13 |
13 |
Smitterisici ved parasitter
- Infektive dosis er lav
- Overlevelse i naturen er generelt høj
Der er ikke fundet nogen referencer på antal Ascaris suum i gylle, men Nilsson (1982) beskriver bla. overlevelsen i grise-urin. Hvis æggene inden 3 måneder overføres fra urinen til vand genoptager de udviklingen, men ligger de i urinen mere end 3 måneder dør de.