Dermal absorption af bekæmpelsesmidler - Evaluering af årsager til variation samt forebyggelsesmuligheder
3 Metoder til at studere hudpenetration
Gennem de seneste årtier har metoder til at standardisere og validere eksperimentelle modeller for hudpenetration fået meget opmærksomhed. Der eksisterer både in vitro- og in vivo-metoder, og hver metode har fordele og ulemper. Derfor accepterer OECD også flere forskellige metoder i deres guidelines.
I 2004 lavede OECD guidelines for testning af kemikalier via in vitro-metoder. Standardprincipperne blev beskrevet ved brugen af enten statiske diffusionsceller eller flow-through celler. I begge metoder påføres teststoffet til hudoverfladen – som adskiller donorkammer fra receptorkammer – og mængden af penetreret stof måles i receptorkammeret over tid (OECD, 2004).
3.1 In vitro modeller
3.1.1 Statisk diffusionscelle
I 1975 udviklede Franz den statiske diffusionscelle (figur 3), som nu er en af de mest brugte in vitro-modeller, når det gælder forskning inden for hudpenetration. Modellen har et simpelt design og er billig i drift. Der kan bruges human- eller dyrehud samt fuldhud eller delhud. Teststoffet tilsættes donorkammeret. Stoffet passerer gennem huden, der ligger på et metalgitter mellem donor- og receptorkammer. I receptorkammeret optages stoffet i en receptorvæske, hvor man vha. magnetomrøring undgår koncentrationsgradienter i væsken. Receptorkammeret står i et 37º grader varmt vandbad, der sikrer en temperatur på hudens overflade svarende til de omkring 32º på normal hud.

Figur 3: Statisk diffusionscelle.
3.1.2 Flow-through-celle
En anden in vitro-model er ”flow-through cellen” (figur 4), der ligesom den statiske diffusionscelle kan bruges med både human hud, dyrehud, fuldhud og delhud. Cellen er specielt velegnet til at bestemme reservoireffekten (Bronaugh & Stewart, 1985a). Den består af et donorkammer, hvori teststoffet tilsættes. Derefter passerer stoffet gennem huden til receptorkammeret. I receptorkammeret løber en opsamlingsvæske med konstant hastighed. Denne væske kan sammenlignes med blodstrømmen i en blodåre.
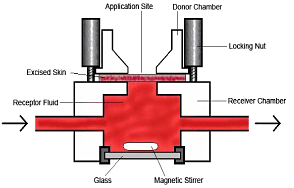
Figur 4: Flow-through cellen (Tilladelse til brug af skitsen fra Dr. Wilkinson SC, University of Newcastle).
3.2 In vivo modeller
In vivo studier er baserede på fysiologisk og metabolisk intakte systemer. Der er to slags in vivo studier: 1) dyre studier eller 2) humane studier. Det mest anvendte dyr er rotten, selvom studier har vist, at man ved brug af dette dyr ofte overestimerer human hudabsorption, men valget af et andet forsøgsdyr forøger omkostningen ved forsøget (ECETOC, 1993).
I 2004 vedtog OECD guidelines for afprøvning af kemikalier via in vivo-metoder. Standardprincipperne blev beskrevet som applikation af teststoffet på huden i den korrekte applikationsform og det rette tidsrum. Endvidere beskriver guidelines prøvetagning af forskellige kropsvæsker eller væv med specifikke intervaller samt kvantificering af teststofferne eller deres metabolitter med en tilpas sensitiv analysemetode.
3.2.1 Traditionel metode
Ved den traditionelle metode appliceres teststoffet til huden af raske frivillige forsøgspersoner, hvorefter blod og/eller urin opsamles og analyseres. Mængden af teststof, der findes i blodet/urinen, giver en god indikation af den mængde stof, der er absorberet gennem huden til den systemiske cirkulation. Denne metode har været brugt, før alle andre teknikker blev udviklet, og bruges stadig, hvor der ikke er væsentlig risiko for de frivillige forsøgspersoner (Lammers JHCM et al., 2005; Nohynek et al., 2006; Hueber-Becker et al., 2007). Ofte er risici dog ukendt, hvilket i forsøgsøjemed gør det etisk bekymrende at bruge forsøgspersoner.
3.2.2 Microdialyse
Microdialyseteknikken er brugt klinisk i mange år til kontinuerlig måling af fx ilttension i transplanteret væv såvel som i forskning, hvor fremmedstoffers kinetik kan følges. Det er den eneste teknik, der kan opsamle endogene/eksogene substanser i det ekstracellulære rum i levende væv, og den er derfor vigtig ved undersøgelser af farmakologiske og biokemiske processer i væv. Denne type data kan give vigtig information i bestemmelsen af farmakokinetiske samt farmakodynamiske forhold for forskellige stoffer og kan derigennem give en bedre beskrivelse af eksponeringsrisici (Chaurasia et al., 2007).
Principperne ved microdialyse er, at proben imiterer et blodkar i dermis (figur 5). Teststoffet tilføres hudoverfladen, hvorefter det penetrerer til dermis, hvor proben ligger. Proben består af en semi-permeabel struktur, hvorigennem molekyler kan passere til perfusatet, der løber igennem proben til et opsamlingsglas. Molekylerne diffunderer over membranen grundet koncentrationsgradienten, der opstår, når perfusatet pumpes gennem proben med en konstant og meget præcis hastighed. Perfusatet indeholdende molekyler af teststof kaldes nu for dialysatet. Dialysatet opsamles til videre analyse. Teknikken har været brugt i såvel humane undersøgelser som i dyreforsøg (Groth, 1996; Benfeldt & Serup, 1999; Benfeldt et al., 2007).
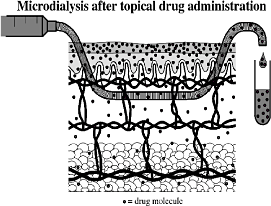
Figur 5: Microdialyse. Proben beliggende i dermis. (Benfeldt & Serup, 1999)
3.2.3 Tape-stripping
Tape-stripping er en velkendt in vivo-metode, som også bruges in vitro. Teststoffet (ofte radioaktivt mærket) penetrerer et forudbestemt område af huden over et bestemt tidsinterval. Derefter vaskes huden skånsomt for at fjerne eventuelle uabsorberede rester på hudoverfladen. Endeligt fjernes hudens tynde lag af eksponeret stratum corneum ved gentagne påsætninger og fjernelser af tapestykker. De fjernede celler på tapen kan derefter analyseres med en egnet analysemetode. Metoden er billig at anvende og minimal invasiv, såfremt kun døde hudceller fjernes, men har også visse metodemæssige begrænsninger.
I dermato-farmakologien bruges tape-stripping til at fremskaffe information om lægemidler appliceret på huden. Tape-stripping er en speciel nyttig teknik, når det gælder studier om lokal biotilgængelighed af præparater med effekt i hudens øverste lag, som fx antibiotika (Lboutounne et al., 2002) , svampemidler (Alberti et al., 2001) eller UVA/UVB filtre (Fernandez et al., 2002; Wissing & Muller, 2002; Jacobi et al., 2004; Sarveiya et al., 2004).
De forskellige metoder har hver deres fordele og ulemper (uddybet i den engelsksprogede rapport) og bør benyttes alt efter formål.
Version 1.0 Maj 2009, © Miljøstyrelsen.