Påvisning af patogene bakterier i vand ved anvendelse af DNA-chip-prototype og mikrobiologiske dyrkningsmetoder
4 Prøveforberedelse til DNA-chip-analyse
Første trin i prøveforbehandling er ekstraktion af DNA i en form, som gør det muligt at gennemføre en PCR- og DNA-chip-analyse. Til lysering af bakterier anvendes tilsætning af 0.006N NaOH og varmebehandling ved 95°C. Den lyserede prøve kan anvendes direkte til PCR, dvs. der undgås et tidskrævende DNA-oprensningstrin, hvor der kan mistes udgangsmateriale undervejs. I denne undersøgelse er den ovenfor nævnte lyseringsmetode anvendt til lysis af cellerne i alle prøver, og prøverne er herefter direkte anvendt til PCR opformering af ribosomalt DNA efterfulgt af DNA-chip-analyse, jf. figur 3.
Figur 3: Flow-diagram over prøveforbehandling til DNA-chip-analyse af hhv. suspensionsprøver og filtermateriale fra spikede vandprøver.
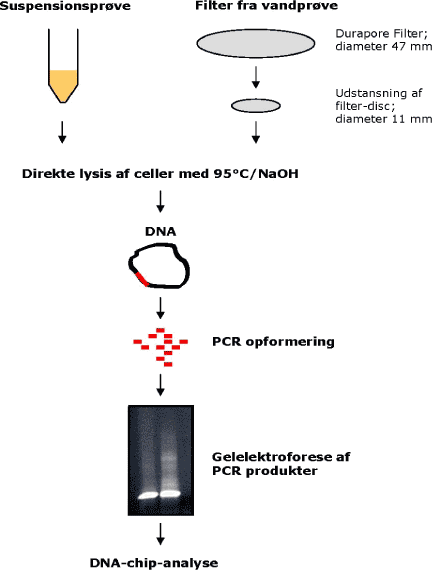
Som det fremgår af figur 3 verificeres PCR-produkterne ved agarosegel-elektroforese før DNA-chip-analyse.
Til analyse af ”vandprøverne” (sterilt vand spiket med blanding A, C og A+C) blev der indledningsvist testet 4 forskellige prøveforbehandlingsmetoder, idet DNA-chip-analysen ikke tidligere har været testet med et filter som prøvemateriale, hvor filterdiameteren var større end 1 cm. Resultaterne af disse indledende tests viste, at den mest effektive prøveforbehandlingsteknik var direkte lysis af cellerne på filteret med 95°C/0.006N NaOH, hvilket i praksis blev testet ved udstansning af en mindre filterdisc, som herefter kunne anvendes til lysis og PCR (figur 3).
Ulempen ved denne fremgangsmåde er, at der kun analyseres på et mindre areal af filteret: Filter-disc (11 mm) udgør 7,6% af totalt filterareal (diameter estimeret til 40 mm, når filterkanten uden påsat prøve er klippet fra), hvilket giver et tab i analysens følsomhed.
Version 1.0 December 2006, © Miljøstyrelsen.