|
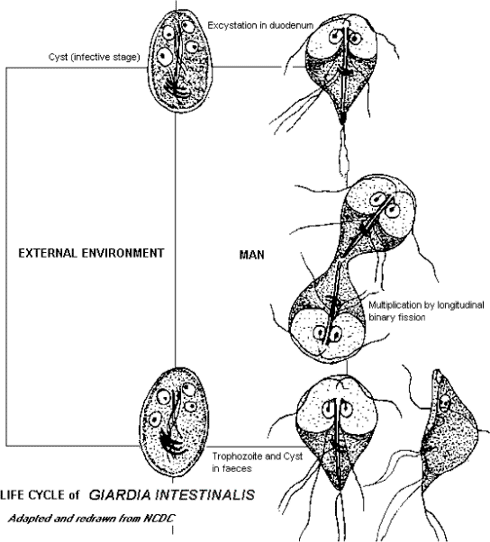
Risikovurdering af Giardia og Cryptosporidium i vand 3 Beskrivelse af protozoerne3.1 Giardia intestinalis3.1.1 Basal biologi3.1.1.1 MorfologiGiardia forekommer i to stadier: trofozoit- og cystestadiet (hvilestadiet) – se figur 3-1. G. intestinalis trofozoiter er pæreformede, 12-15 µm lange og 5-9 µm brede. Celleskelettet indeholder et midterlegeme, fire par flagellater og en slags sugekop (ventral disk), hvormed protozoen hæfter sig til tarmepitelet. Trofozoiterne er forsynet med to cellekerner, lysosomale vakuoler samt ribosomale og glykogen-granula. Cystedannelse sker efter replikation af cellekernerne. Cysterne indeholder fire cellekerner, er cirka 5-10 µm i diameter og er dækket af en 0,3-0,5 µm tyk væg. Den ydre del er belagt med et net af tråde. Cysternes metabolisme er kun 10-20% af trofozoiternes, hvilket gør at cysterne er stabile i miljøet. Figur 3-1 Livscyklus for Giardia intestinalis (http://www.cdfound.to.it/html/gia1c.htm)
3.1.1.2 Klassifikation og taksonomiGiardia blev, som den første human-patogene protozo, opdaget af Antony van Leeuwenhoek i 1659. Organismerne blev senere beskrevet af Lambl i 1859 og kom derfor til at hedde Giardia lamblia. Denne art er dominerende hos mennesker. Giardia hører til ordenen Diplomonadida og klassen Zoomastigophorea. Artsbetegnelsen har været diskuteret og ændret flere gange. For tiden anvendes Giardia duodenalis, som oprindeligt blev forslået af Filice (1952) samt Giardia intestinalis. Sidstnævnte betegnelse benyttes i denne rapport, men synonymet G. lamblia bliver stadig brugt af mange, især indenfor det humanmedicinske område. Antallet af Giardia-arter er stadig uafklaret. Artsnavne er oprindeligt blevet foreslået på baggrund af henholdsvis vært og morfologiske karakteristika. Der er for eksempel foreslået mere end 40 artsnavne på baggrund af artens vært. For tiden er seks artsnavne accepterede (se tabel 3-1), men kun G. intestinalis inficerer mennesker og andre pattedyr (Thompson, 2000). Arterne kan delvist skelnes ud fra morfologiske kriterier. Tabel 3-1 Klassifikation af Giardia (efter Adam, 2001 og Thompson, 2000)
Med henblik på differentiering af Giardia-isolater er molekylære studier af f.eks. ”small-subunit rRNA”, (tim-gener), og glutamat dehydrogenase (GDH)-generne blevet anvendt i stigende omfang. Disse undersøgelser har alle bekræftet delingen af G. intestinalis i to overordnede genotyper (se tabel 3-2), nemlig gruppe A (1 & 2) og gruppe B (3). Der er sandsynligvis en række biologiske forskelle imellem disse grupper. For eksempel har et enkelt studie vist, at isolater fra gruppe 3 var signifikant mere patogene end isolater fra gruppe 1 over for frivillige forsøgspersoner, der blev eksperimentelt inficeret. (Nash et al., 1987) Udover de nævnte genotyper hos mennesker er der foreslået en række andre genotyper/ grupper, som foreløbigt kun er blevet påvist hos dyr. F.eks. er der hos hunde identificeret en genotype, der er genetisk forskellig fra G. intestinalis, men som indtil videre ikke har vist zoonotisk potentiale (dvs. at der ikke er fundet tegn på, at hundens genotype kan overføres til mennesker). Ligeledes er der foreslået separate grupper (genotyper E til G) for hovdyr, katte og rotter (se tabel 3.2). Undersøgelse af Giardia fra kalve har vist, at nogle isolater tilhører produktionsdyr-gruppen (gruppe E), mens andre tilhører gruppe A (genotype 1), som kan smitte mennesker. Gruppe C til G er endnu ikke fundet hos immunkompetente mennesker, hvilket tyder på at nogle genotyper af G. intestinalis har et bredt værtsspektrum, mens andre er mere værtsspecifikke og således ikke udgør en zoonotisk risiko. Molekylære epidemiologiske data med hensyn til forekomst og udbredelse af de forskellige grupper foreligger kun i begrænset omfang. Yderligere studier er derfor nødvendige før det kan afgøres, om disse syv grupper bør anses for at være separate arter. Giardiasis hos kvæg, især kalve, kan være forårsaget af to forskellige genotyper, hvoraf den ene kan give anledning til infektion hos mennesker. Selvom produktionsdyrs-genotypen tilsyneladende er den mest almindelige hos kvæg, viser besætningsundersøgelser fra Canada og Australien, at en mindre gruppe (<20%) kreaturer kan være smittet med Giardia – genotyper fra den zoonotiske gruppe A (O'Handley, 2000). Tabel 3-2 Genotyper af G. intestinalis
3.1.1.3 LivscyklusSmitte sker ved oral optagelse af cyster, som udskilles med fækalier fra værten. Efter optagelsen excysterer cysterne (dvs. cysterne brister og frigiver trofozoiterne) i den forreste del af tyndtarmen, hvorefter trofozoiterne sætter sig fast på tarmepitelet ved hjælp af sugekoppen og forårsager en betændelsestilstand med diarré og hæmmet optagelse af næringsstoffer. Trofozoiterne multipliceres ved binær fission (længdedeling) afhængigt af næringsstofferne i det omgivende miljø. Giardia kan udskilles via fækalier som trofozoiter, eller encysteres hvis de påvirkes af galdesalte og udskilles som cyster. Mens trofozoiterne hurtigt går til grunde uden for værten, er cysterne relativt resistente over for miljøpåvirkninger herunder kloring, og kan overleve længe i kølige, fugtige omgivelser. Mennesker udskiller 105-107 cyster pr. g fækalie (Fechem et al., 1983) og udskillelsen sker i op til 41 dage, dog i sjældne tilfælde op til flere år for børn (Anonym, 2003). 3.1.2 Kliniske symptomer hos menneskerForløbet kan være asymptomatisk, akut eller kronisk. Akut giardiasis udvikler sig efter en inkubationsperiode på fem til seks dage og varer sædvanligvis en til tre uger. Symptomerne inkluderer diarré, opkastning, karakteristisk lugtende afføring, mavesmerter, opsvulmethed, vægttab, kvalme, træthed, appetitløshed og kuldegysninger. Ved kronisk giardiasis er symptomerne tilbagevendende og kvalme samt svækkelse kan forekomme. Selvom giardiasis er kendetegnet ved diarré, ses asymptomatiske infektioner (Lengerich et al., 1994) specielt hos børn samt tidligere inficerede personer (Ortega & Adam, 1997). Giardia cyster kan udskilles periodisk i uger eller måneder, hvorfor inficerede individer kan udgøre en smitterisiko igennem lange perioder. (Pickering, 1994; Rendtorff & Holt, 1954). Hos immunkompetente personer er sygdommen ofte selvbegrænsende og symptomerne forsvinder. Immunitet hos mennesker overfor en efterfølgende (sekundær) infektion findes ikke beskrevet i litteraturen. Dog indikeres det, dersom symptomerne er selvbegrænsende, at der eksisterer en beskyttende immunitet. Den lave prævalens af giardiasis blandt voksne i områder, hvor sygdommen er endemisk sammenlignet med symptomatiske infektioner blandt tilrejsende i de samme områder, er endnu et tegn på at der eksisterer immunitet. (Faubert, 2000) Den infektiøse dosis varierer mellem forskellige Giardia isolater og afhænger bl.a. af forskellige værtsfaktorer, men indtag af 10 – 100 cyster er som regel nok til at forårsage infektion (Faubert, 2000; Cook, 1996). Dette tal er dog ikke brugbart ved en kvantitativ risikovurdering, hvor der er brug for en fordeling. I kapitel 7 opstilles denne fordeling. Der findes en række agens (medikamenter) med effekt overfor giardiasis herunder metronidazol, tinidazol, quinacrin, furazolidon og forskellige benzimidazoler. Behandling af akut giardiasis er som regel ukompliceret, mens kroniske infektioner i visse tilfælde responderer dårligere på behandling. En vaccine mod giardiasis hos hunde og katte er for nyligt blevet kommercielt tilgængelig i udlandet (Olson et al., 2002). 3.1.3 Epidemiologi3.1.3.1 Forekomst hos dyrSymptomerne hos dyr svarer til det kliniske forløb af giardiasis hos mennesker og varierer meget. Flere studier beskriver et asymptomatisk infektionsforløb, mens andre undersøgelser har dokumenteret en sammenhæng mellem giardiasis, forekomsten af diarré og nedsat tilvækst. Giardiasis forekommer hyppigt som infektion hos produktionsdyr. Udenlandske studier har vist infektionsrater på 38-100% hos unge kalve (Xiao & Herd, 1994; Quílez et al., 1996; O'Handley et al., 2000). Hos får, svin og heste er der fundet prævalenser på 9-38%, hvor prævalens er antallet af syge i en population til et bestemt tidspunkt. Også hos kæledyr er der fundet en meget høj forekomst af Giardia. Et australsk studie har således vist, at G. intestinalis er den hyppigste tarm-protozo hos hunde (Bugg et al., 1999). Giardiasis hos kvæg forårsages overvejende af den non-zoonotiske produktionsdyrs-genotype (Gruppe E) (O'Handley et al., 2000), mens den zoonotiske genotype (gruppe A) forekommer i ca. halvdelen af tilfældene hos hunde. Foreløbigt inkluderer relativt få epidemiologiske studier genotypning af Giardia isolater fra dyr. I Danmark påvises der årligt 5-10 tilfælde af giardiasis hos henholdsvis hunde og katte på Danmarks Fødevareforskning. Hovedparten af disse infektioner diagnosticeres hos hvalpe og killinger med kronisk, vandig diarré. Det vides ikke i hvilket omfang infektionen diagnosticeres i privat praksis. Et studie af asymptomatiske malkekøer og kalve påviste for første gang giardiasis i en dansk kvægbesætning i 1996. Der blev demonstreret en besætningsprævalens på 7,6% (Iburg et al., 1996), men der undersøges ikke rutinemæssigt for Giardia i prøver fra danske produktionsdyr. Prævalensen af giardiasis, zoonotisk potentiale samt betydning for produktion og sundhedsstatus er ukendt hos såvel produktionsdyr som hobby-dyr i Danmark, men en igangværende undersøgelse hos Danmarks Fødevareforskning søger at klarlægge denne samt den genetiske variation af såvel Cryptosporidium som Giardia. 3.1.3.2 Forekomst hos menneskerG. intestinalis er den hyppigste årsag til parasitær diarré i Skandinavien, men antallet af infektioner er dog faldet i takt med forbedret hygiejne og bedre sanitære forhold. Udbredelsen af giardiasis varierer betydeligt mellem forskellige grupper af mennesker og lokaliteter (se tabel 3-3). Andre grupper med forøget risiko og højere prævalens er immunsvækkede og patienter på hospitaler eller plejehjem. Idet human giardiasis ikke er anmeldelsespligtig i Danmark (eller i Norge og Finland), kendes den sande incidens ikke (incidens er forekomst af nytilkomne tilfælde opgivet pr. tid og evt. pr. 100.000 personer). Estimater for incidens i Danmark angives i kapitel 5 om sygdomsudbrud. Giardia er anmeldelsespligtig i Sverige og anmeldes med fuld identitet til Smittskyddsinstitutet, Smittskyddslægen og kommunens miljø- og sundhedsnævn. Tabel 3-3 Prævalens (udbredelse) af Giardiasis.
I svenske rutinescreeninger af fækalieprøver fra flygtninge er der fundet Giardia i 10% af prøverne (Benzeguir et al., 1999). Tillige er der lejlighedsvis rapporteret om smitte mellem børn i daginstitutioner og blandt ældre patienter (Christenson et al., 1992). Tabel 3-4 Incidens af giardiasis.
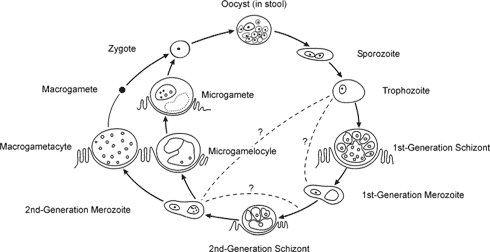
En amerikansk undersøgelse fra 1997, baseret på frivillig indrapportering, viste en incidens fra 0,9 til 42,3 pr. 100.000 indbyggere i de forskellige stater. I 10 stater var der flere end 20,0 tilfælde af giardiasis pr. 100.000 personer, og landsgennemsnittet var 9,5 tilfælde pr. 100.000 personer. I 1997 rapporterede staten New York (inkl. byen New York) det højeste antal tilfælde (3.673), svarende til 14,5% af tilfældene i hele landet. Staten Vermont havde dog den højeste incidensrate, idet der blev rapporteret 42,3 tilfælde pr. 100.000 indbyggere. I begge stater overvåges antallet af giardiasis tilfælde, hvilket sandsynligvis er medvirkende til, at der rapporteres flere tilfælde sammenlignet med andre stater. (Furness et al., 2000) I den amerikanske undersøgelse var tilfældene fordelt ligeligt mellem kønnene. Hyppigheden var størst blandt børn fra nul til fem år, tæt fulgt af personer mellem 31 og 40 år. I disse to grupper blev de fleste tilfælde rapporteret i sensommeren og det tidlige efterår, hvilket tyder på at der er størst risiko for smitte i sommermånederne. (Furness et al., 2000) 3.2 Cryptosporidium parvum3.2.1 Basal biologi3.2.1.1 MorfologiCryptosporidium er en intracellulær parasit. Cellens membran har såkaldte mikrovilli, også kaldet børstesøm. Eftersom andre stadier end oocyster i livscyklusen (se figur 3-2) ikke udskilles og normalt ikke anvendes til klinisk eller mikroskopisk diagnose, beskrives disse stadier ikke videre (se også afs. 3.2.1.3). Figur 3-2 Livscyklus for Cryptosporidium parvum (http://www.cdfound.to.it/html/cry12.htm)
Oocysterne er normalt runde, 4-6 mikrometer og de færdige oocyster indeholder fire sporozoiter. Den tykvæggede oocystvæg har distinkte ydre lag og et finere, granulært indre lag. Mellem disse lag findes en dobbeltmembran. I cellevæggen findes et sutur, som opløser sig ved excystering og derved giver en åbning, som frigiver oocysterne. Excysteringen fremskyndes ved tilstedeværelse af bugspytkirtelenzymer og galdesalte. Både tykvæggede (som udskilles) og tyndvæggede (som autoinficerer, dvs. inficerer andre tarmceller end de allerede inficerede) oocyster kan dannes. 3.2.1.2 Klassifikation og taksonomiCryptosporidium er klassificeret rækken Apicomplexa, klassen Sporozoasida og Cryptosporidiiae familien. Den taksonomiske position af Cryptosporidium er imidlertid uklar. Molekylære studier samt fund af nye udviklingsstadier har således igennem de senere år stillet spørgsmålstegn ved den nuværende klassifikation, og flere data tyder på, at Cryptosporidium bør klassificeres som tilhørende gregarinerne (Hijjawi et al., 2002; Tenter et al., 2002). Tabel 3-5 Cryptosporidium: gyldige artsbetegnelser (Fayer et al., 2000 & 2001; Alvarez-Pellitero & Sitjà-Bobadilla, 2002; Morgan-Ryan et al., 2002)
a Beskrevet siden 1990 På artsniveau er der også igennem den seneste tid sket hastige ændringer, og nye arter beskrives kontinuerligt. For nylig er den humane genotype af C. parvum (syn. genotype I) således blevet karakteriseret som en selvstændig art: C. hominis (Morgan-Ryan. et al., 2002). Blandt de anerkendte Cryptosporidium arter (tabel 3-5) er C. parvum den vigtigste hos dyr (Tzipori & Griffiths, 1998). Den bovine genotype af C. parvum (genotype II) har et meget bredt værtsspektrum og er bl.a. fundet hos kvæg, får, rådyr, grise, mus og mennesker. C. parvum omfatter dog også tilsyneladende værtsspecifikke genotyper hos f.eks. mus, svin og fritte, identificeret på baggrund af sekvens data (Morgan et al., 1999; Xiao et al., 1999). Oocyst-stadierne af disse forskellige genotyper kan ikke differentieres på baggrund af morfologiske karakteristika og de biologiske forskelle har hidtil ikke været tilstrækkelige til at berettige at disse typer betegnes som selvstændige arter. Ikke desto mindre tyder molekylære data på, at der er tale om forskellige arter. Således er den genetiske forskel mellem f.eks. den bovine og den porcine genotype af C. parvum større end forskellen mellem C. parvum og hhv. C. meleagridis og C. wrairi (Xiao et al., 2000). Såvel C. hominis (C. parvum, human genotype) som C. parvum (bovin genotype) har forårsaget udbrud af cryptosporidiose hos mennesker. Ud af 10 undersøgte udbrud i Nordamerika var 6 udbrud forårsaget af C. hominis, 3 var forårsaget af den bovine genotype og ét udbrud var forårsaget af begge genotyper (Sulaiman et al., 1998). Udbrud forårsaget af den bovine genotype forekom hovedsageligt i landområder. Ligeledes var fem af seks undersøgte udbrud i Storbritannien og ét i Holland forårsaget af C. hominis. Nogle af de udbrud, som skyldtes spildevandsforurening af drikkevand, var forårsaget af begge arter. C. hominis er muligvis bedre tilpasset mennesker end C. parvum, idet britiske studier har vist, at mennesker smittet med C. hominis udskilte signifikant flere oocyster end mennesker smittet med C. parvum bovin genotype (McLauchlin et al., 1999). Blandt Cryptosporidium-arterne er C. parvum og C. hominis de hyppigste årsager til sygdom hos mennesker, men infektioner som følge af C. felis, C. meleagridis, C. canis og C. muris er sjældent observeret. Immunsupprimerede personer (med svækket immunforsvar) smittes hyppigere med forskellige Cryptosporidium-arter end mennesker med et normalt fungerende immunapparat. Procentdelen af infektioner med dyreparasitter er generelt højere hos AIDS-patienter end hos immunkompetente personer, hvilket antyder, at infektioner forårsaget af zoonotiske parasitter har større betydning for denne patientgruppe. 3.2.1.3 LivscyklusCryptosporidier udskilles via fækalier som infektive oocyster med fire sporozoiter. Smitte sker ved oral optagelse af oocyster, hvorefter oocystvæggen brister og sporozoiterne trænger ind i tyndtarmens epitelceller. Her gennemføres flere ukønnede opformeringsstadier efterfulgt af en kønnet formering under dannelse af oocyster, hvoraf 80% udskilles med fækalier, mens ca. 20% er tyndvæggede og derfor straks brister i tarmen, hvorved de kan forårsage autoinfektion. Dette er unikt i forhold til andre beslægtede parasitter, som må gennemgå en sporulering udenfor værten, før de bliver infektive. Cryptosporidier er desuden karakteriseret ved at være lokaliseret i en vakuole under tarmens overfladeepitel (intracellulært men extracytoplasmatisk), hvilket formodentlig er årsag til den ringe effekt af enhver behandling. Ved klinisk sygdom udskilles meget store mængder oocyster: 106-108 pr. g fækalie, hvilket medfører risiko for massiv kontamination af det omgivende miljø. (Girdwood & Smith, 1999) 3.2.2 Kliniske symptomerSygdomsforløbet afhænger bl.a. af værtens alder og generelle helbredstilstand, og det kliniske billede varierer fra asymptomatisk infektion til alvorlig, livstruende sygdom. Vandig diarré er det mest almindelige symptom og kan ledsages af dehydrering, mavekramper, vægttab, underlivssmerter, kvalme, opkastning og let feber. Symptomerne begynder generelt 2-10 dage efter smitte. Hos personer med et normalt immunsystem varer symptomerne sædvanligvis omkring to uger. Symptomerne kan gå i ring, idet symptomerne aftager nogle dage for derefter at tiltage inden sygdommen slutter. Den infektiøse dosis betegnes som lav (WHO, 2003). Forsøg med raske frivillige resulterede i, at den laveste undersøgte dosis på 30 oocyster gav infektion hos én ud af 5 personer (Dupont et al., 1995). Et ældre, mindre forsøg med primater viste, at begge de 2 undersøgte dyr blev smittet ved doser på 10 oocyster. (Miller et al., 1986). I kapitel 7 opstilles der en normalfordeling baseret på resultaterne fra humanforsøg, og denne fordeling er anvendt til den kvantitative risikovurdering. Cryptosporidiose kan blive kronisk og mere alvorlig hos patienter med svækket immunforsvar, især patienter med CD4-tal under 200/µL (CD4-celler f.eks. monocytter og makrofager har afgørende betydning for sygdomsbekæmpelsen). Individer med et svækket immunforsvar omfatter bl.a. patienter med AIDS samt patienter, der får immunsvækkende medicin pga. kræft eller transplantation. Der findes desuden arvelige sygdomme, som medfører svækket immunforsvar. Selvom cryptosporidiose som regel er begrænset til tyndtarmen, kan infektionen brede sig til resten af fordøjelsessystemet, og andre organer kan også inficeres f. eks. lunger, galdegange og muligvis øjets bindehinde. Der er ikke nogen effektiv behandling mod cryptosporidiose. Hurtigt væsketab pga. diarré kan kontrolleres via tilskud af væske og elektrolytter. Infektioner hos immunkompetente (med normalt fungerende immunforsvar) personer er som regel selvbegrænsende. Nitazoxanid har vist lovende resultater ved behandling af cryptosporidiose hos immunkompetente patienter, men kan ikke standse oocystudskillelsen hos personer med svækket immunforsvar. Anti-retroviral behandling, som styrker immunforsvaret hos patienter med AIDS nedsætter oocystudskillelsen samt mindsker diarréen i forbindelse med cryptosporidiose. 3.2.3 Epidemiologi3.2.3.1 Forekomst hos dyrCryptosporidiose er dokumenteret hos mere end 152 forskellige arter af pattedyr (Fayer et al., 2000) og er almindeligt forekommende hos danske dyr (tabel 3-6). Hos hvalpe, killinger og føl er cryptosporidiose en væsentlig årsag til diarré, men infektionen udgør især et problem i kvægproduktionen. Antallet af kliniske tilfælde hos kalve topper fra januar til april, med højest prævalens i 2.-3. leveuge (Henriksen & Krogh, 1985; Enemark, 2002). Tabel 3-6 Forekomst (januar 1997 til december 2001) af Cryptosporidium i fækalieprøver fra danske dyr i alle aldersklasser. (Enemark, 2002)
Hos kalve under 1 måned påvises cryptosporidier i 30-35 % af de prøver, der indsendes til undersøgelse på Danmarks Fødevareforskning, og cryptosporidier er dermed det næst hyppigste tarmpatogen i denne aldersgruppe, kun overgået af rotavirus. Egentlige prævalensundersøgelser er ikke gennemført i danske kvægbesætninger, men talrige udenlandske studier har dokumenteret prævalensrater på 60-100% hos unge kalve (Blewett, 1988; Quílez et al., 1996). Symptomerne er, som hos mennesker, voluminøs, vandig diarré, dehydrering, anoreksi, samt høj kalvedødelighed. Forløbet kompliceres ofte af sekundære infektioner og volder således betydelige økonomiske tab for kvægavlerne. 3.2.3.2 Forekomst hos menneskerPå verdensplan er Cryptosporidium en af de hyppigste ikke-virale årsager til diarré hos mennesker (Current & Garcia, 1991). Human cryptosporidiose forekommer over hele verden og er blevet rapporteret i 95 lande omfattende industrialiserede (i-lande) og udviklingslande (u-lande), by- og landområder samt alle kontinenter bortset fra Antarktis (gennemgået af Fayer, 1997). C. parvum er den vigtigste årsag til vandbårne udbrud i flere lande (bl.a. MacKenzie et al., 1994; Goldstein et al., 1996), og et af de hyppigste enteropatogener især i udviklingslande, hvor cryptosporidiose ofte forekommer samtidigt med andre infektioner (Casemore et al., 1997). Talrige studier, ikke omfattende tilfælde hos AIDS-patienter eller specifikke udbrud, har vist prævalensrater på 0,1 – 27,1% (gns. 4,9%) i I-lande og 0,1-37,5% (gns. 7,9%) i u-lande (O'Donoghue, 1995). På et hospital i Skt. Petersborg i Rusland blev 373 børn under 7 år undersøgt, og 2,7% var positive for Cryptosporidium (Beyer et al., 1990). Tabel 3-7 Prævalens af Cryptosporidium
En engelsk undersøgelse viste, at Cryptosporidium var årsag til 6 % af diarrétilfældene hos børn i Blackburn-distriktet. Infektionen var lige så hyppig som sygdom forårsaget af Campylobacter samt E. coli, og hyppigere end diarré forårsaget af Giardia, Shigella og Salmonella. (Thomson et al., 1987). Efterfølgende studier viste, at Cryptosporidium var det næst-hyppigste patogen hos engelske børn kun overgået af Campylobacter (Badenoch, 1995). Tabel 3-8 Procentdel med Cryptosporidium blandt patienter med diarré.
I forhold til undersøgelser af afføringsprøver har data, baseret på tilstedeværelse af specifikke antistoffer i blodet, vist en overraskende høj forekomst af cryptosporidiose i den immunkompetente, sunde population (Ungar et al., 1986). I Europa og Nordamerika er seroprævalenserne (dvs. måling af antistoffer i befolkningen) således 25 - 35 %, mens seroprævalenserne når helt op på 64% i Sydamerika (Peru og Venezuela) (Ungar et al., 1988). 3.3 DelkonklusionGiardia cyster har en størrelse på 5-10 µm og er således større end Cryptosporidium oocyster, som er 4-6 µm. Begge protozoer har en lav infektiøs dosis hos mennesker; 10 Giardia cyster og 30 Cryptosporidium oocyster kan være nok til infektion. Sygdom som følge af Cryptosporidium infektion varer ofte omkring 2 uger, men kan bliver kronisk hvortil der ikke er effektiv behandling. Giardiasis varer typisk 1-3 uger, men der findes mulighed for behandling, hvis infektionen ikke forsvinder af sig selv. Ved giardiasis udskilles der 105-107 cyster pr. g fækalie og ved cryptosporidiose udskilles der op til 106-108 oocyster pr. g fækalie under den akutte fase. Det er ikke fuldt afklaret hvilke arter og hvilke genotyper, der kan smitte og forårsage sygdom hos mennesker. Ydermere er der ikke nogen systematisk rapportering af, hvilke genotyper der er fundet, når der diagnosticeres giardiasis og cryptosporidiose. På denne baggrund er det derfor ikke muligt kvantitativt at begrænse risikoanalysen til enkelte genotyper.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||