Transport af bekæmpelsesmidler over moderkagen, analogier til percutan transport og modellering
2 Materialer og metoder
- 2.1 Præsentation af teststoffer
- 2.2 Delstudie 1. Dermal absorption
- 2.3 Delstudie 2. Transplacental transport
- 2.4 Delstudie 3. Modellering
2.1 Præsentation af teststoffer
Teststofferne er valgt ud fra deres opløselighed og molekylevægte idet der ønskes dækning af et bredt opløseligheds- såvel som molekyle størrelsesspektrum for derved at opnå et repræsentativt datasæt med gode muligheder for udvikling af kvantitative modeller.
2.1.1 Antipyrin
| CAS nr.: | 60-80-0 |
| Struktur: | 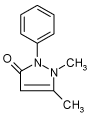 |
| Anvendelse: | Smertestillende middel |
| Molvægt: | 188,1 g/mol |
| Molar volumen: | 162,7 |
| Vand opl.: | 52 g/L |
| LogKow | 0,38 |
| Damptryk: | 4,08 mPa |
| pKa: | 1,4 |
Antipyrin anvendes som intern markør som en del af kvalitetssikringen (positiv kontrol) ved perfusionsforsøgene, idet antipyrin vides at passere placenta relativt uhindret og historiske data eksisterer for sammenligning.
2.1.2 Benzoesyre
| CAS nr.: | 65-85-0 |
| Struktur: | 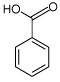 |
| Anvendelse: | Benzoesyre er en svag syre og anvendes til pH-justering og som konserveringsmiddel (fungicid) i føde- og drikkevarer samt i kosmetik industrien |
| Molvægt: | 122 g/mol |
| Molar volumen: | 101,9 |
| Vand opl.: | 3,41 g/L, 25 oC |
| LogKow | 1,87 |
| Damptryk: | 93,3 mPa |
| pKa: | 4,19 |
Benzoesyre optages hurtigt via mave-tarm kanalen og omdannes i leveren til hippursyre. I de aktuelle undersøgelser anvendes radioaktivt mærket ¹4C-Benzoesyre, hvorfor såvel udgangsstoffers som metabolitter detekteres.
2.1.3 Bisphenol A
| CAS nr.: | 80-05-7 |
| Struktur: | 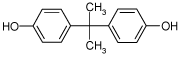 |
| Anvendelse: | Bisphenol A anvendes i en lang række to- eller flerkomponente materialer |
| Molvægt: | 228,28 g/mol |
| Molar volumen: | 199,5 |
| Vand opl.: | 0,12 g/L |
| LogKow | 3,32 |
| Damptryk: | 4 * 10-8 mmHg |
| pKa: | - |
Bisphenol A har stor udbredelse og human eksponering indbefatter såvel oral som dermal eksponering. Målinger fra mennesker viser, at Bisphenol A absorberes hurtigt ved oral eksponering og efterfølgende elimineres via nyrerne i løbet af 24 timer (Volkel, 2002). Den daglige indtagelse af bisphenol A antages at være mellem 0,01-1,18 µg/kg/dag. Serum koncentrationer er målt til 0,2- 20 ng/ml (Ouchi, 2002; Vandenberg, 2007).
Konkret viden om penetrationskinetik over såvel human hud som placenta er sparsom.
Bisphenol A’s størrelse (MW) og opløselighed gør stoffet velvalgt i forhold til allerede testede modelstoffer. Stoffets tilgængelighed som beta-emitter/isotop gør det letanvendeligt i eksperimentelle studier. Samlet set er der ud fra mange prioriteringer tale om et godt modelstof.
I de aktuelle undersøgelser anvendes radioaktivt mærket ¹4C-Bisphenol(A), hvorfor såvel udgangsstoffers som metabolitter detekteres.
2.1.4 Caffein
| CAS nr.: | 58-08-2 |
| Struktur: | 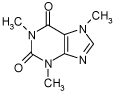 |
| Anvendelse: | Caffein er et trimethylxanthin alkaloid. Caffein er det aktive stof i kaffe, te, cola og energi-drikke |
| Molvægt: | 194,19 g/mol |
| Molar volumen: | 133,3 |
| Vand opl.: | 21,6 g/L, 25 oC |
| LogKow | -0,07 |
| Damptryk: | 2106 mPa |
| pKa: | 10,4 |
Caffein er hydrofilt og optages hurtigt og fuldstændigt over mave-tarm kanalen, kan passere alle organer samt over placenta. Daglig indtagelse af caffein er 4 - 414 mg/person/dag. Ved indtagelse af en kop kaffe opnås f.eks. plasma koncentrationer på 0,25-2,5 mg/ml (Fredholm, 1999; Shapiro, 2007).
I de aktuelle undersøgelser anvendes radioaktivt mærket ¹4C-Caffein, hvorfor såvel udgangsstoffers som metabolitter detekteres.
2.1.5 Dimethoat
| CAS nr.: | 60-51-5 |
| Struktur: | 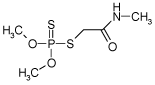 |
| Anvendelse: | Anvendes erhvervsmæssigt til bekæmpelse af fluer, thrips og viklerlarver. Spredes i vandmiljøet og kan muligvis nedvaskes til grundvandet. Er potentielt nedbrydeligt og anses ikke for bioakkumulerende. |
| Molvægt: | 229,26 g/mol |
| Molar volumen: | 175,7 |
| Vand opl.: | 39,8 g/L Farveløse krystaller, der er moderat opløselige i vand |
| LogKow | 0,7 |
| Damptryk: | 0,25 – 1,1 mPa |
| pKa: | - |
Dimethoat optages hurtigt og næsten fuldstændigt over mave-tarm kanalen.
2.1.6 Glyphosat
| CAS nr.: | 1071-83-6 |
| Struktur: | 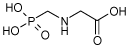 |
| Anvendelse: | Glyphosat er det aktive stof i sprøjtemidlet Roundup. Glyphosat er et non-selektivt ukrudtsmiddel. Stoffet inhiberer enzymet 5-enolpyruvylshikimate-3-phosphatsyntase, hvilket er essentielt for produktionen af chorismat – en intermediær i produktion af aromatiske aminosyrer som phenylalanin, tyrosin og tryptophan. Pattedyr syntetiserer ikke disse aminosyrer og glyphosat virker derfor udelukkende hæmmende for syntesen af disse stoffer i planter. |
| Molvægt: | 169 g/mol |
| Molar volumen: | 100,6 |
| Vand opl.: | 10,5 g/L, 25 oC |
| LogKow | -3,2 |
| Damptryk: | 13,1 mPa |
| pKa: | 2,34 – 10,2 |
Glyphosat optages delvist via mave-tarm kanalen med hurtig udskillelse og akkumuleres ikke. I de aktuelle undersøgelser anvendes radioaktivt mærket ¹4C-Glyphosat, hvorfor såvel udgangsstoffers som metabolitter detekteres.
2.1.7 Methiocarb
| CAS nr.: | 2032-65-7 |
| Struktur: | 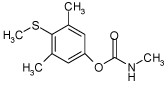 |
| Anvendelse: | Methiocarb anvendes i landbruget til sneglebekæmpelse. |
| Molvægt: | 225,31 g/mol |
| Molar volumen: | 196 |
| Vand opl.: | 0,027 g/L |
| LogKow | 3,34 |
| Damptryk: | 0,036 mPa |
| pKa: | - |
Methiocarb optages næsten fuldstændigt via mave-tarm kanalen med hurtig udskillelse og akkumuleres ikke.
2.1.8 Miconazol
| CAS nr.: | 22916-47-8 |
| Struktur: | 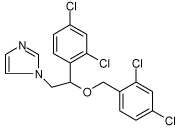 |
| Anvendelse: | Miconazol er et fungicid af azol-typen og anvendes i lægemidler (f.eks. Brentan) til bekæmpelse af svamp. |
| Molvægt: | 416,13 g/mol |
| Molar volumen: | 296 |
| Vand opl.: | Miconazol er praktisk talt uopløseligt i vand; vandopløseligheden er beregnet til 0,000011 g/L |
| LogKow | 5,9 |
| Damptryk: | - |
| pKa: | - |
2.1.9 Tebuconazol
| CAS nr.: | 107534-96-3 |
| Struktur: | 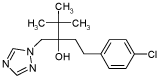 |
| Anvendelse: | Tebuconazol er et fungicid af azol-typen og anvendes som svampemiddel i Danmark |
| Molvægt: | 307,8 g/mol |
| Molar volumen: | 268,1 |
| Vand opl.: | 0,036 g/L, 20 oC |
| LogKow | 3,7 |
| Damptryk: | 0,0017 mPa |
| pKa: | - |
Tebuconazol optages hurtigt og næsten fuldstændigt efter oral administration, og med hurtig udskillelse via fæces (65-80 %) og sekundært via urin (16-35 %). Tebuconazol akkumuleres ikke.
2.2 Delstudie 1. Dermal absorption
2.2.1 Metode
Projektet gennemføres under anvendelse af en in vitro diffusionscellemodel ved anvendelse af human hud (figur 2.2.1). Modellen er beskrevet i OECD´s guidelines for undersøgelse af hudpenetration (OECD, 2003) og er særdeles relevant for denne type undersøgelser (Grandjean, 1990). Modellen tillader kvantitering og sammenligning af både transport igennem og temporær deposition i huden. Modellen har været anvendt på Afdeling for Miljømedicin, SDU i en årrække og laboratoriet har i 2002-2003 deltaget i en EU-finansieret valideringsrunde for hudpenetrationsmodeller. Modellen har vist god overensstemmelse med in vivo resultater fra mennesker (Ramsey, 1994; van de Sandt, 2004b). Modellen er den bedste eksperimentelle mulighed for at tilvejebringe systematisk viden.

Figur 2.2.1. In vitro diffusionscellemodel med anvendelse af human hud som anvendt i dette projekt.
2.2.2 In vitro model
Diffusionscellerne er af håndblæst glas og består af et donorkammer og et receptorkammer. Huden, der stammer fra brystoperationer eller abdominalplastikker foretaget ved læger fra Odense Universitetshospitals plastik-kirurgiske afdeling, monteres mellem de to kamre med hornlaget vendende mod donorkammeret. Udtørring af huden ved fordampning undgås ved at dække donorcellen med parafilm. Receptorvæsken (isotonisk NaCl med 5 % BSA og hexamycin), der fylder receptorkammeret, omrøres konstant (magnetomrøring) for at undgå en koncentrationsgradient mellem top og bund i receptorkammeret. Diffusionscellerne placeres i vandbad (35 oC) for at sikre en temperatur på omkring 32 oC på hudoverfladen, svarende til normal hudtemperatur. Hudens integritet vurderes ved kapacitansmåling før og under forsøg.
2.2.3 Eksperimentelt design
Forsøgene gennemføres med 48 timers eksponering af brugsopløsninger af de valgte stoffer og opsamling af prøver fra receptorvæsken på relevante tidspunkter i dette forløb. Ved afslutning bestemmes den mængde, der resterer i donorkammeret, den i huden deponerede mængde (reservoir-effekt), samt den penetrerede mængde således, at der kan opstilles massebalancer ved forsøgene. Der vil i forsøgene blive anvendt infinite dose for at sikre penetrationskurver med mulighed for bestemmelse af maksimal flux og Kρ. Vi vil anvende 2 bekæmpelsesmidler af azol-typen (miconazol samt tebuconazol). Det er bekæmpelsesmidler, der har fundet stadig stigende anvendelse i Danmark, og for hvilke vi fortsat mangler viden om deres penetrationsegenskaber. Bekæmpelsesmidlerne vil blive appliceret i koncentrationer svarende til de erhvervsmæssigt anvendte.
2.2.4 Variabilitet og statistik og forsøgsplanlægning
Anvendelsen af hud fra forskellige donorer betinger en naturlig heterogenicitet med deraf følgende interindividuel variation, der kan estimeres til omkring 60 %. Med en power på 90 %, et signifikansniveau på 5 % og en standard deviation på 60 % kan den krævede gruppestørrelse anslås til 13-15. Vi kan således opnå valide resultater med gruppestørrelser på 6-8 diffusionsceller per stof (Nielsen, 2000; Nielsen, 2008a) samtidig med, at alle eksperimenter gentages to gange. Tidligere forsøg har vist, at huden opretholder normal barrierefunktion i over 72 timer, hvilket muliggør eksponeringsperioder på 48 timer. Delstudie 1 gennemføres med 2 modelstoffer af azol-typen plus antipyrin og bisphenol A.
2.2.5 Kemiske analyser
Flemming Nielsen (Syddansk Universitet) er ansvarlig for alle kemiske analyser af bekæmpelsesmidler (methiocarb, dimethoate, miconazol og tebuconazol). Udgangspunktet for disse stoffer var analyse ved hjælp af HPLC. Laboratoriet har en betydelig erfaring i analyse af bekæmpelsesmidler fra tidligere projekter (Nielsen, 2000; Nielsen, 2008a). Endvidere er en række modelstoffer anvendt i form af radioaktivt mærkede stoffer (bisphenol A, glyphosat, benzoesyre, caffein), hvilket muliggør anvendelse af ganske lave eksponeringer.
2.3 Delstudie 2. Transplacental transport
2.3.1 Metode
Projektet gennemføres med udgangspunkt i en kendt in-vitro placentaperfusions-model (Miller, 1985; Schneider, 1985). Systemet er siden videreudviklet (Myllynen, 2001; Myllynen, 2003b) og nu etableret på Københavns Universitet (Mose, 2006; Mose, 2007b; Mose, 2007a; Mose, 2008). Der arbejdes med et dobbelt recirkulerende system, hvor moderens og fosterets kredsløb simuleres i en mindre vaskulær enhed, et cotyledon (se figur 2.3.1). I denne forsøgsopstilling kan den føtale og den maternelle side af cotyledonet gennemstrømmes samtidigt, hvilket er forudsætningen for transplacental transport. Den eksperimentelle model medfører, at transporten over placenta, akkumulering i placenta samt metabolisering i placenta, kan bestemmes.
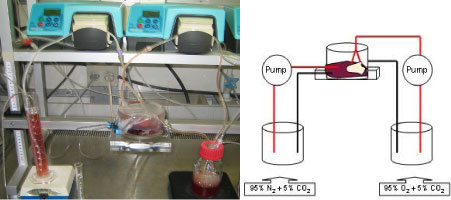
Fig. 2.3.1. Billede samt skematisk fremstilling af det dobbelt recirkulerende perfusionssystem. Det føtale reservoir ses til venstre i opstillingen og det
maternelle til højre. På tegningen er de røde linjer et udtryk for inflow (arterier) til cotyledonet og de sorte et udtryk for outflow (vener).
2.3.2 In vitro model
Placenta og blod indsamles fra ukomplicerede graviditeter og fødsler fra både vaginale fødsler og kejsersnit på Rigshospitalets Fødeafdeling. Placenta afhentes umiddelbart efter fødslen, vejes, navlesnorsblod udtages og næringsvæske tilføres. Fosterets kredsløb simuleres i et enkelt cotyledon ved at kanylere arterie og vene. Cotyledonet isoleres og placeres i perfusionkammer, hvorefter 2 stumpe kanyler tilsluttes det intervilløse rum og derved simulerer det maternelle kredsløb. Flowet på den maternelle og føtale side er henholdsvis 11,5 mL/min og 3,5 mL/min. Perfusionvæsken er en Krebs-Ringer-buffer tilsat heparin, glukose og dextran (føtal 30 g/L, maternalt 8,5 g/L), der i det føtale reservoir mættes med 95 % N2 / 5 % CO2 og i det maternelle med 95 % O2 / 5 % CO2. Væsketab mindskes ved brug af parafilm. Systemet er opsat i en termostateret 37 oC flowbænk, hvor pH, flow, volumentab og pO2 moniteres konstant. Præ-perfusionen gennemføres for at stabilisere placenta inden tilsætning af teststof samt det positive kontrolstof (antipyrin).
Efter præ-perfusion tilsættes 98 ml maternel perfusionsmedie og 1 ml antipyrin sammen med 1 ml af en stamopløsning til opnåelse af valgt slutkoncentration. Stamopløsningerne er enten opløst i vand eller ethanol.
Prøver udtages fra maternel og føtal side inden perfusion og efter 2, 5, 10, 15, 30, 45, 60, 90, 120 og 150 minutter (Mose, 2008).
2.3.3 Eksperimentelt design
Perfusionsforsøgene gennemføres med 2½ timers eksponering. Inden analyse af teststof i de indsamlede prøver, kontrolleres transporten af antipyrin ved hjælp af HPLC-analyse. Teststofferne måles i perfusionsvæskerne efter placental perfusion samt i placentavæv før og efter perfusion. Herved kan stoffernes transportkinetik bestemmes og en sammenhæng fastlægges mellem bekæmpelsesmidlernes opløselighed, størrelse og transportmekanisme. Der anvendes fem teststoffer dækkende et bredt opløseligheds og molvægtsområde (methiocarb, dimethoat, benzoesyre, glyphosat, caffein) for hvilke dermale resultater er tilgængelige fra et tidligere MST-finansieret projekt (MST projekt 7041-0334). Disse er suppleret med to nyere azolforbindelser for hvilke, der ikke findes tilstrækkelig viden om penetrationsevne gennem human hud og placenta, samt stoffet bisphenol A – i alt 8 teststoffer samt antipyrin. Vi tager udgangspunkt i de koncentrationer, der tidligere er målt i receptorkammeret fra hudforsøgene, idet disse koncentrationer er fremkommet efter dermal eksponering for arbejdsmiljørelevante koncentrationer. Der stiles mod bestemmelse af lag-time, FM ratio (CF /CM, der er forholdet mellem koncentrationerne på den føtale side og den maternelle side af cotylidonet), samt den initiale hældning af FM-ratioen som funktion af tiden kaldet den indikative permeabilitetskoefficient (IPK). Denne parameter er et udtryk for transporthastigheden over placentabarrieren. Alle udførte regressioner til beregning af IPK udføres på gennemsnitsværdier. De to valgte azol-forbindelser miconazol samt tebuconazol, er valgt med baggrund i relevans for modellering samt relevant human eksponering.
2.3.4 Etisk godkendelse, tilgængelighed af væv og analyse
Placenta og blod indsamles efter informeret og skriftligt samtykke fra moderen, og data opbevares kodet uden adgang til moderens identitet, jf. godkendelse fra videnskabsetisk komité og datatilsynet. På Rigshospitalet udføres 5-15 planlagte kejsersnit om ugen fordelt på 3 dage, og det tilstræbes at køre forsøg flere dage om ugen. Dette afhænger dog fuldstændig af tilgængelighed og kvalitet af moderkagerne. I flere perioder er det svært at modtage intakte placenta, da iturivning under kejsersnittet hyppigt forekommer. For hvert teststof gennemføres 3-8 perfusioner foruden bestemmelse af baggrundsniveau ved de ikke-radioaktivt mærkede stoffer. De opsamlede prøver analyseres i Odense ved allerede etablerede metoder eller ved radioaktivitetsbestemmelse.
2.4 Delstudie 3. Modellering
2.4.1 Metode
I Delstudie 3 opstilles og afprøves en matematisk model til forudsigelse af hudpenetration og placentatransport. Formålet med modellen er at kunne estimere hudpenetrationens indflydelse på et kemisk stofs (bekæmpelsesmiddels) senere skæbne i kroppen, inklusiv placenta, ud fra dets fysisk-kemiske egenskaber samt en potentiel risiko for fosteret. Der benyttes data fra in vitro undersøgelser af de ni udvalgte modelstoffers transport over henholdsvis human hud og placenta. Disse data er delvis genereret i tidligere undersøgelser (Grandjean, 1990; Nielsen, 2000; Nielsen, 2008a) og dels genereret i dette projekt (Delstudie 1 og Delstudie 2). Modellen baseres på fælles parametre, primært passiv diffusion bestemt af fysisk-kemiske parametre.
Hudens penetration af kemiske stoffer har været modelleret i adskillige år (Borling P, 2001; Engelund EH, 2003; Holmberg RD, 2004). Med udgangspunkt i eksisterende modeller (Berge WF, 2003; Sartorelli, 1998; US EPA, 1992) udvikles en model på baggrund af de data, der genereres i projektet (delstudie 2).
Kendskabet til placentatransport er meget ringe (Frasch, 2002; Myllynen, 2003a). Problemet kompliceres yderligere af, at placenta er et dynamisk organ, der ændrer karakter gennem graviditeten (Gude, 2004). I modelforsøgene anvendes terminale placentaer, som anses for det stadie, hvor placenta er tyndest og dermed det stadie, hvor stoffer må forventes at passere placenta lettest. Som for hudens vedkommende, vil de enkelte stoffers fysisk-kemiske egenskaber og de afledte parametre inddrages i den opstillede model. Der er kendskab til specifikke transportsystemer som f.eks. P2-glycoprotein, ’multidrug resistance proteins’ (MDR, MDP), ’organic anion transporters’ (OAT) og ’organic cation transporters’ (OCT), der kan influere på transporten af modelstofferne (Leazer, 2003; Novotna, 2004; St-Pierre, 2000; St-Pierre, 2004). Der er dog ikke tilstrækkelig viden. Denne del af studiet vil derfor bestå i at opstille en model, der beskriver placentatransport af de uomdannede modelstoffer med forskellige fysisk-kemiske egenskaber. De nødvendige data hertil indhentes fra Delstudie 2.
2.4.2 Eksperimentelt design
For begge organmodellers vedkommende baseres modellen primært på stoffernes fysisk-kemiske egenskaber og de parametre, der kan udledes heraf:
- Molekylvægt (MW)
- Molær volumen
- Lipofilicitet
- Vandopløselighed
- Ionisationsgrad
- Diffusionshastighed
- Lag-time (gennembrudstid)
- Deponeringskapacitet
- Maksimal flux
På grund af den ringe viden vedrørende placentatransport vil den opstillede model i første omgang beskrive placentatransport af de uomdannede bekæmpelsesmidler. Det tilstræbes, at den samme grundmodel kan benyttes til estimering af hudpenetration og placentatransport.
2.4.3 Variabilitet og statistik
Data genereret fra delstudie 1 og 2 (9 forskellige stoffer) anvendes til verificering af modellen til forudsigelse af dermal og placental transport. Verificering af modellen indebærer sammenligninger af kinetikken opnået ud fra de konkrete tal med den computer-estimerede kinetik og ved systematisk at udtrække et stof og undersøge virkningen på modellens statistiske parametre. Verificeringen rummer endvidere sammenligninger med allerede eksisterende humane og dyremodeller. De statistiske bearbejdninger af data foregår med S-PLUS. Fremgangsmåden i verificeringen af modellen vil følge ECVAM’s principper for testvalidering (Hartung, 2004).
Version 1.0 Juli 2009, © Miljøstyrelsen.