Mikrobiologiske plantebeskyttelsesmidlers skæbne i mave-tarm kanalen
2 Materialer og metoder
- 2.1 Anvendte Bacillus cereus og Bacillus thuringiensis stammer
- 2.2 Mærkning af bakterier med fluorescens
- 2.3 Dyreforsøg
- 2.4 Undersøgelser af effekter på omkringliggende flora
- 2.5 Enterotoksin assays
- 2.5.1 Immunologisk detektion af HBL
- 2.5.2 Vero-celle assay
- 2.5.3 Bestemmelse af detektionsgrænsen i Vero-celle assay
- 2.5.4 Effekt af vækstbetingelser på Vero-toksiske substanser
- 2.5.5 Betydningen af sterilfiltrering for indholdet af Vero-toksiske substanser
- 2.5.6 Ekstraktion af potentielle Vero-toksiske substanser fra tarmprøver
- 2.5.7 Indflydelse af fæces på genfindelse af Vero-toksiske substanser
I det følgende er der en overordnet gennemgang af de valgte materialer og metoder. En mere udførlig fagteknisk beskrivelse kan findes i bilag A.
2.1 Anvendte Bacillus cereus og Bacillus thuringiensis stammer
Til dyreforsøgene har vi arbejdet med tre forskellige stammer fra Bacillus cereus gruppen, en B. cereus og to Bt stammer, derudover er yderligere tre stammer blevet testet i Vero-celle assay (Tabel 1). B. cereus F4433/73 blev udvalgt som positiv kontrol for enterotoksinproduktion. Denne stamme er isoleret fra et udbrud af fødevareforgiftning [Melling et al., 1976] og producerer enterotoksiner i store mængder [Damgaard, 1995;Granum et al., 1993]. De to Bt stammer er identiske med de kommercielle stammer i produkterne Dipel®, Bactimos®, og Vectobac®. Alle tre produkter er lovlige at bruge i Danmark som plantebeskyttelsesmidler (http://www.mst.dk/). Bt subsp. kurstaki DMU67R er blevet isoleret fra miljøet [Pedersen et al., 1995], og kan ved forskellige molekylære teknikker ikke skelnes fra den Bt subsp. kurstaki HD1 stamme som anvendes i plantebeskyttelsesmidlet Dipel®. Ligeledes er den anvendte Bt subsp. israelensis HD567 identisk med de stammer der findes i de kommercielle produkter Bactimos® og Vectobac®.
Tabel 1. Oversigt over anvendte Bt stammer.
| Stamme | Karakteristika |
| B. cereus F4433/73 | Har været årsag til fødevareforgiftning |
| B. thuringiensis subsp. kurstaki DMU67 | Identisk med HD1, som er til stede i produktet Dipel®. Toksisk overfor insekter af slægten Lepidoptera. |
| B. thuringiensis subsp. Israelensis HD567 | Identisk med de kommercielle stammer i Bactimos® og Vectobac®. Toksisk overfor insekter af slægten Diptera |
| B. thuringiensis subsp. kurstaki HD1 | Kommerciel stamme |
| B. thuringiensis subsp. tenebrionis NB125 | Kommerciel stamme, toksisk overfor insekter af slægten Coleoptera. Ikke tilladt i Danmark |
| B. cereus BCIP 5832 | Probiotisk stamme |
2.1.1 Fremstilling af antibiotika-resistente stammer
For at kunne genfinde de anvendte stammer mellem de øvrige bakterier i tarmen, var det nødvendigt at bruge stammer der var resistente overfor antibiotika. Der blev opnået spontane rifampicin resistente mutanter af B. cereus F4433/73 og Bt subsp. kurstaki DMU67. Rifampicin resistens er sjælden blandt bakterier fra en normal tarmflora og derfor velegnet til at skelne de tilsatte B. cereus og Bt bakterier fra resten af floraen. Det var ikke muligt at gøre Bt subsp. israelensis HD567 stammen resistent overfor rifampicin da dette ødelagde stammens sporuleringsevne, så denne stamme var derfor streptomycin-resistent.
2.2 Mærkning af bakterier med fluorescens
Gener, der koder for fluorescerende proteiner, eksempelvis Green Fluorescent Protein (GFP) fra goblen Aquorea victoria er stærke redskaber til at visualisere bakterier og/eller plasmidoverførsel mellem bakterier [Christensen et al., 1998;Normander et al., 1998].
I projektet har vi udnyttet dette til fremstilling af grøn-fluorescerende bakterier (se Figur 1). Bakterierne blev gjort grønne ved at indsætte et plasmid (et cirkulært stykke DNA), som indeholder et gfp gen. Genet udtrykker GFP proteinet, som bliver konstant udtrykt under vækst, altså når cellerne er vegetative. Derimod vil sporerne ikke lyse, da de er ”i dvale”. To forskellige plasmider (pAD43-25 og pAD44-12) konstrueret af amerikanske forskere [Dunn and Handelsman, 1999] er blevet brugt. Skelettet (plasmid pAD123) af disse to plasmider kan ses i Bilag A og består af to replikons, så plasmidet er i stand til at blive opretholdt i både en Gram-negativ vært (f.eks. Escherichia coli) og en Gram-positiv vært (f.eks. Bacillus). Derudover indeholder plasmidet et gen der giver resistens overfor ampicillin og som virker i E. coli og et gen der giver resistens overfor kloramfenikol, som kan bruges som markør i Bacillus. Endelig indeholder pAD123 genet kodende for GFP, som dog kun bliver udtrykt såfremt der er en promotor foran genet, som det er tilfældet i de to anvendte plasmider pAD43-25 og pAD44-12. De to plasmider blev indsat i både Bt subsp. kurstaki og subsp. israelensis og testet under fluorescens-mikroskopi. Den kombination der gav det bedste signal var Bt subsp. israelensis indeholdende plasmid pAD44-12 (Figur 1), og denne konstruktion blev derfor udvalgt til dyreforsøget med kimfri rotter.
Til detektion af grønne vegetative celler i tarmen på rotterne har vi benyttet flow-cytometri, som er en meget følsom metode til at detektere og tælle fluorescerende bakterier. Flowcytometri af prøverne er blevet udført på Københavns Universitet af phd.-studerende Martin Iain Bahl.
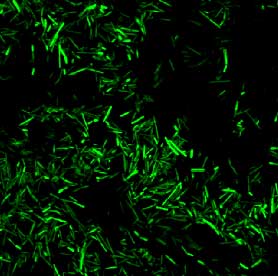
Figur 1. Bt bakterier mærket med GFP (grønfluorescerende protein).
2.3 Dyreforsøg
2.3.1 Kimfri rotter
DFVF har mange års erfaring med avl og håndtering af kimfri rotter, som ikke har en tarmflora. Dyrene købes fra Taconic i USA og holdes i specielle sterile isolatorer, hvor luften der indblæses til dyrene også er steril. Ind- og udslusning af prøver foregår sterilt via en sluse, og dyrene går på steril strøelse og får sterilt foder og vand. Disse dyr er velegnede til at teste enkelte bakterier da det ofte er muligt at kolonisere tarmen på dyrene med høje koncentrationer af den bakterie man vil undersøge.
Ulempen ved at anvende kimfri rotter er at man ikke kan undersøge effekten af og på den omkringliggende flora. Derudover er der andre fysiologiske forskelle mellem kimfri og konventionelle dyr, der kan have en indflydelse på de bakterier man undersøger.
2.3.2 Human Flora Associerede (HFA) rotter
HFA rotter er dyr, som oprindelige er kimfri, og som derefter oralt indgives en opslæmning af human fæces, sådan at de humane tarmbakterier etableres i rotternes tarm. Dyrene holdes i hele forsøgsperioden sterile på samme måde som de kimfri dyr. HFA dyr er det tætteste man kan komme på en menneskelig tarmfloramodel.
2.3.3 Udførte dyreforsøg
Projektet omfatter to større dyreforsøg, kaldet A og B, beskrevet i flowdiagrammerne nedenfor. Forsøg A blev udført som tre delforsøg (A1, A2 og A3) med HFA rotter med en B. cereus stammer og to stammer af Bt. Dyreforsøg B blev udført med kimfri rotter og Bt subsp. israelensis mærket med et grøn-fluorescerende protein.
DYREFORSØG A (2004):
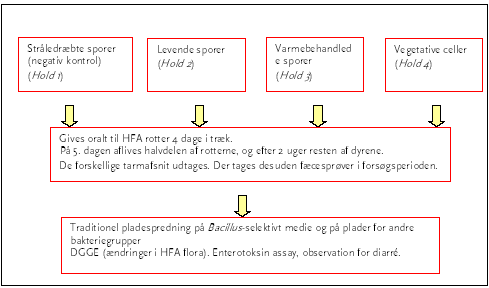
Forsøget blev udført som tre separate forsøg med hver sin stamme A1: B. cereus F4433/73, A2: Bt subsp. kurstaki og A3: Bt subsp. israelensis). Dyrene blev inddelt i fire hold, som blev doseret (dvs. fodret) med henholdsvis: 1) stråledræbte sporer, 2) ubehandlede sporer, 3) varmebehandlede sporer (80°C, 15 min) og 4) vegetative celler (Figur 2). Fremstillingen af de enkelte bakteriesuspensioner kan findes i Bilag A. Formålet med forsøgene var at:
1. undersøge overlevelse og spiring af sporer i tarmen
2. undersøge om der er forskel på ubehandlede og varmebehandlede sporer mht. til overlevelse og spiring
3. undersøge en evt. forskel i overlevelse af sporer og vegetative celler i tarmen
4. undersøge hvorvidt dosering med B. cereus og Bt kan ændre sammensætningen af den omkringliggende tarmflora
5. undersøge hvorvidt der kan detekteres enterotoksiner i tarmen
Figur 2. Dyreforsøg A blev udført som tre separate forsøg med B. cereus, Bt subsp. kurstaki og Bt subsp. Israelensis.
DYREFORSØG B (2005):
Dyreforsøg B blev udført med kimfri rotter, da resultater fra dyreforsøg A viste, at Bt koloniserer tarmen på HFA rotter til et niveau af ca. 106 bakterier pr. gram fæces. Dette lave niveau ville gøre det svært at detektere spirede grøn-fluorescerende bakterier, enterotoksinproduktion og en eventuel genoverførsel fra Bt (donorcelle) til en udvalgt recipientstamme, hvilket var formålet med dette forsøg.
Ved at anvende kimfri dyr opnås følgende fordele:
a) En forventet højere kolonisering af Bt i tarmen med en deraf følgende forventet højere mængde transkonjuganter (recipientceller der har modtaget DNA fra donor cellen) og/eller spirede bakterier som derfor bliver lettere at detektere.
b) Fravær af den omgivende flora vil i sig selv forenkle detektionen og nedsætte detektionsgrænsen, idet kun de bakterier, der er relevante for forsøget, er til stede i prøverne.
Ulempen ved at anvende kimfri dyr i stedet for HFA dyr er, at en eventuel effekt af den omgivende mikrobielle flora på spiring og/eller enterotoksinproduktion og/eller genoverførsel ikke vil fremgå af forsøget.
Dyreforsøg B blev udført som to delforsøg. I delforsøg B1 (Figur 3) anvendte vi den grøn-fluorescerende stamme af Bt subsp. israelensis. Dyrene blev kun doseret med ubehandlede sporer af stammen, da dyreforsøg A viste at varmebehandling af sporerne inden dosering ingen indflydelse har på overlevelse og spiring. I delforsøg B2 (Figur 4) blev dyrene først doseret med en recipientstamme, der er isogen med donor-stammen og som i reagensglas har vist sig at være i stand til at modtage det overførbare plasmid pXO16. Efter en uge blev der doseret med donor-stammen, indeholdende pXO16, som er et naturligt forekommende overførbart plasmid fra Bt subsp. israelensis. For at være i stand til at detektere overførsel af plasmidet til recipient-stammen benyttede vi en variant af pXO16 som var mærket med et tetracyklinresistensgen.
Formålet med forsøget var at:
1. undersøge spiring af sporerne v.h.a. GFP og flow-cytrometri
2. undersøge om eventuelle vegetative celler danner detektbare enterotoksiner
3. undersøge hvorvidt Bt er i stand til at overføre genetisk materiale i tarmen, hvilket i sig selv er en indikation på at sporerne har spiret
Figur 3. Dyreforsøg B1.
Figur 4. Dyreforsøg B2.

2.4 Undersøgelser af effekter på omkringliggende flora
2.4.1 Kimtællinger af fæces- og tarmprøver
Fæces- og tarmprøver fra dyreforsøg A blev fortyndet i fysiologisk saltvand og udpladet på forskellige selektive næringsmedier for at tælle antallet af bakterier i de største bakteriegrupper i den omkringliggende tarmflora, samt de doserede bakterier (B. cereus og Bt), som beskrevet i Tabel 2.
For at kunne skelne de tilsatte B. cereus og Bt fra den omkringliggende flora blev der anvendt et kommercielt Bacillus Cereus Selektivt Agar (Oxoid) tilsat det antibiotikum som stammen er resistent overfor. Forsøg viste at den anvendte humane fæces-flora ikke indeholdt andre B. cereus –lignende bakterier end dem der blev givet til dyrene.
Tabel 2. Medier til tælling af de forskellige undersøgte bakteriegrupper.
| Bakterie gruppe | Medium | Inkubering |
| B. cereus | Bacillus Cereus Selective Agar (BCSA)* (Oxoid) | 30°C, aerobt, 24 timer |
| B. cereus F4433/73 Bt subsp. kurstaki DMU67R |
Do. Indeholdende 50 μmg/ml rifampicin | |
| Bt subsp. israelensis | BCSA + 100 mg/ml streptomycin | |
| Total aerobe bakterier | Reinforced Clostridial Agar (Oxoid) | 37°C, aerobt, 72 timer |
| Total anaerobe bakterier | 37°C, anaerobt, 72 timer | |
| Laktobaciller | Rogosa agar (Oxoid) | |
| Koliforme | MacConkey Agar no. 3 (Oxoid) | 37°C, aerobt, 24 timer |
| Enterokokker | Slanetz & Bartley Medium (Oxoid) | 37°C, aerobt, 48 timer |
*Bacillus Cereus Selective Agar Base tilsat Bacillus Cereus Selective Supplement (Oxoid) og Egg Yolk Emulsion (Oxoid).
2.4.2 Molekylær metode
Da størstedelen af bakterierne i tarmen ikke kan dyrkes konventionelt, har vi anvendt Denaturerende Gradient Gel Elektroforese (DGGE), som er en forholdsvis ny metode til monitorering af ændringer i komplekse, mikrobielle økosystemer uden forudgående dyrkning [Muyzer and Smalla, 1998].
DNA fra fæces/tarmindhold blev oprenset, hvorefter det blev opformeret ved PCR (Polymerase Chain Reaction), en udførlig beskrivelse af metoden kan findes i Bilag A. Primerne til PCR er rettet mod generne for 16S ribosomalt RNA, og man kan vælge enten specifikke PCR-primere, der opformerer en given taksonomisk gruppe af bakterier, eller generelle primere, der opformerer rRNA fra den totale bakterie-population. I projektet er der blevet benyttet både generelle primere og specifikke primerne til at kigge på ændringer i flg. bakteriepopulationer: laktobaciller, bifidobakterier og bacteroides sp. (Bilag A).
PCR produkterne blev separeret på en denaturerende, elektroforetisk gradient gel (Bilag A). Gelen indeholdt en lineært stigende gradient af en blanding af urinstof og formamid. DNA molekyler med forskellige sekvenser vil ”smelte” (dele sig i to strenge) ved forskellige koncentrationer af urinstof og formamid. Idet der er en aftagende elektroforetisk bevægelighed af delvist smeltede DNA molekyler, vil DNA med forskellige sekvenser standse deres vandring ved forskellige positioner i gradient-gelen. Selv ganske små forskelle i sekvens vil give anledning til ændringer på gelen.
Gelmønstret giver en slags ’fingeraftryk’ af bakteriepopulationens sammensætning, som vil ændres, hvis der sker større ændringer i populationen. Mønstrene blev efterfølgende analyseret ved hjælp af specialiseret software (BioNumerics). Endvidere var det muligt at identificere de bakterie-grupper der giver anledning til de forskellige bånd på gradient-gelen ved at skære båndene ud af gelen, oprense DNA herfra, bestemme dets sekvens og sammenligne med kendte sekvenser i forskellige databaser (Bilag A).
2.5 Enterotoksin assays
Bakterier i B. cereus gruppen kan producere det hæmolytiske enterotoksin hæmolysin BL (BHL), det non-hæmolytiske enterotoksin (NHE), cytolysin K (CytK), samt en række andre produkter og enzymer, som alle kan være medvirkende til at fremkalde sygdom hos mennesker. De stammer af Bt, som blev undersøgt i projektet, har generne for disse produkter, og det vides at de udtrykkes under optimale betingelser i laboratoriet. Ekspressionen af generne (dvs. produktionen af toksin) kan imidlertid være reguleret af mange faktorer i bakteriernes omgivelser, og man ved ikke, om Bt stammerne danner disse toksiner i tarmen hos dyr og mennesker, eller i givet fald hvor store mængder, de er i stand til at lave. Produktion af enterotoksin blev undersøgt både vha. et kommercielt kit og vha. celle-assay.
2.5.1 Immunologisk detektion af HBL
Det kommercielle BCET-RPLA kit fra Oxoid blev brugt til at detektere enterotoksin HBL. Kittet detekterer L2 komponenten fra HBL, og har en meget lav detektionsgrænse på 2 ng toksin per ml. Enterotoksinet HBL består, ligesom enterotoksinet NHE, af tre komponenter som alle tre skal udtrykkes for at toksinet er fuldt virulent. Derfor er det ikke nok at benytte dette kit til bestemmelse af en Bt stammes virulens, og af den grund har vi også brugt celle-assay som beskrevet i næste afsnit.
2.5.2 Vero-celle assay
Udover de kendte toksiner, som Bt producerer, er der sandsynligvis også nogle, som vi endnu ikke kender og som kan være giftige for mennesker. Desuden kan man forestille sig at toksiciteten overfor mennesker ikke skyldes enkeltprodukter, men blandinger af forskellige produkter. Til detektion af en eventuel toksisk effekt af sådanne produkter på mennesker er det en fordel at anvende et test-system som ligner de menneskelige forhold så meget som muligt. Her har vi valgt at anvende en såkaldt Vero-cellelinie (dyrkede nyreceller fra grøn afrikansk abe, som vides at være følsomme overfor diverse enterotoksiner) til påvisning af cytotoksisk aktivitet i tarmindhold og/eller fæcesprøver fra HFA rotter, som har indtaget Bt.
Der laves en række fortyndinger af prøverne, som skal undersøges for toksin-indhold, og disse sættes på en Elisa plade, som indeholder de levende Vero-celler. Efter en inkubationsperiode tilsættes et rødt tetrazolium salt, som af levende Vero-celler omdannes til et gult formazan salt. Mængden af gult salt, der dannes over en given periode er derfor et mål for antallet af levende Vero-celler. Jo mere cytotoksisk aktivitet, der er i prøverne, jo færre levende Vero-celler vil der være tilbage og jo mindre gul vil farven i brøndene i Elisa pladen være. Konkret defineres cytotoksiciteten af prøven som den laveste fortyndingsfaktor, der resulterer i mere end 50% overlevelse af Vero-cellerne. Vero-cellernes 50% aktivitet bestemmes ved at inkludere en gradient med et forskelligt antal Vero-celler på alle Elisa pladerne.
2.5.3 Bestemmelse af detektionsgrænsen i Vero-celle assay
Antallet af bakterier i en 6 timers kultur blev bestemt og forskellige fortyndingsrækker blev fremstillet. Detektionsgrænsen blev bestemt som antallet af bakterier i den fortyndingsrække som tillod mere end 50% af Vero-cellerne at overleve. Antallet af B. cereus F4433/73 i en 6 timers kultur, som havde en Vero-toksisk aktivitet på 160 (dvs. kulturen skulle fortyndes 160 gange for at få mere end 50% overlevelse af Vero-cellerne), var 1,8 x 107 bakterier per ml kultur. Da den laveste realistiske fortyndingsfaktor er en 10 gange fortynding, som er 16 gange lavere den observerede fortyndingsfaktor for B. cereus F4433/73, kan detektionsgrænsen for Vero-toksisk aktivitet blive bestemt til 106 bakterier per ml kultur. Dette er dog et groft skøn idet produktionen af Vero-toksiske substanser afhænger af forskellige faktorer såsom alderen af kulturen og vækstraten. Toksiciteten studeret i kultur-alder eksperimentet (se nedenfor) viste at unge kulturer kan producere store mænger af Vero-toksiske substanser.
2.5.4 Effekt af vækstbetingelser på Vero-toksiske substanser
Tidligere undersøgelser har indikeret at bakteriernes vækstbetingelser kan have indflydelse på bakteriens Vero-toksicitet. Aktiviteten af en ung og en gammel kultur var reduceret i forhold til en ”midaldrende” kultur og (vækstmedie volumen/kolbe volumen) ratioen havde også en betydning for Vero-toksiciteten. To vækstbetingelser blev undersøgt for at bestemme effekten af ”volumen ratio”. B. cereus F4433/73R blev dyrket i 20 ml medium enten i 250 ml kolbe eller i 2 ml medium i 14 ml rør.
Når B. cereus F4433/73 blev dyrket i 20 ml BHIG i 250 ml kolbe ved 32°C og 271 rpm (rounds per minute) i seks timer, var Vero-toksiciteten kun 20, mens toksiciteten var 160 når bakterien blev dyrket i 2 ml BHIG i et 14 ml rør (se Figur 5). Alle dyrkninger blev herefter udført i 14 ml rør med 2 ml BHIG.

Figur 5. A: 250 ml kolber med 20 ml BHIG. B: 14 ml rør med 2 ml BHIG.
Ved at tage prøver ud til forskellige tidspunkter viste det sig at B. cereus F4433/73 ikke producerede detekterbare Vero-toksiske substanser i de første 2 timer efter ompodning af en udvokset kultur. Vero-toksiciteten var 80 efter 3, 4 og 5 timers inkubering. Toksiciteten nåede 160 efter 6 timer og dette niveau holdt sig også efter 8 timers inkubering. Baseret på dette, blev alle kulturer herefter høstet efter 6 timer.
2.5.5 Betydningen af sterilfiltrering for indholdet af Vero-toksiske substanser
For at være sikker på at steril-filtrering af fæces- og tarmprøver med ”low protein binding” filtre ikke binder store mængder af enterotoksiner under filtrering blev fortyndinger af B. cereus F4433/73 med og uden sterilfiltrering sammenlignet i et Vero-celle assay. Resultaterne viste at steril-filtrering ikke havde indflydelse på Vero-celle assayet (Figur 6). Forsøget viste endvidere at der ikke skete forurening af Vero-celle assayet selvom prøverne ikke blev sterilfiltreret. Dette betyder at en centrifugering ved 20.000 g var nok til at fjerne mikroorganismer, og at antibiotika tilsat Vero-celle vækstmediet er nok til at hæmme evt. tilbageværende mikroorganismer. Konsekvensen af denne observation, blev at sterilfiltrering kunne udelades i forsøgene, hvilket betød at sensitiviteten blev fordoblet, siden kun 1 ml 0,85% NaCl per gram tarmprøve var nødvendig og tab af ekstrakt under sterilfiltrering blev undgået.
A
B
Figur 6. Vero-celle assay til undersøgelse af effekten af sterilfiltrering. A: Datafilen viser OD (optical density) værdien ved 200 min fratrukket værdien ved tiden 0 min. Det røde område indikerer fortyndinger hvor mere end 50% af cellerne er dræbt af B. cereus F4433/73 toksin. B: Udregning af OD værdi svarende til 50% overlevelse af Vero-celler, som i denne plade blev beregnet til 0,406.
2.5.6 Ekstraktion af potentielle Vero-toksiske substanser fra tarmprøver
Siden prøverne fra tarmprøverne skulle analyseres både vha. celle-assay og det immunologiske RPLA-BCET assay, skulle ekstraktionsproceduren være anvendelig til begge protokoller. I RPLA metoden ekstraheres toksinet med 0,85% NaCl opløsning, og denne ekstraktionsmetode blev benyttet. Efter at tarmprøverne blev taget fra dyrene blev de holdt koldt (-80°C) indtil analyse. Der blev tilsat 1 ml 0,85% NaCl per gram tarmprøve, og alle ekstraktionsprocedurer blev udført ved 0-4°C. Tørre fæcesprøver blev rehydreret i 2 timer inden ekstraktion. Alle prøver blev homogeniseret i Eppendorfrør efterfulgt af 10 min centrifugering ved 15.000 x g, og opbevaret ved -80°C inden analyse.
2.5.7 Indflydelse af fæces på genfindelse af Vero-toksiske substanser
Tarmen indeholder en del hydrolytisk aktivitet, som kan inaktivere B. cereus toksinerne. For at undersøge denne aktivitet blev fæces fra kimfri rotter blandet med Vero-toksisk kulturekstrakt. Desuden blev effekten af fæces og 0,85% NaCl på den Vero-toksiske aktivitet testet i ni forskellige kombinationer (Tabel 3). Fæces fra kimfri dyr havde i sig selv ingen toksisk effekt på Vero-celler, og ligeledes havde fæces ingen negativ effekt på detektion af Vero-toksisk effekt af kulturekstrakter fra B. cereus F4433/73.
Tabel 3. Kombinationer af fæces, NaCl, BHIG og kulturekstrakt for at undersøge effekten af forskellige faktorer på den Vero-toksiske aktivitet.
| Kombinationer | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Fæces opløst i 0,85% NaCl | + | + | + | + | |||||
| 0,85% NaCl | + | + | + | + | |||||
| BHIG | + | + | |||||||
| Kulturekstrakt fra B. cereus F4433/73 | + | + | + | ||||||
| Kulturekstrakt fra Bt 407 dPlcR | + | + | + |
Version 1.0 Januar 2007, © Miljøstyrelsen.