Kortlægning og sundhedsmæssig vurdering af kosmetiske produkter til børn
6 Sundhedsvurdering
6.1 Udvælgelse af stoffer til sundhedsvurdering
Som udgangspunkt for udvælgelsen af stoffer til sundhedsvurderingen er anvendt listen over de hyppigst anvendte stoffer i de kosmetiske produkter til børn. Der er dog i udvælgelsen lagt vægt på stoffer med de mest bekymrende egenskaber, og der er primært valgt at lægge vægt på risikoen for udvikling af allergi.
Der er tidligere foretaget sundhedsvurderinger af en række af de 26 deklarationspligtige parfumestoffer, hvorfor disse ikke gentages i dette projekt. Desuden er parabener under risikovurdering i øjeblikket i EU, og fravælges derfor også ved sundhedsvurderingen i dette projekt.
I udvælgelsen af parfumestoffer til sundhedsvurderingen er der lagt vægt på analyseresultaterne, og således udvalgt et parfumestof, der er identificeret i analyserne i en koncentration, der kræver en særskilt deklaration af stoffet.
Valget af stoffer til sundhedsvurdering er derfor faldet på stofferne angivet i tabellen nedenfor.
| INCI navn | CAS Nr. | Kemisk navn (dansk) | Funktion | I antal kortlagte produkter |
| Benzyl alcohol | 100-51-6 | Benzylalkohol | Konserveringsmiddel. Parfumestof. Opløsningsmiddel. | 20 |
| Sodium benzoate | 532-32-1 | Natriumbenzoat | Konserveringsmiddel | 13 |
| Kathon | MI 2682-20-4 CMI 26172-55-4 MI/CMI 55965-84-9 |
MI = 2-Methyl-2H-isothiazol-3-on. CMI = 5-chloro-2-methyl-2H-isothiazol-3-on |
Konserveringsmiddel | 15 |
| Phenoxyethanol | 122-99-6 | 2-Phenoxyethanol | Konserveringsmiddel | 50 |
| 5-Bromo-5-nitro-1,3-dioxane | 30007-47-7 | 5-Bromo-5-nitro-1,3-dioxane | Konserveringsmiddel | 15 |
6.2 Parfumestoffer
6.2.1 Benzylalkohol
Forekomst og anvendelse
Der produceres årligt 40.000 tons benzylalkohol på verdensplan. Hovedparten (30%) bliver brugt som hærdemiddel i epoxymalinger, hvor det bliver kemisk bundet efter reaktion. Andre vigtige anvendelser er som opløsningsmiddel i lave koncentrationer i vandbaserede malinger (10%), som bestanddel i farvefjernere (10%), og som kemisk mellemprodukt i syntesen af benzylestere, der bliver brugt i aroma og parfumeindustrien (10%) (OECD SIDS, 2001). Endelig bliver benzylalkohol brugt i mange forskellige kosmetiske produkter som duftstof, konserveringsmiddel, opløsningsmiddel og viskositetsnedsættende middel (SCF 78, 2002). Benzylalkohol har en bakteriehæmmende virkning, hvorfor det også bliver brugt som konserveringsmiddel (Jensen AA, 1999).
I de undersøgte kosmetiske produkter til børn forekommer benzylalkohol i 20 af de 208 produkter, fordelt på seks hårfarver, seks badekonfetti/kaviar/fizzle salt-produkter, en tandpasta, en eau de toilette, en bodyshampoo/badegelé, en shampoo, et skumbadsprodukt, en bodylotion/creme og endelig et produkt i kategorien andet (body splash), dvs. i stort set alle former for kosmetiske produkter undersøgt i dette projekt.
Benzylalkohol bruges som et lokalbedøvelsesmiddel og farmaceutisk hjælpemiddel. Benzylalkohol er en naturlig bestanddel i en række forskellige planter, bl.a. i jasmin. Benzylalkohol forekommer naturligt i f.eks. nogle spiselige frugter (op til 5 mg/kg) og i grøn og sort te (henholdsvis 1-30 og 1-15 mg/kg). Benzylalkohol tilsættes også nogle fødevarer og drikkevarer som smagsstof (op til 400 mg/kg – for tyggegummi dog 1254 mg/kg). (SCF 78, 2002; Jensen AA, 1999). I Europa anvendes årligt ca. 110 tons benzylalkohol som tilsætningsstof i fødevarer. WHO estimerer, at det daglige indtag af benzylalkohol er på 16.000 µg/dag svarende til 270 µg/kg legemsvægt/dag i Europa (WHO, 2002).
Identifikation
| Kemisk navn | Benzylalkohol |
| Synonymer | (Hydroxymethyl)benzene Benzenecarbinol a-Hydroxytoluene Phenylmethanol Phenylmethyl alcohol |
| INCI navn | Benzyl alcohol |
| CAS-Nr. | 100-51-6 |
| EINECS Nr. | 202-859-9 |
| Bruttoformel | C7H8O |
| Molekylstruktur | 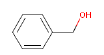 |
| Lovgivning: Listen over farlige stoffer (BEK 923, 2005) Listen over uønskede stoffer (Orientering fra Miljøstyrelsen nr. 8, 2004) MST Selvklassificering (Miljøprojekt nr. 635, 2001) Kosmetikbekendtgørelsen (BEK 422 , 2006) |
XN; R20/22. Konc. = 25%: XN; R20/22 R20/22 = ” Farlig ved indånding og ved indtagelse”. Ja Nej Højest tilladte koncentration som konserveringsmiddel i kosmetiske produkter er 1%. (Bilag 5, løbenummer 4 VI, 1, 34) Er en af de 26 parfumestoffer, der af SCCNFP* er vurderet som allergen ved hudkontakt. Som parfumestof skal tilstedeværelsen af stoffet angivet på indholdsdeklarationen, når koncentrationen overstiger 0,001% i produkter, som ikke afrenses og når koncentrationen overstiger 0,01% i produkter, som afrenses. |
| International Fragrance Association (IFRA) | Ingen retningslinjer fra IFRA for dette stof |
* Den videnskabelige komite for kosmetik og andre forbrugerprodukter end fødevarer
Fysisk kemiske egenskaber
De fysisk kemiske egenskaber for benzylalkohol er fundet via TOXNETs ChemIDplus database, Chemfinder og OECDs rapport om benzoater (OECD SIDS, 2001).
| Fysisk tilstandsform | Farveløs væske |
| Molvægt (g/mol) | 108,14 |
| Smeltepunkt | -15 °C |
| Kogepunkt | 205 °C |
| Damptryk | 0,13 hPa ved 20 °C 0,3 hPa ved 20 °C (ifølge IUCLID, 2000b) 0,02 kPa ved 250 °C |
| Octanol-vand fordelingskoefficient (log POW) | 1,1 |
| Vandopløselighed | 42,9 g/L ved 25 °C 35 g/L ved 20 °C |
Ifølge HSDB er benzylalkohols lugtgrænse på 5,5 ppm.
Optagelse og distribution
Benzylalkohol bliver let optaget gennem huden – det, der ikke når at fordampe først. I dyreforsøg med rhusus aber blev benzylalkohol smurt på abernes hud. Ved almindelig påsmøring blev kun 32% absorberet gennem huden i løbet af 24 timer, fordi stoffet fordampede. Under omstændigheder, hvor benzylalkohollen ikke kunne fordampe så let, blev 56-80% af stoffet absorberet. (IUCLID, 2000b).
Benzylalkohol optages let i mave-tarmkanalen. Efter optagelsen omdannes det hurtigt i leveren til benzoesyre, som udskilles inden 24 timer, hovedsageligt som hippursyre i urinen. Ved meget høje doser (> 500 mg/kg/dag ved oralt indtag) kan der forekomme en mætning af denne stofskifteproces. (Jensen AA, 1999; Nair B, 2001; OECD SIDS, 2001; WHO, 2002).
Akut toksicitet
Benzylalkohol har tidligere været brugt i koncentrationer på omkring 1% som konserveringsmiddel i infusionsvæsker med fysiologisk saltvand og i en lang række injektionspræparater. I 1983 advarede Sundhedsstyrelsen mod denne anvendelse, da der i USA i begyndelsen af 1980’erne blev rapporteret om hjerneskader, blodændringer og flere dødsfald blandt for tidligt fødte spædbørn forårsaget af disse anvendelser. Totaldosis tilført de børn, der døde, var 130-405 mg benzylalkohol per kg legemsvægt per dag. Dette svarer til den intravenøse LD50-værdi fundet i forsøgsdyr. Indtaget gennem munden er benzylalkohol 25 gange mindre akut giftigt. (Jensen AA, 1999).
Indtagelse af store mængder benzylalkohol fører til opkastninger og diarré og depression af centralnervesystemet (HSDB). Tilsvarende har fem for tidligt fødte spædbørn fået flere injektioner tilsat bakteriehæmmende vand med 0,9% benzylalkohol. Daglige doseringer var på 99-234 mg benzylalkohol per kg legemsvægt. Effekterne der sås var gradvis neurologisk nedbrydning, alvorlig acidosis (abnormt stærk syredannelse i kroppen), markant gispende vejrtrækning, nedbrydning af huden, påvirkninger af blodet, påvirkning af lever- og nyrefunktion, lavt blodtryk og kollaps af hjertekarsystemet (Gershenk et al, 1982).
Ifølge ”Listen over farlige stoffer” vurderes benzylalkohol at være sundhedsskadeligt ved indånding og ved indtagelse. I Tabel 6-1 er anført den akutte giftighed i forsøgsdyr.
Tabel 6-1: Akut toksicitet (LD50) af benzylalkohol
| Art | Eksponering | LD50 (mg/kg lgv) |
Reference |
| Kanin | Oral | 1000 | Graham & Kuizenga, 1945 |
| Rotte | Oral | 1600 | Procter & Gamble, 1992 |
| Rotte | Oral | 3100 | Smyth et al., 1951 |
| Rotte | Oral | 2080 | Opdyke, 1973. Graham & Kuizenga, 1945 |
| Mus | Oral | 1580 | Opdyke, 1973. Jenner et al, 1964. |
| Rotte | Oral | 1610 | Loeser, 1978. |
| Rotte | Oral | 1230 | RTECS |
| Rotte | Oral | 1610 | IUCLID, 2000b |
| Rotte | Oral | 1230 | IUCLID, 2000b |
| Mus | Oral | 1150 | IUCLID, 2000b |
| Kanin | Oral | 1040 | IUCLID, 2000b |
| Kanin | Dermal | 2000 | NPIRI, 1974. |
| Marsvin (guinea pig) |
Dermal | < 5000 | IUCLID, 2000b |
WHO har sat en grænse for det acceptable daglige indtag for benzylalkohol på 5 mg/kg/dag. US FDA (US Food and Drug Administration) anser generelt benzylalkohol for at være sikkert til brug i fødevarer. (Nair B., 2001). En WHO-arbejdsgruppe har undersøgt benzylalkohol og andre lignende tilsætninger til fødevarer og konkluderer, at benzylalkohol ikke giver anledning til bekymring i forhold til sundheden ved fortsat brug på det nuværende niveau (WHO, 2002).
Ved forsøg med rotter sås ingen effekter ved dosis på 500 mg/kg legemsvægt/dag (375 mg/kg legemsvægt/dag, når der justeres for, at der kun gives dosis fem gange per uge). Værdien er baseret på et 16-dages studie, hvor effekterne ved højere doser var øget dødelighed, fald i legemsvægt, blødninger og sløvhed. Tilsvarende sås ingen effekter ved dosis på 400 mg/kg legemsvægt/dag (286 mg/kg legemsvægt/dag justeret for fem dages dosis) i et subkronisk studie over 13 uger. Der var neurotoxiske effekter ved højere doser. Ved tilsvarende 16 dages og subkronisk (13 uger) forsøg med mus sås ingen effekter ved henholdsvis 250 (188 når justeret for fem dages dosis) og 400 (286 når justeret for fem dages dosis) mg/kg legemsvægt/dag. Ved 16-dages forsøget var effekterne sløvhed ved højere dosis og ved 13 ugers forsøget var der neurotoxiske effekter ved højere dosis. (NTP, 1989). På baggrund af disse forsøg kan 400 (286) mg/kg legemsvægt/dag anses som NOAEL værdi.
Lokal irritation
Benzylalkohol virker irriterende på hud (i en 0,5% opløsning), slimhinder og øjne (ved 100 mg pr. dyr) og virker bedøvende på nervesystemet. (Jensen AA, 1999; IUCLID, 2000b; OECD SIDS, 2001).
Allergi
I lappeprøver på mennesker har benzylalkohol vist sensibiliserende egenskaber i nogle forsøg, men også tvetydige og negative resultater er set (IUCLID, 2000b; OECD SIDS, 2001). Den videnskabelige komite for kosmetik og andre forbrugerprodukter end fødevarer (SCCNFP) vurderer, at benzylalkohol er et af de parfumestoffer, der hyppigst er rapporteret som allergent for forbrugere. (SCCNFP 0017, 1999). Benzylalkohol er et af de 26 deklarationspligtige parfumestoffer som ifølge Kosmetiklovgivningen særskilt skal deklareres, netop med det formål, at allergikere kan undgå stoffet.
Længerevarende, gentagen påvirkning og genskadende effekter
Benzylalkohol udviser generelt lav toxicitet ved gentagen påvirkning (OECD SIDS, 2001). Ved langtidsforsøg med rotter og mus var der ingen alvorlige effekter af benzylalkohol – effekterne var begrænset til at være reduceret fødeindtag og reduceret vækst ved doser på mere end 400 mg/kg legemsvægt/dag.
I et reproduktionsstudie med mus var effekterne lavere moderkropsvægt og faldende middelvægt af kuldene. I et andet studie blev der også noteret en lavere fostervægt i forhold til kontrolgruppen, mens et tredje studie ingen forskel viste mellem kontrolgruppen og gruppen af dyr udsat for benzylalkohol (Nair B, 2001).
I dyreforsøg med mus og rotter var der ingen tegn på, at benzylalkohol er kræftfremkaldende. (Jensen AA, 1999; Nair B., 2001; WHO, 2002; NTP, 1989).
I langtidsforsøg på mus og rotter var der ingen tegn på kræftfremkaldende effekt af benzylalkohol i hverken hun- eller hanrotter ved doseringer på 200 og 400 mg/kg i foderet. Tilsvarende var der ingen tegn på kræftfremkaldende effekt af benzylalkohol i hverken hun- eller hanmus ved en dosering på 100 og 200 mg/kg i to år (NTP, 1989). I OECD SIDS rapporten om benzoater angives en NOAEL-værdi for benzylalkohol på henholdsvis =400 mg/kg/dag for rotteforsøget og =200 mg/kg/dag for forsøget med mus baseret på ovenstående NTP-rapport (OECD SIDS, 2001).
I OECD SIDS rapporten angives en NOAEL-værdi for benzylalkohol på 550 mg/kg lgv/dag for udviklingstoxicitet for mus (OECD SIDS, 2001).
Benzylalkohol har ikke vist sig at være mutagent i Ames-testen og andre bakterietester eller i cellekulturer (Jensen AA, 1999; Nair B., 2001; WHO, 2002; NTP, 1989).
Kritisk effekt
Den kritiske effekt af benzylalkohol ved længere tids påvirkning vurderes at være neurotoxiske effekter. Her er angivet en NOAEL-værdi på 400 mg/kg legemsvægt/dag. Mht. benzylalkohols akutte toksicitet er der set dødelighed ved dosis på ned til 100 mg/kg legemsvægt/dag for for tidligt fødte spædbørn. Dosis blev her givet intravenøst. Ved indtag gennem munden er benzylalkohol 25 gange mindre akut giftigt. I forsøg med mus er angivet en NOAEL-værdi på 188 mg/kg legemsvægt/dag, hvor den akutte toksicitet ved højere niveauer var sløvhed. Den kritiske effekt af benzylalkohol er således sløvhed (NOAEL-værdi 188 mg/kg legemsvægt/dag). Denne værdi anvendes i risikovurderingen på trods af, at der er set dødelighed ved intravenøs påvirkning ved lavere doser, da den akutte effekt af benzylalkohol intravenøst er 25 gange højere end gennem munden.
6.3 Konserveringsmidler
6.3.1 Natriumbenzoat
Natriumbenzoat er natriumsaltet af benzoesyre, der også virker konserverende (WHO, 2000). Natiumbenzoat omdannes til benzoesyre i sure miljøer. Generelt vurderes benzoesyre og natriumbenzoat derfor samlet i en sundhedsvurdering – og det gælder også for parfumestoffet/konserveringsmidlet benzylalkohol, som er beskrevet ovenfor. Natriumbenzoat og benzoesyre hører til en forholdsvis ens kemisk gruppe, og benzylalkohol kan oxideres til benzoesyre. Alle tre stoffer har derfor lignende sundhedsmæssige egenskaber (OECD SIDS, 2001).
Begrænsninger for natriumbenzoat i forhold til kosmetiske produkter er sat som en maximumgrænse for ”salte af benzoesyre”, hvor det max tilladte procentvise indhold beregnes som benzoesyre (BEK 422, 2006). De fysisk-kemiske parametre er derfor angivet for både natriumbenzoat og benzoesyre.
Forekomst og anvendelse
I de undersøgte kosmetiske produkter til børn forekommer natriumbenzoat i 13 af de 208 produkter, fordelt på fem tandpastaer, tre shampooer, to skumbadsprodukter, en bodyshampoo/badegelé, en fast sæbe og en balsam.
OECD vurderer, at der på verdensplan årligt produceres 75.000 tons natriumbenzoat. Hovedparten[14] bliver brugt som konserveringsmiddel i fødevarer og drikkevarer, og en stor del bliver brugt som rusthæmmende middel, i særdeleshed som et additiv til frostvæske til biler eller anden kølevæske. Natriumbenzoat bliver brugt til mange andre formål også, såsom stabilisator ved fotobearbejdning, i medicinalvarer, i plast som eksempelvis polypropylen for at forbedre styrke og klarhed, samt i kosmetiske produkter. I de fleste anvendelser er den primære funktion konserveringsmiddel. (OECD SIDS, 2001; WHO, 2000).
Natriumbenzoat anvendes som konserveringsmiddel (E211 – ”Atamon”) i bl.a. marmelade, syltetøj, saft, grøntsager i lage, læskedrikke, fiskevarer som marinerede sild og kaviar, overfladebehandling af tørrede kødprodukter, flydende ægprodukter m.m. Natriumbenzoat forekommer naturligt i frugter og bær. De eneste frugter, der har et indhold af natriumbenzoat af betydning er tyttebær, tranebær og multebær. De indeholder mellem ca. 600 og 2000 mg/kg. (Biosite, 2006; E nummer guiden, 2004; Fødevarestyrelsen, 2004).
Ifølge Positivlisten må indholdet af benzoesyre og dets salte ikke overstige 6 g/kg i specielle krebsdyr og bløddyr. Andre eksempler på grænser for benzoesyre i fødevarer er 200 mg/l i saft, alkoholfri øl og spiritus (under 15% alkohol), 500 mg/kg i sky, frugtsmørepålæg og marmelade, 600 mg/l i flydende frugtte, 1 g/kg i krydderier, 1,5 g/kg i fødevarer til særlige medicinske formål, tyggegummi og slankekostprodukter, 2 g/kg i kosttilskud og fisk, og 5 g/kg i flydende ægprodukter. (Positivlisten, 2005).
HSDB giver et eksempel på en koncentration af natriumbenzoat på 0,125% i en bodylotion. (HSDB).
Ifølge JECFA (Joint FAO/WHO Expert Committee on Food Additives) indtager vi imellem 0,18 og 2,3 mg benzoat per kg legemsvægt per dag. Den lave værdi stammer fra Japan og den høje værdi illustrerer det daglige indtag i USA (WHO, 2000).
Identifikation
| Kemisk navn | Natriumbenzoat | Benzoesyre |
| Synonymer | Benzosyre, natrium salt Antimol Benzoat af soda |
Benzenecarboxylic acid Benzenemethanoic acid |
| INCI navn | Sodium benzoate | Benzoic acid |
| CAS-Nr. | 532-32-1 | 65-85-0 |
| EINECS Nr. | 208-534-8 | 200-618-2 |
| Bruttoformel | C7H5NaO2 | C7H6O2 |
| Molekylstruktur | 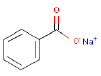 |
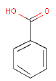 |
| Lovgivning: Listen over farlige stoffer (BEK 923, 2005) Listen over uønskede stoffer (Orientering fra Miljøstyrelsen nr. 8, 2004) MST Selvklassificering (Miljøprojekt nr. 635, 2001) |
Nej Nej Nej |
Nej Nej Nej |
| Kosmetikbekendtgørelsen (BEK 422 , 2006) |
Salte af benzosyre er tilladt i kosmetiske produkter, men i en maximumkoncentration på 0,5% regnet som syre. (Bilag 5 løbenummer 3, VI, 1, 1). | |
Fysisk kemiske egenskaber
Oplysninger om natriumbenzoats fysisk kemiske egenskaber er fundet via Chemfinder, TOXNETs ChemIDPlus database, en rapport fra OECD SIDS om benzoater og via sikkerhedsdatablade for natriumbenzoat (OECD SIDS, 2001; Malinckrodt Chemicals, 2004; Safety Emporium, 2004).
| Natriumbenzoat | Benzoesyre | |
| Fysisk tilstandsform | Hvidt krystallisk pulver | Hvidt krystallinsk pulver |
| Molvægt (g/mol) | 144,11 | 122,12 |
| Smeltepunkt | 331 °C | 122 °C |
| Kogepunkt | 465 °C | 249 °C |
| Damptryk | < 0,001 hPa | 0,0004 mmHg ved 25 °C |
| Octanol-vand fordeling (log POW) | -2,27 | 1,87 |
| Vandopløselighed | 556 g/l ved 25 °C | 3,4 g/l ved 25 °C |
Optagelse og distribution
Natriumbenzoat optages let i mave-tarmkanalen. Natriumbenzoat forventes at dissociere øjeblikkeligt til benzoesyre i sure miljøer, og dermed også i maven. Benzoesyren bindes til aminosyren glycin og udskilles hovedsageligt som hippursyre i urinen inden 24 timer. (Nair B, 2001; OECD SIDS, 2001).
Akut toksicitet
WHO har sat en grænse for den acceptable daglige indtagelse (ADI) for natriumbenzoat på 5 mg/kg/dag. US FDA (US Food and Drug Administration) anser generelt natriumbenzoat for at være sikkert til brug i fødevarer (Nair B, 2001).
Der er en begrænset mængde data for den akutte toksicitet af natriumbenzoat, og de studier, der findes, er ikke gennemført efter nutidens guidelines (WHO, 2000). De fundne LD50 værdier for natriumbenzoat er angivet i Tabel 6.2. De angivne værdier betyder, at natriumbenzoat ikke skal klassificeres som sundhedsskadeligt ved indtagelse.
Tabel 6.2: Akut toksicitet (LD50) af natriumbenzoat
| Art | Eksponering | LD50 (mg/kg lgv) |
Reference |
| Rotte | Oral | 3140 | Loeser, 1977. |
| Rotte | Oral | 4070 | Smyth & Carpenter, 1948. |
| Rotte | Oral | 2100* | Deuel HJ et al, 1954 |
| Rotte | Oral | 3450* | Deuel HJ et al, 1954 |
* Beregnet som benzoesyre
Den primære effekt ved indtagelse af moderate mængder benzoater er irritation af mavetarmsystemer. Indtagelse af store mængder benzoater (> 1 mg/kg legemsvægt/dag) kan forårsage lavt pH værdi i blodet (acidosis). (HSDB).
Lokal irritation
Natriumbenzoat vurderes ikke til at være hudirriterende, men lettere irriterende for øjne. (OECD SIDS, 2001; WHO, 2001).
Allergi
Der er rapporteret tilfælde af nældefeber, astma, rhinitis (helårssnue) og anafylaktisk chok (heftig allergisk reaktion med hududslæt og åndedrætsbesvær) efter oral eksponering, hudeksponering eller indånding af natriumbenzoat (WHO, 2000).
Natriumbenzoat er ikke hudsensibiliserende i forsøg med dyr, men i mennesker udsat ved lappeprøver er der en lav grad af hudsensibilisering (5 ud af 2045 tilfælde (0,2%) var positive). (OECD SIDS, 2001; WHO, 2000). Det er vurderet, at der skal en udsættelse for 50 mg benzoat på én gang til at udløse en allergisk reaktion hos følsomme personer (Fødevarestyrelsen, 2004).
Længerevarende, gentagen påvirkning og genskadende effekter
Ved langtidsforsøg med rotter og mus var effekterne begrænset til at være reduceret fødeindtag og reduceret vækst. Der er ikke observeret reproduktionsskadende eller kræftfremkaldende effekter af natriumbenzoat ved forsøg med rotter og mus.
Der opgives i litteraturen forskellige NOAEL-værdier på henholdsvis 1000, >1090, 1310 og 3145 mg/kg lgv/dag (Deuel HJ et al, 1954; Onodera et al, 1978; Sodemoto & Enomoto, 1980; IUCLID, 2000c; SCCNFP 0532, 2002). Den højeste værdi er den ældste.
Der er ikke rapporteret alvorlige bivirkninger efter terapeutisk brug af natriumbenzoat ved doser på mellem 250 og 500 mg/kg lgv/dag i mennesker, selvom der dog har været observeret enkelte tilfælde af anorexi og opkastninger (WHO, 2000).
Den videnskabelige komite for kosmetik og andre forbrugerprodukter end fødevarer (SCCNFP) har vurderet, om det er sikkert at anvende benzoesyre og dets salte og estere til ikke-konserverende formål i en maximumkoncentration på 2,5% i kosmetiske produkter, der skylles af efter brug. SCCNFP konkluderede, at data ikke var tilstrækkelige til at kunne udføre en risikovurdering af benzoesyre og natriumbenzoat for disse ikke-konserverende formål i kosmetiske produkter. (SCCNFP 0532, 2002).
Natriumbenzoat har vist sig ikke at være mutagent i Ames tests og andre tests (Nair B., 2001; OECD SIDS, 2001; WHO, 2000).
Kritisk effekt
Den kritiske effekt for natriumbenzoat vurderes at være irritation af mavetarmsystemet ved oral indtagelse. Der er ikke fundet en eksakt NOAEL-værdi for denne effekt, men NOAEL-værdien ligger på mellem 250 og 500 mg/kg legemsvægt/dag, selvom der her er set et enkelt tilfælde af opkastninger.
6.3.2 Kathon
Kathon er det kommercielle navn og en samlebetegnelse for de to stoffer methylchlorisothiazolinon og methylisothiazolinon, der også ofte forkortes henholdsvis CMI og MI. Ifølge Kosmetikbekendtgørelsen (BEK 422 §25, 2006) er den højest tilladte koncentration af Kathon i kosmetiske produkter på 0,0015% af en blanding i forholdet 3:1 af methylchlorisothiazolinon og methylisothiazolinon.
Da Kathon anvendes i CMI/MI forholdet 3:1 i kosmetiske produkter er det også denne blanding, der primært bliver vurderet i denne sundhedsvurdering. De fleste undersøgelser har også været foretaget på blandingen og ikke på de enkelte isothiazolinoner.
Der har tidligere været foretaget en sundhedsvurdering af Kathon i Environmental Project No. 615 fra Miljøstyrelsen 2001. Denne sundhedsvurdering er blevet opdateret med nye data (Madsen T et al, 2001).
Forekomst og anvendelse
Kathon bruges i kosmetiske produkter som konserveringsmiddel. Kathon anvendes i både ”leave-on” produkter (primært body lotions og andre former for cremer) og ”rinse-off” produkter, såsom shampoo og bodyshampoo (SCCNFP 0625, 2003).
I de undersøgte kosmetiske produkter til børn forekommer Kathon i 15 af de 208 produkter, fordelt på otte bodyshampoo/badegelé-produkter, to shampooer, to skumbadsprodukter, en flydende sæbe, en eau de toillette og en bodylotion/creme.
Identifikation
I nedenstående tabel er den kemiske identifikation af methylisothiazolinon, methylchlorisothiazolinon og blanding af disse to stoffer opsummeret.
Tabel 6.3: Identifikation af Kathon
Fysisk kemiske egenskaber
I tabellen nedenfor er de fysisk kemiske egenskaber af Kathon opsummeret. Oplysningerne er baseret på oplysninger fra SCCNFP (SCCNFP 0805, 2004) og (SCCNFP 0625, 2003), samt oplysninger fra IUCLID databasen, der dog kun dækker egenskaberne for blandingen af de to stoffer.
Tabel 6.4: Fysisk kemiske egenskaber af Kathon
| Methylisothiazolinon | Methylchlorisothiazolinon | Kathon (blandingen) | |
| Fysisk tilstandsform | Råhvidt eller lyst brunt fast stof ved stuetemperatur | Fast stof | |
| Molvægt (g/mol) | 115.16 | 149.59 | |
| Densitet | 1,35 g/cm³ ved 25 °C | 1,2556 g/cm³ ved 20 °C | |
| Smeltepunkt | 46,7 – 48,3 °C | Ca. 50-55 °C | |
| Kogepunkt | Termisk dekomponering ved 155 °C | 106,5 °C ved 1000 hPa | |
| Damptryk ( | 0,73 Pa ved 20 °C | 20,8 hPa ved 20 °C | |
| Octanol-vand fordeling (log POW) | -0,486 ved 24 °C | -0,71 – 0,75 ved 20 °C | |
| Vandopløselighed | > 1000 g/l ved 20 °C | > 5000 mg/l ved 20 °C | |
| Flammepunkt | > 100 °C |
Optagelse og distribution
Kathon udskilles forholdsvist hurtigt efter optagelse i kroppen. Rotter, der oralt har indtaget Kathon 886, udskilte størstedelen af MI og CMI problemfrit med urinen eller fæces (CIRP, 1992). Forsøg med C14-mærkning af chlorforbindelsen (CMI) har vist, at mere end 50% udskilles med fæces eller urinen efter 24 timer og omkring 70% (fæces 35%, urin 31% og CO2) efter 96 timer (Debethizy et al, 1986).
Kathon 886 distribueres hurtigt til blod, lever, nyrer og testikler efter en intravenøs dosis (0,8 mg/kg lgv) (CIRP, 1992).
Halveringstiden for dermal absorberet forbindelser er fundet til at være 13,1 dag. Dette tyder på et forøget potentiale for akkumulering i kroppen ved gentagen påføring eller brug (Conner et al, 1996).
Akut toksicitet
Kathon (CMI og MI) er moderat til meget giftigt ved oral indtagelse (tabel Tabel 6.5). Tegn på giftighed er bl.a. sløvhed, ataksi (tab af fuld kontrol over kropsbevægelighed) og alvorlig maveirritation. Der er set tegn på forgiftninger ved doser fra 75 mg MI/kg legemsvægt/dag i hunrotter (150 mg MI/kg legemsvægt/dag for hanrotter). (Rohm and Haas, 1999; Rohm and Haas, 2000a; SCCNFP 0625, 2003; CIRP, 1992).
In vitro-forsøg med normal human keratinocytcellekulturer viste, at en kortvarig eksponering (10 min) med CMI/MI i koncentrationer mellem 0,001% og 0,1% fremkalder en cytotoxisk (celledræbende) effekt, der er koncentrationsafhængig (Ettorre A. et al, 2003).
Tabel 6.5: Akut toksicitet (LD50) af Kathon
| Stof | Art | Eksponering | LD50 (mg/kg lgv) |
Reference |
| MI | Rotte | Oral | 183-235 | Rohm and Haas, 1999 |
| MI | Rotte | Oral | 106-275 | Rohm and Haas, 2000a |
| MI | Rotte | Dermal | > 485 | Rohm and Haas, 2000b |
| Neolone 950 (regnet som MI) |
Rotte | Oral | 104 - 269 | Rohm and Haas, 2004b |
| Neolone 950 (regnet som MI) | Rotte | Dermal | > 475 | Rohm and Haas, 2004b |
| Kathon CG (regnet som CMI/MI total) | Rotte | Oral | 39,5-50,3 | Rohm and Haas, 2004a |
| Kathon CG (regnet som CMI/MI total) | ? | Dermal | 75 | Rohm and Haas, 2004a |
| CMI | Rotte | Dermal | > 1008 | IUCLID, 2000a |
| CMI | Rotte | Oral | 481 | IUCLID, 2000a |
| CMI | Rotte/mus | Oral | 53-60 | DFG, 1993 |
| Kathon CG | Rotte | Oral | 3350* | CIRP, 1992 |
| CMI | Kanin | Dermal | 80 | DFG, 1993 |
* Tyder på, at værdien er for det solgte product Kathon CG og ikke beregnet for det totale indhold af CMI/MI.
Lokal irritation
Kathon er i sin rene form ætsende for både hud og øjne. Opløsninger indeholdende mere end 0,5% aktive isothiazolinoner er meget hudirriterende på mennesker og kan forårsage ætsning af slimhinder og hornhinder. (DFG, 1993; CIRP, 1992).
For de to enkeltstoffer i Kathon gælder ligeledes, at de hver for sig er ætsende i ren form. MI er hverken hud- eller øjenirriterende (på kaniner) ved 100 ppm (0,01%) aktivt indholdsstof. Der er ikke fundet data, der indikerer, hvor irriterende CMI er i ufortyndet form. (Rohm and Haas, 2000d; IUCLID, 2000a; Rohm and Haas, 2000e).
Allergi
Sensibiliseringspotentialet for Kathon (CMI/MI) for mennesker er godt beskrevet i litteraturen. Der er en generel holdning om, at CMI/MI er en sensibilisator. CMI/MI blev i begyndelsen af 1980’erne introduceret som konserveringsmiddel i kosmetik og gav anledning til en epidemi af allergitilfælde i Europa. De mange tilfælde af allergi har ført til en begrænsning af anvendelsen af CMI/MI. I 2005 var 1,6% af eksempatienter i Danmark allergiske overfor CMI/MI. Dette tal er stort set uændret fra 2003 og 2004, og CMI/MI regnes fortsat en af de hyppigste årsager til konserveringsmiddelallergi i Danmark. (Videncenter for Allergi, 2006b). Billedet i Tyskland var det samme, da CMI/MI blev introduceret som konserveringsmiddel i 1980’erne. Her var 5,2% af patienterne allergiske overfor CMI/MI. Reduktion i brugskoncentrationen af CMI/MI har siden halveret dette tal (Alexander BR., 2002).
I et notat til ECB (European Chemicals Bureau) om CMI/MI beskrives tre forsøg med patchtest på børn. Studierne udført i Norge (i 1991), i Tyskland (i 1990-1995) og i Italien (i 1988-1994) viser, at henholdsvis 5,2%, 1,1% og 5,7% reagerede positivt overfor Kathon CG. Studierne demonstrerer, at Kathon CG er sensibiliserende, og at arbejdsbetinget eksponering kan udelukkes. Kathon fra kosmetiske produkter er den mest sandsynlige årsag til sensibiliseringen. I samme notat beskrives en undersøgelse i Japan, hvor 0,9% reagerede positivt på en patchtest i perioden 1989 til 1992, og det på trods af, at Kathon CG kun er blevet brugt i produkter, der skylles af efter brug, i en max. koncentration på 15 ppm. En koncentration på 15 ppm i produkter, der skylles af efter brug udgør således også en risiko for sensibilisering af Kathon CG. (ECB, 1999). I dag er Kathon tilladt i en maximal koncentration på 15 ppm, men også i produkter, der har til formål at blive på huden.
Dermatologiske studier har vist, at isothiazolinonkoncentrationer under 20 ppm kan forårsage sensibilisering, og at allergiske reaktioner kan fremprovokeres i allerede sensibiliserede personer ved koncentrationer på 7-15 ppm. (DFG, 1993).
Det er primært CMI, som er det sensibiliserende stof i Kathon (CMI/MI), men MI har også sensibiliserende egenskaber. SCCNFP (Scientific Committee on Cosmetic Products and Non-Food Products) vurderer, at der er mindst en faktor 30 i forskel på blandingen CMI/MI og MI i sensibiliseringspotentialet for de to produkter. (SCCNFP 0625, 2003). ECB (2002b) karakteriserer blandingen CMI/MI som en ekstrem sensibilisator og MI som en stærk sensibilisator på baggrund af de EC3 værdier[15], der er fundet i LLNA-tests (Local Lymph Node Assay).
ECB’s Working Group on Sensitisation har opstillet en tærskelværdi for sensibilisering for Kathon CG på < 3 ppm på baggrund af flere publicerede Guinea Pig Maximazation Tests. (ECB, 2002a). Tilsvarende har Alexander (2002) opstillet en tærskelværdi for sensibilisering for CMI/MI på 58 ppm baseret på dyreforsøg og 10-20 ppm baseret på humanforsøg. For MI er den tilsvarende tærskelværdi for sensibilisering 800 ppm, baseret på dyreforsøg. Højest testede dosis for blandingen CMI/MI, der ikke var sensibiliserende, er ved dyreforsøg fundet til 36 ppm og 500 ppm for MI. (Alexander BR, 2002).
En artikel i Ugeskrift for Læger beskriver, at personer med kendt kathonallergi har fået kraftige allergiske reaktioner ved at opholde sig i rum malet med vandbaseret plasticmaling konserveret med Kathon (30 ppm). Det vides ikke om kathonreaktionerne skyldes inhalation eller hudkontakt med Kathon i luften. (Ugeskrift for Læger, 2002).
Længerevarende, gentagen påvirkning og genskadende effekter
Ved langtidsforsøg med rotter sås der ingen effekter ved oral forsøg med MI alene. Ved tilsvarende langtidsforsøg med rotter sås kun en let maveirritation for Kathonblandingen (Kathon 886). (Rohm and Haas, 2000c; CIRP 1992).
Der er ikke konstateret reproduktionsskadende eller kræftfremkaldende effekter af Kathon i de forholdsvist få forsøg, der er refereret i litteraturen (CIRP, 1992). Der er ikke fundet oplysninger om det reproduktionsskadende eller kræftfremkaldende potentiale af de to individuelle stoffer MI og CMI.
I et langtidsforsøg, hvor rotter blev udsat for MI via drikkevandet, var der ingen dødelighed ved nogen af doseringerne. Der var ingen behandlingsrelaterede effekter på kropsvægt og fødeindtag ved op til den næsthøjeste dosering. Baseret på dette forsøg blev der opstillet en NOAEL på 250 ppm aktivt indholdsstof, svarende til 19,0 og 24,6 mg a.i./kg lgv/dag for henholdsvis han og hunrotter for MI. (Rohm and Haas, 2000c). På baggrund af denne NOAEL har den videnskabelige komite for kosmetik og andre forbrugerprodukter end fødevarer (SCCNFP) vurderet, at MI (som enkeltstof) ikke vil udgøre nogen risiko for forbrugernes sundhed ved brug som konserveringsmiddel i kosmetiske produkter i en maximumkoncentration på 100 ppm (0,01%) (SCCNFP 0805, 2004).
Et tremåneders forsøg på rotter med CMI via dermal eksponering viste kun svage hudreaktioner ved den højeste dosis på 18,75 mg/kg/dag. (IUCLID, 2000a).
For Kathonblandingen (Kathon 886) viste et tremåneders forsøg på rotter ved oral indtagelse via drikkevandet kun en let maveirritation ved dosis på 20 mg/kg/dag. NOEL blev fastsat til 8 mg/kg/dag (CIRP, 1992).
Kathonblandinger (Kathon CG og Kathon 886) har gennemgået en række tests vedrørende blandingens mutagene egenskaber. Flere tests viser, at Kathon er mutagent i Ames test, hvorimod der er negative resultater i studier, der har undersøgt Kathons DNA-skadende potentiale. (Madsen T et al, 2001). Tilsvarende er enkeltstoffet CMI testet mutagent ifølge Ames test (IUCLID, 2000a), hvorimod MI ikke viser tegn på mutagenicitet i test med bakterier. På baggrund af in vitro-forsøg (in vitro) vurderer SCCNFP MI til at være clastogent, dvs. det kan forårsage skader eller ændringer på kromosoner (SCCNFP 0625, 2003).
Kritisk effekt
Den kritiske effekt ved indtagelse af Kathon er ataksi og alvorlig maveirritation. NOEL-værdi, der stammer fra forsøg ved oral indtagelse via drikkevand, er fundet til 8 mg/kg legemsvægt/dag. Denne værdi benyttes i risikovurderingen af Kathon, da det er den laveste værdi, hvorved der er set effekter af Kathon.
I det samlede billede af Kathons toxicitet gøres der opmærksom på, at Kathon vurderes at være sensibiliserende. ECB’s Working Group on Sensitisation har opstillet en tærskelværdi for Kathon CG på < 3 ppm på baggrund af dyreforsøg. Andre angiver en tærskelværdi for Kathon på 10-20 ppm baseret på humanforsøg.
6.3.3 Phenoxyethanol
Forekomst og anvendelse
OECD har undersøgt produktionen af phenoxyethanol og har ikke identificeret mere end én amerikansk producent. I 1999 blev der i USA produceret 6400 tons phenoxyethanol. Der er rapporteret en lang række anvendelser af phenoxyethanol i både USA og Europa (se nedenstående tabel). Maling, rengøringsmidler og farver ser ud til at være de største anvendelsesområder (OECD SIDS, 2004). I kosmetik anvendes phenoxyethanol som konserveringsmiddel (INCI, 2006).
OECD rapporten estimerer, at omkring 60% af den producerede mængde phenoxyethanol anvendes i forbrugerprodukter. (OECD SIDS, 2004).
I de undersøgte kosmetiske produkter til børn forekommer phenoxyethanol i 50 af de 208 produkter, fordelt på 22 bodyshampoo/badegelé, 10 shampooer, otte skumbadsprodukter, seks bodylotion/creme, to hårstylingsprodukter, en balsam, og en ansigtscreme. Phenoxyethanol er således et af de mest anvendte konserveringsmidler i de kortlagte produkter. Kun methylparaben og propylparaben er hyppigere anvendt (i henholdsvis 79 og 70 af de kortlagte produkter).
Tabel 6.6: Anvendelsesområder rapporteret for phenoxyethanol
| USA | Europa |
| Opløsningsmiddel for celluloseacetat Farver Trykfarver Harpiks Organisk syntese af blødgører Desinfektionsmidler Medicinalprodukter Konserveringsmiddel for menneskelige præparater til dissektion Fikseringsvæske for parfumer Som baktericid og insektspray i organisk syntese Fikseringsvæske for kosmetiske produkter Tekstilfarve bærestof Kemisk mellemprodukt Opløsningsmiddel for rengøringsmidler Opløsningsmiddel for frimærkepuder Specielle trykfarver og kuglepennespidser |
Rengørings- og vaskemidler Maling og lakker Skæreolier Ikke-landbrugsmæssige pesticider og konserveringsmidler Reprografiske stoffer Overfladeaktivt stof Kosmetikprodukter Blødgører Lim og bindemidler Overfladebehandling Svejsning og lodningsmidler Medicinalprodukter Farvestoffer Rustbeskytter Smøremiddel Stabilisator Opløsningsmiddel |
Identifikation
| Kemisk navn | 2-phenoxyethanol |
| Synonymer | 1-Hydroxy-2-phenoxyethane 2-Hydroxyethyl phenyl ether 2-Phenoxyethyl alcohol Ethylene glycol phenyl ether Phenoxethol Phenoxyethanol Phenoxyethyl alcohol Phenyl cellosolve Phenylmonoglycol ether Rose ether |
| INCI navn | Phenoxyethanol |
| CAS-Nr. | 122-99-6 |
| EINECS Nr. | 204-589-7 |
| Bruttoformel | C8H10O2 |
| Molekylstruktur | 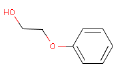 |
| Lovgivning: Listen over farlige stoffer (BEK 923, 2005) Listen over uønskede stoffer (Orientering fra Miljøstyrelsen nr. 8, 2004) MST Selvklassificering (Miljøprojekt nr. 635, 2001) Kosmetikbekendtgørelsen (BEK 422 , 2006) |
XN; R22 XI; R36 R22 = Farlig ved indtagelse. R36 = Irriterer øjnene. Nej Nej Er tilladt som konserveringsmiddel i kosmetiske produkter i en maximumkoncentration på 1,0%. (Bilag 5, løbenummer 39 VI, 1, 29). Stoffet må anvendes i andre koncentrationer og til andet formål en konservering, f.eks. som deodorant i sæber eller som skælfjernelsesmiddel i hårshampoo. I sådanne tilfælde skal formålet med stoffets anvendelse fremgå af selve produktet. |
Fysisk kemiske egenskaber
Data om phenoxyethanols fysisk kemiske egenskaber er fundet via Chemfinder, TOXNETs ChemIDplus database, OECD SIDS rapport om phenoxyethanol, samt IUCLID datasheet for 2-phenoxyethanol. (Chemfinder; TOXNET; IUCLID, 2000d; OECD SIDS, 2004).
| Fysisk tilstandsform | Klar, farveløs, tyktflydende væske |
| Molvægt (g/mol) | 138,17 |
| Smeltepunkt | 14 °C |
| Kogepunkt | 245 °C |
| Damptryk | 0,013 hPa ved 20 °C |
| Octanol-vand fordeling (log POW) | 1,16 |
| Vandopløselighed | 26.700 mg/l ved 20 °C |
Optagelse og distribution
Human hudabsorption af phenoxyethanol er testet in vitro, og viser, at ca. 60% af stoffet er absorberet efter 6 timer (Roper et al, 1997). OECD noterer, at det er uvist om brugen af methanol som opløsningsmiddel har haft en effekt på absorptionen af phenoxyethanol i den ene eller anden retning. (OECD SIDS, 2004).
Forsøg med rotter viser, at mere end 75% og op til 99% af phenoxyethanolen efter enten oral eller dermal eksponering kan findes uændret i urinen sammen med små mængder af to stoffer som phenoxyethanolen har metaboliseret til. (Howes, 1988). Et af metabolismeprodukterne er phenoxyacetylsyre (Breslin et al, 1991).
Akut toksicitet
Symptomer på forgiftning med phenoxyethanol i dyreforsøg er en lettere til mere alvorlig reduktion i aktivitet, svækkelse, nedsatte reflekser og besværet åndedræt. Ved høje doser forekommer der bevidstløshed før død eller bedring, ligesom der er set sløvhed, ataksi (mister fuld kontrol over kroppens bevægelse) og rysten ved høje doser. Ingen anormaliteter blev fundet i dyrene, der døde. (Hill Top Research, 1980; Richold et al, 1982).
De fundne LD50-værdier (Tabel 6.7) understøtter klassificeringen af phenoxyethanol som sundhedsskadeligt ved indtagelse.
Tabel 6.7: Akut toksicitet (LD50) af phenoxyethanol
| Art | Eksponering | LD50 (mg/kg lgv) |
Reference |
| Rotte | Oral | 1386 - 2563 | Hill Top Research, 1980 |
| Rotte | Oral | 2937 - 4013 | Gollapudi et al, 1988 |
| Rotte | Oral | 1260 | Smyth et al, 1941. |
| Rotte | Dermal | 14.300 | Davies, 1970 |
Lokal irritation
Phenoxyethanol er ikke hudirriterende for mennesker, men irriterende for øjne i dyreforsøg med kaniner. Phenoxyethanol skal også klassificeres Xi R36 ”Irriterer øjnene”. (IUCLID, 2000d; OECD SIDS, 2004; BEK 923, 2005).
En undersøgelse af 2736 patienter, der fik foretaget lappeprøver med 1% phenoxyethanol i vaseline (petrolatum) viste, at ingen af patienterne havde tegn på irritative effekter to eller fire dage efter eksponering. (Lovell et al, 1984).
Allergi
Både humandata og data fra dyreforsøg viser, at phenoxyethanol ikke er sensibiliserende. En undersøgelse med lappeprøver viste, at der ud af 501 patienter, kun var 1 positiv reaktion på phenoxyethanol (5% i vaseline), svarende til 0,2%. (IUCLID, 2000d; De Groot et al, 1986). I en anden undersøgelse med lappeprøver med 5% phenoxyethanol i vaseline på 3726 patienter, var der én patient, der udviste allergiske reaktioner (CIR Review, 1990a). I den ovenfor beskrevne undersøgelse af 2736 patienter med lappeprøver var der ingen af patienterne, der fik allergiske reaktioner. (Lovell et al, 1984).
Længerevarende, gentagen påvirkning og genskadende effekter
Der er ikke fundet nogle studier angående de kræftfremkaldende egenskaber af phenoxyethanol, men Miljøstyrelsen i Danmark har anvendt FDA’s kræftmodeller på phenoxyethanol med negativt resultat (OECD SIDS, 2004). Det vil sige, at phenoxyethanol ikke forventes at være kræftfremkaldende.
Phenoxyethanol har udvist reproduktionsskadende effekter og udviklingstoksicitet i dyreforsøg med mus. I flere reproduktionsstudier med mus var effekterne faldende legemsvægt på de voksne mus og deres afkom, samt øget levervægt ved høje doser på mellem 1875 og 4000 mg/kg lgv/dag. Ved den højeste dosering på mellem 3700 og 4000 mg/kg lgv/dag udviste phenoxyethanol reproduktionsskadende effekter i form af fald i både antallet af unger per kuld og i antal levendefødte unger. (NTP, 1984; Heindel et al, 1990; OECD SIDS, 2004).
Heindel et al. (1990) angiver en NOAEL for effekter på både forældre og fostre på 400 mg/kg lgv/dag i reproduktionsstudier med mus. Et 90-dages gentaget forsøg med oral eksponering af rotter med doserne 80, 400 og 2000 mg/kg lgv/dag viste ingen effekter ved 80 mg/kg lgv/dag (NOAEL-værdi). Ved 400 mg/kg lgv/dag sås nyretoksicitet og ændringer i deres soigneringsadfærd. Ved dosering på 2000 mg/kg lgv/dag sås toksicitet overfor røde blodlegemer(Ben-Dyke et al, 1977).
Et 90-dages gentaget forsøg med hudeksponering på kaniner viste ingen effekter ud over rødmen af huden (erythem) på teststedet ved doser på 50 til 500 mg phenoxyethanol/kg lgv/dag. Heraf afledtes en NOAEL for systemisk toksicitet på 500 mg/kg lgv/dag. (Breslin et al, 1991).
Phenoxyethanol har vist sig ikke at være mutagent i Ames-testen. Andre genmutationstests var også negative. (IUCLID, 2000d; OECD SIDS, 2004).
Anbefalingerne i OECD SIDS rapport om phenoxyethanol er, at stoffet er kandidat for fremtidigt arbejde, hvad angår human sundhed, da stoffet har egenskaber, der indikerer en fare for menneskers sundhed (øjenirritation og udviklingstoksicitet ved høje doser, der også giver effekter på moderen). (OECD SIDS, 2004).
Kritisk effekt
Den kritiske effekt af phenoxyethanol vurderes at være nyretoksicitet ved indtagelse. NOAEL-værdien er fundet til 80 mg/kg legemsvægt/dag.
6.3.4 5-bromo-5-nitro-1,3-dioxan
Forekomst og anvendelse
5-bromo-5-nitro-1,3-dioxan bliver brugt som stabilisator, overfladeaktivt stof, baktericid, og bliver i immunologien brugt til at konservere antistoffer i koncentrationer på mellem 0,1 og 0,5% (Wikipedia, 2006). Ifølge SPIN databasen bliver 5-bromo-5-nitro-1,3-dioxan brugt i Danmark i rengørings- og vaskemidler, i kosmetiske produkter og til overfladebehandling. (SPIN2000).
Siden midten af 1970’erne har 5-bromo-5-nitro-1,3-dioxan været brugt i kosmetiske produkter som konserveringsmiddel i shampoos, skumbad, osv. (Wikipedia, 2006). Den tilladte maxiumkoncentration ifølge Kosmetikbekendtgørelsen er 0,1%, og kun i produkter, der skylles af efter brug (BEK 422, 2006).
I de undersøgte kosmetiske produkter til børn forekommer 5-bromo-5-nitro-1,3-dioxan i 15 af de 208 produkter, fordelt på 13 bodyshampoo/badegelé og to skumbad.
Identifikation
| Kemisk navn | 5-Bromo-5-nitro-1,3-dioxan |
| Synonymer | 1,3-Dioxane, 5-bromo-5-nitro- 5-Bromo-5-nitro-m-dioxane Bronidox |
| INCI navn | 5-Bromo-5-nitro-1,3-dioxane |
| CAS-Nr. | 30007-47-7 |
| EINECS Nr. | 250-001-7 |
| Bruttoformel | C4H6BrNO4 |
| Molekylstruktur | 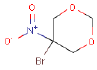 |
| Lovgivning: Listen over farlige stoffer (BEK 923, 2005) Listen over uønskede stoffer (Orientering fra Miljøstyrelsen nr. 8, 2004) MST Selvklassificering (Miljøprojekt nr. 635, 2001) Kosmetikbekendtgørelsen (BEK 422 , 2006) |
Nej Nej Xn; R22 R43 R22 = Farlig ved indtagelse R43 = Kan give overfølsomhed ved kontakt med huden Er tilladt som konserveringsmiddel i kosmetiske produkter i en maximumkoncentration på 0,1%. Må kun anvendes i produkter som skylles af efter brug. Dannelse af nitrosaminer skal undgås. Obligatorisk brugsanvisning og advarsel på etiketten er: ”Indeholder formaldehyd”, såfremt koncentrationen i det færdige produkter overstiger 0,05%. |
Fysisk kemiske egenskaber
Data om 5-bromo-5-nitro-1,3-dioxans fysisk-kemiske egenskaber er fundet via forskellige sikkerhedsdatablade på Internettet (ChemicalLand21.com, 2006), (Wikipedia, 2006), samt Informationscenteret for Miljø & Sundhed (IMS, 2004).
| Fysisk tilstandsform | Hvidt krystallisk pulver |
| Molvægt (g/mol) | 212,06 |
| Smeltepunkt | 60 °C |
| Kogepunkt | - |
| Damptryk | - |
| Octanol-vand fordeling (log POW) | 0,25 |
| Vandopløselighed | Uopløselig |
Akut toksicitet
Der foreligger generelt ikke mange data om toksiciteten af 5-bromo-5-nitro-1,3-dioxan. Ifølge listen over farlige stoffer skal 5-bromo-5-nitro-1,3-dioxan ikke fareklassificeres, men ifølge Miljøstyrelsens Vejledende liste til selvklassificering er stoffet sundhedsskadeligt (farlig ved indtagelse) (Orientering fra Miljøstyrelsen nr. 8, 2004).
Tabel 6.8: Akut toksicitet (LD50) af 5-Bromo-5-nitro-1,3-dioxan
| Art | Eksponering | LD50 (mg/kg lgv) |
Reference |
| Rotte | Oral | 590 | (Wikipeida, 2006) |
| Rotte | Oral | 455 | (Fette, Seifen, Anstrichmittel, 1976) |
| Mus | Oral | 455 | (Wikipeida, 2006) |
| Rotte | Dermal | 2,5 mg/24 timer | (Wikipeida, 2006) |
I sikkerhedsdatablade beskrives 5-bromo-5-nitro-1,3-dioxan som værende farligt ved indtagelse. Reaktioner på giftighed ved indtagelse er effekter på centralnervesystemet, såsom skælven, kramper og nervøsitet. (ScienceLab, 2005; Wikipedia, 2006).
Lokal irritation
5-bromo-5-nitro-1,3-dioxan er hudirriterende og irriterende for øjne i koncentrationer over 0,1%. (ScienceLab, 2005; Wikipedia, 2006; CIR Review, 1990b).
Allergi
5-bromo-5-nitro-1,3-dioxan vurderes at være sensibiliserende for mennesker, selvom stoffet ikke er sensibiliserende i studier med marsvin (CIR Review, 1990b; Madsen T et al, 2001). Ifølge Miljøstyrelsens Vejledende liste til selvklassificering er 5-bromo-5-nitro-1,3-dioxan allergifremkaldende, hvorfor stoffet bør mærkes med R43 ”Kan give overfølsomhed ved kontakt med huden”. (Miljøprojekt nr. 635, 2001).
5-bromo-5-nitro-1,3-dioxan er en såkaldt formaldehydreleaser, dvs. at stoffet fraspalter formaldehyd. Det er på denne måde 5-bromo-5-nitro-1,3-dioxan virker konserverende, da formaldehyd er konserverende. Ifølge Videncenter for Allergi er der ca. 2% af personer med eksem, der er allergiske overfor formaldehyd. (Videncenter for Allergi, 2006c).
Længerevarende, gentagen påvirkning og genskadende effekter
Der er kun få oplysninger om stoffets kræftfremkaldende, fosterskadende og genskadende effekter, men ifølge de få oplysninger, der er fundet, er 5-bromo-5-nitro-1,3-dioxan hverken kræftfremkaldende, fosterskadende eller mutagent (negativ Ames test), (Roche Applied Science 2005; CIR Review, 1990b).
5-bromo-5-nitro-1,3-dioxan kan reagere med aminer og amider og danne nitrosaminer eller nitrosamider, der vurderes at være kræftfremkaldende, og kan trænge igennem huden. (Madsen T et al, 2001, US FDA). Der er specielle retningslinjer vedrørende dette stof i Kosmetikbekendtgørelsen, hvoraf det fremgår, at dannelsen af nitrosaminer skal undgås. (BEK 422, 2006). Det betyder i praksis, at 5-bromo-5-nitro-1,3-dioxan ikke må blandes med aminer og amider i kosmetiske produkter. Desuden må stoffet kun bruges i kosmetiske produkter, som skal skylles af efter brug.
Kritisk effekt
Der mangler detaljerede oplysninger om 5-bromo-5-nitro-1,3-dioxan til at vurdere stoffets kritiske effekt, men der er ikke tvivl om, at kontaktallergi ved hudkontakt er en væsentlig effekt.
Fodnoter
[14] De forskellige kilder er lidt uenige om, hvor store mængder natriumbenzoat, der bliver brugt til de forskellige formål, men konserveringsmiddel til fødevarer og drikkevarer ser ud til at udgøre mere end 50% af den totale producerede mængde.
[15] EC3 værdi er den estimerede koncentration, der skal til for at fremkalde en tre gange stigning i lymfekirtelcelle aktivitet.
Version 1.0 Oktober 2007, © Miljøstyrelsen.