Påvisning af virus i vand og toskallede bløddyr
BILAG 12Beskrivelse af semi-nested RT-PCR på naturligt kontaminerede toskallede bløddyr(38).
Princippet i semi-nested RT-PCR er, at man laver en ekstra PCR på sit første PCR produkt (fig. 2). Hvis der i den første PCR ikke er dannet nok DNA, hvilket kan skyldes, at primere har bundet for svagt, kan man forsøge at amplificere produktet ved at vælge en primer, der binder sig længere inde på det ønskede produkt, medens den anden primer fra 1. PCR anvendes igen. Metoden er mere sensitiv end konventionel PCR.
Første PCR amplifikation med primer 1 og 2
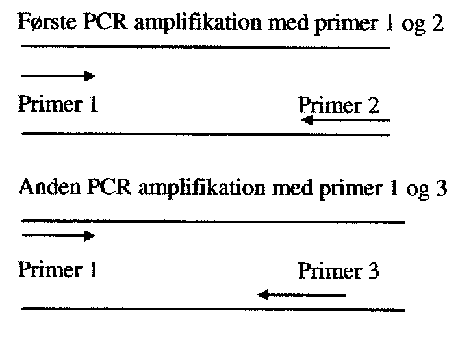
Figur 2. Illustration af semin-nested PCR
I (38) beskrives semi-nested RT-PCR med efterfølgende hybridisering til detektion af hepatitis A virus, rotavirus og enterovirus.
Primere:
Til semi-nested-PCR på enterovirus blev benyttet 3 primere svarende til det meget konserverede 5’ ikke-kodende område i picornavirus (tabel 3). Til detektion af hepatitis A virus ved semi-nested PCR blev benyttet 3 primere, der var relateret til den konserverede sekvens af VP1 kapsidregionen. Til rotavirus-detektion blev benyttet 3 primere svarende til et konserveret område af VP7 genet. Dette område er konserveret inden for gruppe A rotavirus, men meget divergerende blandt forskellige rotavirusgrupper (reviewed af 38).
Tabel 1. Sekvens og lokalisering af oligonukleotider (primere) og prober)
| Virus og oligo- nukleotid |
Sekvens (5’ - 3’) |
Lokali- sering |
Fragment- længde (bp) |
| Hepatitis A virus | |||
| H1 | GGAAATGTCTCAG- GTACTTTCTTTG |
2389- 2413 |
|
| H2 | GTTTTGCTCCTCTTT- ATCATGCTATG |
2167- 2192 |
247 |
| H3 | TCCTCAATTGTTGTGATAGC | 2358- 2377 |
210 |
| Hp | TCAACAACAGTTTCTACAGA | 2233- 2252 |
|
| Enterovirus | |||
| E1 | TCCGGCCCCTGAATGCGG | 446-463 | |
| E2 | CACCGGATGGCCAATCCAAT | 623-642 | 196 |
| E3 | CTCTCAATTGTCACCATAAG | 584-603 | 157 |
| Ep | ACACGGA- CACCCAAAGTAGTCGGTTCC |
533-559 | |
| Rotavirus | |||
| R1 | GGCTTTAAAAGAGAG- AATTTCCGTCTGG |
1-28 | |
| R2 | GATCCTGTTGGCCATCC | 376-392 | 392 |
| R3 | GTATGGTATTGAATATACCAC | 51-71 | 342 |
| Rp | TCCATTGATCCTGTTATTGG | 220-239 |
Revers transkription (RT):
Første streng cDNA blev syntetiseret ved revers transkription med en 10 µl blanding bestående af 2 µl nukleinsyre ekstrakt og 1 µM downstream primer (E1 eller H1). For enterovirus og hepatitis A virus blev RT-blandingen inkuberet i 45 min. ved 370C, opvarmet til 950C i 5 min. og derpå afkølet på is.
Betingelserne for revers transkription af rotavirus var lidt anderledes; 2 µl nukleinsyreekstrakt blev denatureret med 10 µM af downstream primer og 10 mM af methyl mercuric hydroxid i 5 min. ved stuetemperatur, som beskrevet (38).
PCR:
PCR-reaktionsblanding blev udført på følgende måde: 2 µl af RT-blanding (for henholdsvis enterovirus og hepatitis A virus) blev sat til 23 µl af PCR-blanding (med Taq polymerase som angivet af producent Perkin-Elmer Cetus). Rotavirus-amplifikation blev udført på 40 µl af PCR-blandingen tilsat til 10 µl rotavirusblanding som beskrevet ovenfor, dog med ændring i MgCl2 -koncentration.
Amplifikationen var ens for alle tre virus og blev udført på følgende måde:
3 cykler (940C i 30 sek, 500C i 30 sek, 720C i 30 sek), derefter 27 cykler (940C i 15 sek, 500C i 15 sek og 720C i 20 sek), derpå en ekstensionsperiode ved 720C i 2 min. og afslutning med nedkøling til 40C Semi-nested PCR blev udført på følgende måde:
1 µl af første amplifikationsreaktion blev yderligere amplificeret med interne primere (H3, E3 eller R3) og samme upstream primer som ved første PCR. Semi-nested PCR var i øvrigt som ved 1. PCR amplifiaktion som beskrevet ovenfor.
Hybridisering:
PCR produkterne blev analyseret ved agarosegelelektroforese og efterfølgende Southern hybridisering med oligoprobe mærket med digoxigenin-dUTP. For hybridiserings- og vaskebetingelser henvises til artiklen. Hybridisering blev detekteret med anti-digoxigenin antistof konjugeret med alkalisk fosfatase, der defosforylerer chemiluminescent substratet Lumigen PPD. Membraner blev eksponeret med røntgenfilm i 1 time ved 37 0 C inden fremkaldelse.
Sensitivitetsstudier:
Sensitiviteten af metoden blev evalueret ved studier, hvor kendte koncentrationer af virus blev sat til afskallede hjertemuslinger fra et "farming area". Toskallede bløddyrprocessing foregik således:
- 25 g toskallede bløddyr blev afskallet, hvorefter virus blev tilsat
- tilsætning af 100 ml 0,2 M glycin i 0,15 M NaCl (pH 9,5)
- homogenisering i Waring blender i 5 min
- blandingen omrørtes i 15 min. ved stuetemperatur og centrifiguredes i 10 min. ved 10000xg ved 40 C
- vandig fase blev fældet med PEG 6000 i en koncentration på 50% (wt/vol) opløsning i 0,1 M PBS, således at den endelige koncentration var 8%PEG
- pH blev indstillet til 7,0
- blandingen blev omrørt i 2 timer ved 40 C
- centrifugering i 30 min. ved 10000xg og 40 C
- pellet blev suspenderet i 5 ml DEPC vand (diethyl pyrocarbonatbehandlet destilleret vand)
- pH blev justeret til 7,0.
RNA-ekstraktion:
Derpå blev viral RNA ekstraheret fra toskallede bløddyrskoncentraterne på følgende måde:
- 1/10 af ovenstående suspension blev behandlet med en opløsning bestående af 0,1 M Tris-HCl (pH 7), 5 mM EDTA, 1% SDS, proteinase K (200 m g/ml) ved 56 0 C i en time (hermed nedbrydes proteinerne)
- derpå ekstraheredes med phenol:cloroform:isoamyl alkohol (25:24:1) med henblik på at isolere nukleinsyre. Ved ethanolfældning og centrifugering blev RNA opkoncentreret, og pellet opløst i 100 m l DEPC-vand.
Rotavirus nukleinsyre blev oprenset ved adsorption på granular cellulose efter PEG-fældning på følgende måde:
- prøve blev blandet med 2xSTE (vol/vol) (10xSTE i 1M NaCl, 0,01 M EDTA og 0,1 M Tris-HCl (pH 6,8)) indeholdende 66% ethanol (vol/vol) og 10 mg af CC41 cellulose
- blandingen blev omrystet i 45 min. og centrifugeret i 3 min ved 10000xg
- pellet blev vasket 3 gange med 1xSTE-20% ethanolbuffer
- adsorberet RNA blev elueret med 50 m l af DEPC vand i 10 min. ved 550 C efter centrifugering i 3 min. anvendes supernatant til reverse transkription som ovenfor beskrevet.
Resultat efter sensitivitetsstudier:
Ud fra disse sensitivitetsstudier bestemtes, at sensitiviteten for hepatitis A virus var 100 gange større ved semi-nested PCR end ved konventionel PCR. Hybridiseringstrinnet øgede sensitiviteten yderligere en faktor 10. Ved beregninger blev detektionsgrænsen bestemt til 1200 hepatitis A viruspartikler/g toskallet bløddyrvæv ved brug af semi-nested PCR og hybridisering.
For enterovirus fandtes ligeledes, at sensitiviteten er 100 gange større for semi-nested PCR end PCR, men sensitiviteten fandtes ikke yderligere øget ved hybridisering. Efter beregninger var detektionsgrænsen for enterovirus bestemt til 2000 enteroviruspartikler/g toskallet bløddyrvæv ved brug af semi-nested PCR og hybridisering.
For rotavirus blev der kun observeret amplificeret DNA efter oprensning med CC41 cellulose og efter semi-nested PCR. Hybridisering øgede ikke sensitiviteten. Beregninger fastlagde, at detektionsgrænsen for rotavirus var 5000 rotaviruspartikler/g toskallet bløddyrvæv.
Disse sensitiviteter og detektionsgrænser var baseret på den antagelse, at der ikke skete tab af viralt materiale under koncentreringsmetoderne.
Resultat af seminested RT-PCR på naturligt kontaminerede toskallede bløddyr:
Field site 1:
Ud af 20 hjertemuslinger var 3 positive for enterovirus RNA og 1 positiv for hepatitis A virus RNA.
Ud af 10 blåmuslingeprøver var 2 positive for enterovirus RNA, medens ingen prøver fandtes positive for hepatitis A virus RNA.
Bakterielle data indikerede, at næsten alle toskallede bløddyrene var kontamineret over det acceptable niveau, kun 1 prøve var acceptabel bedømt ud fra bakterielle indikatorer.
Field site 2:
Ud af 12 muslingeprøver (clam) var 3 positive for hepatitis A virus RNA, 3 var positive for enterovirus RNA og 2 var positive for rotavirus RNA. Heller ikke her var der korrelation mellem bakteriologiske data og virusfund. Nogle af prøverne var kontamineret med bakterier over det acceptable niveau og andre under.
Hepatitis A virus RNA detektion korrelerede altid med detektion af enterovirus og/eller rotavirus, hvorimod enterovirus RNA alene blev detekteret i flere prøver. De primere, der blev brugt til detektion af enterovirus, detekterer en bred række af typer. Så sandsynligheden for at detektere enterovirus RNA er større end for RNA fra de to andre virus. Undersøgelserne peger på, at enterovirus kan fungere som indikator for mulig tilstedeværelse af andre humane patogene virus.
I samme studie blev forekomst af hepatitis A virus og enterovirus i sedimentprøver (disse behandles direkte med proteinase K og proceduren for toskallede bløddyr følges, efter ethanolfældning laves en oprensning på Sephadex G150 søjle) undersøgt.
Resultaterne viste, at hver gang viralt RNA (entero eller hepatitis A virus) var påvist i sediment, var der også påvist i toskallede bløddyr. Der var næsten dobbelt så meget enterovirus og hepatitis A virus i sediment som i toskallede bløddyr. Det blev konkluderet, at korrelationen mellem viruskontaminering i toskallede bløddyr og sediment yderligere bør undersøges.
Konklusion:
I dette arbejde konkluderedes det, at semi-nested PCR var mere sensitiv, altså havde lavere detektionsgrænser, end konventionel PCR. Efterfølgende hybridisering af PCR-produkter til probe øgede yderligere sensitiviteten, hvilket er i overensstemmelse med tidligere fund (49). Det skal understreges, at der ikke fandtes nogen korrelation mellem påvisning af viral og bakteriel forurening i toskallede bløddyrsprøverne, hvilket bekræfter at bakterielle indikatorer er utilstrækkelige som mål for, at de toskallede bløddyr er fri for viruspatogener.