Påvisning af virus i vand og toskallede bløddyr
4. Bestemmelse af virus i vand
4.1.1 Filter-adsorption-elueringsmetode
4.1.2 Ultrafiltrering
4.1.3 Filtrering gennem granuleret aktivt kul
4.1.4 PEG præcipitation
4.1.5 Organisk flokkulation
4.2 Påvisningsmetoder
4.2.1 Cellekulturer
4.2.2 EIA (enzyme immunosorbent assay)
4.2.3 Polymerase chain reaktion (PCR)
4.2.4 RT-PCR-assay. Enterovirus i grundvand
4.2.5 RT-PCR-assay. Enterovirus i flodvand og havvand
4.2.6 RT-PCR-assay. Enterovirus i spildevand
4.2.7 RT-PCR-assay. Enterovirus, hepatitis E virus
og rotavirus i drikkevand
4.2.8 RT-PCR-assay. Norwalk virus i drikkevand og spildevand
4.2.9 RT-Seminested PCR assay
4.2.10 RT-Seminested PCR assay.Enterovirus i podet drikkevand
4.2.11 RT-Seminested PCR assay. Enterovirus i overfladevand
4.2.12 RT-Seminested PCR assay. Enterovirus og hepatitis A virus i
overfladevand
4.2.13 Nested PCR asssay. Adeno-, entero- og hepatitis A virus i
spildevand og flodvand
4.3 Validering af metoder
4.4 Diskussion
Virus forekomst i spildevand og andre vandsystemer samt jord, slam og sediment er veldokumenteret.
Spildevand
Humane enteriske virus udskilles med fæces og afledes til spildevandsystemet. Mængden af virus og de virustyper der forekommer i spildevand afhænger af den epidemiologiske status i samfundet. Rensningsprocesser fjerner 50-90% af virus fra vandfasen (4) og partikelassocierede virus aflejres i slamfasen, hvor viruskoncentionen kan være op til 10 gange større end i urenset spildevand. Mekanisk biologisk rensning med aktiv slambehandling kan reducere enterovirus med 98% (5). Antallet af virus reduceres ved slambehandling, men virus elimineres ikke.
Recipienter
Utilstrækkelig renseprocesser eller tekniske svigt kan medføre udledning af forholdsvis store mængder virus til vandrecipienter men koncentrationen af virus er på grund af fortynding og sedimentation generelt meget lav i recipienter (5). Alexander et al. 1992 (6) rapporterer dog om fund af enterovirus i 73-88% prøver af kontamineret havvand fra 2 badestationer i England.
Drikkevand
Drikkevandskilder kan være forurenet grundvand eller overfladevand fra floder og søer. I udlandet praktiseres rensning til drikkevandskvalitet ved flokkulation af organisk materiale, der fjerner de fleste virus, og sedimentation. Den efterfølgende klorering vil inaktivere resterende virus (4).
Virustyper
De virustyper der ofte forekommer i kontamineret vand er Norwalk virus, enterovirus (poliovirus, coxsackievirus gruppe A og B og echovirus), hepatitis A virus, hepatitis E virus, astrovirus, adenovirus og rotavirus. (7, 8, 9, 10). Enteriske virus, der er kendt for at forårsage gastroenteritis er Norwalk virus, rotavirus gruppe A, astrovirus og adenovirus serotyper 40 og 41 (4).
Indikator organismer
Den hygiejniske vandkvalitet vurderes på forekomst af coliforme bakterier. Mange enteriske virus er mere resistente mod fysiske og kemiske påvirkninger i det ydre miljø end coliforme bakterier. Bakteriofager foreslås ofte som indikator for virus tilstedeværelse, men mange dokumenterede undersøgelse har vist modstridende resultater over relationer mellem coliphager og virus. Spørgsmålet om bakteriofagers anvendelighed som indikator diskuteres stadig (5).
Opkoncentrering af virus
I drikkevand og recipientvand er mængden af virus generelt meget lav og for at de kan påvises i cellekulturassays eller andre assays er det nødvendigt at opkoncentrere virus fra vandprøver i størrelsesordenen 10 - 100 liter eller derover. Koncentrering kan udføres ved filtrering hvor virus adsorberer til og elueres fra filtermembraner eller andre metoder og prøvevolumen er ofte reduceret til 1 liter. En efterfølgende rekoncentrering ved organisk flokkulation eller PEG (polyethylen glycol) precipitation medfører en yderligere reduktion af prøvekoncentratet til <=30 ml.
Påvisning af virus
Den traditionelle metode til påvisning af virus i prøvekoncentrater er cellekulturassay. En fordel ved metoden er, at der påvises infektiøse virus, men de problemer der er forbundet med metoden er, at cellekulturer er følsomme overfor toksiske komponenter i prøvematerialet, og at nogle virus er vanskelige at dyrke eller ikke kan vokse i cellekulturer. For at kunne påvise sådanne virustyper går tendensen i retning af, at anvende PCR.
Koncentreringsprocesser og metoder til påvisning af virus er nærmere beskrevet i de følgende afsnit.
4.1Koncentreringsmetoder
De koncentreringsmetoder der beskrives eller refereres til i nedenstående afsnit er skematisk illustreret i bilag 2. I skemaet er desuden anført, hvilke vandtyper og prøvemængder, der er blevet koncentreret i de pågældende metoder. Metodernes fordele og ulemper er angivet i bilag 3.
4.1.1Filter-adsorption-elueringsmetode
Procedure
Filter-adsorption-eluering er den mest anvendte og veldokumenterede metode til koncentrering af virus. Ved filtrering gennem elektronegative eller elektropositive filtre vil virus adsorbere til filtermembranen og efterfølgende frigives til en proteinholdig elueringsvæske med højt pH og eluatet kan derefter rekoncentreres eksempelvis ved organisk flokkulation (11). Processen er skitseret i bilag 4.
Kapacitet
For at opnå optimal virus adsorption til elektronegative filtre skal prøven forbehandles ved tilsætning af AlCl3 og sænkning af pH til 3,5. De elektronegative filtre har en god kapacitet for virus adsorption fra vand med højt indhold af organisk materiale, hvorimod elektropositive filtre er mindre egnede fordi de hurtigere blokeres (11). Filterkapaciteten kan forøges ved forfiltrering af prøven, der fjerner suspenderet stof, men ulempen er, at partikelbundne virus også fjernes (12). American Public Health Association 1995 (11) anbefaler, at frafiltreret suspenderet stof også undersøges for virusforekomst. Ved undersøgelser af klorbehandlet vand skal kloret neutraliseres med natriumthiosulfat forud for filtreringen.
Genfindelsesgrad
Jothikumar et al. (13) beskrev i 1995 en forsøgsrække med koncentrering af virus ved filter-adsorption-eluering. 100 liter vand podet med poliovirus type 1 blev filtreret gennem elektronegative filtre og 80% af de tilsatte virus blev genfundet i eluatet. Ju-Fang et al. 1995 (14) rapporterer om genfindelsesprocenter for elektropositive filtre på 89,9%-94,6% for poliovirus og 88,6%-95,5% for coxsackievirus B3.
Fordel - Ulempe
Metoden har den fordel, at virus kan koncentreres fra store mængder vand og genfindelsesgraden for enterovirus er god. Adsorptionskapaciteten for elektronegative filtre er mest effektiv ved tilstedeværelse af multivalente kationer som Al3+ ved lavt pH men det har den ulempe, at filtrene kan blokeres af metalkomplexer, der dannes ved lavt pH (13).
4.1.2 Ultrafiltrering
Procedure
Koncentrering ved ultrafiltrering beror på, at virus tilbageholdes i membrancylinderne på grund af molekylevægt- eller størrelsesforhold. Processen kræver tilsætning af Tween 80 (5 - 10 ml pr. 100 liter prøve) for at forhindre adsorption af virus og organisk materiale til membranen (7).
Genfindelsesgrad - Ulempe
Vandprøver i størrelsesorden 100 - 1.000 liter kan koncentreres til 1 liter, og genfindelsesgraden for enterovirus er 80% og 72% for adenovirus (15). Ulemperne er, at membranudstyret er kostbart, meget tungt og vanskeligt at transportere, og at indholdet af organisk materiale i vandprøver skal være lavt.
4.1.3 Filtrering gennem granuleret aktivt kul
Procedure
Jothikumar et al. 1995 (13) har beskrevet en filtreringsmetode med anvendelse af granuleret aktivt kul (GAC). Virus adsorberer til aktivt kul og elueres med urea-arginene fosfatbuffer pH 9,0.
Genfindelsesgrad - Fordel
Der er påvist en genfindelsesgrad på 74% for poliovirus 1, men den største fordel er, at metoden er billig og mindre tidskrævende end filter-adsorptionelueringsprocessen, idet 100 liter vand kan filtreres gennem GAC på 2 timer hvorimod det tager op til 8 timer at filtrere en tilsvarende mængde ved filter-adsorption-eluering.
4.1.4PEG præcipitation
Procedure - Genfindelsesgrad
Prøver, der er koncentrerede efter ovennævnte metoder kan rekoncentreres ved PEG (polyethylen glycol) precipitation, men metoden kan også anvendes til koncentrering af råt eller renset spildevand. Prøvematerialet tilsættes PEG 8.000 (8%), og efter centrifugering kasseres den PEG holdige supernatant, og pellet resuspenderes i fosfatbuffer (16). Metoden er hurtig og enkel med gode genfindelsesprocenter for hepatitis A virus på 61% og poliovirus på 91% (17).
4.1.5Organisk flokkulation
Procedure
Organisk flokkulation er en meget anvendt metode til rekoncentrering af eluater fra filter-adsorption-elueringsprocessen. Proteiner flokkulerer ved lavt pH, og flokkulatet med adsorberede virus bundfældes ved centrifugering og resuspenderes i 5-10 ml buffer (4).
4.2Påvisningsmetoder
Virus i koncentreret prøvemateriale kan påvises i cellekulturer, immunologiske assay som EIA (enzyme immunosorbent assay) eller PCR assay. Disse metoder er beskrevet i de følgende afsnit. Metodernes fordele og ulemper er anført i bilag 5.
4.2.1Cellekulturer
Cellekulturer
Cellekulturer er den metode, der hidtidig har været brugt til påvisning af virus i vand. Cellekulturer podes med prøvemateriale og observeres for cytopatogene forandringer (CPE). Enterovirus kan dyrkes i BGM (Buffalo Green Monkey) cellekulturer i plaque assay, og adenovirus påvises ved CPE i cellekulturer (HEp-2) under flydende medium, og virus identificeres efterfølgende i en neutralisationstest. Hepatitis A virus kan dyrkes i FRhK (Fetal Rhesus Kidney) cellekulturer og rotavirus i MA104 (Rhesus menkey Kidney) celler og identificeres i immunologiske assays. Norwalk virus kan ikke dyrkes i cellekulturer.
Koncentrationsbestemmelse
I cellekulturer under flydende medie kan antallet af infektiøse virus bestemmes efter MPN metoden og angives som TCID50 (Tissue Culture Infektive Dose), hvorimod plaques kan tælles direkte i plaque assay og angives som PFU (Plaque Forming Units).
Fordel - Ulempe
Fordelen ved cellekulturer er, at der påvises infektiøse virus. Ulemperne er, at metoden er tidskrævende, og at cellekulturer er meget følsomme over for celletoksiske stoffer, som kan forekomme i prøvematerialet. Den væsentligste ulempe er, at hepatitis A virus og nogle adenovirus er langsomt voksende, og at Norwalk virus, der ofte forårsager vandbårne infektioner, ikke er dyrkbare i cellekulturer.
4.2.2EIA (enzyme immunosorbent assay)
Procedure
I EIA påvises virusantigener og metoden er baseret på antigen-antistof reaktioner. Proceduren er, at antistof bindes til en plastoverflade, og virusantigen i prøvemateriale bindes til antistoffet. Efterfølgende bindes peroxidase-konjugeret antistof til antistof/antigen komplexet, og reaktionen synliggøres ved tilsætning af substrat, der ved enzymatisk spaltning giver en farvereaktion, der kan aflæses spectofotometrisk.
Evaluering af EIA kits og LA kits
Dahling et al. 1993 (18) har evalueret 4 EIA kits og 4 LA (latex-agglutination) kits til påvisning af rotavirus for at udvælge et kit til brug i spildevandsundersøgelser. Samtidig blev 1 EIA kit til påvisning af adenovirus type 40 og 41 evalueret. Suspensioner med kendte koncentrationer af human rotavirus (Wa), simian rotavirus (SA11) eller adenovirus (41) blev anvendt til undersøgelse af sensitiviteten af de forskellige kits.
EIA procedure - Rotavirus
I EIA assayet til rotavirus coates brønde i mikrotiterplader med monoklonalt anti-human rotavirus. Prøver overføres til brøndene og inkuberer 1 time med anti-rotavirus antistof konjugeret med peroxidase. Efter vaskeprocesser med deioniseret vand tilsættes substrat med urea-peroxid og chromogen-opløsning med tetramethylbenzidin, hvorefter der inkuberes ved stuetemperatur i 10 min. Rotavirusantigen påvises via antistof konjugeret med peroxidase, der spalter substratet og udvikler en blåfarve. Farvereaktionen aflæses visuelt eller i spectrophotometer, hvor absorbansen måles ved 450 nm i en UV max kinetisk mikroplade reader (Molecular Devices Corp. Menlo Park, CA) med softmax version 2.01.
Adenovirus
En tilsvarende EIA procedure anvendes til påvisning af adenovirus.
LA procedure - Rotavirus
I LA assayet til påvisning af rotavirus tilsættes prøven til en suspension af latex partikler coated med anti-rotavirus antistof. I alle latex kits anvendes et kanin antistof rettet mod en pool af humane rotavirus. Tilstedeværelse af virus resulterer i en visuel agglutinering af partiklerne.
Sensitivitet
Evalueringen af LA rotavirus kits viste, at den højeste sensitivitet var 103 PFU/ml for rotavirus Wa og 105 PFU/ml for SA11. Den højest påviste sensitivitet i EIA kits var 102 PFU/ml for Wa og 104 PFU/ml for SA11 og dette Rotaclone kit fra Cambridge Bio-Science blev udvalgt til de efterfølgende spildevandsanalyser. EIA Adenoclone 40/41 kit, der ligeledes var fra Cambridge BioScience, havde en sensitivitet der svarede til 102 TCID50/ml.
Detektionsgrænse
Ifølge protokollen for begge kits var prøver viruspositive, når der kunne måles en absorbans på 0,150, men en statistisk analyse af A450 værdier viste, at en absorbans >0,07714 var signifikant højere end negative kontroller. På basis af denne analyse blev detektionsgrænsen sænkes til 10 PFU/ml for Rotaclone kit og 10 TCID50/ml for Adenoclone 40/41 kit.
Spildevand - Rotavirus - Adenovirus
30 spildevandsprøver fordelt på 15 indløbsprøver og 15 udledningsprøver blev koncentreret ved filter-adsorption-eluering og rekoncentreret ved flokkulation. Prøverne blev undersøgt for rotavirus og adenovirus i EIA kits. Rotavirus blev påvist i 3 indløbsprøver, og adenovirus var ikke påviselig i prøverne.
Konklusion
Dahling et al. 1993 (18) konkluderer, at sensitiviteten af Rotavirusclone og Adenoclone 40/41 kits er på niveau med sensitiviteten af cellekulturer, og at EIA kits ikke er nær så følsomme over for kemiske stoffer i spildevand som cellekulturer. En væsentlig fordel er, at metoden er hurtig i forhold til cellekulturer hvor adeno- og rotavirus kan være vanskelige at dyrke. Til gengæld er det virusantigener, der påvises, og ikke nødvendigvis infektiøse virus.
4.2.3 Polymerase chain reaktion (PCR)
Udvikling og anvendelse af PCR er et af de nyere fremskridt inden for metoder til påvisning af humane enteriske virus i vand. PCR er en in vitro metode, der enzymatisk amplificerer et ønsket nukleinsyre segment mellem to sekvens specifikke oligonucleotid primere. Metoden kan amplificere og påvise meget små mængder virus nukleinsyre i et prøvemateriale.
PCR teknikken er nærmere beskrevet i afsnit 5: "Bestemmelse af virus i toskallede bløddyr", bilag 9 "Generel beskrivelse af PCR". Der henvises til dette afsnit.
RT-PCR
Humane enteriske virus, med undtagelse af adenovirus, er RNA-virus. For at amplificere og påvise viralt-RNA er det, forud for PCR, nødvendigt at fremstille DNA kopier (cDNA) af RNAet ved hjælp af enzymet reverse transcriptase (RT). DNAet kan derefter amplificres ved PCR. Metoden kaldes RT-PCR.
PCR inhibitorer
PCR er en meget følsom teknik, og tilstedeværelse af kemiske komponenter som humussyre og metalioner i prøvematerialet inhiberer PCR reaktionen. Humussyre bindes kraftigt til proteiner og hæmmer enzymfunktioner i PCR reaktionen, og metalioner vil interferere med enzymaktiviteten, hvilket kan medføre falsk negative resultater eller non-specifikke reaktioner. PCR kan også inhiberes af beef extract, som anvendes i filter-adsorption-eluering i forbindelse med koncentrering af prøver (7).
4.2.4RT-PCR-assay. Enterovirus i grundvand
Abbaszadegan et al. (8) publicerede i 1993 resultater fra studie omhandlende udvikling af RT-PCR assay til påvisning af enterovirus i grundvand. Procedure for koncentrering af virus og påvisning i RT-PCR er nærmere beskrevet i bilag 6. Studiet omhandlede desuden evaluering af primer specificitet og sensitivitet.
Primere
De anvendte primere svarede til den 5' ikke-kodende region i poliovirus genomet, som er et meget konserveret område i enterovirus. Downstream og upstream primerne flankerer en region på 149 bp (base par).
Specificitet
Specificiteten af primerne blev testet på udvalgte enterovirus og andre enteriske virus i RT-PCR. Efterfølgende blev PCR produkter overført fra agarose gel til hybridiseringsmembran (GeneScreen Plus) for Southern hybridisering med oligoprobe mærket med (a-32P) ATP.
Hybridiseringsprodukter blev påvist efter eksponering på røntgenfilm i 48 timer.
Resultat
Der blev påvist specificitet for poliovirus type 1, 2 og 3, coxsackievirus A1, B1-B3, B5 og B6 samt echovirus type 7, 17, 19, 21, 24, 27 og 29. Andre enterovirus som echovirus 23, bovine enterovirus 1 og porcine enterovirus blev ikke påvist. Ligeledes kunne en specificitet for andre enteriske virus som hepatitis A (HM 175), Norwalk virus, calicivirus, human rotavirus (ATTC 2018-VR), rotavirus SA-11 og adenovirus serotype 41 ikke dokumenteres.
Sensitivitet - Resultat
For at bestemme primer sensitiviteten blev grundvandskoncentrat samt destilleret vand podet med poliovirus 1 (103 PFU). Efter oprensning på Sephadex G-200 og Chelex-100 søjler blev prøverne undersøgt i RT-PCR assayet. Detektionsgrænsen for RT-PCR var 0.1 PFU.
Grundvand - Resultat
Undersøgelser til påvisning af enterovirus i 10 grundvandskoncentrater blev udført ved Southern hybridisering (uden forudgående PCR), ved dyrkning i BGM cellekulturer og RT-PCR (uden efterfølgende Southern hybridisering). Enterovirus blev påvist i 2 af de 10 koncentrater efter dyrkning i cellekulturer, og 1 af disse koncentrater blev fundet positiv efter hybridisering. Ingen af koncentraterne var positive i det anvendte RT-PCR assay. I kontrolforsøg med 10 grundvandskoncentrater podet med poliovirus type 1 (LSc), 103 PFU pr. reaktionsenhed, blev poliovirus påvist i 1 af prøverne i RT-PCR. Det blev antaget, at de negative resultater skyldtes PCR inhiberende stoffer i grundvandet.
Oprensning af grundvand - Resultat
For at underbygge denne antagelse blev de 10 grundvandskoncentrater og de 10 podede koncentrater fra kontrolforsøgene oprenset på Sephadex G-100 og Chelex-100 koloner og derefter undersøgt i RT-PCR. De 2 prøver, der var fundet positive i cellekulturer blev nu også fundet positive i RT-PCR analysen. De øvrige 8 prøver forblev negative. De 10 podede koncentrater blev alle fundet positive.
Konklusion
Det blev konkluderet, at inhiberende substanser som humussyre og beef extract i grundvandskoncentraterne interfererer med PCR amplifikationen. Efterfølgende studier viste, at reverse transkriptase er mere følsom over for inhibition end Taq polymerase. Desuden konkluderede Abbaszadegan et al. 1993 (8), at det udviklede RT-PCR assay kan anvendes til påvisning af enterovirus i grundvand når inhiberende substanser er fjernet ved oprensning forud for RT-PCR.
4.2.5 RT-PCR-assay. Enterovirus i flodvand og havvand
Wyn-Jones et al. 1995 (19) har undersøgt flod- og havvand for enterovirus ved dyrkning i cellekulturer og ved RT-PCR. Undersøgelsen omfattede 15 prøver fra River Thames og 3 havvandsprøver fra rekreative områder i nordøst England.
Procedure
Prøverne blev koncentreret ved filter-adsorption-eluering med efterfølgende flokkulation. Oprensning for RT-PCR inhiberende stoffer foregik samtidig med RNA ekstraktionen, hvor RNA adsorberes til størrelsesfraktioneret Silica under tilstedeværelse af guanidinium thiocyanat. Silicaprecipitatet indvindes ved centrifugering og supernatanten, der indeholder de inhiberende substanser, kasseres.
Primere
Til RT-PCR på enterovirus blev der anvendt to primere P1 og P3 fra den 5' ikke-kodende region i enterovirus. RT-PCR produkterne blev efterfølgende bekræftet ved hybridisering med digoxigenin mærket P2 primer. Hybridiseringsprodukterne blev påvist med anti-digoxigenin antistof efter eksponering med X-ray film i 2 timer, hvorefter filmen blev fremkaldt (Boehringer Mannheim protokol). Primer lokalisering er illustreret i figur 1.
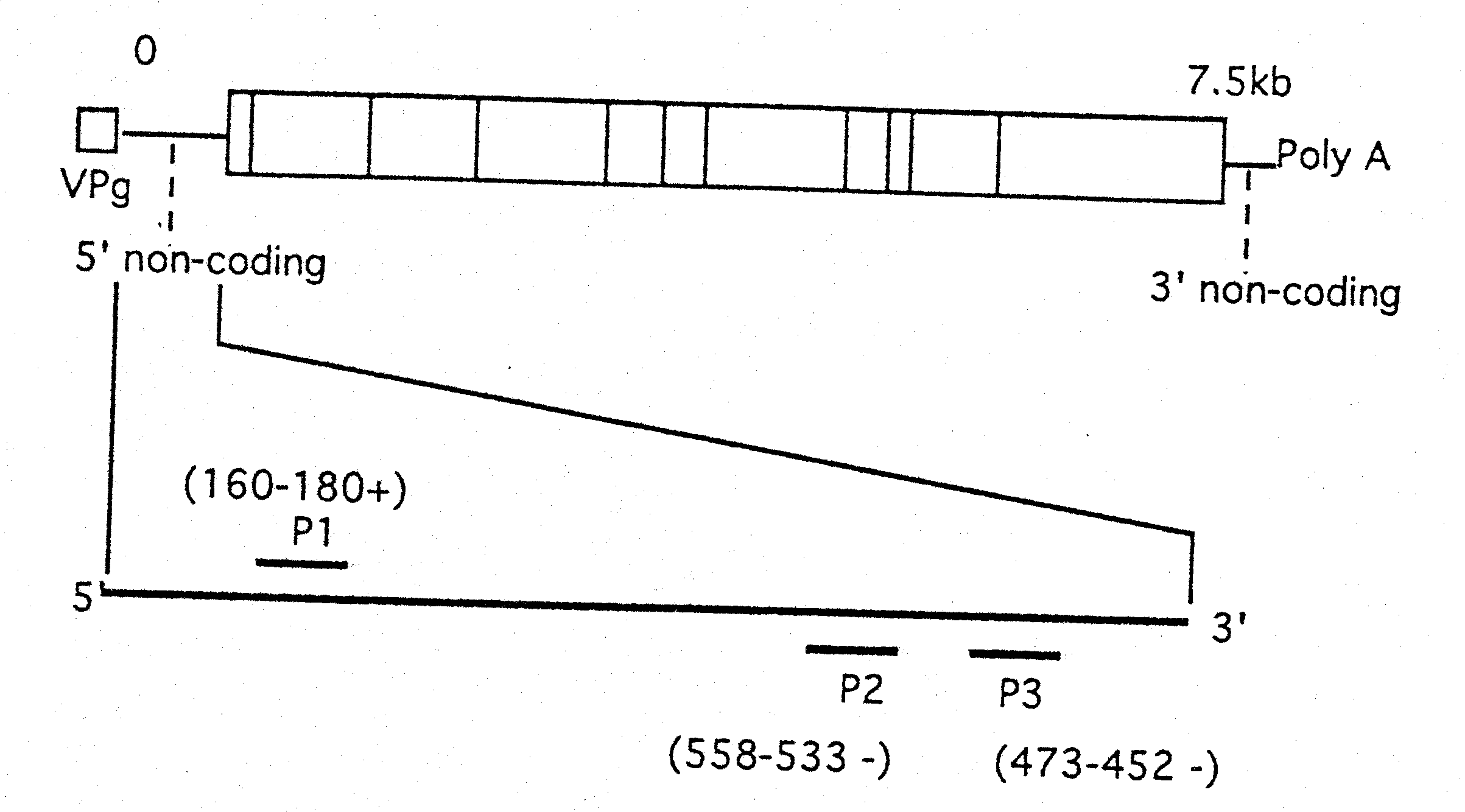
Wyn-Jones et al., 1995 (19)
Figur 1. Primer lokalisering i den 5' ikke-kodende region i enterovirus
Cellekultur
De koncentrerede prøver blev podet på BGM cellekulturer under flydende medium og observeret for virus induceret cytopatogen effekt (CPE) i 14 dage. Virus blev isoleret fra kulturer med CPE reaktion og efterfølgende identificeret i neutralisationstest. Desuden blev prøverne undersøgt for enterovirus i RT-PCR med efterfølgende hybridisering.
Resultat
I begge analysemetoder blev der påvist enterovirus i 2 havvandsprøver og 4 flodvandsprøver, men virus var ikke påviselig i 1 havvandsprøve og 4 flodvandsprøver. Undersøgelsen af disse 11 prøver viste, at der var en god korrelation mellem de to metoder.
I 3 flodvandsprøver blev der kun påvist virus i RT-PCR men derimod var 4 flodvandsprøver positive i cellekulturer, men negative i RT-PCR og årsagen hertil formodes at være inhiberende stoffer i flodvandet til trods for, at prøverne var oprenset i RNA ekstraktionen.
Konklusion
Wyn-Jones et al. (1995) foreslår, at koncentrater der er negative i RT-PCR podes på cellekulturer og inkuberer 1 døgn for at fjerne inhibitorerne. De finder, at der er god korrelation mellem de to analysemetoder, og at RT-PCR kan påvise enterovirus i de fleste prøver uden forudgående dyrkning i cellekulturer. Kombinationen af RT-PCR og hybridiseringsteknik forøger sensitiviteten.
4.2.6 RT-PCR-assay. Enterovirus i spildevand
Shieh et al. beskrev i 1995 (16) en metode til ekstraktion af RNA fra spildevand og andet fækalt affald under anvendelse af guanidinium isothiocyanate (GIT).
Procedure
Prøverne blev koncentreret ved PEG præcipitation og efterfølgende behandlet med kloroform eller Freon dels for at oprense virus og dels for at bryde virus aggregater.
Primere
Efter oprensning på Sephadex G-200 og GIT ekstraktionaktion blev enterovirus påvist i RT-PCR med primere fra den meget konserverede 5' ikke-kodende region. Det amplificerede PCR produkt på 196 bp blev efterfølgende påvist ved hybridisering med oligoprobe mærket med digoxigenin-dUTP (Boehringer Mannheim).
Sensitivitet
Der blev udført sensitivitetstests med enterovirus, der var isoleret fra cellekulturer, og detektionsgrænsen for GIT ekstraktion RT-PCR metoden blev fundet til 0,003 - 0,6 TCID50/10 ml for coxsackievirus A17 og A20 samt echovirus 16.
Spildevand
3 prøver råt spildevand og 8 prøver af andet fækalt affald blev undersøgt ved direkte RT-PCR uden forudgående RNA ekstraktion, og enterovirus blev påvist i 3 affaldsprøver. Efter GIT ekstraktion af RNA blev enterovirus påvist i 6 affaldsprøver og i 1 spildevandsprøve, og GIT ekstraktion RT-PCR metoden medførte, at antallet af positive prøver steg fra 3 til 7.
Konklusion
Den forbedrede sensitivitet tilskrives GIT metoden, der ekstraherer og separerer RNA fra viruskapsid og andet materiale i prøven samtidig med at RNA beskyttes mod degradering. Fordelen er desuden, at RNA kan ekstraheres fra 200 ml prøvekoncentrat, og mængden af templates pr. RT reaktion forøges 20 gange i forhold til den direkte RT-PCR , hvor kun 10 ml prøve undersøges.
4.2.7 RT-PCR-assay. Enterovirus, hepatitis E virus og rotavirus i drikkevand
Procedure
Jothikumar et al. 1995 (13) har udført studier med det formål, at udvikle en hurtig og enkel procedure til opkoncentrering og påvisning af virus i drikkevand.
Prøverne blev koncentrerede ved filtrering gennem granuleret aktivt kul (GAC), og eluatet blev efterfølgende rekoncentreret ved magnesiumklorid precipitation. Prøvekoncentraterne blev blandet med 1% SDS-20 mM EDTA-1M NaCl og 10% CTABNaCl, der minimerer RNase aktivitet, og virus-RNA blev derpå ekstraheret med fenol-kloroform-isoamyl alkohol.
Primere
Til RT-PCR på enterovirus blev der anvendt 2 primere svarende til det konserverede 5' ikke-kodende område i poliovirus-1, og til RT-PCR på hepatitis E virus (HEV) blev anvendt 2 primere fra det konserverede område af polymerasegenet. Til påvisning af rotavirus blev der benyttet 2 primere svarende til den konserverede region på gensegment 9, der koder for VP7 protein i rotavirus gruppe A. PCR produkter blev bekræftet ved Southern hybridisering med digoxigenin mærkede prober.
Sensitivitet
Til bestemmelse af RT-PCR metodens sensitivitet blev vandprøver podet med kendte koncentrationer af poliovirus 1, og detektionsgrænsen blev fundet til 15 PFU/100 liter.
Drikkevand
24 drikkevandsprøver, udtaget fra forskellige vandpumper i omegnen af New Dehli, blev undersøgt for enterovirus, HEV og rotavirus. Enterovirus blev påvist i 3 prøver, og rotavirus blev påvist i 8 prøver. HEV og rotavirus blev påvist i 1 prøve. Desuden blev enterovirus, HEV og rotavirus påvist i 1 prøve.
Konklusion
Forfatterne konkluderer, at den udviklede procedure, der kan påvise 15 PFU/100 liter vand, er hurtig og enkel, og at GAC metoden kan koncentrere 100 liter vand på 2 timer, og at RT-PCR resultater kan foreligge inden for samme dag.
4.2.8RT-PCR-assay. Norwalk virus i drikkevand og spildevand
Woolfaardt et al. 1995 (20) har udført undersøgelser af RT-PCR for at vurdere metodens anvendelighed til påvisning af Norwalk virus i miljøprøver.
Procedure
Undersøgelsen omfattede drikkevand, spildevand og slam podet med kendte fortyndinger af Norwalk virus samt naturligt (ikke podet) spildevand og slam. Desuden blev 10 liter overfladevand podet med Norwalk virus opkoncentreret ved glass wool-adsorption-elueringsproces. Adsorberede virus blev elueret med 3x50 ml glycine beef extrakt buffer pH 9,5. De tre eluater samt drikke-, spildevands- og slamprøver, af hver 10 ml, blev koncentreret ved centrifugering, og RNA blev ekstraheret ved PEG precipitation under anvendelse af CTAB (cetyltrimethylammonium bromide). Til RT-PCR blev anvendt et primer par 51-3, fra det konserverede område af polymerase regionen.
Resultat - Miljøprøver
Norwalk virus blev påvist i alle podede prøver, men RT-PCR sensitiviteten var højere i drikkevand end i spildevand og slam. Årsagen til den lavere sensitivitet formodes at være et højere indhold af kemiske komponenter i slam- og spildevandsprøver, der interfererer med RT-PCR reaktionen. Der blev ikke påvist Norwalk virus i de "naturlige" slam- og spildevandsprøver, men da de er en hyppig årsag til mave-tarm infektioner, var det forventet, at Norwalk virus kunne påvises i disse prøver.
Resultat - Opkoncentrering
Efter opkoncentrering blev Norwalk virus påvist i de to første eluater, hvilket indikerer, at adsorberede virus ikke umiddelbart frigives i elueringsprocessen. Desuden tydede resultaterne på, at nogle virus passerer gennem filtermatrixen, og at adsorption af virus til glass wool ikke er komplet. Vurdering af virus genfindelsesgraden er meget vanskelig, da der ikke er nogen praktiske metoder til påvisning af små mængder Norwalk virus.
Konklusion
Det blev konkluderet, at der er behov for fremtidige undersøgelser af RT-PCR sensitiviteten og metoder, der effektivt kan fjerne RT-PCR inhibitorer samt undersøgelser til vurdering og beregning af Norwalk virus genfindelsesgraden efter opkoncentrering ved glass wool-adsorption-elueringsmetoden.
4.2.9 RT-Seminested PCR assay
Seminested - Nested
Forøget sensitivitet og specificitet af RT-PCR er mulig ved anvendelse af nested PCR teknik, hvor der udføres to PCR reaktioner med forskellige primer sæt. I den første PCR reaktion anvendes et primer sæt til amplifikation af det ønskede nukleinsyre segment, mens den sekundære reaktion udføres på PCR produktet fra den første reaktion. I den sekundære reaktion kan der enten benyttes en primer fra første reaktion og en ny internal primer, og metoden kaldes seminested PCR, eller der kan benyttes to nye interne primere, og denne metode betegnes nested PCR. Metoden har desuden den fordel, at inhiberende substanser fortyndes i den sekundære PCR (7, 9).
4.2.10 RT-Seminested PCR assay. Enterovirus i podet drikkevand
I 1995 publicerede Ju-Fang et al. (14) en artikel omhandlende undersøgelser af metoder til oprensning og ekstraktion af virus-RNA for at evaluere sensitiviteten af RT-seminested PCR til påvisning af enterovirus i drikkevand. Procedurer for koncentrering af drikkevand, RNA ekstraktion og RT-seminested PCR er nærmere beskrevet i bilag 7.
Primere
Til RT-seminested PCR på poliovirus 1 og coxsackievirus B3 blev der til den første RT-PCR reaktion benyttet downstream og upstream primere, der flankerer en 149 bp region i det konserverede 5' ikke-kodende område i enterovirus. Til den sekundære RT-PCR anvendtes upstream og internal primere, der flankerer et område på 105 bp.
Sensitivitet - Resultat
Indledende undersøgelser til evaluering af sensitiviteten af RT-seminested PCR blev udført med HPLC renset vand podet med kendte koncentrationer af poliovirus 1 (LSc-2ab). De podede prøver blev varmebehandlet ved 99°C i 5 min. for at frigøre virus-RNA, eller RNA blev ekstraheret med phenol-chloroform-isoamyl alkohol (PCI). Sensitiviteten blev fundet til 0,02 PFU/10 ml efter varmebehandling og 0,2 PFU/10 ml efter ekstraktion. Efterfølgende forsøg med podet drikkevandskoncentrat viste en tilsvarende sensitivitet 0,2 PFU/10 ml efter PCI ekstraktion.
Oprensning - Sensitivitet
Undersøgelser af oprensningsmetoder, hvor drikkevandskoncentrater podet med kendte koncentrationer af poliovirus 1 og coxsackievirus B3 blev oprenset på Sephadex G-100 eller Sephadex G-50 koloner i kombination med Chelex-100, viste, at sensitiviteten var 20 PFU/10 ml efter oprensning på Sephadex G-100 og Chelex-100 og 200 PFU/10 ml efter Sephadex G-50 og Chelex-100.
Konklusion
Ju-Fang et al. 1995 (14) mener, at varmebehandling til frigivelse af RNA er den foretrukne metode, når vandprøver er oprenset og fri for inhibitorer, og at varmebehandling er enkel og hurtig sammenlignet med PCI ekstraktion. Den væsentligste ulempe er, at en oprensning er nødvendig, da PCR inhiberende substanser ikke fjernes ved varmebehandling. Oprensning på Sephadex G-50 og Chelex-100 fjerner ikke inhibitorer effektivt, derimod fjernes inhibitorer på Sephadex G-100 og Chelex-100, men til gengæld fjernes også op til 99% af virus. Studierne viste, at PCI ekstraktionsmetoden i tilstrækkelig grad kan fjerne inhiberende substanser, så der opnås en sensitivitet for RT-seminested PCR på 0,2 PFU/10 ml, der svarer til 0,2 PFU/liter drikkevand.
4.2.11RT-Seminested PCR assay. Enterovirus i overfladevand
Procedure
Kopecka et al. 1993 (21) anvendte RT-seminested PCR til påvisning af enterovirus i vandprøver udtaget fra River Seine og fra en sø i Berlin. Prøverne blev koncentreret ved filter-adsorption-eluering eller organisk flokkulation, og RNA blev ekstraheret med kloroform.
Primere
Sensitiviteten af RT-seminested PCR med efterfølgende hybridisering til påvisning af poliovirus 3, coxsackievirus B5 og echovirus 7 blev undersøgt i forhold til cellekulturassay og direkte hybridisering. De benyttede primere var P3, P2 og P5 fra det konserverede 5' ikke-kodende område i poliovirus 1, og til hybridisering anvendtes en 32P mærket riboprobe. I cellekulturassayet blev virus dyrket i Vero celler under flydende medie i 6 dage og efterfølgende påvist ved hybridisering.
Forfatterne pointerer, at kvantitative resultater ikke kan forventes under de anvendte forsøgsbetingelser, da forsøgene er baseret på optimering af sensitiviteten og ikke på kvantitative resultater.
Sensitivitet
Mineralvand podet med kendte koncentrationer af de respektive virustyper blev podet på Vero cellekulturer samt testet ved hybridisering og ved RT-seminested PCR. Man fandt, at RT-seminested PCR var 10-1.000 gange mere sensitiv end detektionen i cellekulturer og 105 -107gange mere sensitiv end den direkte hybridisering.
I andre sensitivitetsstudier er poliovirus-RNA blevet ekstraheret fra podede HeLa celler, og poliovirus cRNA blev syntetiseret in vitro fra plasmid PhK8, som indeholder cDNA af det komplette poliovirus 1 genom. RNA og cRNA blev efterfølgende påvist i koncentrationer ned til 1 nanogram/spot efter hybridisering, og 1 femtogram RNA kunne påvises i RT-seminested PCR, hvilket svarer til 200 genom kopier.
Overfladevand
RT-seminested PCR til bestemmelse af enterovirus i flod- og søvand blev først udført på "naturlige" ikke koncentrerede prøver. Disse prøver blev efterfølgende opkoncentrerede og undersøgt i RT-seminested PCR. Med undtagelse af en prøve blev enterovirus påvist i alle "naturlige" prøver, men to af de positive prøver var negative efter opkoncentrering, hvilket indikerer, at proceduren ikke kun koncentrerer virus men også PCR inhiberende stoffer, og at en oprensningsprocedure er nødvendig forud for RNA ekstraktion og RT-seminested PCR.
Enterovirus kunne ikke påvises i prøvekoncentrater efter podning på cellekulturer. Forfatterne mener, at desinfektion af renset spildevand inden udledning til recipientvandet inaktiverer størstedelen af virus, så de ikke er påviselige i cellekulturer men at de forsat er i stand til at producere positive RT-seminested PCR resultater.
Konklusion
Det konkluderes, at RT-seminested PCR kan blive en fordelagtig metode til undersøgelse af miljøprøver, men at der er behov for udvikling af oprensningsprocedurer til fjernelse af urenheder, som inhiberer PCR reaktioner.
4.2.12 RT-Seminested PCR assay. Enterovirus og hepatitis A virus i overfladevand
RT-seminested PCR har været anvendt af Guyader et al. 1995 (22) til påvisning af enterovirus og hepatitis A virus (HAV) i vandprøver fra flodmundinger i Fort de France Bay og fra flodmundinger i den sydlige del af Martinique, de Caribiske øer.
Procedure - Primere
Prøverne på 50 ml blev efter koncentrering ved PEG precipitation og RNA ekstraktion med fenol og kloroform analyseret i RT-PCR assayet. Til påvisning af enterovirus anvendtes primerne E1 og E2 samt E1 og E3 til seminested PCR fra det konserverede 5' ikke-kodende område i enterovirus. Til RT-seminested PCR på HAV benyttes primerne H1 og H2 samt H1 og H3 fra VP1 regionen.
Overfladevand
Prøvekoncentrater såvel som "naturlige" prøver indgik i undersøgelsen. I de "naturlige" prøver blev der påvist enterovirus i 2 prøver, HAV i 4 prøver og 5 prøver blev fundet positive for begge virustyper. 9 prøver var negative. To af de HAV positive prøver var svagt positive med hensyn til PCR produktets intensitet under UV. Med undtagelse af disse to svagt positive prøver, hvor HAV ikke blev påvist i de koncentrerede prøver, formodentlig pga. PCR inhibitorer, svarede antallet og fordelingen af virus positive prøvekoncentrater til de "naturlige" prøver.
Konklusion
Forfatterne konkluderer, at RT-seminested PCR tegner til at kunne blive et vigtigt redskab til påvisning af viruskontamineret overfladevand og i risikovurdering af sundhedsmæssige aspekter i forbindelse badevand.
4.2.13 Nested PCR asssay. Adeno-, entero- og hepatitis A virus i spildevand og flodvand
Puig et al. 1994 (9) har anvendt nested PCR til påvisning af adenovirus og nested RT-PCR til påvisning af enterovirus i spildevand og flodvand. Girones et al. (23) rapporterede i 1995, at undersøgelsen også omfattede nested RT-PCR til påvisning af HAV.
Procedure
Spildevandsprøver blev koncentreret ved centrifugering, og virus blev elueret fra faste partikler med glycine buffer 0,25 N pH 9,0 og efterfølgende ultracentrifugeret. Flodvandsprøver blev koncentreret ved adsorption til og eluering fra glass powder og efterfølgende koncentreret som beskrevet for spildevand. DNA og RNA blev ekstraheret fra prøvekoncentrater ved adsorption til Silica under anvendelse af guanidium thiocyanate. PCR proceduren omfattede RT-reaktion til syntese af cDNA fra enterovirus- og HAV-RNA efterfulgt af enzymatisk amplifikation af cDNA og ekstraheret DNA.
Primere
Til PCR på adenovirus anvendtes primerene hexAA1885 og hexAA1913 fra hexon genet i Ad2, Ad40 og Ad41, og til nested PCR benyttedes nehexAA1893 og nehexAA1905. Disse primere har specificitet over for 47 humane adenovirus serotyper Ad1 - Ad47. De benyttede primere til påvisning af enterovirus var Ent1 og Ent2 samt neEnt1 og neEnt2 fra det konserveret 5' ikke-kodende område i enterovirus, der har specificitet for 24 enterovirustyper. Der blev anvendte primere fra den 5' ikke-kodende region i HAV genomet, og primerne HAV1 og HAV2 blev benyttet til 1. RT-PCR reaktion og neHAV1 og neHAV2 blev benyttet til nested RT-PCR.
Miljøprøver
10 af de 16 spildevandsprøver blev undersøgt for forekomst af HAV, og alle 10 prøver var positive, men derimod kunne HAV ikke påvises i de 9 flodvandsprøver.
Enterovirus blev i nested RT-PCR påvist i 12 af de 16 spildevandsprøver, men kun 8 prøver var positive efter 1. RT-PCR og i cellekulturassayet var 5 prøver positive. Adenovirus var påviselig i alle 16 prøver efter nested PCR, hvor 7 af prøverne var positive efter 1. PCR.
I flodvand blev adenovirus påvist i 6 af de 9 prøver efter 1. PCR. Enterovirus var ikke påviselig efter 1. RT-PCR. Efter nested PCR henholdsvis nested RT-PCR blev adenovirus og enterovirus påvist i alle 9 prøver. Efter celledyrkning blev 1 prøve fundet positiv for enterovirus.
Konklusion
Undersøgelsen viste, at nested PCR og nested RT-PCR medførte en stigning i antallet af positive prøver i forhold til 1. PCR/RT-PCR reaktion, og at stigningen var særlig markant for enterovirus. Adenovirus blev påvist i alle prøverne, og på grund af denne store udbredelse foreslår Puig et al. 1994 (9), at der rettes en større opmærksomhed på adenovirus som indikator for virusforurening.
4.3 Validering af metoder
Filter-adsorption-eluering
Virus kan forekomme i meget lav koncentration i vand og skal opkoncentreres for at blive påvist i cellekulturer eller andre analysemetoder. Filter-adsorption-eluering er den foretrukne metode til koncentrering af virus fra vand. De to typer af filtermembraner, elektronegative og elektropositive, kan koncentrere virus fra store mængder vand, og genfindelsesgraden for enterovirus er høj. En ulempe ved elektronegative filtre er, at der tilsættes multivalente kationer som Al3+ ved lavt pH for at forbedre adsorptionskapaciteten, og det kan medføre dannelse af metalkomplexer der kan blokere filterne.
Ultrafiltrering
Ultrafiltreringsprocessen kan koncentrere meget store mængder vand, 100-1.000 liter, med lavt indhold af organisk stof, og den påviste genfindelsesgrad for enterovirus er på niveau med genfindelsesgraden i filter-adsorption-elueringsprocessen. I forhold til adsorption-elueringsmetoder har ultrafiltrering den fordel, at der ikke indgår en elueringsproces, da virus koncentreres på grund af molekylevægt eller størrelsesforhold. Den væsentligste ulempe ved ultrafiltrering er, at udstyret er kostbart, tungt og vanskeligt at håndtere.
Granuleret aktivt kul
Koncentrering på granuleret aktivt kul er i forhold til de to andre processer en billig og hurtig filtreringsmetode, der kan koncentrere 100 liter vand indenfor et par timer hvorimod tidsforbruget er op til 8 timer for behandling af en tilsvarende mængde i de andre metoder. En væsentlig fordel er, at koncentrering og PCR kan udføres indenfor en dag og at der derfor hurtigt kan foreligge analyseresultater, hvilket er ønskeligt med hensyn til rutineundersøgelser. Til gengæld er genfindelsesgraden for virus lavere end ved filter-adsorption-eluering og ultrafiltrering.
PEG - Organisk flokkulation
Råt spildevand kan koncentreres ved PEG (polyethylen glycol) precipitation, men metoden anvendes sædvanligvis til rekoncentrering af prøvekoncentrater fra ovennævnte koncentreringsprocesser, og genfindelsesgraden er høj. Organisk flokkulation er den foretrukne metode til rekoncentrering af eluater fra elektronegative eller elektropositive filtre.
En general ulempe ved koncentreringsmetoderne er, at der også koncentreres substanser, der kan være toksiske for cellekulturer eller inhibere PCR reaktion.
Cellekulturer - EIA
Virus i prøvekoncentrater kan efterfølgende påvises i cellekulturer, EIA eller PCR assays. I cellekulturer påvises infektiøse virus, men metoden er tidskrævende, og cellekulturer er meget følsomme over for toksiske komponenter i prøvematerialet og dertil kommer, at nogle virustyper enten ikke kan påvises eller er vanskelige at dyrke i cellekulturer. EIA er en hurtig metode til påvisning af eksempelvis adenovirus, der er langsomt voksende i cellekulturer, og metoden er mindre følsom over for kemiske komponenter i prøvematerialet end cellekulturer. Til gengæld kan sensitiviteten variere meget afhængig af det anvendte EIA kit, og da EIA påviser virus antigener kan der ikke skelnes mellem infektiøse eller inaktive virus.
PCR
PCR har en høj sensitivitet og specificitet, og resultater kan foreligge inden for timer i stedet for dage/uger, som ofte er nødvendige ved dyrkningsteknikker. PCR kan påvise ikke dyrkbare virus som Norwalk virus og vanskeligt dyrkbare virus som hepatitis A og adenovirus (20, 9). Sensitiviteten af PCR kan forøges ved efterfølgende hybridiseringsteknik. RT-seminested og nested PCR medfører en forøget sensitivitet i forhold til 1 trins PCR (9). I forhold til cellekulturassays kan sensitiviteten af RT-seminested PCR være op til 1.000 gange højere (22).
En væsentlig ulempe er, at inhiberende substanser fra prøvematerialet intefererer med PCR amplifikationen, og at PCR derfor kun i begrænset omfang kan anvendes direkte uden forudgående oprensning af prøvemateriale. Variation i sensitiviteten afhænger primært af vandkvaliteten og påvirkes derfor af koncentrerings-, oprensnings- og ekstraktionsmetodernes effektivitet samt metodernes genfindelsesgrad (10). For at optimere PCR teknikkerne er der forsat behov for forskning inden for metoder til effektiv fjernelse af inhibitorer, der influerer på PCR amplifikation.
PCR påviser virus nukleinsyre. For påvisning af dyrkbare virus kan celledyrkning kombineres med PCR.
4.4 Diskussion
Opkoncentrering af virus
Koncentrationen af virus i drikkevand og recipientvand herunder badevand kan være meget lav, og de anvendte metoder skal derfor kunne koncentrere virus fra vandmængder på 10 - 100 liter eller derover. Volumen af prøvekoncentrat, der ofte er i størrelsesorden 1 liter, reduceres yderligere til <=30 ml i den efterfølgende rekoncentreringsproces. De eksisterende koncentreringsprocesser har alle den ulempe, at også celletoksiske eller PCR inhiberende komponenter opkoncentreres.
Cellekulturer - PCR
Cellekulturassays er kostbare og tidskrævende, og de virustyper, der kan påvises, er begrænset til dem, der kan vokse i cellekulturer. Norwalk virus, der hyppigt forårsager udbrud af vandbårne infektioner, kan ikke dyrkes i cellekulturer, og andre virustyper kan være langsomt voksende eksempelvis adenovirus og hepatitis A virus. Disse virustyper kan påvises i PCR. Sensitiviteten og specificiteten af PCR kan forøges ved efterfølgende hybridisering eller ved nested PCR. Puig et al. 1994 (9) viste, at nested PCR medførte en markant stigning i antallet af positive enterovirus prøver, og at alle undersøgte prøver (16 stk.) var positive med hensyn til adenovirus. På baggrund af denne hyppige forekomst af adenovirus i miljøprøver antager forfatterne, at adenovirus tilstedeværelse i forurenet vand sandsynligvis er underestimeret, idet mange adenovirus er langsomt voksende eller vanskeligt dyrkbare i cellekulturer . Desuden mener forfatterne at der bør fokuseres mere på adenovirus som en mulig indikator for virusforurening (9).
Vanskeligheder forbundet med PCR teknikken kan være forårsaget af substanser i prøvematerialet, der inhiberer enzymfunktioner i PCR reaktionen. Der er udført mange studier med henblik på udvikling af metoder til fjernelse af inhiberende substanser. Nogle metoder fjerner effektivt PCR inhibitorer, men til gengæld kan der være risiko for, at også virus fjernes fra prøvematerialet (14). Der er derfor forsat behov for udvikling af metoder til oprensning og ekstraktion af virusnukleinsyre.
PCR påviser virus nukleinsyre. Med hensyn til enterovirus er nukleinsyren omgivet af et kapsid, der beskytter mod vandmiljøet, og påvist nukleinsyre formodes derfor at være isoleret fra intakte viruspartikler. Hvis påvisning af infektiøse virus er ønskelig, kan celledyrkning kombineres med efterfølgende PCR i de tilfælde, hvor virus kan vokse i cellekulturer (4). En anden mulighed er, at PCR kan anvendes til screening af miljøprøver inden cellekulturassays tages i brug (22).
Der er væsentlige fordele ved PCR, og metoden kan være af betydning for videreudvikling af metoder til påvisning af humane enteriske virus i vandmiljøer.